Журнал прикладной химии. 2022. Т. 95. Вып. 6
РАЗЛИЧНЫЕ ТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ
УДК 544.42: [544.421.081.7+544.422]
КИНЕТИКА РАСТВОРЕНИЯ КАРБОНАТА КАЛЬЦИЯ
В КАРБОНОВЫХ КИСЛОТАХ
© Н. А. Прокудина, А. С. Габисов, В. А. Старковский
Апрелевское отделение
Всероссийского научно-исследовательского геологического нефтяного института,
143363, Московская обл., г. Апрелевка, ул. 1-я Кетрица, д. 1
Поступила в Редакцию 12 января 2022 г.
После доработки 1 сентября 2022 г.
Принята к публикации 1 сентября 2022 г.
Работа посвящена проблеме обработки карбонатных коллекторов растворами карбоновых кислот.
Кинетика процесса растворения кальцита в карбоновых кислотах изучена с использованием волюмо-
метрического метода анализа. Определены порядки и константы скорости реакции растворения
кальцита при комнатной температуре в растворах оксикислот и алифатических кислот. Установ-
лена зависимость полученных величин констант скорости от основности и показателя кислотности
в рядах оксикислот и алифатических кислот соответственно.
Ключевые слова: карбоновые кислоты; карбонат кальция; растворение; кинетика; показатель кис-
лотности; константа скорости
DOI: 10.31857/S0044461822060111, EDN: DLGHBL
Обработка нефтеносных пластов кислотными ком-
рость реакции растворов, их быстрая нейтрализация
позициями является высокоэффективным методом
и, как результат, неглубокое проникновение в пласт.
интенсификации притока нефти, простым в реализа-
Один из способов борьбы с этой проблемой заклю-
ции как в техническом, так и в экономическом плане.
чается в использовании менее агрессивных карбоно-
Немаловажным для интенсификации притока неф-
вых кислот [1]. Однако из-за невысокой стоимости
ти являются улучшение проникающей способности
кислотных обработок исследовательским работам
кислотных составов в пласт и увеличение площади
этого направления уделяют недостаточно внимания,
охвата призабойной зоны коллектора кислотной об-
ограничиваясь в основном общими рекомендациями
работкой. Эффективность метода определяется мно-
[1, 2], экспериментальным подбором кислотного со-
жеством факторов, к которым относят прежде всего
става [2-5] или скорости фильтрации [6].
правильность выбора состава кислотного раствора.
Одним из главных критериев эффективности кис-
Основной причиной, сдерживающей достижение
лотной обработки карбонатной скважины является
высоких приростов добычи нефти за счет обработ-
образование червоточин — разветвленной сети вы-
ки карбонатных коллекторов обычно используемой
сокопроводящих каналов [1]. Неверно выбранный
хлороводородной кислотой, является высокая ско-
режим нагнетания кислотного состава не позволяет
781
782
Прокудина Н. А. и др.
сформировать в поровом коллекторе протяженные
Цель работы — изучение кинетических законо-
каналы растворения [2], и здесь важнейшими аспек-
мерностей процесса взаимодействия карбонатных
тами становятся процессы управления фильтрацией,
пород с карбоновыми кислотами.
скоростью подачи раствора кислоты и скоростью
реакции кислоты с породой [7].
Экспериментальная часть
Результаты лабораторных экспериментов показа-
ли, что путем изменения скорости фильтрации лю-
В качестве модели карбонатной породы исполь-
бой кислоты можно получить каналы со структурой,
зовали порошкообразный CaCO3 (ч., ООО «Лабтех»)
изменяющейся от конической до разветвленной [8].
и мраморную крошку 3-5 мм (ООО «ГеоСтиль»),
Если скорость взаимодействия породы и кислоты
которую измельчали в фарфоровой ступке и с помо-
ниже скорости фильтрации, образуется канал со зна-
щью ситового анализа отбирали фракции со сред-
чительным разветвлением. Оптимальная структу-
ним размером частиц 40 и 100 мкм. Фракционный
ра — червоточина — формируется при близких зна-
состав частиц порошка определяли с помощью ла-
чениях скоростей подачи кислотного раствора и его
зерного анализатора размера частиц Partica LA-960
взаимодействия с породой, при этом затрачивается
(Horiba Ltd.). Рентгенофазовый анализ образцов вы-
наименьший объем кислоты [6].
полняли на порошковом дифрактометре ARL Xʹtra
В модельных исследованиях, подкрепленных экс-
(Thermo Scientific) с использованием рентгенов-
периментами [8-10], утверждается, что для любого
ской трубки с медным анодом [λ(CuKα1) = 1.541 Å,
имеющегося набора пластовых условий существует
λ(CuKα2) = 1.544 Å), программных комплексов
критическая скорость подачи кислоты, и показано
Crystallographica Search-Match и Siroquant и базы дан-
[8, 10], что условия для формирования различных ка-
ных порошковых дифракционных стандартов ICDD
налов можно подобрать с помощью числа Дамкелера
PDF-2 2019 г. выпуска.
(Da), рассчитываемого по отношению скоростей вза-
Для исследований были выбраны моно-, ди- и
имодействия кислоты с породой и подачи раствора
трикарбоновые алифатические кислоты и оксикис-
кислоты:
лоты, применяющиеся в технологиях кислотной
обработки карбонатных коллекторов: муравьи-
Da = πdLW/q,
(1)
ная (85%, ООО «ПраймКемикалсГрупп»), уксус-
где d и L — диаметр и длина капиллярных пор со-
ная (х.ч., ООО «Спектр-Хим»), щавелевая (х.ч.,
ответственно, W — скорость химической реакции
ООО «РМ Инжиниринг»), молочная (80%, ООО
карбонатной породы с кислотой, q — скорость подачи
«ПраймКемикалсГрупп»), аскорбиновая (99%,
кислоты.
ООО «РМ Инжиниринг»), яблочная (99%, ООО
Для образования сквозных каналов со структурой
«ПраймКемикалсГрупп»), лимонная (ч.д.а., ООО «РМ
червоточины оптимальное число Дамкелера состав-
Инжиниринг»).
ляет 0.29 [8-10]. В серии независимых лабораторных
Растворение CaCO3 в водных растворах карбоно-
исследований по выявлению оптимальной линейной
вых кислот выполняли при комнатной температуре
скорости подачи кислотного состава отмечено [4,
с использованием установки, общая схема которой
11, 12], что полученные экспериментальные данные
приведена на рис. 1. Стеклянные узлы установки
подтвердились результатами вышеприведенных мо-
герметично соединяли силиконовыми шлангами.
дельных исследований.
В качестве гидрозатворной жидкости для газовой
В настоящее время ключевым аспектом в управле-
бюретки использовали водный солевой раствор 3 М
нии фильтрацией стало определение скорости хими-
KCl, характеризующийся пониженной способностью
ческой реакции взаимодействия кислоты с породой
растворять СО2. Для приготовления раствора исполь-
[7, 13]. Известны работы [14] по определению скоро-
зовали KCl (х.ч., «РусХим»). Непосредственно перед
сти реакции с использованием вращающегося диска
проведением испытаний солевой раствор насыщали
и микропотоков. И если в случае менее реакционно-
СО2, выделяющимся при проведении холостых опы-
способного доломита лимитирующей стадией была
тов по растворению CaCO3 в кислоте. Герметичность
поверхностная химическая реакция, то для более
установки проверяли по соответствию теоретически
активного известняка — кальцита — лимитирующей
и экспериментально определенных количеств вы-
оказалась стадия диффузионного массопереноса, что,
деляющегося СО2. Объем выделяющегося в ходе
безусловно, исключало определение истинных кине-
реакции СО2 контролировали с помощью газовой
тических параметров химической реакции жидкости
бюретки 5 объемом 150 мл и ценой деления шкалы
с поверхностью твердого тела.
1 мл. Использование буферной емкости 4 позволяло
Кинетика растворения карбоната кальция в карбоновых кислотах
783
где Kw — константа скорости реакции, C — концен-
трация кислоты, n — порядок реакции по кислоте,
S — площадь поверхности образца CaCO3.
Удельную скорость реакции растворения CaCO3
в карбоновой кислоте W/S (моль·л-1·мин-1·м-2) в
пересчете на 1 м2 поверхности CaCO3 определяли на
начальном участке кривой газовыделения:
=
,
(4)
S = 6mp/d,
(5)
где ΔQ — количество CO2 (моль, н. у.), выделившего-
ся за время Δt (мин); ν — объем раствора кислоты (л);
m — масса навески CaCO3 (г); p — плотность CaCO3
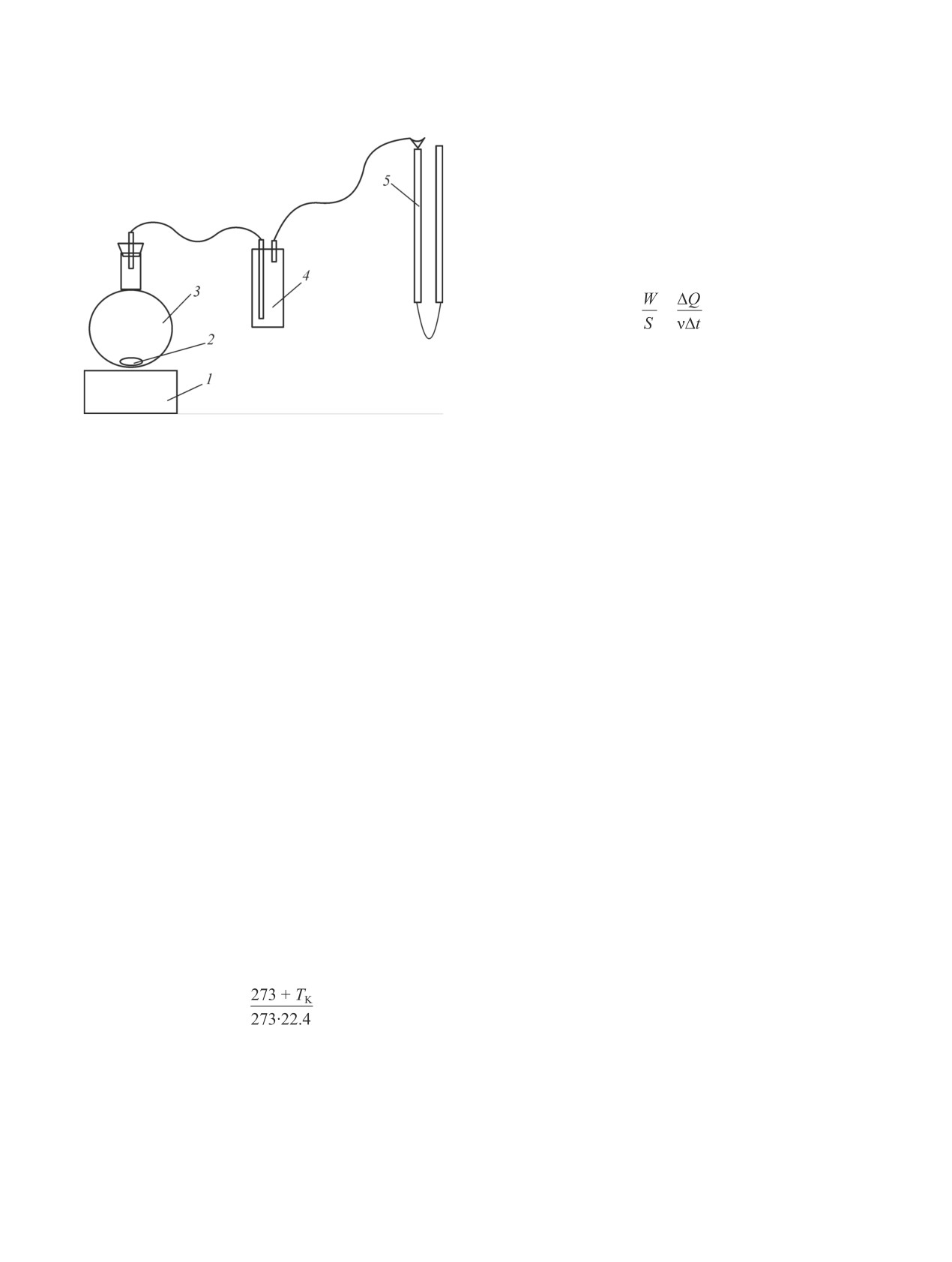
Рис. 1. Общая схема установки.
(для кальцита 2.71.10-6 г·м-3); d — средний размер
1 — магнитная мешалка, 2 — магнитный якорь, 3 — сте-
клянная колба, 4 — буферная емкость, 5 — газовая бю-
частиц CaCO3 (м).
ретка.
Текущую концентрацию кислоты (C) в процессе
растворения CaCO3 рассчитывали по формуле
избегать колебаний мениска жидкости в газовой бю-
C = C0(1 - α),
(6)
ретке в процессе измерения.
Для выполнения измерений в колбу с магнит-
где C0 — начальная концентрация кислоты (моль·л-1),
ным якорем помещали раствор кислоты, добавля-
α — степень превращения кислоты.
ли навеску карбоната кальция (аналитические весы
Константу скорости реакции растворения CaCO3
AUW 320, Shimadzu, точность определения массы
в карбоновой кислоте и порядок реакции по кислоте
1 мг, цена деления 0.1 мг), закрывали колбу резиновой
определяли с помощью дифференциального метода
пробкой, одновременно включали секундомер и вра-
Вант-Гоффа:
щение магнитной мешалки (MR Hei-Tec, Heidolph).
lgW/S = lgKw + n·lgC .
(7)
Поступление количества газа в газовую бюретку
регистрировали через каждые 15 с в течение первой
Статистическую обработку проводили по ГОСТ
минуты, 30 с во вторую минуту и затем через 1 мин.
Р 8.736-2011 «Государственная система обеспече-
За скоростью растворения CaCO3 в карбоновых
ния единства измерений. Измерения прямые много-
кислотах следили по количеству эквимолярно обра-
кратные. Методы обработки результатов измерений.
зующегося в ходе реакции (I) продукта — газообраз-
Основные положения». Среднеарифметические зна-
ного CO2:
чения констант скорости рассчитывали по выборке
из 4-7 параллельных опытов с коэффициентом вари-
ηCaCO3 + 2HηA → CaηA2 + ηH2O + ηCO2↑. (I)
ации, не превышающим 10%.
Начальное содержание карбоновой кислоты в рас-
Пересчет объемных показателей выделения CO2
творе составляло 1.5.10-3 моль, что обеспечивало вы-
по газовой бюретке V (л) в количество вещества Q
деление количеств СО2 в диапазоне корректных по-
(моль, н. у.), проводили по формуле
казателей газовой бюретки — несколько десятков мл.
Для определения порядка реакции по кислоте бра-
Q = V
,
(2)
ли 10-кратный стехиометрический избыток CaCO3
(0.75 г) по отношению к одноосновной кислоте.
В предварительных исследованиях устанавливали
где ТK — комнатная температура (°С), 273 — тем-
условия, в которых химическая реакция взаимодей-
пература при н. у. (K), 22.4 — молярный объем газа
ствия CaCO3 с кислотой является лимитирующей и
(л·моль-1, н. у.).
на скорость растворения CaCO3 не влияют диффу-
Скорость реакции растворения CaCO3 в карбоно-
зионные ограничения, для чего необходим прежде
вой кислоте (W) можно выразить уравнением
всего турбулентный режим перемешивания суспен-
W = KwCnS,
(3)
зии. Поэтому вначале провели проверку влияния на
784
Прокудина Н. А. и др.
характер перемешивания частиц CaCO3 в водной
среде следующих экспериментальных параметров:
объем реакционной колбы (0.3, 0.5 и 1 л), объем рас-
твора (0.1, 0.3 и 0.5 л), размер частиц CaCO3 (8.4, 40
и 100 мкм), скорость перемешивания реакционной
смеси (350, 600, 1000 и 1200 об·мин-1). Кинетический
режим подтверждали последующей проверкой на не-
зависимость от этих параметров константы скорости
реакции.
Обсуждение результатов
В качестве модели карбонатной породы выбрали
наиболее часто встречающуюся в нефтеносных го-
ризонтах кальцитную форму CaCO3. На дифракто-
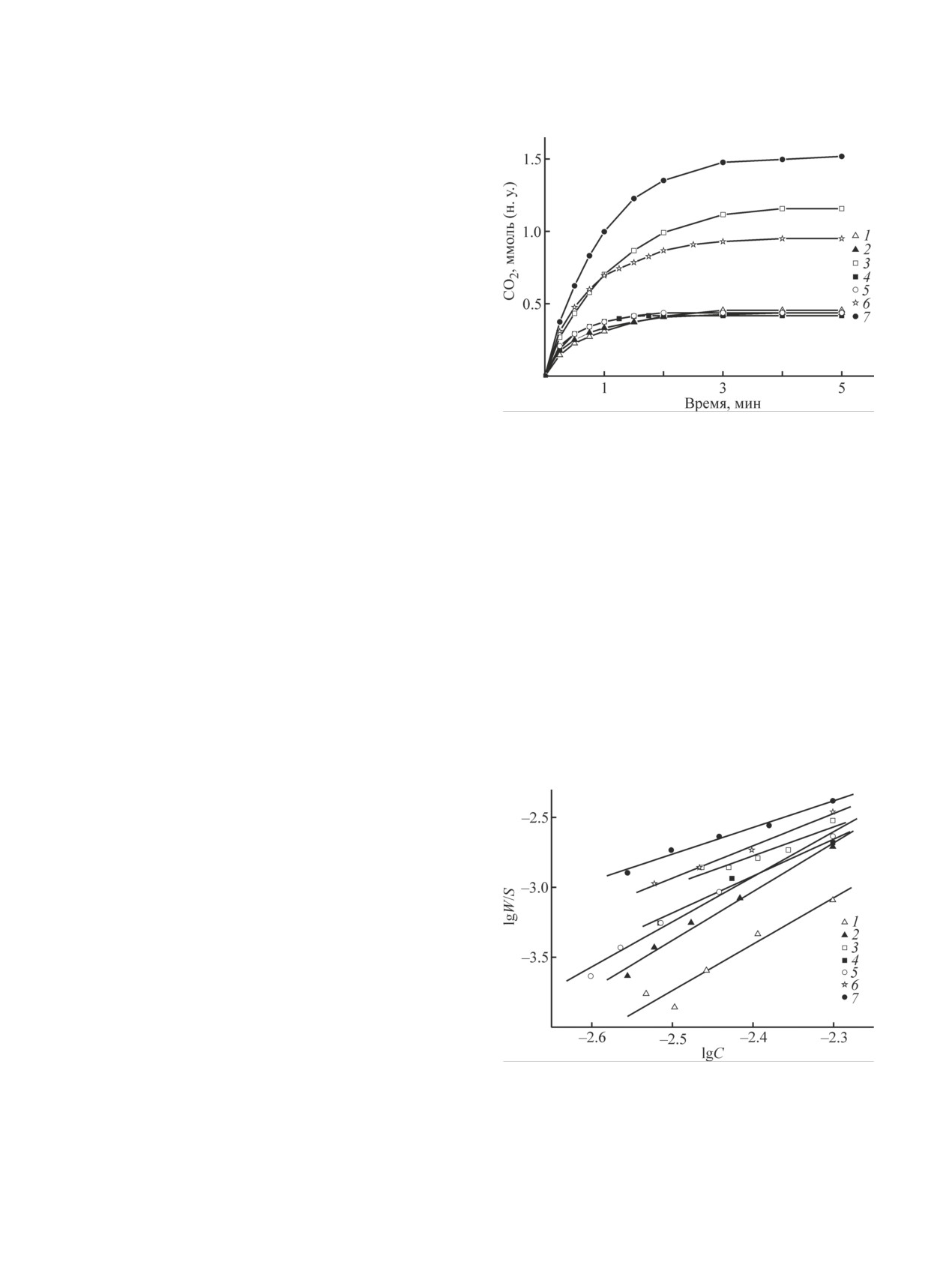
Рис. 2. Кинетические кривые образования CO2 при об-
граммах исследуемых образцов CaCO3 наблюдаются
работке CaCO3 растворами карбоновых кислот: мета-
рефлексы кальцита (PDF 010-80-2800).
новой (1), 2-этановой (2), этандиовой (3), 2-гидрокси-
Образование однородной суспензии с турбулент-
пропановой (4), гамма-лактон-2,3-дигидро-L-гулоновой
ным режимом перемешивания наблюдали при соче-
(5), гидроксибутандиовой (6), 3-гидрокси-3-карбокси-
тании следующих экспериментальных параметров:
пентандиовой (7).
объем реакционной колбы — 1 л, объем реакционной
жидкости — 0.3 л, размер частиц CaCO3 — 8.4 мкм.
монокарбоновой этановой к дикарбоновой этанди-
При перемешивании реакционной смеси со скоро-
овой также влечет за собой уменьшение константы
стями 350, 600 и 1000 об·мин-1 значения константы
скорости (см. таблицу). Таким образом, наблюдается
скорости отличались друг от друга, тогда как при
антибатная зависимость констант скорости реакции
перемешивании со скоростями 1000 и 1200 об·мин-1
растворения CaCO3 в карбоновых кислотах от основ-
различий не наблюдалось — выбрали скорость пере-
ности в рядах кислот одного класса.
мешивания 1000 об·мин-1.
Показатель кислотности карбоновой кислоты
Среди карбоновых кислот наибольшей активно-
R—COOH pKк:
стью в растворении CaCO3 характеризуется трикар-
pKк = -lg[H+]·[RCOO-]/[RCOOH].
(8)
боновая 3-гидрокси-3-карбоксипентандиовая кислота,
наименьшей — метановая (рис. 2).
Порядки реакций по кислотам, определенные из
логарифмической зависимости удельной скорости
образования CO2 от текущей концентрации соответ-
ствующей кислоты (рис. 3), составляют 2.0-3.5 (см.
таблицу). Повышенные значения порядка реакции
по кислотам связаны скорее всего с присутствием в
водных растворах ассоциированных форм карбоно-
вых кислот.
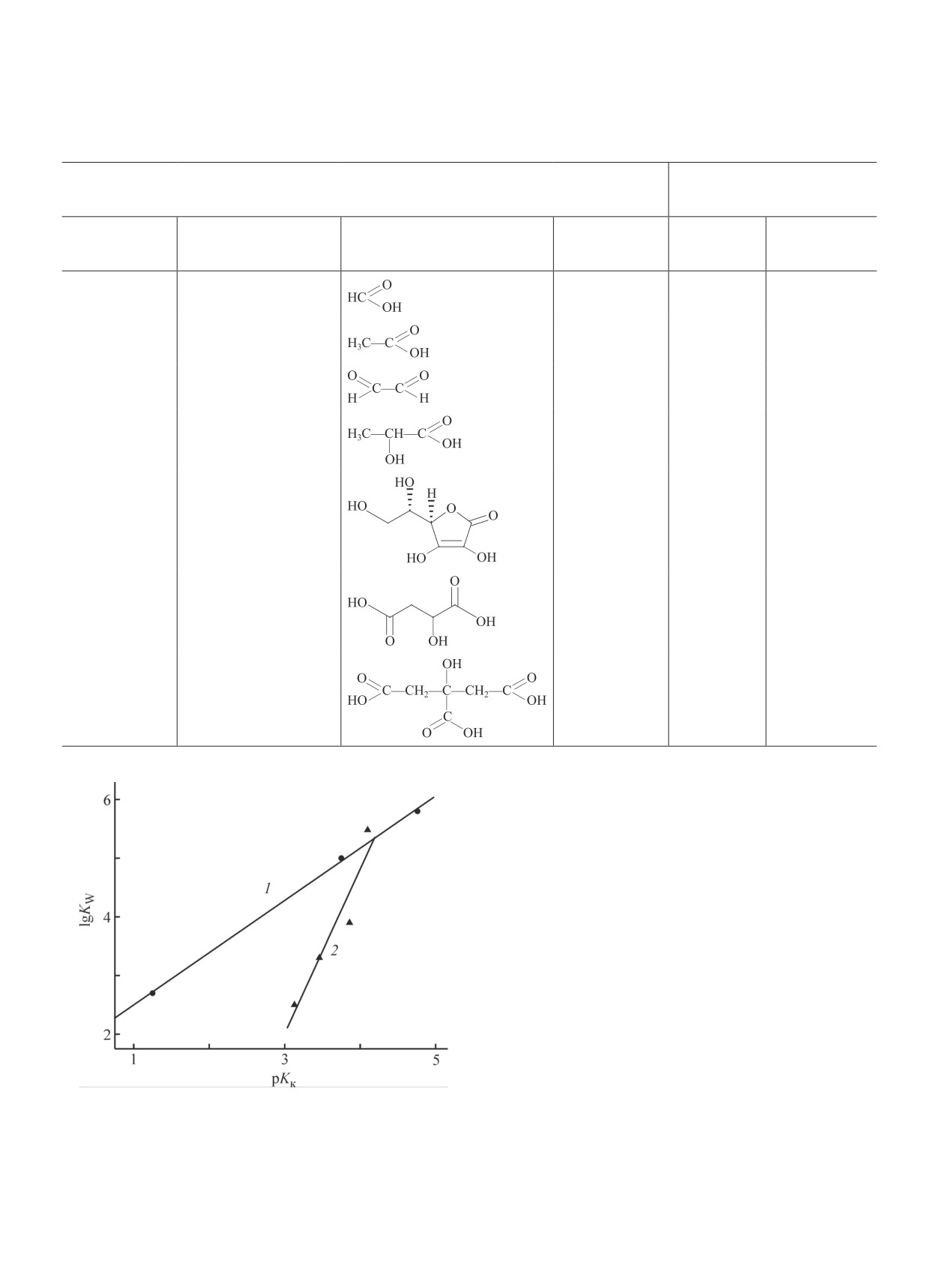
Логарифмы констант скорости реакции раство-
рения CaCO3 в карбоновых кислотах составляют
2.5-5.8 (см. таблицу). Прямолинейные зависимости
логарифмов констант скорости реакции от показате-
лей кислотности наблюдаются в рядах карбоновых
кислот одного класса — соответственно оксикислот
и алифатических кислот (рис. 4). В ряду оксикислот
Рис. 3. Зависимость скорости растворения CaCO3 в
2-гидроксипропановая-гидроксибутандиовая-3-ги-
карбоновых кислотах от их концентрации: метановой
дрокси-3-карбоксипентандиовая рост основности от 1
(1), 2-этановой (2), этандиовой (3), 2-гидроксипропа-
до 3 сопровождается уменьшением константы скоро-
новой (4), гамма-лактон-2,3-дигидро-L-гулоновой (5),
сти реакции (см. таблицу). Аналогичная зависимость
гидроксибутандиовой (6), 3-гидрокси-3-карбоксипен-
наблюдается для алифатических кислот: переход от
тандиовой (7).
Кинетика растворения карбоната кальция в карбоновых кислотах
785
Кинетические параметры реакции растворения CaCO3 в карбоновых кислотах
Кинетические параметры
Характеристика карбоновых кислот
реакции растворения CaCO3
в карбоновых кислотах
логарифм
показатель
порядок
класс
наименование
структурная формула
константы
кислотности рKк
по кислоте n
скорости lgKw
Алифатические
Метановая
3.75
3.2
5.0
кислоты
Этановая
4.76
3.5
5.8
Этандиовая
1.25; 4.14
2.0
2.7
Оксикислоты
2-Гидроксипропановая
3.86
2.7
3.9
Гамма-лактон-2,3-
4.10
3.2
5.3
дигидро-L-гулоновая
Гидроксибутандиовая
3.46; 5.05
2.3
3.3
3-Гидрокси-3-карбо-
3.13; 4.76; 6.40
2.0
2.5
ксипентандиовая
Физический смысл показателя кислотности —
степень стабилизации аниона кислоты: чем ниже
величина pKк, тем стабильнее ионизированная форма
кислоты. Повышенные значения рKк указывают на
присутствие в водных растворах неионизированных
более гидрофобных молекул кислоты. Вследствие
этого в рядах и оксикислот, и алифатических кислот
константы скорости реакции растворения CaCO3 в
карбоновых кислотах больше для кислот с меньшим
показателем кислотности (рис. 4). При этом для кис-
лот алифатического ряда значения констант выше,
чем для оксикислот (рис. 4). Отличительной особен-
ностью оксикислот является наличие дополнитель-
ной гидроксильной группы — OH, вследствие чего
оксикислоты более гидрофильны по сравнению с
алифатическими кислотами. Более гидрофобные мо-
Рис. 4. Зависимость константы скорости реакции рас-
творения CaCO3 в карбоновых кислотах от показателя
лекулы алифатических кислот легче адсорбируются
кислотности алифатических кислот (1) и оксикислот (2).
на гидрофобной поверхности карбоната кальция.
786
Прокудина Н. А. и др.
Выводы
[4]
Амиров А. М. Определение оптимальной скоро-
сти закачки кислотного состава для образования
Одной из основных трудностей при определении
высокопроницаемого канала в керне // Междунар.
кинетических параметров гетерогенной химической
науч.-исслед. журн. 2014. № 3. С. 113-116.
реакции растворения, протекающей на межфазной
[5]
Хижняк Г. П., Амиров А. М., Гладких Е. А., Коз-
границе жидкость-твердая фаза, является проведение
лов А. А., Колесов В. А., Захарян А. Г., Пестри-
процесса растворения в кинетической области, когда
ков А. В., Чикин А. Е., Комин М. А., Харрис Р. Ла-
на скорость химической реакции не влияют диффузи-
бораторные испытания кислотогенерирующего
онные ограничения, что наглядно продемонстрирова-
состава DEEPA // Вестн. ПНИПУ. Геология. Нефте-
но в представленной работе. Полученные константы
газ. и горн. дело. 2015. № 14. С. 18-31.
[6]
Солодовников А. О., Андреев О. В., Киселев К. В.
скорости реакции растворения CaCO3 в карбоновых
Влияние скорости закачки растворов кислотообра-
кислотах коррелируют с такими характеристиками
зующих реагентов на структуру каналов филь-
кислот, как основность и показатель кислотности, что
трации // Башкир. хим. журн. 2013. Т. 20. № 1.
подтверждает корректность выполненных измерений.
С. 135-137.
Численные значения полученных кинетических па-
[7]
Андреев К. В. Анализ применения кислотных со-
раметров реакции растворения CaCO3 в карбоновых
ставов в высокотемпературных карбонатных кол-
кислотах — константы скорости и порядки по кисло-
лекторах // Недропользование. 2021. Т. 21. № 2.
там — могут быть использованы для моделирования
С. 76-83.
процесса кислотной обработки карбонатных коллек-
торов и управления процессами фильтрации.
[8]
Fred C. N., Fogler H. S. Influence of transport and
reaction on wormhole formation in porous media
// AIChE J. 1998. V. 44. N 9. P. 1933-1949.
Благодарности
Авторы выражают благодарность инженеру 2-й
[9]
Fredd C. N., Tjia R., Fogler H. S. The Existence of an
optimum Damkohler number for matrix stimulation
категории А. В. Дектеревой за определение фракци-
of carbonate formations // Paper presented at the SPE
онного состава образца порошкообразного CaCO3 и
European Formation Damage Conference. The Hague,
геологу Е. П. Микляевой за выполнение рентгенофа-
Netherlands, June 1997. N SPE-38167-MS.
зового анализа образцов CaCO3.
[10]
Fredd С. N., Fogler H. S. Optimum conditions for
wormhole formation in carbonate porous media:
Информация об авторах
Influence of transport and reaction // SPE J. 1999. V. 4.
Прокудина Нина Александровна, к.х.н.
[11]
Al-Arji H., Al-Azman A., Le-Hussain F., Regenauer-
Габисов Ахдан Салманович
Lieb K. Acid stimulation in carbonates: A Laboratory
test of a wormhole model based on Damköhler and
Старковский Владислав Анатольевич, к.т.н.
Péclet numbers // J. Pet. Sci. Eng. 2021. V. 203. ID
[12]
Чижов А. П., Андреев В. Е., Чибисов А. В.,
Орловский С. Л., Федоров К. М., Иванов Д. В.
Список литературы
Совершенствование соляно-кислотного воз-
действия в условиях карбонатов Волго-Урала //
[1] Сучков Б. М., Каменщиков Ф. А. Новые методы ин-
Проблемы сбора, подготовки и транспорта нефти
тенсификации добычи нефти из карбонатных кол-
и нефтепродуктов. 2017. № (4) 110. С. 26-35.
лекторов // Нефт. хоз-во. 1998. № 3. С 48-50.
[2] Фарманзаде А. Р., Литвин В. Т., Рощин П. В. Подбор
[13]
Szymczak P., Ladd A. J. C. Wormhole formation in
основы кислотного состава и специальных до-
dissolving fractures // JGR. 2009. V. 114. ID B06203.
бавок для обработки призабойной зоны пласта
Баженовской свиты // Междунар. науч.-исслед.
[14]
Alarjia H., Alzahid Ya., Regenauer-Liebc K. Acid
журн. 2015. Т. 3. № 4. С. 68-72.
stimulation in carbonates: Microfluidics allows
[3] Глущенко В. Н., Пташко О. А. Фильтрационные ис-
accurate measurement of acidic fluid reaction rates in
следования новых кислотных составов для обра-
carbonate rocks by quantifying the produced CO2 gas
ботки карбонатных коллекторов // Вестн. ПНИПУ.
// J. Nat. Gas Sci. Eng. 2022. V. 99. ID 104444.
Геология. Нефтегаз. и горн. дело. 2014. № 11. С. 46-56.