894
Сарымсаков А. А. и др.
Журнал прикладной химии. 2022. Т. 95. Вып. 7
УДК 542.06:547.96:544.032.7:66.081
ПОЛУЧЕНИЕ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ГЕМОСОРБЕНТА
НА ОСНОВЕ ФИБРОИНА КОКОНОВ ШЕЛКОПРЯДА Bombyx mori
© А. А. Сарымсаков, С. С. Ярматов, Х. Э. Юнусов*
Институт химии и физики полимеров АН Республики Узбекистан,
700128, Узбекистан, г. Ташкент, ул. А. Кадыри, д. 7б
Поступила в Редакцию 10 мая 2022 г.
После доработки 30 сентября 2022 г.
Принята к публикации 30 сентября 2022 г.
Разработан способ получения гемосорбента посредством химической и физической модификации на-
турального шелка и волокнистых отходов, получаемых при переработке коконов шелкопряда Bombyx
mori. Посредством гидролиза шелковых волокон и волокнистых отходов в воде в замкнутой системе
при 110°С и давлении 0.143 МПа в течение 24 ч достигнуто полное разделение шелковых нитей на
чистый фиброин и серицин. Гидролиз чистого фиброина осушествлен в водной среде при температуре
130°С под давлением 0.145 МПа. Далее температуру повышали до 210°С при давлении 0.60 МПа и
на реакционую среду воздействовали ультразвуковым диспергированием и сверхвысокочастотным
облучением при 2450 МГц в течение 1-15 мин. Состав, структуру, физико-химические свойства ге-
мосорбента изучали с использованием методов ИК-спектроскопии, рентгеноструктурного анализа
и высокоэффективной жидкостной хроматографии. Полученный гемосорбент обладает высокой
сорбционной активностью по отношению к витамину В12.
Ключевые слова: гемосорбент; фиброин; аминокислота; серицин; коконы Bombyx mori
DOI: 10.31857/S0044461822070088; EDN: DMQXET
Белок природного шелка — фиброин, который
Экспериментальная часть
выделяют из коконов шелкопряда Bombyx mori, не
растворяется в воде и в некоторых разбавленных
В качестве объектов исследований были выбраны
растворах кислот и щелочей [1]. Он существует в не-
шелковые нити, некондиционные коконы шелкопря-
скольких структурных формах, в частности, способен
да Bombyx mori и волокнистые отходы переработки
формировать α-спирали и β-складки [2, 3]. Фиброин
шелка фирмы OOO Inter Silk Pro. Основные использу-
применяется в регенеративной медицине в качестве
емые реактивы приобретены у фирмы Sigma-Aldrich:
материала для изготовления матриксов, пленок, хи-
спирт этиловый (96.0%, кат. № 1.59010), HCl (37.0%,
рургических нитей и покрытий [4]. Кроме того, он
кат. № Н1758), бензол (99.9%, кат. № 270790), ви-
обладает умеренной антимикробной активностью
тамин B12 (98.0%, кат. № V6629), LiCl (98.0%, кат.
и может быть рекомендован в качестве природного
№ 203637, диметилформамид (99.8%, кат. № 227056),
антибактериального биоматериала [5].
CaCl2 (99.99%, кат. № 499609), гель додецилсуль-
Цель работы — получение гемосорбента на осно-
фат-полиакриламид натрия (4-12%, 10 × 10 см, кат.
ве фиброина шелка из коконов шелкопряда Bombyx
№ PCG2003); для получения дистиллированной
mori для детоксикации крови и сыворотки крови, а
воды использовали дистиллятор DZ-10L11 фирмы
также определение его физико-химических и сорб-
Huanghua Faithful Instrument Co., LTD.
ционных характеристик.
Очистку шелковых нитей и волокнистых отходов
от жиро-восковых и неорганических примесей осу-
Научное редактирование проведено научным редактором журнала «Нефтехимия» к.х.н. Н. В. Шелеминой.
Получение и физико-химические свойства гемосорбента на основе фиброина коконов шелкопряда Bombyx mori
895
ществляли посредством последовательной обработки
ским методом в 2.5 М растворе LiCl, в диметилфор-
бензолом и смесью этанол-дистиллированная вода
мамиде при 25°С. Молекулярная масса фиброина
при соотношении 70:30 (об%) трехкратно в течение
рассчитана по уравнению Марка-Куна-Хаувинка с
1 ч при температуре 50°С. Степень чистоты шелко-
использованием параметров K = 1.23·10-3, α = 0.91,
вых нитей и волокнистых отходов, определенная по
величины которых зависят от природы полимера,
методу,* составила 99.8%.
растворителя и температуры [7].
С целью удаления водорастворимого серицина из
Также молекулярную массу фиброина опреде-
структуры шелковых нитей образцы выдерживали в
ляли электрофоретическим методом [8]; при этом
течение 24 ч в воде при температуре 110°С и давлении
водный раствор фиброина был разделен по методи-
0.143 МПа. Аминокислотный состав фиброина шел-
ке [9] на 6 фракций, различающихся молекулярной
ка определяли на приборе Agilent 6400 Series Triple
массой. Для определения молекулярной массы фи-
Quadrupole LC/MS Systems (Shimadzu) методом, пред-
броина электрофоретическим методом [8] 130 мг
ставленным в сообщении A. Steven и D. Cohen [6].
фиброина в растворителе, содержащем 389 мг CaCl2,
С целью повышения сорбционной активности
388 мкл этилового спирта и 544 мкл дистиллирован-
фиброина и получения гемосорбента проведен его
ной воды, перемешивали 5 ч до полного растворе-
повторный гидролиз в воде при температуре 130-
ния фиброина. Раствор центрифугировали на цен-
230°С и давлении 0.145-0.60 МПа с последующим
трифуге Cenlee 20K (Hunan) в течение 20 мин при
ультразвуковым диспергированием на приборе
8000 об·мин-1. Центрифугат диализовали через по-
УЗДН-1, У-4,2 (ООО НПП «Укрросприбор») в тече-
лупроницаемую целлюлозную мембрану (8-14 кДа)
ние 1-15 мин с последующим сверхвысокочастотным
[10]. Распределение молекулярной массы раствора
облучением на СВЧ-установке УОМО-Т150 (ООО
фиброина измеряли электрофорезом на многоцелевой
«Специнтех»).
системе электрофореза EW-28571-02 (Cole-Parmer) в
ИК-спектроскопические исследования фиброина
геле додецилсульфат-полиакриламид натрия.
и гемосорбента на его основе осуществляли с ис-
Степень чистоты фиброина, промытого дистилли-
пользованием ИК-Фурье-спектрометра Inventio-S
рованной водой, определяли УФ-спектроскопическим
(Bruker) в спектральном диапазоне 4000 ± 500 см-1.
методом. Оптические спектры поглощения растворов
Рентгеноструктурный анализ гемосорбента проводи-
были зарегистрированы на приборе Specord М210
ли на приборе Miniflex600 (Rigalku) при 40 кВ и силе
(Analytic Jena) в диапазоне длин волн 200-900 нм, где
тока 15 мА в интервале 2θ, равном 5-44°.
длина оптического пути составляла 2 мм.
Расчет степени кристалличности (СК) проводили
Сорбционные свойства гемосорбента по отноше-
по оценке интенсивности максимального пика и по
нию к витамину В12 изучали в статических условиях
формуле
при комнатной температуре [11]. К навеске образ-
ца чистого фиброина и гемосорбента на его основе
СК =
· 100%,
(1.0000 ± 0.0002 г) добавляли 25 мл водного раствора
витамина В12 концентрацией 0.50 ± 0.02 мг·мл-1.
где Iк и Ia — интенсивности кристаллического реф-
Концентрацию сорбата в растворе определяли через
лекса и аморфного рассеяния соответственно, K —
60 мин методом УФ-спектроскопии до и после про-
поправочный коэффициент.
ведения сорбции при длине волны 360 нм в кювете
Размер кристаллитов определяли по формуле
толщиной 10 мм. Содержание в гидролизованном
Шеррера:
фиброине карбоксильных и аминогрупп определяли
L =
,
потенциометрически по методике [12], объем пор —
методом ГОСТ 17219-71.**
где L — эффективный размер кристаллита (Å);
λ = 1.5418 Å — длина волны; 2θ — брэгговский
Обсуждение результатов
угол (град); k — коэффициент, зависящий от формы
кристаллита, k = 0.9; β — ширина полувысоты пика
Экспериментально определенный аминокислот-
(град).
ный состав чистого фиброина (табл. 1) близок к рас-
Характеристическую вязкость фиброина и гемо-
четному [13].
сорбента на его основе определяли вискозиметриче-
* ГОСТ 5556-81. Вата медицинская гигроскопическая.
** ГОСТ 17219-71. Угли активные. Метод определения
Технические условия.
суммарного объема пор в воде.
896
Сарымсаков А. А. и др.
Таблица 1
Аминокислотный состав чистого фиброина и после его гидролиза
Количественный состав аминокислот, мас%
Содержание аминокислот
Аминокислота
рассчитано
определено
в гидролизате, мг·мл-1
Серин (Ser)*
12.22
11.91
0.3121
Аспарагин (Asp)*
1.93
0.75
0.3563
Аргинин (Arg)*
0.51
0.45
0.0176
Треонин (Thr)*
0.95
0.82
0.0152
Глутамин (Glu)*
1.42
1.35
0.0205
Гистидин (His)*
0.19
0.19
0.0428
Цистеин (Cys)*
0.05
0.05
0.0593
Пролин (Pro)*
0.45
0.65
0.0233
Лизин HCl (Lys)*
0.34
0.46
0.0135
Глицин (Gly)**
42.92
43.10
0.2605
Аланин (Ala)**
29.91
31.21
0.0260
Валин (Val)**
2.55
2.34
0.0253
Изолейцин (Ile)**
0.64
0.72
0.0295
Лейцин (Leu)**
0.55
0.46
0.0217
Метионин (Met)**
0.12
0.22
0.0297
Тирозин (Tyr)***
4.81
5.12
0.0908
Фенилаланин (Phe)***
0.67
0.55
0.0298
П р и мечан и е. * гидрофильные, ** гидрофобные, *** ароматические.
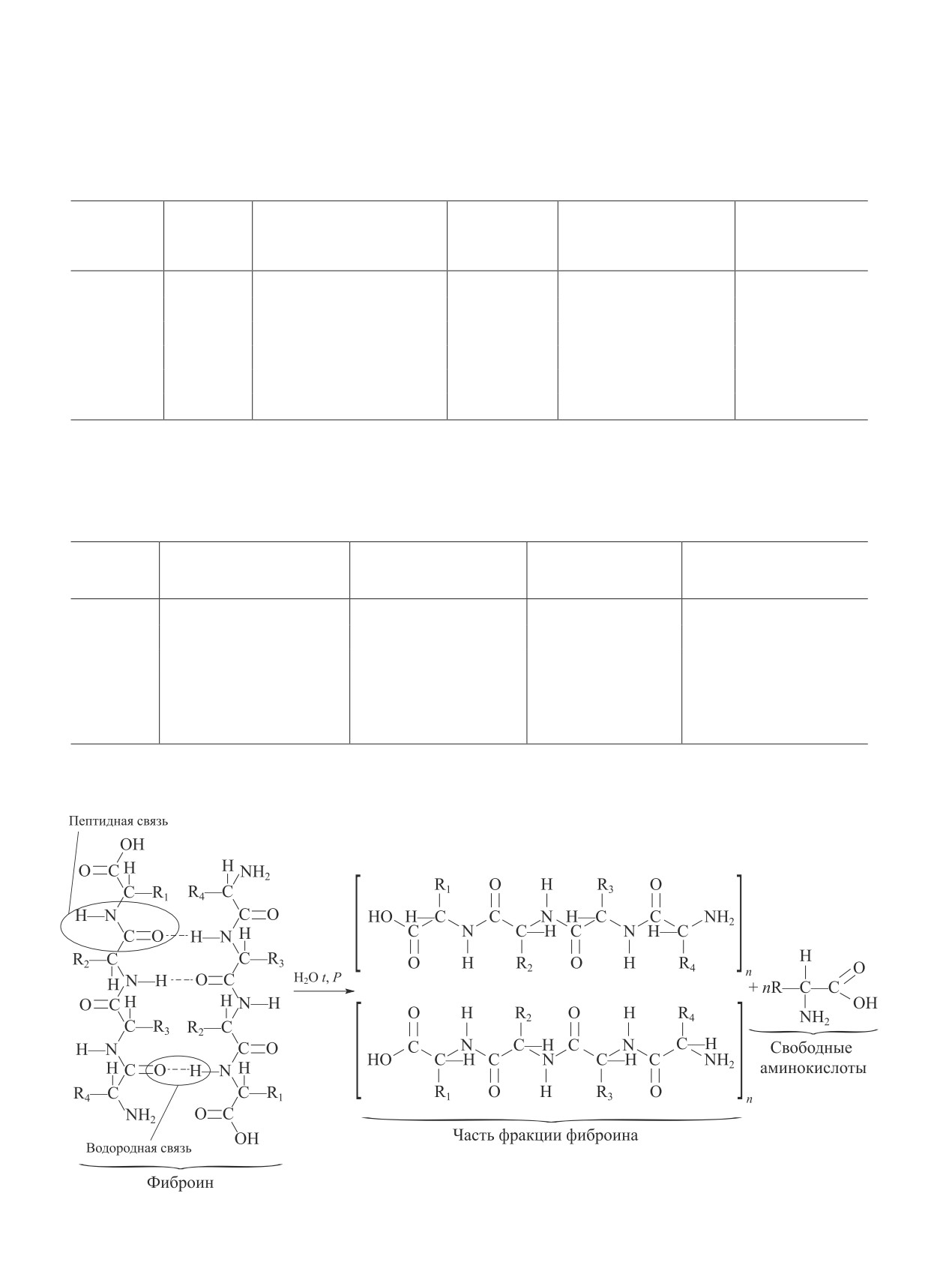
Фиброин шелка шелкопряда Bombyx mori со-
При температуре повторного гидролиза фиброи-
держит в своем составе шесть тяжелых H-цепей
на 210°С сохраняется волокнистая структура и до-
(~350 кДа) и шесть легких L-цепей (~25.8 кДа), свя-
стигаются высокие значения сорбции витамина В12
занных одной дисульфидной связью [14]. Щелочное
(табл. 2, 3).
рафинирование может привести к деградации макро-
Предполагаемый механизм гидротермической де-
молекул фиброина за счет разрыва пептидных связей
струкции фиброина [16] приведен ниже (см. схему).
в основных H- и L-цепях, что снижает среднюю мо-
При повторном гидролизе фиброина в результате
лекулярную массу регенерированного фиброина [15].
разрыва пептидных связей образуются свободные
Фиброин содержит в своем составе примерно 75%
карбоксильные и аминогруппы, способствующие
гидрофобных аминокислот. Кроме того, аминокисло-
увеличению сорбционной способности гемосорбента.
ты фиброина способны формировать большое коли-
В процессе гидролиза фиброин частично гидролизу-
чество межмолекулярных водородных связей. В связи
ется до аминокислот, содержание которых представ-
с этим фиброин не может растворяться, но способен
лено в табл. 1.
к набуханию в воде и большинстве органических
С целью дальнейшего повышения сорбцион-
растворителей. Фиброин растворим только в раство-
ной активности гидролизованного фиброина было
рителях, которые могут разрушить его водородные
проведено его ультразвуковое (УЗ) диспергирова-
связи и гидрофобные взаимодействия, включая раз-
ние и сверхвысокочастотное облучение (табл. 4).
рыв пептидных цепей [4].
Максимальная сорбционная активность гидроли-
Молекулярная масса фиброина, определенная ви-
зованного фиброина достигнута при ультразвуко-
скозиметрическим методом, составила 340 кДа, что
вом диспергировании в течение 5 мин и составляет
сопоставимо с результатом, полученным электрофо-
76 мас%. Данный факт, видимо, объясняется тем,
ретическим методом.
что в процессе ультразвукового диспергирования из
Выделенный очищенный фиброин был подвергнут
структуры фиброина в водную среду переходят амор-
повторному гидролизу при температурах 130-230°С
фные фрагменты фиброина с относительно низкой
в течение 30-240 мин.
молекулярной массой, в результате чего формируются
Получение и физико-химические свойства гемосорбента на основе фиброина коконов шелкопряда Bombyx mori
897
Таблица 2
Зависимость сорбции витамина В12 от температуры повторного гидролиза фиброина
(время гидролиза 60 мин, начальная концентрация В12 180 мг·л-1)
Концентрация
Сорбция
Потеря массы фиброина
Внешний вид
Температура,
Давление,
сорбированного витамина В12
витамина В12,
после повторного
гидролизованного
°С
МПа
гидролизованным
мас%
гидролиза, мас%
фиброина
фиброином, мг·л-1
130
0.145
82
45.55
2.2
Волокно
150
0.249
85
47.22
2.4
»
170
0.320
89
49.44
3.3
»
190
0.410
97
53.89
5.7
»
210
0.510
109
61.23
8.8
»
230
0.609
—
—
—
Порошок
П р и мечан и е: «—» — не определяли, поскольку фиброин в виде порошка не может быть использован в качестве
гемосорбента.
Таблица 3
Зависимость сорбции витамина В12 от времени повторного гидролиза фиброина
(температура 210°С, давление 0.51 МПа, начальная концентрация В12 180 мг·л-1)
Потеря массы фиброина
Концентрация сорбирован-
Сорбция витамина В12,
Внешний вид
Время, мин
после повторного
ного витамина В12, мг·л-1
мас%
гидролизованного фиброина
гидролиза, мас%
30
6.2
97.2
54.1
Волокно
60
8.8
109.8
61.2
»
120
12.6
117.9
65.5
»
180
25.7
124.7
69.3
Смесь волокна и порош-
ка
240
—
—
—
Порошок
П р и мечан и е: «—» — не определяли, поскольку фиброин в виде порошка не может быть использован в качестве
гемосорбента.
Схема
898
Сарымсаков А. А. и др.
Таблица 4
Влияние времени ультразвукового диспергирования на изменение сорбционной активности гидролизованного
фиброина (начальная концентрация В12 180 мг·л-1, время сорбции 45 мин)
Изменение концентрации
Сорбция
Потеря массы
Размеры частиц фиброина, мкм
Время ультразвукового
витамина В12 в системе
витамина
фиброина,
диспергирования, мин
после сорбции, мг·л-1
В12, мас%
мас%
средние
минимальные
максимальные
1
52
71.13
6.02
540
93
850
3
50
71.94
6.10
360
70
720
5
43
76.12
7.51
120
45
590
10
53
70.55
9.75
27
9
60
15
56
68.89
11.97
18
7
38
полости, содержащие реакционноактивные амино- и
карбоксильные группы.
Гидролизованный фиброин модифицировали так-
же с использованием сверхвысокочастотного (СВЧ)
облучения. Сорбционные свойства приведены в
табл. 5.
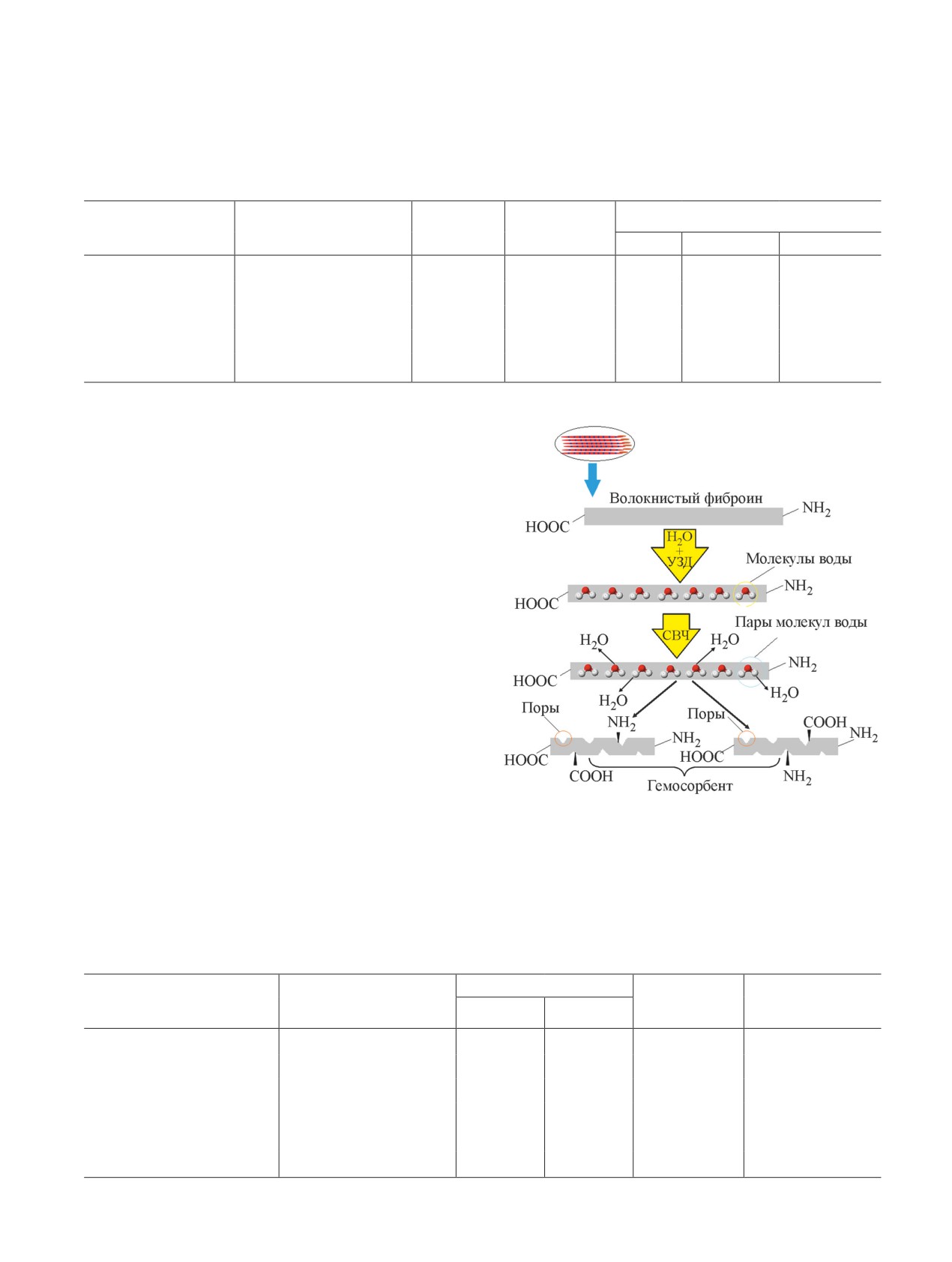
Сверхвысокочастотное облучение гидролизован-
ного фиброина способствует увеличению объема
пор за счет разрыва структуры волокон фиброина и
удаления паров воды из внутренних слоев структуры
элементарных волокон. Установлено, что последова-
тельное УЗ-диспергирование и СВЧ-облучение ги-
дролизованного фиброина способствует увеличению
его сорбционной активности до 95 мас% при сорбции
В12. Наблюдаемый эффект объясняется увеличением
содержания реакционноактивных карбоксильных
и аминогрупп. Для подтверждения данного факта
определено содержание карбоксильных и аминогрупп
в структуре гидролизованного фиброина (табл. 6).
При последовательном изменении условий об-
работки гидролизованного фиброина наблюдается
Рис. 1. Предполагаемый механизм модификации ги-
увеличение содержания в его составе карбоксильных
дролизованного фиброина с использованием ультра-
и аминогрупп, что приводит к увеличению сорбцион-
звукового диспергирования и сверхвысокочастотного
облучения.
ной активности (рис. 1).
Таблица 5
Зависимость сорбции витамина В12 от времени сверхвысокочастотного облучения гидролизованного фиброина
(начальная концентрация В12 180 мг·л-1, мощность 800 Вт, частота 2450 мГц, время сорбции 45 мин)
Изменение концентрации
Сорбция витамина В12
Потеря массы
Внешний вид
Время сверхвысокочастотного
витамина В12 в системе
фиброина,
гидролизованного
облучения, мин
мг·л-1
мас%
после сорбции, мг·л-1
мас%
фиброина
1
41.4
138.6
77
7.8
Волокно
3
37.8
142.2
79
8.2
»
5
31.5
148.5
82
10.6
»
10
14.4
165.6
92
15.8
»
20
9.3
171.1
95
18.7
Частично волокно
30
—
—
—
—
Порошок
Получение и физико-химические свойства гемосорбента на основе фиброина коконов шелкопряда Bombyx mori
899
Таблица 6
Сорбционные показатели образцов гидролизованного фиброина (начальная концентрация В12 180 мг·л-1)
Реакционноактивные функциональные группы, мас%
Сорбция
Образец
витамина В12,
карбоксильные
аминогруппы
мас%
Исходный шелк
4.65
3.52
31.8
Чистый фиброин
4.71
3.86
43.3
Гидролизованный фиброин (210°С)
8.14
6.72
65.5
Гидролизованный фиброин (210°С + ультразвуковое
9.33
8.23
69.4
диспергирование)
Гидролизованный фиброин (210°С + сверхвысоко-
11.64
9.86
70.8
частотное облучение)
Гидролизованный фиброин (210°С + ультразвуковое
14.26
12.82
95.2
диспергирование + сверхвысокочастотное облу-
чение)
Вода способна проникать во внутренние слои фи-
указанной методике установлено, что объем пор ге-
броина. В процессе СВЧ-облучения гидролизован-
мосорбента в 3-4 раза выше, чем при термическом
ного фиброина при 2450 МГц и мощности 800 Вт
гидролизе фиброина в водной среде. Установлено, что
молекулы воды, содержащиеся во внутренних слоях
содержание свободных карбоксильных групп в гемо-
волокна фиброина, быстро переходят в состояние па-
сорбенте составляет 14.2 мас%. Это достигается за
ра и способствуют образованию пор за счет разрыва
счет разрыва пептидных связей фиброина в процессе
поверхности волокон. Путем модификации гидроли-
его модификации.
зованного фиброина под воздействием физических
В ИК-спектрах фиброина шелка (рис. 2) поло-
факторов были получены полифункциональные во-
сы поглощения при 1700-2710 см-1 соответствуют
локнистые гемосорбенты с длиной волокон 5-7 мм
карбоксильным группам, 1514 см-1 — полосам по-
и высокими сорбционными свойствами. Их сорб-
глощения —СО-—NH-групп, 2931 см-1 — —СН2-
ционная активность по отношению к витамину В12
группам и 2979 см-1 — третичным —С(R)Н-группам.
составляла 95 мас%.
В ИК-спектрах гемосорбента, полученного из фибро-
При определении содержания свободных кар-
ина, полосы поглощения при 3296 см-1 характери-
боксильных и аминогрупп в результате разрыва
зуют —ОН-группу; 3300, 1623, 690 см-1 отнесены к
пептидных и водородных связей под воздействием
—NH2-группам; полоса при 1230 см-1 — к связам
УЗ-диспергирования и СВЧ-облучения по выше-
С—О карбоксильных групп и 1700 см-1 — карбок-
Рис. 2. ИК-Фурье-спектры: 1 — фиброина, 2 — гемосорбента, полученного посредством ультразвукового диспер-
гирования и сверхвысокочастотного облучения фиброина.
900
Сарымсаков А. А. и др.
методов ультразвукового диспергирования и сверхвы-
сокочастотного облучения получен высокопористый
гемосорбент, обладающий высокой сорбционной спо-
собностью по отношению к витамину В12.
Финансирование работы
Исследования выполнены при поддержке фун-
даментальных исследований по базовому финанси-
рованию Академии наук Республики Узбекистан и
проекту № MBB-2021-548.
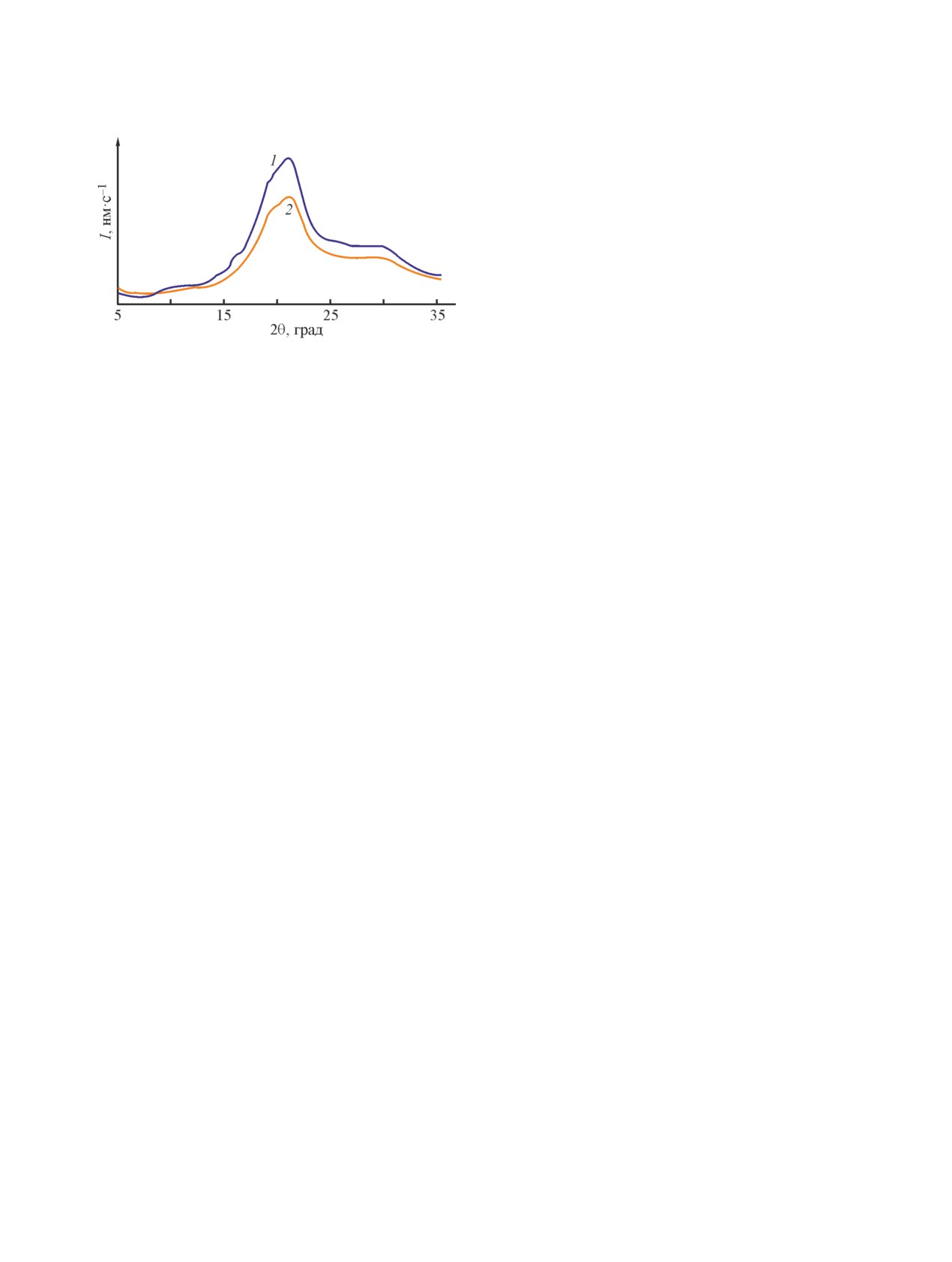
Рис. 3. Рентгеновские дифракционные кривые: 1 — фи-
броина, 2 — гемосорбента на его основе.
Конфликт интересов
Авторы заявляют об отсутствии конфликта инте-
сильным группам, интенсивность которых увеличена
ресов, требующего раскрытия в данной статье.
по сравнению с исходным фиброином.
С целью определения изменения степени кристал-
Информация об авторах
личности чистого фиброина и полученного гемосор-
бента были зарегистрированы их дифрактограммы
Сарымсаков Абдушкур Абдухалилович, проф.
(рис. 3). Степень кристалличности чистого фиброина
Ярматов Сардорбек Собиржонович
составила 46.1 мас%. Высокая кристалличность фи-
броина является результатом вымывания аморфных
Юнусов Хайдар Эргашович, д.т.н.
частей из межплоскостных участков кристаллических
слоев фиброина. В процессе получения гемосор-
бента на основе чистого фиброина, обработанного
УЗ-диспергированием и СВЧ-облучением, степень
Список литературы
кристалличности снижается до 38.1 мас%, что объ-
[1] Hai-Yan W., Yu-Qing Zh., Zheng-Guo W. Dissolution
ясняется аморфизацией структуры гемосорбента.
and processing of silk fibroin for materials science //
При выделении фиброина из шелка происходит уве-
Crit. Rev. Biotechnol. 2021. V. 41. N 3. P. 406-424.
личение степени кристалличности, которое может
быть связано с переходом α-спирали в β-структуру
[2] Weisel J. W., Litvinov R. I. Fibrin formation, structure,
под действием их гидролиза в среде чистой воды
and properties. Fibrous proteins: Structures and
при высоких температурах (130-210°С) и давлениях
mechanisms / Eds D. Parry, J. Squire. Subcell. Biochem.
(0.145-0.510 МПа). Степень кристалличности гемо-
Springer, Cham. 2017. V. 82. P. 405-456.
сорбента еще в больщей степени снижалась при его
УЗ-диспергировании и СВЧ-облучении.
[3] Zheng Y., Wang D., Zhao L., Wang X., Han W.,
Wang L. Chemically modified silk fibroin hydrogel for
environment-stable electronic skin // Sens. Actuators
Rep. 2022. V. 4. P. 100089-100095.
Выводы
Разработан способ очистки природных шелко-
[4] Сашина Е. С., Голубихин А. Ю., Новоселов Н. П.,
вых нитей и волокнистых отходов предприятий по
Цобкалло Е. С., Заборский М., Горальский Я.
Исследование возможности применения пленок
переработке коконов шелкопряда Bombyx mori от
фиброина шелка и его смесей с синтетическими по-
жиро-восковых и минеральных примесей. Путем по-
лимерами для создания материалов контактных линз
следовательной промывки полярными (этанол-вода)
// ЖПХ. 2009. Т. 82. № 5. С. 843-849 [Sashina E. S.,
и неполярным (бензол) растворителями достигнута
Golubikhin A. Yu., Novoselov N. P., Tsobkallo E. S.,
степень чистоты 99.8 мас%. Обработкой шелковых
Zaborskii M., Goralskii Ya. Study of a possibility of
нитей и волокнистых отходов водой при температу-
applying the films of the silk fibroin and its mixtures
рах 110-230°С и давлениях 0.143-0.600 МПа получен
with synthetic polymers for creating the materials of
чистый фиброин.
contact lenses // Russ. J. Appl. Chem. 2009. V. 82. N 5.
Посредством последовательного гидролиза чи-
P. 898-904.
стого фиброина в водной среде с использованием
Получение и физико-химические свойства гемосорбента на основе фиброина коконов шелкопряда Bombyx mori
901
[5]
Abdel-Fattah W. I., Atwa N., Ali G. W. Influence of the
Transplantology and Artificial Organs. 2016. V. 18.
protocol of fibroin extraction on the antibiotic activities
N 3. P. 74-84.
of the constructed composites // Prog. Biomater. 2015.
V. 4. N 2-4. P. 77-88.
[11]
Veprikova E. V., Ivanov I. P., Chesnokov N. V.,
Kuznetsov B. N. Study of enterosorption activity of
[6]
Chumroenphat T., Somboonwatthanakul I., Saensouk
carbon sorbents based on organosolvent lignin of fir
S., Siriamornpun S. Changes in curcuminoids and
wood // J. Sib. Fed. Univ. Chem. 2018. V. 11. N 2.
chemical components of turmeric (Curcuma longa
P. 249-261.
L.) under freeze-drying and low-temperature drying
methods // Food Chem. 2021. V. 339. P. 128121-
[12]
Аввакумова Н. И., Бударина Л. А., Дивгун С. М.,
128130.
Заикин А. Е., Кузнецов Е. В., Куренков В. Ф.
Практикум по химии и физике полимеров. М.:
[7]
Pawcenis D., Syrek M., Koperska M. A., Łojewski T.,
Химия, 1990. С. 57-58.
Łojewska J. Mark-Houwink-Sakurada coefficients
[13]
Yuan-Jing W., Yu-Qing Zh. Three-layered sericins
determination for molar mass of silk fibroin from
around the silk fibroin fiber from Bombyx mori cocoon
viscometric results // RSC Adv. 2016. V. 6. P. 38071-
and their amino acid composition // Adv. Mater. Res.
[8]
Остерман Л. А. Методы исследования белков и
нуклеиновых кислот: электрофорез и ультрацен-
[14]
Asakura T. Structure of silk I (Bombyx mori silk
трифугирование. М.: Наука, 1981. С. 56-59.
fibroin before spinning)-type II β-turn, not α-helix- //
[9]
Aoki M., Masuda Y., Ishikawa. K., Tamada Y.
Molecules. 2021. V. 26. P. 3706-3726.
Fractionation of regenerated silk fibroin and
characterization of the fractions // Molecules. 2021.
[15]
Gandhimathi C., Venugopal J. R., Tham A. Y.,
V. 26. P. 6317-6343.
Ramakrishna S., Kumar S. D. Biomimetic hybrid
nanofibrous substrates for mesenchymal stem cells
[10]
Сафонова Л. А., Боброва М. М., Агапова О. И.,
differentiation into osteogenic cells // Mater. Sci. Eng.
Архипова А. Ю., Гончаренко А. В., Агапов И. И.
C. 2015. V. 49. P. 776-785.
Пленки на основе фиброина шелка для зажив-
ления полнослойной раны кожи у крыс // Вестн.
[16]
Qiang L., Bing Zh., Mingzhong L., Baoqi Z.,
трансплантологии и искусств. органов. 2016.
David L. K., Yongli H., an Hesun Zh. Degradation
Т. 18. № 3. С. 74-84 [Safonova L. A., Bobrova M. M.,
mechanism and control of silk fibroin / /
Agapova O. I., Arkhipova A. Yu., Goncharenko A. V.,
Biomacromolecules. 2011. V. 12. N 4. P.1080-1086.
Agapov I. I. Fibroin silk based films for rat′s full-
thickness skin wound regeneration // Russ. J.