Журнал прикладной химии. 2022. Т. 95. Вып. 8
УДК 661.72+546.262.3-31+66.097.3
КАТАЛИЗАТОРЫ КАРБОНИЛИРОВАНИЯ СПИРТОВ
ДЛЯ ПОЛУЧЕНИЯ КАРБОНОВЫХ КИСЛОТ И СЛОЖНЫХ ЭФИРОВ (обзор)
© Н. Т. Севостьянова, С. А. Баташев
Тульский государственный педагогический университет им. Л. Н. Толстого,
300026, г. Тула, пр. Ленина, д. 125
E-mail: sevostyanova.nt@gmail.com
Поступила в Редакцию 6 июня 2022 г.
После доработки 28 ноября 2022 г.
Принята к публикации 19 декабря 2022 г.
Карбонилирование спиртов с использованием СО — один из способов получения востребованных в
химической и фармацевтической промышленности карбоновых кислот и сложных эфиров. В суще-
ствующих промышленных процессах карбонилирования метанола в условиях гомогенного катализа
соединениями родия (Monsanto процесс) и иридия (Cativa процесс) используют коррозионноактивные
добавки иодидов. С экономической точки зрения актуальны разработки катализаторов, предпоч-
тительно не содержащих дорогостоящих платиновых металлов и сохраняющих активность на
протяжении большого числа рециклов. В обзоре систематизированы результаты исследований, опу-
бликованных с 2011 г. по карбонилированию различных спиртов с использованием СО в присутствии
новых гомогенных и гетерогенных катализаторов. Подавляющее большинство работ было посвящено
процессу карбонилирования метанола, продуктами которого являются уксусная кислота и метил-
пропаноат. Для этого процесса были предложены новые гомогенные родий-рутениевые и иридиевые
катализаторы, гетерогенные катализаторы, содержащие Ir, Rh, Cu, Ni и Re на различных носителях,
а также цеолитный катализатор, не содержащий нанесенных металлов. Процесс карбонилирования
этанола с получением пропановой кислоты и этилпропаноата проводили в присутствии гомогенных
родиевых и никелевых катализаторов, а также гетерогенных катализаторов, содержащих Rh. Про-
цессы карбонилирования других насыщенных алифатических и алициклических спиртов, приводящие
к образованию соответствующих карбоновых кислот и сложных эфиров, осуществляли с использо-
ванием гомогенных никелевых каталитических систем. В процессах карбонилирования насыщенных
алифатических многоатомных спиртов, сопровождающихся образованием монокарбоновых кислот,
применяли гомогенные родиевые и иридиевые катализаторы. В ряде случаев авторам удалось осу-
ществить карбонилирование спиртов в отсутствие добавок иодидов. Для процессов получения нена-
сыщенных карбоновых кислот и сложных эфиров путем карбонилирования аллиловых спиртов были
предложены гомогенные и гетерогенные палладиевые катализаторы. Для синтеза арилзамещенных
карбоновых кислот и сложных эфиров карбонилированием ароматических спиртов были разрабо-
таны гомогенные никелевые и палладиевые каталитические системы. Процессы карбонилирования
пропаргиловых спиртов осуществляли в условиях гомогенного катализа палладиевыми системами.
Ключевые слова: катализатор; карбонилирование; спирт; оксид углерода(II); карбоновая кислота;
сложный эфир
Обозначения, принятые в статье: Ac — ацетил; allyl - аллил; bpim - 1,3-бис(пиридил)имидазолий;
n-Bu — н-бутил; COD — циклооктадиен; dba — дибензилиденацетон; dppb - 1,4-бис(дифенилфосфино)
бутан; dppe — 1,2-бис(дифенилфосфино)этан; dppmS — бис(дифенилфосфино)метанмоносульфид;
947
948
Севостьянова Н. Т., Баташев С. А.
dppp — 1,3-бис(дифенилфосфино)пропан; Et — этил; Me — метил; TfO- — трифлат-ион (трифторме-
тансульфонат-ион); Ph — фенил; i-Pr — изо-пропил; Py — пиридин; TFA — трифторацетат
DOI: 10.31857/S0044461822080011; EDN: NWJNJR
Карбонилирование органических соединений как
цессе. В обзоре [5] P. Kalck и соавт. приводят анализ
метод получения карбоновых кислот и сложных эфи-
последних разработок наиболее перспективных ката-
ров является одним из ведущих процессов зеленой
литических систем для синтеза уксусной кислоты и
химии. Благодаря высокой атомарной эффективно-
метилацетата. В обзоре Ren и сотр. [6] рассматривает-
сти (показатель, равный отношению молекулярной
ся карбонилирование метанола в ацетильные формы
массы целевого продукта к полной молекулярной
в условиях гетерогенного катализа. Таким образом,
массе всех продуктов реакции [1]), мягким условиям
из всех спиртов, используемых в качестве субстра-
и доступному сырью карбонилирование открыва-
тов карбонилирования, в обзорных статьях наиболее
ет возможности разработки ресурсосберегающих,
часто рассматривали метанол как доступный круп-
экологичных и экономичных процессов. В качестве
нотоннажный продукт [3-6], в то время как другим
карбонилирующего агента наиболее часто применя-
спиртам внимание практически не уделялось. В связи
ется СО — продукт, получаемый, главным образом,
с этим мы включили в обзор опубликованные с 2011 г.
из синтез-газа. Карбонилирование спиртов приводит
данные по карбонилированию разнообразных спир-
к образованию карбоновых кислот и сложных эфиров
тов — насыщенных одноатомных и многоатомных,
[реакция (I)], которые находят применение в качестве
ненасыщенных и ароматических. В то же время по
реагентов для химической промышленности (в том
карбонилированию метанола в обзор вошли данные
числе мономеров для синтеза полимеров), экологи-
работ, опубликованных после 2016 г.
чески безопасных растворителей, добавок к топли-
вам и других важных продуктов. Одной из проблем
промышленной реализации этого процесса является
НАСЫЩЕННЫЕ АЛИФАТИЧЕСКИЕ
разработка катализаторов, предпочтительно гетеро-
И АЛИЦИКЛИЧЕСКИЕ
генных, не содержащих дорогостоящих платиновых
ОДНОАТОМНЫЕ СПИРТЫ
металлов и сохраняющих активность на протяжении
Синтез уксусной кислоты и метилацетата
большого числа рециклов.
карбонилированием метанола
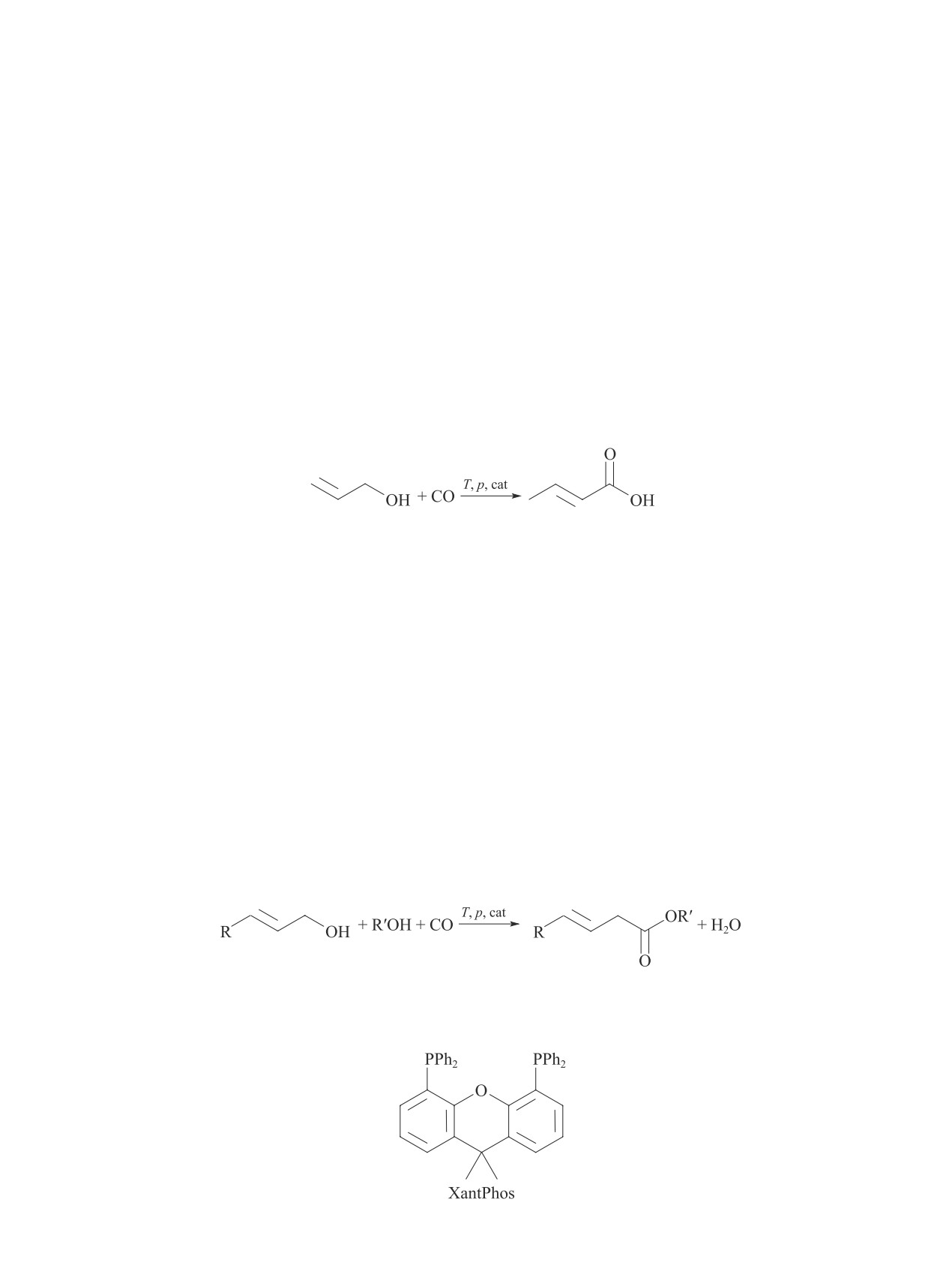
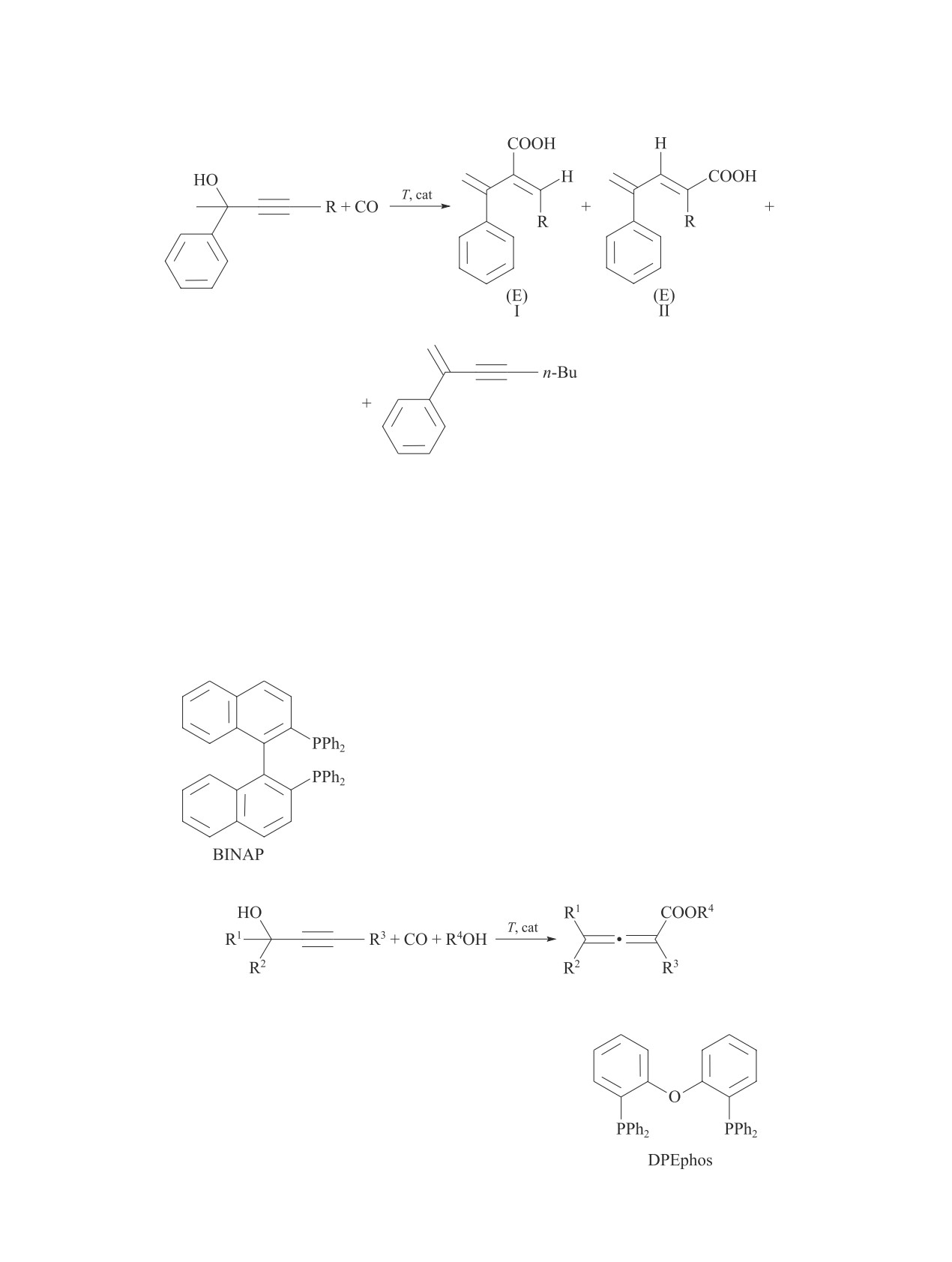
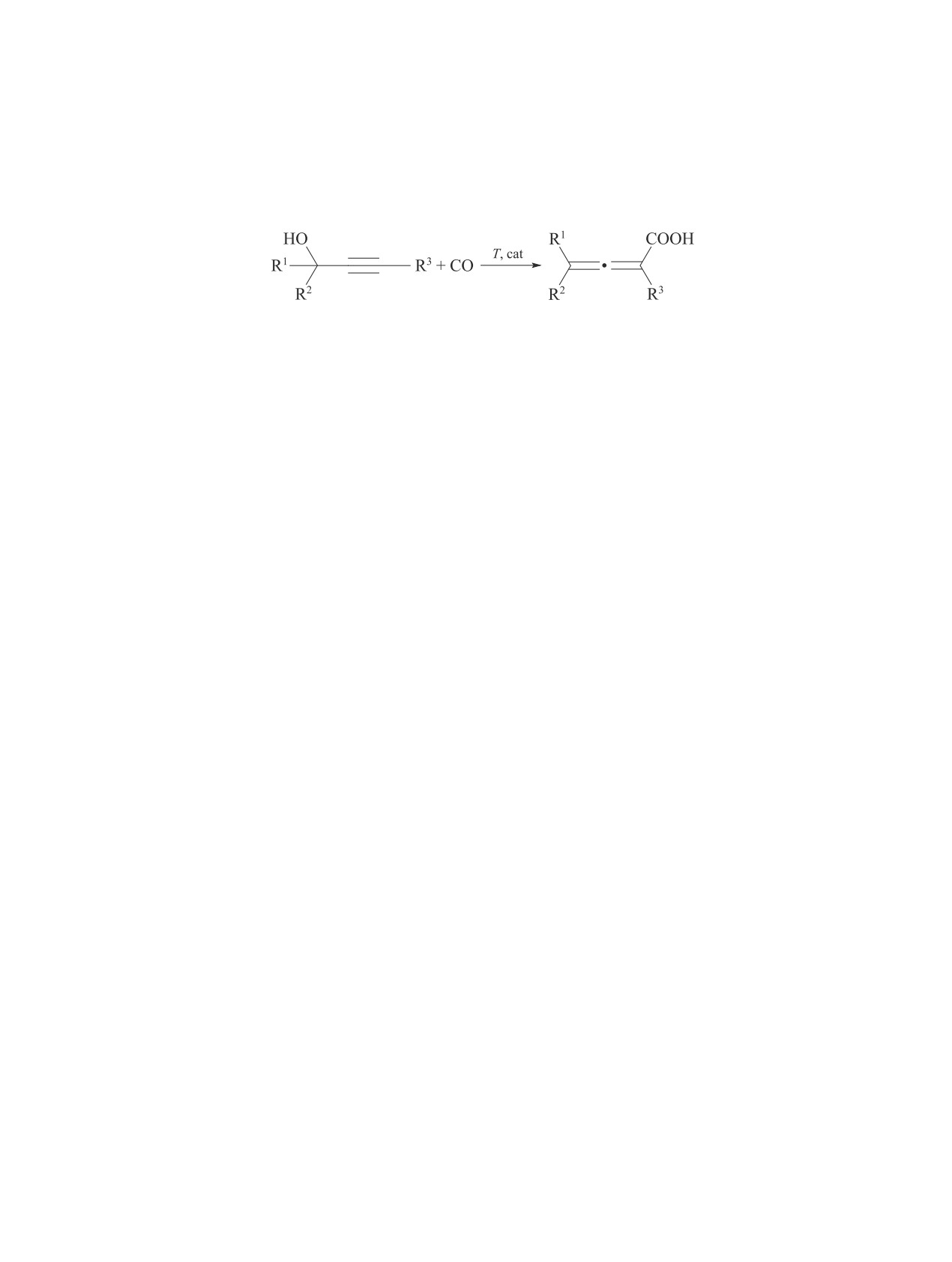
ROH + CO
RCOOH + RCOOR.
(I)
Основными продуктами карбонилирования мета-
нола являются AcOH и AcOMe [2, 5-12].
Цель обзора — систематизация и анализ послед-
них достижений в области разработки катализаторов
CH3OH + CO T, p, cat CH3COOH + CH3COOCH3. (II)
карбонилирования спиртов с использованием СО.
В последнее десятилетие карбонилированию
Процесс карбонилирования метанола занимает
спиртов был посвящен ряд обзорных статей. Так,
первое место в мире по количеству производимой
недавний обзор [2] посвящен каталитическим про-
AcOH среди различных способов получения этого
блемам и стратегиям карбонилирования σ-связей, в
продукта (доля производимой этим способом AcOH
том числе в спиртах. В обзоре 2015 г. [3] основное
превышает 80%) [5, 7, 12-14]. Первоначально кар-
внимание уделялось получению ацетатов и пропа-
бонилирование метанола в промышленности было
ноатов путем карбонилирования метанола и этанола
реализовано с использованием гомогенных кобальто-
соответственно и обсуждалось, как данные о меха-
вых катализаторов. Компанией BASF был разработан
низме реакции могут быть использованы для раз-
способ получения уксусной кислоты и метилацета-
работки новых катализаторов и реакторов. В 2016 г.
та из метанола в присутствии CoI2 или Co(OAc)2,
A. W. Budiman и соавт. опубликовали подробный
промотированных I2 или его соединениями [15, 16].
обзор [4], посвященный методам синтеза уксусной
Процесс осуществляли в жестких условиях — при
кислоты из различного сырья, в том числе путем кар-
температуре 220-260ºС и давлении СО 50-70 МПа.
бонилирования метанола. В частности, в нем приве-
В дальнейшем процесс проводили в присутствии
дена сравнительная характеристика промышленных
родиевых катализаторов [15, 16]. Как отмечают авто-
процессов жидкофазного карбонилирования метанола
ры обзора [5], существующие промышленные гомо-
в уксусную кислоту и гетерогенных катализаторов на
генные процессы с использованием комплексов Rh
основе Ni, Sn, Cu и Rh, использующихся в этом про-
(Monsanto процесс) или Ir (Cativa процесс) высоко-
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
949
эффективны. В то же время процессы с использова-
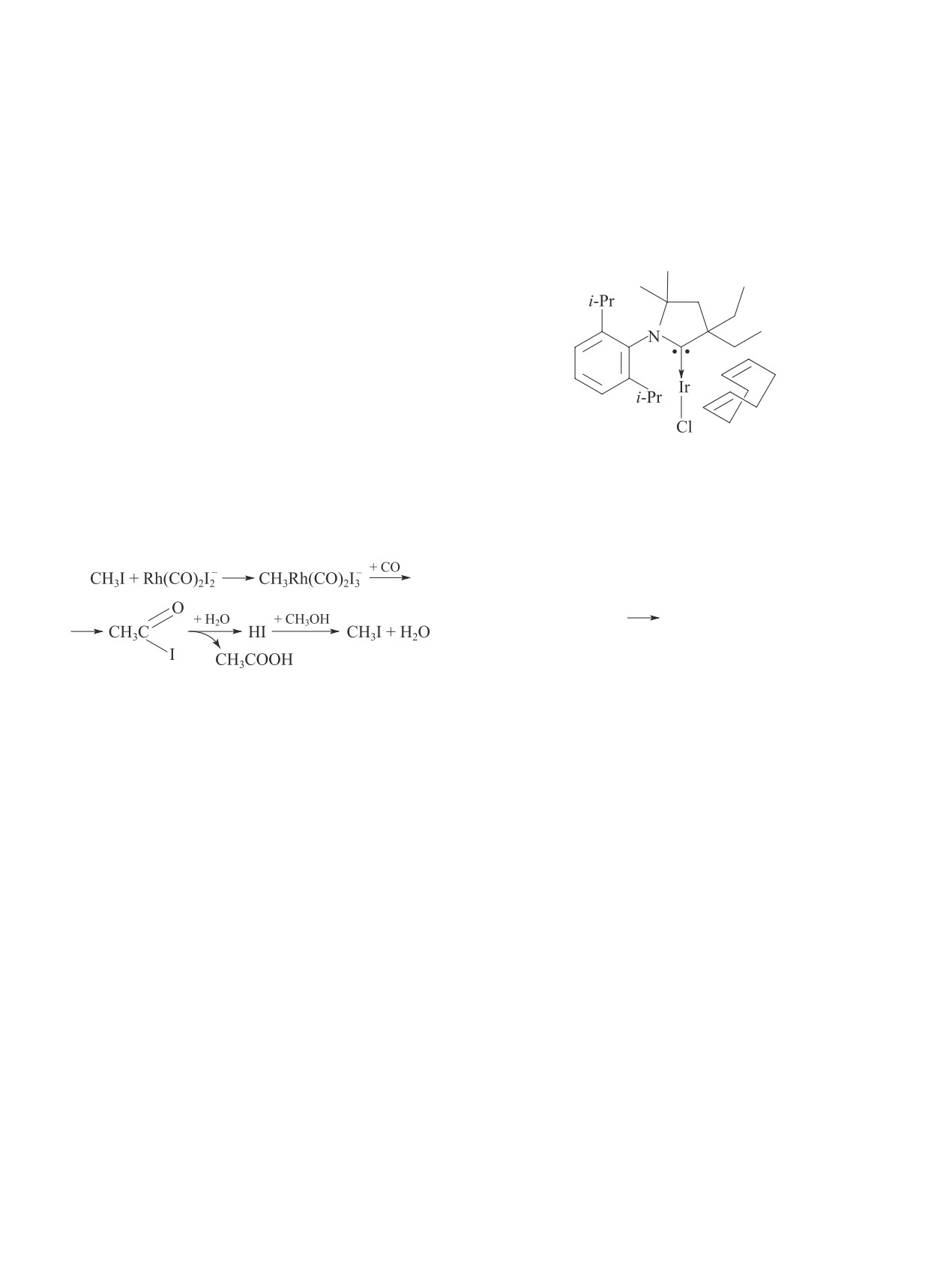
катализаторы на основе карбонилов Ir (Cativa про-
нием гетерогенных катализаторов обладают такими
цесс) [5, 18]. В 2020 г. был разработан цикло(алкил)-
преимуществами, как легкость выделения продуктов
(амино)карбен-иридиевый комплекс (IV) для гомо-
и возможность работы в паровой фазе, что снижает
генно-каталитического карбонилирования метанола
потери катализатора [5].
в AcOMe в присутствии небольшой добавки MeI
Следует отметить, что карбонилирование мета-
[MeOH:MeI≈1000:1 (мол.)] [7].
нола с традиционно используемыми гомогенными
родиевыми катализаторами протекает с применени-
ем добавок HI или MeI. В отсутствие этих добавок
образования продуктов не происходит, поскольку
карбонилированию фактически подвергается MeI, а
(IV)
не метанол [3] [непрямое карбонилирование метано-
ла (III)]. Добавки иодидов нежелательны, посколь-
ку вызывают коррозию стального промышленного
оборудования. В последнее десятилетие в карбони-
лировании спиртов использовались катализаторы,
Карбонилирование осуществлялось при давлении
работающие при добавлении иодидов, а также были
СО 2.0 МПа и температуре 120°С [7], более низкой
предложены катализаторы, способные работать в
по сравнению с предыдущими разработками (150-
отсутствие этих добавок (см., например, статьи [9,
300°С) [5, 10, 12, 13, 18]. Селективность по AcOMe
10, 12]).
достигала 96% при конверсии метанола 81% за 24 ч.
Помимо AcOMe в реакции образовались AcOH и
диметиловый эфир (V) [2].
(III)
2CH3OH
CH3OCH3 + H2O .
(V)
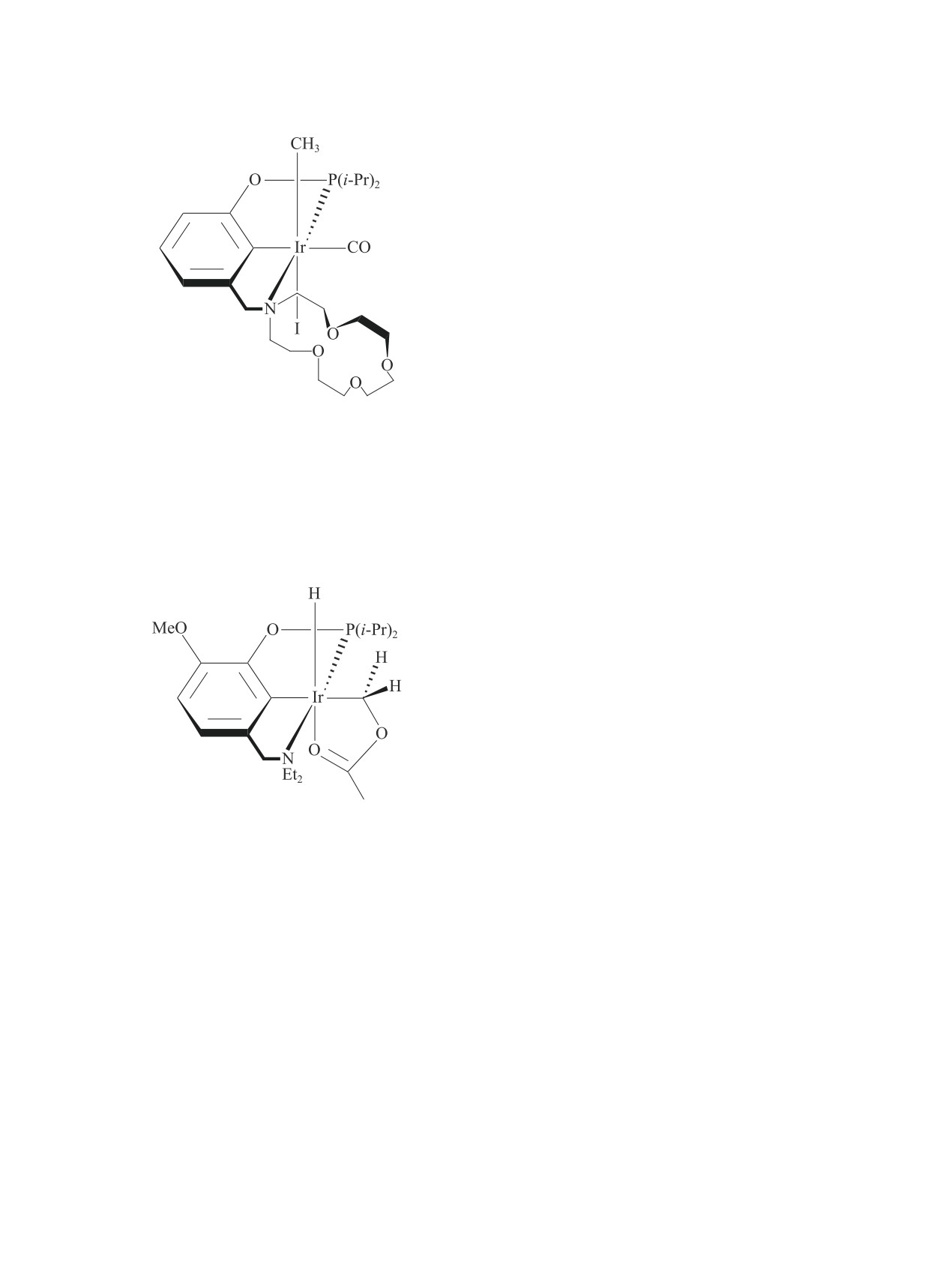
В работах [19, 20] в качестве прекатализаторов для
карбонилирования метанола использовали иридиевые
Гомогенный родий-рутениевый катализатор.
комплексы хелатирующих лигандов [в частности,
В работе [17] был синтезирован катализатор RhCl/
комплекс (VI)], содержащие макроциклы аза-кра-
ун-эфира. Так, в работе [19] исследовались элемен-
RuCl3 с биметаллической структурой для карбони-
тарные стадии карбонилирования метанола в среде
лирования метанола с использованием добавки MeI.
ацетонитрила в присутствии аминофенилфосфи-
На основании данных рентгеновской фотоэлектрон-
нитных комплексов иридия. Было установлено, что
ной спектроскопии (XPS) установлен донорно-ак-
метильные комплексы подвергаются миграционной
цепторный характер связи Rh—Cl, при образова-
вставке при 0.1 МПа CO при 70°C с образованием
нии которой донором электронов является ион Cl-.
Перераспределение электронной плотности способ-
ацетильных форм Ir(III), а добавление солей Li и La
ствовало нуклеофильной реакции катализатора с MeI
увеличивает скорость образования связи C—C до
и снижало энергетический барьер реакции карбони-
25 раз. В работе [20] авторы исследовали различные
лирования метанола. Выход AcOH при температуре
хелатные комплексы в присутствии добавок ряда
солей — потенциальных внешних промоторов — в
190°С и давлении СО 3.5 МПа за 1 ч составил 96.0%.
качестве катализаторов карбонилирования метанола.
По мнению авторов, механизм карбонилирования
В частности, был установлен положительный эффект
метанола при использовании биметаллического ката-
добавок LiCl, NaCl, KCl, HfCl4 и CF3COON(n-Bu)4.
лизатора аналогичен механизму Monsanto процесса.
Реакцию осуществляли с небольшой добавкой MeI
Непосредственно каталитическую функцию выполня-
при давлении CO 2.5 МПа и температуре 150°C в
ет родиевый центр. По сравнению с катализатором на
течение 3 ч. Основным продуктом являлся AcOMe,
основе RhI3 компании «Monsanto» биметаллический
катализатор Rh(I)/Ru(III) обладает более высокой
при этом число оборотов (TONs) по всем ацетилсо-
стабильностью.
держащим продуктам (AcOH + AcOMe) колебалось
Гомогенные иридиевые катализаторы. В сере-
от 265 до 1950 в зависимости от добавленной соли
(наилучший результат был получен при использова-
дине 1990-х г. в промышленном процессе карбони-
нии LiCl, HfCl4 и солей тетрабутиламмония).
лирования метанола нашли применение гомогенные
950
Севостьянова Н. Т., Баташев С. А.
ние 700 ч при температуре 200-240°С. В первые 350 ч
при температуре 200°С суммарный пространствен-
но-временной выход составлял ~3.3 моль·л-1·ч-1.
Затем температура была повышена до 240°С, что
вызвало подъем суммарного пространственно-вре-
менного выхода до ~6.5 моль·л-1·ч-1. Однако этот
(VI)
показатель снижался и через 150 ч достиг значения
~4.6 моль·л-1·ч-1. На протяжении последующих 200 ч
суммарный пространственно-временной выход не
менялся [22].
Разработанные недавно одноатомные (одноцен-
тровые) катализаторы, характеризующиеся высо-
кой активностью и селективностью, открыли новые
возможности в гетерогенном катализе ряда реак-
Как отмечают C. Yoo и A. J. M. Miller [21], ион I-
ций, в том числе карбонилирования спиртов [23, 24].
является эффективным промотором в промышленном
Концепция одноатомных катализаторов была предло-
производстве AcOH карбонилированием метанола.
жена T. Zhang и соавт. [25]. В этих катализаторах от-
Авторы сообщают, что отдельные стадии карбони-
дельные атомы металла изолированы по отношению
лирования метанола до AcOMe могут протекать в
друг к другу за счет образования полярной химиче-
мягких условиях (65-80°С, 0.1 МПа СО) при участии
ской связи с носителем [23-25]. Агрегация атомов
хелатного аминофенилфосфинитного комплекса (VII)
металла при этом затруднена. Оптимальное исполь-
в отсутствие MeI, HI или иодидных солей.
зование активных центров одноатомных катализа-
торов обеспечивается их уникальной электронной и
геометрической структурой [24].
В работе [26] с использованием теории функци-
онала плотности (DFT) в сочетании с ИК-спектро-
скопией с ослабленным полным отражением и
Фурье-преобразованием был изучен механизм кар-
(VII)
бонилирования метанола в AcOH в присутствии MeI
с целью замены традиционного гомогенного ири-
диевого катализатора на Ir-La/C с одним активным
центром, в качестве которого выступал атом Ir. Было
доказано, что ацетил-иридиевый комплекс — ин-
термедиат, участвующий в скоростьопределяющей
Гетерогенные иридиевые катализаторы. Был
стадии карбонилирования. La действует как кислота
разработан ряд катализаторов, нанесенных на ак-
Льюиса, способствуя отрыву I- от Ir-центра, что уско-
тивированный уголь и содержащих Ir в качестве ка-
ряет стадию внедрения CO. Фактически La в составе
талитически эффективного металла и по меньшей
гетерогенного катализатора играет роль промотора
мере один второй металл — Ga, Zn, In или Ge [22].
аналогично гомогенным промоторам.
Разработанные катализаторы обеспечивали более
Авторы работы [27] получили высокоактивные ка-
высокие скорости карбонилирования метанола в
тализаторы Ir-La-S на активированном угле с различ-
присутствии добавки MeI по сравнению с ириди-
ным содержанием S путем пропитки активированного
евым катализатором на активированном угле без
угля раствором Ir и La в H2SO4. В приготовленном
добавок других металлов. В парофазном процессе
катализаторе большая часть частиц Ir существова-
карбонилирования при 190-210°С конверсия метано-
ла в виде отдельных атомных центров. В парофаз-
ла достигла 100%, наилучшее значение суммарного
ном карбонилировании метанола с использованием
(AcOH + AcOMe) пространственно-временного выхо-
добавки MeI и синтез-газа вместо СО суммарная
да составило 25.35 моль·л-1·ч-1. Один из описанных в
(AcOH + AcOMe) частота оборотов катализатора
патенте [22] катализаторов — Ir-Ga на активирован-
(TOF) достигала 2760 ч-1. По мнению авторов, уве-
ном угле, содержащий 0.75 и 0.58% (мас.) Ir и Ga со-
личение скорости скоростьопределяющей стадии
ответственно, — был протестирован на возможность
внедрения CO стало возможным благодаря увеличе-
использования в карбонилировании в потоке в тече-
нию количества кислотных центров на Ir-La-S/акти-
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
951
вированный уголь путем добавления H2SO4 во время
В работе [28] были продолжены исследования ста-
процедуры приготовления катализатора. Кроме того,
бильности гетерогенного одноатомного катализатора,
по мнению авторов, при активации Ir-La-S/активиро-
состоящего из двухъядерного комплекса Ir-La на ак-
ванный уголь может генерироваться больше центров
тивированном угле, в парофазном карбонилировании
Ir+, чем на катализаторе Ir-La/активированный уголь,
метанола при температуре 240°С и общем давлении
что положительно влияет на образование AcI с высво-
2.4 МПа при соотношении СО:Н2 = 1:1 с использова-
бождением Ir3+ и восстановлением его до Ir+. Эта
нием добавки MeI. Было установлено, что благодаря
стадия имеет большое значение для регенерации MeI
структуре биядерного комплекса Ir-La промотор La
и образования продуктов AcOH и AcOMe. При темпе-
может защитить Ir+-форму от восстановления под
ратуре 235°С и давлении синтез-газа 2.5 МПа конвер-
действием H2, что способствует одноатомной дис-
сия метанола достигала 93.44%, выходы составили
персии металла Ir, а также увеличению скорости кар-
28.94% AcOH и 66.54% AcOMe, в качестве побочного
бонилирования метанола. В результате исследования
продукта выделялся метан. Авторами [27] были про-
реакции карбонилирования в реакторе с неподвиж-
ведены испытания стабильности катализаторов Ir-La/
ным слоем в диапазоне температур 180-220°С было
активированный уголь и Ir-La-S/активированный
установлено ускоряющее действие La на реакцию.
уголь во время карбонилирования в потоке. При те-
Карбонилирование протекало с образованием по-
стировании катализатора Ir-La/активированный уголь
бочного продукта метана. Основными причинами
в течение 80 ч суммарная TOF составляла ~1000 ч-1.
дезактивации катализатора являлись выщелачивание
Тестирование катализаторов Ir-La-S/активирован-
металла вследствие образования летучего [Ir(CO)3I] и
ный уголь осуществляли в течение 90-118 ч. Через
осаждение углерода. Было установлено ключевое зна-
20 ч от начала испытаний величина TOF достигла
чение H2 в поддержании стабильности катализатора
максимума 2760 ч-1, а затем в течение последующих
Ir/активированный уголь. В присутствии H2 и катали-
48 ч снизилась до 1660 ч-1 и далее оставалась на этом
затора Ir/активированный уголь получен суммарный
уровне до конца испытаний. Снижение активности
(AcOH + AcOMe) пространственно-временной выход
катализатора Ir-La-S/активированный уголь авторы
2000 моль·мольIr-1·ч-1 при температуре 240°C и дав-
[27] связывают с уменьшением количества S на его
лениях СО 0.78 МПа и Н2 0.78 МПа в течение 100 ч
поверхности. Так, за 92 ч испытаний содержание S
испытания без деактивации.
снизилось с 1.67 до 1.31% (мас.), в течение последу-
Был разработан нанесенный катализатор Ir/
ющих 26 ч содержание S снизилось до 1.28% (мас.).
Ru/PhPy/Zn на основе цеолита [цеолит от Zeolyst
Однако на протяжении всего времени тестирования
International с характеристиками: 0.42-0.84 мм, Si/
катализаторы Ir-La-S/активированный уголь были
Al = 80 (мол.)] для парофазного карбонилирования
более активны по сравнению с Ir-La/активированный
метанола в неподвижном слое с использованием до-
уголь.
бавки MeI [29]. Конверсия метанола достигала наи-
В работе [8] сообщается о гетерогенном одноатом-
большего значения 83.54% через 6 ч использования
ном катализаторе Ir-La/активированный уголь для
катализатора с суммарным (AcOH + AcOMe) про-
получения AcOMe в реакторе с неподвижным слоем.
странственно-временным выходом 7.7 моль·л-1·ч-1
Высокая TOF = 2200 ч-1 и селективность более 90%
при 190°С и давлении СО 1.4 МПа. При дальнейшем
по AcOMe с суммарным пространственно-времен-
использовании катализатора конверсия метанола сни-
ным выходом 8200 г·кгкат-1·ч-1 были достигнуты
жалась и через 238.83 ч (предельное время испытания
на катализаторе Ir-La/активированный уголь в при-
катализатора) составила 28.17%. При этом суммар-
сутствии MeI при 240°С. Был предложен механизм
ный пространственно-временной выход был равен
гетерогенного карбонилирования метанола на La-
1.07 моль·л-1·ч-1.
стабилизированном одноатомном катализаторе Ir/
Гетерогенные родиевые катализаторы. Были раз-
активированный уголь. Тестирование разработанного
работаны нанесенные катализаторы для парофазного
катализатора Ir-La/активированный уголь в потоке
карбонилирования метанола в AcOH и AcOMe в не-
проводили в течение 100 ч, результаты тестирова-
подвижном слое с добавкой MeI: Rh-Py/Li на основе
ния показали стабильный пространственно-времен-
цеолита [цеолит от Stream Сhemicals с характеристи-
ной выход 60 моль·кгкат-1·ч-1 суммарно по AcOH и
ками: 0.42-0.84 мм, Si/Al = 5.6 (мол.)], Rh-PhPy/Li
AcOMe. По мнению авторов, проведенная ими работа
на основе указанного цеолита, Rh-PhPy на основе
может стать основой для создания стабильного нане-
указанного цеолита, Rh-PhPy/Li/C, Rh-PhPy/Li на
сенного катализатора в качестве замены гомогенному
основе SiO2 (ES70W от INEOS Silicas), Rh-PhPy/Li
катализатору.
на основе SiO2 (ES70W от INEOS Silicas, модифи-
952
Севостьянова Н. Т., Баташев С. А.
цированный Rh), Rh-PhPy/Li/MCM-41 (MCM-41 —
CO, 120°C). Однако активность катализатора со вре-
мезопористый SiO2) и Rh-BiPy/Li на основе ука-
менем снижалась из-за перехода Rh с поверхности
занного выше цеолита [29]. Катализатор Rh-PhPy/
носителя в раствор. Через 24 ч количество Rh на
Li на основе указанного выше цеолита был также
поверхности носителя уменьшилось на 95%.
использован в жидкофазном карбонилировании ме-
Авторы работы [32] для проведения прямого кар-
танола. В ряде опытов (парофазное карбонилирова-
бонилирования метанола в AcOMe и AcOH исполь-
ние при температуре 190°С и давлении СО 1.4 МПа)
зовали высокоактивный и стабильный катализатор
конверсия метанола превышала 99%, суммарный
Rh-bpim-CTF, в котором Rh был распределен в виде
пространственно-временной выход (AcOH + AcOMe)
отдельной фазы на заряженном ковалентном три-
превышал 12 моль·л-1·ч-1. Среди перечисленных
азиновом каркасе, содержащем в своей структуре
родиевых катализаторов, по нашему мнению, наи-
bpim. Карбонилирование метанола в присутствии MeI
более перспективен для практического применения
[в соотношении 10:1 (мол.)] проводили в проточном
Rh-PhPy/Li/MCM-41, сохраняющий активность на
реакторе в газовой фазе. Температуру варьировали
протяжении более 293 ч. Наибольшая конверсия ме-
в диапазоне 150-270°С, общее давление — в пре-
танола на этом катализаторе составила 99.11-99.17%
делах 0.75-1.50 МПа (СО в смеси с N2 в соотно-
через 170-173 ч его использования. Спустя 293.50 ч
шении 9:1). Наилучший результат (TOF = 3693 ч-1,
от начала испытаний конверсия метанола снизилась
суммарная производительность AcOH + AcOMe
до 98.78% [29].
218.9 моль·кг-1·ч-1 и конверсия метанола 83.2%) был
В работе [30] был получен и апробирован в па-
получен при 240°С и общем давлении 1.50 МПа при
рофазном карбонилировании метанола катализатор
высокой стабильности (в течение 40 ч) катализато-
Rh-POL-2BPY (POL-2BPY — пористый органи-
ра. Полученный результат авторы [32] объясняют
ческий гомополимерный лиганд, синтезированный
сильным взаимодействием между положительно за-
из 6,6ʹ-дивинил-2,2ʹ-бипиридина) с иерархической
ряженными участками имидазолия в подложке bpim-
пористой структурой, высокой площадью поверх-
CTF и активной формой [RhI2CO2]-, что придает
ности и высокой термостойкостью. Rh-POL-2BPY
дополнительную стабильность катализатору. Было
показал высокую активность в карбонилировании
установлено, что в условиях каталитической реакции
(TOF = 1400 ч-1 на протяжении 400 ч) при 195°C и
карбонилирования метанола общая масса катализа-
давлении 2.5 МПа в присутствии добавки MeI. По
тора Rh-bpim-CTF не изменяется и не происходит
мнению авторов, высокая стабильность Rh-POL-
образования наночастиц Rh.
2BPY обусловлена прочной координационной связью
В работах [33, 34] исследовали возможность
Rh—N и высоким содержанием N в полимере.
применения катализаторов, представляющих собой
В работе [31] сообщается о катализаторе карбо-
графитоподобный нитрид углерода g-C3N4 с метал-
нилирования метанола цис-[Rh(CO)2I2]-, который
лическими включениями. Так, при использовании
был распределен в виде отдельной фазы в диспер-
Rh-g-C3N4 в жидкофазном карбонилировании мета-
гируемом микропористом полимерном носите-
нола в присутствии MeI и воды был получен выход
ле, имеющем катионные функциональные группы
AcOH более 82% за 7 ч при температуре 140°С и
N-метилпиридиния. Микропористый полимер имел
давлении СО 4.0 МПа [33]. Авторы [33] отмечают,
структуру ядро-оболочка, в которой пористое нерас-
что первоначально образовавшийся AcOMe мог легко
творимое ядро (сшитый сополимер дивинилбензола и
гидролизоваться с образованием AcOH, побочные
4-винилпиридина) было стерически стабилизировано
продукты отсутствовали. Снижение количества Rh в
длинными гидрофильными поли(этиленгликолевыми)
катализаторе за указанное время карбонилирования
цепями, что обеспечивало образование стабильной
не превышало 1.1% от первоначального. После од-
дисперсии наночастиц. Включение 4-винилпиридина
ного цикла карбонилирования (в течение 7 ч) смесь
в качестве сомономера позволило провести пост-
продуктов и катализатора разделяли простой филь-
синтетические модификации для создания центров
трацией, отделенный катализатор подвергали по-
N-метилпиридиния, способных к электростати-
вторным испытаниям в катализе карбонилирования
ческому присоединению комплекса [Rh(CO)2I2]-.
метанола при тех же условиях реакции. Значительной
Нанесенный катализатор был активен в карбонилиро-
потери каталитической активности и существенного
вании MeOH в присутствии MeI. Начальная скорость
изменения в соотношении продуктов карбонилиро-
образования AcOMe вдвое превышала начальную
вания при использовании переработанного катали-
скорость карбонилирования с гомогенным катализа-
затора авторы статьи [33] не наблюдали. В работе
тором Bu4N[Rh(CO)2I2] в тех же условиях (1.0 МПа
[34] использовали высокоупорядоченный катализатор
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
953
AlRh-CN — мезопористый графитоподобный C3N4
свободном от галогенидов процессе при стехиоме-
с включениями Al и Rh. AlRh-CN с 2.0% (мас.) Al
трическом соотношении метанола и СО (парциаль-
в присутствии MeI и воды показал выходы более
ное давление каждого из них по 3.3 кПа). Реакцию
65% AcOH и около 30% AcOMe менее чем за 3 ч
исследовали в диапазоне температур 200-300°С.
при температуре 190°С и давлении CO 4.0 МПа при
Испытания последнего катализатора в потоке в те-
небольшом снижении количества Rh в катализаторе.
чение 50 ч при 300°С при указанных парциальных
Возможность повторного использования катализатора
давлениях метанола и СО показали постоянство ско-
AlRh-CN проверяли в трех последовательных опы-
рости образования AcOH.
тах, включающих карбонилирование в течение 3 ч,
В работе [35] сообщается о стратегии стабилиза-
фильтрацию и сушку катализатора. Конверсия мета-
ции изолированных катионов Rh цеолитом MFI для
нола в рециклах незначительно снижалась с 95.3 до
создания высокоактивных катализаторов Rh@MFI
94.6%, при этом сохранялся стабильный выход AcOH
для карбонилирования метанола с использованием
выше 64%. Снижение количества Rh в катализаторе
добавок MeI. Было доказано, что во время карбони-
за один цикл не превышало 0.0012% от его начально-
лирования метанола образуется стабилизированный
го содержания в катализаторе, снижение количества
цеолитом аналог [Rh(CO)2I2]-. По мнению авторов,
Al составило 0.0064% за один цикл [34].
структура цеолита может значительно способствовать
В работе [11] был представлен способ получения
карбонилированию метанола в каналах. В резуль-
и применения катализатора Rh-POL-PPh3 в карбони-
тате при использовании катализатора Rh@ZSM-5
лировании метанола с использованием добавки MeI в
(ZSM-5 — цеолит) при температуре 150°С и давле-
непрерывном режиме в реакторе с неподвижным сло-
нии СО 2.5 МПа суммарная (AcOH + AcOMe) TOF
ем. Rh-POL-PPh3 является одноатомным катализато-
достигла 3950 моль·мольRh-1·ч-1. Авторами была
ром. По мнению авторов, в связи этим, а также бла-
показана возможность повторного использования (в
годаря электронодонорному эффекту лигандов PPh3
четырех последовательных опытах по карбонилиро-
и сильным мультикоординационным связям между
ванию метанола) указанного катализатора, который
Rh и P в катализаторе Rh-POL-PPh3 была получена
отделяли от реакционной массы простой фильтраци-
TOF = 1550 ч-1, что несколько выше по сравнению
ей с последующим промыванием метанолом. В жид-
с традиционным катализатором оптимизированного
кой фазе после отделения катализатора частицы Rh
Monsanto процесса. Новый катализатор поддерживал
не обнаруживались. На протяжении четырех циклов
относительно стабильную активность в течение поч-
средняя скорость суммарного образования AcOH и
ти 180 ч при давлении 2.5 МПа и температуре 195°C.
AcOMe оставалась стабильной.
Таким образом, POL-PPh3 не только действует как
В недавней работе [36] сообщается о полученном
стабильный носитель, но и способствует процессу
одноатомном катализаторе Rh/активированный уголь,
карбонилирования метанола.
который характеризуется в 3 раза большей активно-
В работе [10] сообщается о гетерогенном, сво-
стью в карбонилировании метанола, чем гомоген-
бодном от галогенидов газофазном (в атмосфере Ar)
ный катализатор [Rh(CO)2I2]-. Карбонилирование
процессе карбонилирования метанола до AcOH с
осуществляли в отсутствие добавок иодидов
использованием катализатора, состоящего из атомар-
при добавлении в систему Н2 (CO:Н2 ≈ 10:1).
ных активных центров Rh на кислотных носителях
Суммарный пространственно-временной выход до-
ZrO2 (размер частиц 20 нм) и γ-Al2O3 (размер частиц
стиг 3250 моль·мольRh-1·ч-1 при температуре 240°С
5 нм). Было показано, что вследствие наличия таких
и сохранял это значение практически постоянным на
активных центров происходит высокоселективное
протяжении 100 ч непрерывной работы. Потери родия
образование AcOH, в то время использование кла-
были незначительны. Селективность суммарного об-
стеров Rh приводит к разложению метанола до CO
разования ацетильных соединений (AcOH + AcOMe)
и CO2. Сравнительное карбонилирование на атомар-
превышала 95%.
но дисперсных формах Rh на γ-Al2O3, ZrO2 и Na-
Гетерогенный платиновый катализатор. Был
модифицированном ZrO2 показало, что при умень-
разработан нанесенный катализатор Pt-PhPy/Li на
шении количества кислотных центров образование
основе цеолита [цеолит от Zeolyst International с ха-
побочного продукта — диметилового эфира — сво-
рактеристиками: 0.42-0.84 мм, Si/Al = 80 (мол.)] для
дится к минимуму. При использовании катализатора,
карбонилирования метанола в неподвижном слое
в состав которого входил атомарно диспергирован-
с использованием добавки MeI [29]. Конверсия ме-
ный Rh на носителе ZrO2 с 5% (мас.) осажденного Na,
танола достигала 74.64% (максимальное значение,
селективность по AcOH достигла 54% в стабильном,
полученное через 2 ч карбонилирования), суммар-
954
Севостьянова Н. Т., Баташев С. А.
ный пространственно-временной выход составил
Наиболее высокая конверсия метанола составила
0.1 моль·л-1·ч-1 при 190°С и давлении СО 1.4 МПа.
4.2% за 12 ч в потоке при суммарном пространствен-
Однако активность катализатора при дальнейшем его
но-временном выходе 1.37 моль·кгкат-1·ч-1, суммар-
использовании снижалась. Через 172.5 ч работы ката-
ная селективность по AcOMe и AcOH составила
лизатора конверсия метанола составила 17.14% [29].
22.1% при температуре 290°C и давлении 3 МПа.
Гетерогенные медные катализаторы. Было осу-
Авторы фиксировали образование ряда побочных
ществлено гетерогенное карбонилирование метанола
продуктов: диметилового эфира, углеводородов
до AcOMe и AcOH с использованием катализатора
(CH4, C2H4, C2H6, C3H6 и C3H8) и метилформиата.
CuCeOx/H-MOR (H-MOR — цеолит) с достижением
Образование углеводородов, в частности метана,
96.5%-ной конверсии метанола и селективностью по
могло происходить в результате реакции воды и СО
AcOMe 87.4% при температуре 200°С и давлении
(«водяной газ») (VIII). По мнению авторов, одно-
СО 1.0 МПа в отсутствие добавок галогенидов [37].
временное присутствие в катализаторе Ni0 и MoOx
Было доказано, что частицы Cu и Ce сильно рассре-
(особенно MoO2) заметно уменьшало образование
доточены на H-MOR, даже когда содержание CuCeOx
диметилового эфира и способствовало увеличению
достигало 29% (мас.). По мнению авторов, введение
выхода AcOMe и AcOH.
Ce способствовало ингибированию отложений кокса
и, таким образом, повышало стабильность катализа-
3H2O + 5CO
CH4 + 4CO2 + H2. (VIII)
тора. На протяжении 35 ч испытаний катализатора
в карбонилировании метанола в потоке конверсия
На основании проведенных исследований авторы
метанола была очень стабильной. Небольшое сниже-
[39] предполагают, что во время карбонилирования
ние селективности по AcOMe (до ~82%) наблюдали
могло происходить осаждение кокса на катализато-
спустя 25 ч с момента начала процесса.
ре в форме аморфного углерода. Отложение частиц
Авторы работы [38] описали катализаторы па-
кокса препятствовало контакту между реагентами и
рофазного безгалогенидного карбонилирования ме-
активным центром, что снижало конверсию метанола
танола на основе смешанных оксидов меди, титана
и селективность карбонилирования.
и кремнезема (Cu/TiO2-SiO2), которые получали с
В работе [40] представлены результаты исследова-
использованием ацетата, нитрата и хлорида меди(II).
ния синтеза AcOMe карбонилированием метанола в
Было доказано, что взаимодействие между медью и
паровой фазе на катализаторах, содержащих NiCl2-
носителем было самым сильным на катализаторе,
CuCl2 на активированном угле и кордиеритовых но-
приготовленном с использованием CuCl2, в резуль-
сителях со структурой медовых сот. В процессе не
тате чего была получена наибольшая степень дис-
использовали добавки галогенидов. Метанол одно-
персности Cu и образовалось наибольшее количество
временно выступал как субстрат карбонилирования
поверхностных форм Cu+. Этот катализатор отли-
и источник СО. Выход AcOMe 18% был получен за
чался наибольшей абсорбционной способностью к
2 ч при температуре 355°С на катализаторах, содер-
CO, максимальным количеством кислотных центров
жащих NiCl2-CuCl2 на углеродной подложке марки
Льюиса и наиболее высоким пространственно-вре-
BAC-A, обладающей следующими характеристиками:
менным выходом AcOMe 1.619 моль·кгкат-1·ч-1 через
мезопоры со средним диаметром ~7 нм и кислотность
24 ч карбонилирования в потоке. Конверсия метанола
поверхности катализатора 0.705 ммоль NH3/г. В то же
положительно коррелировала с количеством поверх-
время 15%-ный выход AcOMe на катализаторе NiCl2-
ностных кислотных центров. Общее давление СО и
CuCl2/кордиерит был соизмерим с выходом, получен-
метанола составляло 1.0 МПа, температуру поддер-
ным при использовании катализатора NiCl2-CuCl2/
живали на уровне 230°С.
активированный уголь. По мнению авторов, эффек-
Гетерогенные никелевые катализаторы. Путем
тивность катализатора в этом случае обусловлена
восстановления водородом каталитических пред-
такими преимуществами структурированных систем,
шественников NiO-MoO3/SiO2, синтезированных
как более эффективный массообмен и отвод тепла, по
методом пропитки и последующей обработки про-
сравнению с высокопористыми гранулированными
каливанием, был получен бифункциональный ката-
системами. В качестве побочных продуктов были об-
лизатор Ni-MoOx для парофазного карбонилирова-
наружены метан и диметиловый эфир. Использование
ния метанола в отсутствие галогенидов в реакторе
катализаторов CuO-ZnO-NiO/Al2O3/кордиерит (для
с неподвижным слоем [39]. Было установлено, что
получения CO в качестве карбонилирующего агента
производительность катализатора значительно зави-
путем разложения метанола) и NiCl2-CuCl2/активи-
сит от температуры прокаливания-восстановления.
рованный уголь (или на кордиерите), размещенных
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
955
в последовательно соединенных реакторах проточ-
боте [12]. Конверсия метанола и селективность по
ного типа или в одном реакторе с двумя различными
AcOH достигали 100% и 95% соответственно при
температурными зонами, обеспечивало получение
температуре 270°С и общем давлении 5.0 МПа.
AcOMe в газообразном сырье, не содержащем СО, с
Селективность по AcOMe составила около 2.7%.
выходом AcOMe 13-16.5% в процессе «самокарбо-
Общая селективность по остальным побочным про-
нилирования». Катализатор NiCl2-CuCl2/кордиерит
дуктам (метилформиат, ацетон, углеводороды) была
прошел испытания в карбонилировании метанола в
менее 2%. Во время 145-часового процесса наблюда-
потоке в течение 4 ч. При температуре 310°С после
ли лишь незначительную дезактивацию катализатора.
первого часа работы катализатора конверсия метано-
Промышленное применение процесса карбони-
ла и выход AcOMe достигли значений 40 и 10% соот-
лирования спиртов помимо синтетической стадии
ветственно и в течение следующих 3 ч практически
требует разработки процесса выделения и очистки
не изменялись.
целевых продуктов. Следует отметить, что метанол
Ранее той же группой авторов [41] был установлен
образует азеотропную смесь с AcOMe. В работе [42]
положительный эффект модификации катализатора
было описано успешное применение нескольких эф-
NiCl2-CuCl2 с помощью CeO2 в парофазном карбо-
фективных комбинаций полностью термически свя-
нилировании метанола, приводящий к увеличению
занных колонн для дистилляции реакционной смеси
выхода AcOMe.
карбонилирования метанола с получением чистой
Гетерогенный рениевый катализатор. Был разра-
AcOH. В работе [43] использовали экстрактивную
ботан гетерогенный катализатор ReO4/SiO2 с атомар-
дистилляцию с помощью ДМСО при атмосферном
но дисперсными активными центрами Re для синтеза
давлении. Было показано, что явление азеотропии
AcOH газофазным карбонилированием метанола,
между метанолом и AcOMe отсутствует, когда моль-
свободным от галогенидов [9]. Исследования реак-
ное соотношение ДМСО и бинарной системы состав-
ционной способности при атмосферном давлении
ляет 1.5:1 (мол.).
(при разбавлении гелием) в диапазоне температур
Таким образом, в последнее десятилетие актив-
220-280°С показали, что объемные кластеры Re2O7
но исследовали карбонилирование метанола как в
и ReOx на SiO2 [образующиеся при содержании Re
жидкой, так и в газовой фазах. Было показано, что
более 10% (мас.)] селективны к образованию диме-
побочными продуктами в основном являются ди-
тилового эфира, в то время как атомарно дисперги-
метиловый эфир и углеводороды. Следует отметить
рованные кластеры ReO4 на SiO2 [образующиеся
важную тенденцию последнего десятилетия — пе-
при содержании Re менее 10% (мас.)] проявляют
реход с гомогенных на гетерогенные катализаторы,
стабильную в течение 60 ч селективность по AcOH
не содержащие платиновых металлов, что открывает
более 93% при конверсии метанола за один цикл
возможности более простого выделения продуктов,
более 60%. Было доказано, что механизм образова-
работы в паровой фазе, снижения потерь катализато-
ния AcOH включает активацию метанола на ReO4
ра и повышения экономических показателей процесса
с последующим внедрением СО. Введение ~0.2%
карбонилирования метанола. В ряде случаев удалось
(мас.) атомарно диспергированного Rh к 10% (мас.)
полностью отказаться от использования коррози-
атомарно диспергированного ReO4 на SiO2 приводило
онноактивных добавок галогенидов. Дальнейшего
к селективности более 96% по AcOH при скоростях
исследования требуют вопросы о сохранении ста-
реакции, сравнимых с гомогенными процессами.
бильности и активности катализаторов на протяже-
Несомненным преимуществом осуществления про-
нии длительного времени (при осуществлении кар-
цесса карбонилирования в газовой фазе с использо-
бонилирования в непрерывном проточном режиме в
ванием твердого катализатора является возможность
газовой фазе) или при многократном рецикле катали-
его легкого отделения от продуктов. В подобных
заторов жидкофазного карбонилирования. По нашему
случаях не возникает необходимости организации
мнению, наиболее полные данные по этим вопросам
рецикла катализатора, как при реализации гомоген-
представлены в работах [11, 29, 30], посвященных
но-каталитических процессов.
нанесенным родиевым катализаторам, и патенте [22],
Цеолитный катализатор, свободный от галогенов
содержащем данные о нанесенных иридиевых ката-
и благородных металлов. О парофазном карбонили-
лизаторах. Результаты этих работ свидетельствуют
ровании метанола в отсутствие галогенов и благо-
о высокой активности гетерогенных катализаторов,
родных металлов при использовании стабильного и
позволяющих получать высокие конверсии при кар-
селективного катализатора — цеолита Н-морденит,
бонилировании метанола в AcOH и AcOMe в газовой
модифицированного пиридином, сообщено в ра-
фазе в потоке уже при 190-195°С на протяжении дли-
956
Севостьянова Н. Т., Баташев С. А.
тельного времени (180-350 ч). Недостатком работ [11,
Na13X повышало селективность по этилпропаноату
22, 29, 30] является использование добавок иодидов,
до 60%. Влияние добавок солей ослабевало в ряду
вызывающих коррозию стального оборудования.
Na2CO3 ≥ K2CO3 > > CsHCO3. Катализатор Rh/Na13X
прошел испытания в карбонилировании этанола в
потоке в течение 40 ч. Конверсия EtOH оставалась
Синтез пропановой кислоты
постоянной — около 35%, что, по мнению авторов
и этилпропаноата карбонилированием этанола
[45], свидетельствует об отсутствии значительной
В то время как карбонилированию метанола в
дезактивации. Селективность по этилпропаноату на
последние десятилетия было посвящено множе-
протяжении 40 ч также оставалась относительно по-
ство работ, исследований процессов карбонилиро-
стоянной — около 42%.
вания других спиртов было существенно меньше,
В недавней работе [47] был получен одноатомный
хотя, например, карбонилирование этанола можно
катализатор Rh-TPISP [TPISP — самополимер трис-
использовать для получения пропаноатов (IX) [44].
(4-винилфенил)фосфонийиодида] путем включения
Как и в карбонилировании метанола, катализаторы,
ионов Rh+ в пористую матрицу. Катализатор был
использующиеся в этом процессе, — родиевые и
применен в парофазном карбонилировании этанола
иридиевые.
в присутствии добавки EtI. По мнению авторов [47],
активным центром катализатора Rh-TPISP является
CH3CH2OH + CO T, p, cat
звено [Rh(CO)I3]2-. Rh-TPISP продемонстрировал
(IX)
значительно более высокую активность по сравнению
CH3CH2COOH + CH3CH2COOC2H5.
с описанными ранее каталитическими системами,
в которых активным центром являлся [Rh(CO)2I2]-.
Так, в работах [45, 46] исследовали парофазное
В реакции карбонилирования этанола с использова-
карбонилирование этанола в пропаноаты. В работе
нием Rh-TPISP при температуре 195°C и давлении
[46] в качестве катализатора использовали Rh, на-
3.5 МПа была достигнута TOF = 350 ч-1 с суммарной
несенный на пористую Cs-замещенную гетерополи-
селективностью по пропановой кислоте и этилпро-
кислоту Cs3PW12O40. Были обнаружены побочные
паноату более 95% (побочный продукт — этилен).
продукты — этилен и диэтиловый эфир (X), (XI).
Катализатор сохранял активность на протяжении
около 1000 ч. По мнению авторов, более высокая
CH3CH2OH T, cat CH2 CH2 + H2O, (X)
активность и селективность катализатора Rh-TPISP
обусловлены большей электронной плотностью на
2CH3CH2OH T, cat CH3CH2OCH2CH3 + H2O. (XI)
его активных центрах [Rh(CO)I3]2- по сравнению с
каталитическими системами, в которых активным
Селективность по этилпропаноату достигла 96.6%
центром являлся [Rh(CO)2I2]-. Показано, что форми-
при 170°C в присутствии добавок EtI [EtOH:EtI = 10:1
рование двух ионных связей между [Rh(СО)I3]2- и
(мол.)]. Катализатор проявлял стабильную селектив-
P(V) катионного каркаса полимера играет ключевую
ность в течение 30 ч в потоке и конверсию до 77%.
роль в устойчивой иммобилизации Rh.
Небольшая дезактивация катализатора происходила,
Авторы работы [44] в карбонилировании этанола
по мнению авторов, в связи с образованием наноча-
использовали гомогенную каталитическую систе-
стиц Rh [46]. По-видимому, в указанных условиях
му, состоящую из RhI3 и промоторов — HI, EtI и
парофазного карбонилировании этанола наночастицы
LiI. Был установлен оптимальный состав каталити-
Rh не проявляют каталитическую активность.
ческой системы: 10% (мас.) EtI, 0.14% (мас.) RhI3
Для карбонилирования этанола в паровой фа-
и 10% (мас.) LiI при температуре реакции 180°C и
зе использовали нанесенный катализатор Rh/
давлении 3.0 МПа. Эти условия обеспечивали почти
Na13X с добавлением EtI (Na13X — цеолит
100%-ную конверсию этанола, 96%-ную селектив-
Na86[(AlO2)86(SiO2)106](H2O)x) [45]. При темпера-
ность по пропановой кислоте и пространственно-вре-
туре 200°C катализатор проявлял селективность по
менной выход 2.20 моль·л-1·ч-1. Был предложен меха-
этилпропаноату около 37-52% (суммарный выход
низм карбонилирования этанола при использовании
пропановой кислоты и этилпропаноата 42-62%) при
каталитической системы RhI3-LiI, в котором ско-
конверсии этанола 30-66%, побочными продукта-
ростьопределяющей стадией являлась реакция окис-
ми являлись этилен и диэтиловый эфир. Осаждение
лительного присоединения EtI к каталитическому
дополнительных количеств щелочных агентов
родиевому центру. Была получена макроскопическая
(Na2CO3, K2CO3 и CsHCO3) на катализатор Rh/
кинетическая модель реакции карбонилирования эта-
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
957
нола в диапазоне температур 170-190°C. В соответ-
путем азеотропной дистилляции с двухфазным оро-
ствии с полученной моделью реакция имеет первый
шением.
порядок по родиевому катализатору и дробные по-
В работе [51] были опубликованы данные о том,
рядки по EtI и иону I-.
что п-ксилол является необходимой экстрактивной
В работе [48] было осуществлено карбонилиро-
добавкой, которая может быть использована для раз-
вание этанола с использованием гомогенной катали-
деления методом дистилляции бинарной азеотропной
тической системы, включающей RhI3, дифосфино-
смеси EtOH/EtCOOEt при атмосферном давлении.
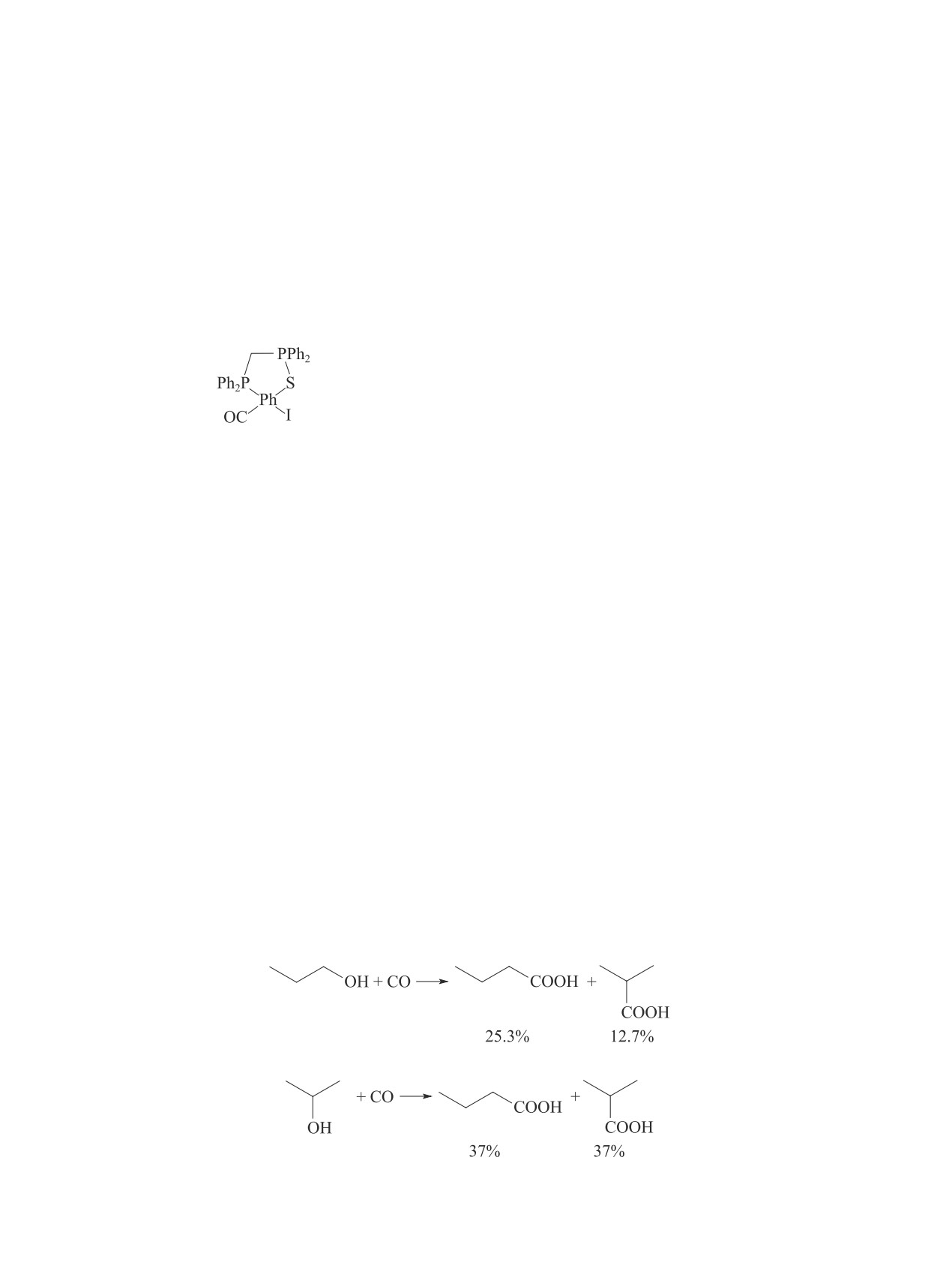
вые промоторы, EtI и LiI. Катализатор был наиболее
Показано, что явление азеотропии между этими ком-
активен и стабилен в присутствии лиганда dppmS
понентами отсутствует, когда мольное соотношение
[комплекс (XII)].
п-ксилола и бинарной системы EtOH/EtCOOEt со-
ставляет 1:1 (мол.).
В работе [52] в результате исследования равнове-
(XII)
сия жидкость-пар для системы синтеза EtCOOEt и
EtCOOH карбонилированием этанола были получены
данные для изобарного парожидкостного равновесия
для бинарных систем EtI/EtOH, EtI/EtCOOH и EtI/
При найденных оптимальных условиях реакции
EtCOOEt при атмосферном давлении. В частности,
(190°C, давление СО 3.0 МПа) суммарный простран-
было установлено, что система EtI/EtOH имеет ми-
ственно-временной выход для продуктов карбони-
нимальную азеотропную точку кипения 336.08 K, в
лирования (пропановой кислоты и этилпропаноата)
которой состав включает 63.445% (мол.) EtI. В то же
достигает 6.21 моль·л-1·ч-1. Были предложены ме-
время в системах EtI/EtCOOH и EtI/EtCOOEt явление
ханизм карбонилирования этанола в присутствии
азеотропии отсутствует. По мнению авторов [52],
добавок dppmS и кинетическая модель реакции [48].
полученные экспериментальные и расчетные данные
В работе [49] осуществлено гомогенно-катали-
могут быть использованы при организации процесса
тическое карбонилирование этанола в присутствии
выделения и очистки пропановой кислоты, получен-
системы NiI2-P(Bu)3-LiI. При температуре 120°C и
ной карбонилированием этанола. EtI и EtOH могут
давлении CO 3.0 МПа выход пропановой кислоты
быть выделены в виде азеотропной смеси и возвра-
достигал 64% за 20 ч.
щены в процесс карбонилирования без разделения.
Как отмечено в работе [50], при получении про-
пановой кислоты и этилпропаноата промышленным
Синтез других алифатических
способом — карбонилированием EtOH в присутствии
и алициклических карбоновых кислот
добавок EtI — одной из наиболее важных проблем
является выделение продуктов в связи с наличием
В статье [49] представлено обширное иссле-
бинарных азеотропов EtCOOH/H2O, EtCOOEt/H2O
дование карбонилирования различных спиртов.
и EtI/H2O. С целью получения термодинамических
Карбонилированию подвергали алифатические
данных, необходимых для проектирования процесса
и алициклические спирты в присутствии системы
разделения продуктов, было изучено равновесие жид-
NiI2-P(Bu)3-LiI. Ниже показаны уравнения реакций
кость-пар для систем EtI/EtCOOH и EtI/EtCOOEt. По
(XIII)-(XVI) с указанием выходов основных продук-
мнению авторов [50], наиболее предпочтительным
тов за 20 ч при температуре 120°C и давлении CO
является способ извлечения пропановой кислоты
3.0 МПа.
(XIII)
(XIV)
958
Севостьянова Н. Т., Баташев С. А.
(XV)
(XVI)
Следует отметить, что карбонилирование али-
По мнению авторов [49], галогенид-ионы играют
циклических спиртов, как правило, не сопровожда-
важную роль в осуществлении реакции. В частно-
ется образованием изомерных продуктов. В связи с
сти, было установлено, что Ni(OAc)2 или Ni(OTf)2
этим реакции с подобными субстратами часто ис-
в отсутствие добавок галогенидов были неактивны
пользуют в качестве модельных, в частности при
в карбонилировании 1-фенилэтанола. Относительно
изучении кинетических закономерностей [53-56].
происхождения алкилиодидов, которые не вноси-
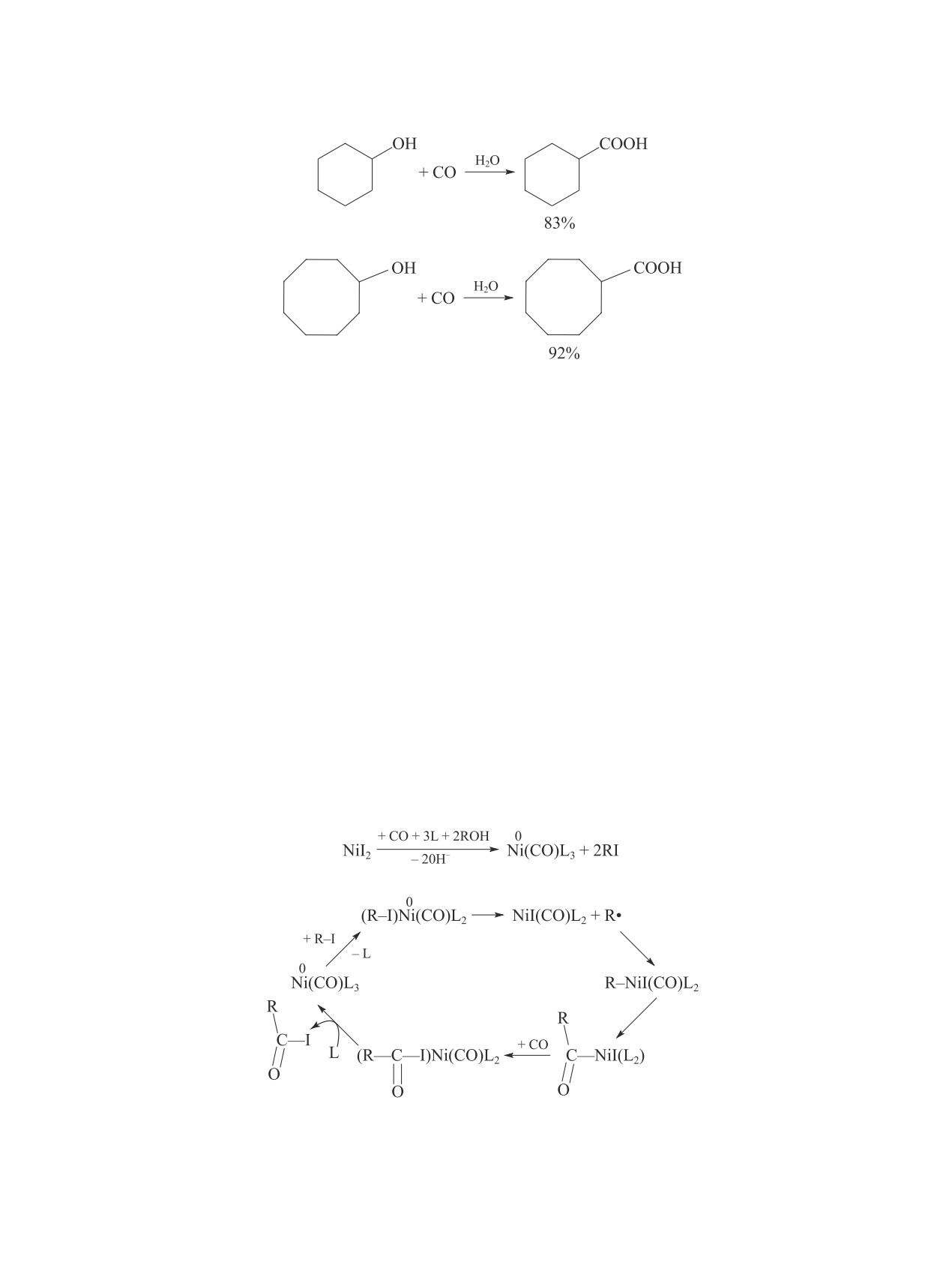
В карбонилировании циклогексанола (XV) также
ли в реакционную массу, в работе [49] лишь кратко
использовали гомогенную каталитическую систему
отмечается, что в присутствии органофосфина и га-
Ni(COD)2-P(n-Bu)3 — иодциклогексан. При тех же
логенидных солей в реакционной среде образуются
значениях температуры и давления СО, что указаны
карбонильные комплексы Ni0. HI, образующийся при
выше, выход циклогексанкарбоновой кислоты соста-
восстановлении Ni2+, реагирует со спиртом по меха-
вил 72% за 20 ч.
низму SN1 с образованием алкилиодида в качестве ре-
В работе [49] детально рассмотрены два варианта
акционноспособного промежуточного продукта [49].
каталитического цикла образования карбоновых кис-
Эти процессы могут быть представлены в виде схемы
лот. Исходными комплексами в этих циклах являются
(XVII), в которой в качестве лигандов L могут вы-
комплексы Ni0, однако авторы не приводят реакции
ступать молекулы СО и органофосфина или I--ионы,
восстановления NiI2 и образования участвующего
источником которых служит LiI. В последнем слу-
в этих циклах алкилиодида, как и в более ранних
чае, когда L = I-, образуется анионный комплекс Ni0.
работах [57-59], посвященных исследованиям карбо-
По-видимому, в процессе образования алкилиодида
нилирования спиртов при использовании в качестве
RI участвует LiI, связывая уходящую группу -ОН в
каталитических предшественников соединений Ni(II).
LiOH.
,
(XVII)
(XVIII)
Как доказано в работе [49], в каталитическом ци-
Образование изомерных карбоновых кислот линей-
кле (XVIII) участвуют четырех- и пятикоордини-
ного и разветвленного строения в реакциях (XIII)
рованные комплексы Ni и алкильный радикал R•.
и (XIV) обусловлено возможностью изомеризации
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
959
радикала R•. Генерируемые в результате реализации
ет потребность в способах утилизации глицерина,
каталитического цикла ацилиодиды легко гидролизу-
являющегося главным побочным продуктом этих
ются с образованием соответствующих карбоновых
процессов. Карбонилирование может стать одним из
кислот [49].
путей применения глицерина для синтеза ценных хи-
мических продуктов, однако на сегодня исследования
в этом направлении немногочисленны.
НАСЫЩЕННЫЕ АЛИФАТИЧЕСКИЕ
Так, в работе [61] показано, что высшие полиолы
МНОГОАТОМНЫЕ СПИРТЫ
CnHn+2(OH)n карбонилируются до соответствующих
Как отмечается в обзоре [60], в связи с развитием
монокарбоновых кислот Cn+1. В результате карбони-
производств биодизеля, мыла и жирных кислот на
лирования глицерина образуется смесь бутановой и
основе растительных и животных жиров возраста-
2-метилпропановой кислот (XIX).
(XIX)
Реакцию осуществляли в условиях гомогенного
обнаружены 3-бутеновая и 2-бутеновая кислоты, ал-
катализа соединениями Rh или Ir с использованием
лилацетат, аллилиодид, 1-иодпропан, 2-иодпропан
HI в качестве сокатализатора.
и изо-пропилацетат. Наибольший выход бутановой
В работе [61] в качестве субстратов карбонилиро-
кислоты 63% за 5 ч был получен в результате кар-
вания использовали глицерин и триацетат глицерина.
бонилирования глицерина в присутствии системы
Реакцию осуществляли в среде AcOH с примене-
[RhCl(CO2)]2-HI-Н2О при температуре 180°C и дав-
нием следующих гомогенных каталитических си-
лении СО 3.0 МПа в среде AcOH. В качестве побоч-
стем: [RhCl(CO)2]2-MeI-H2O, [RhCl(CO)2]2-HI-H2O,
ных продуктов в этом случае образовались 2-метил-
[NBu4][IrCl2(CO)2]-MeI-H2O, [NBu4][IrCl2(CO)2]-
пропановая кислотa и незначительные количества
HI-H2O и [NBu4][IrCl2(CO)2]-[Ru3(CO)12]. Процесс
2-иодпропана и изопропилацетата. Авторами [61]
карбонилирования триацетата глицерина также осу-
была предложена схема образования различных про-
ществляли в условиях кислотного катализа HI в при-
дуктов в процессе карбонилирования триацетата гли-
сутствии H2O. В качестве побочных продуктов были
церина, катализируемом HI (XX).
(XX)
Как уже отмечено, при использовании добавки
образованием как изо-пропильных, так и н-пропиль-
MeI образование HI происходит in situ под действием
ных металлокомплексов, и, как следствие, карбони-
CO и Н2О [последовательность реакций (III)].
лирование сопровождается образованием бутановой и
Как отмечают авторы [61], окислительное присо-
2-метилпропановой кислот. Повышение температуры
единение i-PrI к родиевому и иридиевому каталити-
приводило к снижению количества н-пропилиодида
ческим центрам приводит к изомеризации алкила с
[61]. По-видимому, варьирование температуры можно
960
Севостьянова Н. Т., Баташев С. А.
применять для управления селективностью карбони-
путем фильтрации и был пригоден для повторного ис-
лирования многоатомных спиртов.
пользования (более пяти циклов без заметной потери
В дальнейшем в работе [62] синтезировали закре-
первоначальной активности).
пленный на полистироле комплекс Rh(I) с имидазо-
лом. Каталитические характеристики комплекса были
НЕНАСЫЩЕННЫЕ СПИРТЫ
оценены в реакции карбонилирования глицерина в
атмосфере СО с получением бутановой и 2-метилпро-
Аллиловый спирт является легкодоступным ре-
пановой кислот. По мнению авторов [62], в качестве
агентом для получения 2-бутеновой (кротоновой)
побочного продукта образовался СО2. Конверсия
кислоты. Получение этого продукта основано на
глицерина приближалась к 100% за 5 ч с селектив-
многостадийном процессе крекинга этана с очень
ностью по бутановой кислоте около 60% при тем-
низким общим выходом и низкой селективностью.
пературе 180°C и давлении СО 3.0-3.5 МПа в среде
Карбонилирование аллилового спирта до 2-бутеновой
AcOH в присутствии HI [глицерин/HI = 27/13 (мол.)].
кислоты [уравнение (XXI)] является одним из пер-
Используемый катализатор показал высокую актив-
спективных подходов в связи с высокой атомарной
ность, мог быть легко выделен из реакционной массы
эффективностью и одностадийностью [63].
(XXI)
Помимо 2-бутеновой кислоты — целевого про-
Pd(PPh3)4-dppe, Pd(PPh3)4-PPh3, а также Pd(PPh3)4
дукта реакции — происходило образование 3-буте-
без промотирующей добавки. В частности, было
новой кислоты, аллиловых эфиров этих двух кислот
показано, что гомогенная каталитическая система
и γ-бутиролактона. В соответствии с предлагаемым
Pd(OAc)2-dppb высокоэффективна в реакции (XXI).
механизмом реакции, катализируемой палладий-фос-
Выход 2-бутеновой кислоты составил 99% за 18 ч
финовыми комплексами [63], сначала образуется
при температуре 110°С и давлении СО 0.5-5.0 МПа.
3-бутеновая кислота. Последующая изомеризация
Авторы отмечали снижение производительности про-
этой кислоты, также катализируемая комплексами
цесса вследствие образования палладиевой черни.
Pd, приводит к образованию 2-бутеновой кислоты.
По их мнению, гомогенные катализаторы на основе
Авторами показано, что выбор растворителя как сре-
Pd перспективны для применения в промышленном
ды для осуществления карбонилирования, а также
синтезе 2-бутеновой кислоты [63].
варьирование состава каталитической системы и
Разработке селективного синтеза 2-бутеновой кис-
соотношения количеств аллилового спирта и пал-
лоты предшествовали исследования M. Beller и соавт.
ладиевого предшественника позволяют управлять
[64], предложивших метод карбонилирования алли-
селективностью реакции. Были предложены простые
ловых спиртов алифатическими спиртами и CO для
и эффективные каталитические системы для полу-
получения β,γ-ненасыщенных сложных эфиров — по-
чения 2-бутеновой кислоты: Pd/C-dppb, Pd(OAc)2-
лезных полупродуктов для разнообразных синтезов
dppb, Pd(PPh3)4-dppb, Pd2(dba)3-dppb, Pd(dba)2-dppb,
(XXII).
(XXII)
Наибольший выход 82% был получен для реак-
Pd(OAc)2-(XXIII)-трифторуксусная кислота при тем-
ции 3-фенил-2-пропенола-1 с СО и 2-фенилэтанолом
пературе 105°С и давлении СО 4.0 МПа [64].
за 22 ч в условиях гомогенного катализа системой
(XXIII)
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
961
АРОМАТИЧЕСКИЕ СПИРТЫ
некоторых нестероидных противовоспалительных
средств, например ибупрофена [49]. Авторы рабо-
Синтез арилзамещенных карбоновых кислот
ты [49] в реакции карбонилирования 1-фенилэта-
и их сложных эфиров карбонилированием
нола (XXIV) использовали в качестве гомогенных
бензиловых спиртов
каталитических предшественников NiI2 и Ni(COD)2
Карбонилирование бензиловых спиртов можно ис-
в сочетании с LiI и (или) HI и органофосфиновыми
пользовать в синтезе разветвленных арилзамещенных
промоторами P(Bu)3 и (Bu)3P·HI.
карбоновых кислот, необходимых для производства
(XXIV)
Наибольший выход 2-фенилпропановой кислоты
Ni в сочетании с I--ионами. Квантово-химические
92% был получен за 20 ч при 120°С и давлении СО
расчеты показали, что наблюдаемая реакционная спо-
5.0 МПа в условиях катализа системой Ni(COD)2-
собность обусловлена сочетанием двух механизмов и
LiI-HI-P(Bu)3. При использовании в качестве ка-
что окислительное присоединение алкилгалогенидов
талитического предшественника NiI2 в отсутствие
к Ni(0)-форме следует по радикальному окислитель-
добавок иодидов был апробирован ряд моно-, дифос-
ному пути.
финовых промоторов и P,N-хелатирующих агентов.
В работе [49] в качестве субстратов карбонили-
При тех же значениях температуры и давления СО,
рования, катализируемого гомогенной системой
что и в привиденном выше примере, выходы 2-фе-
NiI2-LiI-P(Bu)3, также были использованы другие
нилпропановой кислоты не превышали 68%. Как
ароматические спирты. Ниже представлены урав-
отмечают авторы [49], достижение высокой скорости
нения реакций (XXV)-(XXXI) с указанием выходов
и региоселективности реакции стало возможным
основных продуктов в тех же условиях, что приве-
вследствие использования каталитических количеств
дены выше.
(XXV)
(XXVI)
(XXVII)
962
Севостьянова Н. Т., Баташев С. А.
(XXVIII)
(XXIX)
(XXX)
O
OH
OH
+ CO
(XXXI)
19%
Была разработана методика гомогенно-каталити-
зованием органических карбонатов в качестве эко-
ческого синтеза различных сложных эфиров (алкил-
логически безопасных растворителей и in situ-ак-
арилацетатов, применяющихся в агрохимии и фар-
тиваторов. Так, в результате карбонилирования
мацевтике) из бензиловых спиртов [65]. Бензиловые
бензилового спирта (XXXII) в условиях катализа
спирты были эффективно карбонилированы в при-
системой (CF3COO)2Pd-Cs2CO3-dppp были получены
сутствии гомогенных палладиевых каталитических
метиловый эфир фенилуксусной кислоты и бензил-
систем без каких-либо галогенных добавок с исполь-
метилкарбонат.
(XXXII)
Выход метилового эфира фенилуксусной кислоты нии СО 2.0 МПа. Ниже представлены уравнения ре-
достигал 93% за 24 ч при температуре 135°С и давле- акций синтеза различных алкиларилацетатов с указа-
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
963
нием выходов основных продуктов (XXXIII)-(XLVI) применением добавок карбонатов (главным образом
при катализе системой Pd(TFA)2-Cs2CO3-dppp с диметилкарбоната, а также пропиленкарбоната) [65].
(XXXIII)
(XXXIV)
(XXXV)
(XXXVI)
(XXXVII)
(XXXVIII)
(XXXIX)
964
Севостьянова Н. Т., Баташев С. А.
(XL)
(XLI)
(XLII)
(XLIII)
(XLIV)
(XLV)
(XLVI)
Синтез ненасыщенных карбоновых кислот
вые кислоты получают с помощью реакции Виттига
и их сложных эфиров карбонилированием
из альдегидов, карбонилированием 2,3-диен-1-олов
пропаргиловых спиртов
и присоединением-элиминированием 3-(метокси-
карбонил)-1,2-аллен-4-олов. Другой синтетический
1,3-Диены широко распространены в природных
путь открывают пропаргиловые спирты, являющиеся
продуктах и часто используются в качестве строи-
легкодоступными соединениями. В работе [66] был
тельных блоков в органическом синтезе и при раз-
представлен простой подход к синтезу замещенных
работке различных материалов [66]. В частности,
1,3-алкадиен-2-ил-карбоновых кислот из пропаргило-
синтезируемыми продуктами часто являются 1,3-ал-
вых спиртов [реакция (XLVII)] путем их карбонили-
кадиены, содержащие карбоксильную или сложно-
рования с использованием гомогенных палладиевых
эфирную группу. Обычно 1,3-алкадиен-2-ил-карбоно-
каталитических систем.
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
965
(XLVII)
Наибольший выход карбоновой кислоты II ли-
Другими важными ненасыщенными продуктами
нейного строения составил 85% за 12 ч при исполь-
являются аллены, которые в качестве структурного
зовании в качестве субстрата пропаргилового спирта
компонента входят в состав натуральных продуктов,
с заместителем R = (CH2)4Cl в условиях катализа
биологически активных соединений и ряда современ-
системой [Pd(π-allyl)]2-BINAP (XLVIII)-(PhO)2POOH
ных материалов, а также являются субстратами в раз-
при температуре 80°С и давлении СО 0.1 МПа. Было
личных органических синтезах [67, 68]. Как отмеча-
установлено, что реакция протекает через региоселек-
ют авторы работы [69], среди функционализованных
тивное гидрокарбонилирование связей C C 1,3-ени-
алленов большой интерес представляют 2,3-аллено-
новых интермедиатов, образующихся in situ [66].
вые кислоты, поскольку могут легко превращаться
в алленолы, алленали, алленоаты, алленамиды и бу-
тенолиды. В статьях [69, 70] представлены простые
методики синтеза тетразамещенных 2,3-алленовых
кислот путем каталитического карбоксилирования
легкодоступных пропаргиловых спиртов в присут-
(XLVIII)
ствии СО с использованием гомогенных палладиевых
каталитических систем. Эта атомно-экономичная
реакция (XLIX) протекала в мягких условиях с об-
разованием сложных эфиров 2,3-алленовых кислот с
широким спектром полезных функциональных групп.
(XLIX)
В частности, при карбонилировании пропарги-
лового спирта с заместителями R1 = Ph, R2 = Me,
R3 = n-Bu с использованием метанола как сореагента
(R4OH) наибольший выход 90% выделенного продук-
та (замещенной алленовой кислоты) был получен за
(L)
14 ч при температуре 50°С и давлении СО 0.1 МПа
при катализе гомогенной системой [(π-allyl)PdCl2]-L-
(PhO)2PO2H [69].
966
Севостьянова Н. Т., Баташев С. А.
В работе [70] при использовании более простого и
держащего заместители R1 = Ph, R2 = n-Pr, R3 = n-Bu,
доступного каталитического предшественника PdCl2
был получен выход 97% замещенной алленовой кис-
в сочетании с добавками DPEphos, (PhO)2PO2H и
лоты за 18 ч при тех же значениях температуры и
воды в карбонилировании пропаргилового спирта, со-
давления, что и в работе [69] [реакция (LI)].
(LI)
В реакциях (XLIX) и (LI) кислота Бренстеда (H2O
добавки иодидов. Разработка каталитических процес-
или спирт R4OH в сочетании с СО) была необходима
сов карбонилирования метанола и этанола с целью
для активации пропаргилового спирта с образованием
получения карбоновых кислот и сложных эфиров
оксониевого интермедиата [69, 70].
также сопровождалась изучением различных вари-
антов разделения азеотропных смесей, образуемых
продуктами и реагентами.
Заключение
В большинстве работ исследовали процессы кар-
В последнее десятилетие для карбонилирования
бонилирования в основном низших спиртов. В то
спиртов с применением СО были разработаны высо-
же время в ряде работ изучали карбонилирование
коактивные, селективные, а в ряде случаев и высо-
спиртов С3 и выше. C использованием новых гомо-
костабильные катализаторы, перспективные с точки
генных и гетерогенных катализаторов карбонилиро-
зрения промышленного использования в процессах
вания спиртов были осуществлены синтезы широкого
получения различных сложных эфиров и карбоновых
спектра востребованных в химической и фармацев-
кислот. Взамен гомогенных родиевых и иридиевых
тической промышленности продуктов, в том числе
катализаторов карбонилирования насыщенных спир-
ароматических. В некоторых работах по исследова-
тов с использованием СО были предложены гетеро-
нию процессов гетерогенно-каталитического карбо-
генные катализаторы не только на основе Rh и Ir, но
нилирования спиртов были получены кинетические
также медь-титановые, позволяющие получать вы-
модели, отражающие влияние различных факторов
сокие выходы карбоновых кислот и сложных эфиров
на скорость образования целевых продуктов. Эти
при температуре до 200°С. С использованием гомо-
модели могут быть использованы для оценки произ-
генных иридиевых катализаторов карбонилирование
водительности процессов карбонилирования в кон-
осуществляли при достаточно низкой температуре
кретных условиях, что создает необходимую основу
(65-120°С), однако в этом случае использовали до-
для последующей разработки технологий процессов
бавки коррозионно-активных иодидов, без которых
карбонилирования.
карбонилирование не протекало. С использованием
некоторых гетерогенных катализаторов, содержа-
Финансирование работы
щих Rh, Re, Cu, Ni-Cu и Ni-Mo, карбонилирование
осуществляли в отсутствие добавок иодидов, но при
Исследование выполнено за счет гранта
температуре выше 200°С.
Российского научного фонда № 22-23-00102, https://
Одной из проблем использования гетерогенных
катализаторов являлось снижение их стабильности
вследствие углеродных отложений. Эта проблема
Конфликт интересов
была успешно решена, в частности, путем исполь-
зования CO в смеси с H2 и добавками различных
Авторы заявляют об отсутствии конфликта инте-
металлов (например, Ce) в структуру катализаторов.
ресов, требующего раскрытия в данной статье.
В основном в результате удалось достичь необхо-
димой стабильности гетерогенных катализаторов,
Информация об авторах
а в ряде случаев — и высоких скоростей карбони-
лирования. Во многих работах была показана воз-
Севостьянова Надежда Тенгизовна, к.х.н., до-
можность длительного (до 1000 ч) использования
цент, руководитель научно-производственно-
гетерогенных родиевых и иридиевых катализаторов
го центра «Химреактивдиагностика» ТГПУ им.
в карбонилировании метанола и этанола в потоке
Л. Н. Толстого
при 190-195°С. Однако в этих случаях использовали
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
967
Баташев Сергей Александрович, к.х.н., доцент,
[10]
Qi J., Christopher P. Atomically dispersed Rh active
старший научный сотрудник научно-производ-
sites on oxide supports with controlled acidity for
ственного центра «Химреактивдиагностика» ТГПУ
gas-phase halide-free methanol carbonylation to
acetic acid // Ind. Eng. Chem. Res. 2019. V. 58. N 28.
им. Л. Н. Толстого
P. 12632-12641.
[11]
Ren Z., Lyu Y., Feng S., Song X., Ding Y. A highly
efficient single site Rh-POL-PPh3 catalyst for
Список литературы
heterogeneous methanol carbonylation // Mol. Catal.
[1]
Чоркендорф И., Наймантсведрайт Х. Современный
2017. V. 442. P. 83-88.
катализ и химическая кинетика: Научное издание.
Долгопрудный: Изд. Дом «Интеллект», 2010. 504 с.
[12]
Ni Y., Shi L., Liu H., Zhang W., Liu Y., Zhu W., Liu Z.
[Chorkendorff I., Niemantsverdriet J. W. Concepts of
A green route for methanol carbonylation // Catal. Sci.
Modern Catalysis and Kinetics. Wiley-VCH Verlag
Technol. 2017. V. 7. N 20. P. 4818-4822.
GmbH & Co. KGaA, 2007. 457 p.].
[2]
Nasr Allah T., Ponsard L., Nicolas E., Cantat T.
[13]
Peng J.-B., Wu F.-P., Wu X.-F. First-row transition-
Catalytic challenges and strategies for the carbonylation
metal-catalyzed carbonylative transformations of
of σ-bonds // Green Chem. 2021. V. 23. N 2. P. 723-
carbon electrophiles // Chem. Rev. 2019. V. 119. N 4.
P. 2090-2127.
[3]
Zoeller J. R., Paul N. Rylander Award Address:
Selected advances in catalysis and reactor systems
[14]
Dingwall L. D., Lee A. F., Lynam J. M., Wilson K.,
for the generation of acetates and propionates using
Olivi L., Deeley J. M. S., Gaemers S., Sunley G. J.
carbonylation // Org. Process Res. Dev. 2016. V. 20.
Bifunctional organorhodium solid acid catalysts for
N 6. P. 1016-1025.
methanol carbonylation // ACS Catal. 2012. V. 2. N 7.
[4]
Budiman A. W., Nam J. S., Park J. H., Mukti R. I.,
[15]
Шелдон Р. А. Химические продукты на основе син-
Chang T. S., Bae J. W., Choi M. J. Review of acetic
тез-газа / Пер. с англ. под ред. С. М. Локтева. М.:
acid synthesis from various feedstocks through different
Химия, 1987. 248 с. [Sheldon R. A. Chemicals from
catalytic processes // Catal. Surv. Asia. 2016. V. 20. N 3.
synthesis gas. Dordrecht: D. Reidel Publ. Co., 1983.
216 p.].
[5]
Kalck P., Le C., Serp B. P. Recent advances in the
[16]
Ян Ю. Б., Нефедов Б. К. Синтезы на основе оксидов
methanol carbonylation reaction into acetic acid //
углерода. М.: Химия, 1987. C. 232-233.
Coord. Chem. Rev. 2020. V. 402. ID 213078.
[17]
Zhang S., Ji W., Feng N., Lan L., Li Y., Ma Y. Study
on Rh(I)/Ru(III) bimetallic catalyst catalyzed
[6]
Ren Z., Lyu Y., Song X., Ding Y. Review of
carbonylation of methanol to acetic acid // Materials.
heterogeneous methanol carbonylation to acetyl species
2020. V. 13. N 18. P. 4026-4037.
// Appl. Catal. A. 2020. V. 595. 117488.
[18]
Feng S., Lin X., Song X., Liu Y., Jiang Z., Ding Y.
[7]
Zhang D., Yang G., Zhao Y., Shao S., Zhu G., Liu P.,
Insight into the stability of binuclear Ir-La catalysts
Liu J., Hu X., Zhang Z. Efficient methanol carbonylation
for efficient heterogeneous methanol carbonylation //
to methyl acetate catalyzed by a cyclic(alkyl)(amino)-
J. Catal. 2019. V. 377. P. 400-408.
carbene iridium complex // Catal. Sci. Technol. 2020.
V. 10. P. 6045-6049.
[19]
Gregor L. C., Grajeda J., Kita M. R., White P. S.,
Vetter A. J., Miller A. J. M. Modulating the elementary
[8]
Feng S., Song X., Ren Z., Ding. La-stabilized, single-
steps of methanol carbonylation by bridging the
atom Ir/AC catalyst for heterogeneous methanol
primary and secondary coordination spheres //
carbonylation to methyl acetate // Ind. Eng. Chem. Res.
Organometallics. 2016. V. 35. N 17. P. 3074-3086.
2019. V. 58. N 12. P 4755-4763.
[20]
Gregor L. C., Grajeda J., White P. S., Vetter A. J.,
[9]
Qi J., Finzel J., Robatjazi H., Xu M., Hoffman A. S.,
Miller A. J. M. Salt-promoted catalytic methanol
Bare S. R., Pan X., Christopher P. Selective methanol
carbonylation using iridium pincer-crown ether
carbonylation to acetic acid on heterogeneous
complexes // Catal. Sci. Technol. 2018. V. 8. N 12.
atomically dispersed ReO4/SiO2 catalysts // J. Am.
Chem. Soc. 2020. V. 142. N 33. P. 14178-14189.
[21]
Yoo C., Miller A. J. M. Stepwise iodide-free methanol
carbonylation via methyl acetate activation by pincer
968
Севостьянова Н. Т., Баташев С. А.
iridium complexes // J. Am. Chemical. Soc. 2021.
[32]
Park K., Lim S., Baik J. H., Kim H., Jung K. D., Yoon S.
V. 143. N 32. P. 12633-12643.
Exceptionally stable Rh-based molecular catalyst
heterogenized on a cationically charged covalent
[22]
Pat. US 9421522 B2 (publ. 2016). Iridium catalysts for
triazine framework support for efficient methanol
carbonylation.
carbonylation // Catal. Sci. Technol. 2018. V. 8. N 11.
[23]
Guo J., Liu H., Li D., Wang J., Djitcheu X., He D.,
Zhang Q. A Minireview on the synthesis of single
[33]
Nam J. S., Kim A. R., Kim D. M., Chang T. S., Kim B. S.,
atom catalysts // RSC Adv. 2022. V. 12. P. 9373-9394.
Bae J. W. Novel heterogeneous Rh-incorporated
graphitic-carbon nitride for liquidphase carbonylation
[24]
Голубев К. Б., Яшина О. В., Батова Т. И., Колес-
of methanol to acetic acid // Catal. Commun. 2017.
ниченко Н. В., Ежова Н. Н. Прямое низкотемпе-
V. 99. P. 141-145.
ратурное окислительное превращение метана в
уксусную кислоту на модифицированных родием
[34]
Kim D. M., Kim A. R., Chang T. S., Koo H. M.,
цеолитах // Наногетероген. катализ. 2021. Т. 6. № 1.
Kim J. K., Han G. Y., Shin C. H., Bae J. W. Synergy
C. 17-23.
effects of Al2O3 promoter on a highly ordered
mesoporous heterogeneous Rh-g-C3N4 for a liquid-
[Golubev K. B., Yashina O. V., Batova T. I.,
phase carbonylation of methanol // Appl. Catal. A.
Kolesnichenko N. V., Ezhova N. N. Direct low-
2019. V. 585. 117209.
temperature oxidative conversion of methane to acetic
acid on rhodium-modified zeolites // Petrol. Chem.
[35]
Shang W., Gao M., Chai Y., Wu G., Guan N., Li L.
2021. V. 61. N 5. P. 663-669.
Stabilizing isolated rhodium cations by MFI zeolite for
heterogeneous methanol carbonylation // ACS Catal.
[25]
Qiao B., Wang A., Yang X., Allard L. F., Jiang Z.,
2021. V. 11. N 12. P. 7249-7256.
Cui Y., Liu J., Li J., Zhang T. Single-atom catalysis of
CO oxidation using Pt1/FeOx // Nature Chem. 2011.
[36]
Feng S., Lin X., Song X., Mei B., Mu J., Li J., Liu Y.,
Jiang Z., Ding Y. Constructing efficient single Rh sites
[26]
Hensley A. J., Zhang J., Vinçon I., Hernandez X. P.,
on activated carbon via surface carbonyl groups for
Tranca D., Seifert G., McEwen J.-S., Wang Y.
methanol carbonylation // ACS Catal. 2021. V. 11. N 2.
Mechanistic understanding of methanol carbonylation:
Interfacing homogeneous and heterogeneous catalysis
[37]
Tong C., Zuo J., Wen D., Chen W., Ye L., Yuan Y.
via carbon supported Ir-La // J. Catal. 2018. V. 361.
Halide-free carbonylation of methanol with H-MOR
supported CuCeOx catalysts // Front. Chem. Sci. Eng.
[27]
Ren Z., Lyu Y., Feng S., Song X., Ding Y. Acid-
2021. V. 15. N 5. P. 1075-1087.
promoted Ir-La-S/AC-catalyzed methanol
carbonylation on single atomic active sites // Chin. J.
[38]
Meng X., Yuan L., Guo H., Hou B., Chen C., Sun D.,
Catal. 2018. V. 39. N 6. P. 1060-1069.
Wang J., Li D. Carbonylation of methanol to methyl
acetate over Cu/TiO2-SiO2 catalysts: Influence of
[28]
Feng S., Lin X., Song X., Liu Y., Jiang Z.,
copper precursors // Mol. Catal. 2018. V. 456 P. 1-9.
Hemberger P., Bodi A., Ding Y. The role of H2 on
the stability of the single-metal-site Ir1/AC catalyst
[39]
Nie Q., Zhao G., Shen M., Liu Y., Lu Y. Ni-MoOx
for heterogeneous methanol carbonylation // J. Catal.
bifunctional catalyst on SiO2 for vapor halide-free
2020. V. 381. P. 193-203.
methanol carbonylation: Insight into synergistic
catalysis between Ni and MoOx // Appl. Catal. A.
[29]
Pat. US 9387469 B2. (publ. 2016). Carbonylation
2021. V. 623. 118263.
catalyst and process using same.
[30]
Ren Z., Liu Y., Lyu Y., Song X., Zheng C., Feng S.,
[40]
Kapran A. Yu., Chedryk V. I., Alekseenko L. M.,
Jiang Z., Ding Y. Single-atom Rh based bipyridine
Orlyk S. M. Carbonylation of methanol over Nickel-
framework porous organic polymer: A High active
Copper based supported catalysts // Catal. Lett. 2021.
and superb stable catalyst for heterogeneous methanol
V. 151. N 4. P. 993-1002.
carbonylation // J. Catal. 2019. V. 369. P. 249-256.
[41]
Капран А. Ю., Борисевич В. С., Алексеенко
[31]
Ivko S. A., James A. M., Derry M. J., Dawson R.,
Л. М., Чедрик В. И., Орлик С. Н. Влияние диок-
Haynes A. Heterogenisation of a carbonylation catalyst
сида церия в составе композиций NiCl2-CuCl2,
on dispersible microporous polymer nanoparticles
нанесенных на активированный уголь, на их ка-
// Catal. Sci. Technol. 2021. V. 12. N 2. P. 664-673.
талитические свойства в процессе парофазного
карбонилирования метанола // Теорет. и эксперим.
Катализаторы карбонилирования спиртов для получения карбоновых кислот и сложных эфиров (обзор)
969
химия. 2016. Т. 52. № 4. С. 233-238 [Kapran A. Yu.,
carbonylation catalyzed by iodide // Ind. Eng. Chem.
Borysevych V. S., Alekseenko L. M., Chedryk V. I.,
Res. 2020. V. 59. N 13. P. 6090-6101.
Orlyk S. M. Effect of cerium dioxide in NiCl2-CuCl2
compositions deposited on activated carbon on their
[51]
Xing Z., Gao Y., Ding H., Wang X., Li L., Zhou H.
catalytic properties in the vapor-phase carbonylation
Isobaric vapor-liquid equilibrium for ternary system
of methanol // Theoret. Experim. Chem. 2016. V. 52.
of ethanol, ethyl propionate and para-xylene at 101.3
N 4. P. 233-239.
kPa // Chin. J. Chem. Eng. 2018. V. 26. P. 560-565.
[42]
Dimian A. C., Kiss A. A. Enhancing the separation
[52]
Pan J., Li X., Zhang W., Cui W., Zhou Z., Liu D.
efficiency in acetic acid manufacturing by methanol
Isobaric vapour-liquid equilibrium for binary systems
carbonylation // Chem. Eng. Technol. 2021. V. 44.
of ethyl iodide with ethanol, propionic acid and ethyl
N 10. P. 1792-1802.
propionate at 101.3 kPa // J. Chem. Thermodyn. 2019.
V. 132. P. 23-28.
[43]
Zhang X. M., Liu H. P., Liu Y. X., Jian C. G., Wang W.
Experimental isobaric vapor-liquid equilibrium for
[53]
Лапидус А. Л., Пирожков С. Д. Каталитический
the binary and ternary systems with methanol, methyl
синтез органических соединений карбонилиро-
acetate and dimethyl sulfoxide at 101.3 kPa // Fluid
ванием непредельных углеводородов и спиртов
Phase Equilib. 2016. V. 408. P. 52-57.
// Успехи химии. 1989. Т. 58. Вып. 2. С. 197-233
[Lapidus A. L., Pirozhkov S. D. Catalytic synthesis
[44]
Hu Y., Pan J., Nawaz M. A., Li X., Liu D. Kinetic
of organic compounds by the carbonylation of
study on the carbonylation of ethanol to propionic acid
unsaturated hydrocarbons and alcohols // Russ.
using homogeneous Rh complex catalyst at low water
content // Reac. Kinet. Mech. Cat. 2020. V. 129. N 1.
P. 235-251.
[54]
Kiss G. Palladium-catalyzed Reppe carbonylation //
Chem. Rev. 2001. V. 101. N 11. P. 3435-3456.
[45]
Yacob S., Kilos B. A., Barton D. G., Notestein J. M.
Vapor phase ethanol carbonylation over Rh supported
[55]
Севостьянова Н. Т., Баташев С. А. Гидрокарбо-
on zeolite 13X // Appl. Catal. A. 2016. V. 520. P. 122-
метоксилирование циклогексена, катализируемое
системой RuCl3-NaCl // Хим. физика. 2018. Т. 37.
[46]
Yacob S., Park S., Kilos B. A., Barton D. G.,
№ 6. С. 94-96.
Notestein J. M. Vapor-phase ethanol carbonylation
with heteropolyacid-supported Rh // J. Catal. 2015.
[Sevostyanova N. T., Batashev S. A. Cyclohexene
V. 325. P. 1-8.
hydrocarbomethoxylation catalyzed by the RuCl3-
NaCl system // Russ. J. Phys. Chem. B. 2018. V. 12.
[47]
Ren Z., Liu Y., Lyu Y., Song X., Zheng C., Jiang Z.,
P. 593-594.
Ding Y. Quaternary phosphonium polymer-supported
dual-ionically bound [Rh(CO)I3]2- catalyst for
[56]
Аверьянов В. А., Севостьянова Н. Т., Баташев С. А.
heterogeneous ethanol carbonylation // Chin. J. Catal.
Кинетические закономерности гидрокарбал-
2021. V. 42. N 4. P. 606-617.
коксилирования циклогексена циклогексано-
лом, катализируемого системой Pd(PPh3)2Cl2-
[48]
Xu L., Hu Y., Nawaz M. A., Li X., Liu D. Kinetic
PPh3-п-толуолсульфокислота // Нефтехимия.
study of carbonylation of ethanol to propionic acid
2008. Т. 48. № 4. С. 286-294 [Averʹyanov V. A.,
using homogeneous rhodium complex catalyst in
Sevostʹyanova N. T., Batashev S. A. Kinetics
the presence of diphosphine ligand // Fuel Process.
of cyclohexene hydrocarbalkoxylation with
Technol. 2021. V. 213. 106716.
cyclohexanol catalyzed by the Pd(PPh3)2Cl2-PPh3--
p-toluenesulfonic acid system // Petrol. Chem. 2008.
[49]
Sabater S., Menche M., Ghosh T., Krieg S.,
V. 48. N 4. P. 287-295.
Rück K. S. L., Paciello R., Schäfer A., Comba P.,
Hashmi A. S. K., Schaub T. Mechanistic investigation
[57]
Kelkar A. A., Ubale R. S., Chaudhari R. V. Promoting
of the nickel-catalyzed carbonylation of alcohols //
effects of metal iodides in Ni(Isoq)4Cl2-catalyzed
Organometallics. 2020. V. 39. N 6. Р. 870-880.
carbonylation of ethanol and n-propanol // J. Catal.
1992. V. 136. P. 605-608.
[50]
Li H., Na J., Cong H., Wu L., Zhao L., Li X., Gao X.
Thermodynamics foundation and separation process
[58]
Ubale R. S., Kelkar A. A., Chaudhari R. V.
design for production of propionic acid from ethanol
Carbonylation of ethanol using Ni-isoquinoline
970
Севостьянова Н. Т., Баташев С. А.
complex catalyst: Activity and selectivity studies // J.
Chem. Int. Ed. 2013. V. 52. N 31. P. 8064-8068.
Mol. Catal. A: Chemical. 1997. V. 118. P. 9-19.
[65]
Li Y., Wang Z., Wu X.-F. A sustainable procedure
[59]
Rizkalla N. Acetic acid production via low-pressure,
toward alkyl arylacetates: Palladium-catalysed direct
Nickel-catalyzed methanol carbonylation // ACS
carbonylation of benzyl alcohols in organic carbonates
Symp. Ser. 1987. V. 328. P. 61-76.
// Green Chem. 2018. V. 20. N 5. P. 969-972.
[60]
Kong P. S., Aroua M. K., Daud W. M. A. W. Conversion
[66]
Yuan Y., Jia M., Zhang W., Ma S. Palladium catalyzed
of crude and pure glycerol into derivatives: A
regioselective elimination-hydrocarbonylation of
Feasibility evaluation // Renewable Sustainable
propargylic alcohols // Chem. Commun. 2019. V. 55.
Energy Rev. 2016. V. 63. P. 533-555.
[67]
Chen G., Fu C., Ma S. A Novel synthesis of
[61]
Coskun T., Conifer C. M., Stevenson L. C.,
1,3-oxazine-2,4-diones via a simple and efficient
Britovsek G. J. Carbodeoxygenation of biomass:
reaction of CO2 with 2,3-allenamides // Org. Lett.
The Carbonylation of glycerol and higher polyols to
2009. V. 11. N 13. P. 2900-2903.
monocarboxylic acids // Chem. Eur. J. 2013. V. 19.
N 21. P. 6840-6844.
[68]
Pan S., Huang Y., Xu X.-H., Qing F.-L. Copper-assisted
oxidative trifluoromethylthiolation of 2,3-allenoic
[62]
Molla R. A., Ghosh K., Roy A. S., Islam Sk. M. Polymer
acids with AgSCF3 // Org. Lett. 2017. V. 19. N 17.
supported rhodium carbonyl complex catalyzed
P. 4624-4627.
carbonylation of glycerol for the synthesis of
carboxylic acids // J. Mol. Catal. A: Chemical. 2015.
[69]
Zhang W., Huang C., Yuan Y., Ma S. Catalytic transient
V. 396. P. 268-274.
leaving group for atom-economic synthesis of allenes
from 2-alkynols // Chem. Commun. 2017. V. 53.
[63]
Padmanaban S., Jiang J., Yoon S. Revisiting the
P. 12430-12433.
palladium-catalyzed carbonylation of allyl alcohol:
Mechanistic insight and improved catalytic efficiency
[70]
Zheng W.-F., Zhang W., Huang J., Yu Y., Qian H.,
// Organometallics. 2020. V. 39. N 10. P. 1881-1886.
Ma S. 2,3-Allenoic acids via palladium-catalyzed
carboxylation of propargylic alcohols // Org. Chem.
[64]
Liu Q., Wu L., Jiao H., Fang X., Jackstell R., Beller M.
Front. 2018. V. 5. N 12. P. 1900-1904.
Domino catalysis: Palladium-catalyzed carbonylation
of allylic alcohols to β,γ-unsaturated esters // Angew.