104
Савельев Е. А. и др.
Журнал прикладной химии. 2023. Т. 96. Вып. 1
УДК 547-326
ОБРАЗОВАНИЕ МУРАВЬИНОЙ КИСЛОТЫ И ЕЕ ЭФИРОВ
ПРИ ОКИСЛЕНИИ МЕТИЛОВЫХ ЭФИРОВ ЖИРНЫХ КИСЛОТ
© Е. А. Савельев, А. Д. Черепанова, В. Н. Сапунов
Российский химико-технологический университет им. Д. М. Менделеева,
125047, г. Москва, Миусская пл., д. 9
Поступила в Редакцию 25 марта 2023 г.
После доработки 8 июня 2023 г.
Принята к публикации 3 июля 2023 г.
Изучены пути образования легких продуктов в ходе окисления метиловых эфиров жирных кислот
кислородом воздуха в барботажной колонне. Эти вещества непрерывно удаляются из реактора под
действием высокой температуры и при постоянной подаче воздуха. Для исследования использовали два
вида сырья с различным содержанием эфиров моно- и диненасыщенных жирных кислот (метиловые
эфиры жирных кислот оливкового и подсолнечного масел). Помимо кислот и альдегидов, которые
составляют основную часть легколетучих продуктов, были обнаружены соединения, содержащие
эфирные группы. Анализ методами 1Н и 13С ЯМР показал наличие в образцах эфиров муравьиной
кислоты. В работе предложен механизм образования формиатов, включающий взаимодействие аль-
дегидов и гидропероксидов в реакционном объеме по реакции Байера-Виллигера.
Ключевые слова: окисление кислородом воздуха; метиловые эфиры жирных кислот; ненасыщенные
жирные кислоты; эфиры муравьиной кислоты; муравьиная кислота
DOI: 10.31857/S0044461823010127; EDN: HVNQCU
Установление состава и строения легких продук-
Экспериментальная часть
тов играет важную роль при изучении процессов
окисления, протекающих при превращениях по ра-
Исходные реагенты: метанол (х.ч., ООО ТД
дикальному механизму. Авторами ряда исследова-
«ХИММЕД»), KОН (х.ч., ООО ТД «ХИММЕД»),
ний было зафиксировано образование формиатов
пропанол-2 (х.ч., ООО ТД «ХИММЕД»), спирт
при окислении различных ненасыщенных соедине-
этиловый (96.0 об%, ООО «ТехноХимЭкспорт»),
ний, например цис,цис-6,9-октадиена (амилформиат,
Na2S2O3 (ч.д.а., ООО ТД «ХИММЕД»), HCl (х.ч.,
гексилформиат и октилформиат) [1], триолеина и
ООО ТД «ХИММЕД»), NaHCO3 (ч.д.а., ООО
трилинолеина (гексиловый, октиловый и транс-2-ок-
ТД «ХИММЕД»), CaSO4 (99.0 мас%, ООО ТД
тениловый эфиры муравьиной кислоты) [2, 3].
«ХИММЕД»), H2O дистиллированная (удельная элек-
Образующиеся эфиры являются вторичными про-
трическая проводимость не более 5.1·10-4 См·м-1,
дуктами окисления, поскольку их образованию пред-
ООО ТД «ХИММЕД»), дейтерированный хло-
шествует накопление в реакционной среде первичных
роформ (99.9 мас%, Merck), ацетат аммония (х.ч.,
продуктов — гидропероксидов, которые, по-видимо-
Sisco Research Laboratories), ацетонитрил (ос.ч.,
му, выступают в роли интермедиатов. Несмотря на
Merck), уксусная кислота ледяная (х.ч., ООО ТД
многочисленные работы в области изучения процес-
«ХИММЕД»).
сов окисления ненасыщенных соединений, авторы
Исходные метиловые эфиры жирных кислот по-
не предложили механизма образования формиатов в
лучали путем переэтерификации глицериновых эфи-
ходе окисления метиловых эфиров жирных кислот.
ров растительных масел с метанолом при щелочном
Цель работы — изучение пути образования фор-
катализе KОН в массовом соотношении 100/10/1
миатов в процессе окисления метиловых эфиров жир-
соответственно при 40-50°С в течение 3 ч. После
ных кислот.
окончания реакции смесь разделяли в делительной
Образование муравьиной кислоты и ее эфиров при окислении метиловых эфиров жирных кислот
105
Таблица 1
Состав исходных смесей метиловых эфиров жирных кислот
Компонент, мас%
Исходное сырье
С
16/0+1
С18/0
С18/1
С18/2
С18/3
Метиловые эфиры жирных кислот оливкового масла
12.6
2.7
77.2
6.9
0.6
Метиловые эфиры жирных кислот подсолнечного масла
6.7
3.1
25.1
65.1
0.0
воронке (1 сут). Нижний глицериновый слой сливали,
Концентрацию двойных связей определяли в соот-
а верхний, содержащий метиловые эфиры жирных
ветствии с методикой*** титрованием стандартным
кислот, очищали с помощью молекулярной дистилля-
водным раствором Na2S2O3 выделившегося иода до
ции KDL 1 BASIC VERSION 2007 (UIC GmbH) при
исчезновения окраски.
170°С и 20 Па. Составы исходных смесей метиловых
Регистрацию ИК-спектров осуществляли с по-
эфиров жирных кислот оливкового и подсолнечного
мощью Фурье-спектрометра Nicole 380 (Thermo
масел приведены в табл. 1.
Scientific). Основные технические характеристи-
Окисление метиловых эфиров жирных кислот
ки: спектральный диапазон на пропускание 4000-
проводили в условиях диффузионного контроля [4] в
400 см-1, спектральный диапазон на приставке НПВО
соответствии с методикой [5] в барботажной колон-
4000-650 см-1, спектральное разрешение 1 см-1, пре-
не (120 мл рабочего объема), оснащенной обратным
делы допускаемой абсолютной погрешности шкалы
водяным холодильником, при 110°С и подаче воздуха
волновых чисел ±0.5 см-1, отношение сигнал/шум не
25 мл·с-1. Температуру в реакторе поддерживали
менее 1500.
с помощью термообмотки, которая подключалась
1H и 13С ЯМР-спектры регистрировали на при-
к контрольно-измерительному прибору. Контроль
боре AVANCE III 400 (Bruker) при комнатной тем-
температуры осуществляли термопарой. После во-
пературе с использованием стандартных импуль-
дяного холодильника на линии отходящего воздуха
сных программ компании Bruker. Рабочая частота для
устанавливали ледяную ловушку для дополнительной
ядер 1H и 13С — 300 МГц и 75 МГц соответственно.
конденсации соединений, уносимых газовым пото-
Образцы растворяли в дейтерированном хлорофор-
ком. Это позволило собрать суммарное количество
ме. Идентификацию групп веществ легких фракций,
легколетучей фракции в количестве ~5 мас% от за-
собранных в ледяную ловушку при окислении мети-
грузки исходного сырья.
ловых эфиров жирных кислот растительных масел,
Кислотное число (КЧ) определяли в соответствии
проводили по данным сигнал-функциональная груп-
со стандартной методикой* методом кислотно-ос-
па литературных источников [6-8]. Особое внимание
новного титрования образцов 0.2 М водным раство-
уделяли области 9.50-10.00 ppm, характерной для
ром KОН с применением автоматического потен-
альдегидов, ввиду их крайне малого количества в
циометрического титратора Аквилон АТП-02 (АО
реакционной массе, выгружаемой из реактора.
«Аквилон») при тщательном перемешивании магнит-
Разделение смеси продуктов проводили на при-
ной мешалкой. Для регистрации кривой титрования
боре для высокоэффективной жидкостной хромато-
и точки эквивалентности использовали программное
графии (Bischoff) с хроматографической колонкой
обеспечение Titrate 39 5.0. Base.
Cosmosil Packed Column 5 C18-MS-II 4.6 × 75 мм
Содержание эфирных групп определяли в соот-
(Nacalai tesque). Подвижная фаза А — водные
ветствии с методикой** кислотно-основным титро-
растворы 0.001 моль·дм-3 уксусной кислоты и
ванием 0.2 М раствором HCl избытка KОН после
0.005 моль·дм-3 ацетата аммония; подвижная фа-
гидролиза образца 0.1 М раствором KОН в этиловом
за Б — ацетонитрил. Общее время анализа — 25 мин.
спирте с применением автоматического потенциоме-
Соотношение компонентов А и Б изменялось гради-
трического титратора при тщательном перемешива-
ентно и составляло 80/20 (0.00-1.00 мин), 5/95 (10.00-
нии магнитной мешалкой.
20.00 мин) и 80/20 (20.50-25.00 мин). Скорость пото-
ка подвижной фазы — 0.4 мл·мин-1, температура
термостата — 25°С.
* ISO 660:2020. Animal and vegetable fats and oils —
Determination of acid value and acidity.
** ISO 709:2001. Essential oils — Determination of ester
*** ISO 3961:2018. Animal and vegetable fats and oils —
value.
Determination of iodine value.
106
Савельев Е. А. и др.
Кислоты, растворенные в водных фракциях, ней-
В обеих пробах установлено наличие насыщенных
трализовали в стакане с мешалкой при медленном
(9.75 ppm) и α-ненасыщенных (9.50 ppm) альдегидов
добавлении насыщенного раствора NaHCO3 до пре-
(табл. 2), механизм образования которых подробно
кращения образования газа. После окончания реак-
представлен в работах [9, 10]. В свою очередь сиг-
ции соли просушивали и определяли массу сухого
нал в области 9.78-9.80 ppm, согласно результатам
остатка. При нейтрализации водной фазы, получен-
исследований [11], соответствует 4-оксо-транс-2-ал-
ной при окислении метиловых эфиров жирных кис-
кеналям, низкомолекулярным короткоцепочечным
лот оливкового масла, образовалось 2.38 г солей, в
н-алканалям.
случае окисления метиловых эфиров жирных кислот
По результатам анализа образца, полученного при
подсолнечного масла — 1.20 г. Исходя из известного
окислении метиловых эфиров жирных кислот оливко-
количества кислот и масс полученных солей были
вого масла, методом высокоэффективной жидкостной
рассчитаны молекулярные массы кислот. Отклонение
хроматографии установили наличие нонановой и
расчетной и теоретической массы сухих солей не
октановой кислот в равных количествах. Это согласу-
превышает 3 мас% в обоих случаях.
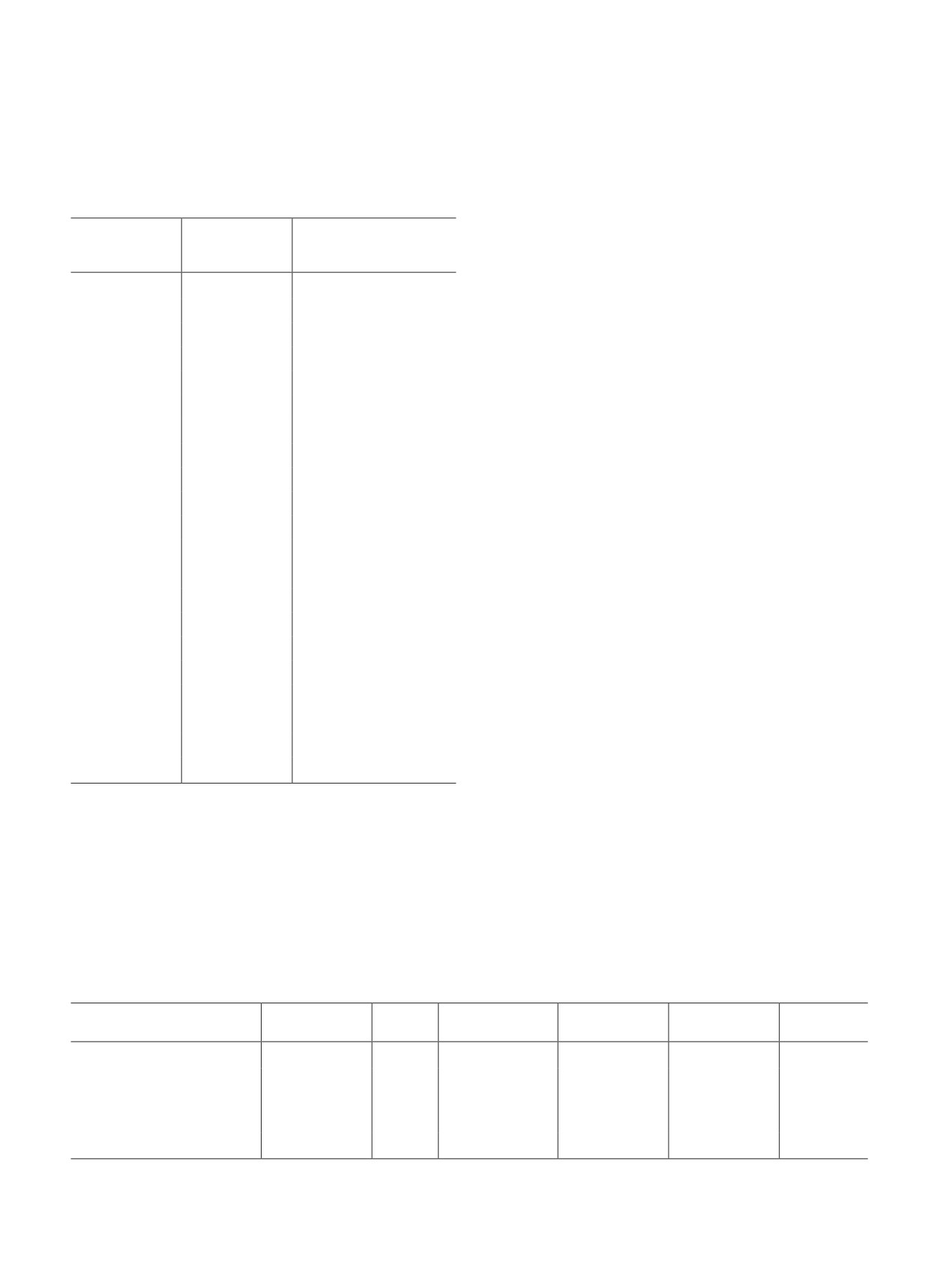
ется с равным количеством образующихся изомерных
форм гидропероксидов, путь их образования пред-
(x - 1 + 23)nкислот = mсолей,
(1)
ставлен на схеме (I) [12]. Присутствие кислот также
подтверждается сигналом в области 180.00 ppm, ха-
где x — молекулярная масса кислоты (г·моль-1),
рактерным для —COOH групп,* и титриметрически
nкислот — общее количество кислот в водной фазе
(табл. 3). Образование кислоты с девятью атомами
(моль), mсолей — масса полученных солей при ней-
углерода объясняется процессами разрыва двойных
трализации (г).
связей при С9 С10 через промежуточное образова-
ние гидропероксида и альдегида — нонаналя [12].
В свою очередь образование октановой кислоты не-
Обсуждение результатов
посредственно сопряжено с протекающими процес-
В ходе окисления метиловых эфиров жирных кис-
сами изомеризации положения двойной связи [13].
лот оливкового и подсолнечного масел в ледяной
Ввиду того что накопление октановой и нонановой
ловушке наблюдали накопление двухфазной смеси,
кислот связано с образованием октаналя и нонаналя
состоящей из органического (верхний) и водного
соответственно, логично предположить, что в смеси
(нижний) слоев.
содержатся именно эти альдегиды.
Собранные в ледяную ловушку органические и
Согласно данным литературных источников,
водные фазы разделили путем отстаивания в пробир-
альдегиды способны вступать в реакцию Байера-
ках в течение 1 сут. Верхние слои отделили и просу-
Виллигера с надкислотами [14, 15], в том числе при
шили с помощью CaSO4. Поскольку сырье представ-
окислении кислородом воздуха [16], пероксидом во-
ляет собой соединения, характеризующиеся малым
дорода [17] и органическими гидропероксидами [18,
давлением насыщенных паров (низкой летучестью), в
19], с образованием эфиров муравьиной кислоты.
ледяной ловушке маловероятно накопление большо-
Характерным для формиатов на 1Н ЯМР-спектрах яв-
го количества исходных метиловых эфиров жирных
ляется сигнал в области 8.05-8.10 ppm, соответству-
кислот.
ющий протону в кислотном остатке.** Окисление
При сравнении ИК-спектров органических фаз
альдегидов в формиаты протекает по механизму, опи-
легких фракций, полученных в ходе окисления ме-
санному в работе G. R. Krow [20].
тиловых эфиров жирных кислот оливкового и под-
Следует отметить, что в реакцию Байера-Вилли-
солнечного масел, установили, что существенные
гера могут вступать и ненасыщенные альдегиды.
различия наблюдаются лишь в области 977 см-1. Это
полоса характерна для двойных связей, несовпадение
* Pretsch E., Biihlmann P., Affolter C. Structure
интенсивностей сигналов согласуется с различиями
determination of organic compounds: Tables of spectral
величин иодного числа в пробах. Разница в поло-
data. Berlin; Heidelberg; New York; Barcelona; Hong Kong;
жении пика 1720-1711 см-1 обусловлена различи-
London; Milan; Paris; Singapore; Tokyo: Springer, 2000.
ем строения соединений, обладающих карбониль-
P. 136.
** Pretsch E., Biihlmann P., Affolter C. Structure
ной группой. Следует отметить, что для исходных
determination of organic compounds: Tables of spectral
метиловых эфиров жирных кислот не характерно на-
data. Berlin; Heidelberg; New York; Barcelona; Hong Kong;
личие сигналов в области 977 ( C C
) и 1720 см-1
London; Milan; Paris; Singapore; Tokyo: Springer, 2000.
( C O).
P. 220-221.
Образование муравьиной кислоты и ее эфиров при окислении метиловых эфиров жирных кислот
107
Таблица 2
ненасыщенной связи в подобных соединениях (6.86 и
Основные сигналы ЯМР-спектров легких продуктов
4.67 ppm) и при оксирановом цикле (4.63 и 3.30 ppm)
окисления метиловых эфиров жирных кислот
не обнаружены в обоих образцах.
оливкового и подсолнечного масел
При изучении 13C ЯМР-спектра легких продук-
тов окисления метиловых эфиров жирных кислот
Химический
Спектр ЯМР
сдвиг сигнала
Функциональная группа
подсолнечного масла не удалось установить нали-
(область), ppm
чие в смеси С9 — альдегидов, однако обнаружили
1Н
0.80
—CH3
α-октеналь — слабые сигналы в областях 158.00
(—CH CH—COH) и 133.03 ppm (—CH CH—COH)
1.27
—CH2—
[9, 10].
1.57
β-CH2—
Наличием в образце легких продуктов окисления
2.00-2.50
α-CH2—
метиловых эфиров жирных кислот подсолнечного
3.64
—С(O)OCH3
масла ненасыщенных альдегидов объясняется боль-
4.05-4.15
HCOO—CH2—
шая величина иодного числа по сравнению с образ-
цом, полученным при окислении метиловых эфиров
8.05-8.10
HC(O)O—
жирных кислот оливкового масла (табл. 2). В изу-
9.50
—CH CH—C(O)H
ченных образцах не были обнаружены α-ненасы-
9.75
—CH2—CH2—C(O)H
щенные эфиры — 120.69 (R—CH CH—COOCH3);
13C
14.08
—CH3
149.27 ppm (R—CH CH—COOCH3) и α-ненасы-
22.70
CH3—CH2—
щенные кислоты — 122.22 (R—CH CH—COOH),
149.92 ppm (R—CH CH—COOH).
25.07
β-CH2—
Поскольку в изученных образцах обнаружены
29.00-31.50
—CH2—
альдегиды, логично было предположить и наличие
34.06
α-CH2—
в исследованных смесях второго продукта разрыва
51.40
—С(O)OCH3
двойной связи — метилового эфира оксокислот [9].
64.10
HC(O)O—CH2—
Одновременное присутствие на ЯМР-спектрах сигна-
лов, соответствующих сложноэфирной и альдегидной
133.03
—CH CH—C(O)H
группам, позволяет сделать вывод об образовании
158.00
—CH CH—C(O)H
метиловых эфиров оксокислот в ходе окисления ме-
161.50
HC(O)O—
тиловых эфиров жирных кислот.
170.40
—C(O)OCH3
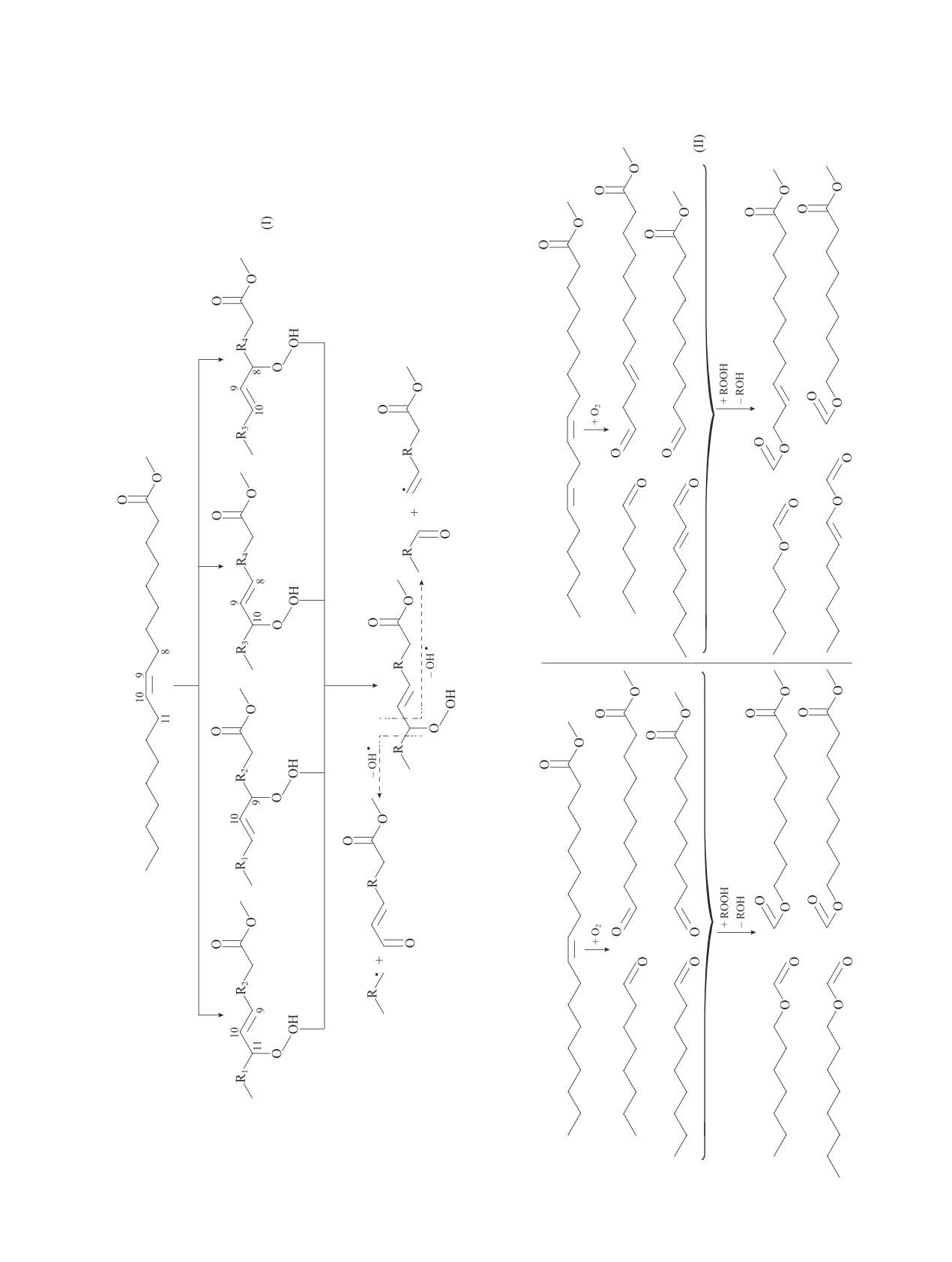
Исходя из строения образующихся в ходе окис-
180.00
—COOH
ления метиловых эфиров жирных кислот альдеги-
дов, можно предположить структуру образующихся
эфиров муравьиной кислоты, путь их образования
Согласно работе Z. Pikh, на первом этапе взаимодей-
приведен на схеме (II).
ствия альдегидов с надкислотой образуются α-нена-
На 1Н ЯМР и 13С ЯМР-спектрах образца легких
сыщенные формиаты, на втором — эпоксипроизвод-
веществ, образовавшихся при окислении метило-
ные сложных эфиров [15]. Однако характерные пики
вых эфиров жирных кислот, были обнаружены слож-
Таблица 3
Характеристики легких фракций, образовавшихся при окислении 150 г метиловых эфиров жирных кислот
подсолнечного и оливкового масел при 110°C и подаче воздуха 25 мл·с-1 до 95% конверсии двойных связей
Кислотное число,
Иодное число,
Эфирное число,
Образец
Слой
Масса, г
Окраска
мг KОН/г
г/100 г
мг KОН/г
Метиловые эфиры жирных
Органический
6.5
117
24
125
Желтая
кислот подсолнечного
Водный
3.0
280
—
—
б/ц
масла
Метиловые эфиры жирных
Органический
4.0
157
3
180
б/ц
кислот оливкового масла
Водный
10.0
190
—
—
б/ц
Примечание. «—» — не измеряли, б/ц — бесцветная.
Образование муравьиной кислоты и ее эфиров при окислении метиловых эфиров жирных кислот
109
ные эфиры муравьиной кислоты. Изучение спектров
Результаты расчетов говорят о наличии в образце
чистых веществ* дало объяснение сигналам в об-
водной фазы легких продуктов окисления метиловых
ластях 8.05-8.10 (HCOO—CH2—), 4.05-4.15 ppm
эфиров жирных кислот оливкового масла муравьиной
(HCOO—CH2—). На 13С ЯМР-спектрах продуктов
кислоты (молекулярная масса — 46 г·моль-1), в слу-
окисления оливкового масла общими для эфиров
чае метиловых эфиров жирных кислот подсолнечного
муравьиной кислоты являются сигналы атомов угле-
масла — уксусной кислоты (молекулярная масса —
рода в составе формиатной группы (161.50 ppm) и
60 г·моль-1).
α-углеродного атома (64.10 ppm). Из-за того что ме-
Согласно результатам множества исследований,
тиловые эфиры жирных кислот подсолнечного мас-
в ходе окисления метиловых эфиров жирных кислот
ла представляют собой сырье с большей степенью
растительных масел молекулярным кислородом от-
ненасыщенности исходных соединений, в ходе их
мечается образование преимущественно муравьиной
окисления образуется больший спектр продуктов.
и в меньшей мере уксусной среди кислот в составе
Поэтому не все вещества из представленных на схеме
легколетучих продуктов при хранении метиловых
выше удалось идентифицировать как индивидуаль-
эфиров соевого, пальмового масла и их смесей [24],
ные.
изучении стабильности масел и биодизелей методом
Следует обратить внимание на существенное раз-
Rancimat [25]. Согласно результатам работы [26],
личие в окраске органических фаз собранных образ-
скорости образования муравьиной и уксусной кислот
цов (табл. 3). Наблюдаемое различие объясняется
намного больше, чем скорости образования других
большим количеством α-ненасыщенных альдеги-
кислот при окислении метиловых эфиров жирных
дов в продуктах окисления метиловых эфиров жир-
кислот. При этом независимо от состава исходного
ных кислот подсолнечного масла, что подтверждено
сырья (соотношение моно-, ди- и полиненасыщенных
методом ЯМР-спектроскопии и титриметрически
эфиров) кислоты С1-С2 являются преобладающими
(табл. 3 — иодное число). Цветность таких соеди-
продуктами. Как уже отмечалось ранее, образование
нений обусловлена наличием сопряженной системы
кислот в ходе окисления метиловых эфиров жирных
между двойной связью в α-положении и кислородом
кислот непосредственно связано с образованием ги-
в карбонильной группе [21]. Также окраска может
дропероксидов и разрывом связей в их молекулах.
являться следствием образования малых количеств
Однако данным механизмом не объясняется наличие
продуктов конденсации альдегидов в кислотной среде
в образцах кислот с одним и двумя атомами углерода.
(КЧ = 117-157 мг KОН/г) [22], в том числе в процессе
Авторами работ [26-29] предполагается, что путь
окисления масел [23].
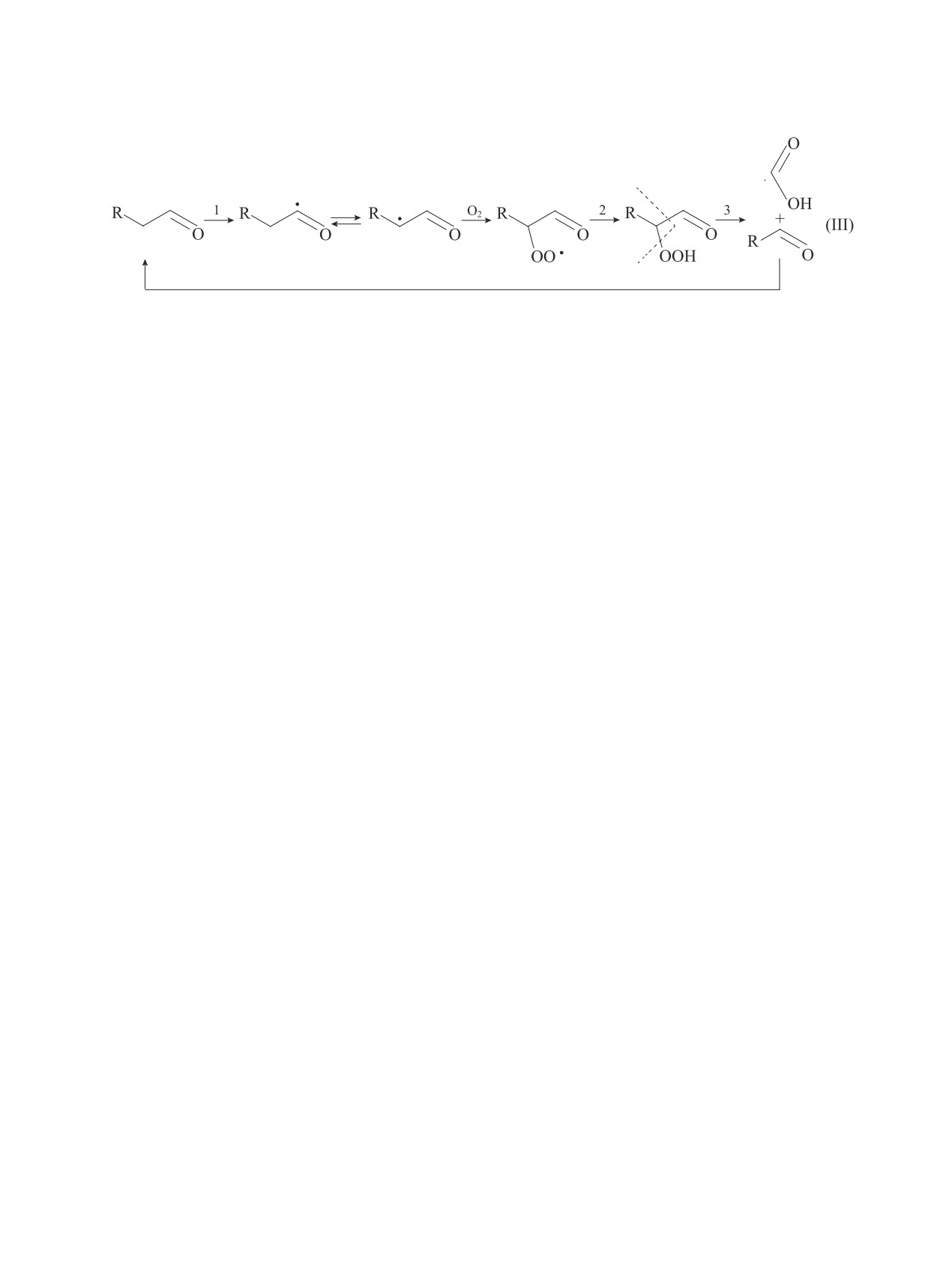
образования муравьиной кислоты представляет собой
В ходе изучения собранных образцов легких фрак-
циклический процесс окисления альдегидов. На пер-
ций окисления метиловых эфиров жирных кислот
вом этапе (1) происходит образование двух резонанс-
оливкового и подсолнечного масел большой инте-
ных форм карбонильных радикалов, один из которых
рес вызвало высокое значение кислотного числа у
превращается в α-гидропероксид (2). Последний в
водных фаз — 190 и 280 мг KОН/г (табл. 3). Ввиду
свою очередь распадается (3) с образованием му-
того что остальные вещества обладают малой рас-
равьиной кислоты [схема (III)].
творимостью в воде, логично предположить, что в
Помимо описанного выше пути образования му-
водной фазе из органических соединений растворены
равьиной кислоты в условиях проведения наших
преимущественно кислоты. Следует принимать во
экспериментов необходимо учитывать и гидролиз
внимание, что эти кислоты хорошо растворимы в во-
эфиров на границе раздела органической и водной
де, следовательно, относятся к низшим карбоновым
фаз в ледяной ловушке, что может приводить к
кислотам С1-С4, которые полностью растворимы в
дополнительному образованию кислоты. Однако
воде в отличие от ограниченно растворимых кислот
в органической фазе спирты обнаружены не бы-
С5+.**
ли. Следовательно, данной реакцией можно прене-
бречь.
В свою очередь причиной образования уксусной
кислоты может являться атака по β-углероду моле-
Database, 2023.
кулы альдегида, что предполагает более сложное
резонансное равновесие в цепном механизме, пред-
of Medicine National Center for Biotechnology Information,
2023.
ложенном M. Loury [27, 29].
110
Савельев Е. А. и др.
Выводы
Сапунов Валентин Николаевич, д.х.н.
Существенное различие состава легких продуктов
окисления метиловых эфиров жирных кислот подсол-
нечного и оливкового масел заключается в большем
Список литературы
количестве α-ненасыщенных альдегидов, образова-
ние которых непосредственно связано с наличием
[1]
Horvat R. J., Mcfadden W. H., Ng H., Lee A., Fuller G.,
двух двойных связей в молекуле метилового эфира
Applewhite T. H. Volatile products from room
линолевой кислоты. Сложные эфиры муравьиной
temperature autoxidation of cis,cis-6, 9-octadecadiene.
кислоты образуются в ходе взаимодействия между
Analysis by combined gas chromatography-mass
альдегидами и гидропероксидами по реакции Байера-
spectrometry // J. Am. Oil Chem. Soc. 1969. V. 46.
Виллигера. Помимо указанных выше соединений в
[2]
May W. A., Peterson R. J., Chang S. S. Chemical
ходе окисления метиловых эфиров жирных кислот
reactions involved in the deep- fat frying of foods: IX.
образуются низкомолекулярные водорастворимые
Identification of the volatile decomposition products
кислоты С1-С2. Среди продуктов установлено нали-
of triolein // J. Am. Oil Chem. Soc. 1983. V. 60. N 5.
чие муравьиной кислоты в случае мононенасыщен-
ного сырья и уксусной кислоты в случае высокого со-
[3]
Chang S. S., Peterson R. J., Ho C. T. Chemical reactions
держания диненасыщенного компонента в исходном
involved in the deep-fat frying of foods // J. Am. Oil
сырье. В ходе проведенного исследования изучены
Chem. Soc. 1978. V. 55. N 10. P. 718-727.
пути превращений гидропероксидов и спектр образу-
ющихся легких продуктов при окислении метиловых
[4]
Сапунов В. Н., Юдаев С. А., Черепанова А. Д.,
эфиров жирных кислот кислородом воздуха.
Ивашкина Е. Н., Воронов М. С., Козловский Р. А.
Особенности процесса эпоксидирования метило-
вых эфиров жирных кислот в барботажном реак-
Благодарности
торе // ЖПХ. 2020. Т. 93. № 5. С. 697-704. https://
Работа выполнена в рамках государственного за-
дания Министерства науки и высшего образования
Cherepanova A. D., Voronov M. S., Kozlovskiy R. A.,
Российской Федерации (FSSM-2023-0004). Измерения
Yudaev S. A., Ivashkina E. N. Features of epoxidation
ИК-спектров выполняли на оборудовании Центра кол-
of fatty acid methyl esters in a bubble reactor // Russ. J.
лективного пользования им. Д. И. Менделеева в рам-
Appl. Chem. 2020. V. 93. N 5. P. 704-711.
ках государственного контракта № 13.ЦКП.21.0009.
[5]
Cherepanova A., Savelʹev E., Alieva L., Kuznetsova I.,
Sapunov V. A new green method for the production
Конфликт интересов
polyvinylchloride plasticizers from fatty acid methyl
esters of vegetable oils // J. Am. Oil Chem. Soc. 2020.
Авторы заявляют об отсутствии конфликта инте-
V. 97. N 11. P. 1265-1272.
ресов, требующего раскрытия в данной статье.
[6]
Guillén M. D., Ruiz A. Monitoring of heat-induced
Информация об авторах
degradation of edible oils by proton NMR // Eur. J.
Lipid Sci. Technol. 2008. V. 110. N 1. P. 52-60.
Савельев Евгений Алексеевич
[7]
Sacchi R., Falcigno L., Paduano A., Ambrosino M. L.,
Savarese M., Degiulio B., Addeo F., Paolillo L. Quantitative
Черепанова Анна Дмитриевна, к.х.н.
evaluation of the aldehydes formed in heated vegetable
oils using high resolution proton-NMR spectroscopy
// Riv. Ital. Sostanze Grasse. 2006. V. 82. P. 257-263.
Образование муравьиной кислоты и ее эфиров при окислении метиловых эфиров жирных кислот
111
[8]
Alexandri E., Ahmed R., Siddiqui H., Choudhary M.,
[19]
Гольдман О. В., Перкель А. Л., Смирнова Т. Я.,
Tsiafoulis C., Gerothanassis I. High resolution NMR
Фрейдин Б. Г. О превращении высших α-дикетонов
spectroscopy as a structural and analytical tool for
под действием некоторых пероксидных продук-
unsaturated lipids in solution // Molecules. 2017.
тов окисления алканов // ЖПХ. 1984. Т. 57. № 8.
V. 22. N 10. P. 1663-1690.
С. 1830-1835.
[20]
Krow G. R. The Baeyer-Villiger oxidation of ketones
[9]
Guillén M. D., Goicoechea E. Toxic oxygenated α,β-
and aldehydes // Org. React. 1993. V. 43. P. 251-798.
unsaturated aldehydes and their study in foods: A
Review // Crit. Rev. Food Sci. Nutr. 2008. V. 48. N 2.
[21]
Теренин А. Н. Фотоника молекул красителей и род-
P. 119-136.
ственных органических соединений. Л.: Наука,
1967. С. 55-60.
[10]
Frankel E. N. Lipid oxidation. Amsterdam: Elsevier,
[22]
Garland R. M., Elrod M. J., Kincaid K., Beaver M. R.,
1980. P. 89-90.
Jimenez J. L., Tolbert M. A. Acid-catalyzed reactions
[11]
Moumtaz S., Percival B. C., Parmar D.,
of hexanal on sulfuric acid particles: Identification
Grootveld K. L., Jansson P., Grootveld M. Toxic
of reaction products // Atmos. Environ. 2006. V. 40.
aldehyde generation in and food uptake from culinary
N 35. P. 6863-6878.
oils during frying practices: Peroxidative resistance of
a monounsaturate-rich algae oil // Sci. Reports. 2019.
[23]
Abreu I., Da Costa N. C., van Es A., Kim J.-A.,
V. 9. N 1. P. 4125-4146.
Parasar U., Poulsen M. L. Natural occurrence of aldol
condensation products in valencia orange oil // J. Food
[12]
Frankel E. N. Chemistry of autoxidation: Mechanism,
Sci. 2017. V. 82. N 12. P. 2805-2815.
products and flavor significance // Eds D. B. Min,
T. H. Smouse. Flavor chemistry of fats and oils.
[24]
Souza P. T., Silva W. L. G., Meirelles A. J. A., Tubino
Champaign, III // J. Am. Oil Chem. Soc. 1985. P. 1-34.
M. Monitoring the short-chain carboxylic acids
[13]
Flitsch S., Neu P. M., Schober S., Kienzl N.,
produced during the storage of different fatty
Ullmann J., Mittelbach M. Quantitation of aging
composition biodiesels and their binary blends using
products formed in biodiesel during the rancimat
ion chromatography // Fuel. 2021. V. 289. P. 119943-
accelerated oxidation test // Energy Fuels. 2014. V. 28.
[25]
deMan J. M., deMan L. Automated AOM test for fast
[14]
Перкель А. Л., Воронина С. Г., Боркина Г. Г. Роль
stability // J. Am. Oil Chem. Soc.1984. V. 61. N 3.
реакции Байера-Виллигера в процессах жидкофаз-
ного окисления органических соединений // Изв.
[26]
Souza P. T., Ansolin M., Batista E. A. C.,
АH. Сер. хим. 2018. Т. 67. № 5. С. 779-786. EDN:
Meirelles A. J. A., Tubino M. Kinetic of the formation
RPTCOF [
Perkel А. L., Voronina S. G., Borkina G. G.
of short-chain carboxylic acids during the induced
The role of the Baeyer-Villiger reaction in the liquid-
oxidation of different lipid samples using ion
phase oxidation of organic compounds // Russ. Chem.
chromatography // Fuel. 2017. V. 199. N 1. P. 239-
Bull. 2018. V. 67. N 5. P. 779-786.
[27]
Loury M. Possible mechanisms of autoxidative
[15]
Pikh Z., Nebesnyi R., Ivasiv V., Pich A., Vynnytska S.
rancidity // Lipids. 1972. V. 7. P. 671-675.
Oxidation of unsaturated aldehydes by peracetic acid
// Chem. Chem. Technol. 2016. V. 10. N 4. P. 401-411.
[28]
Котельникова Т. С., Воронина С. Т., Перкелъ А. Л.
Образование муравьиной кислоты и циклогексил-
[16]
Lehtinen C., Brunow G. Factors affecting the
формиата в процессе окисления циклогексана //
selectivity of air oxidation of 2-ethyhexanal, an
a-branched aliphatic aldehyde // Org. Process. Res.
[Kotelʹnikova T. S., Voronina S. G., Perkelʹ A. L.
Dev. 2000. V. 4. P. 544-549.
Formation of formic acid and cyclohexyl formate
in oxidation of cyclohexane // Russ. J. Appl. Chem.
[17]
Hassall C. H. The Baeyer-Villiger oxidation of
2006. V. 79. N 3. P. 416-420.
aldehydes and ketones // Org. React. 2011. V. 9. P. 73-
[29]
deMan J. M., Tie F., deMan L. Formation of short
[18]
Yaremenko I. A., Vilʹ V. A., Demchuk D. V.,
chain volatile organic acids in the automated AOM
Terentʹev A. O. Rearrangements of organic peroxides
method // J. Am. Oil Chem. Soc. 1987. V. 64. N 7.
and related processes // Beilstein J. Org. Chem. 2016.
V. 12. P. 1647-1748.