850
Давыдова П. В., Королев В. А.
Журнал прикладной химии. 2023. Т. 96. Вып. 11
УДК 546.95:546.05:66.081
ИЗВЛЕЧЕНИЕ РОДИЯ, РУТЕНИЯ, ПАЛЛАДИЯ ГЕКСАЦИАНОФЕРРАТОМ(II)
ЖЕЛЕЗА(III) ИЗ АЗОТНОКИСЛЫХ И СОЛЯНОКИСЛЫХ РАСТВОРОВ
© П. В. Давыдова, В. А. Королев
АО «Радиевый институт им. В. Г. Хлопина»,
194021, г. Санкт-Петербург, 2-й Муринский пр., д. 28
Поступила в Редакцию 26 ноября 2023 г.
После доработки 22 декабря 2023 г.
Принята к публикации 29 декабря 2023 г.
Приведены результаты исследования возможности извлечения Rh, Ru и Pd с использованием
Fe4[Fe(CN)6]3 из азотнокислых и солянокислых растворов. Определены условия практически полного
извлечения суммы металлов платиновой группы из азотнокислых растворов в интервале концентра-
ций кислоты 1-5 М. Из солянокислых растворов Rh и Ru можно извлечь при концентрации кислоты
0.1-0.5 М. Pd полностью извлекается как из азотно-, так и солянокислых растворов концентрацией
1-5 М. Из модельных растворов переработки отработавшего ядерного топлива вместе с Rh, Ru и Pd
в разной степени извлекаются также Cs, Mo и Zr. Изотермы сорбции Rh и Ru описываются уравнени-
ем Ленгмюра. Изотерма сорбции Pd имеет нестандартную двухступенчатую форму. Fe4[Fe(CN)6]3
может быть рекомендован для извлечения металлов платиновой группы из технологических рас-
творов, в том числе растворов переработки отработавшего ядерного топлива и отработанных
катализаторов.
Ключевые слова: Fe4[Fe(CN)6]; Rh; Ru; Pd; изотерма сорбции; извлечение металлов; технологические
растворы; платиновые металлы
DOI: 10.31857/S0044461823110026; EDN: CLSSYE
Большой спрос и высокая стоимость металлов
в широких пределах. Часто используемым методом
платиновой группы стимулируют поиск путей по-
обращения с жидкими высокоактивными отходами
вторного использования материалов, содержащих эти
является остекловывание. Наличие в высокоактив-
металлы. К таким материалам относятся растворы
ных отходах металлов платиновой группы вызывает
гальванических производств, катализаторы хими-
некоторые эксплуатационные проблемы, например,
ческой и нефтехимической промышленности, авто-
осаждение Ru, Rh и Pd в ходе плавления стекломассы
мобильные катализаторы, мембранные палладиевые
на дно аппарата, из-за чего возникают технические
катализаторы для получения сверхчистого водорода,
трудности при выдаче стекломассы в контейнер [2, 3].
материалы электронной техники, медицины и т. п.
Известны способы извлечения металлов платино-
Значительное количество металлов платиновой
вой группы с помощью гексацианоферратов металлов
группы (несколько килограммов Rh, Ru, Pd на 1 т
[3-5]. В работе [4] предпринята попытка применить
отработавшего ядерного топлива [1]) нарабатывается
Al4[Fe(CN)6]3 для совместного извлечения металлов
в реакторах атомных электростанций и находится
платиновой группы из модельных растворов перера-
в растворах переработки отработавшего ядерного
ботки отработавшего ядерного топлива. Из растворов
топлива. Как правило, промышленные растворы,
HNO3 концентрацией 1.5 М и концентрациями Ru, Rh
содержащие металлы платиновой группы, — это
и Pd 1700, 4400 и 2000 мг∙л-1 соответственно удалось
солянокислые растворы. Платиновые металлы со-
полностью извлечь Pd, менее 50% Ru и лишь около
держатся также в азотнокислых растворах перера-
1% Rh.
ботки отработавшего ядерного топлива, в которых
Авторами ранее была исследована возможность
концентрации Ru, Rh, Pd и HNO3 могут изменяться использования Fe4[Fe(CN)6]3, получаемого in situ,
Извлечение родия, рутения, палладия гексацианоферратом(II) железа(III) из азотнокислых и солянокислых растворов
851
для извлечения Pd из азотнокислых растворов пе-
при непрерывном перемешивании на магнитной ме-
реработки отработавшего ядерного топлива [6]. Pd
шалке в течение 24 ч. После остывания и отстаивания
в описанных в работе условиях извлекается количе-
(6-8 ч) декантировали раствор с осадка в круглодон-
ственно независимо от концентрации HNO3 в интер-
ную колбу и кипятили с обратным холодильником
вале 1-5 М.
48 ч. Остывший раствор фильтровали через бумаж-
Применение гексацианоферратов металлов может
ный фильтр.
также вызывать интерес у исследователей для одновре-
Для приготовления азотнокислого модельного рас-
менного совместного извлечения некоторых металлов
твора переработки отработавшего ядерного топлива
платиновой группы из растворов добычи природных
использовали Sr(NO3)2, Ba(NO3)2, Ce(NO3)3∙6H2O,
ископаемых или переработки изделий, содержа-
Eu(NO3)3∙6H2O, Cs(NO3)3, приготовленные растворы
щих Ru, Rh и Pd концентрацией до 200-300 мг∙л-1.
UO2(NO3)2 и Zr(NO3)4, а также H2MoO4.
Цель работы — оценка возможности применения
Fe4[Fe(CN)6]3 синтезировали из водных раство-
Fe4[Fe(CN)6]3 для совместного извлечения Rh, Ru,
ров K4[Fe(CN)6] и FeCl3 по методике, описанной
Pd из азотнокислых и солянокислых растворов, в том
в [10]. Полученный материал тщательно отмыва-
числе из модельных растворов переработки отрабо-
ли дистиллированной водой от ионов K+ и Cl-, за-
тавшего ядерного топлива.
тем сушили при температуре 100°С до постоянной
массы. Дистиллированную воду получали на элек-
трическом аквадистилляторе (Labdevices-10LIII,
Экспериментальная часть
UED Group).
В работе использовали Ru(OH)Cl3 (х.ч., ОАО
Определение концентраций элементов в раство-
«Аурат»), RhCl3∙4H2O (х.ч., ОАО «Аурат»), палладий
рах осуществляли методом оптически-эмиссионной
металлический в порошке (х.ч., ОАО «Красцветмет»),
спектрометрии с индуктивно связанной плазмой с
HNO3 (х.ч., ОАО «Каустик»), HCl (х.ч., ОАО
помощью прибора ICP OES (Varian 725-ES Radial).
«Каустик»), медные листы (М1, ООО «Металлика»), а
Степень извлечения благородных металлов опре-
также реактивы марки «ч.»: K4[Fe(CN)6], FeCl3∙9H2O,
деляли в режиме статической сорбции. В стеклянные
Ag(NO)3, Sr(NO3)2, Ba(NO3)2, Ce(NO3)3, Eu(NO3)3 —
колбы помещали 400 мг сорбента и 40 см3 рабочего
и «ч.д.а.»: ZrO(NO3)2∙2H2O, H2MoO4 (все — АО
раствора солей индивидуальных металлов концен-
«ЛенРеактив»).
трацией 200 мг∙л-1. Суспензию перемешивали при
Азотнокислый и солянокислый растворы Rh полу-
заданной температуре со скоростью 200 об∙мин-1
чали растворением навески RhCl3∙4H2O в 12 М HNO3
и через определенные промежутки времени или по
и трижды упаривали до влажных кристаллов. Затем
окончании перемешивания отбирали пробы жидкой
осадок растворяли в 8 М HNO3. Для получения рас-
фазы.
твора хлорида родия навеску RhCl3∙4H2O растворяли
Степень извлечения металлов (R, %) рассчитывали
в 6 М HCl.
по формуле
В азотнокислых растворах после растворения от-
R =
·100,
(1)
работавшего ядерного топлива Ru находится в форме
нитрозо-нитратов различного состава [7, 8]. Навеску
Ru(OH)Cl3 растворяли в 12 М HNO3 и трижды упари-
где cи — исходная концентрация металла в растворе
вали до влажных кристаллов. Затем осадок растворя-
(мг∙л-1); cp — равновесная концентрация металла в
ли в 8 М HNO3 и через полученный раствор в течение
растворе после сорбции (мг∙л-1).
24 ч пропускали смесь газов NO и NO2, полученных
Поиск оптимальных условий извлечения Rh, Ru,
по реакции металлической меди с HNO3, для получе-
Pd из азотнокислых растворов начали с проведения
ния нитрозо-нитратных комплексов Ru.
серии экспериментов по определению зависимости
Солянокислый раствор Ru получали растворением
степени извлечения металла от времени контакта с
навески Ru(OH)Cl3 в 6 М HCl.
сорбентом. Эксперименты проводили при темпера-
Азотнокислый и солянокислый растворы Pd полу-
туре 20 ± 2°С и концентрации HNO3 1 М.
чали растворением навески порошка металлического
Для построения изотерм сорбции применяли ме-
Pd в 6 М HNO3 или в 6 М HCl соответственно.
тод переменных концентраций, суть которого заклю-
Азотнокислый раствор Mo готовили согласно [9],
чается в приведении навесок сорбента одинаковой
используя HNO3 и H2MoO4.
массы в контакт с растворами различных концен-
Для получения Zr(NO3)4 навеску ZrО(NO3)2 зали-
траций металла, причем объемы растворов остаются
вали 10 М HNO3, прогревали на плитке при 50-60°С
постоянными.
852
Давыдова П. В., Королев В. А.
Для построения изотерм сорбции использовали
Обсуждение результатов
данные статической обменной емкости (СОЕ), по-
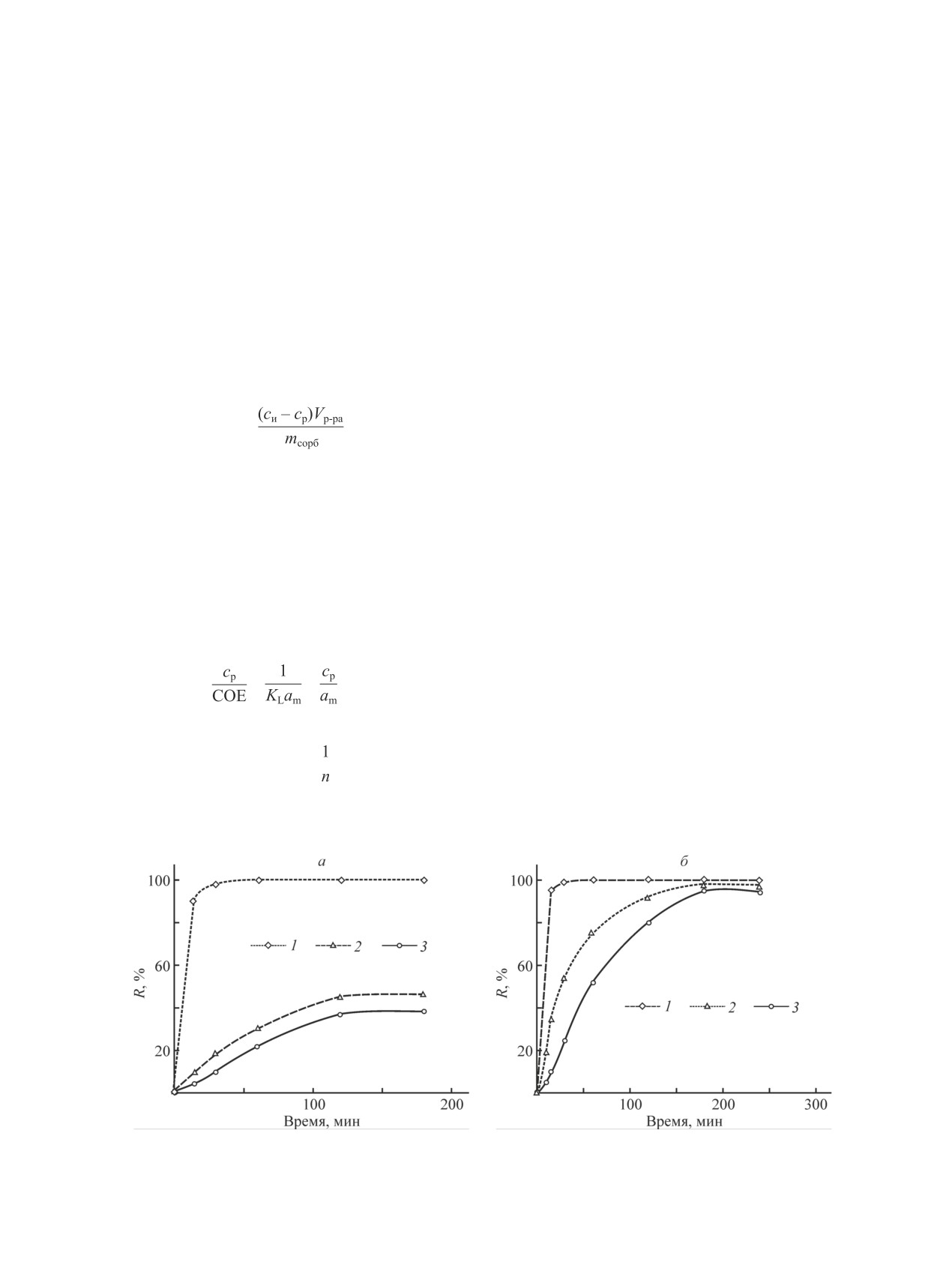
Pd из азотнокислого раствора при 20°С извлека-
лученные при концентрации HNO3 и HCl 1 М и тем-
ется нацело в течение первых 15 мин (рис. 1, a). В то
пературе 80°С. Масса навески сорбента составляла
же время извлечение Rh и особенно Ru существенно
200 мг, объем раствора — 20 см3. В эксперименте
замедляется через 15-20 мин, и за 3 ч они извлека-
использовали растворы солей индивидуальных ме-
ются не более чем на 40%, при этом достигнутая
таллов, содержащие 100-3000 мг∙л-1. Контакт фаз
степень извлечения существенно выше, чем в работе
проводили при постоянном перемешивании на ла-
[3]. Так как дальнейшее увеличение времени контакта
бораторной магнитной мешалке в течение 3 ч. По
не приводит к сколько-нибудь заметному изменению
окончании эксперимента фазы разделяли, маточники
степени извлечения Ru и Rh, длительность последу-
анализировали на содержание металлов. Значение
ющих экспериментов составляла 3 ч.
статической обменной емкости (СОЕ, мг∙г-1) сорбен-
Повышение температуры до 80°С позволяет
та по металлу рассчитывали по формуле
увеличить степень извлечения Ru и Rh более 95%
(рис. 1, б). При совместном извлечении металлов
COE =
,
(2)
платиновой группы из раствора с концентрациями
каждого металла 200 мг∙л-1, сHNO3 = 1 М при 80°С не
где Vр-ра — объем загрузки исходного раствора (дм3),
было замечено взаимного влияния металлов на сорб-
mсорб — масса навески сорбента (г).
цию. Степень извлечения Rh и Pd составила >99%, а
Для количественного описания равновесия сорб-
Ru — ~95%.
ции в интервале концентраций были использованы
Применительно к переработке отработавшего
линеаризованные уравнения моделей Ленгмюра и
ядерного топлива концентрация HNO3 в растворах
Фрейндлиха. О применимости моделей судили по
может варьироваться от 1 до 5 М. Эксперименты по
значению среднеквадратичного отклонения (R2).
извлечению Rh, Ru и Pd из растворов в указанном
Математическую обработку экспериментальных
диапазоне концентраций HNO3 проводили при темпе-
данных вели в соответствии с уравнениями изотерм
ратуре 80°С. Достигнутые величины степени извлече-
Ленгмюра (3) и Фрейндлиха (4):
ния оказались практически постоянными (95-100%).
=
+
,
(3)
Высокая степень извлечения суммы Rh, Ru и Pd де-
лает возможным использование сорбента в широком
диапазоне кислотности технологических растворов.
где KL и am — константы уравнения Ленгмюра;
Важной для технологического применения ха-
рактеристикой сорбента является его способность
lgCOE = lgKF + cp,
(4)
извлекать металлы платиновой группы из разбав-
где KF — константа Фрейндлиха [(мг1-(1/n)·(дм3)1/n)·г-1],
ленных растворов. Из 1 М азотнокислого раствора с
n — фактор гетерогенности.
концентрацией каждого металла ~5 мг∙л-1 за 3 ч при
Рис. 1. Зависимость степени извлечения металлов от времени контакта, cHNO3 =1 М; Т = 20 ± 2 (а), 80 ± 2°С (б).
1 — Pd, 2 — Rh, 3 — Rh.
Извлечение родия, рутения, палладия гексацианоферратом(II) железа(III) из азотнокислых и солянокислых растворов
853
80°С металлы платиновой группы были извлечены
творы. С этой точки зрения представляет интерес
нацело (конечная концентрация металлов оказалась
исследовать сорбционное поведение Fe4[Fe(CN)6]3
ниже предела обнаружения — для Pd — 0.02 мг∙л-1,
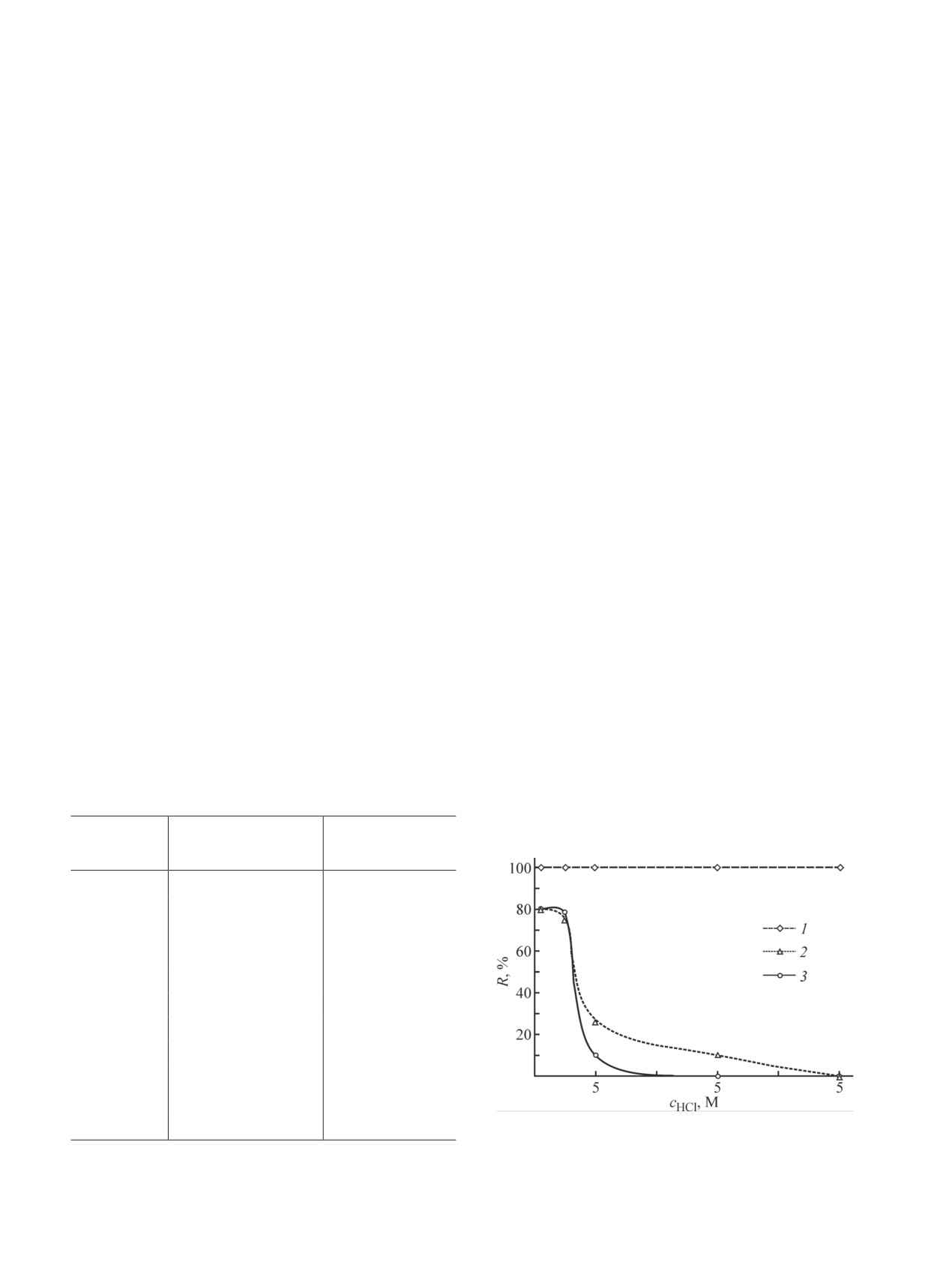
в хлоридных средах. Из солянокислых растворов в
для Rh — 0.04 мг∙л-1, для Ru — 0.02 мг∙л-1).
интервале концентраций HCl 1-5 М Pd извлекается
Возможность извлечения металлов платиновой
нацело, хотя и несколько медленнее, чем из азот-
группы из растворов переработки отработавшего
нокислых растворов. Степень извлечения Rh и Ru
ядерного топлива проверили на многокомпонентном
оказалась существенно меньше, чем из азотнокислых
модельном растворе (табл. 1). Степень совместного
растворов, и имеет ярко выраженную зависимость от
извлечения металлов платиновой группы составила
концентрации кислоты (рис. 2). Увеличение степени
>99%. Помимо благородных металлов из модельного
извлечения Rh и Ru при повышении температуры
раствора были извлечены Cs, Mo и в незначитель-
до 80°С в отличие от азотнокислых растворов не
ной степени Zr. Взаимодействие Cs с Fe4[Fe(CN)6]3
происходит.
было ожидаемо, так как гексацианоферраты различ-
Таким образом, совместное извлечение металлов
ных металлов используются для извлечения Cs из
платиновой группы можно реализовать лишь в интер-
радиоактивных отходов [11]. Попутное извлечение
вале 0.1-0.5 М HCl. В более кислой области интерес
Mo оказывает положительное влияние на качество
может представлять селективное извлечение Pd с
стеклоподобного компаунда, так как присутствие
одновременным отделением его от Rh и Ru.
ионов Mo в высокой концентрации приводит к обра-
Основываясь на значительных отличиях законо-
зованию гетерогенных стекол [12]. Полученные ре-
мерностей сорбции Pd от сорбции Ru и Rh, мож-
зультаты (табл. 1) дают основание для рассмотрения
но предположить, что эти металлы сорбируются
Fe4[Fe(CN)6]3 в качестве селективного сорбента для
Fe4[Fe(CN)6]3 по различным механизмам. О характере
извлечения металлов платиновой группы из техно-
сорбции металлов можно судить по изотермам сорб-
логических растворов переработки отработавшего
ции, которые обычно описываются классическими
ядерного топлива.
моделями Ленгмюра и Фрейндлиха.
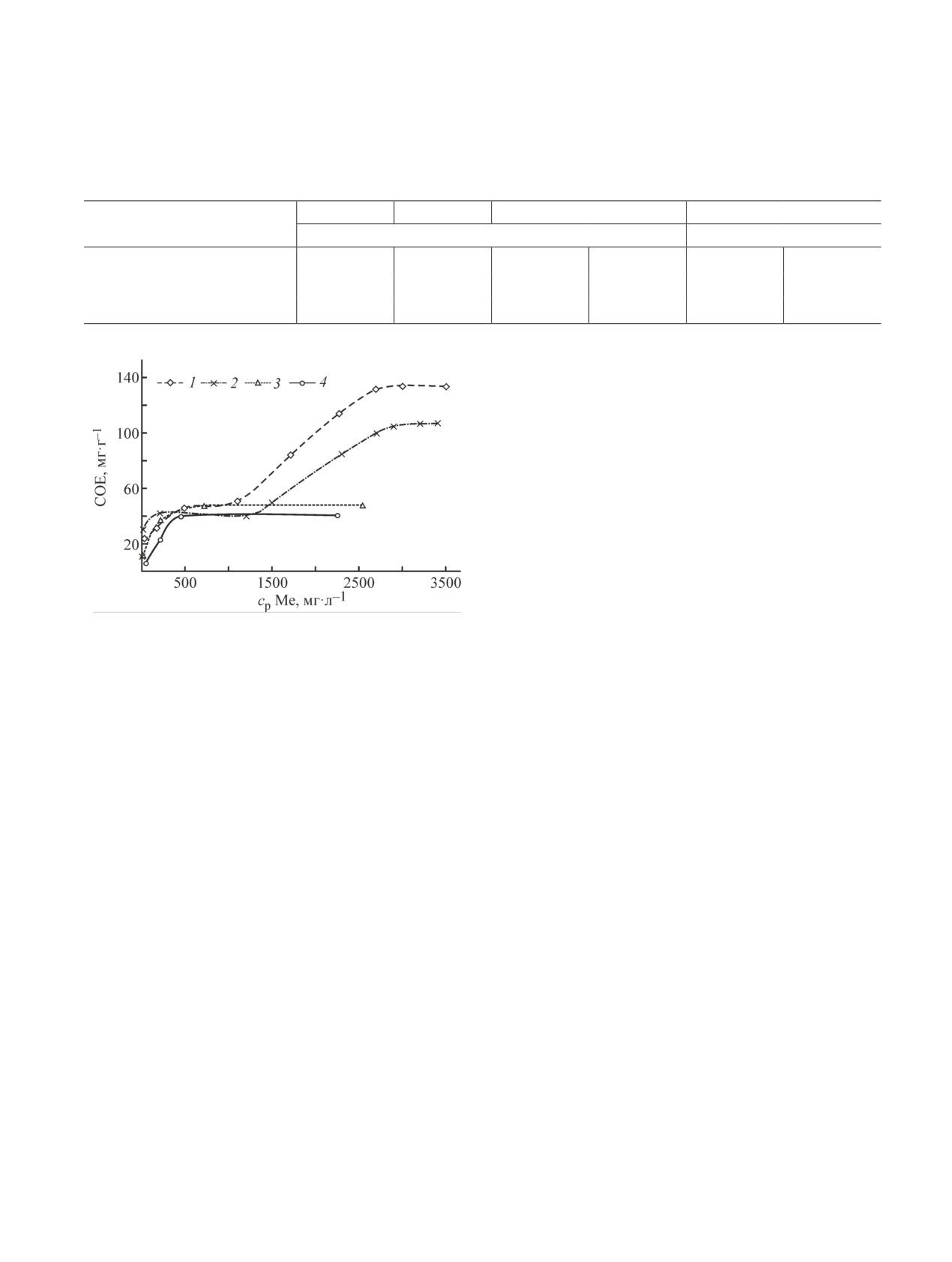
Селективное выделение металлов платиновой
В области низких концентраций изотермы сорб-
группы из солянокислых растворов имеет большое
ции Ru, Rh, Pd на Fe4[Fe(CN)6]3 (рис. 3) имеют вы-
значение в гидрометаллургической технологии аф-
пуклый профиль с крутым подъемом, который сви-
финажа благородных металлов, где практически
детельствует о возможности глубокого извлечения
повсеместно используются именно хлоридные рас-
металлов платиновой группы. При увеличении кон-
центрации металла изотермы Ru и Rh достигают
насыщения. Изотермы сорбции Pd в HNO3 и HCl
Таблица 1
имеют ступени. Согласно [13], двухступенчатый вид
Сорбция металлов Fe4[Fe(CN)6]3 из модельного
изотермы и наличие точки перегиба свидетельствуют
раствора*
о смене механизма сорбции.
Концентрация
Степень
Металл
в исходном
извлечения, %
растворе, мг∙л-1
Rh
115
>99.9
Ru
225
98.0
Pd
325
>99.9
Сs
750
>99.9
Mo
1030
53.0
Zr
380
17.0
Sr
445
<0.1
Ba
1520
<0.1
Ce
2240
<0.1
Eu
220
<0.1
U
45
<0.1
Рис. 2. Зависимость степени извлечения металла R от
* Условия проведения сорбционного процесса: 1 М
концентрации HCl.
HNO3, 80°С, время контакта — 3 ч.
1 — Pd, 2 — Rh, 3 — Ru; Т = 20°С.
854
Давыдова П. В., Королев В. А.
Таблица 2
Коэффициенты корреляции, полученные при обработке изотерм сорбции металлов Fe4[Fe(CN)6]3
с использованием моделей Ленгмюра и Фрейндлиха для всей области применяемых концентраций
Ru
Rh
Pd
Pd
Изотерма
сHNO3 = 1 М
сHCl = 1 М
Интервал СОЕ, мг∙г-1
0-40
0-45
<45
>45
<42
>42
Модель Ленгмюра
0.99
0.99
0.99
0.91
0.99
0.71
Модель Фрейндлиха
0.83
0.89
0.96
0.98
0.65
0.98
творах Pd находится в форме нитрата, по-видимому,
данная форма обеспечивает быстрое взаимодействие
с Fe4[Fe(CN)6]3 ввиду отсутствия комплексных со-
единений палладия или его олигомеров. Как было
отмечено выше [16], Rh в азотнокислых растворах
находится в форме олигомеров-нитратов. Повышение
температуры раствора, возможно, способствует пе-
реходу олигомеров Rh в форму мономера-нитрата,
что облегчает взаимодействие Rh с Fe4[Fe(CN)6]3.
Планируется продолжение работ по изучению вли-
яния температуры на сорбцию Ru с Fe4[Fe(CN)6]3.
Определены значения полной обменной емкости
Fe4[Fe(CN)6]3 по металлам, полученные в условиях
эксперимента. Согласно полученным данным, полная
Рис. 3. Изотермы сорбции Rh, Ru, Pd из индивидуаль-
обменная емкость Fe4[Fe(CN)6]3 по металлам возрас-
ных азотнокислых и солянокислых растворов.
тает в ряду Ru < Rh < Pd.
1 — Pd, 3 — Ph, 4 — Ru, cHNO3 = 1.0 М; 2 — Pd, cHCl = 1 М.
Процесс взаимодействия Ru и Rh с Fe4[Fe(CN)6]3
с максимальной вероятностью описывает уравнение
В работе [5] описывается сорбция Pd из модель-
Ленгмюра (табл. 2), о чем свидетельствуют высо-
ных растворов переработки отработавшего ядерного
кие значения коэффициента корреляции R2 — более
топлива KxNiy[NiFe(CN)6], который нанесен на SiO2
0.99. Применимость модели указывает на равноцен-
матрицу. Авторами работы предложен ионообменный
ность активных центров и однородность поверхности
и одновременно окислительно-восстановительный
Fe4[Fe(CN)6]3 по отношению к Ru и Rh.
механизм сорбции палладия, основанный на восста-
На изотерме сорбции Pd можно выделить два
новлении сорбированного палладия до Pd(0) и окис-
участка. На первоначальном участке до достижения
лении части Fe(II) до Fe(III). Сорбция Pd проходит в
значения СОЕ ~45 мг∙г-1 изотерма сорбции описыва-
соответствии с моделью изотермы Ленгмюра.
ется уравнением Ленгмюра (рис. 3). На втором участ-
В работе [14] рассматривалось взаимодействие
ке, в отличие от Rh и Ru, при дальнейшем увеличении
HAuCl4 c Fe4[Fe(CN)6]3. Авторы считают, что в резуль-
концентрации СОЕ по Pd продолжает увеличиваться,
тате взаимодействия происходит окисление Fe(II) до
достигая максимума при концентрации исходного
Fe(III) и восстановление Au(III) до Au(I) и (или) Au(0).
раствора более 2100 мг∙л-1.
Возможно, что ионообменный и одновременно
окислительно-восстановительный механизм сорбции
Выводы
является общим для взаимодействия Fe4[Fe(CN)6]3 с
соединениями платиновых металлов в азотнокислых
Показано, что Fe4[Fe(CN)6]3 обладает способно-
или солянокислых растворах. Химия Ru и Rh в азот-
стью к одновременной сорбции Ru, Rh и Pd из азот-
нокислых и солянокислых средах характеризуется
нокислых растворов, что позволяет рекомендовать
многочисленностью химических форм, медленным
сорбент для проведения испытаний на реальных рас-
переходом их друг в друга в определенных условиях
творах переработки отработавшего ядерного топлива.
и практической невозможностью перевода металла
В солянокислых растворах только Pd может быть
в единственную форму [15]. В азотнокислых рас-
извлечен количественно с помощью Fe4[Fe(CN)6]3,
Извлечение родия, рутения, палладия гексацианоферратом(II) железа(III) из азотнокислых и солянокислых растворов
855
что дает возможность применения сорбента для из-
[2]
Пат. РФ 2077600 (опубл. 1997). Способ извлечения
влечения или аффинажа палладия.
осколочного родия из азотнокислых водных рас-
творов.
[3]
Onishi T., Sekioka K., Suto M., Tanaka K., Koyama Sh.,
Благодарности
Inaba Yu., Takahashi H., Harigai M., Takeshita K.
Adsorption of platinum-group metals andmolybdenum
Авторы выражают благодарность к.х.н. А. А. Лум-
onto aluminum ferrocyanide in spent fuel solution //
пову, Л. В. Красникову за участие в обсужде-
Energy Procedia. 2017. N 131. P. 151-156.
нии результатов экспериментов, Ю. И. Корнейко,
О. Н. Егоровой, С. А. Ткаченко за приготовление
[4]
Mishima R., Inaba Yu., Tachioka S., Harigai M.,
исходных растворов солей платиновых металлов,
Watanabe Sh., Onoe J., Nakase M., Matsumura T.,
Н. В. Сапожниковой за разработку методики опреде-
Takeshita K. Sorption properties of aluminum
ления концентраций металлов платиновой группы в
hexacyanoferrate for platinum group elements //
модельных многокомпонентных растворах.
Chem. Lett. 2020. V 49. P. 83-86.
[5]
Wang Q., Sang H., Chen L., Wu Y., Wei Y. Selective
Финансирование работы
separation of Pd (II) through ion exchange and
oxidation-reduction with hexacyanoferrates from
Работа выполнена в рамках проекта «Разработка
high-level liquid waste // Sep. Purif. Technol. 2020.
технологии извлечения металлов платиновой группы
N 231. P. 1-10.
из отработавшего ядерного топлива», финансируемо-
го АО «Наука и Инновации».
[6]
Давыдова П. В., Корнейко Ю. И., Королев В. А.,
Красников Л. В., Крецер Ю. Л. Извлечение палла-
Конфликт интересов
дия из азотнокислых растворов переработки отра-
ботавшего ядерного топлива // Радиохимия. 2022.
Авторы заявляют об отсутствии конфликта инте-
Т. 64. № 3. С. 1-4.
ресов, требующего раскрытия в этой статье.
[Davydova P. V., Korneyko Yu. I., Korolev V. A.,
Krasnikov L. V., Kretser Yu. L. Recovery of palladium
Информация о вкладе авторов
from nitric acid solutions of spent nuclear fuel
П. В. Давыдова проводила эксперименты по опре-
делению условий извлечения металлов платиновой
группы в азотнокислой и солянокислых средах, ма-
[7]
Kolarik Z., Renard E. V. Recovery of value fission
тематически обрабатывала полученные изотермы
platinoids from spent nuclear fuel. Part I: General
considerations and basic chemistry // Platinum Metals
сорбции металлов; В. А. Королев осуществлял синтез
Rev. 2003. V. 47. N 2. P. 74-87.
Fe4[Fe(CN)6]3, проводил экспериментальное изучение
https://www.elibrary.ru/LHZZKL
сорбционных процессов.
[8]
Goela A., McCloyb J. S., Pokornyc R.,. Kruger A. A.
Challenges with vitrification of Hanford High-Level
Информация об авторах
Waste (HLW) to borosilicate glass — An overview //
J. Non-Cryst. Solids. 2019. V. 10. N 4.
Давыдова Полина Викторовна
[9]
Артыкбаев Т. Д., Ишанходжаев С., Чернилов-
Королев Владимир Алексеевич, к.х.н.
ская А. И., Черных Т. А. Растворение молибдена в
азотной кислоте // Химия и хим. технология редких
и цв. металлов. Сб. статей / Под ред. Н. А. Пар-
пиева, Т. Д. Артыкбаева. Ташкент: ФАН, 1974.
Список литературы
C. 123-127.
[1] Похитонов Ю. А. Выделение платиноидов из от-
[10]
Reguera E., Fernández-Bertrán J., Dago A., Diaz C.
работавшего топлива АЭС и перспективы их ис-
Mössbauer spectroscopic study of Prussian Blue
пользования // Атом. энергия. 2019. Т. 127. № 6.
from different provenances // Hyperfine Interact.
С. 332-339. https://www.elibrary.ru/WBTQWF
[11]
Воронина А. В., Семенищев В. С., Ноговицына Е. В.,
Energy. 2020. V. 127. P. 367-374.
Бетенеков Н. Д. Исследование ферроцианидных
сорбентов на основе гидратированного диоксида
856
Давыдова П. В., Королев В. А.
титана с применением физико-химических ме-
composite through galvanic replacement enhances
тодов // Радиохимия. 2012. Т. 54. № 1. С. 66-70.
stability for electrocatalysis // Chem. Select. 2017.
https://www.elibrary.ru/OXHDKH
V. 2. P. 5333-5340.
[Voronina A. V., Semenishchev V. S., Nogovitsyna E. V.,
Betenekov N. D. A study of ferrocyanide sorbents
[15] Беляев А. В. Химико-технологические проблемы
on hydrated titanium dioxide support using
платиновых металлов при переработке обработан-
ного ядерного топлива // ЖСХ. 2003. Т. 44. № 1.
V. 54. P. 69-74.
С. 39-47. https://www.elibrary.ru/OYRNAB
[Belyaev A. V. Technological problems of platinum
[12]
Magnin M., Schuller S., Caurant D., Majérus O.,
metals in nuclear fuel waste disposal // J. Struct.
Ligny D. d., Mercier C. Effect of compositional
Chem. 2003. V. 44. N 1. P. 29-36.
changes on the structure and crystallization tendency
of a borosilicate glass containing MoO3 // Ceram.
[16] Беляев А. В., Ренард Э. В., Храненко С. П.,
Trans. 2009. V. 207. P. 59-67.
Емельянов В. А., Федотов М. А. О состоянии ра-
диородия в жидких высокоактивных отходах
[13]
Пимнева Л. А., Ганяев В. П., Пахолков B. C. Сорбция
от регенерации отработавшего топлива АЭС //
двухзарядных ионов металлов из растворов MeF2-
HF(NH4F∙HF)-Н2О катионитом КФП-12 // ЖПХ.
[Belyaev A. V., Renard E. V., Khraanenko S. P.,
1982. Т. 55. № 1. С.40-46.
Emelʹyanov V. A., Fedotov M. A. State of radiorhodium
[14]
Ren B., Jones L., Oppedisano D., Kandgani Ah.,
in high-level liquid waste from regeneration of spent
Chen M., Antolasic F., Ippolito S., Bhargava S. The
preparation of a AuCN/Prussian blue nanocube