Журнал прикладной химии. 2023. Т. 96. Вып. 5
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ И МАТЕРИАЛЫ НА ИХ ОСНОВЕ
УДК 678.073/074
ОСОБЕННОСТИ ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ
ХЛОРСУЛЬФИРОВАННОГО ПОЛИЭТИЛЕНА
© А. А. Селезнев1,2, А. В. Навроцкий1, С. А. Сафронов3, В. А. Навроцкий1
1 Волгоградский государственный технический университет,
400005, г. Волгоград, пр. им. В. И. Ленина, д. 28
2 АО «Инжиниринговый центр «Кронштадт»,
197760, г. Кронштадт, Макаровская ул, д. 2, лит. Л
3 ООО «Интов-Эласт»,
404103, Волгоградская обл., г. Волжский, ул. Александрова, д. 60 В
Е-mail: aas1504@yandex.ru
Поступила в Редакцию 29 января 2021 г.
После доработки 30 ноября 2023 г.
Принята к публикации 30 ноября 2023 г.
Исследованы особенности термолиза хлорсульфированного полиэтилена и установлено, что свобод-
ные радикалы, образующиеся после одновременного гомолитического разрыва связей углерод-сера и
сера-хлор, не только реагируют друг с другом (рекомбинация или диспропорционирование), но и отры-
вают атом водорода от макромолекулы полиэтилена или этиленпропиленового каучука, обеспечивая
сшивание макромолекул, сопровождающееся повышением прочностных показателей композитов на
их основе.
Ключевые слова: хлорсульфированный полиэтилен; хлорангидриды сульфокислот; термическое раз-
ложение; термопластичные эластомеры; полиэтилен
DOI: 10.31857/S004446182305002X; EDN: RNCTOM
Термическая деградация хлорангидридов суль-
[реакция (I)] или непредельного углеводорода и HCl
фокислот, по мнению авторов [1, 2], сопровождается
[реакция II)]:
выделением SO2, соответствующего алкилхлорида
Присутствие SO2 в продуктах термолиза сульфо-
этом возникает вопрос об очередности разрыва этих
кислот с учетом изменения валентности серы прямо
связей. Известно [3] несколько молекул, которые при
свидетельствует о разрыве связей C—S и S—Cl. При
нагревании претерпевают одновременный гомолиз
459
460
Селезнев А. А. и др.
Рис. 1. Схема распада молекул по одной и двум связям [3], k1 — константа скорости распада, k-1 — константа
скорости рекомбинации первичной пары радикалов (релаксация клетки растворителя*), kD — константа скорости
диффузии первичной пары радикалов друг от друга, kβ — константа скорости (или их сумма) любого процесса
β-разрыва, конкурирующего с диффузией радикалов.
двух связей, например азоизобутиронитрил и азо-
Cl•) при согласованной деградации сульфохлоридных
кумол с разрывом двух связей C—N, а также эфиры
групп в хлорсульфированном полиэтилене и оценка
трет-бутилпероксикарбоновых кислот, у которых
роли этих радикалов в реакциях структурирования
одновременно разрушаются O—O- и C—C-связи.
макромолекул.
Анализируя термический распад молекулы с одно-
временным разрывом двух связей в сравнении с мо-
Экспериментальная часть
лекулой, в которой распадается только одна, авторы
[3] справедливо утверждают, что константы скорости
Исследованию подвергались хлорсульфированный
таких реакций должны по-разному зависеть от вяз-
полиэтилен марки Tosoh CSM TS430 (TOSOH Corp.),
кости среды, в которой проходит термолиз молекул
содержащий 35 мас% хлора и 1 мас% серы (2 мас%
(рис. 1). Однако оказалось, что этот качественный
SO2), полиэтилен высокого давления 10803-020 (ПАО
тест соблюдается не всегда [3], и вязкостного теста
«Уфаоргсинтез») и этилен-пропиленовый каучук
для доказательства согласованного (одновременного)
Vistalon 8800 (ExxonMobil) в качестве компонентов
распада молекул при их термолизе оказалось недо-
для создания термопластичных эластомеров.
статочно. Поэтому возникла необходимость в до-
Количественное определение содержания воды
полнительных критериях, позволяющих различить
в хлорсульфированном полиэтилене проводили ме-
молекулы, распадающиеся по одной или одновре-
тодом термогравиметрии с помощью анализатора
менно двум связям, которые были сформулированы
Netzsch STA 449 F3 (Netzsch) при скорости нагрева
Е. Т. Денисовым [4]. Совокупность вязкостного теста
0.05 град·мин-1 и массе образца 18.3∙10-3 г. В ре-
с кинетическими параметрами термолиза молекул
зультате зафиксировано изменение массы образца на
с учетом его успешного использования в работе [5]
0.25% в интервале температур 100-115°С, связанное с
можно считать необходимым, но не достаточным
десорбцией воды. В интервале температур 125-165°С
условием для доказательства согласованного рас-
зафиксировано снижение массы образца на 2%, что
пада молекул потому, что при этом не учитываются
связано с выделением SO2, которое соответствует его
особенности структуры и реакционной способности
теоретическому содержанию в исходном хлорсульфи-
образующихся радикалов.
рованным полиэтилене.
На основании вышеизложенного можно предпо-
Исследование газообразных продуктов термоли-
ложить, что обсуждение кинетики термолиза хлор-
за хлорсульфированного полиэтилена проводили с
сульфированного полиэтилена, сопровождающегося
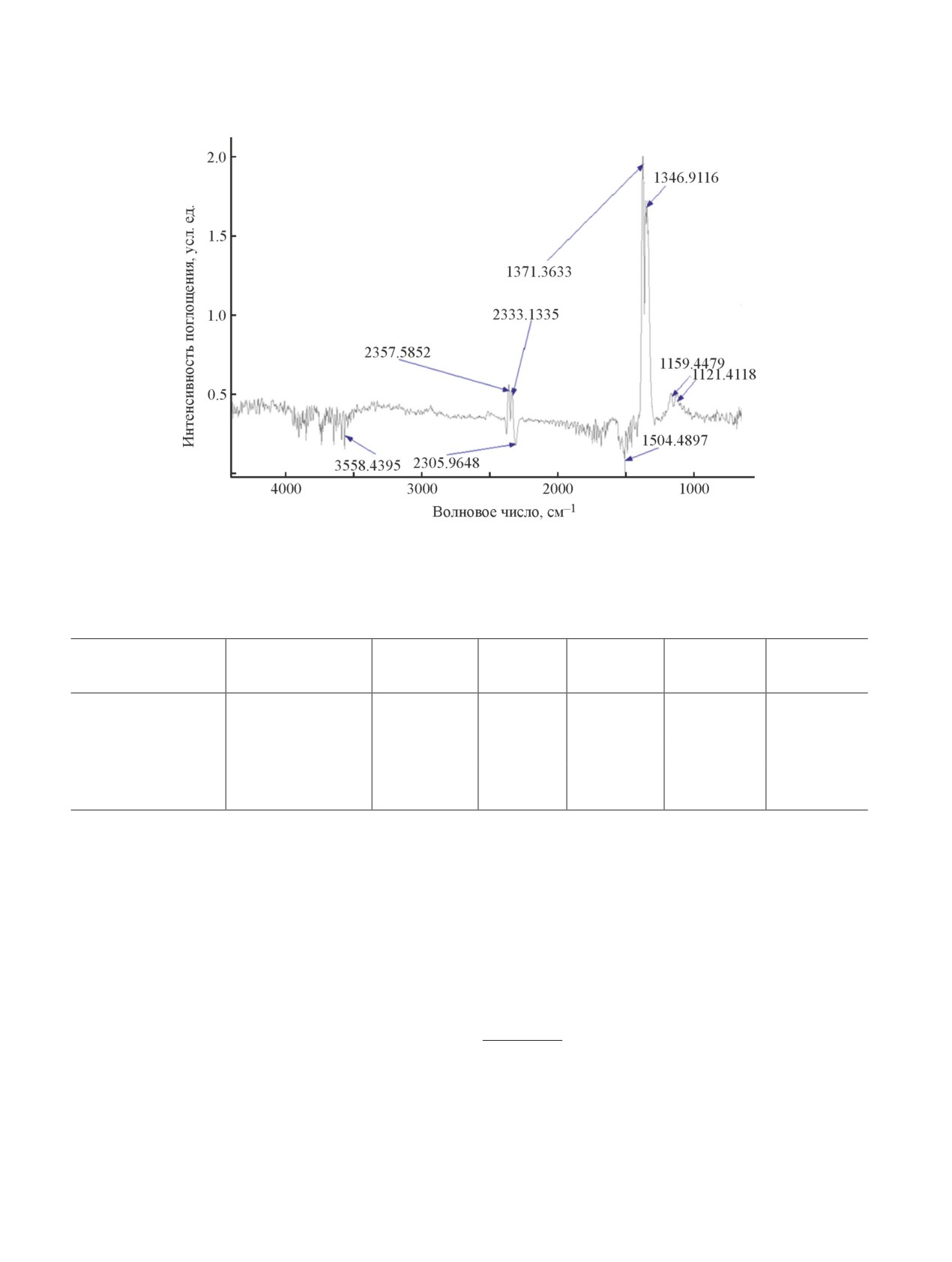
помощью ИК-спектроскопии (рис. 2) при 170°С на
гомолизом C—S- и S—Cl-связей [6], совместно с
синхронном термоанализаторе Netzsch STA 449 F3.
количественным анализом продуктов реакции (тер-
В результате обнаружен сигнал SO2 в диапазонах
молиза хлорсульфированного полиэтилена), полу-
1400-1300 и 1120-1100 см-1.
ченных с участием свободных радикалов (Rn• и Cl•),
Особенности образования и поведения свободных
позволит оценить роль этих радикалов в реакциях
радикалов при согласованном распаде сульфохлорид-
структурирования полимерных молекул.
ных групп анализировали по количеству HCl и SO2,
Цель работы — исследование особенностей (и
выделяющихся в результате термолиза хлорсульфи-
условий) возникновения свободных радикалов (Rn•,
рованного полиэтилена (табл. 1). Определение HCl и
SO2 проводили в два этапа.
* Клетка растворителя — состояние системы, при ко-
На первом этапе образцы хлорсульфированного
тором молекула-генератор свободных радикалов, а также
полиэтилена помещали в ампулы из молибденового
свободные радикалы, образующиеся в момент распада этой
молекулы, окружены молекулами растворителя.
стекла, запаивали и термостатировали. Затем ампу-
Особенности термического разложения хлорсульфированного полиэтилена
461
Рис. 2. ИК-спектры газообразных продуктов термолиза хлорсульфированного полиэтилена.
Таблица 1
Условия термолиза хлорсульфированного полиэтилена
Масса навески
Масса
Время
Температура
Теоретическая
Теоретическая
Условия
хлорсульфированного
растворителя, г
термолиза, ч
термолиза, °С
масса HCl, г
масса SO2, г
полиэтилена, г
В массе, в атмосфере
1.9993
Oтсутствует
10
150
0.0228
0.0399
воздуха
В растворе кумола
0.3750
25
3
180
0.0043
0.0075
В массе, под слоем
0.3754
25
4
150
0.0043
0.0075
воды
лы охлаждали, герметично соединяли силиконовым
ляет 698.9* и 92 г·кг-1** соответственно, и поэтому
шлангом с сосудом, содержащим 50 г воды, ломали
выделяющиеся при термолизе хлорсульфированного
отвод ампулы внутри силиконового шланга и ин-
полиэтилена HCl и SO2 могут полностью поглощать-
тенсивно встряхивали всю систему для поглоще-
ся водой.
ния газообразных продуктов водой. Для термолиза
На втором этапе проводили кондуктометрический
хлорсульфированного полиэтилена под слоем воды
анализ поглощенных HCl и SO2 при их совместном
поглотительная емкость была не нужна, газообразные
присутствии в водном растворе.*** Растворы H2SO3
продукты поглощались водой по мере их выделения.
и HCl количественно переносили в емкость с из-
Полученные водные растворы газообразных про-
дуктов количественно переносили в мерные колбы
* Лурье Ю. Ю. Справочник по аналитической химии.
и разбавляли дистиллированной водой до 100 мл
М.: Химия, 1971. 76 с.
** Young C.L. Solubility data series. Sulfur dioxide,
[дистиллированную воду получали с помощью аква-
chlorine, fluorine and chlorine oxides. Pergamon Press, Oxford,
дистиллятора АЭ-5 (ООО ПФ «Ливам»)]. Пределы
1983. V. 12. P. 24-171.
растворимости газообразных продуктов в условиях
*** ГОСТ Р ИСО 7935-2007. Определение массовой
эксперимента не достигаются (табл. 1), поскольку
концентрации диоксида серы. Характеристики автомати-
растворимость HCl и SO2 в воде при 20°С состав-
ческих методов измерений в условиях применения.
462
Селезнев А. А. и др.
мерительной ячейкой Tetracon 325 кондуктометра
Cond 7310 (WTW inoLab). Кондуктометрическое ти-
трование растворов кислот проводили раствором
NaOH концентрацией 0.04 моль·л-1. Раствор готовили
непосредственно перед проведением анализа рас-
творением навески NaOH (х.ч., АО «ЛенРеактив») в
воде. Исходную концентрацию раствора NaOH опре-
деляли кондуктометрическим титрованием раство-
ром HCl, приготовленным из фиксанала (0.1 Н, ООО
«Реахимприбор»).
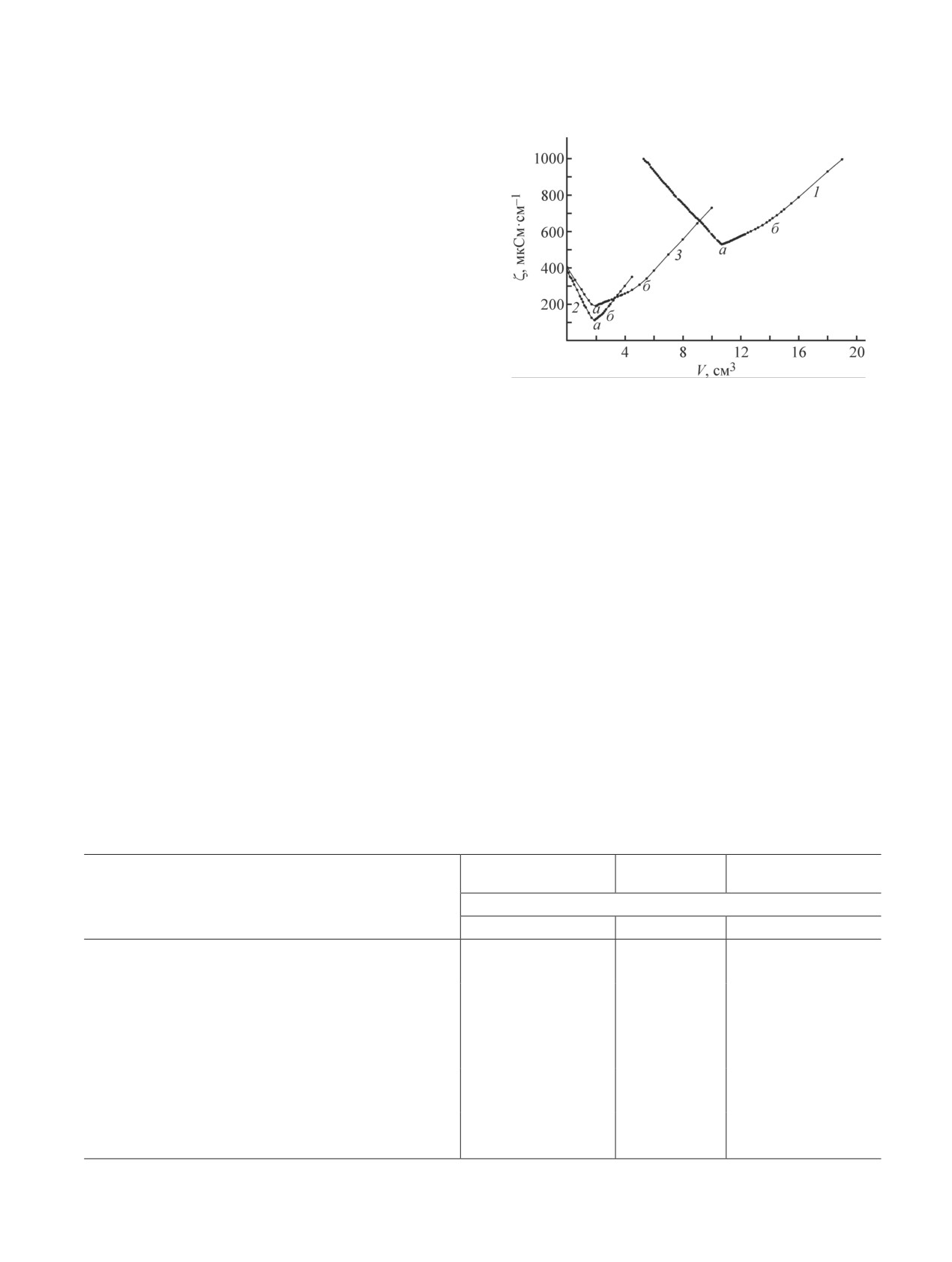
Изломы на кривой кондуктометрического титро-
вания (рис. 3) смеси растворов кислот соответствуют
нейтрализации анионов соответствующих кислот.
Рис. 3. Кривые кондуктометрического титрования вод-
Участок до первой точки эквивалентности а соответ-
ных растворов H2SO3 и HCl, образовавшихся при по-
ствует нейтрализации HCl вместе с H2SO3, диссоци-
глощении газообразных SO2 и HCl, выделившихся в
ированной по первой ступени, а участок до второй
процессе термолиза хлорсульфированного полиэтилена.
точки эквивалентности б соответствует полной ней-
Термолиз хлорсульфированного полиэтилена в массе: 1 —
трализации H2SO3 (рис. 3).
в атмосфере воздуха, 2 — под слоем воды, 3 — в растворе
Образцы хлорсульфированного полиэтилена по-
кумола; a, б — точки эквивалентности.
сле термолиза в массе (в атмосфере воздуха или под
слоем воды) сушили до постоянной массы (табл. 2).
лена высокого давления — при 190°С при скорости
Для качественной оценки растворимости образцов
вращения роторов 100 об-1. Рецептуры и свойства
хлорсульфированного полиэтилена навески выдержи-
термопластичных эластомеров приведены в табл. 3.
вали в избытке толуола в течение 3 сут при комнатной
температуре.
Обсуждение результатов
Термопластичные эластомеры на основе эти-
лен-пропилен-диенового каучука и полиэтилена вы-
Хлорсульфированный полиэтилен характеризуется
сокого давления получали в течение 10 мин в смеси-
сложной микроструктурой, включающей три типа
теле Haake PolyLab QC (ThermoFischer) при 150°С, а
статистически распределенных звеньев (рис. 4): эти-
тройные, на основе хлорсульфированного полиэти-
лена, этилхлорида и этилсульфохлорида, содержание
лена, этилен-пропилен-диенового каучука и полиэти-
которых неодинаково [7].
Таблица 2
Результаты термолиза хлорсульфированного полиэтилена
В массе,
В растворе
В массе,
в атмосфере воздуха
кумола
под слоем воды
Продукты термолиза
давление, МПа
0.19
0.24
0.54
Количество хлорсульфированного полиэтилена после
1.9587
—
0.3680
термолиза, г
Количество газообразных продуктов, определенных
кондуктометрическим методом, г:
HCl
0.0115
0.0020
Следы
SO2
0.0072
0.0015
0.0077
Сумма газообразных продуктов, определенная весовым
0.0406
—
0.0074
методом, г
Растворимость в толуоле образца хлорсульфированного
Нерастворим
—
Растворим
полиэтилена после термолиза
Примечание. «—» — не определяли.
Особенности термического разложения хлорсульфированного полиэтилена
463
Таблица 3
Деформационно-прочностные свойства термопластичных эластомеров
Условная прочность
Относительное удлинение
Содержание компонентов, мас%
при растяжении, МПа
при разрыве, %
Исходный полимер
Полиэтилен высокого давления 10803-020
12.2
210
П олиэ ти ле н в ы со ко го да вл е ни я/э ти ле н-п р о п и ле н-дие н о в ы й кау чу к
70/30
7.2
140
50/50
5.7
140
30/70
3.6
150
Пол и эти л е н в ы с о ко го да вле н и я /эт ил е н-п р о п и ле н-ди е но в ы й
кау чу к/хл о р сул ьфи р о ва н н ы й поли э ти ле н
50/20/30
6.8
170
35/35/30
5.4
150
20/50/30
3.6
160
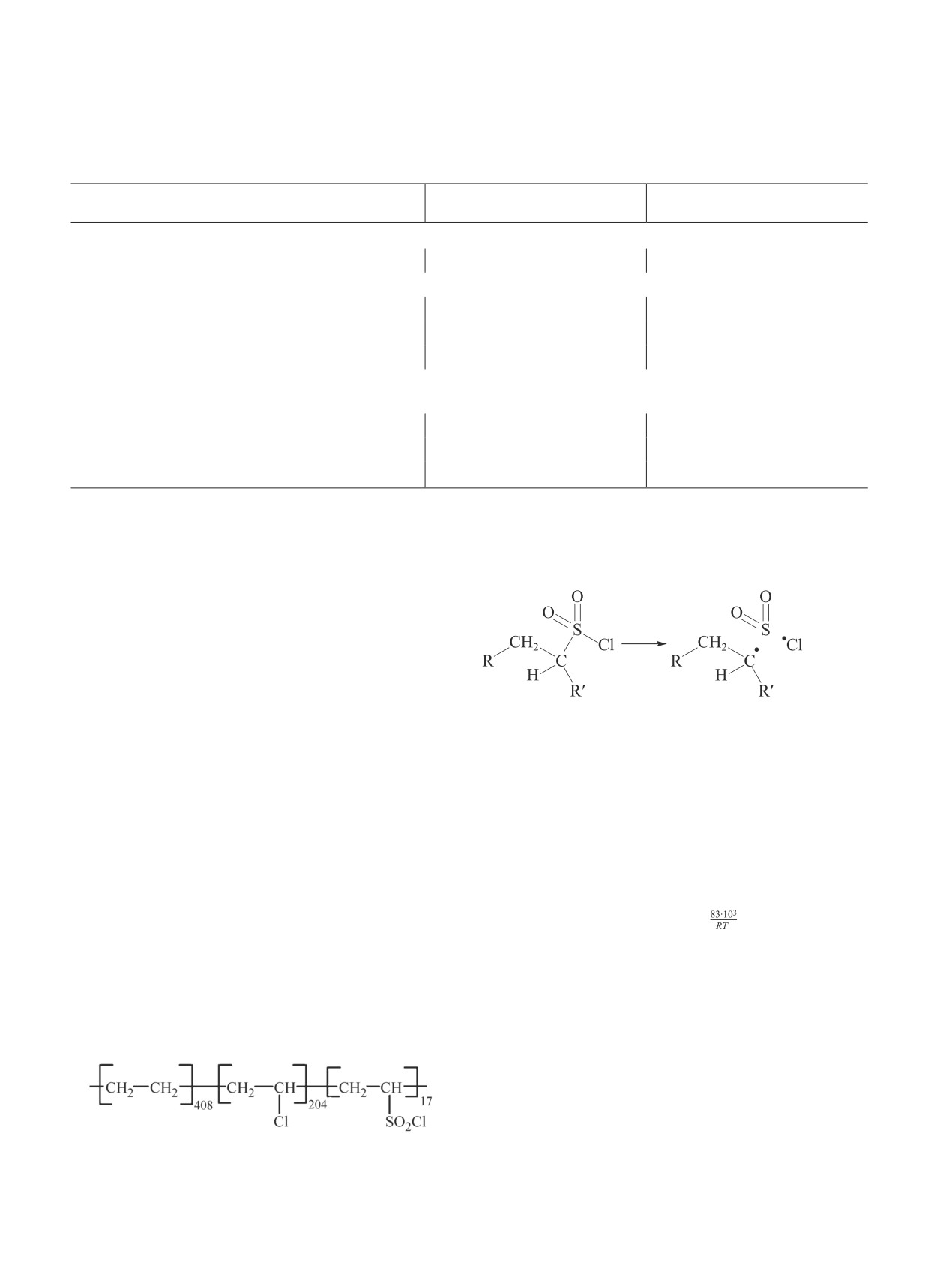
При средней молекулярной массе полимера около
двум связям с образованием свободных радикалов
26 000 соотношение указанных звеньев составля-
[(реакция (III)]:
ет 408:204:17 соответственно. Такая структура об-
условлена способом получения хлорсульфированного
полиэтилена методом сульфохлорирования полиэти-
лена. Процесс сульфохлорирования углеводородов
(III)
сопровождается их хлорированием, поэтому суль-
фохлоридного хлора содержится в хлорсульфирован-
ном полиэтилене около 1%, как и серы, а алкилхло-
ридного (C—Сl) — около 34%. Сульфохлоридные
Для подтверждения этой гипотезы были изуче-
атомы хлора принципиально отличаются по реакци-
ны кинетические закономерности сульфохлоридной
онной способности и энергии диссоциации связей:
деградации хлорсульфированного полиэтилена [6] в
C—Cl (351 кДж·моль-1), S—Cl (286 кДж·моль-1).
интервале температур 130-170°С (табл. 4).
Этилхлоридных звеньев в 10 раз больше, чем этил-
В результате установлено, что реакция (III) подчи-
сульфохлоридных, однако реакционная способность
няется кинетическому уравнению первого порядка, а
и свойства хлорсульфированного полиэтилена опре-
температурная зависимость константы скорости рас-
деляются этилсульфохлоридными звеньями.
пада сульфохлоридных групп в хлорсульфированном
Анализируя продукты термолиза хлорсульфи-
полиэтилене описывается уравнением Аррениуса:
рованного полиэтилена [реакции (I) и II)] с уче-
том изменения валентности атома серы и близости
k = 2.46·106e-
энергий разрывающихся связей C—S и S—Cl (280
и 286 кДж·моль-1 соответственно), мы предполо-
В большинстве случаев распад молекулы по од-
жили, что хлорангидриды сульфокислот при терми-
ной связи с образованием двух свободных радикалов
ческом воздействии распадаются одновременно по
характеризуется энергией активации, близкой по ве-
личине к энергии диссоциации этой связи, величи-
ной предэкспоненциального множителя в уравнении
Аррениуса 1013-1016 с-1 и положительным измене-
нием энтропии активации (40-80 Дж∙моль-1∙K-1) [4].
Одновременный распад двух связей (C—S и S—Cl)
в сульфохлоридных группах хлорсульфированного
полиэтилена сопровождается более чем трехкратным
Рис. 4. Количественное представление микроструктуры
хлорсульфированного полиэтилена [7].
понижением энергии активации (83 кДж·моль-1) по
464
Селезнев А. А. и др.
Таблица 4
Усредненные кинетические параметры десульфирования хлорсульфированного полиэтилена [6]
Константа
Энергия диссоциации
Энергия активации
Предэкспоненциальный
Изменение
Температура,
скорости
связи Eдис, кДж·моль-1
термораспада
множитель
энтропии активации
K
термораспада
Ea, кДж·моль-1
A, с-1
ΔS, Дж∙моль-1∙K-1
k∙104, с-1
С—S
S—Cl
403
0.43 ± 0.05
413
0.80 ± 0.03
423
1.77 ± 0.13
280
286
83
2.46∙106
-134
433
2.31 ± 0.28
443
4.24 ± 0.50
сравнению с энергией диссоциации разрывающихся
Rn• + Cl• →RnCl,
(IV)
связей, уменьшением предэкспоненциального мно-
Rʹ—H + Cl• → Rʹ• + HCl,
(V)
жителя в уравнении Аррениуса (2.46∙106 с-1) на семь
порядков, и отрицательным изменением энтропии
где Rn• — макрорадикал, образовавшийся в резуль-
активации, составляющим -134.2 Дж∙моль-1∙K-1
тате термораспада сульфохлоридной группы; Rʹ• —
(табл. 4). Такое заметное различие в кинетических
макрорадикал, образовавшийся в результате отрыва
параметрах термолиза хлорсульфированного полиэ-
водорода атомом хлора.
тилена в совокупности с балансом (табл. 2) реакции
По количеству получающегося HCl можно оце-
(III) является убедительным доказательством одно-
нить возможность отрыва атома водорода от угле-
временного разрыва C—S- и S—Cl-связей. Снижение
водородного субстрата атомом хлора Cl• и понять
энергии активации можно объяснить компенсацией
особенности термической деградации хлорсульфи-
энергии за счет выделения молекулы SO2, энтальпия
рованного полиэтилена. HCl выделяется в количе-
образования которой равна -297 кДж·моль-1,* а так-
стве не более половины от теоретического значения
же за счет частичной рекомбинации атома хлора (Cl•)
(табл. 2). Это является следствием того, что Cl• не
с макрорадикалом (Rn•).
только рекомбинирует с Rn• [реакция (VI)], но и от-
Однако для понимания и оценки превращения
рывает от макрорадикала или от растворителя атом
макрорадикала Rn• и атома хлора (Cl•), появление
водорода по реакции (V).
которых по реакции (III) не вызывает сомнений, необ-
ходима количественная оценка содержания SO2 и HCl
Rn• + Rʹ• → Rn— Rʹn .
(VI)
в газообразных продуктах термолиза хлорсульфиро-
ванного полиэтилена. Термораспад сульфохлоридов в
В условиях нашего эксперимента (150-180°С,
соответствии с реакцией (III) должен сопровождаться
табл. 2) HCl получается только по реакции (V), по-
выделением SO2 одновременно с HCl только в том
скольку дегидрохлорирование с участием C—Cl-
случае, если атом хлора Cl• не рекомбинирует с ал-
связи начинается только при 250°С [8]. В результате
кильным радикалом Rn• [реакция (IV)], образованным
отрыва водорода от углеводородного субстрата обра-
в результате термораспада сульфохлоридной группы
зуется макрорадикал Rʹ•, способный рекомбинировать
[реакция (III)], а отрывает от него или от соседней мо-
с Rn• с образованием между ними С—С-связи по
лекулы атом водорода с образованием макрорадикала
реакции (VI), что подтверждается нерастворимостью
Rʹ• [реакция (V)]. По количеству получающегося HCl
образца хлорсульфированного полиэтилена в толуоле
можно оценить возможность отрыва атома водорода
после его термолиза в массе (табл. 2).
от углеводородного субстрата атомом хлора Cl• и
Рекомбинации атомов хлорангидридного хлора в
понять особенности термической деградации хлор-
условиях нашего эксперимента, как и в исследова-
сульфированного полиэтилена:
ниях авторов [1, 2], не обнаружено. Гипотетически
молекулярный хлор может образоваться только по
реакции Cl• + Cl• → Cl2, однако с учетом содержания
* Краткий справочник физико-химических величин.
хлорангидридного хлора в хлорсульфированном по-
Издание десятое, испр. и дополн. / Под ред. А. А. Равделя
и А. М. Пономаревой. СПб: «Иван Федоров», 2003. 240 с.
лиэтилене (около 1 мас%) эта рекомбинация стано-
Особенности термического разложения хлорсульфированного полиэтилена
465
вится практически невозможной, что и подтвержда-
ется экспериментом.
При термолизе хлорсульфированного полиэти-
лена под слоем воды количество SO2, определен-
ное кондуктометрическим титрованием (0.0077 г),
практически совпадает с теоретическим значени-
ем (0.0075 г, табл. 1), что также соответствует поте-
ре массы образца в результате термолиза (0.0074 г,
табл. 2). Отсутствие заметного количества HCl в воде
и полная растворимость образца хлорсульфированно-
го полиэтилена в толуоле после термолиза являются
доказательствами рекомбинации атома хлора (Cl•) с
углерод-центрированным макрорадикалом (Rn•), а
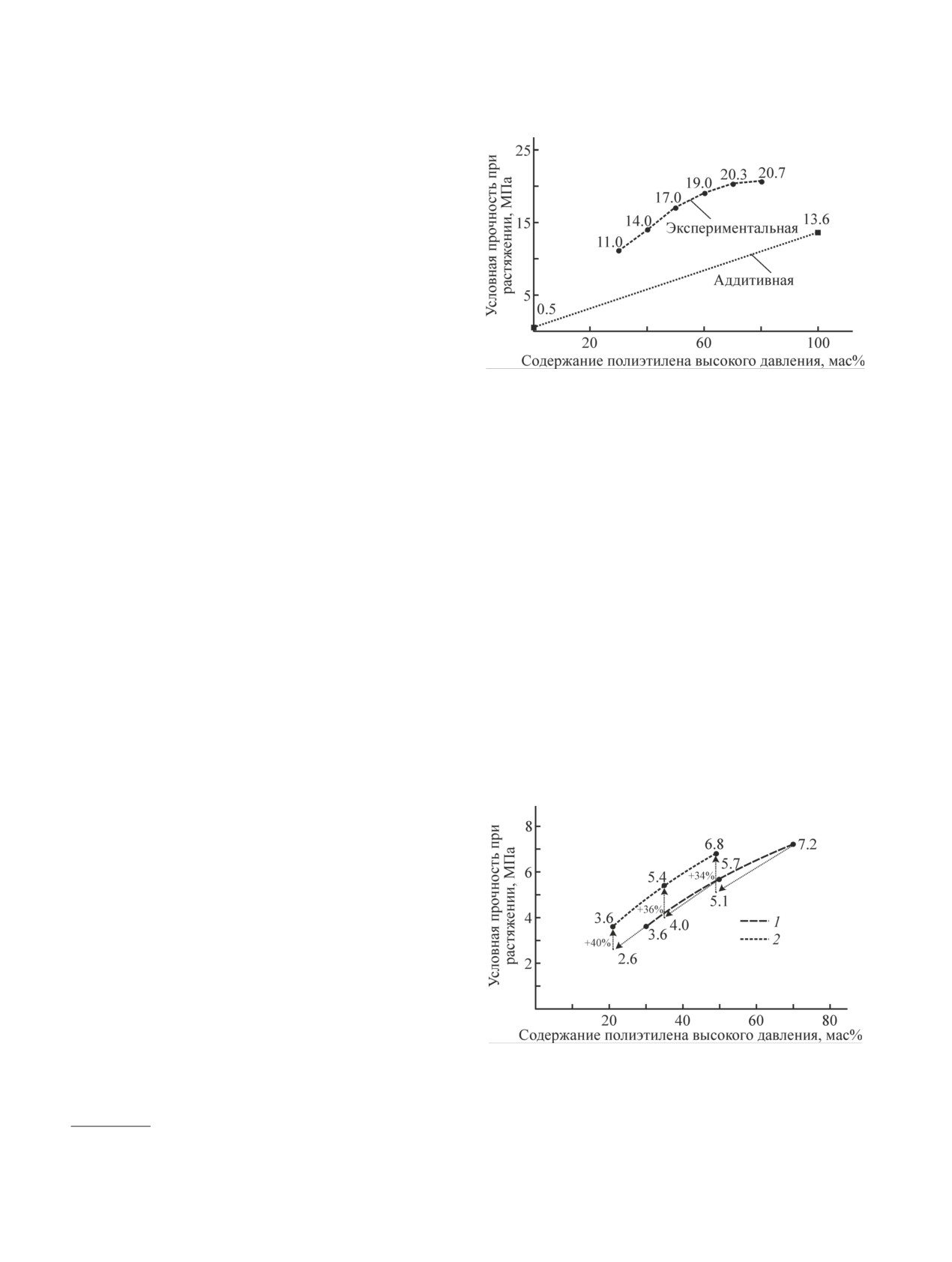
Рис. 5. Зависимость условной прочности термопластич-
диспропорционирования данных свободных радика-
ного эластомера на основе полиэтилена высокого давле-
лов в этих условиях не наблюдается. По-видимому,
ния и хлорсульфированного полиэтилена от содержания
этому способствует повышенное давление (0.54 МПа,
полиэтилена высокого давления [9].
табл. 2) за счет нагревания образца в процессе термо-
статирования. Практическое отсутствие HCl в воде
свидетельствует также о том, что дегидрохлориро-
прочности при растяжении, превышающей 20 МПа,
вание из углеводородного фрагмента хлорсульфиро-
превосходит исходный полиэтилен высокого дав-
ванного полиэтилена не проходит. Пониженное по
ления (рис. 5), и его можно считать сверхпрочным.
сравнению с теоретическим количество SO2 (0.0015 г,
Эффективность хлорсульфированного полиэтилена
табл. 2), определенное при термолизе раствора хлор-
в качестве генератора свободных радикалов подтвер-
сульфированного полиэтилена в кумоле, вероятно,
дилась также при получении тройного термопла-
связано с растворимостью SO2, которая, например,
стичного эластомера на основе полиэтилена высоко-
в толуоле (246 г·кг-1 толуола*) почти в 3 раза выше,
го давления, этилен-пропилен-диенового каучука и
чем в воде (92 г·кг-1 воды*).
хлорсульфированного полиэтилена (рис. 6).
Таким образом, превращения свободных ради-
При введении 30 мас% хлорсульфированного по-
калов, образующихся в результате согласованного
лиэтилена в двойные композиции на основе полиэти-
распада, обусловленные их взаимодействиями между
лена высокого давления и этилен-пропилен-диеново-
собой или с другими субстратами, проходят исклю-
го каучука с соотношением компонентов 70/30, 50/50
чительно под диффузионным контролем и зависят от
вязкости среды, поэтому управлять такими реакция-
ми можно за счет изменения вязкости.
В высоковязкой среде рекомбинация между Cl• и
Rn• замедляется, и у свободных радикалов появляется
возможность реагировать с другими субстратами,
например с полиэтиленом высокого давления, с обра-
зованием соответствующего макрорадикала и после-
дующей его рекомбинацией с Rn•. Это предположе-
ние подтвердилось при создании термопластичного
эластомера с полиэтиленом высокого давления [9].
Повышению вероятности сшивания также способ-
ствовали сдвиговые деформации, которые неизбежны
в условиях смешения хлорсульфированного поли-
этилена с полиэтиленом высокого давления. Именно
Рис. 6. Зависимость условной прочности при растяже-
поэтому композит на основе полиэтилена высокого
нии термопластичных эластомеров на основе полиэти-
давления и хлорсульфированного полиэтилена по
лена высокого давления и этилен-пропилен-диенового
каучука (1), а также полиэтилена высокого давления,
* Young C. L. Solubility data series. Sulfur dioxide,
этилен-пропилен-диенового каучука и хлорсульфиро-
chlorine, fluorine and chlorine oxides. Pergamon Press, Oxford,
ванного полиэтилена от содержания полиэтилена вы-
1983. V. 12. P. 24-171.
сокого давления (2).
466
Селезнев А. А. и др.
и 30/70 мас% относительное содержание полиэтилена
Благодарности
высокого давления и этилен-пропилен-диенового
Выражаем благодарность академику РАН И. А. Но-
каучука в тройных композициях уменьшается до
вакову за поддержку направления исследований.
49/21, 35/35 и 21/49 мас% соответственно. Прочность
хлорсульфированного полиэтилена составляет около
0.5 МПа (рис. 5). После введения хлорсульфирован-
Финансирование работы
ного полиэтилена в двойные композиты величины
Исследование выполнено при финансовой под-
условной прочности при растяжении, рассчитан-
держке Российского фонда фундаментальных иссле-
ные по аддитивным вкладам, должны снизиться в
дований в рамках научного проекта № 20-33-90286.
тройных композитах до 5.1, 4.0 и 2.6 МПа (рис. 6)
соответственно. Однако реальные значения услов-
ной прочности этих композитов в 1.3-1.4 раза выше
Конфликт интересов
(рис. 6), что достигается за счет структурирующего
Авторы заявляют об отсутствии конфликта инте-
эффекта Cl• и Rn• [реакции (V) и (VI)], образующихся
ресов, требующего раскрытия в данной статье.
при термолизе сульфохлоридных групп хлорсульфи-
рованного полиэтилена по реакции (III).
Таким образом, установлено, что термоиндуциро-
Информация об авторах
ванное воздействие на хлорсульфированный поли-
этилен (130°С) приводит к одновременному разрыву
Селезнев А. А., к.х.н., материаловед АО «Инжини-
связей С—S и S—Cl в сульфохлоридных группах с
ринговый центр «Кронштадт»
генерированием углерод-центрированного макро-
радикала (Rn•) и атома хлора (Cl•). Атом хлора (Cl•)
Навроцкий А.В., д.х.н., ректор, зав. кафедрой,
отрывает атом водорода от соседних макромолекул,
Волгоградский государственный технический уни-
а Rn• рекомбинирует с другими углерод-центрирован-
верситет
ными макрорадикалами, обусловливая структуриро-
вание (сшивание) макромолекул. Однако неожидан-
Сафронов С.А., к.т.н., гл. технолог ООО «Интов-
ным представляется столь высокая чувствительность
Эласт»
сульфохлоридных групп к давлению, которая, в со-
ответствии с [4], связана с уменьшением объема ак-
Навроцкий В. А., д.х.н., проф., Волгоградский го-
тивированного комплекса по сравнению с исходной
сударственный технический университет
молекулой, что может быть также связано с особен-
ностями пространственного расположения атомов в
сульфохлоридной группе.
Список литературы
[1] Ho Huu T., Iino M., Matsuda M. Sulfonyl radicals. 7.
Kinetics and mechanism of the thermal decomposition
Выводы
of a-phenylalkanesulfonyl chlorides proceeding via
Результаты исследования показывают, что хлор-
ionic intermediates // J. Org. Chem. 1980. V. 45.
сульфированный полиэтилен при термическом воз-
действии на него выше 125°С является генератором
[2] Geiseler G., Herrmann P. Kinetik und mechanismus
свободных радикалов (углерод-центрированного
des thermischen zerfalls der alkansulfohalogenide, 5.
Mitt.: Der thermische zerfall des athansulfochlorids bei
макрорадикала Rn• и атома хлора Cl•) за счет тер-
hohen temperaturen // Monatsh. Chem. 1970. V. 101.
мораспада сульфохлоридных групп одновременно
по связям C—S и S—Cl, что для сульфохлоридных
[3] Pryor W. A., Smith K. The viscosity dependence of bond
групп обнаружено и доказано впервые. Способность
homolysis. A qualitative and semiquantitative test for
генерировать свободные радикалы позволяет исполь-
cage return // J. Am. Chem. Soc. 1970. V. 92. N 18.
зовать хлорсульфированный полиэтилен не только
в качестве эластомерной основы полимерных ком-
[4] Денисов Е. Т. Кинетика гомогенных химических
позиционных материалов, но также в роли высоко-
реакций. М.: Высш. шк., 1988. 156 с.
молекулярного сшивающего агента, улучшая физи-
[5] Кущ О. В., Опейда И. А., Туровский Н. А., Навроц-
ко-механические характеристики термопластичных
кий В. А. О механизме термолиза ацилоксидиалкиль-
эластомеров.
ных пероксидов // ЖФХ. 2005. Т. 79. № 8. С. 1406-
Особенности термического разложения хлорсульфированного полиэтилена
467
1410 [Kushch O. V., Opeida I. A., Turovskii N. A.,
[8] Rijal B., Klipfel F., Dez I., Colin J., Bazin P.,
Navrotskii V. A. The mechanism of thermolysis of
Arethuse F., Tellier E., Le Pluart L. Effect of metal
acyloxydialkyl peroxides // Russ. J. Phys. Chem. A.
oxides on the thermal degradation of polychloroprene
2005. V. 79. N 8. P. 1238-1242].
and chlorosulfonated polyethylene // Polym. Degrad.
[6] Навроцкий А. В., Степанов Г. В., Сафронов С. А.,
Stab. 2019. V. 159. P. 90-97.
Гайдадин А. Н., Селезнев А. А., Навроцкий В. А.,
Новаков И. А. Гомолитическое разложение хлор-
[9] Сафронов С. А., Гайдадин А. Н., Куратова А. В.,
ангидридов сульфокислот // ДАН. 2018. Т. 480.
Навроцкий В. А. Динамические термоэластопла-
№ 3. C. 297-299 [Navrotskii A. V., Stepanov G. V.,
сты на основе хлорсульфированного полиэтилена //
Safronov S. A., Gaidadin A. N., Seleznev A. A.,
ЖПХ. 2012. Т. 85. № 12. С. 2056-2067 [Safronov S. A.,
Navrotskii V. A., Novakov I. A. Homolytic decomposition
Gaidadin A. N., Kuratova A. V., Navrotskii V. A.,
of sulfonyl chlorides // Dokl. Chem. 2018. V. 480.
Kutsov D. A. Dynamic thermoplastic elastomer based on
chlorosulfonated polyethylene // Russ. J. Appl. Chem.
[7] Nersasian A. The structure of chlorosulfonated
2013. V. 85. P. 1939-1949.
polyethylene // J. Appl. Polym. Sci. 1960. V. 4. N 10.
Научное редактирование проведено научным редактором журнала «Нефтехимия» к.х.н. Н. В. Шелеминой.