Журнал прикладной химии. 2023. Т. 96. Вып. 6
КАТАЛИЗ
УДК 544.472.3:546-328:546.262.3-31
НИЗКОТЕМПЕРАТУРНЫЙ ПРОЦЕСС ОКИСЛЕНИЯ МОНООКСИДА УГЛЕРОДА
КИСЛОРОДОМ В ПРИСУТСТВИИ ГЕТЕРОПОЛИКИСЛОТ
© Ю. А. Родикова, Е. Г. Жижина
Институт катализа им. Г. К. Борескова СО РАН,
630090, г. Новосибирск, пр. Академика Лаврентьева, д. 5
Поступила в Редакцию 20 августа 2023 г.
После доработки 23 ноября 2023 г.
Принята к публикации 6 декабря 2023 г.
Изучена кинетика низкотемпературного (10-50°С) окисления СО в присутствии гомогенной ката-
литической системы, состоящей из галоидных комплексов Pt и фосфорномолибденовой гетерополи-
кислоты, допированной атомами ванадия(V). На примере раствора гетерополикислоты с низким
содержанием каталитически активных атомов ванадия (Н7РМо8V4O40) выявлены оптимальные
условия процесса (концентрация СО, содержание Pt и галогенид-ионов, рН), получено кинетическое
уравнение, предложен механизм. Показано, что введение каталитических количеств соли палладия
позволяет устранить индукционный период реакции окисления СО, а также повысить стабильность
каталитической системы. Продемонстрирована значительная активность и стабильность комби-
нированной системы Pt + Pd + Н10Р3Мо18V7O84.
Ключевые слова: гомогенный металлокомплексный катализ; монооксид углерода; окисление; Pt-со-
держащие каталитические системы; гетерополикислоты
DOI: 10.31857/S0044461823060087; EDN: SZHGOE
СО является отходящим газом с высокой цито-
осушку газа, что делает все более актуальным пере-
токсичностью [1], выбросы которого в атмосферу от
ход на каталитические методы очистки с использо-
стационарных источников тепла, а также предпри-
ванием соединений, активных при низких (10-50°С)
ятий по производству кокса, переработке нефти и
температурах в средах, характеризующихся высокой
обработке древесины значительны.* Поэтому очистка
влажностью [2].
воздуха от примесей СО является актуальной эколо-
Среди соединений, активных в реакции окисления
гической проблемой.
СО в СО2 при низких температурах, выделяют не-
Для обезвреживания поступающих в окружаю-
сколько классов катализаторов и каталитических си-
щую среду загрязнений, выделяемых стационарными
стем [3-5]: оксидные и оксидно-металлические ката-
источниками, как правило, используется термическая
лизаторы (Co3O4, Co3O4/γ-Al2O3, CuMnOx, Cu2Ag2O3,
очистка — прямое сжигание отходящего газа в печах
CuO-ZnO/TiO2, Pt/CeO2, Pd/SnO2, Pd/TiO2, Au/ZnO),
или факельных горелках. Однако такой подход требу-
нанесенные металлические катализаторы [(Pt или
ет высоких расходов на топливо и предварительную
Pd)/детонационные наноалмазы, Pd-Cu-Fe/гидрок-
сиапатит], жидкофазные и нанесенные металлоком-
плексные катализаторы [соль Pd(II) + обратимо дей-
614
Низкотемпературный процесс окисления монооксида углерода кислородом в присутствии гетерополикислот
615
ствующий окислитель, Pd-Cu-Clx/носитель]. Однако
добавлением раствора H2PtCl6 (8 мас% в Н2О, кат.
только ограниченное число разработанных систем
номер 262587, Sigma-Aldrich) к раствору гетеропо-
стабильно функционирует при окислении газов с
ликислоты заданного состава. Для стабилизации в
высокой влажностью, а также сохраняет эффектив-
систему дополнительно вводили ионы Cl- или Br-
ность при высоких концентрациях СО в присутствии
(Х-) в виде солей МеХ (Ме = Li, Na, K, ½ Mg, ½ Ca;
сопутствующих газов. Кроме того, многие из пред-
все — х.ч., АО «ВЕКТОН»), после чего смесь упари-
ложенных соединений проявляют каталитическую
вали до 20 мл, охлаждали до комнатной температуры
активность при температурах 10-50°С, однако их
и измеряли значения рН и окислительно-восстанови-
максимальная активность достигается при темпера-
тельного потенциала Е [относительно нормального
турах выше 80-100°С. Это приводит к необходимости
водородного электрода (НВЭ)]. Величины рН и E
их модифицирования, оставляя вопрос поиска актив-
растворов катализаторов определяли при комнатной
ного низкотемпературного катализатора конверсии
температуре на pH-метре InoLab pH 730 (WTW) с ис-
СО с высокими показателями влажности открытым.
пользованием электродов SenTix 41 (WTW) и SenTix
Успешное применение растворов молибдована-
ORP (WTW) соответственно. Для получения катали-
дофосфорных гетерополикислот [ГПК-х, х — число
затора Pt + Pd + ГПК-х использовали PdCl2 (≥ 99.9%,
атомов ванадия(V)] в качестве обратимо действую-
кат. номер 520659, Sigma-Aldrich).
щих окислителей в каталитической системе комплекс
Реакцию окисления CО (ч., массовая доля не менее
Pd(II) + ГПК-х в процессах окисления низших оле-
98.5%, ООО «ПТК «КРИОГЕН») исследовали волю-
финов С2-С4 в карбонильные соединения [6] стиму-
мометрическим методом при атмосферном давлении
лировало исследование возможности использования
и температурах (Т) 10-50°С в термостатированном
ГПК-х в каталитическом окислении СО в СО2 при
стеклянном реакторе объемом 150 мл с циркуляцией
низких температурах.
газовой фазы через 10%-ный раствор NaOH (ч.д.а.,
Цель работы — изучение кинетики низкотемпера-
ООО «АО РЕАХИМ») для поглощения образующе-
турного окисления СО в СО2 в присутствии гомоген-
гося СО2. Вначале через емкость (каталитическую
ной каталитической системы Pt + молибдованадофос-
«утку») с 20 мл катализатора Pt + ГПК-х продували
форная гетерополикислота.
CО без барботажа, затем систему соединяли с бюрет-
кой, заполненной СО. Эксперимент начинали встря-
хиванием реактора с частотой, при которой скорость
Экспериментальная часть
реакции (WСО) не зависела от интенсивности встря-
Синтез водного раствора молибдованадо-
хиваний (800 мин-1). WСО (мольCО·л-1·мин-1) опреде-
фосфорной гетерополикислоты брутто-соста-
ляли на стационарном участке кинетической кривой
ва Н10Р3Мо18V7O84 (ГПК-7) концентрацией
VCО = f(t), где она была постоянной. Для определения
0.25 моль·л-1 проводили из V2O5 (х.ч., ООО «АО
зависимости WСО от Т при каждой температуре экспе-
РЕАХИМ»), H3PO4 (ос.ч., ≥85%, АО «ВЕКТОН»),
римент проводили 3 раза, полученные данные усред-
MoO3 (х.ч., ООО «АО РЕАХИМ»), H2O2 (ос.ч.,
няли. Для экспериментов с вариацией содержания
8-4, ООО «СПЕКТР-ХИМ») и H2O (аквадистилля-
СО готовили газовые смеси CО + N2 (сорт первый,
тор ДЭ-4М, АО «ЛОиП») по методике [7]. Водный
ООО «ПТК «КРИОГЕН») заданной концентрации.
0.20 моль·л-1 раствор молибдованадофосфорной
Во всех экспериментах полнота превращения СО в
гетерополикислоты брутто-состава Н7РМо8V4O40
СО2 составляла 100%.
(ГПК-4) получали по методике [8] из тех же реак-
Содержание ванадия(IV) в растворе катализатора
тивов. Растворы ГПК-4 других концентраций (0.02-
находили методом окислительно-восстановительного
0.4 моль·л-1) готовили разбавлением или упаривани-
титрования с использованием КМnO4 (х.ч., ООО «РМ
ем 0.20 моль·л-1 раствора.
Инжиниринг») в присутствии H3PO4 при комнатной
Состав растворов контролировали методом ядер-
температуре [9]. Степень восстановления катализато-
ного магнитного резонанса на ядрах 31P и 51V на
ра (m) рассчитывали по формуле
спектрометре AVANCE 400 (Bruker) при рабочих ча-
стотах 162.0 и 105.24 МГц с использованием 85%
m = [ванадий(IV)]/[ГПК-х].
(1)
H3PO4 и VOCl3 (99.995%, ABCR) в качестве внешних
стандартов.
Регенерацию растворов катализаторов Pt + (Pd) +
Гомогенный катализатор Pt + молибдованадофос-
+ молибдованадофосфорная гетерополикислота про-
форная гетерополикислота объемом 20 мл (Vкат) с
водили по методике [10] в термостатированном ав-
концентрацией Pt 0.5·10-3-7.5·10-3 моль·л-1 готовили
токлаве при температуре (Трег) 160 (для ГПК-7) и
616
Родикова Ю. А., Жижина Е. Г.
140°С (для ГПК-4) и РО
= 0.4 МПа (кислород техни-
Таблица 1
2
ческий 1-й сорт, объемная доля не менее 99.7%, ООО
Состав Pt-содержащего катализатора для
«ПромГаз») в течение 20-30 мин (tрег).
низкотемпературного двустадийного окисления СО
в СО2 кислородом
Компонент катализатора
Концентрация, моль·л-1
Обсуждение результатов
H2PtCl6
0.5·10-3-7.5·10-3
Полный каталитический цикл двустадийного про-
ГПК-4 или ГПК-7
0.02-0.4
цесса окисления СО в СО2 (I) (стадия 1 — целевая
реакция, стадия 2 — регенерация катализатора) в
MeCl или МеBr (Ме = Li, Na,
0.5·10-2-2.0·10-1
присутствии гомогенной системы Pt + ГПК-х можно
K, ½Mg, ½Ca)
схематично представить уравнениями (II), (III):
CO + 1/2O2 Pt + ГПК-x CO2,
(I)
c различными окислителями, например Fe3+, были
t
описаны в работе [13].
CO + ГПК-x + H2O →
CO2 + H2ГПК-x, (II)
Наличие индукционного периода при использо-
H2ГПК-x + 1/2O2 → ГПК-x + H2O.
(III)
вании свежеприготовленного катализатора привело
к предположению, что активными компонентами
Катализатор представляет собой многоком-
целевой реакции в растворах Pt + ГПК-х являются
понентный водный раствор, содержащий галоид-
комплексы восстановленной платины, а не Н2PtCl6.
ный комплекс Pt(IV), ГПК-х заданного состава, а
С целью подтверждения указанного предположе-
также хлорид или бромид металла (табл. 1). В хо-
ния было выполнено сопоставление кинетических
де исследований с вариацией состава галогенида
кривых, полученных в присутствии идентичных по
металла, выполненных в условиях Vкат = 20 мл,
составу катализаторов, приготовленных разными
[ГПК-4] = 0.05 моль·л-1, [Н2PtCl6] = 2·10-3 моль·л-1,
методами. По первому из них в раствор ГПК-4 вво-
[MeX]/[Н2PtCl6] = 5, 25°С, pH 1.4, было найдено, что
дили платину в виде Н2PtCl6, затем к этому раствору
природа вводимого галогенида не влияет на актив-
добавляли NaCl. По второму способу в отсутствие
ность и стабильность каталитической системы, что
ГПК-4 предварительно получали Pt(CO)2, восстанав-
позволяет выбрать соль среди наиболее доступных.
ливая Н2PtCl6, а затем в атмосфере СО добавляли рас-
Исследования с использованием системы состава
твор ГПК-4 и NaCl. Оказалось, что во втором случае
Pt + ГПК-4, выполненные в условиях Vкат = 20 мл,
катализатор значительно быстрее достигает макси-
[ГПК-4] = 0.05 моль·л-1, [Н2PtCl6] = 2·10-3 моль·л-1,
мальной активности, которая полностью совпадает с
[NaCl]/[Н2PtCl6] = 5, 25°С, pH 1.4, позволили уста-
максимальной активностью системы, приготовленной
новить, что глубокое восстановление контактного
по первому способу, но работающей с индукционным
раствора СО при Т < 50°С без доступа О2 по урав-
периодом.
нению (II) приводит к образованию стабильного в
Изучение кинетики окисления СО в присутствии
атмосфере СО и нерастворимого в воде полимерного
гомогенного катализатора Pt + ГПК-4 позволило
соединения Pt(0) темно-вишневого цвета — дикар-
получить зависимости скорости окисления СО от
бонила Pt(0) состава [Pt(CO)2]n (n > 5). Указанный
концентрации Н2PtCl6 и концентрации СО (табл. 2).
комплекс ранее был получен и описан в работах [11,
Рассчитанный по этим данным порядок реакции по
12]. Последующее окисление раствора катализатора
Pt составил 0.8, порядок реакции по СО оказался рав-
кислородом или воздухом по уравнению (III) (регене-
ным 0.5. Также было установлено, что WСО не зависит
рация ГПК-х) обеспечивает восстановление окисли-
от концентрации ГПК-4 в области 0.02-0.4 моль·л-1,
тельной способности гетерополианионов. При этом
однако кинетические кривые имеют линейный уча-
комплекс Pt(CO)2 превращается в водорастворимый
сток, длительность которого изменяется с ростом
монокарбонил Н2Pt(CO)X2, и раствор снова стано-
содержания ванадия(V) в растворе катализатора.
вится гомогенным, восстанавливая свою активность.
Исследование зависимости WСО от температуры
Инфракрасные спектры выделенного Н2Pt(CO)X2
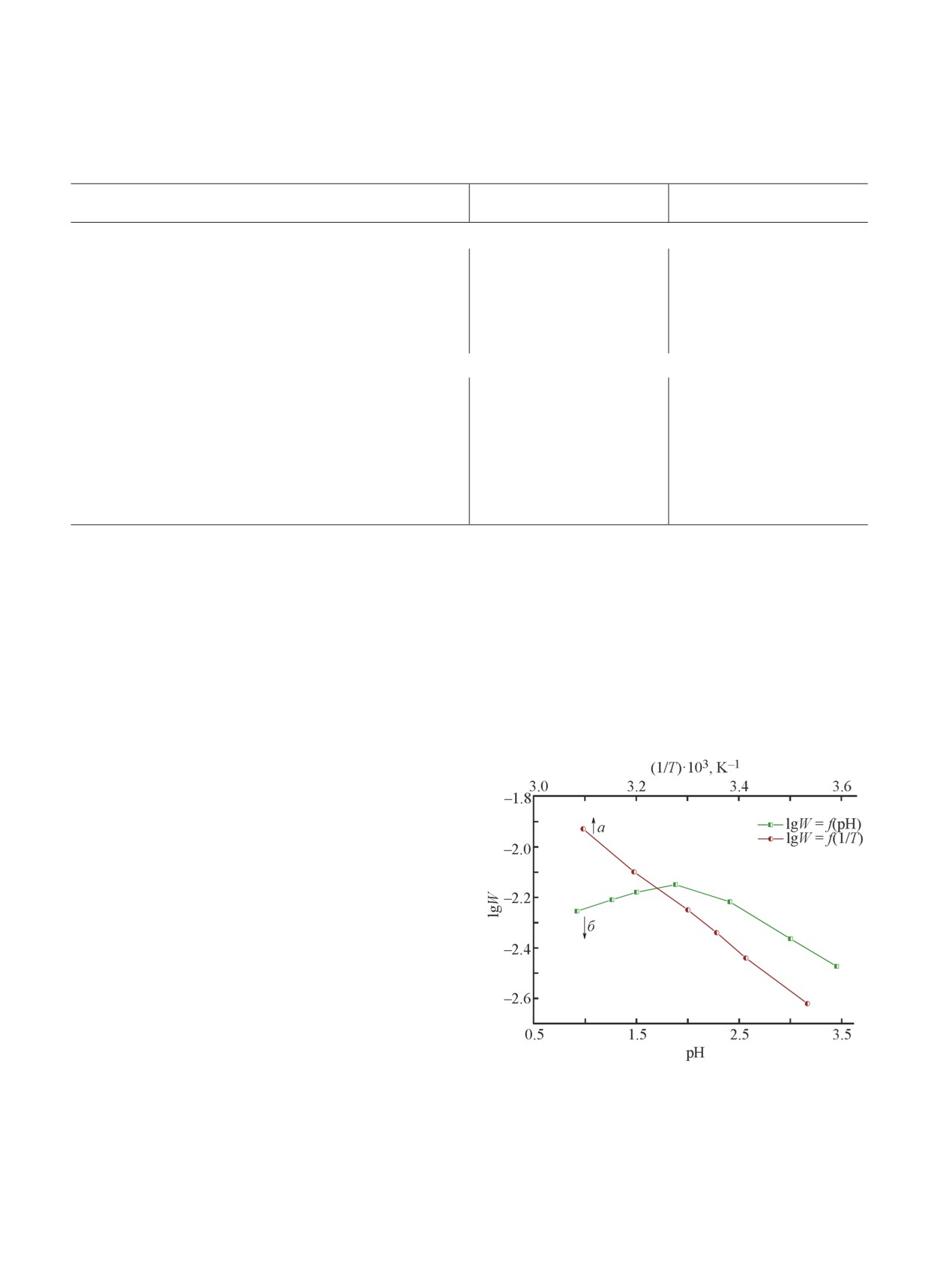
в интервале 10-50°С (рис. 1) позволило рассчитать
показали, что связь Pt—H имеет гидридный харак-
кажущуюся энергию активации Еа реакции, которая
тер, а само соединение представляет собой комплекс
составила 31.4 (±2) кДж·моль-1. Данный темпера-
восстановленной платины. Подобные соединения,
турный интервал был выбран, поскольку увеличение
образующиеся в процессе взаимодействия Pt(CO)2
Т целевой реакции выше 50°С в условиях снижения
окислительно-восстановительного потенциала ка-
Низкотемпературный процесс окисления монооксида углерода кислородом в присутствии гетерополикислот
617
Таблица 2
Зависимость скорости окисления СО от концентрации Н2PtCl6 и концентрации СО
Скорость окисления СО,
Параметр
Значение параметра, моль·л-1
моль·л-1·мин-1
Vкат = 20 мл, [Н7РМо8V4O40] = 0.05 моль·л-1, [NaCl]/[Н2PtCl6] = 10, 25°С, pH 1.25
Концентрация Н2PtCl6
0.0005
0.00087
0.001
0.00142
0.002
0.00246
0.005
0.00512
0.0075
0.0075
Vкат = 20 мл, [Н2PtCl6] = 5·10-3 моль·л-1, [NaCl] = 5·10-2 моль·л-1, [Н7РМо8V4O40] = 0.05 моль·л-1, 25°С, pH 1.25
Концентрация CO
0.0006
0.00512
0.00045
0.00464
0.00036
0.00410
0.0003
0.00330
0.00015
0.00228
0.000075
0.00166
0.000038
0.00118
тализатора приводило к уменьшению стабильности
лили установить оптимальное мольное отношение
каталитической системы и постепенному распаду
[X-]/[Н2PtCl6]] (2-5), обеспечивающее как достаточно
Pt(CO)2:
высокую активность, так и стабильность катализато-
ра (табл. 3).
Pt(CO)2 → Pt↓ + 2CO.
(IV)
С использованием установленных закономерно-
стей и найденных порядков реакции по Pt и СО было
Анализ влияния кислотности раствора показал,
получено кинетическое уравнение целевой реакции
что гомогенный катализатор низкотемпературного
(2), а также предложен ее механизм, замыкающий ка-
окисления СО Pt + ГПК-х с добавками галогенид--
ионов достаточно стабилен в интервале температур
10-50°С при 0.9 < pH < 2.5. Однако скорость окисле-
ния СО максимальна при рН 1.7-2.0 (рис. 1). По всей
видимости, указанный интервал рН является обла-
стью максимальной стабильности активного комплек-
са Н2Pt(CO)X2 с ГПК-х. Дезактивация катализатора
при более высоких значениях рН может происходить
вследствие снижения стабильности Н2Pt(CO)X2 и
постепенного образования фазы металлической пла-
тины. В то же время при существенном снижении рН
усиливается деструктивная диссоциация ГПК-х, что
влечет за собой падение активности катализатора из-
за образования ванадийсодержащих осадков.
В ходе экспериментов было обнаружено, что про-
ведение реакции в отсутствие дополнительных ионов
X- приводит к постепенному осаждению Ptмет при
повторной эксплуатации катализатора. Это проис-
Рис. 1. Зависимость скорости окисления СО от темпера-
ходит вследствие неустойчивости Н2Pt(CO)X2 при
туры (условия: Vкат = 20 мл, [Н2PtCl6] = 5·10-3 моль·л-1,
низких концентрациях галогенид-ионов, увеличе-
[Н7РМо8V4O40] = 0.05 моль·л-1, [NaCl] = 5·10-2 моль·л-1,
ние количества которых, с другой стороны, ведет к
pH 1.25) и рН контактного раствора (условия: Vкат =
снижению скорости окисления СО. Эксперименты
= 20 мл, [Н2PtCl6] = 5·10-3 моль·л-1, [Н7РМо8V4O40] =
в присутствии NaBr разной концентрации позво-
= 0.05 моль·л-1, [NaCl] = 5·10-2 моль·л-1, Т = 25°С).
618
Родикова Ю. А., Жижина Е. Г.
Таблица 3
Зависимость скорости окисления СО от мольного отношения [NaBr]/[Н2PtCl6] в растворе катализатора
Pt + Н7РМо8V4O40 (Vкат = 20 мл, [Н2PtCl6] = 5·10-3 моль·л-1, [Н7РМо8V4O40] = 0.05 моль·л-1, 25°С, pH 1.8)
Концентрация NaBr, моль·л-1
Мольное отношение [NaBr]/[Н2PtCl6]
Скорость окисления СО, моль·л-1·мин-1
0.01
2
0.00540
0.025
5
0.00505
0.05
10
0.00394
0.1
20
0.00300
0.2
40
0.00168
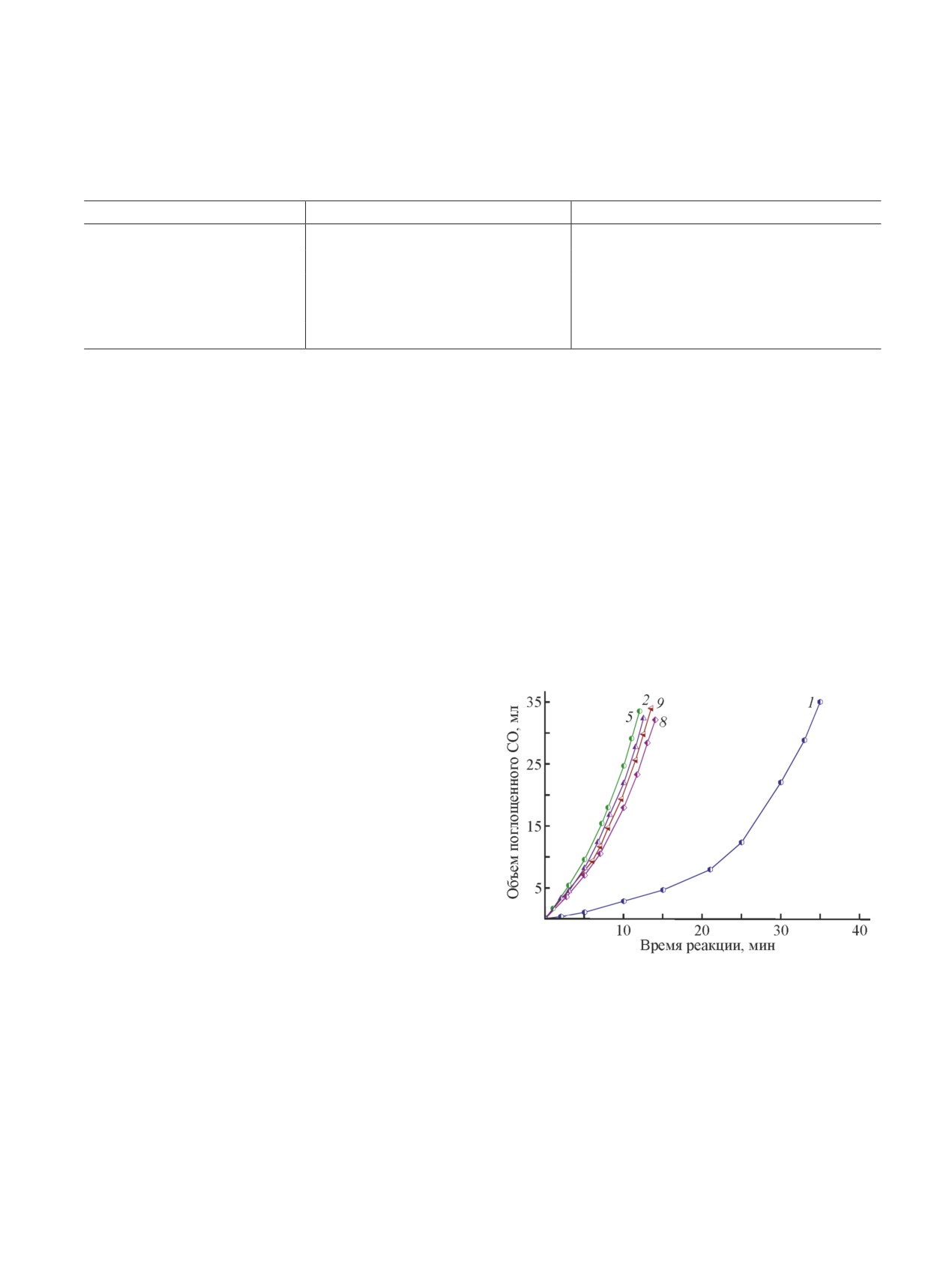
талитический цикл по платине [(V)-(VII)]. По ГПК-х
количеств соли палладия, в присутствии которого
каталитический цикл замыкается реакцией (III) окис-
Pt(IV) очень быстро восстанавливается в Pt(0). При
ления ее восстановленной формы кислородом, де-
мольном отношении Pt/Pd ~ 100 индукционный пери-
тально изученной в работах [10, 14].
од полностью исчезает, а активность комбинирован-
ного катализатора повышается (рис. 2). Катализатор
WСО = k[Pt]0.8[CO]0.5e31.4/RT,
(2)
Pt + Pd + ГПК-х показал высокую стабильность к
осадкообразованию, а также сохранение активности
PtX2-6 + 4CO + 2H2O → Pt(CO)2 + 2CO2 +
в реакции (I) на прежнем уровне после длительного
(V)
+ 4HX + 2X-,
хранения (цикл 9).
Дополнительным направлением исследований ста-
m/2Pt(CO)2 + mHX + m/2H2O + ГПК-x →
ла проверка сохранения установленных закономер-
(VI)
→ m/2H2Pt(CO)X2 + m/2CO2 + HmГПК-x,
ностей при переходе от растворов гетерополикислот
, x = 1-6) к раство-
состава Кеггина (Н3+хРMo12-xVxO40
H2Pt(CO)X2 + CO → Pt(CO)2 + 2HX, (VII)
рам гетерополикислот брутто-состава HaPzMoyVxOb
где X — Cl- или Br-, HmГПК-х — восстановленная на
m электронов форма ГПК-х.
Отметим, что в каждом цикле реакция контактного
раствора с СО начинается с индукционного периода,
который тем продолжительнее, чем глубже степень
регенерации ГПК-х по реакции (III) на предыдущем
цикле. Возникновение индукционного периода мож-
но отнести к окислению активного Н2Pt(CO)X2 на
стадии регенерации катализатора в комплекс PtX2-6 ге-
терополикислотой в отсутствие СО. Поэтому на сле-
дующем цикле процесс (I) начинается с медленного
этапа (V). Дробный порядок реакции по СО позволя-
ет предположить, что после восстановления платины
и образования ее активного комплекса скорость реак-
ции лимитируется этапом (VI) — окислением Pt(CO)2
Рис. 2. Зависимость объема поглощенного СО от
в Н2Pt(CO)X2 гетерополикислотой. Независимость
времени в присутствии каталитической системы
WСО от [ГПК-х] может быть обоснована сложным
Pt + (Pd) + Н7РМо8V4O40 в 9 циклах [условия: Vкат =
механизмом стадии (VI), при котором равновесный
= 20 мл, [Н2PtCl6] = 1·10-3 моль·л-1, [Н7РМо8V4O40] =
= 0.05 моль·л-1, [NaBr] = 5·10-3 моль·л-1, pH 1.8,
этап образования стабильного комплекса Pt(CO)2 с
Т = 25°С, Трег = 140°С, tрег = 30 мин. Перед 2-м цик-
ГПК-х предшествует этапу электронного переноса,
лом в раствор добавлен PdCl2 до концентрации
лимитирующего скорость реакции окисления СО.
1·10-5 моль·л-1. После 8 циклов регенерированный ката-
Индукционный период, наблюдаемый на следу-
лизатор хранился в закрытом сосуде в помещении лабо-
ющем цикле реакции (I) после регенерации катали-
ратории без создания специфических условий хранения
затора Pt + ГПК-х в окислительной атмосфере, мо-
в течение 2 мес, затем его активность была повторно
жет быть сокращен путем введения каталитических
исследована в реакции (I)].
Низкотемпературный процесс окисления монооксида углерода кислородом в присутствии гетерополикислот
619
[z = 1-3, y = 8-18, x = 7-12, a = 2b-6y-5(x + z),
участка кинетической кривой при полном совпадении
b = 40-89] с повышенным содержанием ванадия.
других параметров. Наблюдаемое различие можно
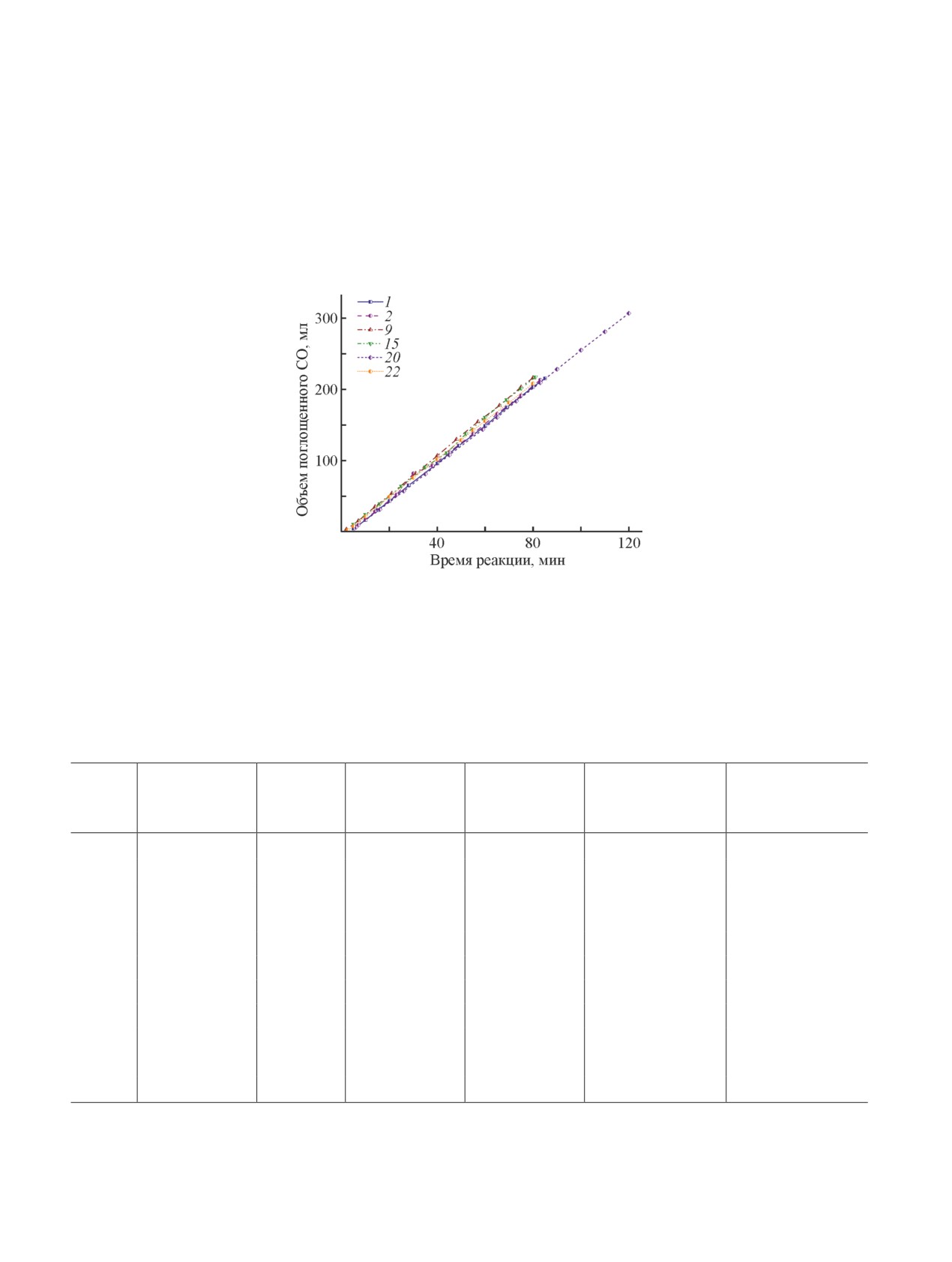
Сопоставление кинетики окисления СО в СО2 в при-
объяснить концентрацией ванадия(V) в гомогенном
сутствии гомогенной системы Pt + ГПК-х с исполь-
катализаторе, которая в случае 0.25 моль·л-1 раствора
зованием растворов ГПК-4 и ГПК-7 показало разли-
ГПК-7 в 8.75 раза превосходит его концентрацию в
чие в продолжительности стационарного линейного
0.05 моль·л-1 растворе ГПК-4. Именно значительное
Рис. 3. Зависимость объема поглощенного СО от времени раствором катализатора Pt + Pd + Н10Р3Мо18V7O84
в 22 циклах (условия: Vкат = 20 мл, [Н2PtCl6] = 1·10-3 моль·л-1, [PdCl2] = 1·10-5 моль·л-1, [Н10Р3Мо18V7O84] =
= 0.25 моль·л-1, [NaBr] = 2.5·10-3 моль·л-1, pH 0.2, Т = 25°С, Трег = 160°С, tрег = 20 мин).
Таблица 4
Результаты многоциклового испытания гомогенного катализатора Pt + Pd + Н10Р3Мо18V7O84 на стабильность
в 22 циклах процесса окисления СО в СО2 (условия: Vкат = 20 мл, [Н2PtCl6] = 1·10-3 моль·л-1,
[PdCl2] = 1·10-5 моль·л-1, [Н10Р3Мо18V7O84] = 0.25 моль·л-1, [NaBr] = 2.5·10-3 моль·л-1, pH 0.2, Т = 25°С,
Трег = 160°С, tрег = 20 мин)
Исходный
Время
Объем
Скорость
Потенциал
Потенциал
№ цикла
потенциал
реакции,
поглощенного
окисления СО,
катализатора после
катализатора после
катализатора, В
мин
СО, мл
моль·л-1·мин-1
реакции, В
регенерации, В
1
1.086
85
216
0.00552
0.841
1.005
2
1.005
83
214
0.00563
0.845
0.999
3
0.999
81
215
0.00553
0.840
1.011
4
1.011
80
211
0.00567
0.847
1.007
5
1.007
83
216
0.00558
0.839
1.005
6
1.005
82
212
0.00563
0.845
1.008
9
1.000
80
217
0.00570
0.844
1.003
15
1.010
81
218
0.00569
0.850
0.999
20
1.005
120
308
0.00552
0.757
1.002
21
1.002
82
213
0.00566
0.841
1.008
22
1.008
80
209
0.00561
0.844
1.004
Примечание. Все значения окислительно-восстановительного потенциала приведены относительно нормального
водородного электрода. Для предотвращения возможного осадкообразования и снижения активности каталитической
системы при низких значениях потенциала (ниже 0.7 В) максимальное восстановление раствора катализатора в прове-
денных исследованиях не превышало ~75%.
620
Родикова Ю. А., Жижина Е. Г.
содержание ванадия(V) в растворах ГПК-х брутто-со-
затор Pt + Pd + ГПК-х на основе раствора ГПК-х брут-
става HaPzMoyVxOb обеспечивает их большую окис-
то-состава H11P4Mo18V7O87 демонстрирует высокую
лительную емкость и высокую производительность
эффективность в реакции окисления СО в СО2, сохра-
каталитических систем на их основе.
няет стабильность при многоцикловом использовании
Для подтверждения высокой эффективности
без снижения активности. Он способен обеспечить
комбинированного катализатора Pt + Pd + ГПК-7
технологичность низкотемпературного каталитиче-
в двустадийном процессе (I) окисления СO в СО2,
ского процесса окисления СО, пригодного для очистки
складывающемся из формальных реакций (II) и (III),
газов от примесей СО при любой степени влажности.
были проведены многоцикловые испытания этой ка-
талитической системы на стабильность в 22 циклах
Финансирование работы
(рис. 3). Полученные результаты продемонстрирова-
ли стабильную работу каталитической системы при
Работа выполнена при финансовой поддержке
сохранении гомогенности раствора во всех циклах.
Министерства науки и высшего образования РФ в
Образования осадков платины и палладия, а также
рамках государственного задания Института катализа
смешанных оксидов ванадия(V) и ванадия(IV) не
СО РАН.
наблюдалось. Во время регенерации катализатора
кислородом за 20 мин при 160°С достигалось близкое
Конфликт интересов
к исходному значение окислительно-восстановитель-
Авторы заявляют об отсутствии конфликта инте-
ного потенциала, что обеспечивало сохранение вы-
ресов, требующего раскрытия в данной статье.
сокой окислительной емкости раствора в реакции (I)
на следующем цикле и активности системы (табл. 4).
Информация об авторах
Нагрузка на катализатор (количество поглощенного
СО), как и начальная скорость реакции, были во всех
Родикова Юлия Анатольевна, к.х.н.
циклах практически одинаковыми.
Следует отметить, что максимально возможная
Жижина Елена Георгиевна, д.х.н.
нагрузка на 20 мл катализатора Pt + Pd + ГПК-7
при заданных условиях (рис. 3, табл. 4) составляет
~420 мл СО, тогда как в присутствии катализато-
Список литературы
ра Pt + Pd + ГПК-4 (рис. 2) можно окислить только
[1] Prockop L. D., Chichkova R. I. Carbon monoxide
48 мл СО. Эти данные характеризуют высокую про-
intoxication: An updated review // J. Neurol. Sci. 2007.
изводительность гомогенных катализаторов на ос-
V. 262. N 1-2. P. 122-130.
нове модифицированных высокованадиевых ГПК-х.
Способность модифицированной системы быстро
[2] Etim U. J., Bai P., Gazit O. M., Zhong Z. Low-
регенерироваться кислородом (воздухом) может обе-
temperature heterogeneous oxidation catalysis and
спечить технологичность исследованного каталити-
molecular oxygen activation // Catal. Rev. 2023. V. 65.
ческого процесса, пригодного для очистки газов от
N 2. P. 239-425.
примесей СО с любой степенью влажности.
[3] Dey S., Dhal G. C. Highly active palladium
nanocatalysts for low-temperature carbon monoxide
Выводы
oxidation // Polytechnica. 2020. V. 3. P. 1-25.
На основе галоидных комплексов Pt и молибдова-
[4] Dey S., Dhal G. C., Mohan D., Prasad R. Advances in
надофосфорных гетерополикислот разработан гомо-
transition metal oxide catalysts for carbon monoxide
генный катализатор окисления СО в СО2, проявляю-
oxidation: A review // Adv. Compos. Hybrid Mater.
щий высокую активность при нормальных условиях.
2019. V. 2. P. 626-656.
Введение в состав каталитической системы допол-
нительных галогенид-ионов приводит к повышению
[5] Dey S., Dhal G. C. Applications of silver nanocatalysts
стабильности катализатора. Использование добавки
for low-temperature oxidation of carbon monoxide
в виде соли палладия обеспечивает снятие индук-
// Inorg. Chem. Commun. 2019. V. 110. ID 107614.
ционного периода. Увеличение содержания ванадия
приводит к росту активности каталитической системы
[6] Матвеев К. И., Жижина Е. Г., Одяков В. Ф.,
Pt + (Pd) + ГПК-х благодаря увеличению окислитель-
Пармон В. Н. Гомогенные катализаторы окисли-
ной емкости катализатора. Комбинированный катали-
тельно-восстановительных процессов на основе
Низкотемпературный процесс окисления монооксида углерода кислородом в присутствии гетерополикислот
621
растворов гетерополикислот. I. Результаты пилот-
[10]
Zhizhina E. G., Odyakov V. F. Regeneration of the
ных испытаний катализатора и процесса синтеза
oxidation catalysts based on the aqueous solutions of
метилэтилкетона // Катализ в пром-сти. 2014. № 3.
non-Keggin Mo-V-P heteropoly acids by molecular
oxygen // Int. J. Chem. Kinet. 2014. V. 46. N 9. P. 567-
Zhizhina E. G., Odyakov V. F., Parmon V. N.
Homogeneous redox catalysts based on heteropoly acid
[11]
Booth G., Chatt J., Chini P. Platinum carbonyls
solutions: I. Pilot testing of a catalyst and methyl ethyl
substituted by tertiary phosphines // Chem. Commun.
ketone synthesis // Catal. Ind. 2014. V. 6. N 3. P. 202-
1965. V. 24. P. 639-640.
[7]
Odyakov V. F., Zhizhina E. G., Maksimovskaya R. I.
[12]
Матвеев К. И., Рачковская Л. Н., Еременко Н. К.
Synthesis of molybdovanadophosphoric heteropoly acid
Карбонил нольвалентной платины // Изв. СО АН
solutions having modified composition // Appl. Catal.
СССР. Сер. хим. наук. 1968. № 2. С. 81-87.
A: General. 2008. V. 342. N 1-2. P. 126-130.
[13]
Рачковская Л. Н., Еременко Н. К., Матвеев К. И.
[8]
Одяков В. Ф., Жижина Е. Г. Новый способ синтеза
Монокарбонил платины // ДАН СССР. 1970. Т. 190.
водных растворов Mo-V-фосфорных гетерополикис-
лот // ЖНХ. 2009. Т. 54. № 3. С. 409-414.
[14]
Жижина Е. Г., Одяков В. Ф., Симонова М. В.,
Матвеев К. И. Кинетика окисления восстановлен-
[Odyakov V. F., Zhizhina E. G. New process for
ных форм Мо-V-фосфорных гетерополикислот
preparing aqueous solutions of Mo-V-phosphoric
кислородом в водных растворах // Кинетика и ка-
heteropoly acids // Russ. J. Inorg. Chem. 2009. V. 54.
тализ. 2005. Т. 46. № 3. С. 380-389.
N 3. P. 361-367.
[Zhizhina E. G., Odyakov V. F., Simonova M. V.,
[9]
Dikshitulu L. S. A., Gopala Rao G. Titrimetric
Matveev K. I. Kinetics of oxidation of reduced
determination of vanadium(IV) with potassium
phosphorus-molybdenum-vanadium heteropoly acid
permanganate at the room temperature, using
species with dioxygen in aqueous solutions // Kinet.
phosphoric acid as catalyst and ferroin as internal
Catal. 2005. V. 46. N 3. P. 354-363.
indicator // Anal. Bioanal. Chem. 1962. V. 189. N 5.