Радиохимия, 2019, т. 61, N 1, c. 7-12
7
Газофазная конверсия мононитрида урана в нитрующей атмосфере
© С. А. Кулюхина, Ю. М. Неволинб, А. В. Гордеева
а Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: kulyukhin@ipc.rssi.ru
б Кафедра радиохимии химического факультета Московского государственного университета им. М. В. Ломоносова,
119991, Москва, Ленинские горы, 1, стр. 10
Получена 05.03.2018, после доработки 17.04.2018, принята к публикации 18.04.2018
УДК 546.799+546.65+621.039.72
Исследована газофазная конверсия UN в водорастворимые соединения в атмосфере NOx-воздух,
NOx-H2O (пар)-воздух и HNO3 (пар)-воздух (далее - нитрующая атмосфера) в интервале температур от
298 до 673 К. Использование окислительной атмосферы на основе NOx-газов позволяет проводить кон-
версию при более низкой температуре. При этом образуются как UO3, так и гидраты UO2(NO3)2. Макси-
мальная степень конверсии UN в водорастворимые соединения, равная ~80%, достигается при темпера-
туре процесса ~565 К. В процессе газофазной конверсии UN в атмосфере NOx-H2O (пар)-воздух и
HNO3 (пар)-воздух переходит в водорастворимые соединения (нитраты, гидроксинитраты). Газофазная
конверсия UN в атмосфере NOx-H2O (пар)-воздух протекает с меньшей эффективностью, чем в атмо-
сфере HNO3 (пар)-воздух.
Ключевые слова: мононитрид урана, газофазная конверсия, нитрующая атмосфера.
DOI: 10.1134/S0033831119010027
В настоящее время смешанное нитридное уран-
новлено, что в процессе газофазной конверсии неко-
плутониевое топливо рассматривается как потенци-
торые соединения (U3O8, SrO, SrUO4) переходят в
альное высокотемпературное плотное топливо для
водорастворимые соединения (нитраты, гидрокси-
реакторов на быстрых нейтронах [1-3]. Переработка
нитраты), в то время как другие (MoO3, SrMoO4) ли-
как некондиционного ядерного топлива (ЯТ), так и
бо претерпевают частичное изменение, либо остают-
отработавшего ядерного топлива (ОЯТ) предусмат-
ся без изменений. Для UO2MoO4, UMo1.7O7.2 и
ривает стадию растворения в HNO3. При растворе-
UMo0.4O3.4 газофазная конверсия в нитрующей атмо-
нии нитридного топлива в HNO3 образуются окси-
сфере приводит к образованию водорастворимых
ды азота (N2O, NO и NO2), от которых требуется
соединений урана, а также нерастворимой в воде
очистка газовой фазы. Использование различных
фазы MoO3·2H2O. Промывка продуктов конверсии
жидких ловушек позволяет практически количест-
UO2MoO4, UMo1.7O7.2 и UMo0.4O3.4 потоком воды в
венно очистить газовый поток от NO и NO2. В то же
колонке позволяет эффективно переводить U в рас-
время известно, что N2O (парниковый газ) является
твор, при этом Mo остается в колонке в виде нерас-
несолеобразующим оксидом и практически не взаи-
творимого осадка. В результате показана принципи-
модействует ни с щелочами, ни с кислотами. При
альная возможность отделения U от Mo путем газо-
растворении 1 моля UN в HNO3 образуется около
фазной конверсии соединений в нитрующей атмо-
1 моля N2O [4, 5]. Помимо необходимости очистки
сфере.
газового потока от N2O остаются проблемы коллои-
В работе [10] двухстадийный процесс волоксида-
дообразования на стадии растворения ОЯТ в HNO3.
ции оксидного топлива проводили с использованием
NO2. На первой стадии осуществляли окисление
Электрохимическая модель растворения UN в
UO2 до UO3 при температуре ~473-725 К, на второй
HNO3 была предложена в работе [6], в соответствии
- конверсию UO3 в UO2(NO3)2 при ~393-403 К. Дан-
с которой растворение описывается следующей ре-
ный подход имеет ряд преимуществ перед окислени-
акцией:
ем UO2 в воздушной атмосфере. Во-первых, данный
O +
6UN + 25HNO3 → 6UO2(NO3)2 + 3NH3 + N2 + N2
процесс проводят при более низких температурах по
+ 6NO + 6NO2 + 8H2O.
(1)
сравнению с «классической» волоксидацией (~725-
775 К). Во-вторых, образующийся UO3 является бо-
В процессе растворения наблюдается образова-
лее реакционноспособным и не требует жестких ус-
ние различных газообразных продуктов, включая
ловий для дальнейшего передела. В-третьих, данный
аммиак, азот и оксиды азота.
процесс, по мнению авторов работы [10], позволяет
В работах [7-9] была исследована газофазная
в дальнейшем провести отделение U и Pu от Tc. В
конверсия ряда соединений, имитирующих компо-
настоящее время в литературе отсутствует информа-
ненты окисленного топлива, в нитрующей атмосфе-
ция о поведении UN в процессе волоксидации с ис-
ре в интервале температур от ~298 до ~423 К. Уста-
пользованием NO2. Представляло интерес исследо-
8
С. А. Кулюхин и др.
вать волоксидацию в атмосфере NO2 при более вы-
соких температурах, но в отсутствие паров воды.
Исследование газофазной конверсии UN в водо-
растворимые соединения в нитрующей атмосфере
составило цель настоящей работы.
Экспериментальная часть
В работе использовали коммерческий таблетиро-
ванный мононитрид урана, поставленный ВНИИХТ.
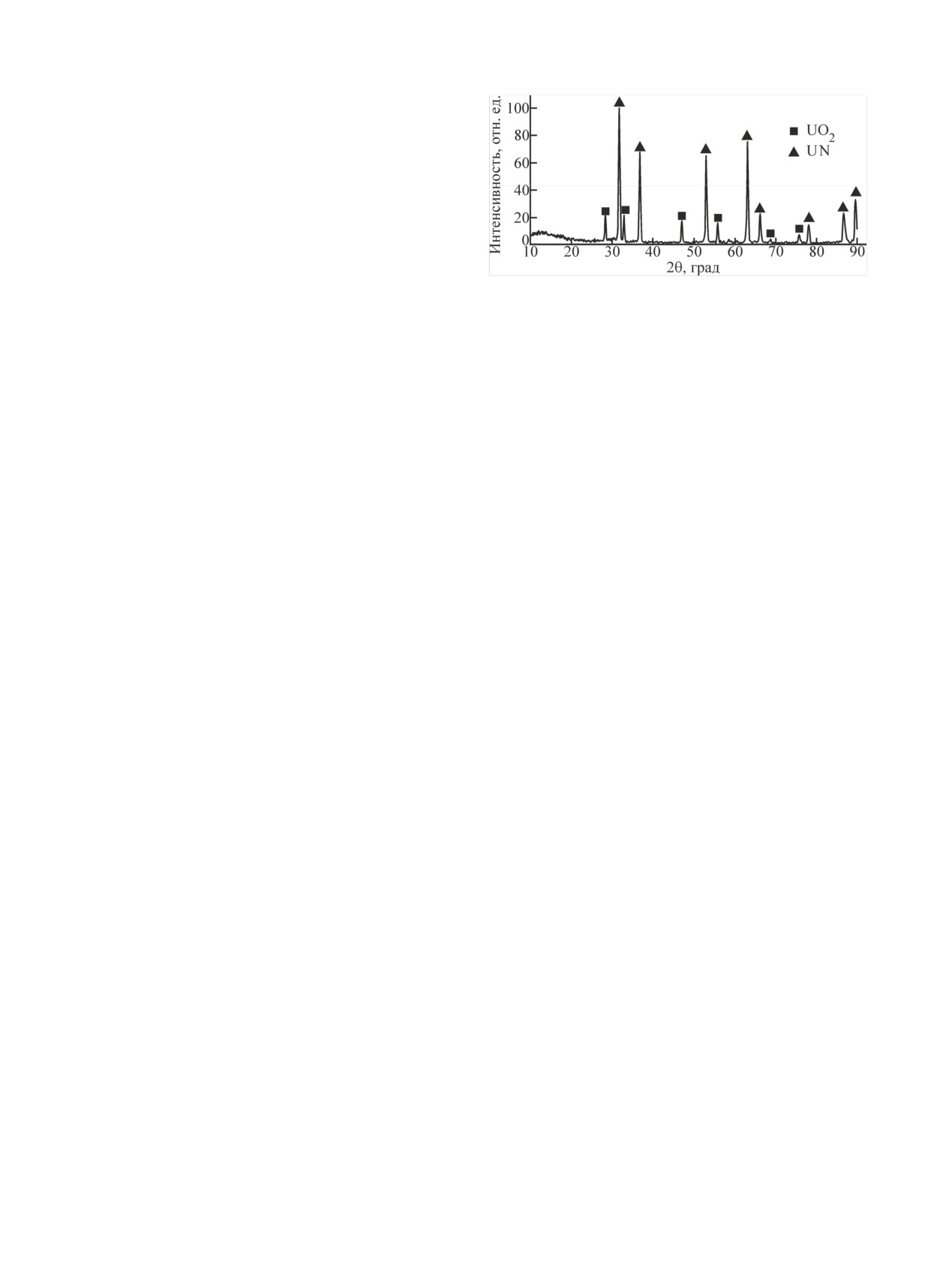
Рис. 1. Порошковая дифрактограмма исходного мононитрида
Анализ рентгеновской дифрактограммы (рис. 1) по-
урана UN. Наблюдаемые рефлексы UN [11], UO2 [12].
казал наличие в продукте примеси UO2 помимо ос-
новной фазы UN.
центрифугированием. Осадок сушили до воздушно-
сухого состояния и взвешивали. В маточном раство-
Азотная кислота, использованная в работе, была
ре определяли содержание U(VI). Зная исходное ко-
марки ч. Газообразные NOx получали путем взаимо-
личество UN и содержание U(VI) в растворе, рассчи-
действия 2 г латуни марки Л68, содержащей 67-70%
тывали степень конверсии UN в водорастворимые
Cu и 30-33% Zn, с 10 мл 12 моль/л HNO3.
соединения.
Эксперименты по газофазной конверсии UN в
Количество U(VI) в воде определяли методом
атмосфере NOx-H2O (пар)-воздух и HNO3 (пар)-
спектрофотометрии. Спектры поглощения растворов
воздух проводили по методикам, приведенным в ра-
UO2+ в воде снимали на спектрофотометре Specord
ботах [7-9]. Конечные продукты реакции взвешива-
M40 в кварцевых кюветах с толщиной поглощающе-
ли, заливали дистиллированной водой и оставляли на
го слоя 1-5 см. Концентрацию UO2+ рассчитывали по
10-15 мин. В результате происходило либо полное,
полосе λ = 414 нм [ε = 7.8 л/(моль·см)].
либо частичное растворение. Полученные из UN
желтые продукты быстро растворялись в воде с об-
Порошковые рентгенограммы исходного UN и
разованием желтого раствора. Образцы черного цве-
продуктов его превращений в нитрующей атмосфере
та не растворялись в воде. Осадки высушивали при
получали на дифрактометре ADP-10 (Philips) с излу-
температуре ~383 К на воздухе до воздушно-сухого
чением CuKα.
состояния и взвешивали.
ИК спектры газовой фазы измеряли на спектро-
Поведение UN в атмосфере NOx-воздух изучали с
метре Specord M 80. Газовые кюветы для ИК спек-
помощью системы эксикаторов, используемой в
троскопии с окнами из KBr имели объем 125 см3 и
опытах по газофазной конверсии U3O8 в водораство-
длину поглощающего слоя 100 мм. Идентификацию
римые соединения в атмосфере NOx-H2O (пар)-
полос в ИК спектрах проводили по данным, приве-
воздух [7]. Однако в отличие от опытов работы [7] во
денным в работах [13, 14].
внутреннем эксикаторе, содержащем UN, создава-
Результаты и обсуждение
лась атмосфера безводного NOx. Данную атмосферу
получали следующим образом. Создавали систему из
Конверсия UN в атмосфере NOx-воздух
двух эксикаторов, соединенных между собой через
Для проведения волоксидации UN в атмосфере
трубку, заполненную SiO2, прокаленным при ~450 К.
NO2 в отсутствие паров воды был выбран темпера-
В первом эксикаторе создавали атмосферу NOx-H2O
турный режим от ~423 до ~725 К. Данный диапазон
(пар)-воздух. Второй эксикатор, содержащий UN,
включал температуры, используемые в процессах
вакуумировали. Затем оба эксикатора соединяли и
волоксидации в работах [7, 9, 10]. Помимо рентгено-
перекачивали NOx из первого эксикатора во второй
фазового состава продуктов окисления UN определя-
за счет разницы давления. В результате эксикатор с
ли также степень его конверсии в водорастворимые
UN заполнялся безводными NOx. Далее эксикатор с
соединения.
UN помещали в эксикатор большего размера и про-
водили дальнейший эксперимент по методике, пред-
При температуре процесса менее ~473 К продукт
ставленной в работе [7]. Окисление образцов UN
конверсии представлял собой компактный образец
проводили в интервале температур ~403-673 К и
темного цвета, покрытый желтой пленкой. При кон-
времени выдержки 5-10 ч. Конечные продукты взве-
такте с водой желтый продукт быстро растворялся с
шивали и отбирали навески для рентгенофазового
образованием бледно-желтого раствора. При этом
анализа. Оставшуюся часть конечного продукта об-
оставался порошкообразный темный осадок. Фазо-
рабатывали дистиллированной водой. При неполной
вый состав отмытого темного осадка соответствовал
конверсии в системе оставался нерастворимый в во-
исходному UN, а спектр оптического поглощения
де осадок, который отделяли от маточного раствора
водного раствора имел полосу поглощения, харак-
Газофазная конверсия мононитрида урана
9
Таблица 1. Конверсия UN в водорастворимые соединения в атмосфере NOx-воздух
Навеска
Δm
Растворимость в воде
Номер
Время
Конверсия
исходная
после выдержки,
U в растворе,
опыта
г
%
выдержки/T, К
остаток, г
UN, %а
г
ммоль
г
ммоль
1
0.23
0.91
0.23
-
-
5 ч/403
-
0.23
~0
2
0.23
0.91
0.23
-
-
5 ч/423
-
0.23
~0
3
0.38
1.51
0.42
~0.04
~10.5
5 ч/473
0.17
0.35
~11.3
4
0.39
1.55
0.40
~0.01
~2.6
10 ч/473
0.19
0.38
~12.3
5
0.65
2.58
0.75
~0.10
~15.4
5 ч/565
2.13
0.14
~82.6
6
0.13
0.52
0.15
~0.02
~15.4
5 ч/673
0.06
0.15
~11.5
a Конверсию рассчитывают как отношение содержания U в растворе к его исходному количеству; то же в табл. 2.
терную для UO22+. Анализ показал, что при темпера-
ятно, поскольку они разлагаются при температурах
турах менее ~473 К степень конверсия UN в водорас-
ниже ~575 К [23-27]. При взаимодействии продук-
творимые соединения не превышает 12% (опыты 1-4
тов конверсии UN с водой образовывался бледно-
в табл. 1). Таким образом, при температуре процесса
желтый раствор и оставался нерастворимый темный
менее ~473 К в присутствии NOx происходила час-
тичная конверсия UN в водорастворимые соедине-
ния уранила.
С целью увеличения степени конверсии UN в во-
дорастворимые соединения были проведены экспе-
рименты при температуре ~565 и ~675 К.
В экспериментах при ~565 К продукт конверсии
UN представлял собой кирпично-красный порошок.
Его порошковая дифрактограмма содержала рефлек-
сы, характерные для ε-UO3 и гидратов UO2(NO3)2·
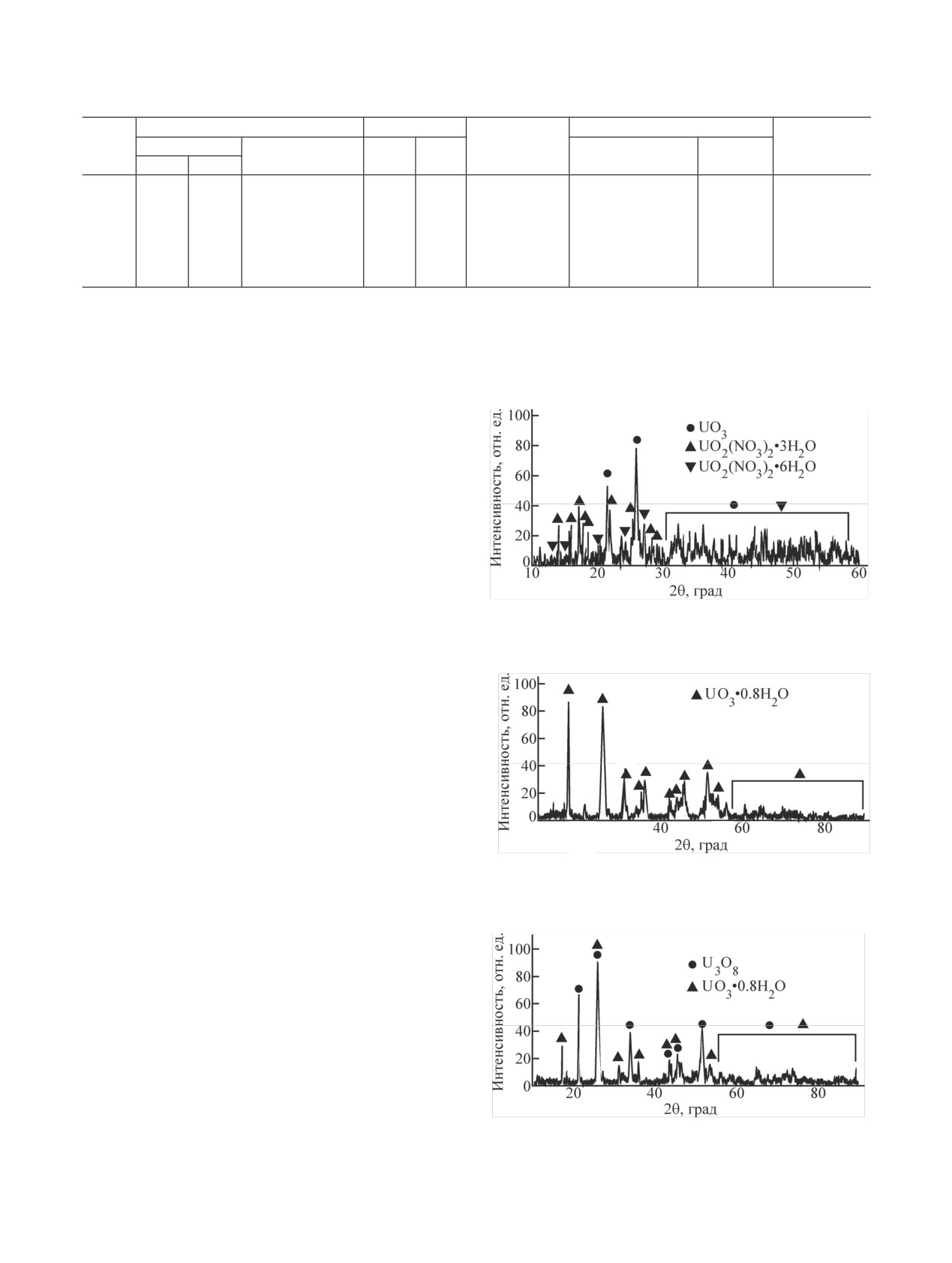
Рис. 2. Порошковая дифрактограмма продуктов конверсии UN
nH2O (рис. 2). Как отмечено в работах [18, 19], моди-
в атмосфере NOx-воздух в течение 5 ч при ~565 К. Наблюдае-
фикация ε-UO3 образуется исключительно при окис-
мые рефлексы ε-UO3 [15], UO2(NO3)2·3H2O [16], UO2(NO3)·
лении оксидов урана в атмосфере NO2. Образование
6H2O [17].
ε-UO3 также было подтверждено в ходе эксперимен-
тов по волоксидации UO2 в атмосфере NOx [18, 20].
С другой стороны, авторами работ [18, 20] показано,
что при полном отсутствии паров воды в NO2 обра-
зования нитратов не происходит. Появление нитра-
тов в продуктах конверсии в наших экспериментах
может быть связано, по-видимому, с недостаточной
степенью обезвоживания NO2. При контакте продук-
20
та конверсии с водой образовывался желтый раствор
и оставался нерастворимый красный осадок. Спектр
оптического поглощения раствора содержал полосы,
Рис. 3. Порошковая дифрактограмма нерастворимого в воде
красного осадка, образовавшегося после контакта продуктов
характерные для UO2+. При этом степень конверсии
конверсии UN в атмосфере NOx-воздух в течение 5 ч при
UN в водорастворимые соединения составляла ~80%
~565 К с водой. Наблюдаемые рефлексы UO3·0.8H2O [21].
(опыт 5 табл. 1). Порошковая дифрактограмма нерас-
творимого в воде красного осадка, представленная на
рис. 3, содержит рефлексы, принадлежащие UO3·
0.8H2O [21].
Конверсия UN в атмосфере NOx при ~675 К при-
водила к образованию темно-красных порошков с
примесью порошков черного цвета. Фазовый состав
продукта конверсии UN представлял собой смесь
U3O8 и UO3·0.8H2O (рис. 4). Данные соединения мо-
гут быть продуктами как окисления исходного UN,
так и превращения UO3, образующегося в процессе
Рис. 4. Порошковая дифрактограмма продуктов конверсии UN
волоксидации UN. Образование гидратов уранила
в атмосфере NOx-воздух в течение 5 ч при ~675 К. Наблюдае-
UO2(NO3)2·nH2O при данной температуре маловеро-
мые рефлексы U3O8 [22], UO3·0.8H2O [21].
10
С. А. Кулюхин и др.
осадок. Спектр оптического поглощения раствора
продуктов конверсии содержал полосу, характерную
для иона UO2+. Степень конверсии UN в водораство-
римые соединения составила ~12% (опыт 6 табл. 1).
Фазовый состав нерастворимого в воде осадка прак-
тически полностью соответствовал составу продукта
после конверсии UN за исключением слабых пиков
нитратов или гидроксинитратов уранила.
Следует отметить, что при ~565 К наблюдалась
максимально возможная степень конверсии UN в
нитраты или гидроксинитраты уранила. Даже не-
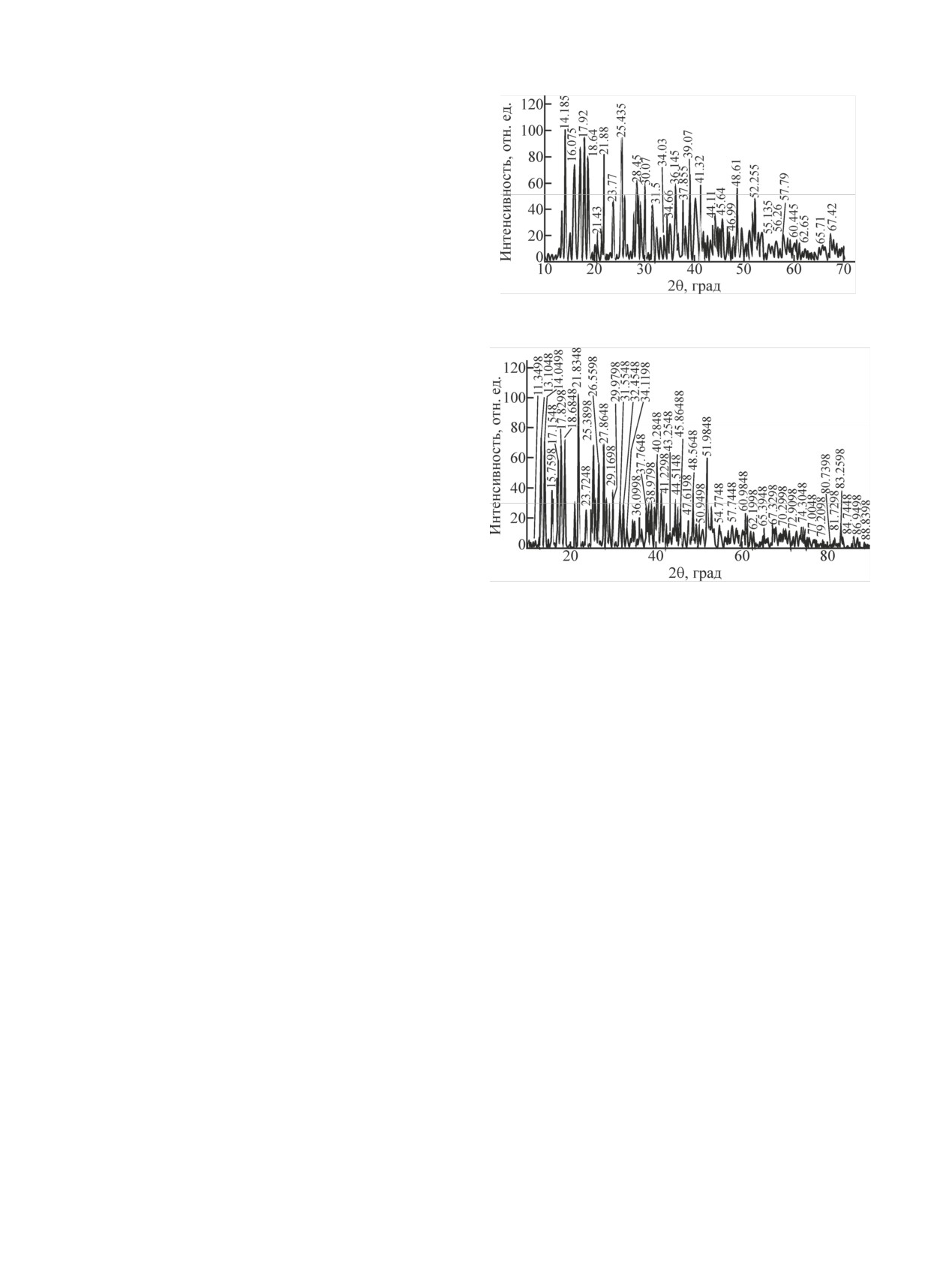
Рис. 5. Порошковая дифрактограмма продуктов конверсии UN
большие следы влаги существенно повышали сте-
в атмосфере NOx-H2O (пар)-воздух при ~403 К в течение 5 ч.
пень конверсии UN в водорастворимые соединения.
В связи с этим представляло интерес исследовать
конверсию UN в атмосфере NOx-H2O (пар)-воздух и
HNO3 (пар)-воздух.
Конверсия UN в атмосфере NOx-H2O (пар)-воздух
и HNO3 (пар)-воздух
Газофазная конверсия UN в атмосфере NOx-H2O
(пар)-воздух с образованием водорастворимых со-
единений может быть описана следующими уравне-
ниями:
UN + 5NO2 + O2 + nH2O → UO2(NO3)2·nH2O + N2O +
+ NO + NO2 (n = 0, 1, 3 или 6),
(2)
Рис. 6. Порошковая дифрактограмма продуктов конверсии UN
2UN + 4NO2 + 7/2O2 + H2O → 2UO2(OH)NO3 + N2O +
в атмосфере HNO3 (пар)-воздух при ~403 К в течение 5 ч.
+ NO + NO2.
(3)
для UO2+. Из полученных спектров поглощения
Газовая конверсия UN в атмосфере HNO3
(пар)-
сделан вывод об образовании водорастворимых
воздух с образованием водорастворимых соедине-
солей уранила. Также в ряде опытов оставался чер-
ний может быть описана реакцией (1).
ный, нерастворимый в воде остаток UN.
Согласно реакциям (1)-(3), конверсия в нитрую-
В табл. 2 приведены результаты, полученные
щей атмосфере должна приводить к изменению
при конверсии образцов UN в нитрующей атмосфе-
массы образцов. При этом образование новых фаз
ре. Как видно из табл. 2, во всех опытах наблюда-
U может привести к изменению окраски образцов.
лось увеличение массы, что говорит об изменении
Действительно, в результате конверсии UN в нит-
химического состава образцов. Конверсия UN мо-
рующей атмосфере цвет образца менялся с черного
жет протекать через образование на поверхности
на желтый. В ряде опытов одновременно присутст-
образца UO2, U3O8 и UO2(OH)2, которые в дальней-
вовали образцы черного и желтого цвета.
шем, по-видимому, подвергаются нитрованию с
На рис. 5 и 6 приведены порошковые дифракто-
образованием нитрата или гидроксинитратов ура-
граммы продуктов конверсии UN в нитрующей
нила.
атмосфере при температуре ~403 К и времени вы-
Выдержка UN в атмосфере NOx-H2O (пар)-
держки 5 ч. Полученные рентгенограммы продук-
воздух при ~298 К в течение 6 сут не привела к
тов конверсии содержат интенсивные рефлексы в
значительной конверсии UN в водорастворимые
области 2θ 12.97-15.50, 20.25-20.58, 26.77-27.15°,
соединения. Степень конверсии составила ~3.5%
характерные для UO2(NO3)2·6H2O [17]. Наблюдае-
(опыт 1, табл. 2). По-видимому, NOx реагирует с
мые дополнительные рефлексы в области 2θ 17.24-
поверхностью монолитного образца UN крайне
18.68° на рентгенограммах образцов после конвер-
медленно. Кроме того, образующиеся на поверхно-
сии в нитрующей атмосфере можно приписать гид-
сти UN продукты конверсии мешают доступу NOx
роксинитратам уранила состава (UO2)2(OH)2(NO3)2·
к UN.
4H2O [28] и UO2(OH)NO3·3H2O [29].
Для сокращения времени и повышения скорости
При растворении в воде продуктов конверсии
конверсии были проведены эксперименты при по-
UN в нитрующей атмосфере образовывался жел-
вышенной температуре, но при более коротком
тый раствор, спектр оптического поглощения кото-
времени выдержки системы. Сокращение времени
рого содержал полосу поглощения, характерную
процесса до 5 ч при одновременном повышении
Газофазная конверсия мононитрида урана
11
Таблица 2. Данные по газофазной конверсии UN в нитрирующей атмосфере
Навеска
Δm
Время
Растворимость в воде
Номер
Конверсия
исходная
после выдержки,
выдержки/T,
U в растворе,
остаток
опыта
г
%
UN, %
г
ммоль
г
oC
ммоль
г
ммоль
Смесь NOx и H2O (пар)
1
0.57
2.26
0.59
0.02
~3.5
6 сут/25
0.08
0.55
~2.18
~3.5
2
0.85
3.37
0.87
0.02
~2.4
5 ч/70
0.07
0.83
~3.30
~2.1
3
0.83
3.29
0.88
0.05
~6.0
5 ч/110
0.29
0.76
~3.00
~8.8
4
0.76
3.02
0.92
0.16
~21.1
5 ч/150
0.82
0.56
~2.20
~27.2
HNO3 (пар)a
5
0.34
1.35
0.36
0.02
~5.9
6 сут/25
0.16
0.30
~1.19
~11.9
6
0.56
2.22
0.57
0.01
~1.8
5 ч/70
0.04
0.55
~2.18
~1.8
7
0.49
1.94
0.57
0.08
~16.3
10 ч/70
0.35
0.40
~1.59
~18.0
8
0.42
1.67
0.45
0.03
~7.1
3 ч/110
0.21
0.37
~1.47
~12.0
9
0.30
1.19
0.52
0.22
~73.3
5 ч/110
1.07
0.03
~0.12
~89.9
10
0.58
2.30
1.60
1.02
~175.9
10 ч/110
2.30
0
~0
~100
11
0.55
2.18
0.62
0.07
~12.7
3 ч/130
0.51
0.42
~1.67
~23.4
12
0.42
1.67
0.83
0.41
~97.6
5 ч/130
1.67
0
~0
~100
13
0.86
3.41
1.63
0.78
~90.7
5 ч/130
3.41
0
~0
~100
14
1.54
6.11
2.59
1.05
~68.2
5 ч/130
5.48
0.16
~0.63
~89.7
15
2.01
7.98
3.17
1.16
~57.7
5 ч/130
6.07
0.48
~1.91
~76.1
16
0.52
2.06
0.74
0.22
~42.3
3 ч/150
1.54
0.13
~0.52
~74.8
а UN выдерживали в парах 12 моль/л HNO3.
температуры не привело к значимому увеличению
составляет ~24 и ~100% соответственно (опыты 12
степени конверсии. Так, при температуре ~343,
и 13, табл. 2). Следует отметить, что по мере уве-
~383 и ~423 К за 5 ч выдержки UN в атмосфере
личения количества UN при сохранении количест-
NOx-H2O (пар)-воздух степень конверсии в водо-
ва HNO3, введенной в систему в виде паров, сте-
растворимые соединения составляет ~2.1, ~8.8 и
пень конверсии UN снижается. Так, при температу-
~27.2% соответственно (опыты 2-4, табл. 2).
ре ~403 К за 5 ч степень конверсии ~3.4, ~6.1 и
Следует отметить, что степень конверсии UN в во-
~8.0 ммоль UN в водорастворимые соединения со-
дорастворимые соединения при его выдержке в атмо-
ставляет ~100, ~90 и ~76% соответственно (опыты
сфере HNO3 (пар)-воздух при ~298 К в течение 6 сут
14-16, табл. 2). По-видимому, чем массивнее обра-
также невелика и составляет ~12% (опыт 5, табл. 2).
зец, тем более длительное время требуется для его
полной конверсии.
Однако постепенное увеличение температуры
процесса с ~343 до ~403 К и времени с 3 до 10 ч
Следует отметить, что увеличение температуры
приводит к заметному изменению степени конвер-
до ~423 К не позволило осуществить полную кон-
сии UN в водорастворимые соединения. Так, при
версию UN в водорастворимые соединения за бо-
температуре ~343 К увеличение времени выдержки
лее короткий промежуток времени выдержки сис-
с 5 до 10 ч приводит к практически 10-кратному
темы. Так, степень конверсии UN в водораствори-
росту степени конверсии UN (c ~2 до ~18% соот-
мые соединения в атмосфере HNO3 (пар)-воздух
ветственно, опыты 6 и 7, табл. 2).
при температуре ~423 К за 3 ч выдержки составля-
ет ~75% (опыт 16, табл. 2). Это, по-видимому, свя-
При температуре ~383 К увеличение времени
зано с тем, что при данной температуре в газовой
выдержки с 3 до 10 ч приводит к практически пол-
фазе из-за термического разложения HNO3 присут-
ной конверсии UN в водорастворимые соединения.
ствовали не ее пары, а смесь NOx-H2O (пар), обла-
Степень конверсии UN за 3, 5 и 10 ч выдержки со-
дающая меньшей химической активностью.
ставляет ~12, ~90 и ~100% соответственно (опы-
ты 8-10, табл. 2). Заметное увеличение массы про-
Согласно реакциям (1)-(3), в результате конвер-
дуктов конверсии не исключает образования не
сии UN должны образовываться различные газооб-
только нитратов или гидроксинитратов, но и соль-
разные соединения азота, среди которых наиболее
вата состава UO2(NO3)2·6H2O·HNO3.
токсичными являются оксиды азота и аммиак. С
целью выяснения механизма газовой конверсии
Дальнейшее увеличение температуры процесса
UN в нитрующей атмосфере были изучены ИК
позволило достичь практически полной конверсии
спектры газовой фазы, образующейся после кон-
UN в водорастворимые соединения за более корот-
такта UN с компонентами нитрующей атмосферы.
кое время. Так, при температуре ~403 К за 3 и 5 ч
выдержки UN в атмосфере HNO3 (пар)-воздух сте-
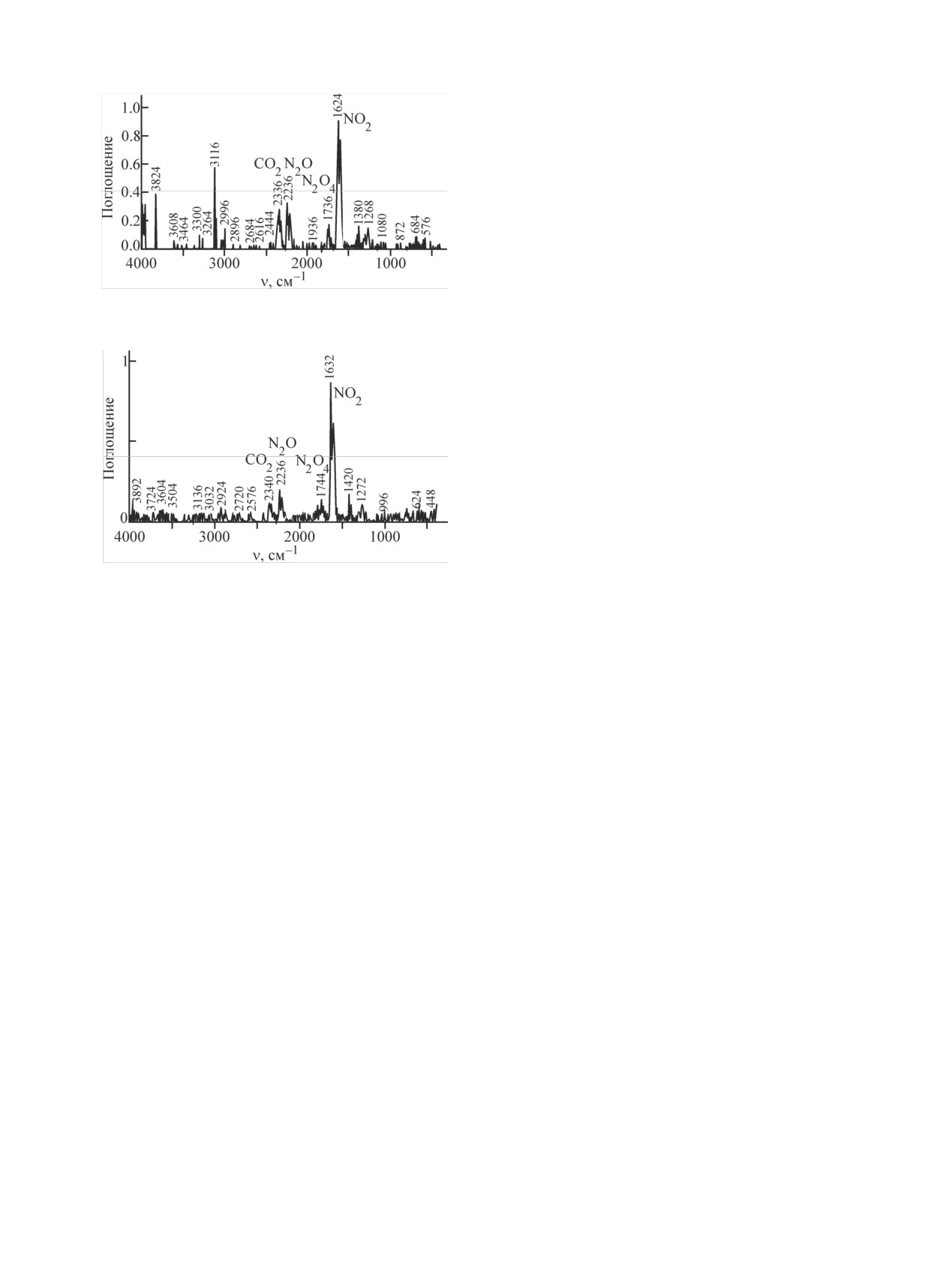
На рис. 7 и 8 приведены ИК спектры газовой
пень конверсии UN в водорастворимые соединения
фазы, образующейся после газофазной конверсии
12
С. А. Кулюхин и др.
ред газофазной конверсией нитридного ОЯТ в нит-
рующей атмосфере является его объемное окисле-
ние (волоксидация) в различных атмосферах.
Работа выполнена при частичной финансовой
поддержке Министерством науки и высшего обра-
зования РФ (тема АААА-А16-116 021 990 023-6).
Список литературы
[1] Алексеев С. В., Зайцев В. А. Нитридное топливо для ядер-
ной энергетики. М.: Техносфера, 2013.
[2] State-of-the-art report on innovative fuels for advanced nu-
Рис. 7. ИК спектр газовой фазы, образующейся после газофаз-
clear systems: NEA Report N 6895. 2014.
ной конверсии UN в атмосфере HNO3 (пар)-воздух при ~403 К
[3] Richter K., Sari C. // J. Nucl. Mater. 1991. Vol. 184. P. 167-176.
в течение 5 ч.
[4] Устинов О. А., Кулюхин С. А., Шадрин А. Ю., Воскресен-
ская Ю. А. // Атом. энергия. 2016. Т. 120, N 2. С. 108-111.
[5] Kulyukhin S. A., Shadrin A. Yu., Voskresenskaya Yu. A. et al. //
J. Radioanal. Nucl. Chem. 2015. Vol. 304, N 1. P. 425-428.
[6] Ершов Б. Г., Кулюхин С. А. // Атом. энергия. 2015. Т. 118,
N 4. С. 207-210.
[7] Кулюхин С. А., Неволин Ю. М., Мизина Л. В. и др. // Радио-
химия. 2016. Т. 58, N 1. С. 15-29.
[8] Кулюхин С. А., Неволин Ю. М., Коновалова Н. А. и др. //
Радиохимия. 2016. Т. 58, N 2. С. 117-127.
[9] Кулюхин С. А., Неволин Ю. М., Гордеев А. В. // Радиохи-
мия. 2017. Т. 59, N 3. С. 216-225.
[10] Collins E. D., Delcul G. D., Hunt R. D. et al. Patent US
8574523. 2013.
[11] JCPDS—Int. Centre for Diffraction Data. PDF 03-065-5985,
Рис. 8. ИК спектр газовой фазы, образующейся после газофаз-
UN.
ной конверсии UN в атмосфере NOx-H2O (пар)-воздух при
[12] JCPDS—Int. Centre for Diffraction Data. PDF 03-065-0285,
~403 К в течение 5 ч.
UO2.
[13] IR database. IR-Spektrensammlung der ANSYCO GmbH.
UN в атмосфере NOx-H2O (пар)-воздух и HNO3
(пар)-воздух. В ИК спектрах присутствуют полосы
[14] NIST Chemistry WebBook. NIST Standard Reference Data-
CO2, N2O, N2O4 и NO2 [13, 14]. Отсутствие NO в
ния: 15.02.2018.
газовой фазе связано, по-видимому, с образовани-
[15] JCPDS—Int. Centre for Diffraction Data. PDF 00-018-1429,
ем NO2 в соответствии с реакцией
ε-UO3.
[16] JCPDS—Int. Centre for Diffraction Data. PDF 00-027-0937,
2NO + O2 → 2NO2.
(4)
UO2(NO3)2·3H2O.
Образование дополнительного количества NO2
[17] JCPDS—Int. Centre for Diffraction Data. PDF 01-077-0121,
UO2(NO3)2·6H2O.
из-за окисления NO объясняет присутствие в газо-
[18] Johnson J. A., Rawn C. J., Spencer B. B. et al. // J. Nucl. Ma-
вой фазе N2O4.
ter. 2017. Vol. 490. P. 211-215.
Следует отметить, что в ИК спектрах газовой фа-
[19] Hoekstra H. R., Siegel S. // J. Inorg. Nucl. Chem.
1961.
Vol. 18. P. 154-165.
зы, образующейся после газофазной конверсии UN в
[20] Johnson J. A. Studies of reaction process for voloxidation
атмосфере HNO3 (пар)-воздух, отсутствуют полосы
methods: PhD Diss. Univ. of Tennessee, 2013.
H2O и NH3 [13, 14]. Их отсутствие связано, по-
[21] JCPDS—Int. Centre for Diffraction Data. PDF 00-010-0309,
видимому, с образованием NH4OH, пары которого
UO3·0.8H2O.
сконденсировались в колонке c SiO2, используемой
[22] JCPDS—Int. Centre for Diffraction Data. PDF 01-074-2101,
α-U3O8.
при отборе проб для защиты окон газовых кювет
[23] Ondrejcin R. S., Garret T. P. // J. Phys. Chem. 1961. Vol. 65.
(KBr) от попадания влаги.
P. 470-473.
Таким образом, нами показана возможность газо-
[24] Кац Дж., Рабинович Е. Химия урана. М.: Иностран. лите-
ратура, 1954. 490 с.
фазной конверсии UN в водорастворимые соедине-
[25] Lister A. J., Richardson R. J. The preparation of uranium tri-
ния в нитрующей атмосфере. Однако данный подход
oxide by thermal decomposition of uranyl nitrate: AERE C/R
можно использовать только в технологических схе-
1874. Harwell: Atomic Energy Research Establishment, 1954.
мах по переработке некондиционного необлученно-
[26] Галкин Н. П., Судариков Б. Н., Верятин У. Д. и др. Техно-
го UN. Серьезным препятствием к применению в
логия урана. М.: Атомиздат, 1964. 309 с.
[27] Schaal G., Faron R. Patent US 5628048. May 6, 1997.
процессах переработки нитридного ОЯТ является
[28] JCPDS—Int. Centre for Diffraction Data. PDF 29-1379,
проблема 3Н, который будет входить в состав как
(UO2)2(OH)2(NO3)2·4H2O.
гидратов уранилнитрата, так и гидроксинитратов
[29] JCPDS—Int. Centre for Diffraction Data. PDF
16-0204,
уранила. В связи с этим необходимой операцией пе-
UO2(OH)NO3·3H2O.