18
Радиохимия, 2019, т. 61, N 1, c. 18-26
Модифицированные сорбенты на основе активированного угля
БАУ-А и крупнопористого силикагеля для извлечения
радионуклидов и цветных металлов из водных растворов
© С. А. Кулюхин*, М. П. Горбачева, Е. П. Красавина, И. А. Румер
Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: kulyukhin@ipc.rssi.ru
Получена 22.12.2017, после доработки 23.01.2018, принята к публикации 24.01.2018
УДК 546.15+661.18.7
Исследована сорбция радионуклидов 90Sr, 90Y, 137Cs, 152Eu и цветных металлов (Cu, Ni, Zn, Pb) из
водных растворов на гранулированных сорбентах на основе крупнопористого силикагеля марок КСКГ
и МСКГ и активированного угля марки БАУ-А. Установлено, что модифицированные гранулированные
сорбенты на основе крупнопористого силикагеля марок КСКГ и МСКГ, содержащие ферроцианиды Cu,
Zn и Ni, эффективно поглощают 90Sr и 90Y из дистиллированной воды. В водопроводной воде эффектив-
ность всех сорбентов на основе КСКГ и МСКГ не превышает 70%. Модифицирование поверхности
БАУ-А проводили путем его выдержки в нитрующей атмосфере [NOx-воздух или HNO3 (пары)-воздух]
при 90-110°С в течение 4 ч, а также путем его импрегнирования 10 мас% триэтаноламина (ТЭА), три-
этилендиамина (ТЭДА) или карбамида (CH4N2O). Найдено, что сорбенты на основе активированного
угля БАУ-А эффективно поглощают 90Y (аналог трехвалентных актинидов и лантанидов) и ионы цвет-
ных металлов из различных водных растворов. Модифицирование БАУ-А приводит к снижению его
сорбционной емкости в отношении Cu2+, Ni2+, Zn2+ и увеличению - в отношении Pb2+.
Ключевые слова: радионуклиды, цветные металлы, сорбция из водных растворов.
DOI: 10.1134/S0033831119010040
В настоящее время большое внимание уделяется
менты, включая радионуклиды, могут существовать
защите окружающей среды. Современная концепция
в различных химических формах, для их извлечения
обращения с жидкими радиоактивными отходами
применяются комбинированные установки, вклю-
(ЖРО) включает разработку технологических схем,
чающие узлы фильтрации, сорбции, ионного обме-
обеспечивающих эффективную и дешевую очистку
на, осмоса и т.д. [1-4]. На каждой стадии происхо-
ЖРО, а также возможность компактирования отхо-
дит извлечение определенной химической формы
дов в сочетании с их надежной и долговременной
техногенных элементов. На стадии сорбционного
изоляцией от биосферы. Однако, несмотря на пред-
извлечения используются неорганические и органи-
принимаемые усилия по безопасному обращению с
ческие сорбенты, причем широкое применение нахо-
ЖРО, существующие в настоящее время методы
дят различные виды активированных углей, цеоли-
переработки нередко приводят к тому, что техноген-
тов и силикагелей. Однако большинство из них име-
ные радионуклиды поступают в окружающую среду,
ет низкую сорбционную эффективность в отноше-
изменяя естественную радиоактивность почв, при-
нии того или иного радионуклида. В связи с этим
родных вод и донных отложений.
особую важность приобретает задача создания высо-
коэффективных сорбентов путем модифицирования
Одновременно разработка месторождений полез-
промышленно выпускаемых марок активированного
ных ископаемых приводит к формированию геохи-
угля и гранулированных силикагелей.
мических ореолов и потоков рассеяния элементов,
вследствие которых значительные количества за-
В связи с этим нами исследована сорбция радио-
грязняющих веществ поступают в поверхностные
нуклидов 85,90Sr, 90Y, 137Cs, 152Eu и цветных металлов
воды прилегающих территорий. При разработке ме-
(Cu, Ni, Zn, Pb) модифицированными гранулирован-
сторождений в окружающую среду поступает повы-
ными сорбентами на основе активированного угля
шенное количество Al, Cu, Ni, Fe, Mn, Zn, Pb, ще-
БАУ-А и крупнопористого силикагеля марок КСКГ
лочных и щелочноземельных металлов и т.п., оказы-
и МСКГ из водных растворов.
вающих токсичное влияние на живую природу. В
связи с этим актуальной задачей является проблема
Экспериментальная часть
контроля содержания техногенных элементов, вклю-
В работе использованы радионуклиды 85,90Sr, 90Y,
чая радионуклиды, в водных экосистемах с целью
137Cs и 152Eu без носителей, поставляемые ОАО
проведения рациональных природоохранных меро-
«Изотоп» в виде водных азотнокислых растворов.
приятий.
Радиоактивность 137Cs, 85Sr и 152Eu измеряли мето-
Поскольку в водных растворах техногенные эле-
дом γ-спектрометрии с помощью полупроводнико-
Модифицированные сорбенты на основе активированного угля БАУ-А
19
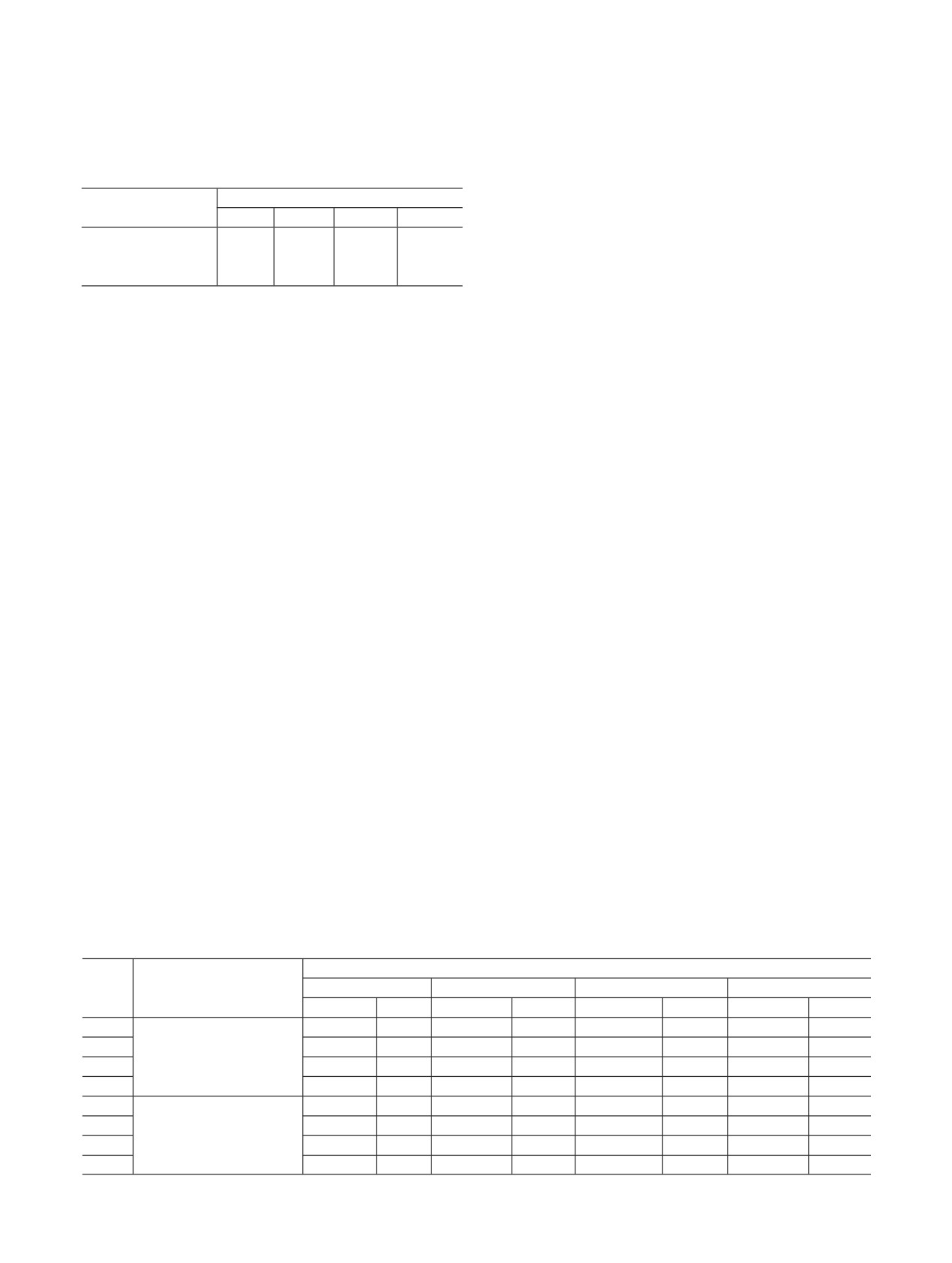
Таблица 1. Некоторые характеристики исходного и выдержанного в нитрующей атмосфере активированного угля
БАУ-А
Образец
Условия выдержки
-С=О или -СООН, мг-экв/г
Фенольные группы, мг-экв/г
ПОЕ, мг-экв/г
I
-
1.1
0.1
1.2
II
NOx-воздух, 90°С, 4 ч
1.8
0.2
2.0
III
HNO3 (пары)-воздух, 90°С, 4 ч
1.0
0.4
1.4
IV
HNO3 (пары)-воздух, 110°С, 4 ч
1.6
0.4
2.0
вого Ge-Li-детектора на многоканальном анализато-
с высушиванием при комнатной температуре до воз-
ре. Для измерения радиоактивности 90Sr + 90Y при-
душно-сухого состояния. Сорбенты на основе
меняли сцинтилляционный β-спектрометр с исполь-
МСКГ, содержащие 10 мас% ферроцианидов d-эле-
зованием программного обеспечения LSRM 2000. В
ментов (Cu, Ni, Zn), синтезировали путем двукрат-
работе использовали радиоактивные растворы с
ной пропитки матрицы по методике, описанной вы-
удельной активностью от 2·103 до 3·104 Бк/мл, в ко-
ше для ФЦ K-U.
торых концентрации Cs+, Sr2+ и Eu3+ составляли
Помимо силикагеля в работе использовали как
1·10-5 моль/л. Погрешность измерений ±5%. Радио-
немодифицированный (образец I), так и модифици-
нуклиды 85,90Sr, 90Y, 137Cs и 152Eu использовали в
рованный древесный активированный уголь марки
работе как радиоактивные метки для весовых коли-
БАУ-А (ГОСТ 6217-74) с размерами гранул 0.5-
честв ионов металлов. В связи с этим обозначения
1.0 мм. Модифицирование поверхности БАУ-А про-
85,90Sr2+, 90Y3+, 137Cs+ и 152Eu3+ относятся к меченым
водили путем его выдержки в нитрующей атмосфе-
соединениям, а не к соединениям чистых радионук-
ре [NOx-воздух или HNO3 (пары)-воздух] при 90-
лидов.
110°С в течение 4 ч. В табл. 1 приведены функцио-
Все соли, щелочи и кислоты, использовавшиеся в
нальные группы, присутствующие на поверхности
работе, были марки х.ч. Концентрация ионов цвет-
активированного угля, после его выдержки в нит-
ных металлов М2+ (М = Cu, Ni, Zn, Pb) в исходных
рующей атмосфере.
азотнокислых растворах составляла 10-1 моль/л.
Как видно из табл. 1, выдержка БАУ-А в нитрую-
В работе использовали сорбенты на основе круп-
щей атмосфере приводит к увеличению количества
нопористого силикагеля марок КСКГ и МСКГ с раз-
функциональных групп на его поверхности прибли-
мерами гранул 2.0-3.0 и 0.5-1.0 мм соответственно.
зительно в 2-4 раза. При этом выдержка в атмосфере
NOx-воздух приводит к более заметному увеличе-
Сорбенты на основе крупнопористого силикагеля
нию количества функциональных групп по сравне-
КСКГ содержали в качестве модифицирующих до-
нию с выдержкой в атмосфере HNO3 (пары)-воздух
бавок аммиакаты или нитраты d-элементов (Cu, Ni,
при одинаковых экспериментальных условиях
Zn) в комбинации с эфиром 18-краун-6 (18К6) или
(образцы II и III). Увеличение температуры при вы-
без него, либо двойной ферроцианид калия и уранила
держке в атмосфере HNO3 (пары)-воздух приводит к
(ФЦ K-U). Сорбенты получали путем последователь-
увеличению количества функциональных групп
ной двух- или трехкратной пропитки КСКГ раствора-
(образцы III и IV), что связано, по-видимому, с об-
ми соответствующих соединений. Для соединений
разованием NOx в результате термической диссоциа-
d-элементов первая стадия приготовления сорбента
ции HNO3. В результате выдержки БАУ-А в атмо-
всегда заключалась в пропитке КСКГ водным раство-
сфере NOx-воздух при 90°С и HNO3 (пары)-воздух
ром нитратов d-элементов (Cu, Ni, Zn) с последую-
при 110°С его полная обменная емкость (ПОЕ) воз-
щим высушиванием при 110°С. На второй стадии
растает приблизительно в 2 раза.
проводили пропитку прекурсора, полученного на
первой стадии, либо раствором аммиака (12 моль/л),
Следует отметить, что помимо образования функ-
либо водным раствором 18К6. В случае трехкратной
циональных групп на поверхности гранул БАУ-А од-
пропитки прекурсор, полученный после пропитки
новременно происходит сорбция NOx или паров
КСКГ растворами нитратов d-элементов и аммиака,
HNO3. При контакте с водными растворами возмож-
пропитывали раствором 18К6 с последующим высу-
на десорбция NOx или HNO3, что может привести к
шиванием до воздушно-сухого состояния. Во всех
повышению кислотности растворов.
случаях готовые сорбенты высушивали до воздушно-
Кроме этого, использовали сорбенты на основе
сухого состояния при комнатной температуре. Содер-
БАУ-А, импрегнированные 10 мас% триэтанолами-
жание модификаторов составляло 10 мас%.
на (ТЭА) (образец V), 1,4-диазабицикло[2.2.2]нонана
Сорбенты на основе КСКГ, содержащие ФЦ K-U,
(триэтилендиамина, ТЭДА) (образец VI) и карбами-
получали последовательной двойной пропиткой
да (CH4N2O) (образец VII). Сорбенты были получе-
КСКГ водными растворами UO2(NO3)2 и K4[Fe(CN)6]
ны путем пропитки БАУ-А растворами соответст-
20
С. А. Кулюхин и др.
вующих соединений с последующей сушкой при ком-
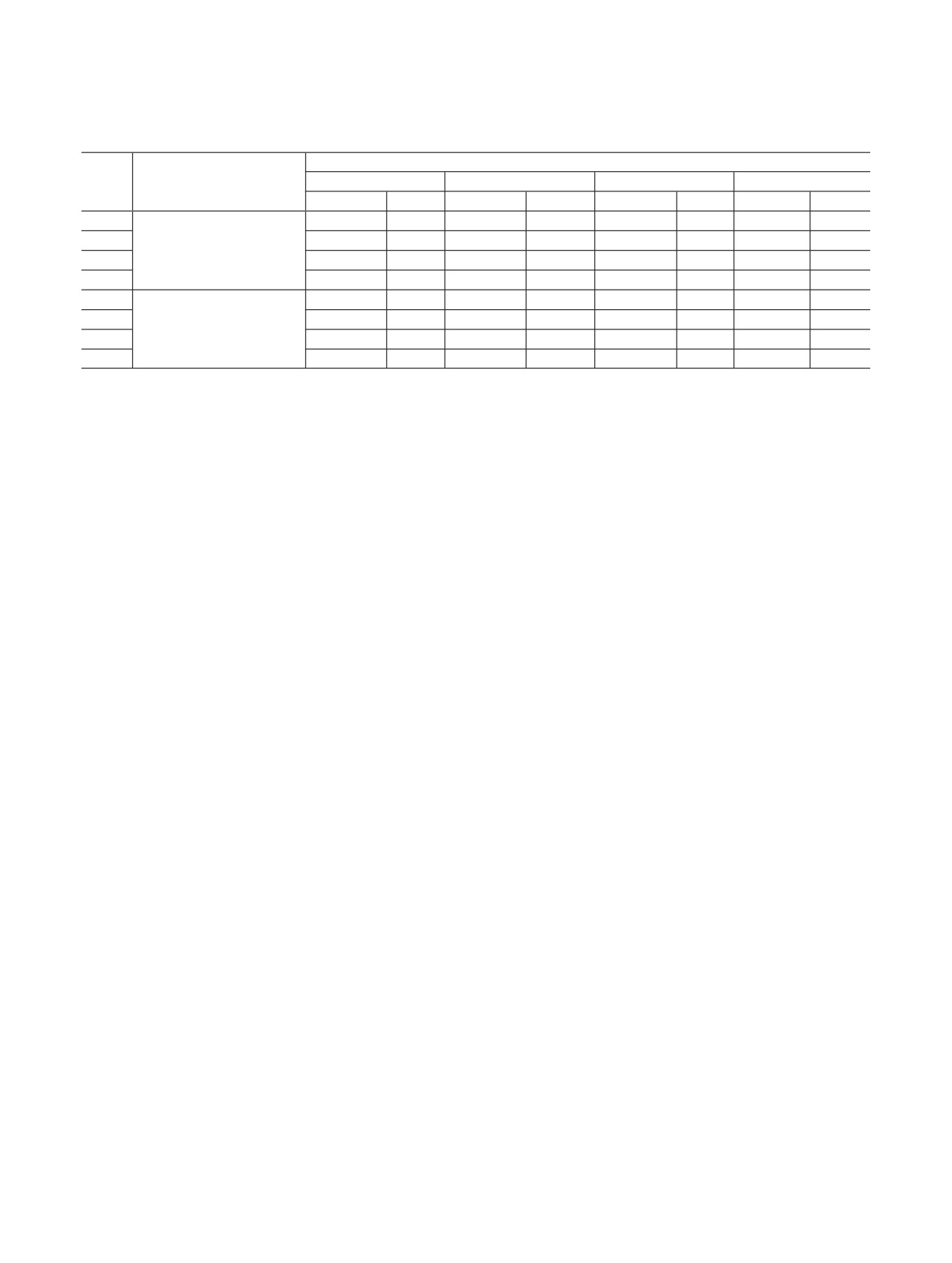
Таблица 2. Данные по сорбции 90Sr2+, 90Y3+ и 137Cs+ из
натной температуре до воздушно-сухого состояния.
дистиллированной воды на сорбентах SiO2-M-Амк (M =
Cu, Ni, Zn) в комбинации с 18К6 или без него и SiO2-
Для изучения сорбции радионуклидов
85,90Sr2+,
Cu-Аз-18К6 ([Sr2+] = [Cs+] = 10-5 моль/л, время контакта
90Y3+, 137Cs+, 152Eu3+ и цветных металлов (Cu, Ni, Zn,
твердой и жидкой фаз 60 мин, V/m = 100 мл/г, pH 5-6,
Pb) из водных растворов использовали методики,
T = 298 К, da = 2-3 мм)
представленные в работах [5-9]. Концентрацию цвет-
Степень поглощения, %
ных металлов в исходных и маточных растворах оп-
Сорбент
137Cs+
90Sr2+
90Y3+
ределяли по методикам, приведенным в работе [10].
SiO2
~62
~64
~95
Результаты и обсуждение
SiO2-Ni-Амк
~16
~12
~76
SiO2-Cu-Амк
~15
-
~72
Предварительные эксперименты показали, что
SiO2-Zn-Амк
~21
-
~67
равновесие в системах с различными сорбентами на
SiO2-Ni-Амк-18K6
~24
-
~82
основе силикагеля КСКГ, содержащего аммиакаты
SiO2-Cu-Амк-18K6
~23
~19
~83
(SiO2-M-Амк) или нитраты (SiO2-M-Аз) d-эле-
SiO2-Zn-Амк-18K6
~32
~18
~82
ментов (M = Cu, Ni, Zn) в комбинации c 18К6 или
SiO2-Cu-Аз-18K6
~15
~9
~16
без него, наступает через 60 мин контакта твердой и
a Здесь и далее d - размер гранул сорбента.
жидкой фаз. Поэтому все эксперименты по сорбции
90Sr2+, 90Y3+ и 137Cs+ на данных сорбентах в H2O про-
Анализ диаграмм состояния 90Y3+ в зависимости
водили в течение 60 мин.
от pH раствора позволил установить количествен-
В табл. 2 приведены данные по сорбции 90Sr2+,
ный состав различных химических форм 90Y3+, при-
90Y3+ и 137Cs+ из дистиллированной воды на сорбен-
сутствующих в исходном и маточном растворах
тах SiO2-M-Амк (M = Cu, Ni, Zn) в комбинации с
[12]. Иттрий в виде 90Y3+ в дистиллированной воде
18К6 (SiO2-Cu-Амк-18К6) или без него, на SiO2-Cu-
при pH 5-6 присутствует только в виде аква-ионов
Аз-18К6 и на немодифицированном SiO2.
90Y3+. Образование 90Y(ОН)2+ и 90Y(ОН)2+ в раство-
Как видно из табл. 2, немодифицированный SiO2
рах с концентрацией Y3+, равной (5-9)·10-3 моль/л,
имеет относительно высокую степень поглощения
происходит при pH > 7.3. При этом их содержание
137Cs+, 90Sr2+ и 90Y3+ из дистиллированной воды, рав-
не превышает ~13%. Образование более сложных
ную ~62, ~64 и ~95%. В данном случае сорбция ио-
гидроксокомплексов, например 90Y(ОН)3, 90Y(ОН)–
нов протекает за счет замещения протонов поверх-
и 90Y(ОН)2-, происходит при pH выше 10. В то же
ностных ≡SiOH-групп [11].
время в условиях эксперимента 90Sr2+ и 137Cs+ при-
В то же время, как видно из табл. 2, практически
сутствуют в растворе только в виде аква-ионов.
все сорбенты на основе силикагеля КСКГ, содержа-
Анализ степени сорбции 90Sr2+, 90Y3+ и 137Cs+ на
щего аммиакаты d-элементов, имеют относительно
сорбентах SiO2-M-Амк (M = Cu, Ni, Zn) позволяет
высокую сорбционную эффективность в отношении
предположить, что сорбция радионуклидов, проте-
90Y3+. Степень поглощения 90Y3+ составляет ~66-
кающая путем ионного обмена между 90Sr2+, 90Y3+ и
76%. В то же время степень поглощения 90Sr2+ и
137Cs+ и ионами d-элементов, по-видимому, малоэф-
137Cs+ не превышает ~21%.
фективна. Основной вклад в сорбционный процесс,
Наблюдаемое различие связано с множеством
вероятно, вносит образование полиядерных ком-
факторов, начиная с размеров и состава химических
плексов между аммиакатами d-элементов и гидро-
форм 90Sr2+, 90Y3+ и 137Cs+, принимающих участие в
ксокомплексами 90Y3+.
процессах сорбции, и заканчивая прочностью связей
Следует отметить, что введение 18К6 в состав
90Sr2+, 90Y3+ и 137Cs+ с функциональными группами на
сорбентов незначительно, но увеличивает степень
поверхности сорбента. Кроме того, резкое снижение
поглощения всех исследуемых радионуклидов. Так,
степени поглощения 90Sr2+ и 137Cs+ связано с тем, что
степень поглощения 90Y3+ возрастает с ~66-76 до
большинство протонов поверхностных ≡SiOH-групп
~82%. Наблюдаемый эффект связан с образованием
было замещено ионами d-элементов, которые при
дальнейшем модифицировании прекурсоров образо-
комплексных соединений 90Sr2+,
90Y3+ и
137Cs+ с
18К6. К сожалению, введение 18К6 в состав сорбен-
вали малореакционноспособные центры сорбента.
тов не дает заметного эффекта в случае 90Sr2+ и
Установлено, что при контакте сорбентов на ос-
137Cs+, как это можно было бы ожидать исходя из
нове аммиакатов d-элементов с дистиллированной
констант комплексообразования [13].
водой, содержащей 90Sr2+, 90Y3+ и 137Cs+, pH маточ-
ного раствора после 60 мин контакта составляет 7.5.
Для сорбента SiO2-Cu-Аз-18К6 степень погло-
Поэтому в условиях экспериментов возможно обра-
щения 90Sr2+, 90Y3+ и 137Cs+ из дистиллированной
зование аква- и гидроксокомплексов 90Y3+.
воды не превышает ~16% (табл. 2). Это подтвержда-
Модифицированные сорбенты на основе активированного угля БАУ-А
21
Таблица 3. Данные по сорбции 90Sr2+, 90Y3+ и 137Cs+ из водных растворов на сорбенте SiO2-ФЦ K-U ([Sr2+] = [Cs+] =
10-5 моль/л, время контакта твердой и жидкой фаз 240 мин, V/m = 100 мл/г, T = 298 К, d = 2-3 мм)
Степень поглощения, %
Среда
137Cs+
90Sr2+
90Y3+
Дистиллированная вода, рН 5-6
~47
~48
~46
Раствор HNO3 в дистиллированной воде с рН 2-3
~36
~4
~13
Раствор NH4OH в дистиллированной воде с рН 9-10
~58
~55
~36
Водопроводная водаa
~16
~13
~37
Раствор HNO3 в водопроводной воде с рН 2-3
~33
~5
~6
Раствор NH4OH в водопроводной воде с рН 9-10
~54
~53
~70
a Состав водопроводной воды, мг-экв/л: Na+ 0.28, K+ 0.1, Mg2+ 0.82, Ca2+ 2.1, Cl- 0.13, SO2- 0.6, HCO– 2.57; общее солесодержание
0.23 г/л, pH 7.8-8.2; то же в табл. 5, 6.
ет предположение о том, что степень поглощения
пень поглощения 90Sr2+ и 137Cs+ из водопроводной
радионуклидов путем ионного обмена и комплексо-
воды заметно уменьшается и не превышает ~16%.
образования с 18К6 незначительна.
Для 90Y3+ степень поглощения снижается незначи-
тельно. В то же время изменение рН раствора путем
Из литературы известно, что смешанные ферро-
добавления HNO3 или NH4OH практически не ска-
цианиды калия и уранила обладают высокой сорб-
зывается на степени поглощения исследуемых ра-
ционной эффективностью по отношению к различ-
дионуклидов. Как следует из табл. 3, степень погло-
ным радионуклидам [6, 14]. Поэтому представляло
щения 90Sr2+ и 137Cs+ на сорбенте SiO2-ФЦ K-U из
интерес исследовать возможность применения сор-
водопроводной и дистиллированной воды в присут-
бентов на основе крупнопористого силикагеля
ствии HNO3 или NH4OH практически одинакова.
КСКГ, содержащего двойной ферроцианид калия и
Для 90Y3+ степень поглощения отличается почти в
уранила (SiO2-ФЦ K-U), для извлечения 90Sr2+, 90Y3+
2 раза как в кислой, так и в щелочной среде. Это
и 137Cs+ из водных растворов.
подтверждает наше предположение о различии в
Предварительные эксперименты показали, что
механизмах сорбции 90Sr2+, 137Cs+ и 90Y3+.
равновесие в системах с сорбентом SiO2-ФЦ K-U
Анализ степени сорбции 90Sr2+, 90Y3+ и 137Cs+ на
наступает через 4 ч контакта твердой и жидкой фаз.
сорбенте SiO2-ФЦ K-U позволяет предположить, что
Поэтому все эксперименты по сорбции 90Sr2+, 90Y3+
основной вклад в сорбционный процесс, по-види-
и 137Cs+ на данном сорбенте из различных водных
мому, вносит образование малорастворимых сме-
растворов проводили в течение 240 мин.
шанных ферроцианидов уранила и ионов металлов.
В табл. 3 приведены данные по сорбции 90Sr2+,
Помимо сорбента SiO2-ФЦ K-U представляло ин-
90Y3+ и 137Cs+ из различных водных растворов на
терес исследовать сорбенты на основе простых фер-
сорбенте SiO2-ФЦ K-U. Cтепень поглощения 90Sr2+
роцианидов d-элементов, которые обладают высо-
и 137Cs+ этим сорбентом из дистиллированной воды
кой сорбционной способностью в отношении 137Cs+
в 1.5-2 раза выше, чем сорбентами SiO2-M-Амк-
[15]. Предварительные эксперименты показали, что
18К6 (M = Cu, Ni, Zn) (табл. 2). Однако для 90Y3+ она
равновесие в системах с сорбентом на основе круп-
практически в 2 раза меньше. Наблюдаемое разли-
нопористого силикагеля МСКГ, содержащего ферро-
чие связано, по-видимому, с различным механизмом
цианиды d-элементов (SiO2-ФЦ M, M = Cu, Ni, Zn),
сорбции исследуемых радионуклидов на ФЦ K-U и
наступает через 100 мин контакта твердой и жидкой
SiO2-M-Амк-18К6 (M = Cu, Ni, Zn).
фаз. Поэтому все эксперименты по сорбции 137Cs+,
Подкисление раствора добавлением HNO3 при-
85Sr2+ и 152Eu3+ на данных сорбентах из различных
водит к существенному изменению степени погло-
водных растворов проводили в течение 100 мин.
щения 90Sr2+ и 90Y3+. При уменьшении pH до 2-3 сте-
В табл. 4 приведены данные по сорбции 137Cs+,
пень поглощения 90Sr2+ и 90Y3+ уменьшается и не
85Sr2+ и 152Eu3+ из различных водных растворов на
превышает ~13%. При увеличении рН до 9-10 пу-
сорбентах SiO2-ФЦ M (M = Cu, Ni, Zn). Степень
тем добавления NH4OH степень поглощения дан-
поглощения 137Cs+ во всех случаях достаточно низ-
ных радионуклидов составляет ~36-54%. При этом
кая и не превышает ~25.0%. Это позволяет сделать
степень поглощения 137Cs+ не зависит от рН раство-
следующие выводы. Во-первых, сорбция 137Cs+, про-
ра и находится на уровне ~36-58%.
текающая путем ионного обмена с ионами d-эле-
В отличие от дистиллированной воды в реальных
ментов, малоэффективна. Во-вторых, затруднено об-
растворах присутствует большое количество посто-
разование смешанных ферроцианидов 137Cs+ и d-эле-
ронних ионов, которые существенно влияют на
ментов, малорастворимых в воде. В-третьих, в про-
сорбцию. Действительно, как видно из табл. 3, сте-
цессе синтеза произошло образование силикатов
22
С. А. Кулюхин и др.
Таблица 4. Данные по сорбции 137Cs+, 85Sr2+ и 152Eu3+ из
кагеле в дистиллированной воде. В присутствии
водных растворов на сорбентах, содержащих ферроциа-
посторонних ионов сорбция Sr резко снижается, что
ниды d-элементов, при 25°С ([Cs+] = [Sr2+] = [Eu3+] =
позволяет сделать вывод о том, что сорбция Sr про-
10-5 моль/л, pH 5-6, V/m = 1000 мл/г, время контакта
текает путем ионного обмена.
твердой и жидкой фаз 100 мин, d = 0.5-1.0 мм)
Помимо крупнопористого силикагеля в качестве
Степень
[М],a
[NaNO3],
матриц для сорбентов исследован гранулированный
Сорбент
поглощения, %
мас%
г/л
активированный уголь марки БАУ-А. Известно, что
137Cs+
85Sr2+
152Eu3+
на активированном угле сорбция протекает преиму-
0
~12
~72
~20
SiO2-ФЦ 8Cu-2Ni
10
щественно по молекулярному механизму, т.е. одно-
10
~21
~4
~39
временно с адсорбцией растворенного вещества про-
0
~18
~81
~14
SiO2-ФЦ 6Cu-4Zn
10
исходит адсорбция растворителя. Зависимость ад-
10
~22
~9
~40
сорбции от строения молекул адсорбата очень слож-
0
~15
~96
~38
SiO2-ФЦ Cu-Амк
5.9
на, и вывести какие-либо закономерности довольно
10
~22
~2
~24
трудно [16]. При этом следует учитывать, что в ре-
0
~10
~80
~32
SiO2-ФЦ Ni-Амк
3.2
альных растворах присутствует большое количест-
10
~20
~1
~19
во посторонних ионов, которые существенно влия-
a [M] - общее исходное содержание металла в сорбенте.
ют на адсорбцию. В связи с этим рабочие растворы
Таблица 5. Данные по сорбции 137Cs+, 90Sr2+ и 90Y3+ из
137Cs+, 90Sr2+ и 90Y3+ готовили на основе водопровод-
водопроводной воды на образцах БАУ-А с модифициро-
ной воды, состав которой приведен выше.
ванной в нитрующей атмосфере поверхностью ([Cs+] =
Предварительные эксперименты показали, что
[Sr2+] = 10-5 моль/л, время контакта твердой и жидкой
равновесие в системах с различными сорбентами на
фаз 240 мин, V/m = 100 мл/г, T = 298 К)
основе БАУ-А наступает через 100-240 мин контак-
Степень поглощения, %
Радионуклид
та твердой и жидкой фаз, поэтому все эксперимен-
I
II
III
IV
ты по сорбции 137Cs, 90Sr и 90Y на различных образ-
137Cs+
~20
~15
~23
~17
цах БАУ-А из водопроводной воды проводили в
90Sr2+
~32
~82
~80
~82
течение 240 мин.
90Y3+
~94
~90
~91
~93
В табл. 5 приведены данные по сорбции 137Cs+,
90Sr2+ и 90Y3+ из водопроводной воды на образцах
d-элементов, имеющих низкую сорбционную спо-
БАУ-А с модифицированной в нитрующей атмо-
собность по отношению к исследуемым радионук-
сфере поверхностью. Как видно из табл. 5, сорбци-
лидам.
онное поведение ионов 137Cs+, 90Sr2+ и 90Y3+ заметно
Степень поглощения 152Eu3+ также невелика и не
различается.
превышает ~40%. Поскольку 152Eu3+ в растворах
при рН 5-6 может находиться как в ионной форме,
Для образца I степень извлечения 137Cs+, 90Sr2+ и
так и в виде гидроксокомплексов, можно сделать
90Y3+ из водопроводной воды составляет ~20, ~32 и
вывод о том, что образование полиядерных ком-
~94% соответственно. Такое различие в поведении
плексов между аммиакатами d-элементов и гидро-
137Cs+, 90Sr2+ и 90Y3+ невозможно объяснить образо-
ксокомплексами 152Eu3+ либо не имеет места, либо
ванием гидроксокомплексов 90Y3+, поскольку, как
не вносит существенного вклада в сорбцию 152Eu3+
отмечалось выше, в дистиллированной воде при
на исследованных сорбентах.
pH 5-6 90Y3+ присутствует только в виде аква-ионов
90Y3+. На основании этого можно предположить, что
На степень поглощения как 137Cs+, так и 152Eu3+
сорбция радионуклидов, протекающая путем ион-
заметно влияет солевой фон раствора. Как видно из
ного обмена 90Sr2+, 90Y3+ и 137Cs+ с ионами H+, при-
табл. 4, степень поглощения обоих радионуклидов в
сутствующими на поверхности угля, по-видимому,
дистиллированной воде и водном растворе 10 г/л
сильно зависит от эффективного заряда сорбируе-
NaNO3 отличается в 2 и более раз.
мого катиона и практически не зависит от размера
Что касается 85Sr2+, то для него степень поглоще-
аква-иона.
ния сильно зависит от содержания солей в растворе.
Модифицирование поверхности угля практиче-
Так, в дистиллированной воде степень поглощения
ски не сказывается на степени извлечения 137Cs+ и
85Sr2+ находится в интервале от ~72 до ~96%. В то
90Y3+ из водопроводной воды. Как видно из табл. 5,
же время в водном растворе 10 г/л NaNO3 степень
степень извлечения 137Cs+ и 90Y3+ из водопроводной
поглощения во всех случаях не превышает ~9.0%,
воды на образцах II-IV составляет ~15-23 и ~90-
т.е. уменьшается более чем в 8-10 раз. Поскольку
93% соответственно. Полученные значения близки
ферроцианиды переходных металлов не сорбируют
к аналогичным величинам для образца I.
ЩЗЭ, то наблюдаемое явление связано, по-
видимому, с неспецифической сорбцией Sr на сили-
Для 90Sr2+ модифицирование поверхности образ-
Модифицированные сорбенты на основе активированного угля БАУ-А
23
Таблица 6. Данные по сорбции 137Cs+, 90Sr2+ и 90Y3+ из
проводной воды практически не изменилась. Это
водопроводной воды на образцах БАУ-А, модифициро-
позволяет однозначно заключить, что сорбция
ванных N-содержащими соединениями ([Cs+] = [Sr2+] =
137Cs+ и 90Sr2+ на модифицированных образцах угля
10-5 моль/л, время контакта твердой и жидкой фаз
протекает в основном за счет ионного обмена.
240 мин, V/m = 100 мл/г, T = 298 К)
Помимо радионуклидов на сорбентах на основе
Степень поглощения, %
Радионуклид
активированного угля БАУ-А исследовали сорбцию
I
V
VI
VII
ионов цветных металлов М2+ (М = Cu, Ni, Zn, Pb).
137Cs+
~20
~32
~26
~34
Предварительные эксперименты показали, что рав-
90Sr2+
~32
~22
~37
~24
новесие в системах с различными сорбентами на
90Y3+
~94
~24
~26
~28
основе БАУ-А наступает через 10-100 мин контакта
твердой и жидкой фаз, поэтому все эксперименты
цов в нитрующей атмосфере заметно влияет на сте-
по сорбции М2+ (М = Cu, Ni, Zn, Pb) на различных
пень его извлечения из водопроводной воды. Сте-
образцах БАУ-А из дистиллированной воды и вод-
пень извлечения 90Sr2+ из водопроводной воды на
ного раствора 0.5 моль/л NaNO3 проводили в тече-
образцах II-IV примерно в 2.5 раза выше, чем на
ние 120 мин.
образце I, и составляет ~80-82% (табл. 5). Получен-
В табл. 7 приведены данные по сорбции М2+ (М =
ные данные позволяют предположить, что основной
Cu, Ni, Zn, Pb) из дистиллированной воды и водного
вклад в сорбцию 90Sr2+ на модифицированных об-
раствора 0.5 моль/л NaNO3 на образцах БАУ-А с мо-
разцах угля вносит ионный обмен на ОН-группах.
дифицированной в нитрующей атмосфере поверхно-
В табл. 6 приведены данные по сорбции 137Cs+,
стью. Как видно из табл.
7, поведение ионов
90Sr2+ и 90Y3+ из водопроводной воды на образцах
d-элементов (Cu2+, Ni2+, Zn2+) и p-элемента (Pb2+) за-
БАУ-А, модифицированных N-содержащими соеди-
метно различается. Степень извлечения М2+ (М = Cu,
нениями. Как видно из табл. 6, в отличие от образ-
Ni, Zn) на образце I из дистиллированной воды прак-
цов II-IV степень сорбции 90Y3+ на образцах V-VII
тически в 7 раз превышает аналогичное значение для
из водопроводной воды резко снизилась по сравне-
Pb2+, при этом количество сорбированного металла
нию с чистым БАУ-А (образец I). Во всех случаях
на образце I для М2+ (М = Cu, Ni, Zn) и Pb2+ отлича-
она не превышает ~28%.
ется всего в ~2 раза (~345 и ~165 мг на 1 г сорбента
соответственно).
Наблюдаемые зависимости позволяют сделать
предположение, что в данных системах сорбция ио-
После модифицирования поверхности БАУ-А в
нов металлов определяется не их взаимодействием с
нитрующей атмосфере, несмотря на увеличение ко-
N-содержащими соединениями, входящими в состав
личества функциональных групп, степень адсорб-
сорбентов, а плотностью заряда сорбируемого ка-
ции М2+ (М = Cu, Ni, Zn) из водных растворов сни-
тиона. В водопроводной воде при рН 7.8-8.2 воз-
жается, при этом максимальное снижение наблюда-
можно образование 90Y(ОН)+ и 90Y(ОН)2+ в раство-
ется для Cu2+. Так, например, емкость образцов I и
рах с концентрацией Y3+, равной (5-9)·10-3 моль/л
IV по Cu2+ различается приблизительно в 9 раз
[11]. Большой размер и маленький эффективный
(~350 и ~40 мг на 1 г сорбента соответственно).
заряд гидроксокомплесов Y3+ препятствуют эффек-
Сорбционная емкость уменьшается как среди эле-
тивной сорбции в микропорах угля путем как ион-
ментов (Ni > Zn > Cu), так и среди образцов сорбен-
ного обмена, так и физической сорбции.
тов (II > III > IV).
Для 137Cs+ и 90Sr2+ степень извлечения из водо-
В аналогичных условиях для Pb2+ наблюдается
Таблица 7. Данные по сорбции М2+ (М = Cu, Ni, Zn, Pb) из растворов на различных образцах БАУ-А ([M2+] =
10-1 моль/л, время контакта твердой и жидкой фаз 120 мин, V/m = 100 мл/г, T = 298 К)
Количество М2+, сорбированного на образце
М2+
Раствор
I
II
III
IV
ммоль/г
мг/г
ммоль/г
мг/г
ммоль/г
мг/г
ммоль/г
мг/г
Cu
~5.5
~350
~1.8
~115
~1.0
~65
~0.6
~40
Ni
~5.8
~340
~5.4
~315
~4.2
~245
~3.1
~180
Дистиллированная H2O
Zn
~5.3
~350
~2.9
~190
~2.6
~170
~1.8
~120
Pb
~0.8
~165
~4.5
~935
~4.1
~850
~3.8
~790
Cu
~2.7
~170
~2.0
~130
~1.0
~65
~3.5
~220
Ni
Водный раствор
~3.2
~190
~3.2
~190
~0.5
~30
~4.0
~235
Zn
0.5 моль/л NaNO3
~2.2
~145
~2.2
~145
~0.2
~15
~2.9
~190
Pb
~2.6
~540
~2.9
~600
~6.2
~1285
~3.5
~725
24
С. А. Кулюхин и др.
Таблица. 8 Долевое распределение химических форм
Анализ приведенных данных позволяет предпо-
М2+ (М - Cu, Ni, Zn, Pb) в водном растворе в зависимо-
ложить, что помимо состава химических форм ис-
сти от рН [17]
следованных элементов в растворе на адсорбцию
Доля формы
влияет размерный фактор. Ионы М2+ (М = Cu, Ni,
Форма
Cu2+
Ni2+
Zn2+
Pb2+
Zn) и Pb2+ заметно различаются как по ионным и
pH 6
pH 4
pH 6
pH 4
pH 6
pH 4
pH 6
pH 4
ковалентным радиусам, так и по координационным
М2+
0
0.02
0.07
0.91
0
0.82
0
0.11
числам в воде. Так, для М2+ (М = Cu, Ni, Zn) ионные
М(ОН)+
0
0.16
0.66
0.09
0
0.02
0.56
0.88
радиусы равны соответственно
0.072,
0.078 и
М(ОН)2
0.83
0.82
0.25
0
0.99
0.16
0.42
0.01
0.083 нм, в то время как для Pb2+ ионный радиус
М(ОН)3
0.17
0
0.01
0
0.01
0
0.01
0
равен 0.132 нм, т.е. приблизительно в 1.6-1.8 раза
больше [18]. Также для М2+ (М = Cu, Ni, Zn) коор-
резкое увеличение степени адсорбции на образцах
динационное число в воде равно 6, а для Pb2+ - 4.
II-IV (более чем в 5 раз). При этом степень извлече-
Различие в строении и размерах аква- и гидроксо-
ния Pb2+, как и для М2+ (М = Cu, Ni, Zn), уменьшает-
комплексов может сказываться на кинетике диффу-
ся в ряду II > III > IV. Однако даже для образца IV,
зионных и адсорбционных процессов.
характеризующегося наименьшей степенью извле-
Наблюдаемые зависимости позволяют сделать
чения Pb2+, емкость превышает в ~5 раз емкость об-
вывод о том, что адсорбция М2+ (М = Cu, Ni, Zn) и
разца I (~790 и ~165 мг на 1 г сорбента соответст-
Pb2+ протекает по двум механизмам, а именно физи-
венно).
ческой сорбции и хемосорбции. При этом вклад ка-
Наблюдаемое различие связано с множеством
ждого механизма в суммарную степень адсорбции
факторов, начиная с размеров и состава химических
для М2+ (М = Cu, Ni, Zn) и Pb2+ различен. К сожале-
форм М2+ (М = Cu, Ni, Zn) и Pb2+, принимающих
нию, нам не удалось определить вклад каждого от-
участие в процессах сорбции, и заканчивая прочно-
дельного механизма в общую степень сорбции ис-
стью связей M2+ с функциональными группами на
следованных элементов.
поверхности БАУ-А.
В отличие от дистиллированной воды в реаль-
В условиях экспериментов возможно образова-
ных растворах присутствует большое количество
ние аква- и гидроксокомплексов М2+ (М = Cu, Ni,
посторонних ионов, существенно влияющих на ад-
Zn, Pb). Установлено, что во всех случаях рН исход-
сорбцию. В табл. 7 приведены данные по сорбции
ных растворов равен 6. При контакте образцов I, III
М2+ (М = Cu, Ni, Zn, Pb) из водного раствора
и IV с водными азотнокислыми растворами иссле-
0.5 моль/л NaNO3 на различных образцах БАУ-А.
дованных элементов pH маточного раствора после
Как видно из табл. 7, разница в адсорбции М2+ (М =
120 мин контакта остается равным 6. Для образца II
Cu, Ni, Zn) и Pb2+ на образце I из водного раствора
pH маточного раствора уменьшается до 4. Анализ
0.5 моль/л NaNO3 практически нивелируется. Сте-
диаграмм состояния исследованных ионов в зависи-
пень адсорбции металлов изменяется от ~22 до
мости от рН раствора позволил установить количе-
~32%, т.е. никакого различия между М2+ (М = Cu,
ственный состав различных химических форм эле-
Ni, Zn) и Pb2+ не наблюдается, как это имело место в
ментов, присутствующих в исходном и маточном
дистиллированной воде.
растворах (табл. 8 [17]). Исследованные элементы в
В то же время для М2+ (М = Cu, Ni, Zn) и Pb2+
растворе могут присутствовать в виде М2+, М(ОН)+,
наблюдается разнонаправленное изменение степени
М(ОН)2 и М(ОН)–. Образование более сложных гид-
адсорбции при переходе от дистиллированной воды
роксокомплексов, например М(ОН)2-, не происхо-
к водному раствору 0.5 моль/л NaNO3. Если для М2+
дит.
(М = Cu, Ni, Zn) степень поглощения на образце I из
Как видно из табл. 8, при рН 6 все элементы нахо-
водного раствора 0.5 моль/л NaNO3 уменьшилась
дятся в виде гидроксокомплексов состава M(OH)2-n
практически в 2-3 раза по сравнению с сорбцией из
(n = 1-3). При этом Cu2+ и Zn2+ присутствуют, глав-
дистиллированной воды, то для Pb2+ данная величи-
ным образом, в виде нейтрального комплекса
на увеличилась более чем в 3 раза. Наблюдаемые
M(OH)2. Для Ni2+ и Pb2+ характерно наличие как
зависимости позволяют заключить, что при перехо-
однозарядного, так и нейтрального комплекса. При
де от дистиллированной воды к водному раствору
этом для Pb2+ их содержание в растворе практиче-
0.5 моль/л NaNO3 заметно изменяется состав и раз-
ски одинаково.
мер гидроксокомплексов М2+ (М = Cu, Ni, Zn, Pb) за
При pH 4 для Ni2+ и Zn2+ резко возрастает коли-
счет различного участия NO–-ионов в построении
чество ионных форм М2+, в то время как для Cu2+ и
координационных сфер элементов. При этом в от-
Pb2+ по-прежнему преобладают гидроксокомпексы
личие от дистиллированной воды в водном растворе
состава M(OH)2-n (n = 1, 2). При рН 4 гидроксоком-
0.5 моль/л NaNO3 физико-химические характери-
плексы состава М(ОН)– отсутствуют.
стики гидроксокомплексов М2+ (М = Cu, Ni, Zn) и
Модифицированные сорбенты на основе активированного угля БАУ-А
25
Таблица 9. Данные по сорбции М2+ (М = Cu, Ni, Zn, Pb) из растворов на различных образцах БАУ-А, модифициро-
ванных N-содержащими соединениями ([M2+] = 10-1 моль/л, время контакта твердой и жидкой фаз 120 мин, V/m =
100 мл/г, T = 298 К)
Количество М2+, сорбированного на образце
М2+
Раствор
I
V
VI
VII
ммоль/г
мг/г
ммоль/г
мг/г
ммоль/г
мг/г
ммоль/г
мг/г
Cu
~5.5
~350
~2.3
~145
~1.4
~90
~1.8
~115
Ni
~5.8
~340
~1.5
~90
~0.5
~30
0
0
Дистиллированная H2O
Zn
~5.3
~350
~1.5
~100
~1.0
~65
~0.5
~35
Pb
~0.8
~165
~2.8
~580
~2.1
~435
~2.0
~415
Cu
~2.7
~170
~2.5
~160
~1.3
~85
~4.4
~280
Ni
Водный раствор
~3.2
~190
~1.3
~75
~0.7
~40
0
0
Zn
0.5 моль/л NaNO3
~2.2
~145
~1.3
~85
~0.8
~55
~0.3
~20
Pb
~2.6
~540
~4.0
~830
~4.8
~995
~4.9
~995
Pb2+ близки, что и определяет близость степени по-
вием различных гидроксокомплексов с функцио-
глощения элементов на образце I.
нальными группами на поверхности сорбента, но и
прочностью комплексов М2+ (М = Cu, Ni, Zn, Pb) с
В отличие от дистиллированной воды степень
N-содержащими соединениями, входящими в со-
адсорбции М2+ (М = Cu, Ni, Zn) и Pb2+ на образцах II
став сорбентов.
и IV из водного раствора 0.5 моль/л NaNO3 близка и
изменяется одинаковым образом. Однако в отличие
Как было отмечено выше, во всех случаях рН
от дистиллированной воды минимум адсорбции всех
исходных растворов равен 6. При контакте образцов
элементов наблюдается на образце III. Для всех ис-
V и VII с водными азотнокислыми растворами ис-
следованных элементов степень адсорбции уменьша-
следованных элементов pH маточного раствора
ется в ряду IV > II > III. Наблюдаемый ряд связан,
после 120 мин контакта остается равным 6. Соглас-
по-видимому, с изменением количества функцио-
но данным, приведенным в табл. 8, в условиях экс-
нальных групп на поверхности БАУ-А после его
перимента исследованные элементы в растворе мо-
взаимодействия с водным раствором
0.5 моль/л
гут присутствовать в основном в виде М(ОН)+ и
NaNO3. Выяснение данного вопроса может составить
М(ОН)2. Доля остальных форм незначительна. Для
предмет самостоятельного исследования.
образца VI при контакте с водными азотнокислыми
растворами pH маточного раствора увеличивается
Помимо образцов БАУ-А, модифицированных в
до 8-9. В этих условиях, согласно данным работы
нитрующей атмосфере, в опытах по извлечению М2+
[17], исследованные элементы в основном находят-
(М = Cu, Ni, Zn) и Pb2+ из водных растворов исполь-
ся в виде М(ОН)2, М(ОН)– и М(ОН)2-. При этом за-
зовали сорбенты на основе БАУ-А, содержащие
метно возрастает доля не только M(OH)–, но и
10 мас% ТЭА (образец V), ТЭДА (образец VI) и
M(OH)2-. Таким образом, для образцов V и VII
CH4N2O (образец VII). В табл. 9 приведены данные
сорбция исследованных элементов определяется,
по сорбции М2+ (М = Cu, Ni, Zn) и Pb2+ на образцах
главным образом, взаимодействием с активными
БАУ-А, модифицированных N-содержащими соеди-
центрами сорбента положительных и нейтральных
нениями. Как видно из табл. 9, в отличие от чистого
гидроксокомплексов, в то время как для образца
БАУ-А и образцов II-IV степень сорбции Pb2+ на
VI - отрицательно заряженных гидроксокомплек-
образцах V-VII из дистиллированной воды и водно-
сов. Образование на поверхности сорбентов ионами
го раствора 0.5 моль/л NaNO3 выше, чем для М2+
М2+ (М = Cu, Ni, Zn, Pb) смешанных комплексов,
(М = Cu, Ni, Zn). Степень сорбции во всех случаях
включающих в свой состав одновременно N-содер-
изменяется в ряду Pb > Cu > Zn ≥ Ni, при этом для
жащие соединения и гидроксил-ионы, и определяет
Pb2+ адсорбция из водного раствора 0.5 моль/л
эффективность сорбции исследованных ионов ме-
NaNO3 протекает эффективнее, чем из дистиллиро-
таллов. При этом вероятность образования смешан-
ванной воды. Емкость образцов V-VII по Pb2+ из
ных комплексов определяется лабильностью гидро-
водного раствора
0.5 моль/л NaNO3 превышает
ксокомплексов металлов. Из-за инертности гидро-
~830 мг на 1 г сорбента. Следует отметить, что во
ксокомплексов М2+ (М = Cu, Ni, Zn) наблюдается
всех случаях степень сорбции Cu выше, чем у Ni и
уменьшение степени их адсорбции на образцах V-
Zn, хотя емкость образцов не превышает ~280 мг
VII по сравнению с образцом I. Для Pb2+ наблюда-
Cu2+ на 1 г сорбента.
ется противоположная зависимость, т.е. высокая
Наблюдаемые зависимости позволяют сделать
лабильность гидроксокомплексов Pb2+ приводит к
предположение, что в данных системах сорбция ио-
увеличению степени его сорбции на образцах V-
нов металлов определяется не только взаимодейст-
VII по сравнению с образцом I.
26
С. А. Кулюхин и др.
Таким образом, модифицированные гранулиро-
[7] Гимаева А. Р., Валинурова Э. Р., Игдавлетова Д. К. и др. //
Сорбционные и хроматографические процессы.
2012.
ванные сорбенты на основе активированного угля
Т. 12, N 2. С. 267-273.
БАУ-А могут быть использованы для очистки вод-
[8] Wang C., Liu J., Zhang Z. et al. // Ind. Eng. Chem. Res. 2012.
ных растворов от токсичных ионов некоторых d- и
Vol. 51, N 11. P. 4397-4406.
p-металлов, в том числе и радиоактивных, в различ-
[9] Unuabonah E. I., Olu-Owolabi B. I., Taubert A. et al. // Ind.
ных системах водоочистки и водоподготовки.
Eng. Chem. Res. 2013. Vol. 52, N 2. P. 578-585.
[10] Шарло Г. Методы аналитической химии. Количествен-
Работа выполнена при частичном финансирова-
ный анализ неорганических соединений. М.: Химия, 1957.
нии Министерством науки и высшего образования
Т. 2.
РФ (тема АААА-А16-116 021 990 023-6).
[11] Сорбенты на основе силикагеля в радиохимии / Под
ред. Б. Н. Ласкорина. М.: Атомиздат, 1977.
[12] Давыдов Ю. П., Давыдов Д. Ю. Формы нахождения ме-
Список литературы
талл-ионов (радионуклидов) в растворе. Минск: Белару-
ская навука, 2011. С. 178-179.
[1] Рябчиков Б. Е. Очистка жидких радиоактивных отходов.
[13] Хираока М. Краун-соединения. Свойства и применение.
М.: ДеЛи, 2008.
М.: Мир, 1986.
[2] Treatment of liquid effluent from uranium mines and mills:
[14] Милютин В. В., Гелис В. М., Клиндухов В. Г., Обручи-
IAEA TECDOC-1419. Vienna: IAEA, 2004.
ков А. В. // Радиохимия. 2004. Т. 46, N 5. С. 444-445.
[3] Климов Е. С., Бузаева М. В. Природные сорбенты и ком-
[15] Тананаев И. В., Сейфер Г. Б., Харитонов Ю. Я. и др. Хи-
плексоны в очистке сточных вод. Ульяновск: УлГТУ,
мия ферроцианидов. М.: Наука, 1971. 320 с.
2011. 201 с.
[16] Михайлов О. В., Татаринцев Т. Б. // ЖФХ. 2004. Т. 78,
[4] Долина Л. Ф. Сточные воды предприятий горной про-
N 1. С. 75-78.
мышленности и методы их очистки: Справ. пособие.
[17] Грег С., Синг К. Адсорбция, удельная поверхность, по-
Днепропетровск: Молодежная экологическая лига При-
ристость. М.: Мир, 1984. 310 с.
днепровья, 2000. 61 с.
[18] Расчет равновесий в аналитической химии // Информа-
[5] Кулюхин С. А., Красавина Е. П., Мизина Л. В. и др. // Ра-
диохимия. 2005. Т. 47, N 6. С. 528-533.
12.12.2017.
[6] Кулюхин С. А., Красавина Е. П., Горбачева М. П. и др. //
[19] Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы
Радиохимия. 2007. Т. 49, N 1. С. 68-73.
неорганических веществ: Справочник. М.: Дрофа, 2006.