Радиохимия, 2019, т. 61, N 1, c. 63-71
63
Биогенные факторы иммобилизации радионуклидов на песчаных
породах верхних водоносных горизонтов
© А. В. Сафонов*а, Н. Д. Андрющенкоа, П. В. Ивановг, К. А. Болдыревб, Т. Л. Бабичв,
К. Э. Германа, Е. В. Захароваа
а Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: alexeysafonof@gmail.com
б Институт проблем безопасного развития атомной энергетики, 115191, Москва, Б. Тульская ул., д. 52
в Институт микробиологии им. С. Н. Виноградского, ФИЦ Биотехнологии РАН,
117312, Москва, пр. 60-летия Октября, д. 7, корп. 2
г Институт наук о Земле Йенского университета им. Ф. Шиллера, Йена, Германия
Получена 07.12.2017, после доработки 06.06.2018, принята к публикации 14.06.2018
УДК 550.47.502.55 621.039.73; 665.7
Изучено влияние микроорганизмов на иммобилизацию Cs, Sr, U и Tc на песчаных породах из верх-
них водоносных горизонтов. Выполнены лабораторные исследования проб пластовой воды, отобран-
ных из наблюдательных скважин в районе законсервированного хранилища жидких радиоактивных
отходов (ЖРО) водоема Б-2 СХК, и компьютерное геохимическое моделирование, позволяющее оце-
нить разнообразие форм радионуклидов с учетом физико-химических условий в верхних водоносных
горизонтах. Показано, что в этой зоне под влиянием микроорганизмов могут формироваться восстано-
вительные условия, способствующие иммобилизации радионуклидов с переменной степенью окисле-
ния. Согласно данным геохимического моделирования, в результате микробных процессов можно ожи-
дать образование осадков U(IV) и Tc(IV) в смеси с биогенным сульфидом. При этом обрастание поверх-
ности частиц водоносных пород микробными биопленками полисахаридной природы приводит к ухуд-
шению сорбции Cs и Sr и повышению эффективности иммобилизации U.
Ключевые слова: цезий, стронций, уран, технеций, миграция, микроорганизмы, биопленки, пески
водоносных горизонтов, сорбция, биовосстановление, биогеохимическое моделирование, PHREEQC.
DOI: 10.1134/S0033831119010106
Попадание высокотоксичных соединений и ра-
ции элементов на вмещающих породах и гидродина-
диоактивных элементов в подземные водоносные
мических параметрах переноса. Однако в таких расче-
горизонты вследствие их выхода из источника за-
тах, как правило, не учитываются микробиологиче-
грязнения, например при эксплуатации шламохрани-
ские факторы, роль которых по мере изучения мик-
лищ [1] или горных отвалов при добыче урансодер-
робных процессов оказывается все более значимой.
жащих руд [2], может приводить к переносу компо-
Первые сведения о важной роли микробного со-
нентов жидких радиоактивных отходов (ЖРО) с то-
общества подземных вод в миграции радионуклидов
ком подземных вод на значительные расстояния к
появились более 30 лет назад [6-8]. Проводимые в
областям разгрузки - открытым водоемам. В настоя-
этой области исследования указывают на большое
щее время особое внимание уделяется изучению за-
значение биологических процессов, влияющих пря-
грязнения верхних водоносных горизонтов - зон
мо или косвенно на миграцию радионуклидов в
аэрации с повышенным содержанием органического
грунтовых водах. В ряде случаев жизнедеятельность
вещества и потенциальной возможностью реализа-
микроорганизмов может приводить к иммобилиза-
ции коллоидного и псевдоколлоидного переноса ра-
ции переменновалентного радионуклида вследствие
дионуклидов. Загрязненные радионуклидами верх-
его восстановления с образованием малораствори-
ние водоносные горизонты встречаются на террито-
мых соединений, а также накопления внутри мик-
рии разных стран: в Российской Федерации на СХК,
робных клеток или сорбции полисахаридным мат-
ГХК, НЗХК и других заводах, в США - на заводах
риксом биопленок. Суть процесса биовосстановле-
Хэнфорд, Саванна-Ривер, в Англии - на заводе Сел-
ния - использование клеткой элемента в высшей сте-
лафилд, в Германии - в районе рудника Ассе-2 [3], а
пени окисления в качестве окислителя (акцептора
также на предприятиях Канады, Казахстана [4], Кыр-
электронов) при клеточном дыхании [9]. Известны
гызстана [5] и других стран.
работы по восстановлению Pu(VI) [10], U(VI) [11,
12], а также ионов TcO4- [13] и NpO+ [14].
Существующие модели, позволяющие прогнози-
ровать миграцию радионуклидов в пластовых водах,
Опосредованная роль микроорганизмов в иммо-
основываются преимущественно на термодинамиче-
билизации радиоактивных элементов заключается в
ских расчетах возможного образования минеральных
осаждении радионуклидов с биогенными минераль-
фаз в рассматриваемых условиях, показателях сорб-
ными фазами и микробными метаболитами [15], на-
64
А. В. Сафонов и др.
пример фосфатами, сульфидами, карбонатами и ок-
Состав сред, условия культивирования и ме-
салатами, сероводородом [16] и/или полисахаридны-
тоды учета микроорганизмов. Численность бакте-
ми биопленками [17]. Оксигидроксиды Fe(III), кото-
рий ряда физиологических групп определяли мето-
рые могут продуцироваться в процессе жизнедея-
дом посева предельных разведений проб пластовой
тельности аэробных и анаэробных денитрифицирую-
воды в жидкие селективные питательные среды в
щих Fe(II)-окисляющих бактерий, также являются
двух повторностях. Посевы инкубировали не более
мощными сорбентами широкого ряда радионукли-
30 сут при 20-28°C. Результаты оценивали методом
дов. Оценка потенциального значения микроорганиз-
наиболее вероятного числа по таблице Мак Креди
мов в иммобилизации радионуклидов на песчаных
[24]. Аэробные органотрофные бактерии учитывали
породах в водоносных горизонтах в зависимости от
в жидкой среде (TEG), содержащей (г/л): бакто-
дозы их излучения проведена в работе [18]. Микроб-
триптон 5.0, дрожжевой экстракт 2.5, глюкозу 1.0,
ные процессы были успешно использованы в биотех-
NaCl 1.0 и раствор микроэлементов (1.0 мл/л), pH
нологиях in situ ремедиации водоносных горизонтов,
7.0-7.2. Денитрифицирующие бактерии обнаружи-
загрязненных компонентами ЖРО [19-21].
вали по появлению молекулярного азота в среде Ад-
Необходимо также отметить возможную роль
кинса [25], дополненной ацетатом натрия (2.5 г/л) в
качестве источника энергии и углерода и нитратом
микроорганизмов в увеличении подвижности радио-
натрия (0.85 г/л) в качестве акцептора электронов.
нуклидов, например в результате образования рас-
Среда содержала (г/л): KH2PO4 0.6, K2HPO4 1.0,
творимых комплексов уранил-иона с карбонат-
ионами биогенного происхождения или с продукта-
NaNO3 1.0, NaCl 0.8, Na2SO4 0.1, MgSO4·7H2O 0.1,
ми микробного метаболизма [22] или переноса урана
KCl 0.1, раствор микроэлементов (1.0 мл/л), pH 7.0-
7.2. В качестве газовой фазы использовали аргон,
в виде биогенных коллоидов [23].
очищенный от кислорода. Численность сульфатре-
Таким образом, комплексное изучение биогеохи-
дуцирующих бактерий определяли по образованию
мических процессов, протекающих в загрязненных
сероводорода в конечных разведениях в среде По-
компонентами ЖРО подземных водах, для оценки
стгейта [26] с лактатом натрия (3.5 г/л), восстанов-
миграционных параметров радионуклидов является
ленной 200 мг/л Na2S·9H2O, содержащей (г/л водо-
новой и важной задачей для радиоэкологии.
проводной воды): KH2PO4 0.5, NH4Cl 1.0, CaSO4 1.0,
Целью работы являлась оценка влияния микроб-
MgSO4·7H2O 2.0, NaCl 5.0, FeSO4 0.5, Na2S·9Н2О 0.1,
ного сообщества подземных вод в районе законсер-
дрожжевой экстракт 0.5. Железоредуцирующие бак-
вированного хранилища ЖРО бассейна Б-2 СХК на
терии определяли по накоплению Fe(II) в среде с
сорбционную емкость вмещающих пород для U, Sr,
ацетатом натрия (2.0 г/л) в качестве донора электро-
Cs и Tc и биогеохимическое моделирование про-
нов и цитратом Fe(III) (16.2 г/л) в качестве акцептора
цессов восстановления уранил- и пертехнетат-
электронов [27]. В состав среды входили (г/л):
ионов.
CaCl2·2H2O 0.1, NaH2PO4·H2O 0.6, MgCl2·6H2O 0.1,
KCl 0.1, NH4Cl 1.5, NaCl 1, KH2PO4 0.75, K2HPO4 1.5,
Экспериментальная часть
MnCl2·4H2O 0.005, Na2MoO4 0.001, NaHCO3 2.5,
В работе исследовали микробное сообщество
дрожжевой экстракт 0.5 и раствор микроэлементов
пластовой воды, отобранной на территории СХК из
1.0 мл/л; pH 7.0. В качестве газовой фазы использо-
наблюдательных скважин по контуру законсервиро-
вали очищенный от кислорода аргон.
ванного хранилища ЖРО - бассейна Б-2. Постоян-
Создание библиотек фрагментов генов 16S
ная температура пласта (глубина залегания 10 м),
рРНК микроорганизмов методом высокопроиз-
составляющая ~10°С, и близкие к нейтральным зна-
водительного секвенирования. Биомассу микроор-
чения рН являются подходящими условиями для
ганизмов получали путем фильтрации 1.5 л подзем-
роста микроорганизмов в круглогодичном режиме.
ной жидкости через нитроцеллюлозные фильтры
Значения окислительно-восстановительного потен-
фирмы Millipore (type GS 0.22 мкм, Германия) с ис-
циала, с одной стороны, не препятствуют протека-
пользованием прибора для вакуумного фильтрова-
нию микроаэрофильных микробных процессов, а с
ния ПВФ-35 (ГОСТ 18963-73). Выделение ДНК
другой - способствуют миграции металлов в выс-
проводили в Балтийском федеральном университете
ших степенях окисления.
(БФУ им. И. Канта) с использованием набора реак-
Пробы отбирали в июне 2016 г. в стерильные гер-
тивов ZymoBIOMICS™ DNA Miniprep Kit (Zymo
метичные пластиковые бутыли объемом 0.5 л без
Research, США) согласно инструкции производите-
газовой фазы. Для исследования отбирали пробы
ля. При подготовке библиотек амплифицировали
пластовой жидкости и песка из трех наблюдатель-
вариабельные участки региона V3-V4 гена
16S
ных скважин, расположенных вне контура загрязне-
рРНК. Амплификацию проводили методом полиме-
ния (скважина 1), и из зон с разными уровнями за-
разной цепной реакции в реальном времени на при-
грязнения (скважины 2 и 3).
боре CFX96 Touch (Bio-Rad, США) с использовани-
Биогенные факторы иммобилизации радионуклидов
65
ем реакционной смеси qPCRmix-HS SYBR (Евроген,
и остаточным содержанием семивалентной формы в
Россия). Далее осуществляли высокопроизводитель-
растворе. Восстановленный уран определяли методом
ное секвенирование с помощью системы MiSeq
жидкостной экстракции U(IV) 2-теноилтрифтораце-
(Illumina, США) с использованием набора реагентов
тоном (ТТА) [29] с последующим анализом водной и
MiSeq Reagent Kit v2 (500cycle) (Illumina, США).
органической фаз с использованием арсеназо III.
Анализ биопленок. Лабораторное моделирова-
Сорбционные эксперименты проводили в поли-
ние роста биопленок проводили путем инкубации
пропиленовых флаконах, в которые вносили по
кварцевого песка в присутствии подземной жидко-
20 мл модельной воды, содержащей радионуклид в
сти с добавлением глюкозы (0.5 г/л) и/или ацетата
концентрации моль/л (Бк/л): 137Cs 2.6·10-10 (1.2·105),
натрия (0.5 г/л) в качестве доноров электронов и ис-
90Sr 1.4·10-10 (6.5·104), 99Tc (TcO–) 1.2·10-6 (7.5·104),
точников углерода в флаконах емкостью 50 мл, гер-
233U (UO2+) 4.8·10-7 (4.0·104). При проведении сорб-
метично закрывающихся резиновыми пробками.
ционных экспериментов использовали раствор, мо-
Кинетические параметры роста биопленок оценива-
делирующий подземную воду из приповерхностного
ли по содержанию общего углерода методом мокро-
горизонта в районе г. Томска, содержащий ионы
го сжигания по Тюрину (ГОСТ 26213-91). Рост мик-
(мг/л): Ca2+ 94.0, Mg2+ 21.6, Na+ 45.4, ∑(CO2- + HCO–)
роорганизмов, образующих биопленки, определяли
465.4, SO2- 30.0, Cl- 10.0, pH 7.3-7.5.
с помощью МТТ-теста [28], основанного на умень-
Через 28 сут из раствора отбирали аликвоты жид-
шении в среде концентрации растворимого бромида
кой фазы, в которой анализировали содержание ра-
3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия
дионуклидов жидкосцинтилляционным методом с
(MTT) за счет его восстановления до малораствори-
применением радиометра Tri-Carb-3180 TR/SL (Perkin
мого синего формазана NAD(P)H-зависимыми окси-
Elmer, США). Содержание Cs определяли по актив-
доредуктазами - дыхательными ферментами актив-
ности счетных образцов на лабораторном цифровом
но растущих и делящихся клеток. Таким образом,
γ-спектрометрическом комплексе (ORTEC, США).
интенсивность окраски формазана в среде отражает
По уменьшению активности в растворе оценивали
жизнеспособность клеток и напрямую зависит от
степень сорбции радионуклида (S, %) и соответствую-
интенсивности микробного дыхания. После инкуба-
щий коэффициент распределения (Kd) по формуле
ции отделяли планктонную культуру от песка с био-
пленкой и в оба варианта добавляли раствор МТТ в
Kd = (Cтв/Cж)/(V/m),
(1)
среде LB (триптон 10 г, дрожжевой экстракт 5 г,
NaCl 5 г на 1 л дистиллированной воды) до конеч-
где Ств - концентрация радионуклида на твердой
ной концентрации 0.1%. Дополнительно планктон-
фазе; Сж - концентрация радионуклида в жидкой
ную культуру и биопленки инкубировали в течение
фазе; V - объем жидкой фазы, см3; m - масса твер-
1 ч для восстановления МТТ при микробном дыха-
дой фазы, г.
нии. Далее в варианте с биопленкой удаляли среду и
Аналитические методы. Прирост биомассы в
добавляли 3 мл диметилсульфоксида (ДМСО) для
жидкой среде оценивали спектрофотометрически по
растворения образовавшихся кристаллов формазана
оптической плотности при длине волны 660 нм на
и образования окрашенного комплекса с восстанов-
приборе Ultrospec 2100 pro. Значения pH и Eh раство-
ленным МТТ. Планктонную культуру центрифуги-
ров и концентрацию нитрат-анионов определяли с по-
ровали (10 мин, 7000 об/мин), сливали супернатант
мощью pH-метра-иономера «Анион-4100» (Россия),
и добавляли в осадок 3 мл ДМСО. Оптическую
снабженного комбинированными электродами. Кон-
плотность определяли спектрофотометрически при
центрацию нитрит-аниона определяли колориметри-
540 нм на приборе Ultrospec 2100 pro (Amersham
чески с помощью реактива Грисса на спектрофото-
Biosciences, Великобритания) за вычетом измерен-
метре Ultrospec 2100 pro при длине волны 540 нм.
ного фонового поглощения.
ИК спектры записывали в диапазоне волновых
Визуализацию микробных биопленок проводили
чисел 4000-550 см-1 с использованием спектрометра
на сканирующем электронном микроскопе TESCAN
Thermo Nicolet Nexus 4700 FT-IR (США) с ячейкой
VEGA-II XMU (Япония) в Палеонтологическом ин-
нарушенного полного внутреннего отражения
ституте им. А. А. Борисяка РАН.
(НПВО).
Эксперименты по восстановлению металлов про-
В моделировании применяли расчетный код гео-
водили в пенициллиновых флаконах в 10 мл пита-
химического моделирования PhreeqC 2.18 [30]. Рас-
тельной среды, содержащей 238U и 99Tc в концентра-
четы при использовании данного кода проводили в
циях 10-3 и 5·10-4 моль/л соответственно. Количест-
рамках разработки методологии расчета эволюции
венный анализ восстановленного Tc проводили ме-
каскада инженерных барьеров DESTRUCT [31]. Для
тодом спектрофотомерии окрашенных комплексов с
расчета форм урана использовали термодинамиче-
дифенилкарбазидом по разности между начальным
скую базу данных llnl.dat, учитывающую следующее
66
А. В. Сафонов и др.
Таблица 1. Характеристика химического и радиохимического состава проб пластовой жидкости из скважин в рай-
оне бассейна Б-2 (июнь 2016 г.)
Скважи-
Окислите-
Feобщ
Na+
K+
NH+
NO–
SO2-
137Cs
90Sr
U (∑)
pH
на
ли, мг О2/л
мг/л
Бк/л
1
6.06
2.19
4.33
245.0
6.01
1.78
1500
152.0
<0.01
1363.9
0.066
2
6.56
12.0
0.17
639.0
4.89
6.2
2680
79.3
<0.01
993.1
0.72
3
6.73
4.15
0.09
506.0
4.79
1.4
1426
40.5
<0.01
396.5
1.78
распределение форм: U(IV) - U(OH)4, U(CO3)4-,
рассматриваемой фазы прогнозируется при SI > 0).
UOH3+, U(CO3)6-, U(SO4)2, USO2+, U4+, UCl3+, UNO3+,
Статистический анализ результатов осуществ-
U(NO3)2+; U(V) - UO+, UO2(CO3)5-; U(VI) - UO2·
ляли с использованием программ, реализованных в
(CO3)2-, UO2(CO3)4-, UO2CO3, UO2(OH)2, UO2OH+,
Microsoft Excel.
UO2(OH)–, UO2SO4, UO2+, (UO2)3(CO3)6-, UO2(SO4)2-,
Результаты и обсуждение
(UO2)3(OH)+, (UO2)2(OH)2+, UO2Cl+, UO2NO+, (UO2)3·
(OH)7, (UO2)4(OH)+, (UO2)3(OH)2+, UO2Cl2, (UO2)3·
Физико-химические условия и биоразнообразие
(OH)5CO+, (UO2)2OH3+, (UO2)3(OH)2(HCO3)+, UO2·
микроорганизмов в пластовых водах
(OH)2-, UO2SO3, (UO2)11(CO3)6(OH)12-; для расчета
в районе бассейна Б-2
форм Tc использовали следующее распределение
В исследованных пробах жидкости из скважин 1,
форм: Tc(IV) - (TcO(OH)2)2, TcO(OH)2, TcOOH+,
2 и 3, расположенных в районе хранилища жидких
TcO2+; Tc(VI) - HTcO–, H2TcO4; Tc(VII) - TcO–. Базы
РАО бассейна Б-2 СХК на участках с разным уров-
данных были актуализированы в рамках проекта
нем загрязнения, отмечено повышенное содержание
NEA-TDB [32, 33].
нитрат-ионов по сравнению с фоновой подземной
Переход между окислительно-восстановитель-
водой (табл. 1). Наибольшее загрязнение техноген-
ными состояниями U и Tc описывается в применен-
ными компонентами - нитрат-ионами, U и Sr - обна-
ной базе термодинамических данных следующими
ружено в пробах из скважин 2, 3 и 1 соответственно.
уравнениями:
В отобранных пробах не наблюдалось превышения
уровней вмешательства по Cs и Tc, однако в водо-
2H+ + UO2+ = U4+ + H2O + 0.5O2, lgK = -33.9491,
носном горизонте присутствуют локальные зоны с
(2)
-ΔH = 135.895 кДж/моль;
заметным увеличением концентрации обоих радио-
UO2+ + 0.5H2O = UO+ + H+ + 0.25O2, lgK = -20.0169,
нуклидов.
-ΔH = 133.759 кДж/моль;
(3)
Состав микробного сообщества пластовой жидко-
сти, отобранной из этих скважин, был проанализиро-
3H+ + TcO– = TcO2+ + H2O + 0.75O2, lgK = -31.5059.
(4)
ван методом высокопроизводительного секвенирова-
Индексы насыщения превышались при восста-
ния генов 16S рРНК (табл. 2). В полученных библио-
новлении урана для следующих минеральных фаз -
теках генов 16S рРНК на уровне высших таксонов
уранинита, аморфного оксида U(IV) и смешанных
домена Bacteria численно преобладали последова-
оксидов урана:
тельности бактерий филума Proteobacteria (97%),
были обнаружены также последовательности бакте-
Уранинит: UO2 + 4H+ = U4+ + 2H2O, lgK = -4.8372;
(5)
рий филумов Actinobacteria, Bacteroidetes, Firmicutes
UO2(ам): UO2 + 4H+ = U4+ + 2H2O, lg K = 0.1091;
(6)
и Parcubacteria. В филуме Proteobacteria 77% после-
довательностей принадлежало бактериям класса Be-
UO2.25: UO2.25 +2.5H+ = 0.5U4+ + 0.5UO+ + 1.25H2O,
taproteobacteria, представленных бактериями родов
(7)
lg K = -4.8193;
Simplicispira (41%), Alicycliphilus (30%), Herminii-
β-UO2.25: UO2.25 + 2.5H+ = 0.5U4+ + 0.5UO+ + 1.25H2O,
monas (15%) и Variovorax (3%), встречающимся в пре-
(8)
lg K = -4.7593;
сных подземных водах. Последовательности Gam-
maproteobacteria
(13%) принадлежали бактериям
β-UO2.3333: (UO2.3333)2 + 8H+ = 0.3333O2 + 2U4+ + 4H2O,
родов Thermomonas (8%) и Pseudomonas (5%), содер-
(9)
lg K = -27.7177;
жащих денитрифицирующих представителей, а по-
TcS2(тв): TcS2 + H2O = TcO2+ + 2HS-, lgK = -65.9742;
(10)
следовательности Alphaproteobacteria (6%) - аэроб-
ным органотрофным бактериям рода Devosia, широ-
Tc2S7(тв): Tc2S7 + 8H2O = 2TcO– + 7HS- + 9H+,
(11)
ко распространенным в почвах и водных экосисте-
lg K = -230.2410;
мах. В составе выявленных таксонов встречаются
TcO2·2H2O(ам): TcO2·2H2O + 2H+ = TcO2+ + 3H2O,
бактерии аэробного и анаэробного типов дыхания.
(12)
lg K = -4.2319.
Многие из них способны использовать нитраты и
Значения индексов насыщения (SI) рассчитыва-
металлы в высших степенях окисления в качестве
ли по формуле SI = lg(IAP) - lgKs (образование
акцепторов электронов.
Биогенные факторы иммобилизации радионуклидов
67
Таблица 2. Возможная геохимическая функция органотрофных бактерий, доминирующих в составе микробного со-
общества пластовой жидкости
Филум
Класс
Род
Возможные процессы
Herminiimonas
Восстановление нитрата, Mn(IV), Fe(III), арсената
Betaproteobacteria (77%)
Alicycliphilus
Восстановление нитрата, хлоратов
Proteobacteria
Thermomonas
Восстановление нитрата, хлоратов, перхлоратов
(97%)
Gammaproteobacteria (13%)
Pseudomonas
Восстановление нитрата, Mn(IV), Fe(III), U(VI), арсената
Alphaproteobacteria (6%)
Devosia
Восстановление нитрата до нитрита
На рис. 1 приведены результаты определения чис-
после начала эксперимента.
ленности аэробных органотрофных и анаэробных
Результаты сканирующей электронной микроско-
железо-, нитрат- и сульфатредуцирующих бактерий.
пии поверхности кварцевых частиц песка (рис. 3) че-
Максимальная численность аэробных органотроф-
рез 20 сут после начала эксперимента подтверждают
ных (до 106 кл/мл), а также факультативно анаэроб-
наличие поверхностной биопленки. На микрофото-
ных денитрифицирующих бактерий (105 кл/мл) была
графиях видны биогенные разрастания между час-
отмечена в пробах с высоким уровнем загрязнения.
тицами и обильное обрастание поверхности.
Во всех пробах численность сульфатредуцирующих
и железоредуцирующих бактерий была низка, веро-
Известно, что бактериальные биопленки на 90-
ятно, вследствие высокого окислительно-восстано-
95% представлены полисахаридным матриксом
вительного потенциала среды обусловленного высо-
[34], основу которого составляет β-глюкуроновая
ким содержанием нитратов в воде.
кислота. При этом его макроструктура, обусловлен-
Результаты образования биопленок на песке
в модельных экспериментах
В ходе эксперимента по выращиванию микроб-
ного сообщества пластовой жидкости в виде пленок
на твердом субстрате было установлено, что на пес-
ке, отобранном из водоносного горизонта в районе
бассейна Б-2 СХК, развивалась бактериальная мик-
рофлора, формируя на поверхности кварцевых час-
тиц биогенный полисахаридный матрикс. Макси-
мум накопления органического вещества приходил-
ся на период 15-25 сут, при этом максимальная ме-
таболическая активность прикрепленных форм бак-
терий (биопленок) наблюдалась на 7-20-е сутки
(рис. 2). По мере роста биопленок происходило
«старение» полисахаридного матрикса и его частич-
ная деградация. При этом повышенное содержание
органического вещества на породе по сравнению с
исходным состоянием наблюдалось и через полгода
Рис. 2. Кинетика роста микробного сообщества в виде биопле-
нок на песке: а - по накоплению органического вещества на
песке, б - по интенсивности метаболизма.
4
3
2
1
Рис. 1. Численность N анаэробных сульфат- (1), железо- (2) и
нитратредуцирующих (3) бактерий и аэробных органотрофных
бактерий (4) в пластовой воде, отобранной из трех наблюда-
Рис. 3. Фотографии биопленок на поверхности кварцевых
тельных скважин по контуру законсервированного хранилища
частиц песка, полученные с помощью сканирующего элек-
Б-2 на территории СХК.
тронного микроскопа TESCAN VEGA-II XMU.
68
А. В. Сафонов и др.
носящихся к валентным колебаниям ν(СО) эфирной
и гидроксильной групп. При этом две интенсивные
полосы при 1081 и 1034 см-1 на фоне полосы ν(SiO)
1002 см-1 можно отнести к колебаниям скелета ко-
лец полисахаридов. Так, например, для структуры,
присущей β-глюкану, в ИК спектрах характерны
интенсивные полосы в области 1078 и 1034 см-1.
Полоса при 1324 см-1 описывает, по всей видимо-
сти, деформационные колебания δ(COH).
Сорбционные характеристики песка до и после
роста на нем биопленок
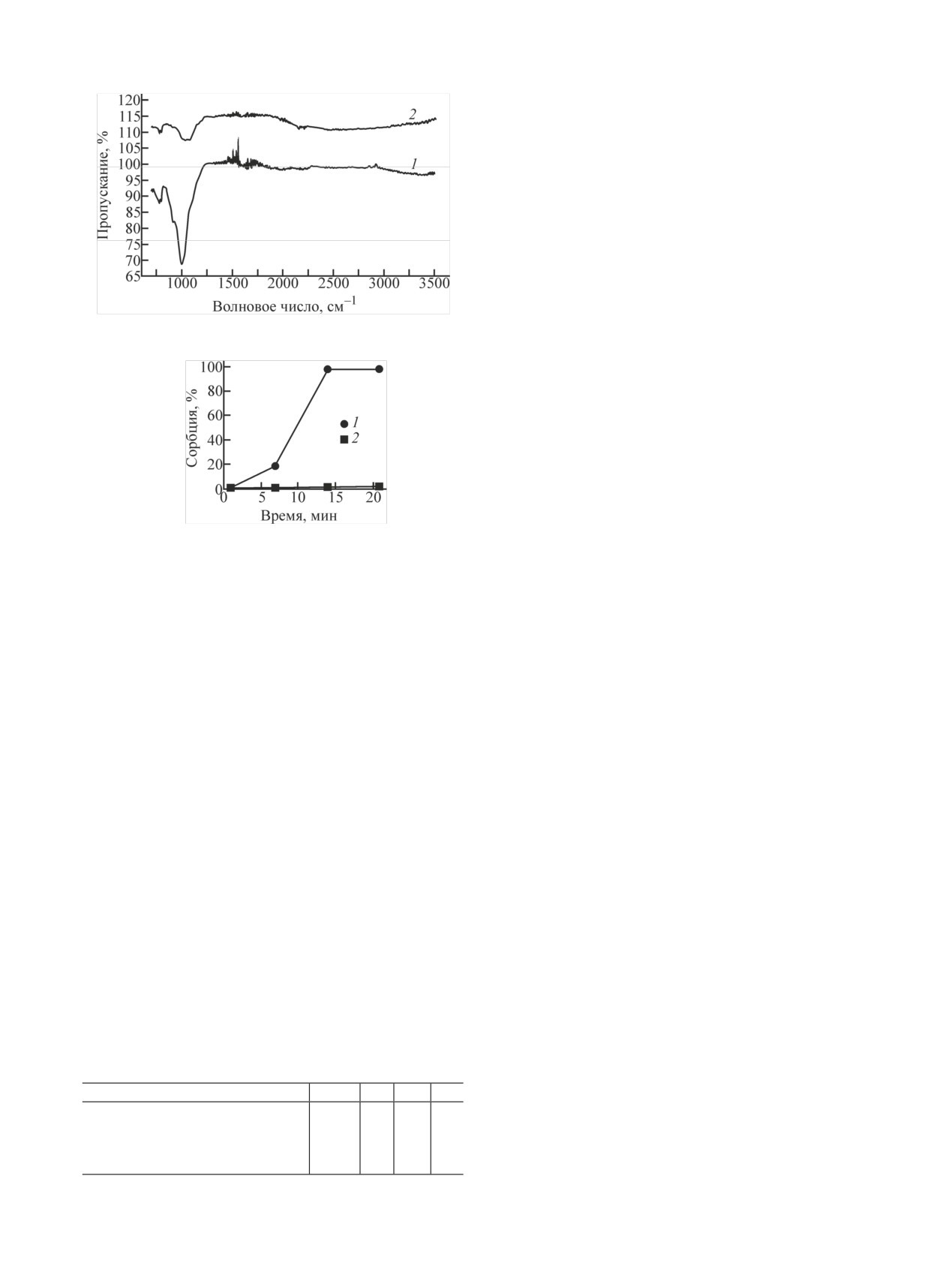
Рис. 4. ИК спектры образцов: 1 - исходный песок, 2 - песок
В табл. 3 приведены значения коэффициента рас-
после роста биопленки (спектр сдвинут вверх).
пределения (Kd) 137Cs, 90Sr, 233U и 99Tc на песке в ис-
ходном образце и после роста на нем микробного
сообщества пластовой жидкости в виде биопленок.
Значения Kd 137Cs были высокими, что можно объяс-
нить наличием глинистой фракции (до 10% от обще-
го объема) песка, после образования биопленки зна-
чительных изменений сорбционной емкости не обна-
ружено. В результате роста биопленок сорбция 90Sr
снижается на 35%. Вероятно, это связано с перекры-
тием сорбционных центров на поверхности глини-
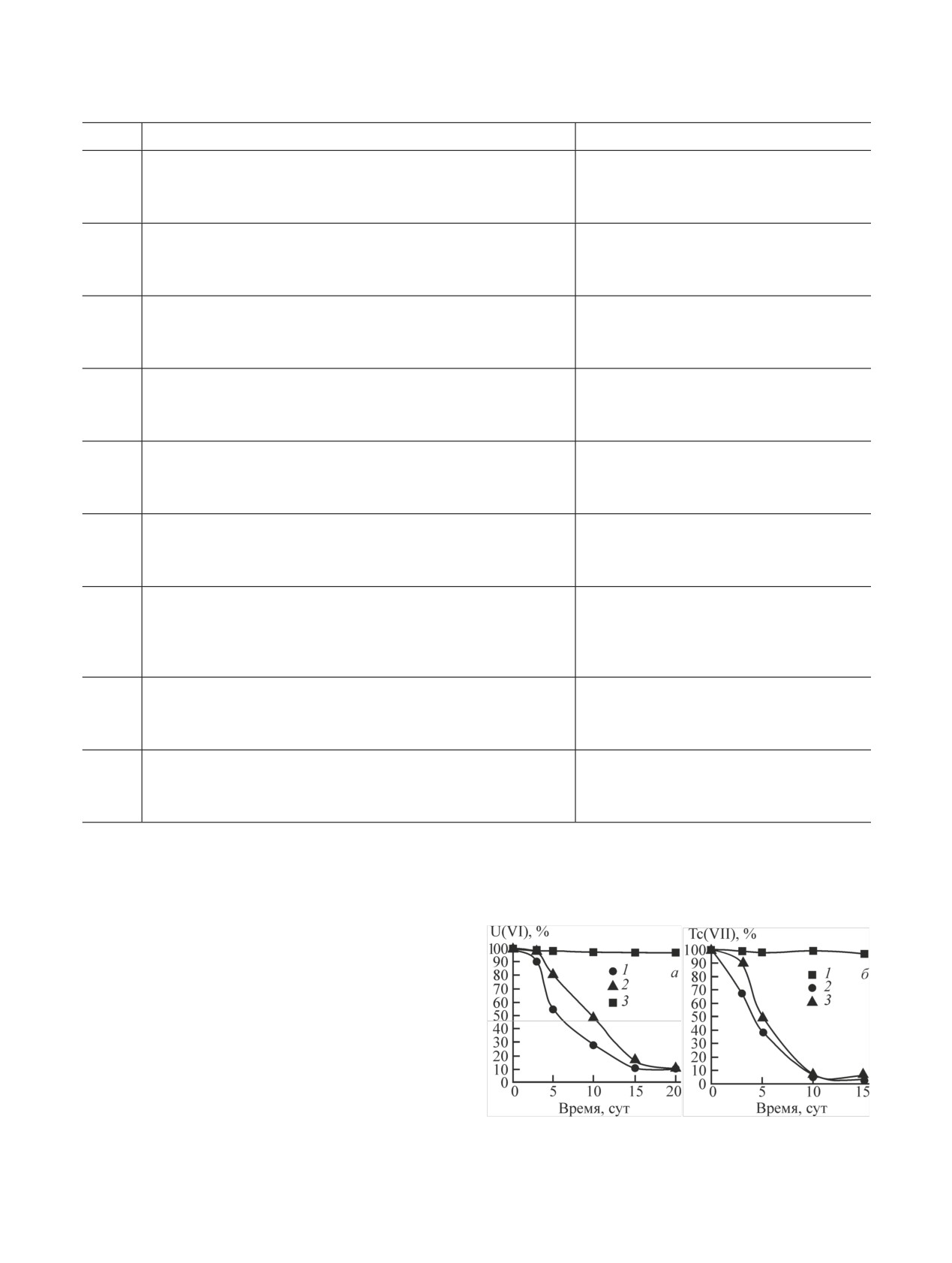
Рис. 5. Кинетика сорбции Tc в присутствии микробного сооб-
стых частиц. Сорбция 99Tc была незначительной.
щества пластовой жидкости (1) и в контроле (2) в анаэробных
условиях при добавлении глюкозы.
Полученные высокие значения Kd 233U можно так-
же объяснить высоким содержанием в песке глини-
ная связями с дополнительными моно-, олиго- и
стой фракции с примесью Fe(II), в результате чего
полисахаридами, пептидами и липидами, как прави-
происходит окислительно-восстановительное осаж-
ло, является уникальной для каждого вида бакте-
дение урана. При этом после роста биопленок сорб-
рий. Тем не менее влияние биогенного обрастания
ционная емкость песка по урану выросла еще на
поверхности вмещающих пород можно оценивать
20%, что может быть обусловлено новыми типами
на примере полисахаридов, содержащих в составе
взаимодействий урана с полисахаридными комплек-
свободные гидроксильные группы, гликозидные
сами, в первую очередь с гидроксильными и карбок-
связи и в ряде случаев карбонильные группы.
сильными функциональными группами. Для под-
тверждения этого предположения был исследован
ИК спектр песка с биопленочным обрастанием
рост микробных биопленок на керамзите, характери-
(рис. 4) заметно отличается от спектра исходного
зующемся сравнительно невысокими исходными
образца, где регистрировались в основном полосы
значениями Kd по радионуклидам вследствие сильно
(см-1), относящиеся к колебаниям SiO2: 1002 с, 796
развитой, но химически инертной поверхности. В
и 778 ср, 695 сл.
аналогичном режиме выращивания биопленок, как и
Анализ появившихся новых полос на песке по-
для песка, после роста биопленок на керамзите коэф-
зволяет предположить присутствие адсорбирован-
фициент распределения 233U вырос в 8 раз, 90Sr - бо-
ных полисахаридов на его поверхности. Об этом
лее чем в 21 раз. При этом сорбция 137Cs уменьши-
свидетельствуют широкая полоса с рядом подмак-
лась в 4 раза, а сорбция 99Tc до и после роста мик-
симумов в области 3700-2000 см-1, обусловленная
робной биопленки была незначительна.
поглощением гидроксильных групп, в разной степе-
Эксперимент по сорбции Tc в присутствии био-
ни связанных водородными связями, и группа слож-
пленок был повторен в динамике в анаэробных усло-
ных полос в интервале 1200-1030 см-1, обычно от-
виях. Как видно из рис. 5, за 21 сут эксперимента
Таблица 3. Коэффициенты распределения радионукли-
сорбция Tc на песке в присутствии микроорганизмов
дов (Kd, см3/г) на песке и керамзите в исходном образце
практически достигла 100%, что можно объяснить
и после формирования на нем биопленок
снижением его растворимости в результате восста-
новления Tc(VII) до Tc(IV) вследствие жизнедея-
Материал
137Cs
90Sr
233U
99Tc
тельности микроорганизмов.
Исходный песок
1851
20
518
0.15
Результаты определения окисленных и восстанов-
Песок после роста биопленок
1848
13
644
0.22
ленных форм U и Tc на песке в аэробных и анаэроб-
Исходный керамзит
42.5
2.9
34.9
0.1
Керамзит после роста биопленок
10.2
61.6
271
0.07
ных условиях в присутствии микробного сообщества
Биогенные факторы иммобилизации радионуклидов
69
Таблица 4. Доминирующие формы урана и технеция в зависимости от Eh системы
Eh, мВ
U, моль/л
Tc, моль/л
U(IV) 3.839·10-11: U(OH)4 3.839·10-11
Tc(IV) 1.035·10-8: TcO(OH)2 9.729·10-9,
U(V) 2.772·10-12: UO+ 2.772·10-12
(TcO(OH)2)2 3.114·10-10, TcOOH+ 5.284·10-13
100
U(VI) 2.478·10-7: UO
2(CO3)2- 1.719·10-7, UO2(CO3)4- 6.460·10-8,
Tc(VII) 1.010·10-6: TcO– 1.010·10-6
UO2CO3 8.362·10-9, UO2(OH)2 2.739·10-9, UO2OH+ 1.236·10-10
U(IV) 4.479·10-10: U(OH)4 4.479·10-10
Tc(IV) 4.851·10-7: TcO(OH)2 2.060·10-7,
U(V) 9.459·10-12: UO+ 9.459·10-12
(TcO(OH)2)2 1.395·10-7
70
U(VI) 2.474·10-7: UO
2(CO3)2- 1.716·10-7, UO2(CO3)34- 6.450·10-8,
Tc(VII) 5.354·10-7: TcO– 5.354·10-7
UO2CO3 8.348·10-9, UO2(OH)2 2.734·10-9, UO2OH+ 1.234·10-10
U(IV) 2.289·10-9: U(OH)4 2.289·10-9
Tc(IV) 9.511·10-7: (TcO(OH)2)2 3.197·10-7,
U(V) 2.130·10-11: UO+ 2.130·10-11
TcO(OH)2 3.117·10-7, TcOOH+ 1.693·10-11
50
U(VI) 2.456·10-7: UO
2(CO3)2- 1.703·10-7, UO2(CO3)4- 6.401·10-8,
Tc(VII) 6.935·10-8: TcO– 6.935·10-8
UO2CO3 8.286·10-9, UO2(OH)2 2.714·10-9, UO2OH+ 1.225·10-10
U(IV) 1.135·10-8: U(OH)4 1.135·10-8
Tc(IV) 1.014·10-6: (TcO(OH)2)2 3.451·10-7,
U(V) 4.655·10-11: UO+ 4.655·10-11
TcO(OH)2 3.239·10-7
30
U(VI) 2.365·10-7: UO
2(CO3)2- 1.640·10-7, UO2(CO3)4- 6.165·10-8,
Tc(VII) 6.167·10-9: TcO– 6.167·10-9
UO2CO3 7.979·10-9, UO2(OH)2 2.614·10-9, UO2OH+ 1.180·10-10
U(IV) 2.464·10-7: U(OH)4 2.464·10-7
Tc(IV) 1.020·10-6: (TcO(OH)2)2 3.476·10-7,
U(V) 1.680·10-11: UO+ 1.680·10-11
TcO(OH)2 3.251·10-7, TcOOH+ 1.766·10-11,
-70
U(VI) 1.418·10-9: UO
2(CO3)2- 9.837·10-10, UO2(CO3)4- 3.698·10-10,
TcO2+ 1.385·10-16
UO2CO3 4.786·10-11, UO2(OH)2 1.567·10-11
Tc(VII) 2.842·10-14: TcO– 2.842·10-14
U(IV) 2.478·10-7: U(OH)4 2.478·10-7
Tc(IV) 1.020·10-6: (TcO(OH)2)2 3.476·10-7,
U(V) 2.178·10-12: UO+ 2.178·10-12
TcO(OH)2 3.251·10-7, TcOOH+ 1.766·10-11
-120
U(VI) 2.370·10-11: UO
2(CO3)2- 1.644·10-11, UO2(CO3)4- 6.182·10-12,
Tc(VII) 6.089·10-17: TcO4- 6.089·10-17
UO2CO3 8.000·10-13, UO2(OH)2 2.620·10-13, UO2OH+ 1.183·10-14
U(IV) 2.479·10-7: U(OH)4 2.479·10-7
Tc(IV) 1.020·10-6: (TcO(OH)2)2 3.476·10-7,
U(V) 6.366·10-13: UO+ 6.366·10-13
TcO(OH)2 3.251·10-7, TcOOH+ 1.764·10-11
-150
U(VI) 3.658·10-14: UO2(OH)2 2.243·10-14, UO2(CO3)2- 7.636·10-15,
Tc(VII) 1.523·10-18: TcO4- 1.523·10-18
UO2CO3 5.053·10-15, UO2OH+ 1.011·10-15, UO2(CO3)3- 2.094·10-16,
UO2(OH)– 1.287·10-16
U(IV) 2.479·10-7: U(OH)4 2.479·10-7
Tc(IV) 1.020·10-6: (TcO(OH)2)2 3.476·10-7,
U(V) 8.202·10-14: UO+ 8.202·10-14
TcO(OH)2 3.251·10-7
-200
U(VI) 3.933·10-16: UO2(OH)2 3.727·10-16, UO2OH+ 1.680·10-17,
Tc(VII) 3.261·10-21: TcO– 3.261·10-21
UO2(OH)– 2.138·10-18, UO2+ 1.551·10-18
U(IV) 2.479·10-7: U(OH)4 2.479·10-7
Tc(IV) 1.020·10-6: (TcO(OH)2)2 3.476·10-7,
U(V) 1.057·10-14: UO+ 1.057·10-14
TcO(OH)2 3.251·10-7
-250
U(VI) 6.536·10-18: UO2(OH)2 6.195·10-18, UO2OH+ 2.792·10-19,
Tc(VII) 6.988·10-24: TcO– 6.988·10-24
UO2(OH)– 3.554·10-20, UO2+ 2.578·10-20
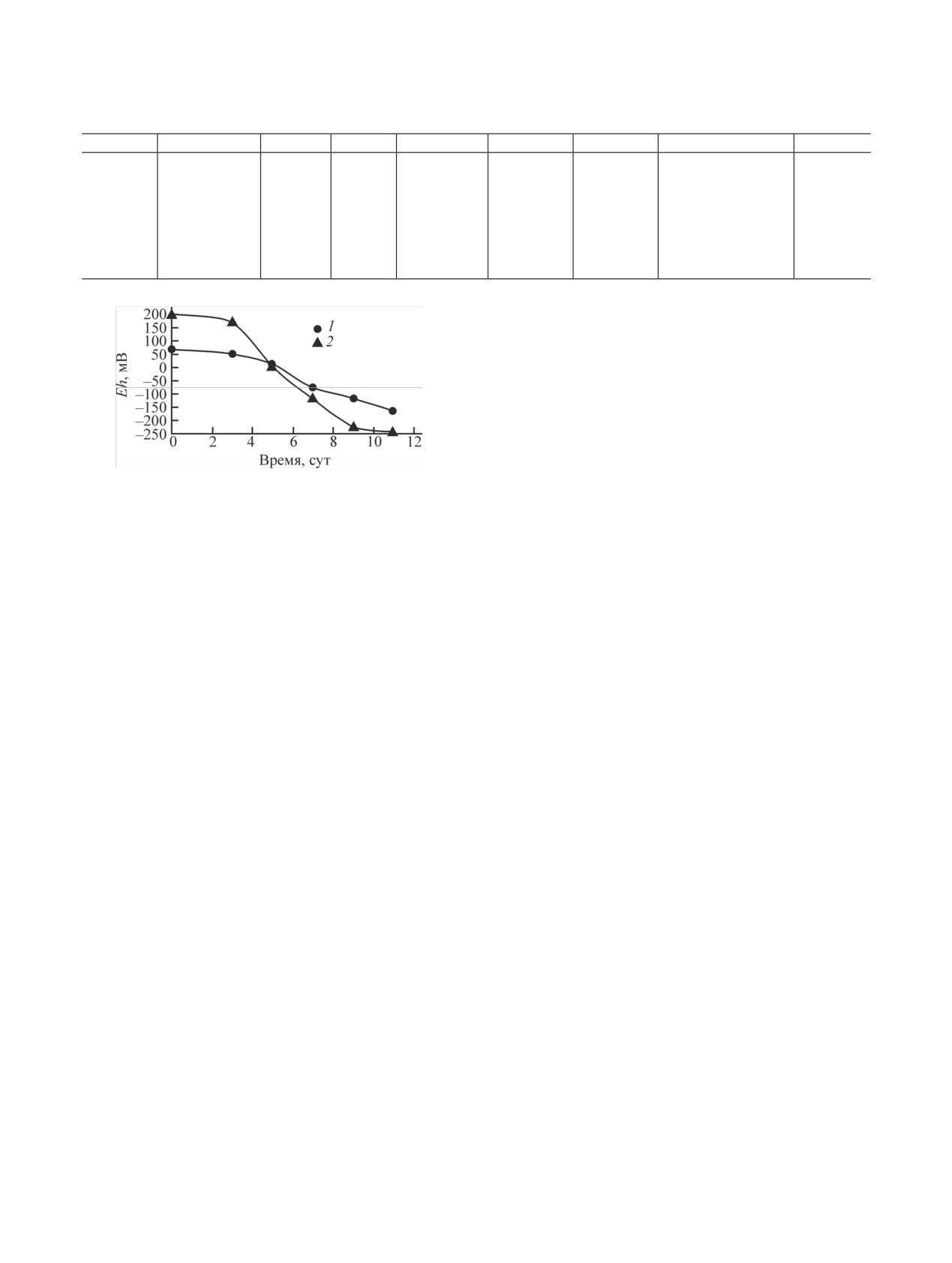
и без него приведены на рис. 6, а, б. Отметим, что
Для расчета форм U и Tc в зависимости от окис-
только в присутствии микроорганизмов происходило
лительно-восстановительного потенциала среды был
взят раствор, аналогичный по ионному составу од-
полное восстановление U и Tc на песке.
ной из исследованных проб (мг/л): Cl- 6.3, HCO– 305,
На основании полученных результатов было про-
ведено компьютерное моделирование состояния U и
Tc в геохимических условиях, имитирующих тако-
вые верхнего водоносного горизонта. В расчетах ис-
пользовали данные по изменению окислительно-
восстановительного потенциала среды во время рос-
та микробного сообщества пластовой жидкости
(рис. 7). При лабораторном моделировании биологи-
ческих процессов в системе происходило восстанов-
ление сульфат-ионов до сульфид-ионов, выпадаю-
щих в виде черного осадка сульфида железа, кото-
рый также может способствовать иммобилизации
Рис. 6. Содержание U(VI) (а) и Tc(VII) (б) на песке в анаэроб-
ряда металлов в восстановленной форме, например
ных (1) и аэробных (2) условиях в присутствии микробного
Tc [35, 36].
сообщества пластовой жидкости и без него (3).
70
А. В. Сафонов и др.
Таблица 5. Значения индексов насыщения SI для твердых фаз U и Tc в низших состояниях окисления для системы
раствора 1 в зависимости от окислительно-восстановительных условий среды
Eh, мВ
Уранинит
UO2(ам)
UO2.25
β-UO2.25
β-UO2.33
Tc2S7
TcO2·2H2O(ам)
TcS2
70
0.03
-4.92
0.15
0.07
-0.16
-141.90
-0.46
-37.80
50
0.73
-4.21
0.68
0.60
0.78
-112.55
0.87
-27.94
30
1.43
-3.51
1.19
1.12
1.70
-94.40
1.05
-22.06
0
2.32
-2.62
1.82
1.74
2.78
-49.88
1.07
-7.81
-70
2.77
-2.18
1.64
1.56
2.00
12.40
1.07
12.12
–120
2.77
-2.17
1.20
1.12
0.82
56.88
1.07
26.35
–150
2.77
-2.17
0.93
0.86
10.11
83.56
1.07
34.89
Аналитические измерения выполнены на обору-
довании ЦКП ФМИ ИФХЭ РАН. Работа выполнена
при финансовой поддержке РНФ (проект 17-17-
01212).
Работа выполнена при частичной финансовой
поддержки Минобрнауки РФ (темы АААА-А16-
11611091001 и 01201350928).
Список литературы
Рис. 7. Изменение окислительно-восстановительного потен-
циала в среде в ходе роста микробного сообщества пластовой
[1] Богуславский А. Е., Гаськова О. Л., Шемелина О. В. //
жидкости в анаэробных (1) и аэробных (2) условиях.
Химия в интересах устойчивого развития. 2012. T. 20.
С. 515-529.
NО– 3849, SО2- 167, Ca2+ 762, Mg2+ 140, K+ 8.9, Na+
[2] Мироненко В. А., Румынин В. Г. Проблемы гидрогеоэко-
логии. М.: Изд-во МГГУ, 1999. Т. 3, кн. 1. 312 с.
647; в расчете была использована концентрация Tc
[3] Schwartz M. O. // Environ. Earth Sci. 2009. Vol. 59, N 2.
0.1, U - 0.059 мг/л. На основании проведенных расче-
Р. 277-286.
тов (табл. 4) потребление кислорода в системе и со-
[4] Panitskiy A. V., Lukashenko S. N. // J. Environ. Radioact.
ответственно снижение окислительно-восстанови-
2015. Vol. 144. Р. 32-40.
тельного потенциала до -250 мВ за счет микробных
[5] Torgoev I. A., Aleshyn U. G., Havenit H. B. // Uranium in the
процессов должно привести к полному восстановле-
Aquatic Environment. Berlin; Heidelberg: Springer,
2002.
нию уранил- и пертехнетат-ионов. В табл. 5 приведе-
[6] Taylor G. H. // Biogeochemical Cycling of Mineral-Forming
ны индексы насыщения доминирующих минераль-
Elements. New York: Elsevier Science, 1979. Р. 485-514.
ных фаз. Исходя из расчетов основная биогенная фа-
[7] Pignolet L., Fonsny K., Capot F., Moureau Z. // Health Phys.
за урана в заданных геохимических условиях, близ-
1989. Vol. 57. Р. 791-800.
ких к условиям исследованного подземного песчано-
[8] Mohagheghi A., Updegraff D. M., Goldhaber M. B. //
Geomicrobiol. J. 1985. Vol. 4. Р. 153-173.
го водоносного горизонта, будет представлена ура-
[9] Lloyd J. R. // FEMS Microbiol. Rev. 2003. Vol. 27. Р. 411-
нинитом и смешанными оксидными формами, для Tc
425.
будут доминировать восстановленные сульфидные
[10] Boukhalfa H., Icopini G. A., Reilly S. D., Neu M. P. // Appl.
минералы, что совпадает с результатами других ис-
Environ. Microbiol. 2007. Vol. 73, N 18. Р. 5897-5903.
следований [36-38].
[11] Lovley D. R., Phillips E. J. P., Gorby Y. A., Landa E. R. //
Nature.
1991. Vol.
350, N
6317. Р.
413-416. DOI:
Таким образом, при изучении миграции радио-
10.1038/350413a0.
нуклидов в водоносных горизонтах помимо абиоти-
[12] Wall J. D., Krumholz L. R. // Annu. Rev. Microbiol. 2006.
ческих процессов необходимо учитывать и влияние
Vol. 60. Р. 149-166.
микроорганизмов. Образование полисахаридных
[13] Lloyd J. R., Sole V. A., Van Praagh C. V. G., Lovley D. R. //
биопленок может приводить к ухудшению сорбци-
Appl. Environ. Microbiol. 2000. Vol. 66, N 9. Р. 3743-3749.
онной емкости пород по отношению к Cs и Sr за
[14] Lloyd J. R., Yong P., Macaskie L. E. // Environ. Sci. Technol.
2000. Vol. 34. Р. 1297-1301.
счет перекрытия химических сорбционных центров
[15] Brookshaw D. R., Pattrick R. A. D., Lloyd J. R., Vaughan D. J. //
вмещающей породы. При этом можно ожидать уве-
Mineral. Mag. 2012. Vol. 76. Р. 777-806.
личения иммобилизации U и Tc за счет формирова-
[16] Hua B., Xu H., Terry J., Deng B. // Environ. Sci. Technol.
ния дополнительных сорбционных центров для U и
2006. Vol. 40, N 15. Р. 4666-4671.
биогенного восстановления Tc за счет изменения
[17] El-Wear S., German K. E., Peretrukhin V. F. // J. Radioanal.
окислительно-восстановительных условий среды и
Nucl. Chem. 1992. Vol. 157. Р. 3-14.
[18] Coombs P., Wagner D., Bateman K. et al. // Q. J. Eng. Geol.
его прямого энзиматического восстановления. По
Hydrogeol. 2010. Vol. 43, N 2. Р. 131-139.
данным геохимического моделирования можно ожи-
[19] Michalsen M. M., Peacock A. D., Smithgal A. N. et al. // Envi-
дать иммобилизацию Tc в виде новой минеральной
ron. Sci. Technol. 2009. Vol. 43, N 6. Р. 1952-1961.
фазы - оксида Tc(IV) с биогенным сульфидом.
[20] Ortiz-Bernad I., Anderson R. T., Vrionis H. A., Lovley D. R. //
Биогенные факторы иммобилизации радионуклидов
71
Appl. Environ. Microbiol. 2004. Vol. 70, N 12. Р. 7558-7560.
chemical Calculations. Denver, Colorado, 1999. 327 р.
[21] Xu M., Wu W. M., Wu L. // ISME J. 2010. Vol. 4, N 8.
[31] Болдырев К. А., Крючков Д. В., Мартынов К. В. и др. Раз-
Р. 1060-1070.
работка расчетных методов оценки миграции радионук-
[22] Cumberlanda S. A., Kliti G. D., Moreau G. J. W. // Earth-Sci.
лидов за пределы ИББ с учетом их эволюции: Препринт
Rev. 2016. Vol. 159. P. 160-185.
ИБРАЭ. М.: ИБРАЭ РАН, 2017. N IBRAE-2017-11. 23 c.
[23] Suzuki Y., Kelly S. D., Kemner K. M., Banfield J. F. // Nature.
[32] Rard J. A., Rand M. H., Anderegg G., Wanner H. Chemical
2002. Vol. 419, N 6903. Р. 134.
Thermodynamycs 3. Chemical Thermodynamics of Techne-
[24] Koch A. L. // Methods for General and Molecular Bacteriol-
tium / Eds M. C. A. Sandio, E. Östhols. OECD NEA Data
ogy. Washington, DC: Am. Soc. for Microbiology, 1994.
Bank. Elsevier, 1999. 544 p.
Р. 257-260.
[33] Guillaumont R., Fanghänel T., Fuger J. et al. // Chemical
[25] Adkins J. P., Cornell L. A., Tanner R. S. // Geomicrobiol. J.
Thermodynamics. OECD NEA Data Bank, Issy-les-
1992. Vol. 10. Р. 87-97.
Moulineaux, France. Elsevier, 2003. Vol. 5. Р. 709.
[26] Postgate J. R. The Sulfate-Reducing Bacteria. Cambridge:
[34] Chabalala S., Chirwa E. // Chem. Eng. Trans. 2012. Vol. 27.
Cambridge Univ. Press, 1984. 2nd ed. 1208 р.
Р. 265-270.
[27] Lovley D. R., Phillips E. J. P. // Appl. Environ. Microbiol.
[35] Flemming H. C., Wingender J. // Nat. Rev. Microbiol. 2010.
1988. Vol. 54, N 6. P. 1472-1480.
Vol. 8. Р. 623-633.
[28] Berridge M. V., Tan M. V. // Arch. Biochem. Biophys. 1993.
[36] Fan D., Anitori R. P., Tebo B. M., Tratnye P. G. // Environ.
Vol. 303, N 2. P. 474-482.
Sci. Technol. 2013. Vol. 47. Р. 5302-5310.
[29] Onishi H., Sekine K. // Talanta. 1972. Vol. 19, N 4. Р. 473-
[37] German K. E., Shiryaev A. A., Safonov A. V. et al. // Radio-
478.
chim. Acta. 2015. Vol. 103. Р. 199-203.
[30] Parkhurst D. L., Appelo C. A. J. User’s Guide to PHREEQC
[38] German K. E., Khijniak T. V., Peretrukhin V. F. // 7th Int.
(Version 2), A Computer Program for Speciation, Batch-
Symp. on Technetium and Rhenium—Science and Utiliza-
Reaction, One-Dimensional Transport, and Inverse Geo-
tion. Moscow (Russia), July 4-8, 2011. Р. 187-189.