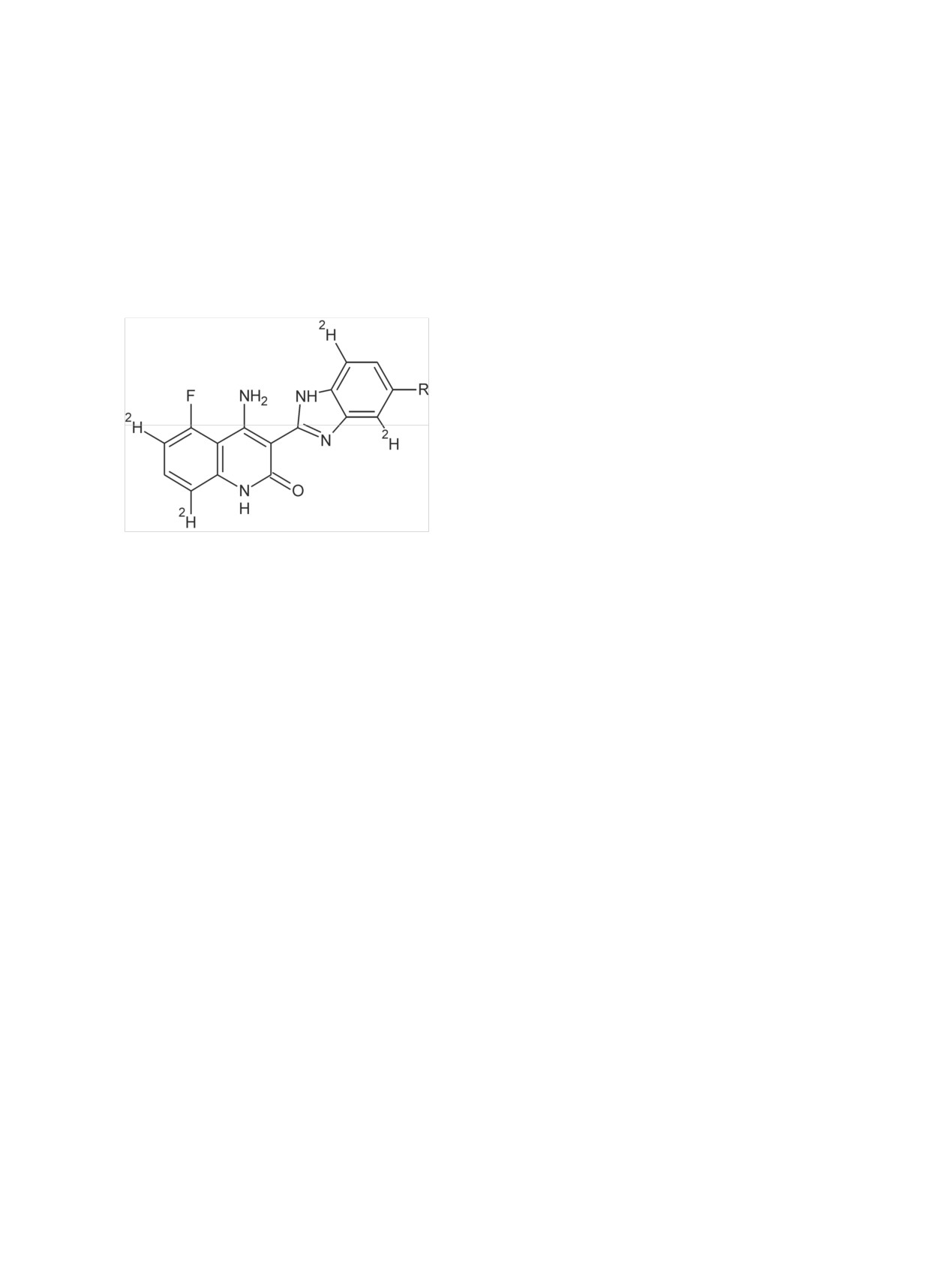
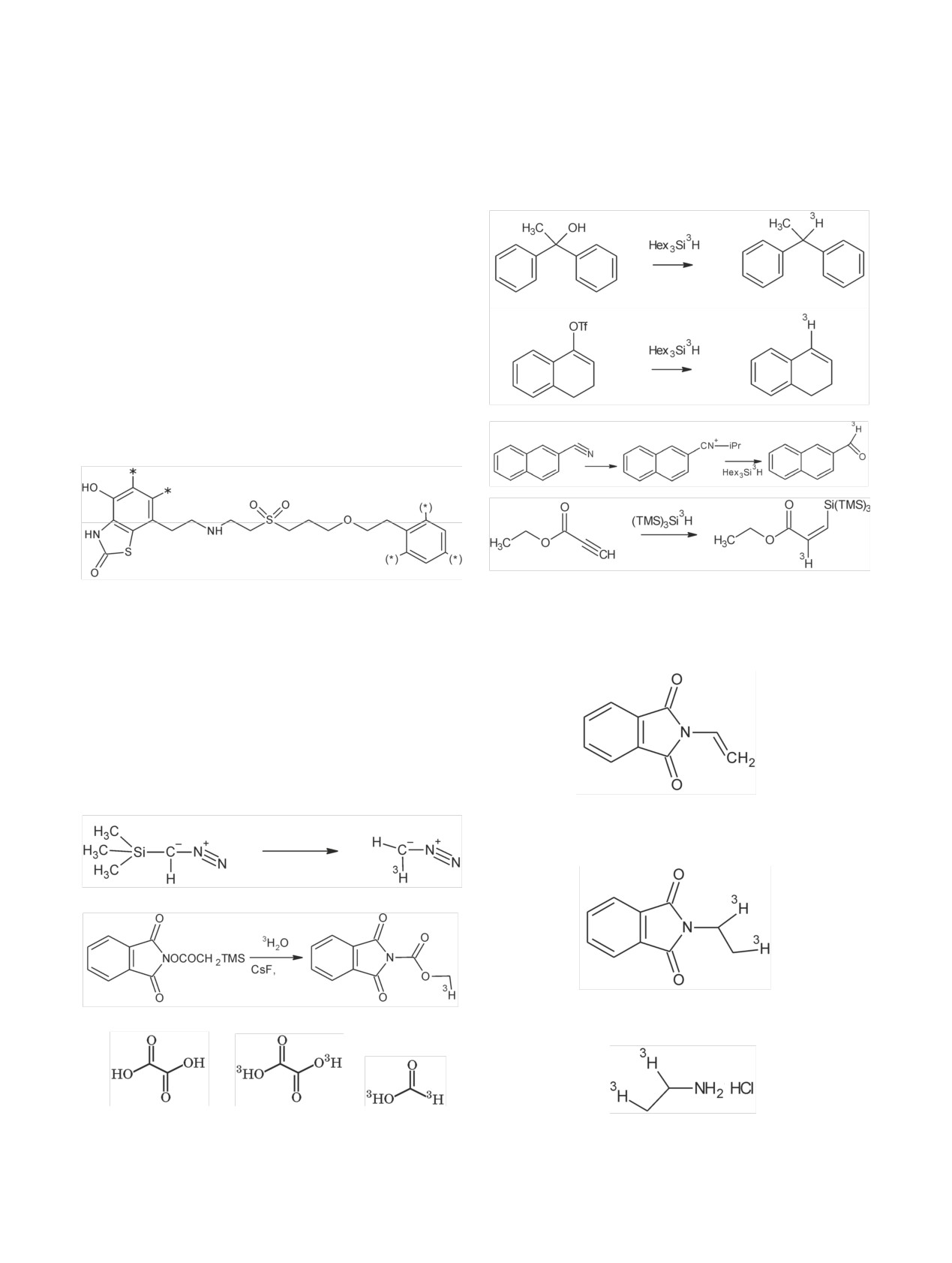
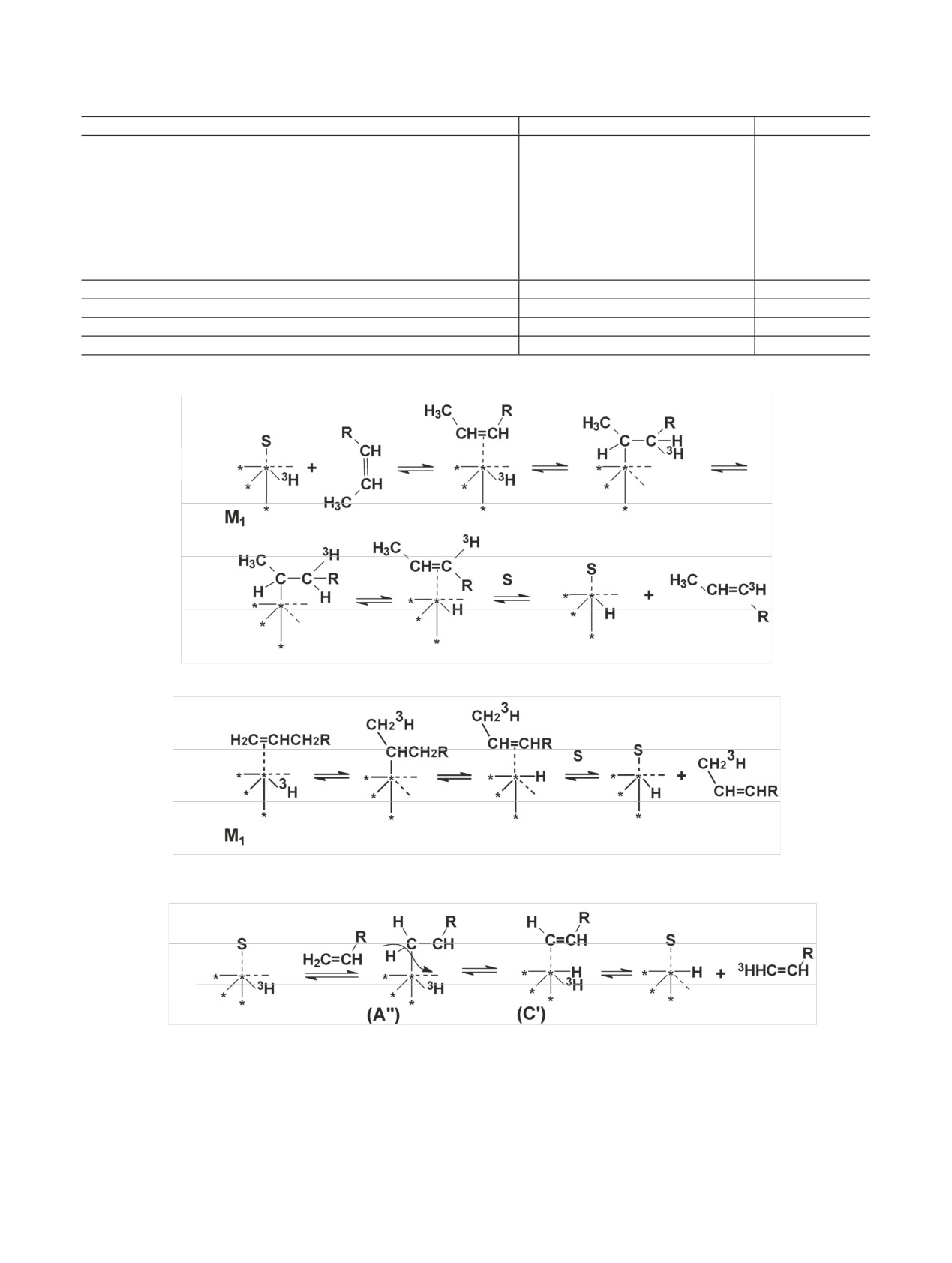
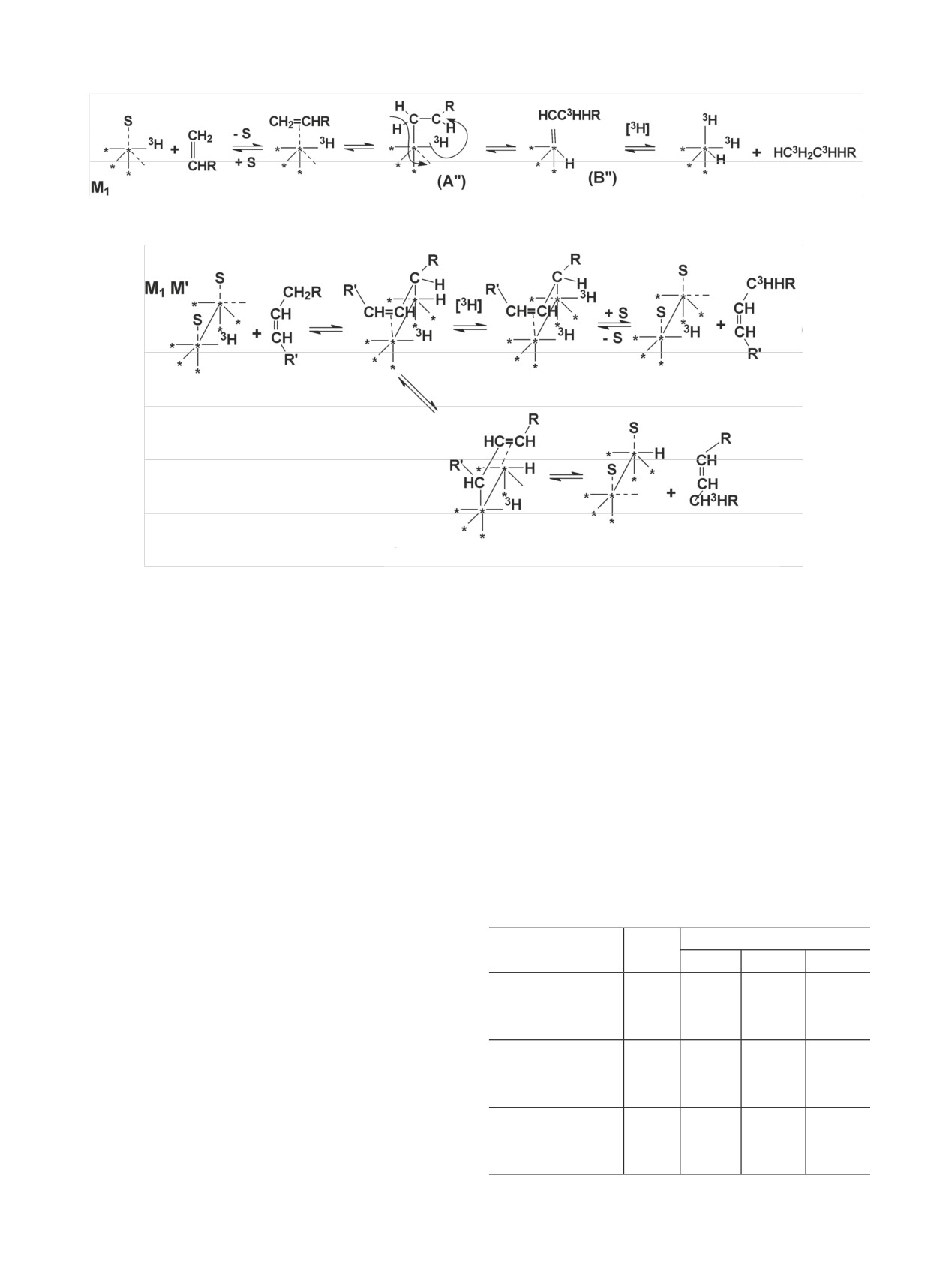
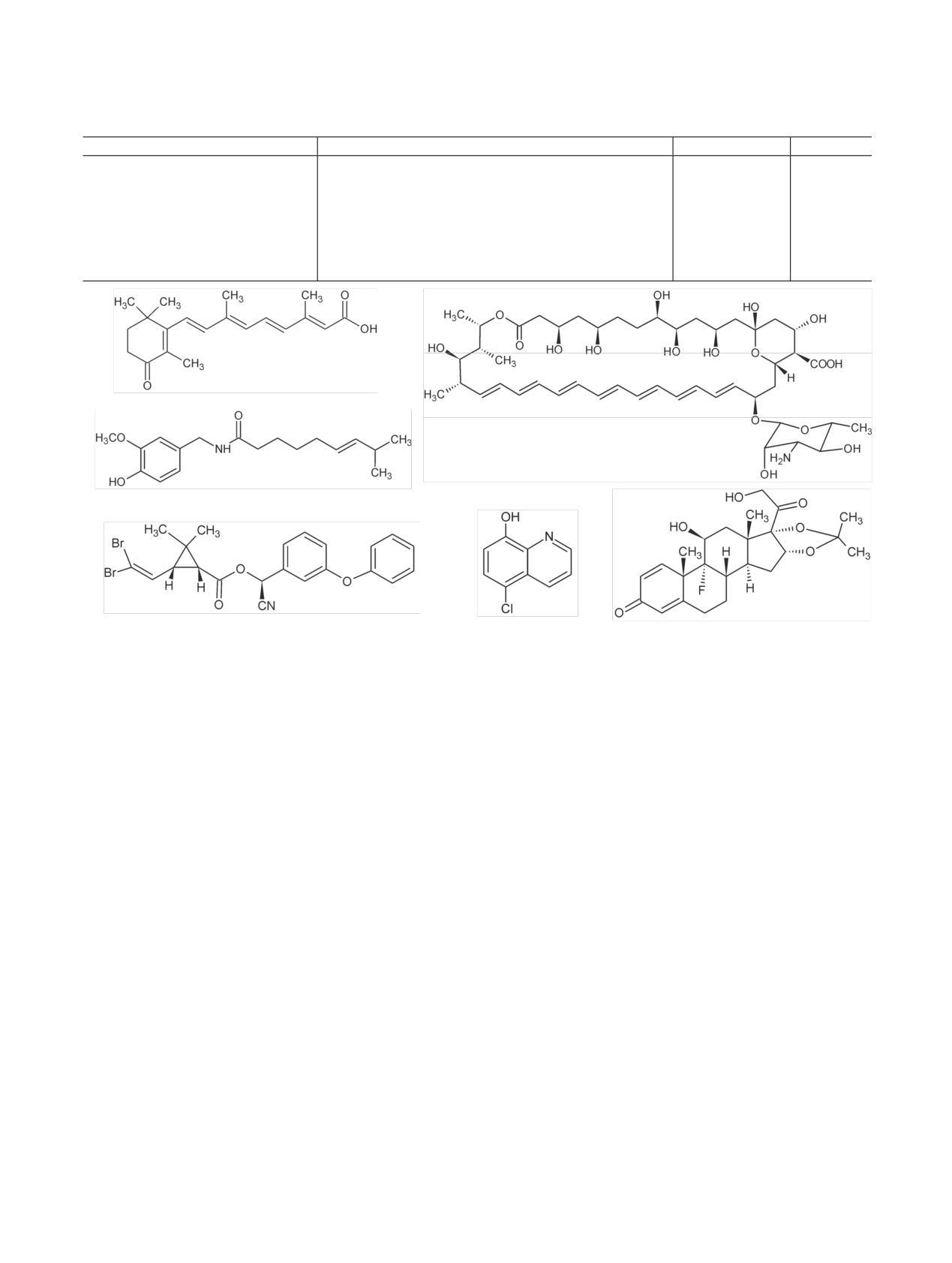
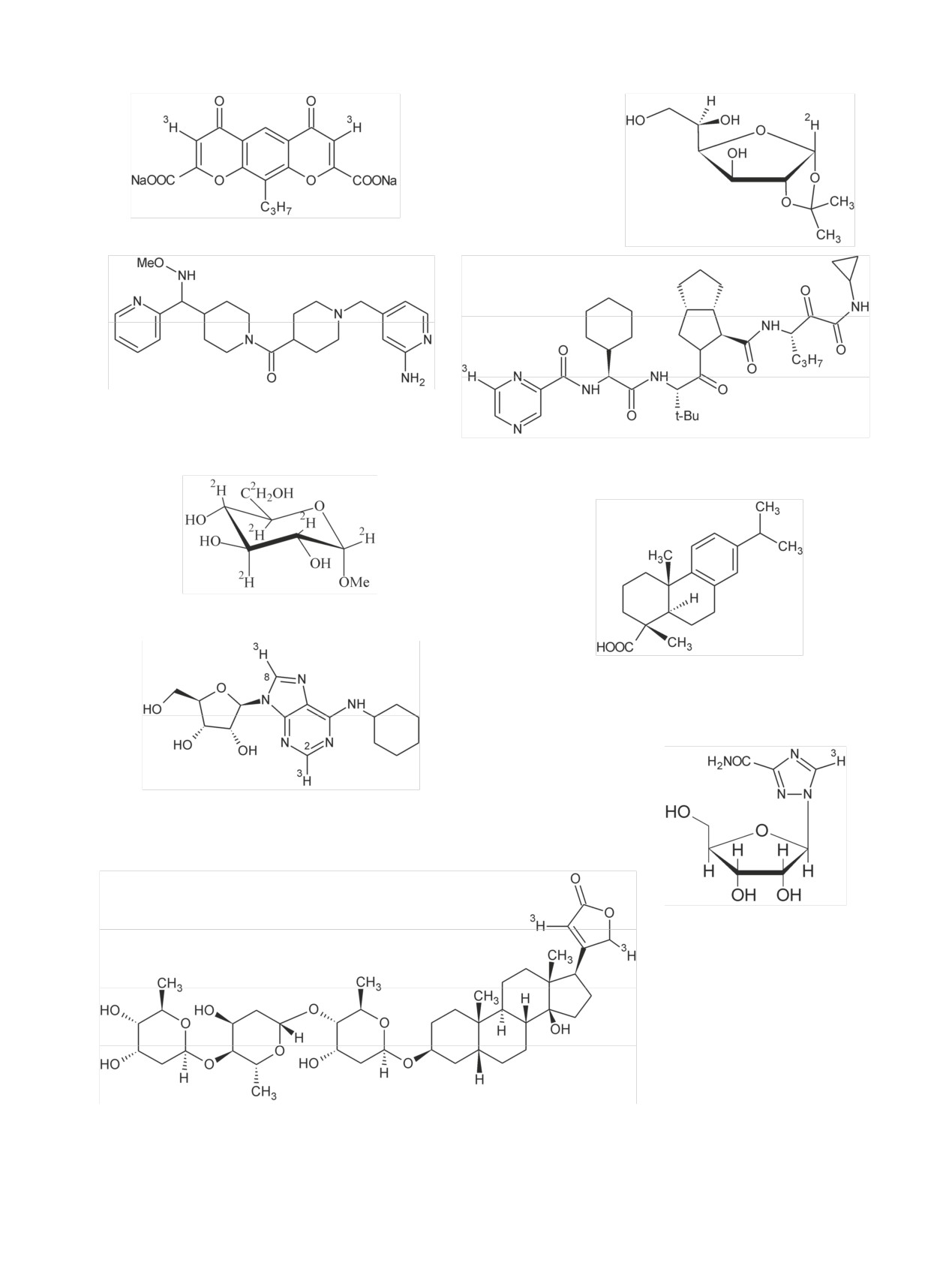
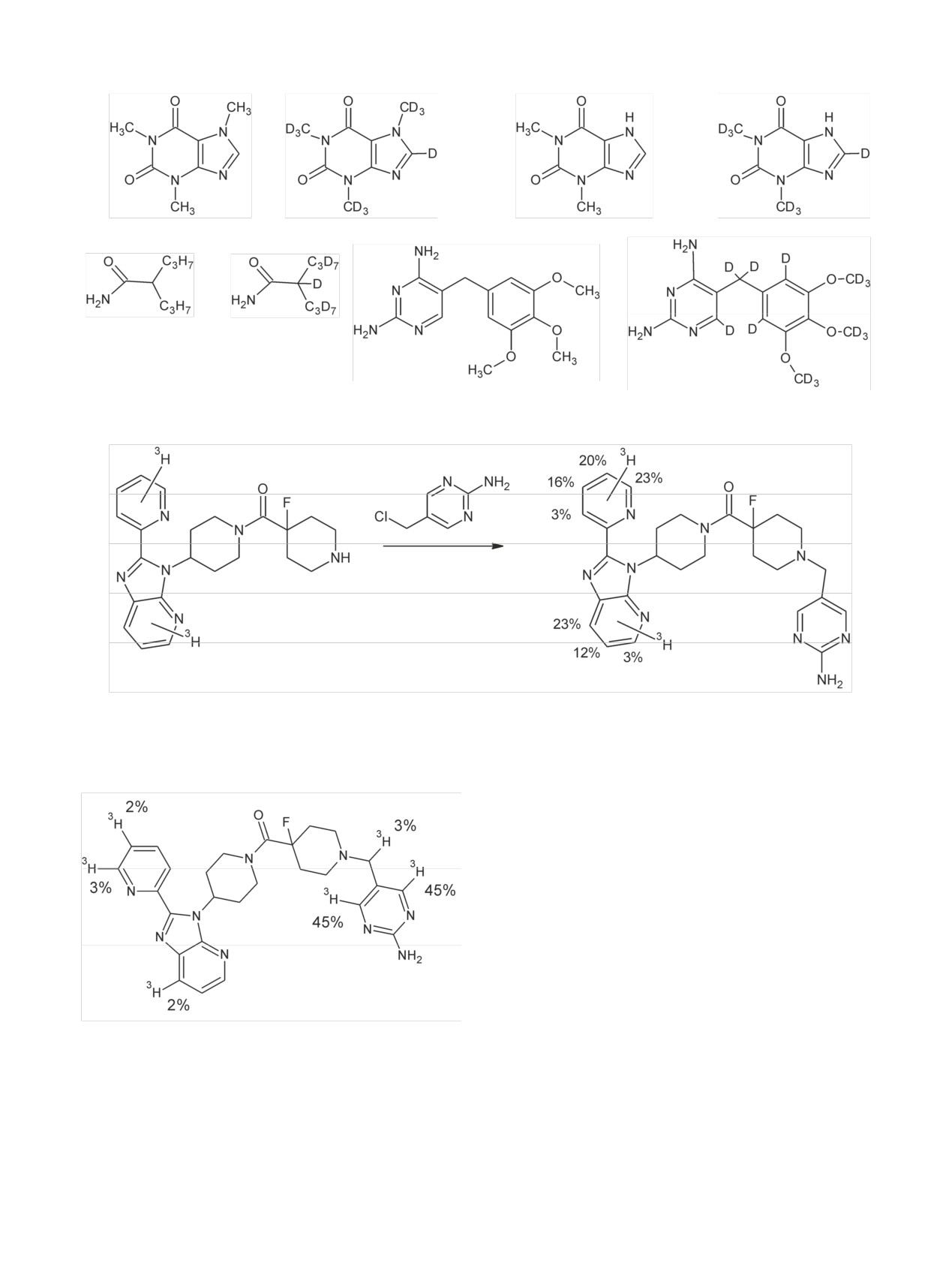
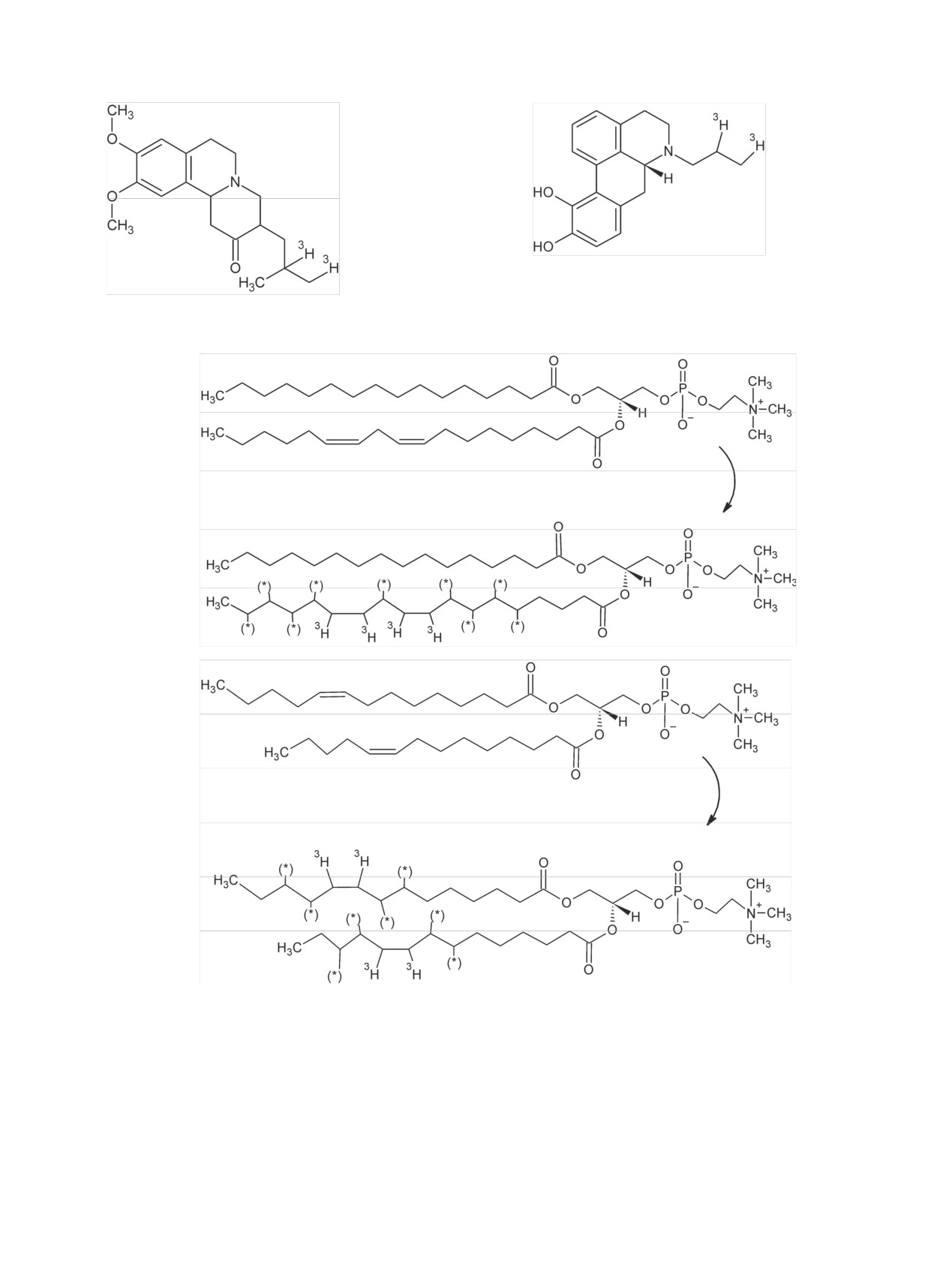
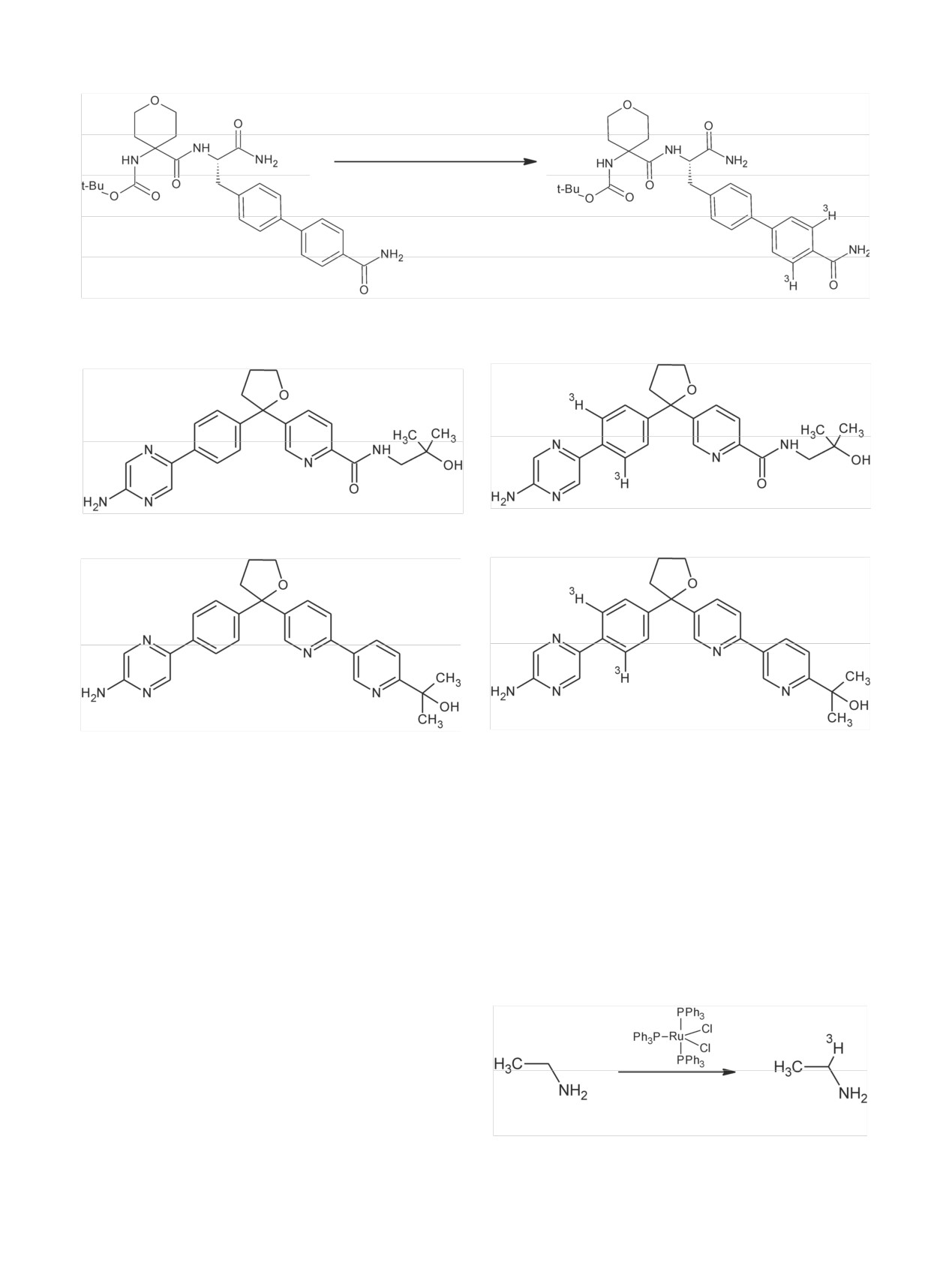
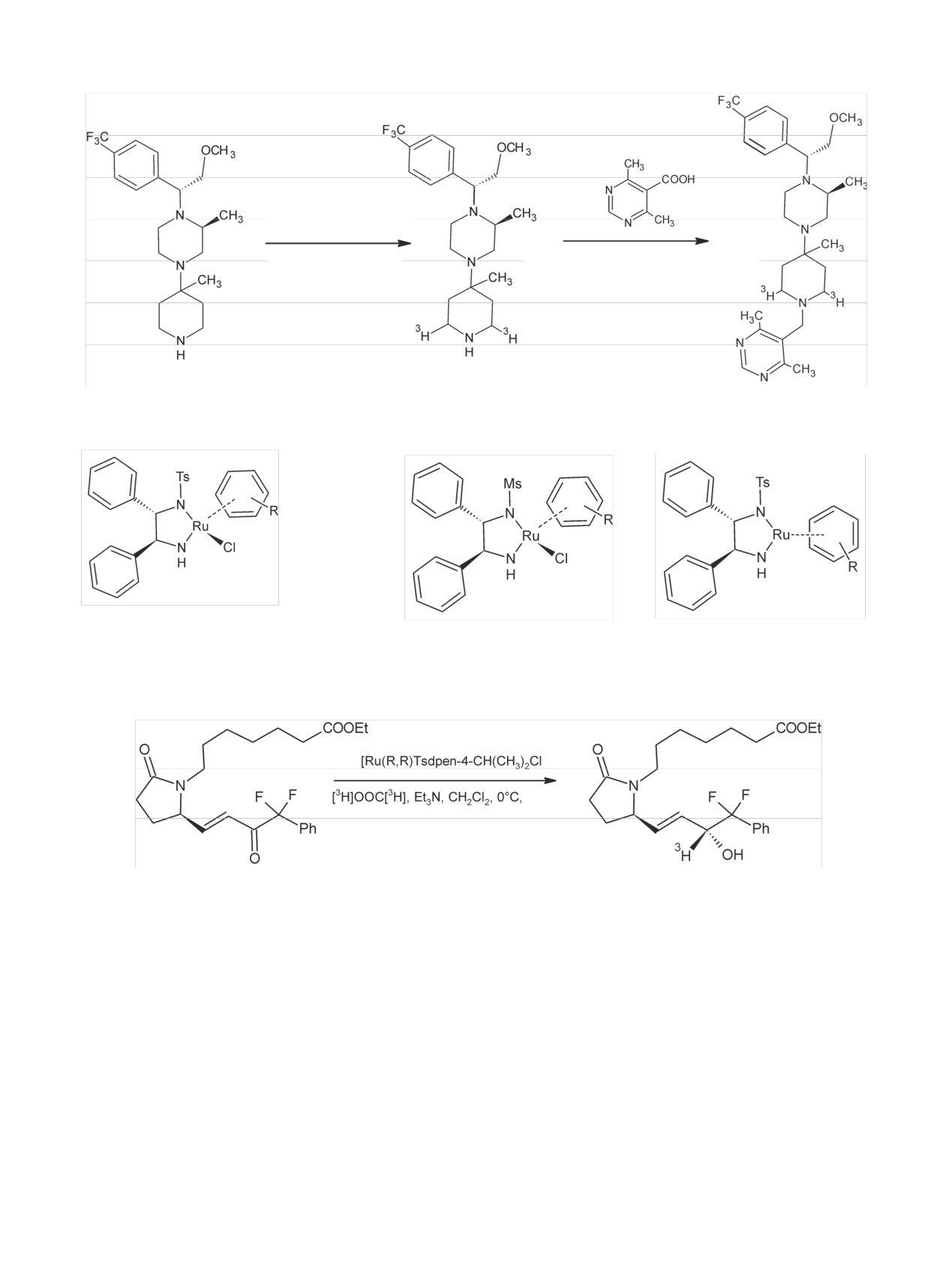
Радиохимия, 2019, т. 61, N 3, c. 183-216
183
Влияние процессов, происходящих в присутствии
металлов-катализаторов, на основные характеристики получаемых
меченных изотопами водорода органических соединений
© В. П. Шевченко*а, И. Ю. Нагаева, Н. Ф. Мясоедова
а Институт молекулярной генетики РАН, 123182, Москва, пл. Курчатова, д. 2; * e-mail: nagaev@img.ras.ru
Получена 17.04.2018, после доработки 17.04.2018, принята к публикации 17.05.2018 УДК 546.100.02.3:547.15/17
Показаны основные источники дейтерия и трития, используемые при получении меченных изотопа-
ми водорода препаратов. Рассмотрены механизмы реакций гидрирования и изотопного обмена в орга-
нических соединениях в присутствии гетерогенных и гомогенных катализаторов при использовании
газообразного трития или дейтерия, а также при использовании тритиевой или дейтериевой воды. При-
ведены примеры участия протонов растворителя при введении дейтерия и трития в органические соеди-
нения методом дегалогенирования. Затронута проблема селективного гидрирования и дегалогенирова-
ния. Особое внимание уделено изотопному обмену с дейтерием или тритием в присутствии гомогенных
иридиевых катализаторов.
Ключевые слова: гетерогенный и гомогенный катализ, иридиевые катализаторы, источники изото-
пов водорода, эффективность введения дейтерия и трития.
DOI: 10.1134/S0033831119030018
I. Введение
модействии как катализатора с изотопами водоро-
да, так и молекул органического вещества с актив-
В исследованиях с использованием изотопноза-
ными центрами катализатора. Это связано с воз-
мещенных органических соединений наиболее час-
можностью больших изотопных эффектов при вве-
то использовались дейтерированные и тритийсо-
дении метки, как правило, приводящих к сниже-
держащие биологически активные соединения [1-
нию включения дейтерия или трития в молекулы
4]. Особенно активно используются такие соедине-
препаратов.
ния для поиска кандидатов фармацевтических пре-
паратов. Изотопный обмен в этом случае наиболее
Введение изотопов водорода в органические
предпочтителен, так как не требует большой пред-
соединения с использованием газообразного дейте-
варительной работы, связанной с синтезом предше-
рия или трития можно проводить и без катализато-
ственников. Дейтерированные препараты также
ра, например, при использовании метода Вильцба-
используются как внутренние стандарты для масс-
ха. Но, использование этого метода оказалось огра-
спектрометрии [5, 6], для кинетических исследова-
ниченным, так как молярные радиоактивности по-
ний [7, 8] и для разработки новых путей реакций в
лучаемых препаратов обычно достигают не более
химическом синтезе [9].
0.1-10 мКи/ммоль [10].
В структурных формулах главное направление
Введение метки за счет изотопного обмена с
включения дейтерия или трития обозначено звез-
дейтериевой или тритиевой водой тоже можно про-
дочкой. Звездочка в скобках обозначает незначи-
водить без катализатора. Но для этого вещество
тельное включение метки в эти положения.
должно выдерживать среды с рН более 11 или ме-
нее 2 [11]. Например, так вводили метку в кампто-
I.1. Источники дейтерия и трития
тецин, который выдерживает многодневное нагре-
вание (90°С) в виде раствора в 98%-ной серной ки-
Источниками изотопов водорода обычно являет-
слоте [11].
ся газообразный дейтерий или тритий, а также дей-
териевая или тритиевая вода. Другие реагенты, со-
При нагревании до 130°С L-гистидина и N-ме-
держащие изотопы водорода, для введения дейте-
тил-L-гистидина в растворе смеси соляной кислоты
рия или трития в органические соединения в при-
и дейтериевой или тритиевой воды метка входит в
сутствии катализаторов используются реже. Неза-
ароматический фрагмент аминокислоты
(5-по-
висимо от источника изотопов водорода необходи-
ложение имидазольного кольца). При этом при ис-
мо учитывать процессы, происходящие при взаи-
пользовании тритиевой воды молярные радиоак-
184
В. П. Шевченко и др.
тивности были невелики, порядка 0.05-0.13 мКи/
вым необходимым актом каталитического процес-
ммоль [12].
са является хемосорбция реагентов на активных
центрах катализатора. Дальнейшие превращения
Если вещество выдерживает микроволновую
соединения претерпевают в хемосорбированном
обработку, то дейтерофосфорная кислота может
состоянии. Следовательно, активность и селектив-
катализировать включение этого изотопа водорода
ность катализатора должна определяться в первую
в позиции, различающиеся по реакционной актив-
очередь структурой и свойствами его активных
ности. Например, при 120°С за 60 мин дейтерий
центров. В настоящее время разработаны методы
включался при четырех углеродных атома в моле-
прямого исследования поверхности катализаторов
куле соединения, содержащего несколько аромати-
и адсорбированных соединений на молекулярном
ческих колец [13]:
уровне. Это дифракция медленных электронов, по-
зволяющая охарактеризовать состояние поверхно-
сти чистого металла или адсорбированного слоя,
электронно-спектроскопические методы: Оже-
электронная спектроскопия, рентгеновская и УФ
фотоэлектронная спектроскопия, спектроскопия
энергетических потерь электронов и др., позволяю-
щие определить химический состав поверхности,
валентность и природу химических связей адсор-
бированных молекул, а также метод EXAFS [21].
Наиболее систематические исследования были
проведены для Pt [22, 23]. Впоследствии те же вы-
воды были сделаны для Ni, Pd, Rh, Ru и других пе-
Введение метки в соединения, где возможен
реходных металлов. Авторы изучали хемосорбцию
обмен протонов на тритий в α-положениях к кето-
более 20 соединений, а также реакции гидрирова-
группе [14], происходит в более мягких условиях
ния, дегидрирования, изомеризации, гидрогенолиза
(раствор в диметилформамиде в присутствии три-
и изотопного обмена на поверхности кристаллов Pt
этиламина, 64 ч, 80°С). Таким путем получен ряд
с различными индексами Миллера [22]. При этом
меченых стероидов, однако молярная радиоактив-
было показано, что для изотопного обмена Н-2Н
ность препаратов не превышала 1.5-3.5 мКи/ммоль
лимитирующей стадией является не собственно
[14].
хемосорбция молекулы на активном центре, проис-
ходящая с энергией, близкой к нулю, а перенос мо-
При нагревании изотопный обмен с тритиевой
лекул или атомов водорода к этому активному цен-
водой проходит и в присутствии K2PtCl4 при низ-
тру и между активными центрами.
ких значениях рН [15].
Кислоты Льюиса также удобны для повышения
I.3. Введение изотопов водорода в органические
эффективности изотопного обмена с тритиевой
соединения при использовании дейтериевой
водой [16, 17]. Смесь BF3/Et2O/3Н2О, BF3/3H3PO4
или тритиевой воды
позволяет включать в ароматические соединения
40-60% трития в пересчете на молярную радиоак-
Проводить изотопный обмен с дейтериевой или
тивность тритиевой воды [17-20].
тритиевой водой можно при использовании как
Но значительно повысить эффективность вклю-
гомогенных, так и гетерогенных катализаторов.
чения изотопов водорода в молекулы органических
Значительно повысить молярную радиоактивность
соединений можно при использовании катализато-
меченых соединений удалось, получая тритиевую
ров на основе переходных металлов.
воду in situ восстановлением оксида палладия или
платины газообразным тритием. Такая вода имела
I.2. Введение изотопов водорода в органические
максимально возможную радиоактивность, и ее
соединения при использовании газообразного
использовали в виде растворов в апротонных рас-
дейтерия или трития
творителях для предотвращения саморадиолиза
3Н2О и сведения к минимуму разрушения искомого
Реакции, связанные с обработкой газообразным
продукта за счет радиолиза. Для работы со 100%-
водородом органических соединений, являются
ной тритиевой водой обычно применяют гетеро-
одними из наиболее изученных каталитических
генные катализаторы, которые устойчивы к радио-
реакций. В свете современных представлений пер-
лизу и тем самым не создают дополнительных
Влияние процессов, происходящих в присутствии металлов-катализаторов
185
трудностей при выделении меченых препаратов из
При использовании этих производных дейтери-
реакционных смесей [24-32].
да или тритида кремния (R3Si3H) [39] удалось вос-
станавливать спирты, превращать нитрилы в альде-
I.4. Другие источники изотопов водорода,
гиды, восстанавливать тройные связи до двойных
используемые для синтеза меченых
(схема 2).
органических соединений
При использовании газообразного трития и три-
тиевой воды получают большинство других источ-
ников изотопов водорода. Например, использова-
ние смеси гептафтормасляного ангидрида и три-
тиевой воды в органическом растворителе позволя-
ет проводить реакции изотопного обмена с гептаф-
тормасляной кислотой без разбавлении трития про-
тием. При использовании 100%-ной 3Н2О из мечен-
ной тритием гептафтормасляной кислоты получали
высокомеченные препараты, содержащие фенолы,
амины, серу [33-35]:
Молярная радиоактивность 13-18 Ки/ммоль
Схема 2.
При использовании тритиевой воды можно
Меченный тритием этиламин можно пригото-
синтезировать меченый диазометан [36, 37], а так-
вить, исходя из N-винилфталимида [40]:
же уксусную и муравьиную кислоты [38] с моляр-
ной радиоактивностью порядка
20 Ки/ммоль,
10 Ки/ммоль и
80 мКи/ммоль соответственно
(схема 1).
При обработке R3SiCl дейтеридом или тритидом
лития (ТГФ, 23°С, 30 мин) можно получить R3Si2H
или R3Si3H.
3Н2, 10% Pd/C, 23°С, 2 ч. Отношение метки в метильной
группе к метиленовой 5 : 1.
3H2O, Bu4NF
ТГФ
HCl (6 моль/л), этанол-вода (1 : 1), 12 ч, при кипении.
·
3H2O (90.1 мКи/ммоль), ТГФ; 180°С, 3 сут
Молярная радиоактивность 48 Ки/ммоль, 3Н0 17%, 3Н1
Схема 1.
23%, 3Н2 26%, 3Н3 24%, 3Н4 9%.
186
В. П. Шевченко и др.
Для введения трития используются и другие
5 мин до нескольких часов. Реакцией C3H3MgI с
реагенты
[3HCHO,
3HC3HO,
3HCON(СН3)2,
кетогруппой метку вводили в производные 5,7-
3HCOOCOСН3, C3H3NН2, N-тритиоацетоксифтал-
прегнадиена, витамина D3 и 9-цис-ретиноевой ки-
имид, 3HN=N3H] [41].
слоты [41].
В качестве источников изотопов водорода ис-
II. Введение изотопов водорода в органические
пользуют также [41] комплексные тритиды метал-
соединения в присутствии гетерогенных
лов и меченый иодистый метил. Обычно использу-
катализаторов
ют боротритид натрия и алюмотритид лития. Дан
ные препараты получают выдерживанием соответ-
II.1. Механизм реакций гидрирования и изотопного
ствующего борогидрида (лития, натрия, калия) в
обмена в органических соединениях в присутствии
атмосфере трития при 270-500°С в течение 4-6 ч
гетерогенных катализаторов при использовании
или реакцией бутиллития с газообразным тритием
газообразного трития или дейтерия
в присутствии N,N,N',N'-тетраметилэтилендиамина,
Как уже отмечалось выше, гидрирование, изо-
в результате которой образуется тритид лития, из
топный обмен и другие процессы, которые имеют
которого можно синтезировать целый набор ком-
место при обработке органических соединений га-
плексных тритидов металлов. Например, из него
зообразным тритием в присутствии переходных
получен три-н-бутилстаннат-тритид, который явля-
металлов, происходят на активных центрах катали-
ется прекрасным реагентом для дегалогенирования
затора [22]. Способность хемосорбированных мо-
[39].
лекул к дальнейшим превращениям определяется
Восстановлением соответствующих предшест-
типом и прочностью их связей с катализатором.
венников (содержащих альдегидные, кето-, карбок-
При этом одна и та же молекула на одних и тех же
сигруппы и др.) перечисленными выше тритидами
центрах адсорбции может образовывать несколько
были синтезированы:
(2E,6E)-3,7,11-триметил-
различных адсорбированных форм. Так, при ад-
2,6,10-[10-3H]додекатриен-1-ол
([10-3H]фарнезол);
сорбции этилена на поверхности платины иденти-
(2E,6E)-3,7,11-триметил-2,6,10-[10-3H]додекатри-
фицированы частицы более 10 видов [42], в том
ен-1-аль ([10-3H]фарнезаль); диэтилацеталь (2E)-4-
числе слабосвязанные p-комплексы, ковалентно-
гидрокси[4-3H]нонен-1-аля;
2-винил[1,1,3-3H]ди-
связанные частицы с линейной (одноцентровой) и
гидросфингозин-1-фосфат; гидрохлорид 3-(S)-ами-
мостиковой (двуцентровой) формами адсорбции,
но-4-гидрокси-5-[5,5,6,6-3H]тридецил-1-фосфоние-
образованные как по ассоциативному, так и по дис-
вой кислоты (фосфонатный аналог сфинганин-1-
социативному механизмам. Для бензола число та-
фосфата); а также ряд 3H-меченых стероидов, вита-
ких форм значительно больше [42, 43], появляются
минов, производных инозитов. Молярная радиоак-
и многоцентровые формы адсорбции. Различные
тивность препаратов при использовании боротри-
формы имеют разную энергию связи с катализато-
тида натрия составляла, как правило, пятую часть
ром и могут превращаться друг в друга. При этом
от молярной радиоактивности боротритида натрия.
слабосвязанные формы типа p-комплексов, перехо-
Реакцию обычно вели в этанолсодержащих раство-
дящие затем в линейные формы, всегда предшест-
рителях в течение 0.5-72 ч при 0 или 20°С. Затем
вуют более сильносвязанным. При этом не все ад-
избыток боротритида разлагали минеральной ки-
сорбированные формы участвуют в данной катали-
слотой и продукт очищали хроматографией.
тической реакции, требуется оптимальная энергия
Синтез меченого иодистого метила проводили
связи с катализатором [44] (основа так называемо-
реакцией HI с соответствующим предшественни-
го
«принципа энергетического соответствия»,
ком, который чаще всего получали восстановлени-
впервые четко сформулированного Баландиным
ем СО2 алюмотритидом лития или дегалогенирова-
[45]).
нием газообразным тритием 4-Ph-C6H4COOCH2Cl,
Очевидно, что вероятность образования той или
C6H5SCH2Cl, 4-Ph-C6H4OCCl3. При использовании
иной адсорбированной формы даже в близких по
меченого иодистого метила получали другие мети-
строению соединениях (например, производных
лирующие агенты (метилтозилат, метилнозилат,
бензодиоксана) будет существенно влиять на рас-
C3H3MgI). Методики, связанные с использованием
пределение изотопа водорода в конечном меченом
С3Н3I и его производных, хорошо известны [41].
продукте [46].
Реакции обычно проводят при 23-60°С в полярных
растворителях (метанол, ацетон, ДМФА, ДМСО и
К настоящему времени накоплен большой экс-
др.) в присутствии оснований (Et3N, i-Pr2NEt, Ag2O,
периментальный и теоретический материал по ад-
K2CO3, NaОН, NaHCO3 и др.) в течение времени от
сорбции водорода на различных переходных ме-
Влияние процессов, происходящих в присутствии металлов-катализаторов
187
таллах
[47-50]. Так, по данным квантово-хи-
разом, принимать значения 1, 2 и 3. Различие меж-
мических расчетов, энергия связей водород-металл
ду реакционной способностью этих центров оказы-
также определяется строением активного центра
вает большое влияние на процесс гидрирования,
адсорбции и связана с различной степенью участия
дегалогенирования, селективного гидрирования и
d- и sp-состояний поверхностных атомов металла в
дегалогенирования, а также на параллельно иду-
образовании связи водород-металл [51, 52].
щие процессы изомеризации (миграция двойных
связей, цис-транс-изомеризация) и изотопного об-
Растворение молекулярного водорода в метал-
мена.
лах является многостадийным процессом, вклю-
чающим адсорбцию и диссоциацию водорода [53].
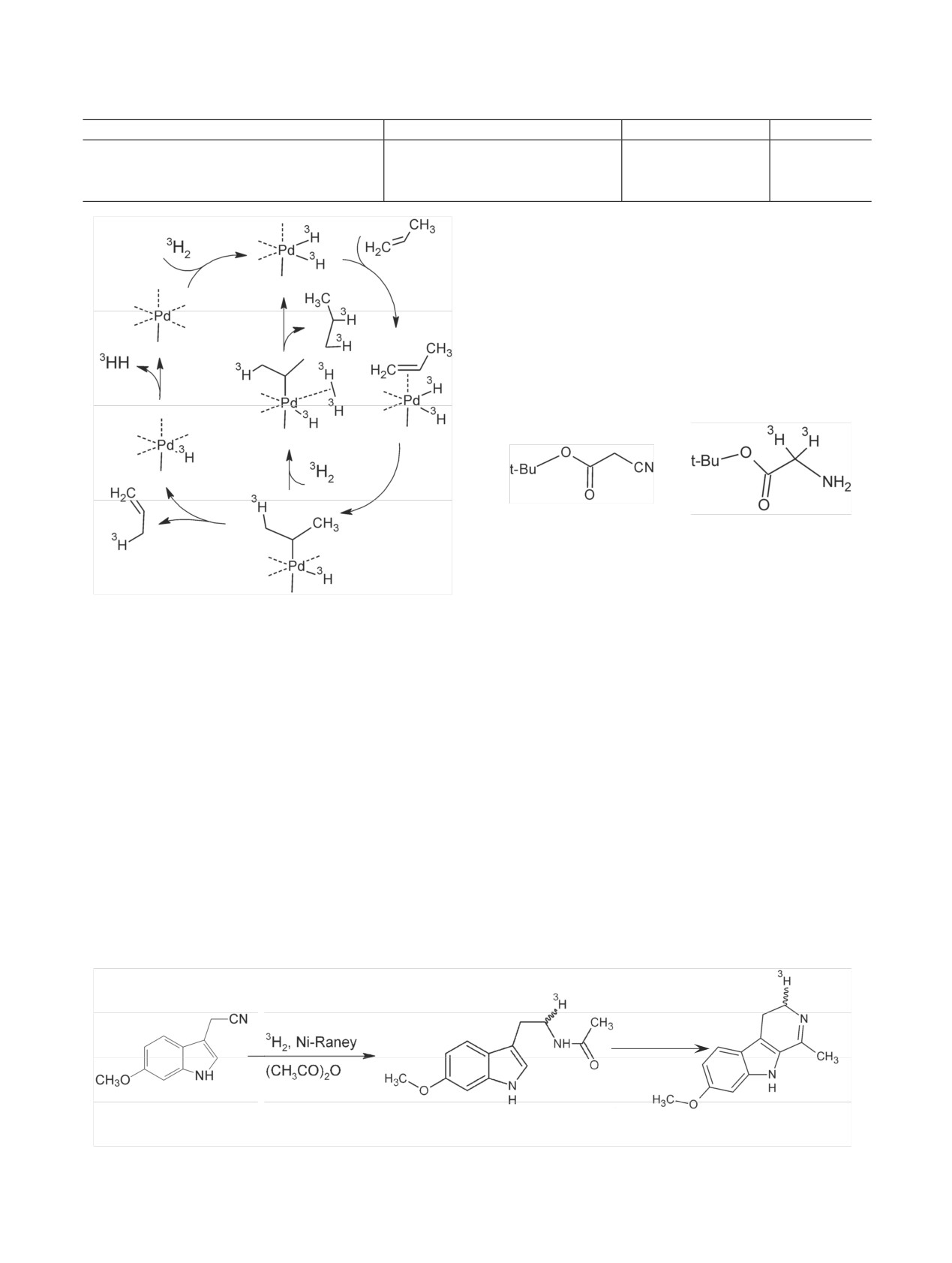
Согласно координационной модели, при взаи-
Если рассматривать процессы, которые происходят
модействии молекулы ненасыщенного соединения
при взаимодействии изотопов водорода с активны-
с активным центром катализатора происходит сме-
ми центрами катализатора, в сильно упрощенном
щение электронной плотности в системе углерод-
виде и считать, что адсорбционные центры отлича-
металл, при этом возникает возможность перехода
ются только степенью координационной ненасы-
водорода от углерода к металлу и наоборот (схе-
щенности, то активные центры катализатора мож-
мы 3-10).
но схематично представить структурами М, M' и
При адсорбции ненасыщенных соединений типа
M'' [54-57]:
этилена, на переходных металлах могут образовы-
ваться промежуточные этилиденовые комплексы
общей структуры Ni=CH-CH2R. Результаты расче-
та позволяют предположить, что лимитирующей
стадией, по-видимому, является поворот группы
СН2. При этом оказалось, что присутствие связан-
ного водорода снижает энергетический барьер по-
ворота этой группы с 3.16 до 0.36 эВ. Возможность
При этом максимальное число групп, которое
образования двойной связи между алкеном и ато-
активный центр может присоединить, определяется
мом металла объясняет распределение метки и воз-
его положением в решетке, является дополнением
можность включения более двух атомов трития
до шести (для октаэдрического окружения боль-
при гидрировании одной двойной связи в образо-
шинства платиновых металлов) и может, таким об-
вавшемся алкане (схема 9) (табл. 1).
Схема 3. Включение метки при диссоциативном механизме адсорбции (через π-комплекс).
Схема 4. Включение метки при диссоциативном механизме адсорбции (через σ-комплекс).
Схема 5. Включение метки при гидрировании двойных связей.
188
В. П. Шевченко и др.
Таблица 1. Введение тритиевой метки гидрированием газообразным тритием ненасыщенных соединений [59]
Исходное соединение
Условия реакции
МР,а Ки/ммоль
5% Pd/BaSO4, 1 ч, бензол
84.8
То же, диоксан
45.9
То же, этилацетат
41.6
То же, хлороформ
52.6
Метилундец-10-енат
То же, гептан
43.2
То же, метанол
26.2
10% Pd/C, 1 ч, бензол
69.7
5% PdO/Al2O3, 1 ч, бензол
65.3
Пикротоксин
10% Pd/BaSO4, 3 ч, этилацетат
37.8
Хлорид диметилаллил-3-хлорбутиламмония
5% Pd/BaSO4, 1 ч, этанол
13.5
2,2-Ди(трифторметил)-3,3-дицианобициклогепт[2.2.1]ен-5
5% Pd/BaSO4, 1.5 ч, этилацетат
25.1
м,м'-Ди-трет-бутил-п-кумаровая кислота
5% Pd/BaSO4, 2 ч, этилацетат
46.2
а Здесь и далее: МР - молярная радиоактивность.
Схема 6. Включение метки в процессе цис-транс-изомеризации двойных связей.
Схема 7. Включение метки при миграции двойных связей.
Схема 8. Включение метки в терминальные двойные связи.
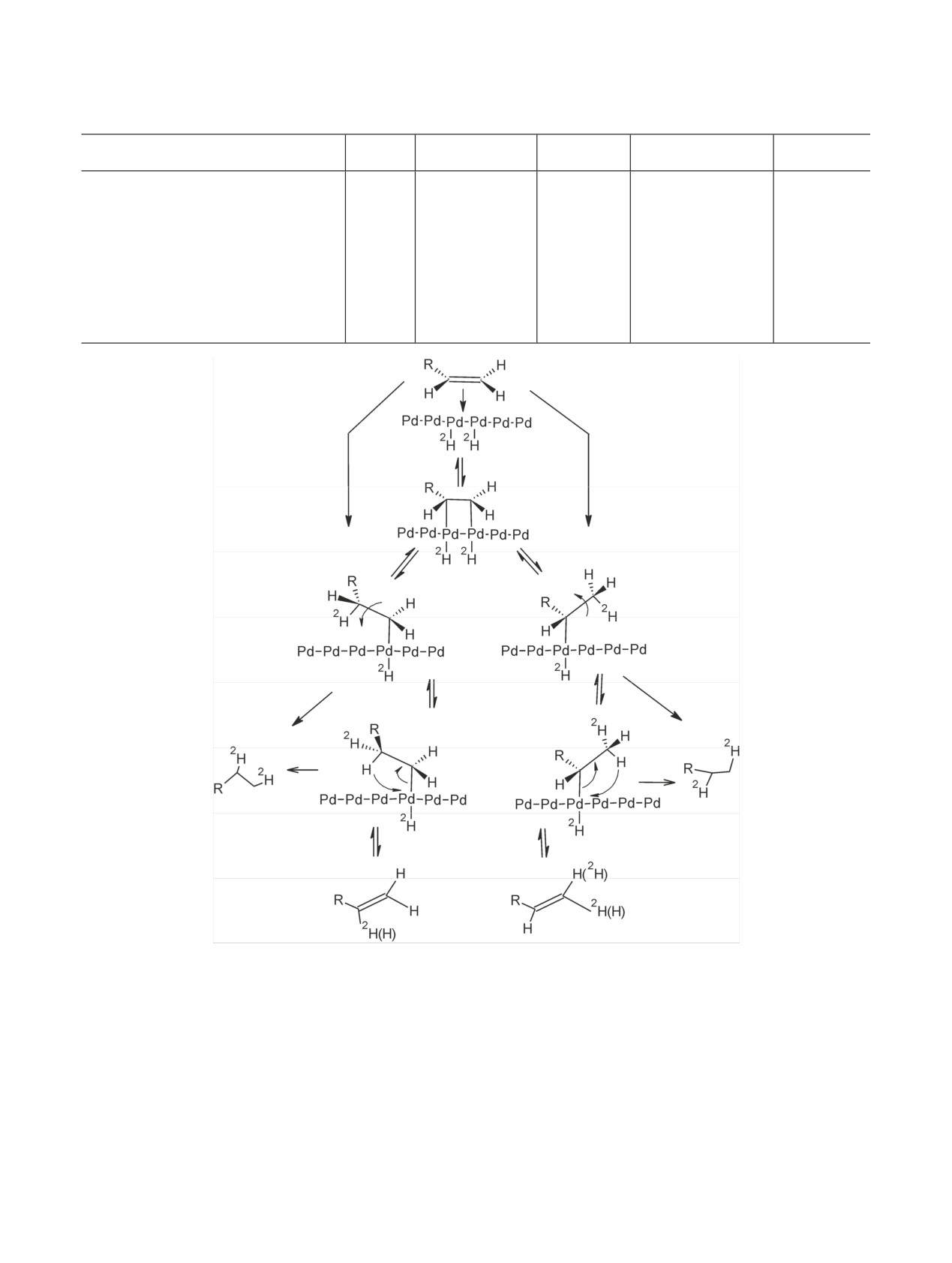
Таким образом, согласно приведенной схеме, за
соединение, содержащее три и четыре атома изото-
счет отщепления двух α-протонов образуется ком-
па. Например, при гидрировании дейтерием терми-
плекс Pd=C-С3HНR. Если отщепляется и β-протон,
нальной двойной связи в фузикокцине оказалось,
то образуется комплекс Pd=C=C3HR. При гидриро-
что образуется смесь изотопомеров, содержащая
вании этих комплексов образуется насыщенное
22% дигидрофузикокцина с тремя атомами D и
Влияние процессов, происходящих в присутствии металлов-катализаторов
189
Схема 9. Включение метки при образовании кратных связей металл-углерод.
Включение метки в аллильные положения
Включение метки через π-аллильный комплекс
Схема 10. Включение метки на двуядерном активном центре.
34% с четырьмя атомами D [58].
процессы, связанные с включением изотопов водо-
рода, интерпретируются как взаимодействие орга-
Сопоставление длин связей C-C, связей Pd-Pd в
нического соединения с несколькими атомами ме-
кристалле, связей H-C, H-Pd, Pd-C также свиде-
талла-катализатора (схема 11) [62-65].
тельствует в пользу того, что гидрирование, мигра-
ция и изомеризация двойных связей, а также изо-
Как видно из приведенной схемы, кроме гидри-
топный обмен (схемы 3-8) происходят на единич-
рования возможно образование продуктов, содер-
ном активном центре, а включение метки в аллиль-
жащих одновременно и дейтерий, и двойные связи.
ные положения при образовании комплексов π-
Если образование связи C-Pd происходит за счет
аллильного типа определяется кооперативными
отщепления терминального протона, то изотопный
взаимодействиями на поверхности кристаллов ме-
обмен фиксируется при нетерминальном углерод-
таллов-катализаторов. Этими обстоятельствами
можно объяснить, почему при миграции терми-
Таблица 2. Анализ реакционных смесей, образовавших-
нальной двойной связи в метиловом эфире ундец-
ся при гидрировании двойной связи в метилундец-10-
енате на 5% Pd/BaSO4 в присутствии этилацетата (Э),
10-еновой кислоты образуется в основном цис-
диоксана (Д), бензола (Б)
изомер (схема 7) (табл. 2), а при миграции нетер-
минальной двойной связи в молекулах метиловых
Продукты
Время,
Содержание продукта, %
эфиров ненасыщенных жирных кислот образуется
гидрирования
мин
Э
Д
Б
транс-изомер (схема 10, табл. 3), при этом метка в
10
44
46
48
основном включается в аллильные положения и
Метилундеканат
30
84
76
69
при двойных связях.
60
100
93
82
Возможность гидрирования и изомеризация
10
14
13
13
двойных связей, а также изотопного обмена на еди-
цис-изо-Метил-ун-
ничном активном центре показана и при использо-
30
0
3
5
деценат
вании гомогенных катализаторов [60, 61]. Более
60
0
0
1
подробные сведения об этом представлены в разде-
10
2
5
0
транс-изо-Метил-
ле III данного обзора.
30
10
9
6
ундеценат
В ряде работ предлагаются схемы, в которых
60
0
5
8
190
В. П. Шевченко и др.
Таблица 3. Распределение метки 3H (%) во фрагментах молекул жирных кислот и простагландинов (введение трития
в присутствии катализатора Линдлара) [59]
Двойная
Карбоксильная
Алкильная
Циклопентановое
Малоновая
Соединение
связь
часть
часть
кольцо
кислота
Метиларахидонат
14
-
47
-
39
Арахидоновая кислота
27
12
28
-
33
PGE2
30
22
30
18
-
транс-Изомер PGE2
54
12
23
11
-
транс-Изомер PGF1α
14
-
53
33
-
Метилолеат
45
-
55
-
-
Олеиновая кислота
54
23
23
-
-
транс-Изомер олеиновой кислоты
64
13
23
-
-
Схема 11. Включение дейтерия в терминальную двойную связь.
ном атоме, а если за счет отщепления нетерминаль-
гласно схеме 3 связано с включением метки при
ного протона, то при терминальном углеродном
диссоциативном механизме адсорбции.
атоме. В последнем случае дейтерий включается в
В ряде случаев при проведении реакции в рас-
транс-положение относительно R. Таким образом,
творе при комнатной температуре (введение три-
реализация данной схемы приводит к образованию
тия в ароматические соединения или в соединения,
в основном только определенно меченого продук-
где возможна кето-енольная таутомерия), возника-
та, что соответствует процессу, описанному в схе-
ет возможность получения высокомеченных соеди-
ме 6. Включение дейтерия в цис-положения отно-
нений даже методом изотопного обмена. Напри-
сительно R не рассматривается в схеме 11, но со-
мер, этим методом получена [1-3Н]глюкоза с мо-
Влияние процессов, происходящих в присутствии металлов-катализаторов
191
Таблица 4. Введение тритиевой метки гетерогенным каталитическим изотопным обменом [59, 69-74]
Соединение
Условия реакции
Выход, %
МР, Ки/ммоль
Метиловый эфир PGF2α
3Н2, катализатор Линдлара, диоксан, 23°С, 1.5 ч
75
0.05-0.07
3Н2, 5% PdO/Al2O3, диоксан, 23°С, 1.5 ч, 150 гПа
30
1.48-1.62
PGF2α
3Н
2, LaNi5, LaNi4Cr, LaNi3Cu2, диоксан, 23°С, 22 ч, 400 гПа
50-60
0.02-0.03
Элеутерозид В
3Н2, 5% Cu/CaCO3, диоксан, 23°С, 4 ч, 400 гПа
40-45
0.18-0.19
Полипренилфосфат
3Н2, 5% Cu/CaCO3, диоксан, 23°С, 4 ч, 400 гПа
30-35
0.005-0.008
6-Кетопальмитиновая кислота
5% Pt/C, 160°C, 15 мин
32
750.60
Гексадекан
5% Pt/C, 140°C, 15 мин
80
472.50
Трихостатин
3Н2О, 5% Pd/BaSO4, диоксан-Et3N, 140°С, 30 мин
25-30
1.80
2-Амино-4-[β-гидроксиэтил-
3Н2О, 115°С, 25 мин, ДМФА
46
1.80
амино]анизол
Паргилин
3Н2О, 5% Pd/BaSO4, диоксан-Et3N, 23°С, 12 ч
5
0.54
Дегидроабиетовая кислота
3H2O (90 мКи/ммоль), PdО
0.013
лярной радиоактивностью 24 Ки/ммоль [10], пури-
тора, с носителем и субстратом не противоречат
ны и производные имидазолов с молярной радио-
исследованиям, связанным с изучением эффектов
активностью 30-40 Ки/ммоль [66, 67]. Есть работы
туннелирования при проведении многих химиче-
[68], где описывается получение меченых аромати-
ских реакций [78, 79]. Другими словами, спилловер
ческих соединений с молярными радиоактивностя-
водорода возникает в результате спилловера элек-
ми 22-74 Ки/ммоль и алифатических альдегидов с
тронов.
молярными радиоактивностями до 20 Ки/ммоль.
Так, в работе [80] показана возможность тунне-
Однако эти сведения касаются лишь соединений,
лирования электрона через различные изоляторы.
имеющих специфическую структуру. Как правило,
Общий вывод, который был сделан, - электроны
изотопный обмен между изотопами водорода и
способны за счет туннельного эффекта преодоле-
большинством органических соединений при ком-
вать значительные для микромира расстояния при
натной температуре с использованием растворите-
миграции по неорганическим носителям. Данные
лей не дает меченые препараты с молярной радио-
этой работы показывают, что за счет туннельных
активностью, которая необходима для изучения
эффектов образуется градиент электронов в массе
рецепции, и может применяться только для получе-
изолятора. Из этих экспериментальных данных,
ния маркеров (табл. 4).
следует, что часть электронов, образовавшихся на
Препараты с высокой молярной радиоактивно-
активных центрах катализатора, попадает на носи-
стью можно получать при использовании методик,
тель и сольватируется на атомах носителя. Именно
исключающих применение растворителей, что по-
это обстоятельство делает возможным миграцию
зволяет проводить реакции при высоких темпера-
катионов водорода с металла на носитель. Когда на
турах (табл. 4).
поверхности носителя катионы водорода и элек-
троны, попадающие на поверхность носителя за
Предложены разные механизмы осуществления
счет туннельных эффектов, образуют ионные пары
подобных реакций [75]. В основном они предпола-
(Н+,ē), которые нейтрализуют отрицательный заряд
гают перетекание с металла-катализатора активи-
на носителе, становится возможным перемещение
рованных частиц изотопов водорода на носитель и
новой порции электронов с активных центров ката-
реакции их с молекулами вещества, адсорбирован-
лизатора на носитель.
ного на поверхности носителя. Есть работы, в кото-
рых авторы предполагают, что активированные
В результате активированные на металлах-ка-
частицы водорода могут переходить на носитель
тализаторах частицы образуют сольватированные
даже через газовую фазу [75]. При этом также су-
на поверхности носителя кластеры с разным содер-
ществует мнение, что спилловер водорода возмо-
жанием ионных пар изотопов водорода и электро-
жен только благодаря дефектам на поверхности
нов. Когда поток электронов и активированных
катализатора и наличию примесей [76, 77]. По-
частиц трития достигает вещества, нанесенного на
видимому, последний вывод не учитывает возмож-
носитель, кластеры из сольватированных катионов
ности перетекания электронов с металла-катали-
водорода и электронов начинают образовываться и
затора на носитель, например, за счет туннельных
в пуле органического соединения. Разная способ-
эффектов. Возможность взаимодействия электро-
ность сольватировать катионы водорода и электро-
нов, генерируемых активными центрами катализа-
ны даже у близких по строению соединений может
192
В. П. Шевченко и др.
Таблица 5. Введение тритиевой метки методом изотопного обмена с тритиевой водой [27,70]
МР,
Выход,
Соединение
Условия реакции
Ки/ммоль
%
Тиазофурин
PdO, 5% PdO/Al2O3, 0.5 ч, 170°C, диоксан-Et3N (10 : 1)
8.1
35
Алпразолам
PdO, 5% PdO/Al2O3, 1 ч, 180°C, диоксан-Et3N (10 : 1)
27.2
20
Залеплон
PdO, 5% PdO/Al2O3, 0.7 ч, 180°C, диоксан-Et3N (9 : 1)
18.4
45
Метил-(E)-2-[6-(цианофенокси)пирими-
PdO, 23°C, 20 ч, диоксан-Et3N (9 : 1)
4.6
19
дин-4-илокси]фенил-3-метоксиакрилат
Ципрофлоксацин
PdO, 5% PdO/Al2O3, 0.5 ч, 150°C, диоксан-Et3N (9 : 1)
35.1
7
-
-
Схема 12. Включение метки на катализаторе, не обработанном газообразным тритием.
быть причиной существенных различий в эффек-
ционной ампуле помимо тритиевой воды, будет
тивности включения изотопов водорода в эти со-
содержаться катализатор, который в результате
единения.
спилловера водорода будет содержать активиро-
ванный тритий. После переноса в ампулу раствора
II.2. Механизм введения изотопов водорода
вещества в апротонном растворителе, в который
в органические соединения в присутствии
обычно добавляют Et3N [14], NaOCH3 [81], бутил-
гетерогенных катализаторов за счет изотопного
литий [82-84], DBU или 15%-ный KOH [85], ее за-
обмена при использовании тритиевой
паивают и нагревают до оптимальной для каждого
или дейтериевой воды
соединения температуры в течение необходимого
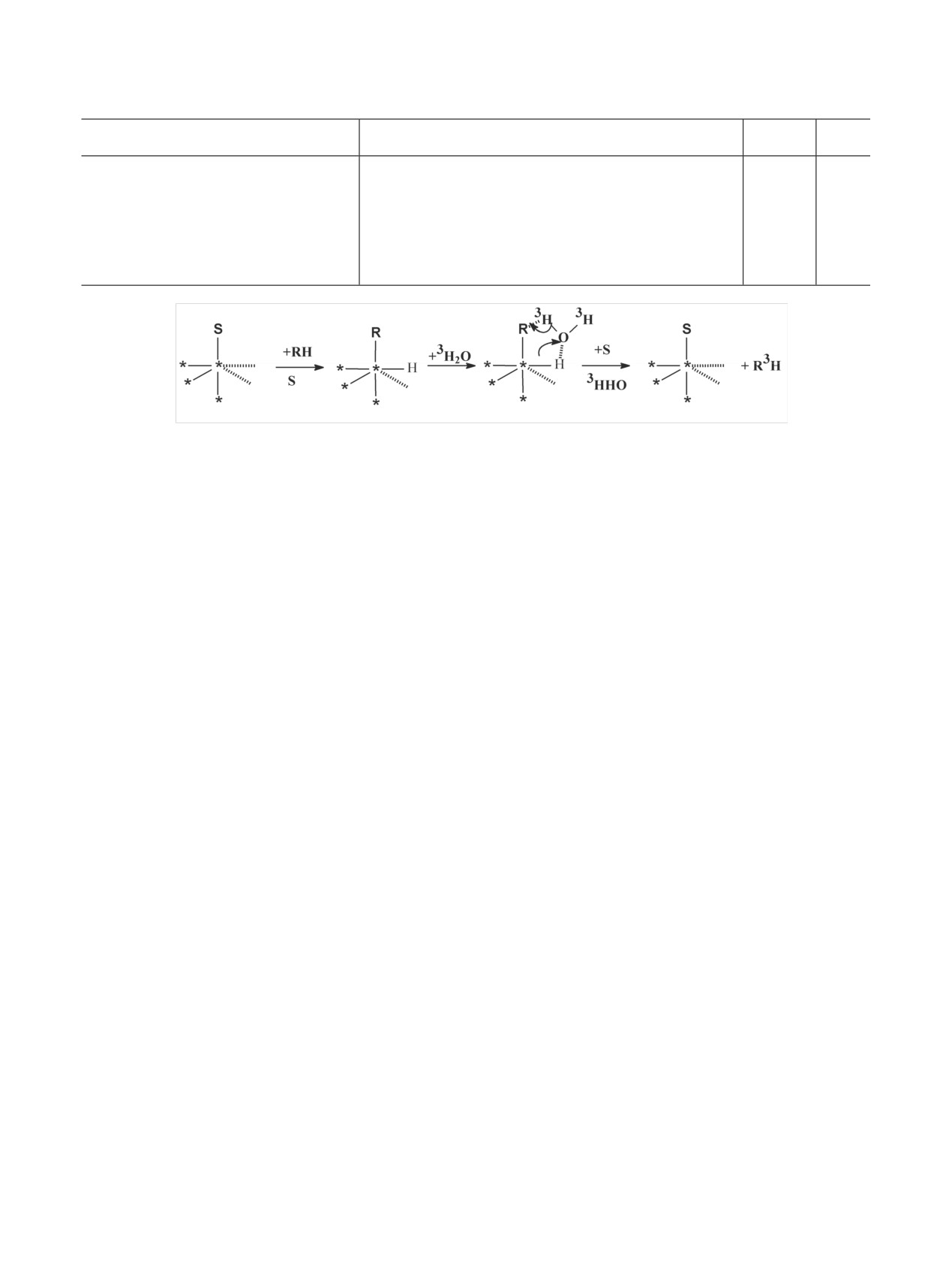
При использовании гетерогенных катализаторов
времени (табл. 5). Если вещество выдерживает эти
(схемы 3, 4) (табл. 4) эффективность изотопного
условия, то, контролируя изменение содержания
обмена органического соединения с тритиевой или
изотопа водорода от времени (например, по инте-
дейтериевой водой при использовании традицион-
гральному сигналу ЯМР), можно определить опти-
ной методики (перемешивание при комнатной тем-
мальное время реакции [86].
пературе диоксанового раствора вещества с три-
Причины повышения эффективности изотопно-
тиевой водой в присутствии катализатора и триэти-
го обмена при использовании катализаторов, со-
ламина) примерно такая же, как при использовании
держащих активированные частицы изотопов водо-
газообразных изотопов водорода (схема 12):
рода, можно объяснить появлением на поверхности
По-видимому, это связано с тем, что при ис-
катализатора кислотных центров [3H+(3H2O)n], где
пользовании гетерогенных катализаторов первая
n - число молекул воды в этом центре [87]. Кванто-
стадия процесса введения трития совпадает с пер-
во-химические расчеты систем, где участие в изо-
вой стадией включения этого изотопа водорода в
топном обмене принимают протонированные акти-
случае, когда источником метки является газооб-
вированным водородом водные кластеры, находя-
разный тритий, т.е. на первой стадии реализуется
щиеся на поверхности катализатора, были проведе-
диссоциативный механизм адсорбции вещества,
ны для водных кластеров, содержащих от одной до
при котором за счет смещения электронной плот-
трех молекул воды [87]. Расчеты показали, что при
ности в системе углерод-металл облегчается пере-
увеличении размера водного кластера энергия от-
ход протия от углерода к металлу.
рыва протона значительно увеличивается. В ре-
Эффективность изотопного обмена можно по-
зультате этого энергия комплексообразования суб-
высить, проводя реакцию при температурах 100-
страта при взаимодействии с протонированным
200°С со 100%-ной 3Н2О, которую получают вос-
водным кластером [3H+(3H2O)n] понижается в ряду
становлением PdO в атмосфере газообразного три-
n = 1, 2, 3 и приблизительно линейно зависит от
тия при использовании катализатора, нанесенного
энергии отрыва протона от соответствующих вод-
на неорганическом носителе. В результате в реак-
ных кластеров.
Влияние процессов, происходящих в присутствии металлов-катализаторов
193
5%
Схема 13. Изотопный обмен с тритиевой водой на катализаторе, обработанном газообразным тритием.
Из приведенных расчетов следует, что в зависи-
тритиевой водой должна повыситься. Для проверки
мости от силы кислотных центров меняется и энер-
этого вывода при изотопном обмене с дейтериевой
гия комплексообразования, что сильно влияет на
водой использовали газообразный протий, участие
эффективность изотопного обмена. Таким образом,
которого в обменных реакциях могло привести
повышение концентрации тритиевой воды в рас-
только к уменьшению включения дейтерия. Полу-
творе не только приводит к увеличению образова-
ченные данные полностью подтвердили выводы,
ния продуктов разложения за счет радиолиза, но и
которые следовали из квантово-химических расче-
уменьшает эффективность изотопного обмена с
тов. Под воздействием газообразного протия уве-
молекулами органического соединения. Схемати-
личилась вероятность изотопного обмена между
чески изотопный обмен в таких условиях можно
дейтериевой водой и органическими соединения-
представить схемой 13.
ми.
Этот модифицированный метод введения метки
При использовании этой методики (изотопный
оказался пригодным для получения высоконенасы-
обмен препарата с дейтериевой водой в атмосфере
щенных соединений с необходимой для многих
газообразного протия) получен целый ряд органи-
биологических экспериментов молярной радиоак-
ческих соединений [89-93].
тивностью (табл. 6).
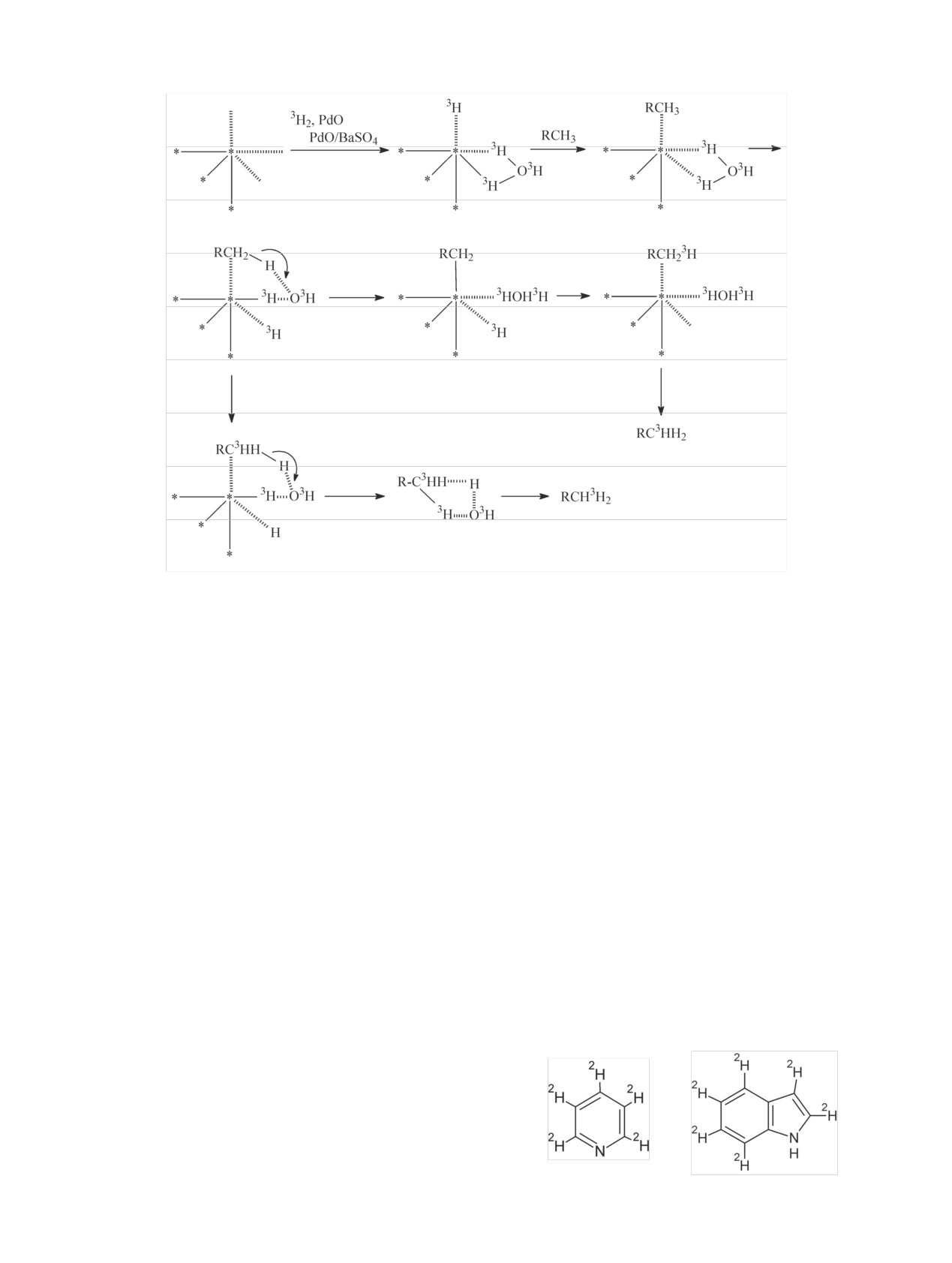
Например, при использовании 10% Pd/C и 5%
Известно, что молекулярный водород может
Rh/C и 2Н2O в атмосфере протия при 110-180°C в
вытеснять хемосорбированные органические моле-
течение 12-24 ч дейтерий включался и в цикличе-
кулы, а, следовательно, и молекулы растворителя и
ские, и в линейные алканы [89], а также в аромати-
воды с активных центров катализатора с высокой
ческие гетероциклы [92]:
координационной ненасыщенностью, на которых
наиболее эффективно происходят изомеризация,
гидрогенолиз, гидрирование и изотопный обмен
[88]. Следовательно, при использовании молеку-
лярного водорода можно ожидать уменьшение n в
водном кластере [3H+(3H2O)n]. В результате эффек-
тивность изотопного обмена с дейтериевой или
194
В. П. Шевченко и др.
Таблица 6. Введение тритиевой метки методом изотопного обмена со 100%-ной 3Н2О (растворители диоксан или
ДМСО с Et3N, в присутствии палладиевых катализаторов)
Соединение
Условия реакции
МР, Ки/ммоль
Выход, %
Оксоретинолевая кислотаа
30 мин, 125°С, диоксан, PdO, 5% PdO/BaSO4
1.8
28
Капсаицинб
30 мин, 145°C, диоксан, PdO, 5% PdO/BaSO4
7.0
30
Дельтаметринв
20 мин, 140°С, диоксан, PdO, 5% Pd/BaSO4
9.3
37
Амфотерицин Вг
30 мин, 120°С, ДМСО, PdO, 5% PdO/BaSO4
18.2
36
5-Хлоро-8-гидроксихинолинд
35 мин, 140°С, 5% Pd/BaSO4, 3Н2О, диоксан
3.8
80-90
Кеналоге
30 мин, 140°С, диоксан, PdO, 5% PdO/BaSO4
3.5
22
а
г
б
е
д
в
Выходы оказались высокими. Единственный
ли 5% Ru/C, катализатор Ренея, Rh или Pd чернь,
недостаток этого подхода заключается в том, что
5% PdO/BaSO4 и 5% Rh/Al2O3 (схема 14) [74, 89,
он не применим для изотопного обмена с ненасы-
94-97].
щенными соединениями. А введение изотопов во-
Как видно из приведенных данных, высокие
дорода в ненасыщенные соединения является од-
молярные радиоактивности получаются, если ис-
ним из главных оснований применения изотопного
пользуется газообразный тритий. Изотопный об-
обмена с дейтериевой или тритиевой водой. С тео-
мен с тритиевой водой эффективен, если использу-
ретической же точки зрения полученные результа-
ется около 100 Ки тритиевой воды с молярной ра-
ты являются еще одним доводом в пользу того, что
диоактивностью, близкой к максимально возмож-
эффективность изотопного обмена с дейтериевой
ной величине (58 Ки/ммоль).
или тритиевой водой зависит от вероятности обра-
зования протонированных активированным водо-
В более термоустойчивые соединения метку
родом водных кластеров. Следовательно, присутст-
можно вводить при более жестких условиях (схе-
вие активированных частиц водорода на катализа-
ма 15) [98].
торе действительно стимулирует изотопный обмен
При температурах 90-180°C дейтерий может
и приводит к образованию препаратов с большим
обмениваться с протием не только в ароматиче-
содержанием дейтерия или трития.
ских и гетероароматических фрагментах, но и при
Таким образом, при рассмотрении основных
одно-, двух- или трехзамещенных углеродных ато-
методов введения метки при использовании гетеро-
мах.
генных катализаторов необходимо учитывать, что
данный процесс происходит в сложной, многоком-
В зависимости от поставленной задачи могут
понентной системе.
меняться стадии, на которых вводится изотоп во-
дорода. Например, если реакцию проводили непо-
II.3. Примеры использования гетерогенных
средственно с SCH C, основное включение изотопа
катализаторов
проходило в пиримидиновое кольцо (тритиевая
II.3.1. Изотопный обмен. Для проведения изо-
вода, диоксан, катализатор Ренея, 110°C, 60 ч). От-
топного обмена с изотопами водорода использова- носительно молярной радиоактивности воды мо-
Влияние процессов, происходящих в присутствии металлов-катализаторов
195
Никель Ренея, 100°C, 2НHO [94]
5% Ru/C, 3НHO, ДМФА, 18 ч [89]
Никель Ренея, тритиевая вода (50 Ки/мл) молярная радио-
активность 0.3 Ки/ммоль, (51% в положении 6 2-ами-
нопиридинового кольца и 43% в пиперидиновом кольце)
[95]
SCH D, Rh чернь, 3Н2, тетрагидрофуран (ТГФ), 16 ч,
15 Ки/ммоль [96]
Никель Ренея, 100°C, дейтериевая вода [94]
Дегидроабиетовая кислота, Pd, [2H]H2O или [3H]H2O
(90 мКи/ммоль [3H]H2O), молярная радиоактивность
12.6 мКи/ммоль. [74]
N6-[2,8-3H]Циклогексиладенозин, 5% Rh/Al2O3, 3H2,
0.1 моль/л HCl, ТГФ, 23°C, 16 ч, 30.2 Ки/ммоль [97]
Рибавирин,
5% PdO/BaSO4,
0.05 моль/л K2HPO4, pH 9.3, 3Н2,
18 ч, 24 Ки/ммоль [96]
[3H]Дигитоксин, ДМФА, 5% Rh/Al2O3, 100 Ки тритиевой воды (58 Ки/ммоль), 80°C, 48 ч, 20-40 Ки/ммоль [97]
Схема 14. Типы соединений, в которые вводили изотопы водорода за счет реакции изотопного обмена.
196
В. П. Шевченко и др.
→
→
→
→
Схема 15. Распределение дейтерия при изотопном обмене, когда в качестве носителя использовался углерод. Усло-
вия реакции: 10% Pd/C (5% Pt/C, 10% Rh/C, 10% Ru/C, 10% Au/C), 2H2, 2Н2O, 90-180°C, 24-34 ч.
Схема 16.
лярная радиоактивность препарата составляла при
При использовании второго варианта включе-
этом примерно 40-60%, или 0.4-0.6 Ки/ммоль:
ние трития увеличилось примерно в 1.7 раза. Это,
по-видимому, связано с тем, что включение трития
в первом варианте происходило при взаимодейст-
вии с активным центром катализатора только пири-
мидинового кольца (при трех углеродных атомах),
а во втором варианте изотопный обмен эффективно
происходил в имидазопиридиновом и пиридино-
вом кольцах (при семи атомах углерода). [96].
Как уже упоминалось выше, повысить эффек-
тивность изотопного обмена можно, проводя реак-
ции без использования растворителей (табл.
4).
Это можно проиллюстрировать на примере получе-
ния октарфина с молярной радиоактивностью
28 Ки/ммоль. Данное соединение после нанесения
Если для проведения биологических исследова-
его водного раствора на оксид алюминия и упари-
ний необходимо было иметь тритий только в пири-
вания взвеси на роторном испарителе механически
диновом и имидазопиридиновом кольцах, то изо-
смешивали с 5% Rh/Al2O3 и выдерживали приго-
топ вводили в соответствующий предшественник в
тех же условиях. И только потом проводили его
товленную смесь при 170°С в течение 20 мин в ат-
конденсацию с пиримидиновой составляющей
мосфере газообразного трития [99].
(схема 16).
II.3.2. Гидрирование. Классическим методом
Влияние процессов, происходящих в присутствии металлов-катализаторов
197
1,3,4,6,7,11b-Гексагидро-9,10-ди-
метокси-3-(2-метилпропил)-2H-
бензо[a]хинолин-2-он
(-)N-н-[3H]Пропилнорапоморфин
Схема 17.
Схема 18. Распределение трития при восстановлении двойных связей в фосфолипидах.
введения изотопов водорода гидрированием явля-
Много работ посвящено гидрированию ненасы-
ется восстановление ненасыщенных углерод-угле-
щенных липидов [59,75, 102-105].
родных связей. Например, гидрированием предше-
Например, лецитин гидрировали в присутствии
ственников, содержащих аллильный фрагмент, бы-
5% Pd/BaSO4 в дихлорметане при комнатной тем-
ли получены меченные тритием соединения с вы-
пературе 2 ч (схема 18). При этом показано, что
сокой молярной радиоактивностью
[100,
101]
тритий включался не только при углеродных ато-
(схема 17).
мах, при которых существовали двойные связи
198
В. П. Шевченко и др.
Таблица 7. Восстановление органических соединений без использования растворителей
Исходное соединение
Условия реакции
МР, Ки/ммоль
Выход, %
Бензиламин
5% Rh/Al2O3, 60°C, 3 ч
210
45
2-Метилпропеновая кислота
5% Pd/C, 170°С, 20 мин
152
80
11-Цианоундекановая кислота
5% Rh/C, 80°C, 3 ч
55
51
В качестве примера гидрирования ненасыщен-
ных углерод-гетероатом связей может служить
восстановление нитрильной группы до амина [101,
107] (схема 20).
Часто такие реакции происходят не столь ус-
пешно. Например, при восстановлении на катали-
заторе Ренея в атмосфере трития в i-PrOH (0.5 ч,
23°C), молярная радиоактивность препарата дости-
гала только 35 мКи/ммоль [107]:
Если восстановление при использовании рас-
творителя ненасыщенных углерод-гетероатом свя-
зей или ароматических колец происходит не эф-
Схема 19. Механизм образования набора продуктов при фективно или образуется соединение с недостаточ-
гидрировании ненасыщенных углерод-углеродных свя- ной молярной радиоактивностью, то можно прово-
зей (процесс происходит на атомах Pd со степенью коор-
дить этот процесс без растворителя при нагрева-
динационной ненасыщенности 3).
нии. Так были получены насыщенные амины и ки-
слоты (табл. 7).
[106]. Такой результат авторы связывают с мигра-
цией двойных связей во время гидрирования (в
Так, при гидрировании 2-метилпропеновой ки-
обобщенном виде этот процесс представлен на схе-
слоты, которую обрабатывали газообразным трити-
ме 19). Данный подход к объяснению процессов,
ем при 170°С на 5% Pd/C, получена меченая кисло-
связанных с гидрированием ненасыщенных угле- та с молярной радиоактивностью примерно в три
род-углеродных связей, аналогичен представленно- раза выше, чем можно было ожидать при восста-
му в схемах 7, 10.
новлении двойной связи [108]. При восстановле-
нии бензиламина без использования растворителя
Новым здесь можно считать данные о том, что
подвижность двойных связей в полиеновых кисло-
молярная радиоактивность оказалась почти в пять
тах выше, чем в моноеновых. Поэтому при гидри-
раз выше, чем при использовании смеси метанол-
ровании полиеновых кислот тритий оказывается
0.5 моль/л. HCl (20 : 1) в качестве растворителя
связанным с бóльшим числом углеродных атомов.
[109].
P2O5, ксилол
(1)
(2)
[3H]Гармалин, 37 Ки/ммоль
Схема 20.
Влияние процессов, происходящих в присутствии металлов-катализаторов
199
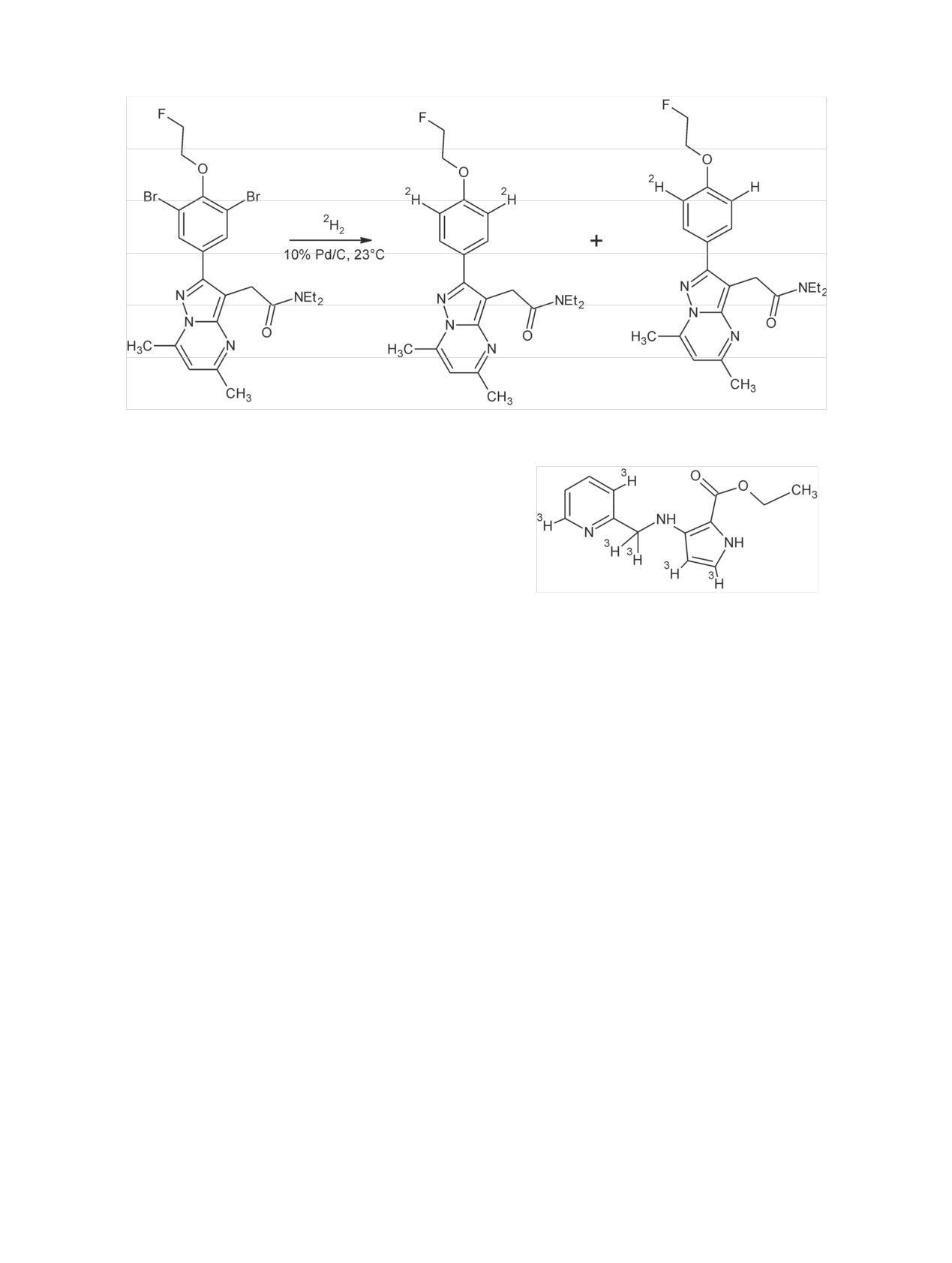
Схема 21. Дегалогенирование бромсодержащего соединения дейтерием (давление 2H2 930 гПа, 20 мин) [124].
II.3.3. Дегалогенирование. Реакция каталити-
ческого обмена водород-галоген (или реакция де-
галогенирования) известна давно [110], однако для
получения меченных тритием соединений ее стали
применять намного позже [111, 112]. Для каталити-
ческого дегалогенирования в атмосфере газообраз-
ного трития используют как полярные, так и непо-
лярные растворители. Образующийся в ходе реак-
Имеющиеся в литературе данные указывают на
ции галогенид трития необходимо нейтрализовать,
то, что при дегалогенировании включение дейте-
так как он отравляет катализатор, что ведет к сни-
рия или трития оказывается в полтора, два раза
жению скорости реакции [10]. Если в молекуле ве-
меньше, чем удаляется атомов галогена. Так, при
щества содержится несколько разных галогенов, то
дебромировании соединения, содержащего два ато-
возможно удалить более сильный нуклеофил, не
ма брома, образовывались полностью дебромиро-
затронув другой. Так, при наличии пары хлор-иод
ванные продукты, содержащие как один, так и два
удаляется иод, а пары хлор-бром - бром.
атома дейтерия (схема 21). При этом соотношение
Реакцию дегалогенирования обычно проводят в
этих продуктов зависело от условий проведения
присутствии катализаторов гидрирования. В основ-
реакции (табл. 9).
ном это Pd на носителе. Наиболее часто для этого
При использовании метанола процентное соот-
используется Pd на угле. При использовании этого
ношение продукта с двумя и одним атомом дейте-
катализатора получены меченые 28-гомокастасте-рон
рия было 70 : 30. По-видимому, это связано с тем,
(5.8 Ки/ммоль)
[113,
114], (S)-4'-(2-(4-амииноте-
что часть газообразного дейтерия успевает при
трагидро-2H-пиран-4-карбоксамидо)-2-цианоэтил)-
взаимодействии с подвижными протонами метано-
3-бифенил-4-илметансульфонат
(12.4 Ки/ммоль)
ла образовать СН3О2Н и 2НН. Когда в процессе де-
[115], AZD5069 (25.1 Ки/ммоль) [116], TAK875
галогенирования участвует 2НН, образуется соеди-
(16.2 Ки/ммоль) [117], вератридин (4.48 Ки/ммоль)
нение, содержащее один атом дейтерия. Действи-
и апоморфин (33 Ки/ммоль) [101]. Есть примеры
тельно, при использовании апротонного раствори-
использования и других катализаторов (табл. 8)
теля соединение, содержащее один атом дейтерия,
[101, 118-123].
не образовывалось, но выход искомого соединения
Интересно отметить, что при дегалогенирова-
был около 5%. Задачу получения соединения, со-
нии этил-4,5-дибром-3-(пиридин-2-ил-метиламин)-
держащего два атом дейтерия, с высоким выходом
1Н-пиррол-2-карбоксилата метка включалась не
удалось решить при использовании в качестве рас-
только при углеродах, где находились атомы бро-
творителя С2Н3О2Н (табл. 9).
ма, но и за счет реакции изотопного обмена в дру-
При использовании газообразного трития и
гие фрагменты данной молекулы:
обычного метанола удалось получить [3H]DPA-714
200
В. П. Шевченко и др.
Таблица 8. Условия дегалогенирования органических соединений
МР,
Соединение
Условия реакции
Ки/ммоль
Троглитазона (R = I, [3H]) [118]
10% Pd/CaCO3, 3Н2, ДМФА, 320 гПа, 0°C, 2 ч
23
10% Pd/C, 3Н2, ДМФА-Н2О (80 : 20), (iPr)2EtN, 170-270 гПа,
RNAsб [119]
1.9
23°C, 6 ч
в, R = Br, затем 3H [120]
Катализатор Линдлара, 3Н2, этанол, 23°C, 4 сут
29
Этил-4,5-дибром-3-(пиридин-2-илметил-
PdО, 3Н2, ДМФА, Et3N, 807 гПа, 23°C, 12 ч
43.2
амин)-1Н-пиррол-2-карбоксилатг [121]
(S)-(3,5-Дихлорфенил)-2-пропилазидд [109]
10%Pd/C, Et3N, ТГФ-метанол (5 : 4), 5-12 ч
30.1
(S)-2,6-Дихлорметамфетамине [122]
20% Pd(OH)2/C, Et3N, ТГФ-метанол (5 : 4), 5-12 ч
38.3
Иодострихнинж → [3H]стрихнинз [101]
3Н2, 10% Pd/Al2O3, бензол, 23°С, 2 ч
25.0
и → к [123]
Pd/C Et3N, 2Н2
-
а
в
д
б
г
e
и
з
ж
к
2H
Таблица 9. Выход N,N-диэтил-2-(2-(4-(2-фтороэтокси)
с молярной радиоактивностью 57 Ки/ммоль, т.е.
фенил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-ил)
трития включалось больше, чем можно было ожи-
ацетамида (DPA-714), содержащего один и два атома
дать, если соотношение продукта с двумя атомами
дейтерия, при использовании разных растворителей
трития и продукта с одним атомом трития остава-
лась 70 : 30.
Растворитель
Время реакции
2Н (2 атома)
2Н (1 атом)
СН3ОН
1 ч
~70%
~30%
Распределение трития в молекуле [3H]DPA-714
С2Н3О2Н
30 мин
~95%
~5%
(25.3% 13Н, 23.6% 23Н, 15.9% 33Н, 14.0% 43Н, 4.3%
53Н; условия реакции: 3H2, 10% Pd/C, 23°С, мета-
Толуол
4 сут
~5%
-
Влияние процессов, происходящих в присутствии металлов-катализаторов
201
3,3-Этилендиокси-16α,17α-
16α,17α-[3',4'-3H]Циклопентано-
3,3-Этилендиокси-16α,17α-циклопент-
[3',4'-3H]циклопен-
прогестерон
3'-енопрегн-5-ен-20-он
танопрегн-5-ен-20-он
Схема 22. Синтез 16α,17α-[3',4'-3H]циклопентанопрогестерона.
катализатора, на активных центрах которого ад-
нол, 20 мин) [124] позволило объяснить получен-
сорбция исходного соединения и продуктов реак-
ный результат.
ции заметно отличаются. В результате после селек-
тивного гидрирования продукт реакции оказывает-
ся вне зоны реакции и может быть выделен в пре-
паративных количествах. Например, при гидриро-
вании Ph-C≡C-C≡C-Ph в присутствии Pd на угле
происходит образование Ph(C3Н2)4Ph, в то время
как при использовании Pd на BaSO4 образуется
PhC3Н2C3Н=C3НC3Н2Ph с молярной радиоактивно-
стью 232.5 Ки/ммоль [125].
При селективном гидрировании одной из не-
скольких двойных связей возможны два случая.
Первый - когда скорости их гидрирования сущест-
венно различаются и можно, например, прогидри-
Полученные данные показали, что соотношение
ровать тритием двойную связь олеинового фраг-
продуктов с двумя и одним атомом изотопа водо-
мента в холестерилолеате, не затронув двойную
рода примерно совпадают с данными, полученны-
связь в холестериновом фрагменте, т.е. достаточно
ми при обработке исходного соединения дейтери-
подобрать условия, при которых эти различия в
ем. Оба атома брома замещались на тритий в 75%
скоростях гидрирования будут максимальны [66,
случаев, а один атом брома на тритий, другой - на
126, 127]. Однако в этом случае молярная радиоак-
протий в 25% случаев. Остальная часть трития
тивность препарата может оказаться невысокой,
включалась за счет изотопного обмена в метиль-
например, как при селективном гидрировании (E)-
ные группы. Таким образом, суммарное среднее
3-[4-[(1R,3R)-3-метил-2-(2-метилаллил)-1,3,4,9-
количество трития, включившееся в DPA-714, со-
тетрагидропиридо[3,4-b]индол-1-ил]фенил]проп-2-
ставило около двух атомов. При отсутствии изо-
еновой кислоты [128] (см. ниже).
топного обмена суммарное среднее количество
трития оказалось бы не более 1.8 атома на молеку-
Второй случай - когда необходимо введение
лу DPA-714.
соответствующих защитных групп для создания
требуемой селективности гидрирования (схема 22)
II.3.4. Селективное гидрирование и дегалоге-
[108].
нирование. Оптимизация условий при реализации
селективного гидрирования заключается в подборе
Известно, что реакции селективного гидрирова-
ТГФ, 23°С, 30 мин
0.513 Ки/ммоль
202
В. П. Шевченко и др.
ния одного ароматического фрагмента при наличии
нескольких других (например, пиридиновой и бен-
зильной групп) идут в растворе только при очень
низких значениях рН [109, 129]. В таких условиях
идет очень сильное изотопное разбавление, что
приводит к заметному понижению молярной ра-
диоактивности меченого препарата, что отмечено,
например, при получении (циклогексилметил)-
амина из бензиламина. При использовании твердо-
Схема 23.
фазного метода можно ожидать гораздо меньших
изотопных эффектов.
Например, оказалось возможным прогидриро-
вать пиридиновое кольцо без затрагивания бен-
зильного. Активированные частицы трития (ка-
тионы) более эффективно протонируют пиридино-
вый фрагмент, чем бензольный. Ароматическая
MeOH, выход 49%
структура пиридинового фрагмента при этом нару-
шается и его гидрирование облегчается. Так, при
селективном гидрировании соединения подобного
строения меченый препарат содержал более пяти
атомов трития (174 Ки/ммоль). Содержание иско-
Схема 24.
мого продукта в реакционной смеси было в семь
раз больше всех остальных, т.е. селективность про-
цесса оказалась высокой [130] (схема 23).
Селективное гидрирование галогенсодержащих
соединений и селективное дегалогенирование не-
Ки/ммоль)
насыщенных соединений также сильно зависят от
условий проведения реакции. В присутствии три-
ДМФА, 85°С, Pd(PPh3)4
2.5 Ки/ммоль
этиламина или хинолина преимущественно проис-
ходит дегалогенирование, в отсутствие этих доба-
вок в основном осуществляется гидрирование.
Схема 25.
Действительно, при использовании 5% Pd/BaSO4 и
этилацетата в работе [27] удалось селективно про-
соединения можно, используя гомогенные катали-
гидрировать
(1R,2R)-N-[2-(4'-метилпиперидилме-
заторы. Кроме того, использование гомогенных
тил)циклогекс-4-енил]-4-амино-5-хлоро-2-цикло-
катализаторов позволяет в ряде случаев эффектив-
пропилметоксибензамид, а при использовании 10%
но проводить изотопный обмен в более мягких ус-
Pd/BaSO4 и смеси метанола с триэтиламином
ловиях реакции.
[131] - селективно дегалогенировать бромпроиз-
водное циклоспорина.
III. Введение изотопов водорода в органические
Существуют и более экзотические приемы для
соединения в присутствии гомогенных
повышения селективности реакций с ненасыщен-
катализаторов
ными соединениями, содержащими галоген. На-
пример, при обработке NiCl2 боротритидом натрия
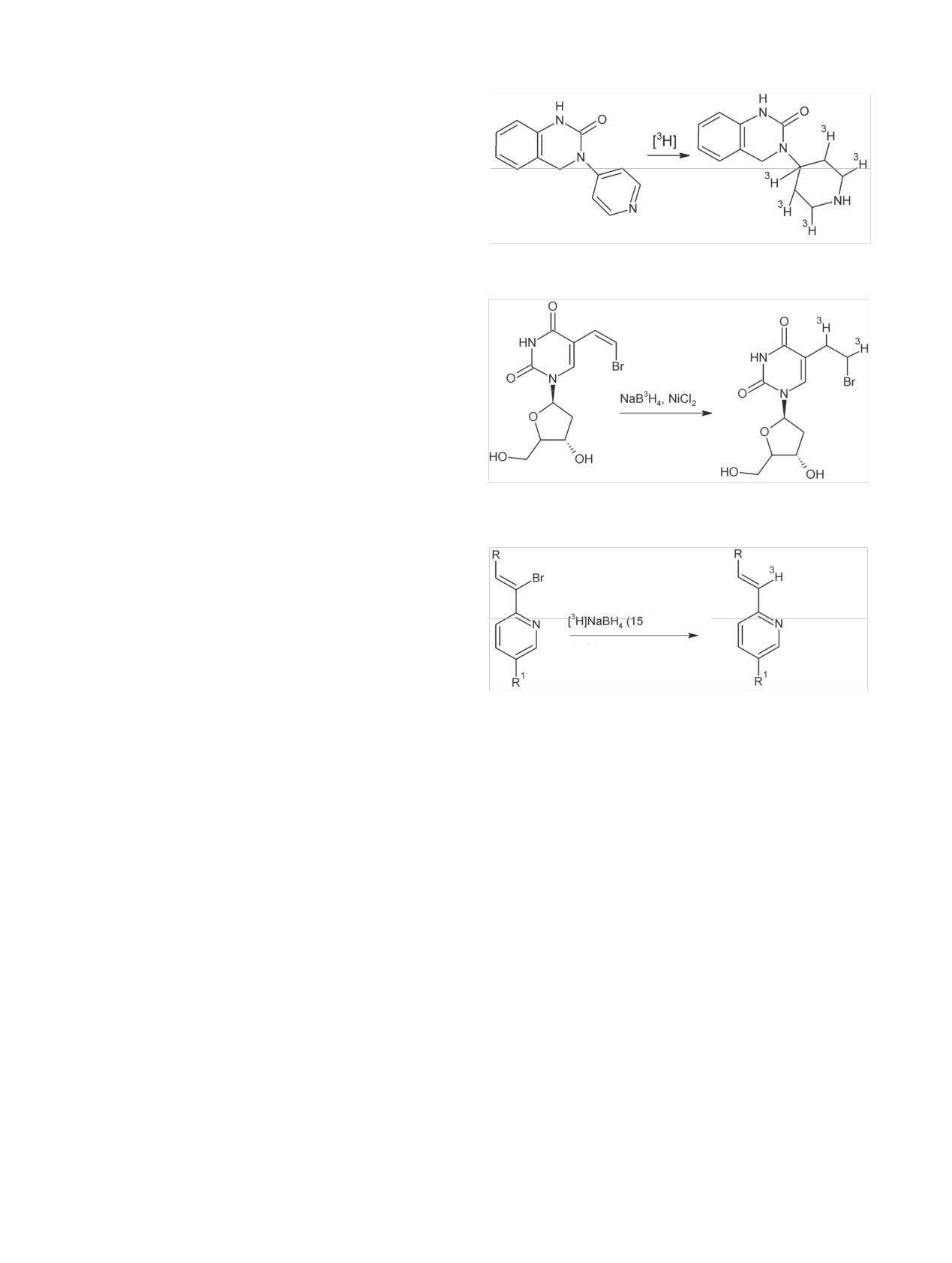
III.1. Механизм введения изотопов водорода
образуется смесь продуктов (3Н2, Н3ВО3, 3НН2ВО3,
гидрированием органических соединений при
NaCl, Ni2B, 3H2HBO3, 3H3BO3), которая селективно
использовании газообразного дейтерия или трития
гидрирует двойные углерод-углеродные связи без
в присутствии гомогенных катализаторов
дегалогенирования органического соединения
[132] (схема 24).
Знания в этой области связаны с развитием хи-
А при использовании Pd(PPh3)4 и [3H]NaBH4
мии комплексных соединений переходных метал-
удалось дегалогенировать ненасыщенное соедине-
лов, которые проявляют свое действие в гомоген-
ние [133] (схема 25).
ной системе. Некоторые дигидридные и моногид-
Увеличить селективность процессов включения
ридные комплексы, а также ряд аддуктов, образую-
дейтерия или трития в молекулы органического
щихся в процессе реакции, были выделены и оха-
Влияние процессов, происходящих в присутствии металлов-катализаторов
203
Схема 26.
-
-
x-1
x
x
x-1
(цис-, транс-)
x-1
x
Схема 27.
-
-
Схема 28.
рактеризованы спектральными методами [60]. На-
комплексе можно проиллюстрировать схемой 27
пример, полученные данные позволили предста-
[60, 61].
вить IrH2Cl(CO)(PPh3)2, RhH2Cl(PPh3)2*CH2Cl2,
Механизм гидрирования на дигидридных ком-
RuHCl(PPh3)3, аддукта 1,3-бутадиена с CoH(CN)5K3
плексах можно проиллюстрировать схемой 28 [60]
в виде структур, показанных на схеме 26.
(где S - молекула растворителя).
Механизм гидрирования на моногидридном
Примеры использования таких катализаторов
204
В. П. Шевченко и др.
Таблица 10. Получение меченых препаратов методом тритиирования соответствующих ненасыщенных предшест-
венников в присутствии (Ph3P)3RhCl
Исходное соединение
Выход, %
МР, Ки/ммоль
Буметанид
37
15.9
2-[N-(2,6-Диметоксифеноксиэтил)аминометил]-1,4-бензодиоксин
46
59.9
Яичный фосфатидилхолин
87
14.6
Дрожжевой фосфатидилинозит
94
0.8
Ганглиозид G1
51
4.3
Ганглиозид G2
72
3.0
1,11,15-Три-BDMS-PGE2
60
51.3
1,11-Ди-BDMS 15-фтор-15-дезокси-PGE2
60
27.0
1,15-Ди-BDMS-PGA2
40
70.2
2,6-Диметил-3,5-ди(аллилоксикарбонил-4-(2'-дифторметоксифенил)-1,4-дигидропиридин
55
109.4
–
Схема 29.
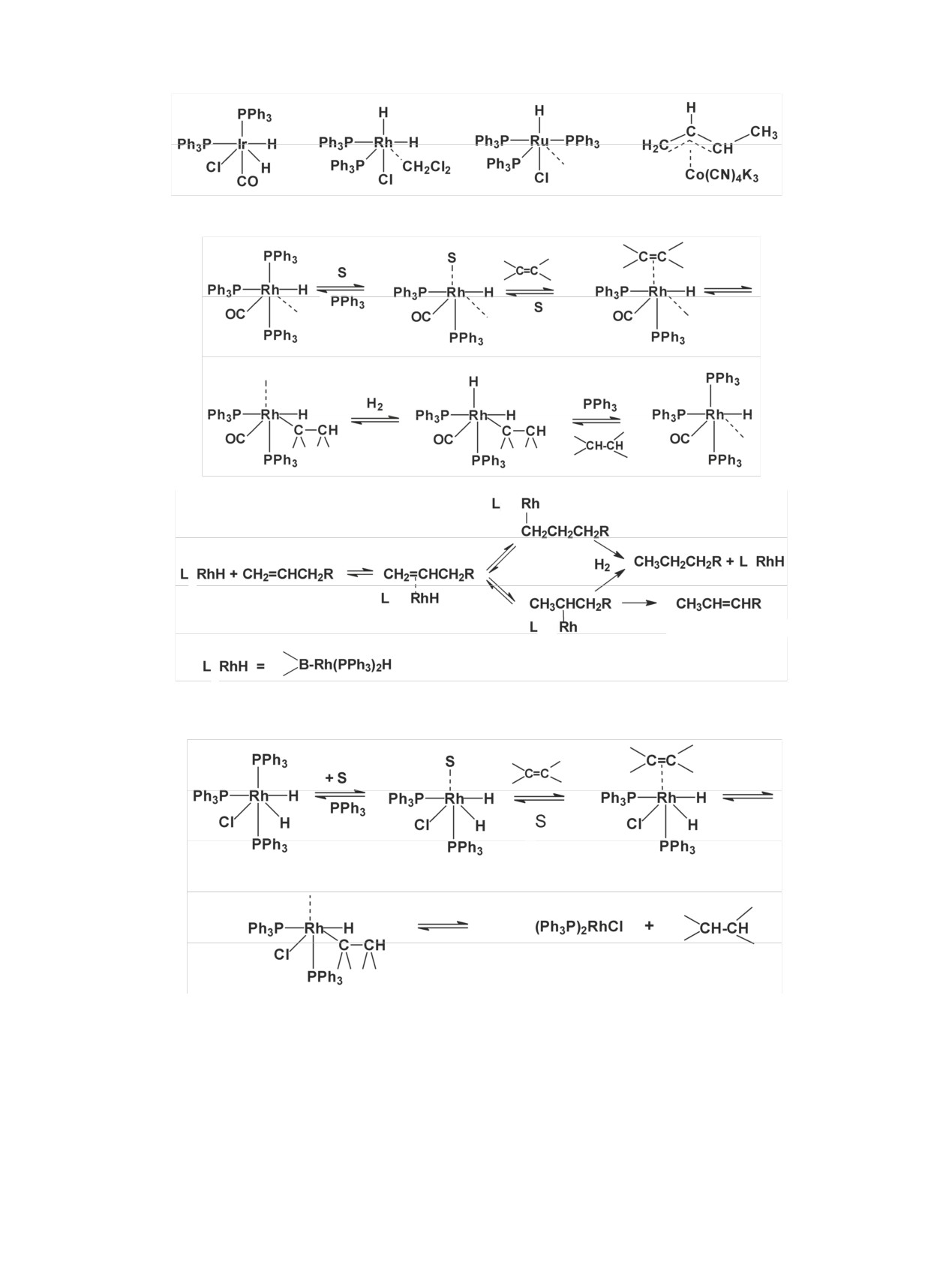
приведены в табл. 10 [70].
Существует также метод введения метки [134]
за счет образования комплекса молекулы субстрата
с двумя свободными координационными связями
атома Ir при использовании соответствующих го-
-
могенных катализаторов (схема 29, S - бензофе-
нон).
Очевидно, что после гидрогенолиза связи Ir-C
активированным тритием образуется препарат с
меткой в о-положении.
III.2. Механизм изотопного обмена с дейтерием
Схема 30. Иридиевые катализаторы. PPh3 - трифенил-
или тритием в присутствии гомогенных
фосфин, PBn3 - трибензилфосфин, BArF - тетракис(бис-
иридиевых катализаторов
3,5-трифторметилфенил)борат. а: L = PPh3, Y = PF6;
, Y = BArF.
b: L = PBn3, Y = PF6; c: L = PPh3
В плане детализации процессов, которые проис-
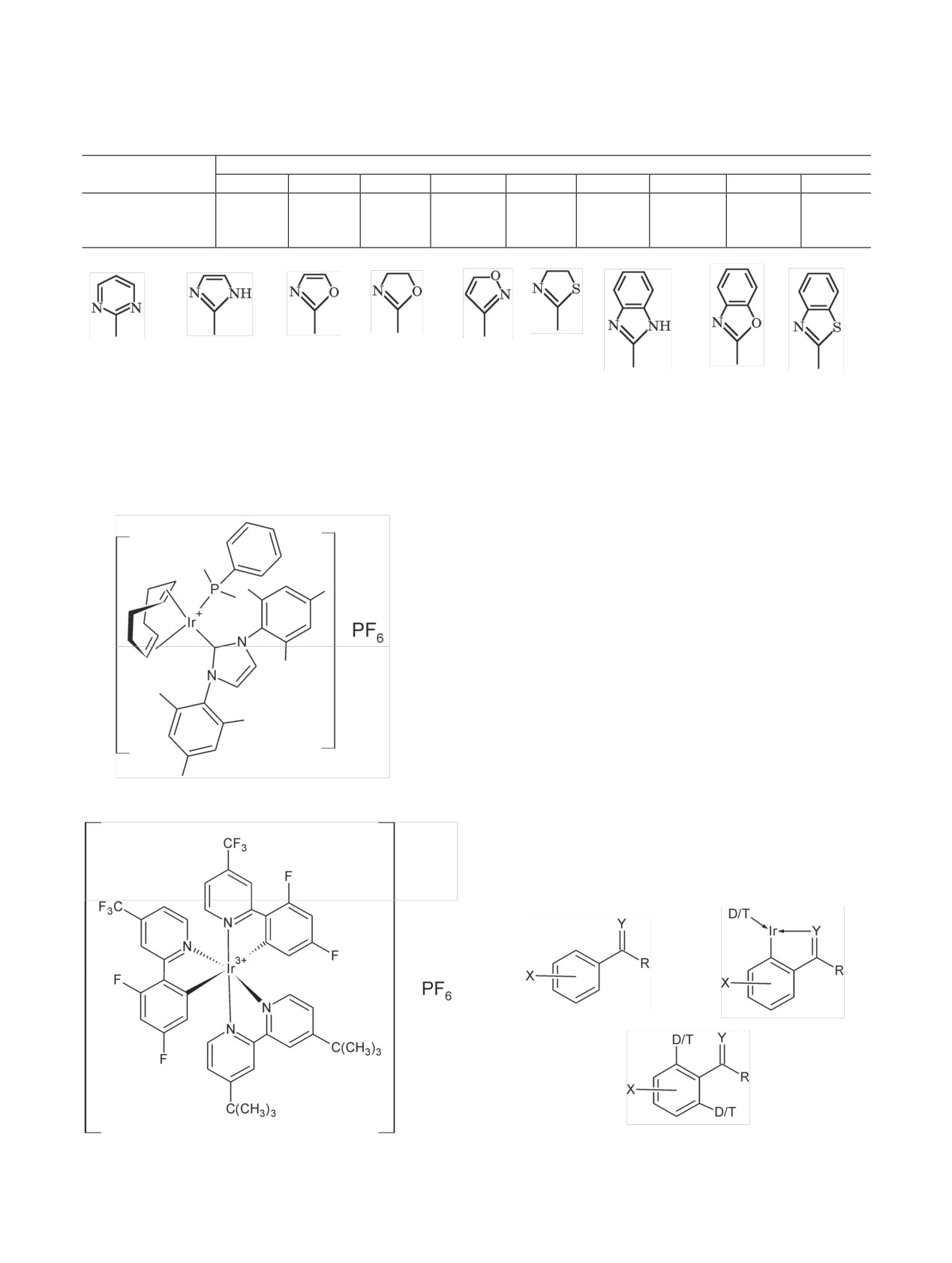
ходят при введении метки за счет образования ком-
использовали иридиевые катализаторы а-с (схе-
плекса молекулы субстрата с атомом иридия, пред-
ма 30).
ставляет интерес работа, посвященная изучению
влияния на изотопный обмен температуры и замес-
При повышении температуры с 25 до 40°С
тителей в бензойной кислоте или ацетофеноне, а
включение дейтерия в этиловые (соединения 1-3)
также заместителей в иридиевых катализаторах
и метиловые (соединения 4-6) эфиры бензойной
[135-137].
кислоты растет (табл. 11). В экспериментах ис-
пользовали производные бензойной кислоты, со-
При использовании как модельных соединений
держащие в п-положении фенильного кольца про-
производных бензойной кислоты и ацетофенона
тий (Н) (соединения 1, 4), метил (соединения 2, 5),
оказалось возможным показать, как влияют стери-
трифторметил (соединения 3, 6). Реакцию вели в
ческие факторы и заместители первого и второго
дихлорметане 1 ч в присутствии катализатора а
рода на эффективность изотопного обмена и, сле-
(давление дейтерия 1 атм).
довательно, получить дополнительные сведения о
механизме изотопного обмена в присутствии ири-
Из приведенных данных следует (табл. 11), что
диевых катализаторов. В качестве катализатора
при более высокой температуре включение дейте-
Влияние процессов, происходящих в присутствии металлов-катализаторов
205
Таблица 11. Влияние температуры на изотопный обмен
(давление дейтерия 1 атм).
(2Н, %)
В экспериментах использовали кроме соедине-
Температура, °С
ний
1-3 n-ClC6H4COOC2H5
(7) и n-CH3OC6H4·
Соединение
25
40
COOC2H5 (8).
C6H5COOC2H5
(1)
23
86
При этом оказалось, что не только спиртовой
п-CH3C6H4COOC2H5
(2)
68
90
фрагмент, образующий сложный эфир, но и изме-
п-CF3C6H5COOC2H5 (3)
77
96
нения Y и L заметно влияют на эффективность
C6H5COOCH3 (4)
52
76
изотопного обмена (табл. 12, 13). Очевидно, что
иридиевый катализатор, который содержит более
п-CH3C6H4COOCH3 (5)
42
96
липофильный противоион (PBn3), легче диссоции-
п-CF3C6H5COOCH3 (6)
32
93
рует в дихлорметане, что облегчает взаимодейст-
вие соединений с атомом Ir (табл. 12). Когда же в
иридиевом катализаторе содержится более объем-
Таблица 12. Влияние спиртового фрагмента в молекуле
сложного эфира и противоиона Y в иридиевом катализа-
ный заместитель, то вероятность образования ком-
торе на изотопный обмен (2Н, %)
плекса с веществом уменьшается (табл. 13).
Катализатор
Катализатор
При повышении температуры различия в эф-
R
R
а
c
а
c
фективности включения дейтерия в соединения с
n-Pr
28
89
i-Pr
72
94
разными эфирными компонентами, содержащие в
CH2CF3
8
24
Bzl
61
89
бензойной кислоте разные заместители, становятся
t-Bu
10
41
менее заметными. Это также указывает на то, что
главное влияние на изотопный обмен оказывает
фрагмент вещества, который определяет эффектив-
Таблица 13. Влияние фрагмента L = PPh3 и PBn3 в
иридиевом катализаторе на эффективность изотопного
ность взаимодействия с атомом Ir (табл. 11). Дейст-
обмена (2Н, %)
вительно, при более высокой температуре влияние
природы противоионов на степень диссоциации
Катализатор
Соединение
иридиевых катализаторов становится менее замет-
а
b
ной, как и различия в строении используемых суб-
1
23
10
стратов.
2
68
19
Если в молекуле соединения имеются две груп-
3
77
56
пы, которые могут ассоциироваться с атомом Ir, то
п-ClC6H4COOC2H5 (7)
95
89
возникает конкуренция между ними, что и опреде-
п-CH3OC6H4COOC2H5 (8)
96
62
ляет распределение дейтерия в меченом препарате.
Это подтверждают данные по изотопному обмену
рия увеличивается. Влияние заместителя на изо-
дейтерия с этиловым эфиром п-нитробензойной
топный обмен между газообразным дейтерием и
кислоты, п-нитроацетофенона, диэтиламида п-ни-
этиловыми эфирами бензойной кислоты при пере-
тробензойной кислоты (катализатор а, 25°С, ди-
ходе от соединения 1 к соединению 3 при 25°С рас-
хлорметан, 1 ч, давление дейтерия 1 атм). Показа-
тет, а для соответствующих метиловых эфиров -
но, что вероятность присоединения дейтерия в
падает. По-видимому, определяющую роль при
о-положения относительно нитрогруппы в п-ни-
образовании комплекса соединения с иридиевым
тробензойной кислоте в 1.4 раза выше, чем в о-по-
катализатором играет не только распределение
ложения к карбонильной группе. Для п-нитро-
электронной плотности в бензольном кольце, но и
ацетофенона присоединение дейтерия в о-поло-
стерические эффекты, связанные с взаимодействи-
жения относительно нитрогруппы в 3 раза ниже,
ем полярной группы вещества с атомом иридия.
чем в о-положения к кетогруппе. Для диэтиламида
п-нитробензойной кислоты распределение дейте-
Естественно, это взаимодействие зависит не
рия в о-положениях, ориентируемых группами,
только от природы соединения, но и от строения
которые могут ассоциироваться с атомом Ir, при-
иридиевого катализатора (табл. 12, 13). В данном
мерно 50%. Это также указывает на то, что главное
случае использовали иридиевые катализаторы,
влияние на эффективность изотопного обмена оп-
отличающиеся фрагментами L
= PPh3 и PBn3
ределяется фрагментом вещества, который лучше
(катализаторы а и b), а также противоионами
взаимодействует с атомом Ir (схема 31).
Y = PF6 и BArF (катализаторы а и c). В ка-
честве субстрата использовали СН3ОС6Н4СООR.
После взаимодействия полярного фрагмента с
Реакцию вели при
25°С в дихлорметане
1 ч
атомом Ir (I), протий из о-положения ароматиче-
206
В. П. Шевченко и др.
+
2+
2+
I
II
III
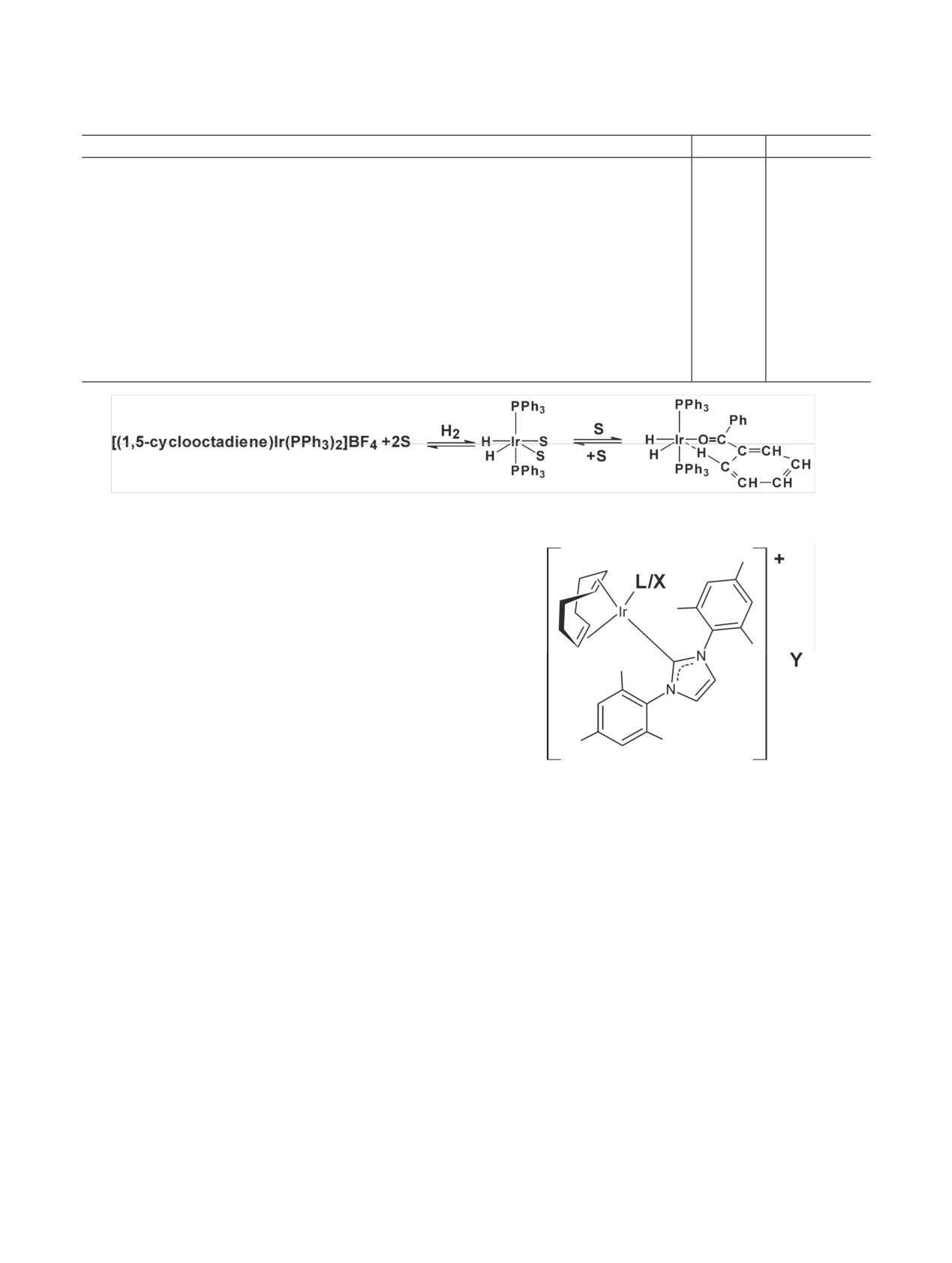
Схема 31. Взаимодействие ароматического соединения с катализатором а (DG -направляющая группа) [136].
или
-
-
3
3
+ Solv
3
3
3
Схема 32. Механизм включения изотопов водорода в молекулы органического соединения в присутствии иридиево-
го катализатора при использовании дейтериевой или тритиевой воды. Solv - растворитель; cod - циклооктадиен; * -
изотоп водорода 2H или 3H.
ского соединения также связывается с атомом
тот же катализатор. Естественно, в основном дей-
Ir (II). Связь протия из о-положения ароматическо-
терий обменялся на протий из о-положения относи-
го соединения с фенильным кольцом ослабевает и
тельно кетогруппы. В результате в о-положении
возникает связь C-Ir (III). Когда происходит раз-
относительно нитрогруппы оказывается в 8 раз
рыв связи C-Ir, дейтерий включается в ароматиче-
больше дейтерия, чем о-положениях относительно
ское соединение, а протий остается связанным с
кетогруппы в 4-нитроацетофеноне.
атомом Ir.
Механизм включения изотопов водорода в мо-
Использование выявленных закономерностей
лекулы органического соединения при использова-
позволяет кардинально менять распределение дей-
нии дейтериевой или тритиевой воды также состо-
терия в меченом препарате. Например, зная, что
ит из нескольких этапов (схема 32). Молекулы рас-
при введении дейтерия в 4-нитроацетофенон при
творителя и воды вытесняют из иридиевого ком-
25°С в о-положение относительно кетогруппы,
плекса 1,5-циклооктадиеновый фрагмент. Затем в
включалось в три раза больше дейтерия, чем в
этот комплекс включается молекула органического
о-положение относительно нитрогруппы, сначала
соединения. При этом меняется валентность метал-
проводили реакцию при 40°С, когда обмениваются
ла-катализатора. В результате этих превращений
все четыре атома протия на дейтерий за счет изо-
происходит изотопный обмен между протонами
топного обмена. Затем обрабатывали меченый пре-
вещества и изотопами водорода из дейтериевой
парат при 25°С газообразным протием, используя
или тритиевой воды [138].
Влияние процессов, происходящих в присутствии металлов-катализаторов
207
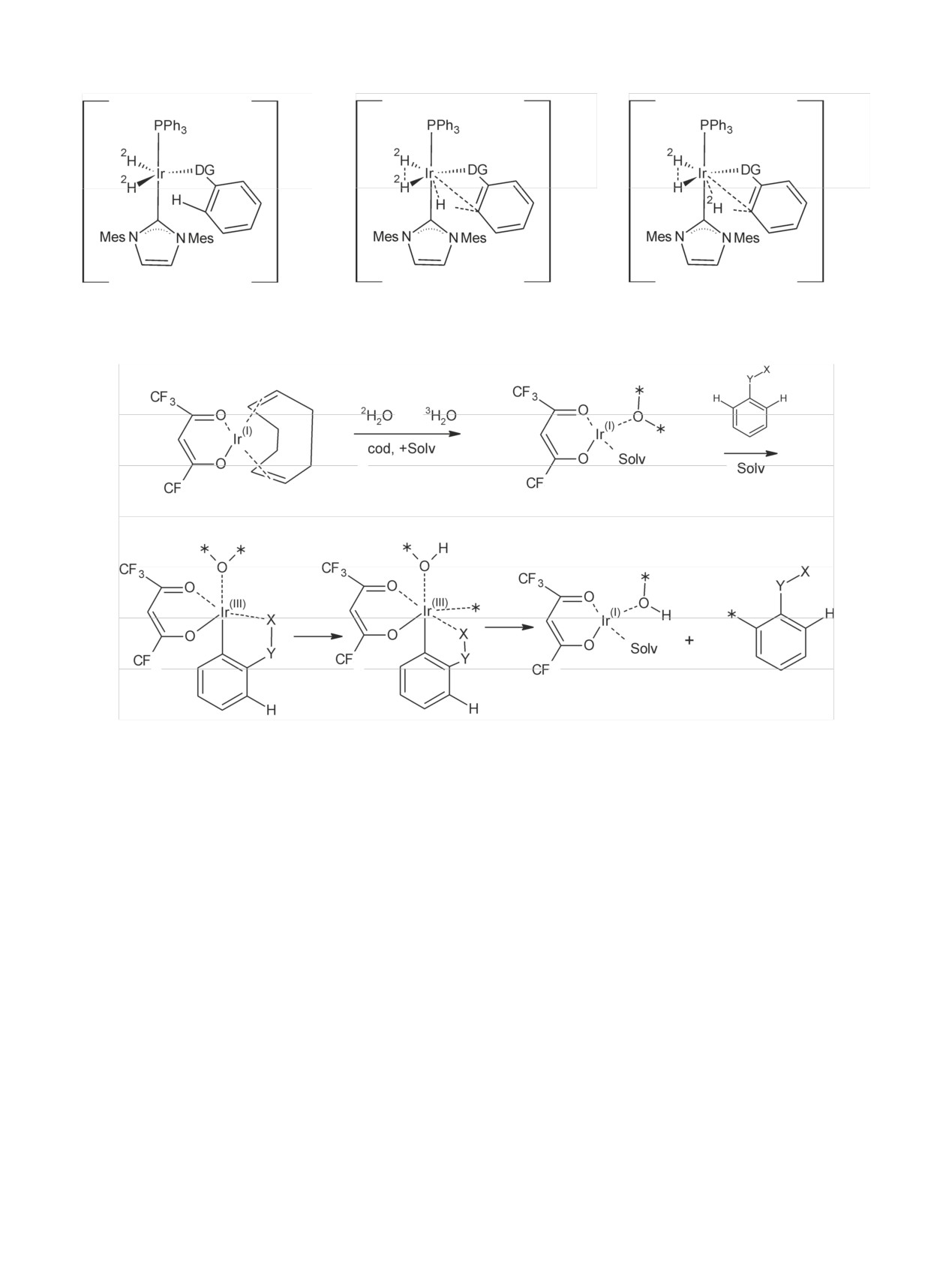
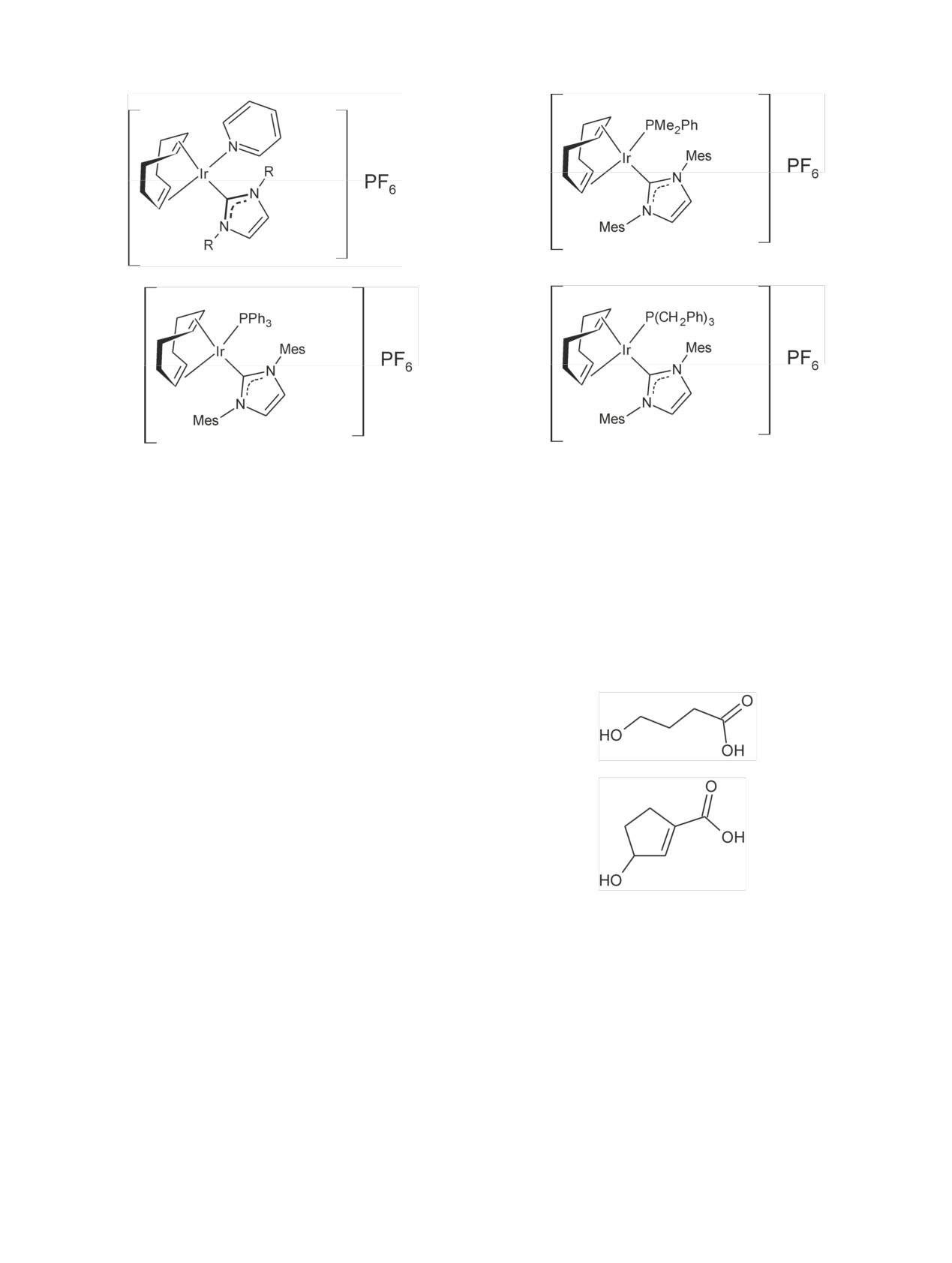
Схема 33. Структуры иридиевых катализаторов, используемых для активации изотопного обмена.
III.3. Использование гомогенных иридиевых
На примерах использования иридиевых катали-
катализаторов для получения меченых соединений
заторов можно показать и детализировать специ-
фику работы при введении изотопов водорода в
органические соединения.
Примерная методика таких реакций выглядит
следующим образом. Смесь вещества, например
При получении меченого дейтерием HOCPCA
4-фенилбензойной кислоты (100 мг), с иридиевым
(аналог GHB), который содержал связь С=С [144],
катализатором, например циклооктадиенилири-
необходимо было подобрать условия, при которых
дий(I)пентан-1,3-дионатом (1.2 мг), растворяли в
двойная связь сохранится:
ДМФА (6.6 мл), содержащем дейтериевую воду
(3.3 мл), и выдерживали при 90°C 2 ч. Выход
4-фенил[2,6-2H2]бензойной кислоты 74%. В моле-
кулу
4-фенилбензойной кислоты включилось в
GHB
среднем 2 атома дейтерия [125]. При использова-
нии газообразного трития реакцию обычно прово-
дят в хлористом метилене. При этом, как и в ранее
рассмотренных случаях, использование в качестве
источника трития газообразного трития позволяет
получать препараты с более высокой молярной ра-
диоактивностью, чем при использовании тритие-
вой воды.
Аналог GHB (HOCPCA)
Для получения препаратов использовались са-
Известно, что при использовании газообразного
мые разные иридиевые катализаторы (схема 33)
водорода и иридиевых комплексов параллельно с
[139-142].
изотопным обменом происходит гидрирование
В настоящее время используются как коммерче-
двойной связи. Поэтому, во-первых, дейтерий вво-
ские катализаторы, так и катализаторы, которые
дили не в HOCPCA, а в пропил-3-оксоциклопент-1-
готовят непосредственно перед проведением изо-
ен-карбоксилат, во-вторых, применяли разные ка-
топного обмена [143]. Приготовленные таким обра-
тализаторы и растворители. В качестве катализато-
зом катализаторы Ir(1,5-циклооктадиен)(Ph3PO)2 ·
ров использовали катализаторы: гексафторфосфат
BF4, Ir(1,5- циклооктадиен)(Bu3PO)2BF4 и Ir(1,5-
(1,5-циклооктадиен)(пиридин)(трициклогексил-
циклооктадиен) (i-PrPh2PO)2BF4 использовались
фосфин)иридия(I), а, d, e; растворители: CH2Cl2,
для введения дейтерия в PhSO2NH2 и метилфенил-
ТГФ, ДМФА, метанол, ацетон, ацетонитрил, нит-
сульфоксид.
рометан, хлороформ, CCl4, этилацетат, ДМСО; вре-
208
В. П. Шевченко и др.
Таблица 14. Зависимость эффективности изотопного обмена (% дейтерия, первое число) и выхода (второе число) от
гетероциклического заместителя в соединении R-[2,6-2H]C6H5 в присутствии иридиевого катализатора. Условия:
0.086 моль вещества, 0.0043 моль [Ir], 1 мл CH2Cl2, 1 атм H2, 25°C, 1 ч
Гетероциклический заместитель R
Катализатор
а
б
в
г
д
е
ж
з
и
а
93; 96
89; 94
83; 99
92; 80
82; 89
86; 93
84; 88
90; 94
94; 99
b
42; 93
73; 91
75; 94
79; 79
44; 80
95;100
83; 89
82; 96
60; 93
d
14; 96
70; 95
80; 94
91; 70
72; 98
89; 95
72; 82
80; 95
31; 95
б
в
г
д
е
ж
з
и
а
мя реакции варьировали от 10 мин до 72 ч (схе-
3%, через 20 мин - 10%, а через 60 мин - 39%. При
ма 34).
использовании катализатора a в соответствующие
промежутки времени количество гидрированного
При использовании катализатора d через 10 мин
продукта составляло 0, 3, 7%. HOCPCA получали
количество гидрированного продукта составляло
восстанавлением кетона борогидридом натрия и
щелочным гидролизом.
Влияние строения иридиевого катализатора на
выход и эффективность изотопного обмена показа-
но в работе, в которой вводили изотопы водорода с
использованием катализаторов а, b, d не только в
ароматические фармацевтические препараты
(схема 35), но и в фармацевтические препараты, в
состав которых входят гетероциклы (табл.
14)
[145].
Как видно из приведенных данных (табл. 14), на
одном и том же катализаторе выход и эффектив-
ность изотопного обмена изменяются у разных ор-
ганических соединений в пределах 10%, в то время
d
как на разных катализаторах эффективность изо-
топного обмена в одном и том же соединении мо-
жет меняться на 60-80%.
Интересно, что при введении изотопов водорода
в соединения при использовании катализатора а
e
Схема 35. Предполагаемый механизм включения изото-
Схема 34. Структуры иридиевых катализаторов d и e.
па водорода в ароматические соединения.
Влияние процессов, происходящих в присутствии металлов-катализаторов
209
Таблица 15. Изотопный обмен на иридиевых катализаторах
Соединение
Условия реакции
а, 1.9 Ки/ммоль
ДМФА, 3Н2О, 70°C, 20 ч [2]
б, 77.7 Ки/ммоль
3H2, CH2Cl2, 16 ч [97]
в, 79.4 Ки/ммоль
CH2Cl2, 3H2, 23°C, 18 ч [2]
г-е
Газообразный тритий или дейтерий, 23°C, 1-2 ч, CH2Cl2 [139]
а
б
г
в
д
е
(1 атм 2Н2, 25°C, 1 ч) в дихлорметане и метаноле
ния подобных реакций (схема 38), то при более
эффективность изотопного обмена сильно не изме-
продолжительном выдерживании включение изо-
няется (схема 36). Это указывает на то, что под-
топов водорода может существенно возрасти [147].
вижные протоны растворителя в данных условиях
При увеличении времени реакции с 1 до 6 сут
проведения реакции практически не участвуют в
включение дейтерия возросло примерно в два раза.
процессе включения метки.
При введении трития в SCH Q реакцию прово-
Влияние стерических факторов при использова-
нии гомогенных иридиевых катализаторов можно
проследить в работе, связанной с введением трития
в ароматические альдегиды (схема 37) [146]. Реак-
цию вели в дихлорметане при перемешивании в
атмосфере газообразного трития при комнатной
температуре в течение 16 ч, используя в качестве
катализатора гексафторфосфат
(1,5-циклооктади-
CH2Cl2, 83, 95; МеОН, 80, 94
ен)(пиридин)(трициклогексилфосфин)иридия(I). В
этих условиях из 3,5-ди-трет-бутил-4-гидрокси-
бензальдегида получен меченый препарат с моляр-
ной радиоактивностью 24 Ки/ммоль.
Как видно из схемы 37, на включение трития в
ароматическое кольцо большое влияние оказывают
стерические факторы. Если о- и п-положения в аро-
матическом кольце заняты, то метка включается
только в формильную группу. Метильные группы
уменьшили включение трития в ароматическое
CH2Cl2, 82, 90; МеОН, 85, 90
кольцо на 19%, а трет-бутильные заместители в
ароматическом кольце привели к полному отсутст-
Схема 36. Эффективность изотопного обмена (первое
вию метки в нем.
число, %) и выход (второе число, %) при использовании
Если вещество устойчиво в условиях проведе- протонных и апротонных растворителей.
210
В. П. Шевченко и др.
74 (23)
22 (70)
8 (100)
68 (33)
13 (100)
24 (100)
50 (40)
52 (44)
Схема 37. Влияние стерических факторов на распределение трития в молекулах ароматических альдегидов (первая
цифра общая молярная радиоактивность, в скобках -часть метки в процентах, находящаяся в формильной группе).
Схема 38. Включение дейтерия в THK-523 в зависимости от времени реакции (1 сут - 50%, 6 сут - >95%).
Схема 39. Строение SCH Q.
дили с метиловым эфиром SCH Q (3.7 мг) и эквива-
нения, которые имеют одну и ту же группу, опре-
лентным количеством гексафторфосфата (1,5-цик-
деляющую места введения метки. Например, для
лооктадиен)(пиридин)(трициклогексилфосфин)ири-
более детального изучения метаболизма и фарма-
дия(I) (3.7 мг) в атмосфере 850 мКи газообразного
кокинетических свойств AZD6642 и его производ-
трития при перемешивании в течение 16 ч. После
ных, которые имеет хорошие перспективы в каче-
омыления [3H]SCH Q (схема 39) имел молярную
стве лекарственных препаратов, необходимо было
радиоактивность 20.5 Ки/ммоль [96].
получить их меченные тритием аналоги
[148]
(схема 41). Так как в этих препаратах группа, опре-
При использовании (COD)IrPMe2Ph(IMes)PF6
деляющая распределение метки, была идентична,
удалось получить трет-бутил-N-[4-[[(1S)-2-амино-
тритий включался при тех же углеродных атомов,
1-[[4-(4-карбамоил[3(5)-3H]фенил)фенил]метил]-2-
что позволяло применять унифицированную мето-
оксоэтил]карбамоил]тетрагидропиран-4-ил]кар-
бамат (схема 40) с выходом 40% и молярной ра-
дику при их использовании в биологических экспе-
диоактивностью 13.3 Ки/ммоль [115].
риментах.
Этим методом удобно вводить тритий в соеди-
Некоторые другие примеры введения изотопов
Влияние процессов, происходящих в присутствии металлов-катализаторов
211
3H2, (COD)IrPMe2(IMes)PF6
CH2Cl2, 23°C, 19 ч
Схема 40. Условия реакции при введении трития в производное карбамоилдифенила.
3Н2, катализатор d, AZD6642, CH2Cl2, 23°С, 2 ч (выход 34%, 28.4 Ки/ммоль)
3Н2, катализатор d, производное AZD6642, CH2Cl2, 23°С, 3 ч (выход 51%, 32.4 Ки/ммоль)
Схема 41. Зависимость выхода и молярной радиоактивности AZD6642 от условий проведения реакции.
водорода с использованием иридиевых катализато-
SCH 417690 (схема 43), который является мощным
ров приведены в табл. 15.
и селективным антагонистом рецептора CCR5 и
считается перспективным для лечения ВИЧ-ин-
фекций.
III.4. Использование гомогенных рутениевых ката-
лизаторов для получения меченых соединений
В случае использования асимметрических ли-
гандов при конструировании рутениевых катализа-
Для осуществления изотопного обмена можно
торов становится возможным образование в вос-
использовать трифенилфосфиновые комплексы
рутения [89] (схема 42).
В литературе приводятся различные методики
синтеза гомогенных рутениевых катализаторов для
восстановления кетонов и иминов [149, 150]. Мож-
3HHO, диоксан,
но получить такой катализатор, например, RuPVP
140°С, 3 ч
при реакции поливинилпирролидона с хлоридом
рутения.
При использовании Ru(Ph3P)3Cl2 метку ввели в
Схема 42.
212
В. П. Шевченко и др.
Ru(PPh3)3Cl2, 3H2O
диоксан, 120°С, 3 ч
DMFA, iPr2EtN, EDC, HOBt
23°С, 12 ч
Схема 43. Синтез [3H]SCH 417690 с молярной радиоактивностью 16.4 Ки/ммоль. EDC - 1-этил-3-(3-диметилами-
нопропил)карбодиимид; HOBt - 1-гидроксибензотриазол.
RuCl[(S,S)-Tsdpen](η6-arene)
Ts = SO2C6H4-p-CH3; R = 1-CH3, 4-
Ru[(S,S)-Tsdpen](η6-arene)
CH(CH3)2,
1,3,5-(CH3)3 (мезити-
RuCl[(S,S)-Msdpen](η6-arene)
R = 4-CH(CH3)2 или 1,3,5-(CH3)3
лен) или 1,2,3,4,5,6-(CH3)6
Ms = SO2CH3, R = 4-CH(CH3)2
(мезитилен)
Схема 44. Рутениевые комплексы, используемые для асимметрического восстановления кетонов и иминов.
2 сут
Схема 45. Синтез оптически активного аналога простагландина (выход 35%, 14.7 мКи/ммоль).
становленных соединениях оптически активных
ходит восстановление кетонов и иминов, может
центров. Например, для этого использовали
служить не только 3Н2О, но и муравьиная кислота
(1R,2R)-(+)-1,2-дифенил-1,2-этандиамин и (1S,2S)-
(схема 45) [38].
(-)-1,2-дифенил-1,2-этандиамин, в которых одна из
IV. Заключение
аминогрупп связана с SO2C6H4-p-CH3 или SO2CH3.
В рутениевый комплекс также входил алкилзаме-
В обзоре приведены описанные в литературе
щенный бензол (схема 44). При использовании
механизмы включения изотопов водорода за счет
данных катализаторов оказалось возможным полу-
изотопного обмена, гидрирования и дегалогениро-
чать оптически активные спирты [151-160] и ами-
вания при использовании гетерогенных и гомоген-
ны [161-164] восстановлением соответствующих
ных катализаторов, а также различных источников
кетонов и иминов.
трития или дейтерия. Приведены современные
Источником водорода, за счет которого проис- представления о процессах, которые влияют на
Влияние процессов, происходящих в присутствии металлов-катализаторов
213
эффективность введения изотопов водорода в орга-
Изотопный обмен с тритиевой водой эффекти-
нические соединения в присутствии гетерогенных
вен, если используется около 100 Ки тритиевой
и гомогенных катализаторов.
воды с молярной радиоактивностью, близкой к
максимально возможной величине (58 Ки/ммоль).
Показано, что источниками дейтерия и трития
Обычно даже при температурах выше 100°C и про-
могут быть не только газообразные изотопы водо-
ведении реакции в течение нескольких суток ока-
рода и 2Н2О, 3Н2О, но и меченый диазометан, ук-
зывается возможным получение препарата пример-
сусная и муравьиная кислоты, R3Si2H или R3Si3H,
но с молярной радиоактивностью 40-60% относи-
3HCHO,
3HC3HO,
3HCON(СН3)2,
3HCOOCOСН3,
тельно молярной радиоактивности тритиевой во-
C3H3NН2, СН23H CН3HNН2, 3HN=N3H, N-тритио-
ды.
ацетоксифталимид, препараты на основе тритидов
металлов (алюмотритид лития, боротритид натрия
Отмечены достижения последних лет при вве-
и т.д.), а также иодистый метил и его производные
дении метки селективным гидрированием и дега-
[41].
логенированием.
Отмечено, что, как правило, при комнатной тем-
Наконец, сделана попытка привлечь особое вни-
пературе и использовании растворителей изотоп-
мание к использованию гомогенных катализато-
ный обмен между изотопами водорода и большин-
ров, применение которых позволяет получать изо-
ством насыщенных органических соединений не
топным обменом в очень мягких условиях меченые
приводит к получению меченых препаратов с мо-
препараты с высоким содержанием изотопов водо-
лекулярными радиоактивностями, которые необхо-
рода, а также использовать эти катализаторы для
димы для изучения рецепции, и данные препараты
получения оптически активных соединений.
могут применяться только в качестве маркеров.
Работа выполнена при поддержке Программы
Если введение изотопов водорода реакциями, про-
фундаментальных исследований Президиума РАН
водимыми в системе источник изотопа водорода-
«Молекулярная и клеточная биология и постгеном-
катализатор-раствор вещества, неэффективно, то
ные технологии» и Программы фундаментальных
задачу получения препаратов с высокой молярной
исследований Президиума РАН «Фундаменталь-
радиоактивностью можно решить при использова-
ные исследования для разработки биомедицинских
нии методик, исключающих применение раствори-
технологий».
телей.
К ранее предложенным механизмам [75] и моде-
Список литературы
лям [165], за счет которых осуществлялись твердо-
[1] Isin E. M., Elmore C. S., Nilsson G. N. et al. // Chem. Res.
фазные реакции, добавлен тезис о том, что спилло-
Toxicol. 2012. Vol. 25, N 3. P. 532-542.
веру водорода предшествует спилловер электро-
[2] Allen P. H., Hickey M. J., Kingston L. P., Wilkinson D. J. //
нов, которые, как известно, способны в результате
J. Label. Compd. Radiopharm. 2010. Vol. 53, N 11-12.
туннелирования перемещаться даже через слой
P. 731-738.
изолятора [80]. В результате облегчается перенос
[3] Шевченко В. П., Нагаев И. Ю., Пронина Т. С. и др. //
Докл. АН. 2018. Т. 480, N 5. C. 551-554.
катионов водорода с металла-катализатора на носи-
[4] Lockley W. J. S., McEwen A., Cooke R. // J. Label. Compd.
тель.
Radiopharm. 2012. Vol. 55, N 7. P. 235-257.
Когда поток электронов и активированных час-
[5] Lin D.-L., Chang W.-T., Kuo T. L., Liu R. H. // J. Anal.
Toxicol. 2000. Vol. 24, N 4. P. 275-280.
тиц изотопов водорода достигает вещества, нане-
[6] Atzrodt J., Derdau V. // J. Label. Compd. Radiopharm. 2010.
сенного на носитель, кластеры из сольватирован-
Vol. 53, N 11-12. P. 674-685.
ных катионов водорода и электронов начинают
[7] Parkin G. // J. Label. Compd. Radiopharm. 2007. Vol. 50,
образовываться и в пуле органического соедине-
N 11-12. P. 1088-1114.
[8] Heinekey D. M. // J. Label. Compd. Radiopharm.
2007.
ния. Разная способность сольватировать катионы
Vol. 50, N 11-12. P. 1063-1071.
водорода и электроны даже у близких по строению
[9] Quasdorf K. W., Huters A. D., Lodewyk M. W. et al. // J. Am.
соединений является обоснованным объяснением
Chem. Soc. 2012. Vol. 134, N 3. P. 1396-1399.
существенных различий в эффективности включе-
[10] Evans E. A. Tritium and Its Compounds. London: Butter-
worths. 1974. 822 p.
ния изотопов водорода в эти соединения.
[11] Hinz H. R., Harris N. J., Giovanella B. C. et al. // J. Label.
Приведены примеры получения меченых соеди-
Compd. Radiopharm. 1996. Vol. 38. N 8. P. 733-742.
нений изотопным обменом, гидрированием и дега-
[12] Samonina-Kosicka J., Kanska M. // J. Label. Compd. Radio-
pharm. 2013. Vol. 56, N 6. P. 317-320.
логенированием без и с использованием раствори-
[13] Jian Z., Ray T., Wu A., Jones L. // J. Label. Compd. Radio-
телей. Более высокие молярные радиоактивности
pharm. 2012. Vol. 55, N 2. P. 84-87.
получаются, если используется газообразный три-
[14] Kolbe A., Schneider B., Voigt B., Adam G. // J. Label. Compd.
тий.
Radiopharm. 1998. Vol. 41, N 2. P. 131-137.
214
В. П. Шевченко и др.
[15] Kanska M. // J. Radioanal. Nucl. Chem. 1988. Vol. 125, N 1.
[45] Баландин А. А. Современное состояние теории гетероген-
P. 183-188.
ного катализа. М.: Наука, 1968. 202 c.
[16] McGeady P., Croteau R. // J. Chem. Soc., Chem.Commun.
[46] Pichat L. // The Synthesis and Applications of Isotopically
1993. N 9. P. 774-776.
Labeled Compounds: Proc. Second Int. Symp. / Ed. R. R. Muc-
[17] Yavorsky P. M., Gorin E. // J. Am. Chem. Soc. 1962. Vol. 84,
cino. Kansas City, MO, 1985. P. 133-138.
N 6. P. 1071-1072.
[47] Сокольский Д. В. Оптимальные катализаторы гидрирова-
[18] Werner T. F., Olsson L.-I. // J. Label. Compd. Radiopharm.
ния в растворах. Алма-Ата: Наука КазССР. 1970. 289 c.
1987. Vol. 24, N 1. P. 29-39.
[48] Сокольский Д. В. Гидрирование в растворах. Алма-Ата:
[19] Tanga M. J., Bupp J. E., Bradford W. W. // J. Label. Compd.
Наука, 1979. 364 c.
Radiopharm. 2001. Vol. 44, N 6. P. 405-411.
[49] Шопов Д., Андреев А. Химическая связь при адсорбции
[20] Leppala E., Wahala K. // J. Label. Compd. Radiopharm.
и катализе. I. Металлы. София: Изд-во Болг. АН, 1975.
2004. Vol. 47, N 1. P. 25-30.
365 с.
[21] Томас Дж., Лемберт Р. Методы исследования ката-
[50] Попова Н. М., Бабенкова Л. В., Савельева Г. А. Адсорбция
лизаторов. М.: Мир, 1983. 304 c.
и взаимосвязь простейших газов с металлами VIII груп-
[22] Somorjai G. A. // Adv. Catal. Res. 1977. Vol. 26, N 1. P. 1-
пы. Алма-Ата: Наука, 1979. 352 c.
68.
[51] Charlot M.-F., Kahn O. // Surf. Sci. 1979. Vol. 81, N 1.
[23] Saito K., Nakamura A., Takey H., Wang B. // J. Am. Chem.
P. 90-108.
Soc. 1980. Vol. 112, N 1. P. 58-63.
[52] Lauher J. W. // J. Am. Chem. Soc. 1979. Vol. 101, N 10.
[24] Myasoedov N. F., Sidorov G. V., Kramerov V. N., Mi-
P. 2604-2607.
shin V. I. // J. Label. Compd. Radiopharm. 1999. Vol. 42, N 9.
[53] Гельд П. В., Рябов Р. А. Водород в металлах. М.: Метал-
P. 859-866.
лургия, 1974. 384 c.
[25] Myasoedov N. F. // J. Label. Compd. Radiopharm. 2007.
[54] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Хим.-
Vol. 50, N 9-10. P. 831-847.
фарм. журн. 1999. Т. 33, N 6. C. 14-27.
[26] Крамеров В. Н. Каталитические методы введения три-
[55] Shevchenko V. P., Myasoedov N. F. // Isotopes in the Physical
тиевой метки в стероидные гормоны: Дис
к.х.н. Л.:
and Biochemical Sciences. Vol. 1: Labelled Compounds.
ГИПХ, 1987. 204 c.
Part A / Eds E. Buncel, J. R. Jones. New York: Elsevier,
[27] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радио-
1987. P. 237-287.
химия. 1998. Т. 40, N 1. С. 79-83.
[56] Shevchenko V. P., Myasoedov N. F. // Isotopes in the Physical
[28] Шевченко В. П., Нагаев И. Ю., Потапова А. В., Мясо-
and Biochemical Sciences. Vol. 1: Labelled Compounds. Part
едов Н. Ф. // Радиохимия. 1998. T. 40, N 1. C. 70-74.
B / Eds E. Buncel, J. R. Jones. New York: Elsevier, 1991.
[29]Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радиохи-
P. 179-231.
мия. 1999. Т. 41, N 6. C. 531-532.
[57] Шевченко В. П., Мясоедов Н. Ф., Безуглов В. В., Бергель-
[30] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радиохи-
сон Л. Д. // Химия природ. соединений. 1980. N 2. С. 148-
мия. 1999. Т. 41, N 1. С. 82-85.
157.
[31] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радиохи-
[58] Садовская В. Л., Ракитин Л. Ю., Гришина И. И. и др. //
мия. 2012. Т. 54, N 1. С. 75-81.
Биоорган. химия. 1990. Т. 16, N 10. С. 1407-1412.
[32] Shevchenko V. P., Nagaev I. Yu., Myasoedov N. F., Susan A.
[59] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Успехи
Sixth Int. Symp. «The Synthesis and Applications of Isotopes
химии. 1999. Т. 68, N 10. C. 944-966.
and Isotopically Labeled Compounds (ISSAIILC6)»: Ab-
[60] Макквиллин Ф. Дж. Гомогенное гидрирование в органи-
stracts. Philadelphia, Pennsylvania, 1997. P. 73.
ческой химии. М: Химия, 1980. 161 c.
[33] Hanzlik R. P., Wiley R. A., Gillesse T. J. // J. Label. Compd.
[61] Калинин В. Н., Мельник О. А., Сахарова А. А. и др. // Изв.
Radiopharm. 1979. Vol. 16, N 4. P. 523-529.
АН СССР. Сер. хим. 1985. N 11. С. 2442-2447.
[34] Magatti C. V., Hesk D., Lauzon M. J. et al. // J. Label.
[62] Lockley W. J. S. // J. Label. Compd. Radiopharm.
2010.
Compd. Radiopharm. 1998. Vol. 41, N 8. P. 731-739.
Vol. 53, N 5-6. P. 227-230.
[35] Kingston L. P., Lockley W. J. S., Mather A. N., Wilkin-
[63] Zaera F. // Catal. Lett. 2003. Vol. 91, N 1-2. P. 1-10.
son D. J. // Synthesis and Applications of Isotopically La-
[64] Brandt B., Fischer J.-H., Ludwig W. et al. // J. Phys. Chem. C.
beled Compounds / Eds U. Pleiss, R. Voges. Chichester:
2008. Vol. 112, N 30. P. 11408-11420.
Wiley, 2001. Vol. 7. P. 105-108.
[65] Doyle A. M., Shaikhutdinov Sh. K., Freund H.-J. // J. Catal.
[36] Kessar S. V. // Pure Appl. Chem. 1990. Vol. 62, N 7. P. 1397-
2004. Vol. 223. P. 444-453.
1400.
[66] Brundish D. E., Combe M. G., Wade R. // J. Label. Compd.
[37] Brook A. G. // Acc. Chem. Res. 1974. Vol. 7, N 3. P. 77-84.
Radiopharm. 1983. Vol. 20, N 7. P. 869-886.
[38] Arns S., Moreau A., Young R. N. // J. Label. Compd. Radio-
[67] Long M. A., Morimoto H., Williams P. G. // J. Label. Compd.
pharm. 2010. Vol. 53, N 4. P. 205-207.
Radiopharm. 1995. Vol. 36, N 11. P. 1037-1049.
[39] Andres H. // Seventh Int. Symp. «The Synthesis and Applica-
[68] Chappelle M. R., Morgan A. D. // J. Label. Compd. Radio-
tions of Isotopes and Isotopically Labelled Compounds»:
pharm. 2004. Vol. 47, N 5. P. 317.
Abstracts. Dresden (Germany), 2000. P. 29.
[69] Petros R. A., Shah J. // J. Label. Compd. Radiopharm. 2014.
[40] Hong Y., Bonacorsi S. J. jr., Tian Y. et al. // J. Label. Compd.
Vol. 57, N 1. P. 53-56.
Radiopharm. 2008. Vol. 51, N 2. P. 113-117.
[70] Нагаев И. Ю., Шевченко В. П., Мясоедов Н. Ф. // Радио-
[41] Voges R., Heys J. R., Moenius T. Preparation of Compounds
химия. 1999. Т. 41, N 4. C. 289-299.
Labeled with Tritium and Carbon-14. Wiley, 2009. 682 p.
[71] Шевченко В. П. Синтез и исследование изотопномодифи-
[42] Bartok M., Czombos J. Stereochemistry of Heterogeneous
цированных липидов и их аналогов: Автореф. дис
Metal Catalysis. Chichester: Wiley, 1985. 632 p.
д.х.н. M.: ИМГ РАН, 1992. 49 с.
[43] Sedlacek J., Wells P. B. // Adv. Catal. 1973. Vol. 23, N 1. P.
[72] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радио-
123-155.
химия. 1993. Т. 35, N 4. C. 106-109.
[44] Иоффе И. И., Решетов В. А., Добротворский А. М. Гете-
[73] Шевченко В. П., Фараджева С. В., Нагаев И. Ю., Мясо-
рогенный катализ. Л.: Химия, 1985. 224 c.
едов Н. Ф. // Радиохимия. 1998. T. 40, N 1. C. 84-88.
Влияние процессов, происходящих в присутствии металлов-катализаторов
215
[74] Шевченко В. П., Нагаев И. Ю., Потапова А. В., Мясо-
[106] Huda A. P. J. Tritium Labelling of Phospholipids Applied in
едов Н. Ф. // Радиохимия. 1995. Т. 37, N 3. С. 265-269.
Lecithin Aggregates. Univ. of Copenhagen, Faculty of Life
[75] Розанов В. В., Крылов О. В. // Успехи химии. 1997. T. 66,
Sciences, 2009.
N 2. C. 117-130.
[107] Ho J. Z., Zhang A. S., Tang Y. S. et al. // J. Label. Compd.
[76] Prins R. // Chem. Rev. 2012. Vol. 112, N 5. P. 2714-2738.
Radiopharm. 2010. Vol. 53, N 5-6. P. 433-435.
[77] Prins R., Palfi V. K., Reiher M. // J. Phys. Chem. C. 2012.
[108] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. и др. //
Vol. 116, N 27. P. 14274-14283.
Радиохимия. 2000. Т. 42, N 2. C. 176-179.
[78] Bell R. P. The Tunnel Effect in Chemistry. London; New
[109] Шевченко В. П., Нагаев И. Ю., Потапова А. В., Мясо-
York: Chapman and Hall, 1980. 222 p.
едов Н. Ф. // Радиохимия. 1994. Т. 36, N 5. С. 445-449.
[79] Compton R. G. Electron Tunneling in Chemistry: Vol. 30 of
[110] Вейганд-Хильгетаг. Методы эксперимента в органиче-
Comprehensive Chemical Kinetics. New York: Elsevier,
ской химии. М.: Химия. 1968. 944 c.
1989. 374 p.
[111] Andre T., Ullberg S. // J. Am. Chem. Soc. 1957. Vol. 79,
[80] Prasittichai C., Avila J. R., Farha O. K., Hupp J. T. // J. Am.
N 2. P. 494-495.
Chem. Soc. 2013. Vol. 135, N 44. P. 16328-16331.
[112] Gut M., Uskovic M. // J. Org. Chem. 1962. Vol. 25, N 5.
[81] De Keczer S. A., Lane T. S., Voronin T., Masjedizadeh M.
P. 792-796.
R. // J. Label. Compd. Radiopharm. 2005. Vol. 48, N 14.
[113] Elbert T., Patil M. R., Marek A. // J. Label. Compd. Radio-
P. 1013-1023.
pharm. 2017. Vol. 60, N 3. P. 176-182.
[82] Archer W. J., Cook R., Taylor R. // J. Chem. Soc., Perkin
[114] Marek A., Klepetarova B., Elbert T. // Tetrahedron. 2015.
Trans. 2. 1983. N 6. P. 813-819.
Vol. 71, N 29. P. 4874-4882.
[83] Ciszewska G., Pfefferkorn H., Tang Y. S. et al. // J. Label.
[115] Allen P., Bragg R. A., Caffrey M. et al. // J. Label. Compd.
Compd. Radiopharm. 1997. Vol. 39, N 8. P. 651-668.
Radiopharm. 2017. Vol. 60, N 2. P. 124-129.
[84] Henot F., Thellend A., Pillon F. et al. // J. Label. Compd.
[116] Hickey M. J., Allen P. H., Caffrey M. et al. // J. Label.
Radiopharm. 1996. Vol. 38, N 6. P. 579-583.
Compd. Radiopharm. 2016. Vol. 59, N 11. P. 432-438.
[85] Scheigetz J., Berthelette C., Li C., Zamboni R. J. // J. Label.
[117] Bertrand R., Hamp I., Bronstrup M. et al. // J. Label.
Compd. Radiopharm. 2004. Vol. 47, N 12. P. 881-889.
Compd. Radiopharm. 2016. Vol. 59, N 14. P. 604-610.
[86] Pajak M., Kanska M. // J. Label. Compd. Radiopharm. 2006.
[118] Tang Y. S., Liu W., Braun M. P., Ho J. Z. // J. Label. Compd.
Vol. 49, N 12. P. 1061-1067.
Radiopharm. 2010. Vol. 53, N 5-6. P. 441-442.
[87] Борисов Ю. А., Золотарев Ю. А. // ЖФХ. 2002. Т. 76.
[119] Christensen J., Natt F., Hunziker J. et al. // J. Label. Compd.
С. 734-738.
Radiopharm. 2012. Vol. 55, N 6. P. 189-196.
[88] Somorjai G. A. Chemistry in Two Dimensions. Surfaces.
[120] Rauh J. J., Lahm G. P., Pahutski T. F. et al. // J. Label.
Ithaca: Cornell Univ. Press, 1981. 575 p.
Compd. Radiopharm. 2010. Vol. 53, N 1. P. 51-52.
[89] Lockley W. J. S., Hesk D. // J. Label. Compd. Radiopharm.
[121] Malmquist J., Bernlind A., Johansson M. et al. // J. Label.
2010. Vol. 53, N 11-12. P. 704-715.
Compd. Radiopharm. 2012. Vol. 55, N 10. P. 393-399.
[90] Sajiki H., Hattori K., Aoki F. et al. // Synlett.
2002.
[122] Lamb P. B., McElhinny C. J., Sninski T. et al. // J. Label.
Vol. 2002, N 7. P. 1149-1151.
Compd. Radiopharm. 2009. Vol. 52, N 11. P. 457-462.
[91] Sajiki H., Aoki F., Esaki H. et al. // Org. Lett. 2004. Vol. 6,
[123] Allen P., Coissard V., Wilkinson D. J. et al. // J. Label.
N 9. P. 1485-1487.
Compd. Radiopharm. 2009. Vol. 52, N 6. P. 214-215.
[92] Esaki H., Ito N., Sakai Sh. et al. // Tetrahedron.
2006.
[124] Damont A., Garcia-Argote S., Buisson D.-A. et al. // J. La-
Vol. 62, N 47. P. 10954-10961.
bel. Compd. Radiopharm. 2015. Vol. 58, N 1. P. 1-6.
[93] Maegawa T., Fujiwara Y., Inagaki Y. et al. // Angew. Chem.
[125] Postolache C., Matei L. // J. Label. Compd. Radiopharm.
Int. Ed. 2008. Vol. 47, N 29. P. 5394-5397.
2010. Vol. 53, N 5-6. P. 459-461.
[94] Heys J. R. // J. Label. Compd. Radiopharm. 2010. Vol. 53,
[126] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радио-
N 11-12. P. 716-721.
химия. 2002. T. 44, N 4. С. 346-348.
[95] Hesk D., Borges S., Dumpit R. et al. // J. Label. Compd.
[127] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. и др. //
Radiopharm. 2015. Vol. 58, N 2. P. 36-41.
Биоорган. химия. 2002. Т. 28, N 3. С. 258-260.
[96] Hesk D., Lavey C. F., McNamara P. // J. Label. Compd.
[128] Bragg R. A., Bushby N., Ericsson C. et al. // J. Label.
Radiopharm. 2010. Vol. 53, N 11-12. P. 722-730.
Compd. Radiopharm. 2016. Vol. 59, N 11. P. 454-461.
[97] Filer C. N. // J. Label. Compd. Radiopharm. 2010. Vol. 53,
[129] Boykin D. W. jr., Patel A. R., Lutz R. E. // J. Med. Chem.
N 11-12. P. 739-744.
1968. Vol. 11, N 2. P. 273-277.
[98] Modutlwa N., Maegawa T., Monguchi Y., Sajiki H. // J. La-
[130] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Радио-
bel. Compd. Radiopharm. 2010. Vol. 53, N 11-12. P. 686-
химия. 2002. T. 44, N 1. C. 72-77.
692.
[131] Cerny B., Jegorov A., Polivkova J. et al. // J. Label. Compd.
[99] Некрасова Ю. Н., Золотарев Ю. А., Наволоцкая Е. В. //
Radiopharm. 1998. Vol. 41, N 4. P. 267-272.
Биохимия. 2011. Т. 76, N 12. С. 1659-1664.
[132] Tang Y. S., Ho J. Z. // J. Label. Compd. Radiopharm. 2010.
[100] Rhee S.-W., Ryan K. J., Tanga M. J. // J. Label. Compd.
Vol. 53, N 5-6. P. 437-440.
Radiopharm. 2011. Vol. 54, N 7. P. 367-370.
[133] Lavey C. F., Hesk D., Borges S. et al. // J. Label. Compd.
[101] Filer C. N. // J. Label. Compd. Radiopharm. 2017. Vol. 60,
Radiopharm. 2010. Vol. 53, N 5-6. P. 368-371.
N 2. P. 96-109.
[134] Shu A. Y. L., Heys J. R. // Proc. Sixth Int. Symp. «The Syn-
[102] Myasoedov N. F. // J. Label. Compd. Radiopharm. 1993.
thesis and Applications of Isotopes and Isotopically Labeled
Vol. 33, N 5. P. 391-401.
Compounds (ISSAIILC6)» / Eds J. R. Heys, D. G. Melillo.
[103] Shevchenko V. P., Myasoedov N. F. // J. Label. Compd. Ra-
Philadelphia, Pennsylvania, 1997. P. 223-226.
diopharm. 1982. Vol. 19, N 1. P. 95-109.
[135] Devlin J., Kerr W. J., Lindsay D. M. et al. // Molecules.
[104] Шевченко В. П., Мясоедов Н. Ф., Бергельсон Л. Д. // Био-
2015. Vol. 20, N 7. P. 11676-11698.
орган. химия. 1979. Т. 5, N 5. C. 730-734.
[136] Kerr W. J., Reid M., Tuttle T. // ACS Catal. 2015. Vol. 5,
[105] Shevchenko V. P., Nagayev I. Yu., Myasoedov N. F. //
N 1. P. 402-410.
J. Label. Compd. Radiopharm.
1989. Vol.
27, N
10.
[137] Kerr W. J., Mudd R. J., Owens P. K. et al. // J. Label.
P. 1195-1214.
Compd. Radiopharm. 2016. Vol. 59, N 14. P. 601-603.
216
В. П. Шевченко и др.
[138] Lockley W. J. S. // J. Label. Compd. Radiopharm. 2010.
Int. Ed. Engl. 1997. Vol. 36. Р. 285-288.
Vol. 53, N 11-12. P. 668-673.
[152] Yamakawa M., Ito H., Noyori R. // J. Am. Chem. Soc. 2000.
[139] Nilsson G. N., Kerr W. J. // J. Label. Compd. Radiopharm.
Vol. 122, N 7. P. 1466-1478.
2010. Vol. 53, N 11-12. P. 662-667.
[153] Murata K., Okano K., Miyagi M. et al. // Org. Lett. 1999.
[140] Simonsson R., Stenhagen G., Ericsson C., Elmore C. S. //
Vol. 1, N 7. P. 1119-1121.
J. Label. Compd. Radiopharm. 2013. Vol. 56, N 6. P. 334-
[154] Hashiguchi S., Fujii A., Haack K.-J. et al. // Angew. Chem.
337.
Int. Ed. Engl. 1997. Vol. 36. Р. 288-290.
[141] Brown J. A., Cochrane A. R., Irvine S. et al. // Adv. Synth.
[155] Kanada R. M., Ogasawara K. // Chem. Commun. 1998.
Catal. 2014. Vol. 356, N 17. P. 3551-3562.
N 16. P. 1755-1756.
[142] Parmentier M., Hartung T., Pfaltz A., Muri D. // Chem. Eur.
[156] Hashiguchi S., Fujii A., Takehara J. et al. // J. Am. Chem.
J. 2014. Vol. 20, N 36. P. 11496-11504.
Soc. 1995. Vol. 117, N 28. P. 7562-7563.
[143] Herbert J. M. // J. Label. Compd. Radiopharm.
2010.
[157] Fujii A., Hashiguchi S., Uematsu N. et al. // J. Am. Chem.
Vol. 53, N 11-12. P. 658-661.
Soc. 1996. Vol. 118, N 10. P. 2521-2522.
[144] Marek A., Pedersen M. H. F., Vogensen S. B. et al. // J. La-
[158] Matsumura K., Hashiguchi S., Ikariya T., Noyori R. // J. Am.
bel. Compd. Radiopharm. 2016. Vol. 59, N 12. P. 476-483.
Chem. Soc. 1997. Vol. 119, N 37. P. 8738-8739.
[145] Atzrodt J., Derdau V., Kerr W. J. et al. //Tetrahedron. 2015.
[159] Okano K., Murata K., Ikariya T. // Tetrahedron Lett. 2000.
Vol. 71, N 13. P. 1924-1929.
Vol. 41, N 48. P. 9277-9280.
[146] Chappelle M. R., Hawes C. R. // J. Label. Compd. Radio-
[160] Koike T., Murata K., Ikariya T. // Org. Lett. 2000. Vol. 2,
pharm. 2010. Vol. 53, N 11-12. P. 745-751.
N 24. P. 3833-3836.
[147] Neumann K. T., Lindhardt A. T., Bang-Andersen B.,
[161] Noyori R., Hashiguchi S. // Acc. Chem. Res. 1997. Vol. 30,
Skrydstrup T.
// J. Label. Compd. Radiopharm.
2017.
N 2. P. 97-102.
Vol. 60, N 1. P. 30-35.
[162] Palmer M. J., Wills M. // Tetrahedron: Asymmetry. 1999.
[148] Lindelof A., Ericsson C., Simonsson R. et al. // J. Label.
Vol. 10, N 11. P. 2045-2061.
Compd. Radiopharm. 2016. Vol. 59, N 9. P. 340-345.
[163] Uematsu N., Fujii A., Hashiguchi S. et al. // J. Am. Chem.
[149] Pieters G., Taglang C., Bonnefille E. et al. // Angew. Chem.
Soc. 1996. Vol. 118, N 20. P. 4916-4917.
2014. Bd 126, Hf. 1. S. 234-238.
[164] Soni R., Cheung F. K., Clarkson G. C. et al. // Org. Biomol.
[150] Nath B. K., Ganguli J. N. // Asian J. Sci. Technol. 2014.
Chem. 2011. N 9. P. 3290-3294.
Vol. 5, N 3. Р. 238-240.
[165] Шевченко В. П., Нагаев И. Ю., Мясоедов Н. Ф. // Успехи
[151] Haack K.-J., Hashiguchi S., Fujii A. et al. // Angew. Chem.
химии. 2003. Т. 72, N 5. С. 471-497.