244
Радиохимия, 2019, т. 61, N 3, c. 244-250
Динамика сорбции-десорбции терапевтического α-эмиттера 223Ra
на гранулированном гидроксиапатите
© А. В. Северин*а, А. Н. Васильева,б, А. В. Гопина, И. Э. Власоваа, Е. В. Черныха
а Химический факультет Московского государственного университет им. М. В. Ломоносова, 119991, Москва,
Ленинские горы, д. 1, стр. 3; * e-mail: severin@radio.chem.msu.ru
б Институт ядерных исследований РАН, 108840, Москва, Троицк, ул. Физическая, вл. 27
Получена 06.06.2018, после доработки 26.11.2018, принята к публикации 27.11.2018
УДК 539.163; 544.034.54
Методом α-трековой радиографии исследована динамика распределения 223Ra в объеме сферических
частиц гидроксиапатита (ГАП) в процессе его сорбции на частицы сорбента из водных растворов и де-
сорбции. Подобрано оптимальное время контакта препарата с детектором (экспозиция) и предложена
методика приготовления экспериментальных образцов. С учетом плотности материала пористого сор-
бента оценены пробеги испускаемых 223Ra и его дочерними продуктами α-частиц и ядер отдачи. Усред-
ненный эффективный пробег α-частицы в материале ГАП составил ~35 мкм. На основании полученных
параметров разработана математическая модель диффузии Ra в глубь пористого сорбента с учетом его
сорбции. Оценен эффективный коэффициент диффузии, равный ~3·10-5 см2/с. Показана связь между
размерами частиц сорбента, временем сорбции на него радионуклида и создаваемой этой частицей по-
глощенной дозой в биологической ткани.
Ключевые слова: ядерная медицина, радий, гидроксиапатит, α-трековая радиография.
DOI: 10.1134/S0033831119030079
Развитие ядерной медицины связано как с созда-
Ca и Ra, а область применения ограничивается кост-
нием новых радиофармацевтических лекарственных
ными метастазами различных типов рака.
препаратов (РФЛП) на основе перспективных диагно-
Проводится направленный поиск альтернативного
стических и терапевтических радионуклидов, так и с
способа доставки и удерживания радионуклида в мес-
совершенствованием методов доставки и функциони-
те проведения терапии: инкорпорирование радия в
рования РФЛП в живом организме. Для разработки
липосомы [8, 9], нано- и микрочастицы наноцеолитов
РФЛП необходимы подходящие с точки зрения ядер-
[10, 11], фосфата лантана [12], карбоната кальция [13].
но-физических и химических характеристик α- и
Идея совмещения Ra и гидроксиапатита не являет-
β-эмиттеры, а также их носители. Все чаще в качестве
ся оригинальной [14-16]. Авторами работы [15] и в
носителей предлагаются неорганические нано- и мик-
нашей работе [16] исследованы закономерности сорб-
рочастицы [1]. Среди таких частиц гидроксиапатит
ции Ra на ГАП, в том числе сделаны попытки ввести
(ГАП, неорганический матрикс костной ткани) пред-
223Ra во время синтеза самого ГАП. В работе [16] на-
ставляется одним из наиболее многообещающих, по-
ми были определены оптимальные условия для про-
скольку является биосовместимым, биорезобируе-
ведения мечения с выходом 98%: соотношение жид-
мым и часто биоактивным препаратом, давно и ус-
кой и твердой фаз, время контакта, pH раствора. Ус-
пешно применяемым в медицинской практике [2], в
тановлено, что в результате отжига меченых частиц
том числе он предлагается и как носитель радионук-
ГАП вымывание 223Ra in vitro не превышает 5%. При
лидов для ядерной медицины [3-5]. ГАП часто ис-
создании РФЛП важно не только знать интегральные
пользуют в качестве модельной системы при иссле-
значения сорбции-десорбции радионуклида с носите-
довании РФЛП для диагностики или лечения заболе-
ля, но и детально изучить динамику распределения
ваний скелета, а также в радиосиновэктомии - методе
Ra в объеме пористого сорбента при сорбции и де-
лечения хронических воспалительных заболеваний
сорбции. Это необходимо для расчета получаемой
суставов, когда радиоактивные золи и суспензии вво-
организмом поглощенной дозы и соответственно не-
дятся непосредственно в сустав. В качестве терапев-
обходимой активности радионуклида, вводимого для
тического α-эмиттера перспективным является ис-
терапевтических целей. Одним из наиболее информа-
пользование 223Ra, препарат Xofigo® (Bayer) на осно-
тивных методов, который может помочь решить дан-
ве которого уже используется для терапии онкологи-
ную задачу, является метод α-трековой радиографии.
ческих заболеваний [6, 7]. Это первый и на данный
момент единственный РФЛП на основе α-эмиттера,
α-Трековая радиография основана на способности
одобренный Управлением по санитарному надзору за
диэлектриков регистрировать следы заряженных час-
качеством пищевых продуктов и медикаментов США
тиц, включая α-частицы, с пространственным разре-
(US Food and Drug Administration, USFDA). Xofigo
шением [17]. α-Трековая радиография позволяет уста-
представляет собой раствор RaCl2, его действие осно-
новить число α-частиц, испущенных исследуемым
вано на подобии биохимического поведения ионов
источником в плоскость трекового детектора, просле-
Динамика сорбции-десорбции терапевтического α-эмиттера 223Ra
245
дить направление трека α-частицы и оценить ее энер-
Оптимальные условия проведения сорбционных
гию [18]. Для получения наиболее информативного
экспериментов (рН, соотношение массы сорбента и
изображения треков α-частиц используется поликар-
объема раствора) были предварительно определены
бонатный α-трековый детектор типа CR-39, обладаю-
в предыдущей работе [16]. Образцы сорбента полу-
щий лучшими характеристиками по пространствен-
чали путем предварительного отбора сферических
ному разрешению и по разрешению по энергии [19.
гранул ГАП одинакового размера (диаметр сфер
20]. Принципиальная возможность использования
900-1000 мкм). Навеску сорбента (~10 мг, или
данного метода для препаратов ГАП-223Ra была так-
19 сферических гранул) помещали в пластиковую
же продемонстрирована нами ранее [16].
пробирку Эппендорфа объемом 1.5 мл, после этого
Таким образом, целью данного исследования яв-
смачивали сорбент дистиллированной водой и пере-
лялась визуализация динамики проникновения ра-
мешивали в течение 1 сут для удаления воздуха из
дионуклида 223Ra в глубь пористых гранул ГАП и его
внутреннего свободного объема пор. После этого
перераспределения в процессах сорбции-десорбции,
вносили в пробирки по 1 мл активного раствора Ra
а также оценка эффективного коэффициента диффу-
(100 мкл раствора 223RaCl2 и 900 мкл H2O) с удель-
зии 223Ra и продуктов его распада, пробега α-частиц,
ной радиоактивностью около 10 кБк/мл. Пробирки
образующихся в цепочке распада 223Ra в различных
встряхивали в течение необходимого времени на
материалах, для дальнейшего расчета мощности по-
вортексе REAXtop (Heidolf, Германия). Время сорб-
глощенной дозы, создаваемой вблизи микрочастицы
ции составляло 1, 5, 15, 30, 60, 180 и 1440 мин. Затем
ГАП.
фазы разделяли центрифугированием (центрифуга
Allegra 64R, Beckman Coulter, США) и порцию рас-
Экспериментальная часть
твора (0.75 мл) измеряли на γ-спектрометре. По раз-
нице удельных активностей рассчитывали долю ра-
Радионуклид 223Ra получали путем облучения
дионуклида, ушедшего в твердую фазу, и строили
мишени из природного Th протонами средних энер-
кинетическую кривую сорбции. Оставшиеся грану-
гий (120-90 МэВ) в Институте ядерных исследова-
лы отделяли от раствора сорбата, промывали 2 раза
ний РАН (г. Троицк), выделяли и очищали в виде
этанолом и высушивали в пробирке Эппендорфа или
солянокислого раствора по известной методике [21].
на фильтровальной бумаге на воздухе. После этого
Непосредственно перед экспериментом по сорбции
разрезали гранулы (по 10 сферических частиц на
раствор нейтрализовали раствором 0.1 моль/л NaOH
1 точку по времени) пополам с помощью специаль-
до рН ~ 5-7.
ного микротома и половинки помещали на плоскую
Активность проб раствора определяли на γ-спек-
подложку на двусторонний скотч сколом или округ-
трометре с полупроводниковым γ-детектором из
лой поверхностью гранулы вверх.
сверхчистого германия GR3818 (Canberra, США).
Трековую радиографию проводили на детекторе,
γ-Спектры обрабатывали с помощью программного
представляющем собой специальную полимерную
обеспечения Genie 2000 (Canberra). Активность 223Ra
подложку из полиаллилдигликолькарбоната CR-39
рассчитывали по пику с энергией 154 кэВ [22].
(TASTRAK®, Великобритания). Детектор помещали
Наночастицы ГАП получали в соответствии с
сверху на образцы и выдерживали в течение време-
методикой, описанной ранее в нашей работе [23]. В
ни экспонирования, которое подбирали опытным
типичном эксперименте раствор 3.1 моль/л H3PO4
путем. Затем детектор промывали дистиллирован-
вводили с контролируемой скоростью в термостати-
ной водой и протравливали в растворе 6.25 моль/л
руемый реактор (298 К), заполненный перемешивае-
NaOH в течение 4 ч при 80°С, снова промывали дис-
мой суспензией 16 мг/мл Ca(OH)2
до рН 6.5-7.0.
тиллированной водой и сушили на воздухе. Для по-
Концентрации реагентов выбирали так, чтобы полу-
лучения изображения ямок травления треков α-час-
чить 5%-ную суспензию продукта. После окончания
тиц использовали оптический микроскоп Olympus
добавления кислоты реакционную смесь перемеши-
BX-51 с цифровой камерой Е-330. Полученные фо-
вали в течение 2 ч.
тографии анализировали с помощью программы Im-
Гранулированный гидроксиапатит получали в ре-
ageScope M. При подсчете числа распадов на опре-
деленном расстоянии от центра гранулы учитывали
зультате механостимулированного морфологического
только те треки, которые были направлены перпен-
отбора при кипячении суспензии ГАП по нашей мето-
дикулярно плоскости пластины детектора (в проек-
дике, подробно описанной в работе [24]. Морфологию
ции на плоскость детектора они образуют правиль-
полученных сферических частиц ГАП характеризова-
ные окружности).
ли с помощью сканирующей электронной микроско-
пии (СЭМ, прибор CamScan, Япония, разрешение 5
Эксперименты по десорбции Ra проводили ана-
нм). Удельную свободную поверхность сухих препа-
логичным образом, при этом в пробирки Эппендор-
ратов определяли методом ртутной порометрии на
фа добавляли по 19 сфер ГАП (10 мг), 150 мкл рас-
приборе Porosimeter 2000 (Германия).
твора 223RaCl2 и 850 мкл H2O, сорбцию проводили в
246
А. В. Северин и др.
течение 24 ч. После этого удаляли раствор и выще-
10 мм
лачивали Ra 1 мл 0.9%-ного раствора NaCl. Даль-
нейшая методика работы была аналогична методике
проведения сорбционных экспериментов, описан-
ных выше.
Все опыты проводили при 22 ± 2°С.
Результаты и обсуждение
Используемые в работе гранулы ГАП представля-
300 мкм
ют собой частицы сферической формы с достаточно
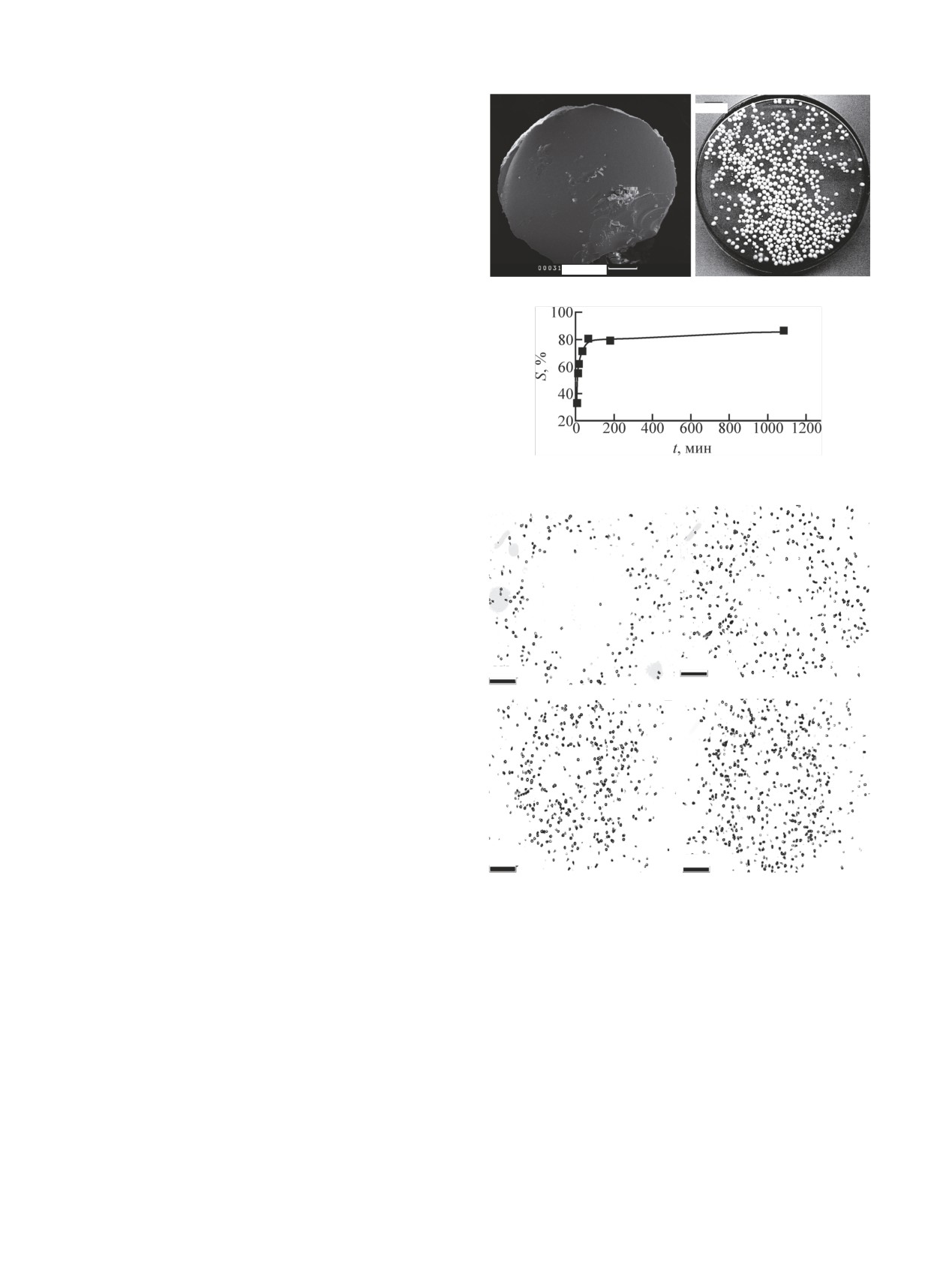
Рис. 1. Гранулы ГАП в СЭМ (а) и оптическом микроскопе (б).
плотной и однородной внутренней текстурой (рис. 1).
В работе использовали частицы с диаметром 900-
1000 мкм, который нам представляется оптимальным
для проведения авторадиографической визуализации
сорбции радия. По данным ртутной порометрии час-
тицы имеют свободную удельную поверхность 72 м2/г
и пористость около 60%.
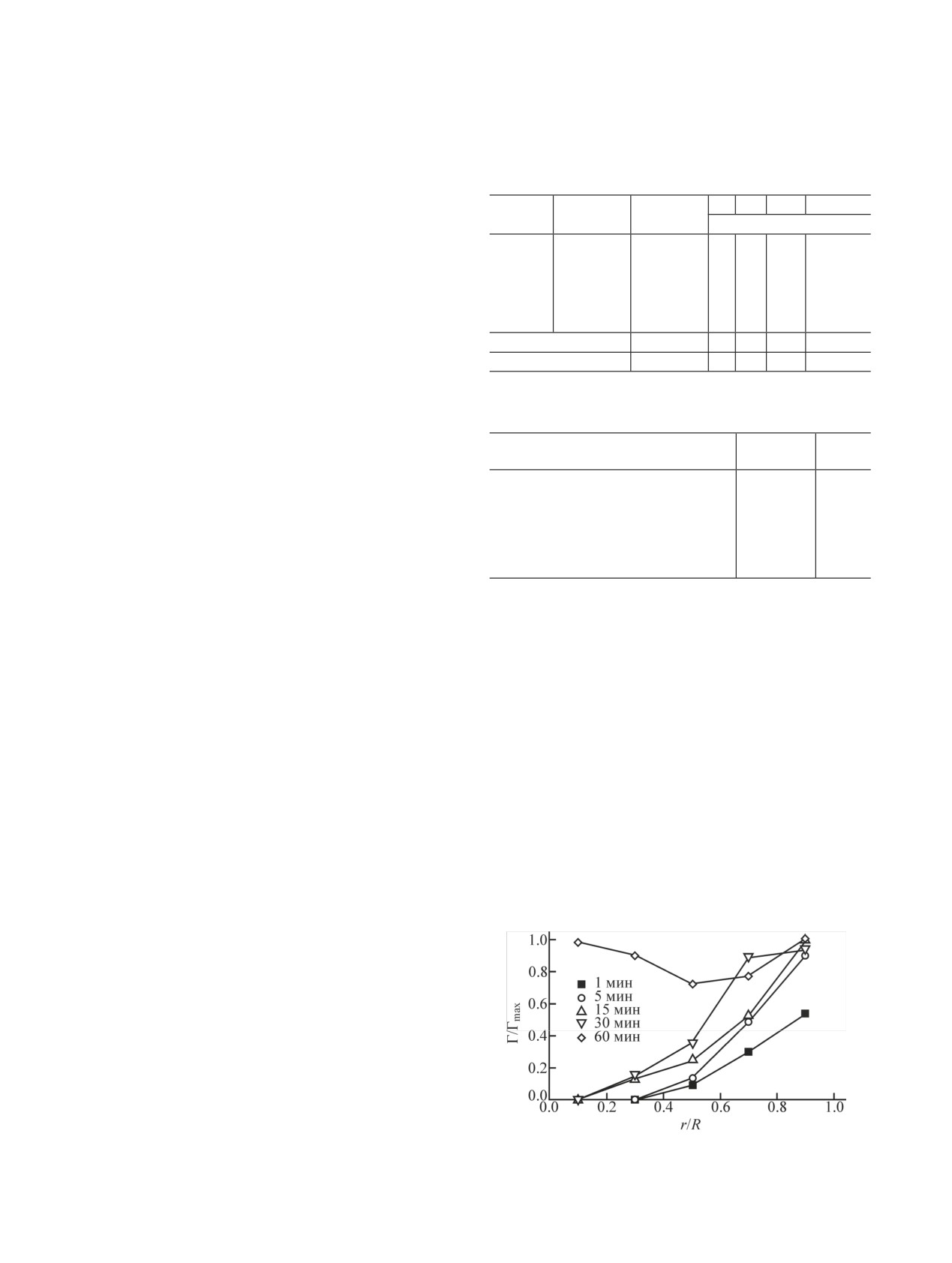
Кинетика сорбции 223Ra представлена на рис. 2.
Сорбционное равновесие в системе устанавливается
Рис. 2. Кинетика сорбции 223Ra на сферическом ГАП. m(ГАП) =
за 60-80 мин.
10 мг, d = 0.5-2.0 мм, 1 мл раствора, pH 6-7.
Анализ результатов трековой радиографии образ-
б
а
цов ГАП после сорбции 223Ra проводили при различ-
ном времени экспонирования детектора - 1 и 24 ч.
При времени экспонирования 24 ч плотность треков
оказалась слишком велика, многие треки перекрыва-
лись. Это обстоятельство очень затрудняет их даль-
нейший подсчет. В результате было выбрано время
экспонирования 1 ч, которое обеспечивает макси-
мально возможное количество различимых индиви-
200 мкм
200 мкм
дуальных треков.
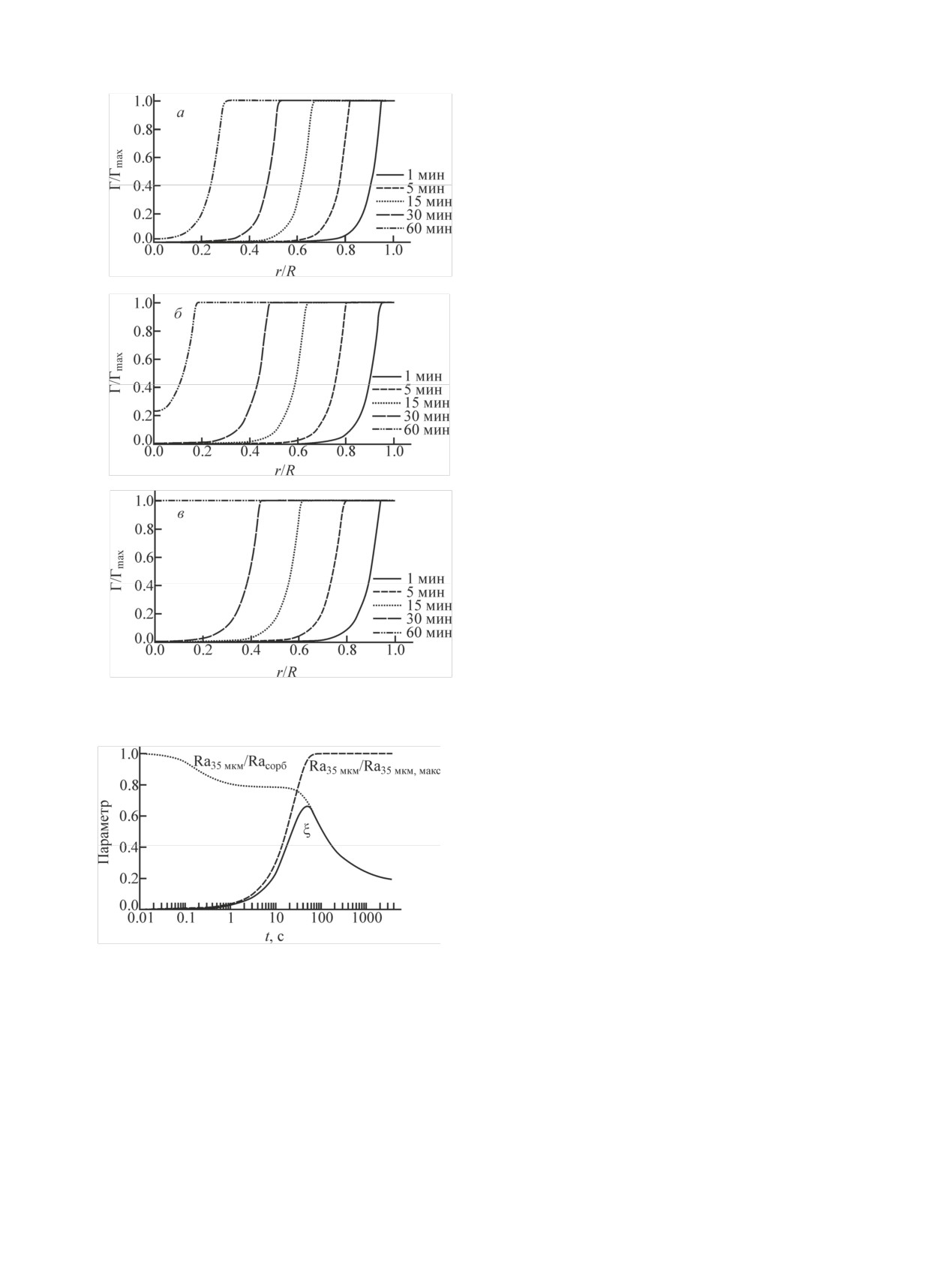
В процессе сорбции наблюдается существенное
в
г
изменение положения и количества α-треков на сколе
гранул. Происходит их перераспределение от пери-
ферии частицы к ее центру (рис. 3). Полученные дан-
ные по десорбции, которая составляла около 20% от
введенной активности, показали, что данный процесс
происходит равномерно по всей глубине гранулы
ГАП.
200 мкм
200 мкм
Основными задачами исследования в данной ра-
боте, кроме тестирования авторадиографической ме-
Рис. 3. α-Трековые изображения поперечного сечения гранул
тодики, являлись определение пробега α-частиц 223Ra
ГАП после диффузии 223Ra в глубь гранул ГАП при различном
времени контакта: а - 5 мин, б - 30 мин, в - 3 ч, г - 24 ч. Время
в материале сорбента, а также оценочный расчет эф-
экспонирования α-трековых детекторов на гранулах ГАП 1 ч.
фективного коэффициента диффузии Ra и продуктов
его распада в глубь пористой гранулы ГАП. Кроме
уменьшается до 15% и вещество теряет кристаллиза-
того, было оценено влияние времени мечения ГАП на
ционную воду. Предполагаем, что поры распределе-
величину создаваемой полученным препаратом эф-
ны равномерно по объему гранулы и заполнены во-
фективной поглощенной дозы.
дой. Тогда для определения пробега α-частиц вос-
Для того чтобы определить влияние распределения
пользуемся формулами [25]
223Ra в макросферах ГАП на создаваемую дозу, необ-
1/RHAP+aq = 1/RHAP + 1/Raq,
(1)
ходимо рассчитать пробег α-частиц в гидроксиапати-
1/RHAP = ωCa/RCa + ωO/RO + ωP/RP + ωH/RH,
(2)
те. ГАП при стехиометрическом составе Ca10(PO4)6·
1/Raq = ωO/RO + ωH/RH,
(3)
(OH)2·3H2O имеет кристаллографическую плотность
3.14 г/см3, сферы ГАП обладают 60%-ной пористо-
Rz = Rair[(0.90 + 0.0275Z) + (0.06 - 0.086Z)ln(E/4)],
(4)
стью. В результате отжига при 900°С пористость
Rair = 0.381E3/2[-b ± (b2 - 4ac)1/2]/(2a),
(5)
Динамика сорбции-десорбции терапевтического α-эмиттера 223Ra
247
где Rz - пробег α-частиц в среде (отдельных элемен-
Таблица 1. Средняя энергия и пробег в воде, биологиче-
тах или в сложном веществе: HAP - гидроксиапатит,
ской ткани и гидроксиапатите α-частиц 223Ra и продук-
тов его распада [RHAP(900) - пробег α-частиц в сфероидах
aq - вода, HAP+aq - ГАП с порами, заполненными
гидроксиапатита, отожженных 3 ч при 900°С в муфель-
водой, air - воздух, мг/см2); ωz - относительная доля
ной печи; Ecp - средневзвешенная энергия α-частиц)
элемента z в смеси или соединении; E - энергия
α-частиц (МэВ); Z - атомный номер элемента z, вхо-
Raq
Rbio
RHAP
RHAP(900)
Нуклид
T1/2
Eαcp, кэВ
дящего в состав вещества. Для водорода сумма 0.90 +
мкм
0.0275Z в выражении (4) заменяется на 0.3. Результа-
223Ra
11.43 сут
5644.6
41
55
28
21
ты расчетов пробегов α-частиц для 223Ra и продуктов
219Rn
3.96 с
6748.7
54
72
37
27
его распада представлены в табл. 1 (для расчетов ис-
215Po
1.78 мс
7385.4
61
82
42
31
пользовали данные по энергии всех α-частиц мате-
211Bi
2.14 мин
6549.2
51
69
35
26
ринского и дочерних радионуклидов и их выходы на
211Po
0.52 с
7442.4
62
83
42
31
распад, представленные в работе [22]).
Среднее
6583
52
69
35
26
В случае определения пробега в однородной среде
σ
719
8
11
6
4
(биологической ткани) применили формулу
Таблица 2. Пробег ядер отдачи 219Rn (E = 103.1 кэВ) в
Rbio = AE3/2/(ρZ2/3),
(6)
различных материалах
Плотность,
Про-
где А - средняя атомная масса среды (15.7), ρ - плот-
Материал
г/см3
бег, нм
ность среды (1 г/см3), Rbio - пробег (мкм). Максималь-
Вода
1.00
84
ный пробег α-частиц составил R = 83 мкм (для
ГАП (без пор)
3.14
33
α-частиц 211Po, Eα = 7.44 МэВ) (табл. 1). Для гидро-
ГАП (60% пор, заполненных водой)
1.86
52
ксиапатита средний пробег составил 35 мкм, а после
ГАП (900) (15% пор, заполненных
2.82
37
отжига снизился до 26 мкм.
водой)
Кортикальная кость
1.92
49
В результате последовательной цепочки α-распа-
дов 223Ra испускает 4 α-частицы со средней энергией
Эффективность сфероидов ГАП в качестве носи-
6.6 МэВ (табл. 1). При каждом акте распада дочерние
телей α-эмиттеров будет зависеть от распределения
ядра приобретают кинетическую энергию отдачи
радионуклидов внутри частицы, поскольку часть α-
~100-145 кэВ. В случае образования 211Bi и 211Pb вы-
частиц будет задерживаться внутри носителя. Для
рванные из кристаллической структуры горячие ато-
возможности моделирования такого распределения
мы после исчерпания сообщенной им энергии имеют
необходимо помимо количественных характеристик
высокую вероятность быть сорбированными носите-
сорбции-десорбции оценить эффективную диффу-
лем [26, 27]. Другой дочерний радионуклид 219Rn со-
зию Ra и продуктов его распада внутри частицы.
четает химическую инертность с коротким периодом
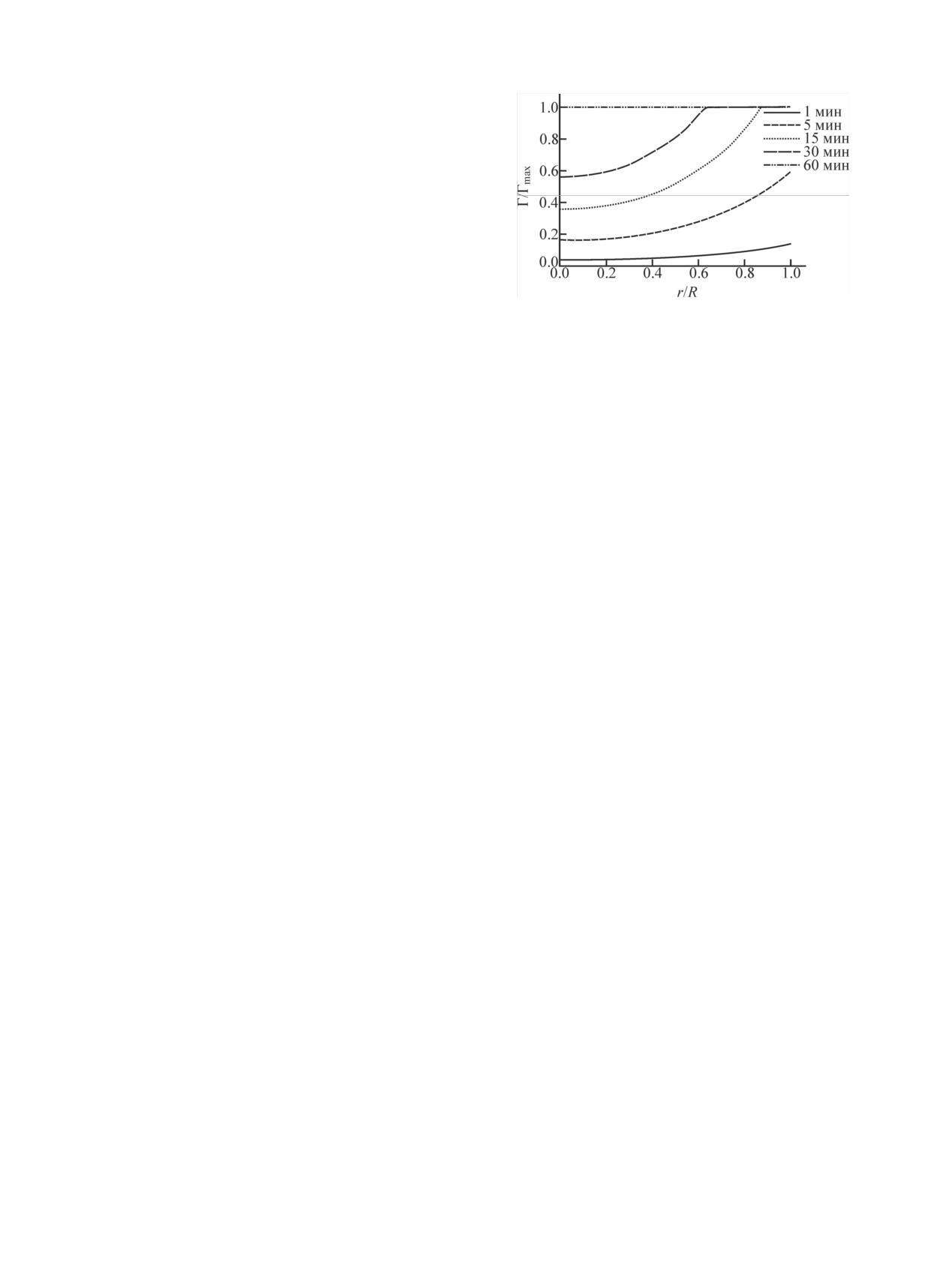
Распределение 223Ra анализировали следующим
полураспада (около 4 с), достаточным для того, что-
образом: поперечное сечение сферической гранулы
бы значительная часть 219Rn мигрировала от места
(r = 450-550 мкм) разбивали на кольцевые сектора
назначения терапии. С помощью программного обес-
шириной 100 мкм и подсчитывали количество пер-
печения SRIM-2013 [28] проведен расчет пробега
пендикулярных треков в каждом из секторов (рис. 4).
ядер отдачи 219Rn (E = 103.1 кэВ) в различных мате-
Предполагая, что таким образом визуализированы
риалах (табл. 2).
треки α-частиц Ra и продуктов его распада, которые
Помимо сферических частиц диаметром
900-
вышли на поверхность частицы ГАП с глубины не
более 35 мкм, можно перейти к количеству треков в
1000 мкм, которые были выбраны для исследования,
также представляется необходимым рассмотреть ва-
риант мечения наночастиц ГАП, когда РФЛП пред-
ставляет собой радиоактивную суспензию. Принимая
во внимание характеристики наночастиц ГАП (длина
до 500, ширина до 100, толщина до 0.8-2.4 нм [29]),
можно заключить, что в случае их использования в
качестве носителя 223Ra до 100% ядер отдачи 219Rn
будет выброшено за пределы нанопластинок ГАП.
Таким образом, оптимальным с точки зрения ядерно-
физических характеристик 223Ra и продуктов его рас-
пада носителем являются сфероиды ГАП, способные
удержать внутри частиц образующиеся в результате
Рис. 4. Экспериментальные профили сорбции активного ком-
распада горячие атомы.
понента.
248
А. В. Северин и др.
выделяемом объеме сферической частицы и таким
образом - к общему количеству треков в данной гра-
нуле в каждый момент сорбции. Зная кинетику сорб-
ции, мы можем соотнести число треков в частице с
реальной абсолютной и удельной активностью 223Ra.
Самая грубая оценка коэффициента диффузии по
времени заполнения центра гранулы
(30 мин,
рис. 3, б) дает величину порядка 10-6 см2/c. Для более
строгого расчета был применен подход, описанный
ниже.
Так как аналитическая оценка параметров диффу-
зии активного компонента в радиальной симметрии
Рис. 5. Профили сорбции активного компонента при k =
представляется достаточно сложной, в работе пред-
0.2 Бк/(см3·с) и D = 5·10-5 см2/с.
принята попытка создания модели его распределения
внутри гранулы сорбента. Модель учитывает поступ-
Здесь ν0 - исходное количество активного ком-
ление активного компонента из внешнего раствора в
понента во внешнем растворе, νC и νΓ - его количе-
гранулу сорбента, а также его диффузию и сорбцию
ство в растворе и в сорбированном виде внутри
внутри гранулы.
гранулы, VM - объем внешнего раствора.
Для сферической гранулы в случае радиальной
Задача (7) с начальными и граничными условия-
симметрии уравнение переноса активного компонен-
ми (9)-(12) и зависимостями (8), (13) представляет
та можно записать следующим образом:
собой нелинейную нестационарную задачу. Ее ре-
шение находили численными методами в простей-
∂C/∂t = D(∂2C/∂r2 + 2r-1∂C/∂r) - q.
(7)
шем одномерном случае. Для этого производные
Здесь C(r,t) - профиль его концентрации, q - функ-
заменяли конечными разностями по схеме Кранка-
ция, учитывающая расход компонента при сорбции.
Николсон и решали получившуюся систему линей-
В данном случае было сделано предположение, что
ных уравнений методом прогонки. В работе была
эта функция не зависит от r и t и линейно зависит от
проведена серия вычислительных экспериментов с
C, причем при достижении предельной сорбции рас-
различными наборами параметров, определяющих
ход прекращается. Таким образом, выражение для q
скорости диффузии и сорбции.
будет выглядеть следующим образом:
Из экспериментальных данных видно, что за
60 мин происходит полное заполнение централь-
kC(r,t) при Г(r,t) < Гmax
ной части гранулы (рис. 4). С другой стороны, за
q(C,r,t) =
(8)
меньшее время активный компонент практически
{
0 при Г(r,t) = Гmax.
не проникает туда. Исходя из этого можно предпо-
Здесь Γ(r,t) - профиль сорбции активного ком-
ложить, что в данном случае лимитирующим фак-
тором является диффузия. Это предположение под-
понента, Γmax - его предельно достижимая сорбция.
тверждается данными вычислительного экспери-
В начальный момент времени в грануле не со-
мента. На рис. 5 представлены профили сорбции
держалось ни растворенного, ни сорбированного
активного компонента при k = 0.2 Бк/(см3·с) и D =
компонента:
5·10-5 см2/с. В данном случае лимитирующим фак-
C(r,0) = 0, 0 < r < R,
(9)
тором является сорбция. Это приводит к тому, что
Г(r,0) = 0, 0 < r < R,
(10)
активный компонент быстро проникает в весь объ-
ем гранулы, а затем происходит лишь увеличение
где R - радиус гранулы.
его сорбции.
Граничное условие при r → 0 можно записать
На рис. 6 представлены профили сорбции актив-
следующим образом:
ного компонента при k = 5 Бк/(см3·с) и D = 2.5·10-5,
∂C/∂t = 3∂2C/∂r2
(11)
3·10-5 и 3.5·10-5 см2/с. Именно сорбированная часть
Концентрация на границе гранулы определяется
в основном определяет радиоактивность гранулы,
концентрацией активного компонента во внешнем
что устанавливается из соотношений объема внеш-
растворе CM
него раствора и гранулы и их радиоактивностей
после сорбции. Видно, что при изменении коэффи-
C(R,t) = CM(t).
(12)
циента диффузии от 2.5·10-5 до 3.5·10-5 см2/с про-
Она уменьшается по мере сорбции внутри грану-
исходит изменение заполнения центральной части
лы
гранулы (r/R < 0.2). Так, при D = 2.5·10-5 см2/с цен-
тральная часть практически не содержит активного
CM(t) = [ν0 - νC(t) - νΓ(t)]/VM.
(13)
компонента (рис. 6, а), при D = 3·10-5 см2/с проис-
Динамика сорбции-десорбции терапевтического α-эмиттера 223Ra
249
быть связано со сложной внутренней текстурой
гранулы и отклонением ее формы от сферической,
что приводит к существенному отклонению реше-
ния от полученного в данной работе.
Исходя из вышеизложенного можно предполо-
жить, что заполнение гранулы активным компо-
нентом происходит в диффузионном режиме. При
этом коэффициент диффузии принимает значение
~3·10-5 см2/с.
При известных численном выражении сорбции,
размере частиц ГАП, пробеге α-частиц в нем и их
распределении внутри сферических частиц можно
предположить, какая поглощенная доза будет соз-
даваться данным радионуклидом в живом организ-
ме (опухолевых клетках). Для достижения макси-
мальной поглощенной дозы необходимо варьиро-
вать размер частиц и время сорбции.
В первом приближении поглощенная доза, созда-
ваемая в ткани, окружающей гранулу, пропорцио-
нальна доли радионуклида во внешнем слое гранулы
(Ra35 мкм), толщина которого не превышает длину
пробега α-частиц, от активности во всей грануле
(Raсорб) (кривая Ra35 мкм/Raсорб, рис. 7). Очевидно, что
с началом сорбции эта доля равна 1, затем по мере
диффузии радия в грануле она стремится к равно-
весному значению (диффузионный компонент).
С другой стороны, поглощенная доза пропорцио-
нальна соотношению активности во внешнем слое к
максимально достижимой активности во внешнем
слое в данных условиях сорбции (кривая Ra35 мкм/
Ra35 мкм, max, рис. 7). Это соотношение при условии
Рис.
6. Профили сорбции активного компонента при k =
постоянной удельной активности Ra в растворе
5 Бк/(см3·с) и D = 2.5·10-5 (а), 3·10-5 (б) и 3.5·10-5 см2/с (в).
стремится к 1 (сорбционный компонент). Произве-
дение диффузионного и сорбционного компонента
позволяет определить параметры мечения, соответ-
ствующие получению наиболее эффективного с точ-
ки зрения передачи излучения ткани препарата
(кривая ξ на рис. 7).
Полученную зависимость ξ можно объяснить
следующим образом: сначала большинство ионов
Ra находится на поверхности ГАП, но сорбция
очень мала (менее 10%). Далее происходит парал-
лельное увеличение сорбции радионуклида и созда-
ваемой им в окружающей ткани поглощенной дозы,
Рис. 7. Зависимость параметров диффузионного и сорбцион-
однако ко времени ts = 1 мин доза, сообщаемая окру-
ного компонентов поглощенной дозы, создаваемой в ткани,
жающей ткани, падает, так как часть Ra оказывается
окружающей гранулу, от времени сорбции и их произведение
внутри частицы сорбента и его α-частицы поглоща-
(ξ).
ются материалом гранулы (или теряют большую
часть своей энергии) и не способны поражать клетки
ходит частичное заполнение (рис. 6, б), а при D =
3.5·10-5 см2/с - полное заполнение сорбированным
опухоли.
активным компонентом (рис. 6, в). Последний ва-
Таким образом, с помощью метода трековой ав-
риант и реализуется в эксперименте. Однако следу-
торадиографии визуализировано распределение
ет отметить, что экспериментальные профили
223Ra в сфероидах гидроксиапатита в зависимости от
сорбции достаточно сильно отличаются от полу-
времени сорбции. Проведен анализ полученных за-
ченных по описанной выше модели. Это может
висимостей и рассчитан эффективный коэффици-
250
А. В. Северин и др.
ент диффузии - ~3·10-5 см2/с. Рассчитаны пробеги
part. Res. 2013. Vol. 15. P. 2082.
[11] Piotrowska A., Meczynska-Wielgosz S., Majkowska-Pilip A.
α-частиц и ядер отдачи 219Rn в материале носителя
et al. // Nucl. Med. Biol. 2017. Vol. 47. P. 10-18.
и на основе полученных значений определено оп-
[12] Rojas J. V., Woodward J. D., Chen N. et al. // Nucl. Med.
тимальное время сорбции (1 мин), при котором для
Biol. 2015. Vol. 42. P. 614-620.
получаемого РФЛП наибольшая доля α-частиц пе-
[13] Westrøm S., Malenge M., Jorstad I. S. et al. // J. Label.
редается клеткам опухоли.
Compd. Radiopharm. 2018. Vol. 61. P. 472-486.
[14] Larsen R. H., Salberg G. Patent US 8142758. 2012.
Исследование выполнено за счет грантов РФФИ
[15] Kozempel J., Vlk M., Malkova E. et al. // J. Radioanal. Nucl.
(проекты 16-33-00200 и 18-03-00432) с использова-
Chem. 2015. Vol. 304. P. 443-447.
нием оборудования Центра коллективного пользо-
[16] Vasiliev A. N., Severin A., Lapshina E. et al. // J. Radioanal.
вания ИЯИ РАН (соглашение с Минобрнауки
Nucl. Chem. 2017. Vol. 311, N 2. P. 1503-1509.
N 14.621.21.0014, уникальный идентификатор ра-
[17] Флейшер Р. Л., Прайс П. Б., Уокер Р. М. Треки заряжен-
ных частиц в твердых телах. М.: Атомиздат, 1981. В 3-х т.
бот RFMEF162117X0014).
[18] Ilić R., Durrani S. A. // Handbook of Radioactivity Analysis /
Ed. M. L’Annunziata. Academic, 2003. 2nd ed. P. 179-237.
Список литературы
[19] Dorschel B., Hermsdorf D., Reichelt U. et al. // Radiat. Meas.
2003. Vol. 37. P. 563-571.
[1] Hamoudeh M., Kamleh M. A., Diab R., Fessi H. // Adv. Drug
[20] Fromm M., Membrey F., El Rahmany A., Chambaude A. //
Deliv. Rev. 2008. Vol. 60, N 12. P. 1329-1346.
Nucl. Tracks Radiat. Meas. 1993. Vol. 21. P. 357-365.
[2] Bohner M. // Injury. 2000. Vol. 31. P. 37-47.
[21] Vasiliev A.N., Ostapenko V. S., Lapshina E. V. et al. // Radio-
[3] Chakraborty S., Das T., Sarma H. D. et al. // Nucl. Med. Biol.
chim. Acta. 2016. Vol. 104, N 8. P. 539-547.
2008. Vol. 35. P. 589-597.
[22] National Nuclear Data Center, Brookhaven National Labora-
[4] Albernaz M. D. S., Ospina C. A., Rossi A. M., Santos-Olivei-
ra R. // Art. Сells Nanomed. Biotechnol. 2014. Vol. 42, N 2.
[23] Melikhov I. V., Komarov V. F., Severin A. V. et al. // Dokl.
P. 88-91.
Phys. Chem. 2000. Vol. 373. P. 125-128.
[5] Kothari K., Suresh S., Sarma H. D. et al. // Appl. Radiat. Isot.
[24] Северин А. В., Комаров В. Ф., Божевольнов В. Е., Мелихов
2003. Vol. 58, N. 4. P. 463-468.
И. В. // ЖНХ. 2005. T. 50, N 1. C. 76-81.
[6] Trewartha D., Carter K. // Nat. Rev. Drug Discov. 2013.
[25] Немец О. Ф., Гофман Ю. Ф. Справочник по ядерной фи-
Vol. 12. P. 823-824.
зике. Киев: Наук. думка, 1975.
[7] Den R. B., Doyle L. A., Knudsen K. E. // Can. J. Urol. 2014.
[26] Akkaya R. // J. Radioanal. Nucl. Chem. 2012. Vol. 292, N 2.
Vol. 21. Suppl. 1. P. 70-76.
P. 771-775.
[8] Henriksen G., Schoultz B. W., Michaelsen T. E. et al. // Nucl.
[27] Morsy R. // Arab. J. Sci. Eng. 2016. Vol. 41, N 6. P. 2185-
Med. Biol. 2004. Vol. 31. P. 441-449.
2191.
[9] Jonasdottir T. J., Fisher D. R., Borrebaek J. et al. // Antican-
cer Res. 2006. Vol. 26. P. 2841-2848.
[29] Suvorova E. I., Klechkovskaya V. V., Komarov V. F. et al. //
[10] Piotrowska A., Leszczuk E., Bruchertseifer F. et al. // J. Nano-
Crystallogr. Rep. 2006. Vol. 51, N 5. P. 881-887.