314
Радиохимия, 2019, т. 61, N 4, c. 314-319
Катион-катионное взаимодействие в комплексе Np(V)
с анионами циклобутанкарбоновой кислоты Na[NpO2(cbc)2]
© М. С. Григорьева, И. А. Чарушникова*а, А. М. Федосеева
a Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: charushnikovai@ipc.rssi.ru
Получена 09.07.2018, после доработки 30.08.2018, принята к публикации 30.08.2018
УДК 539.26+546.798.21
Выделен в кристаллическом виде и исследован методом рентгеноструктурного анализа комплекс
Np(V) состава Na[NpO2(cbc)2]. Координационное окружение атома Np(1) - пентагональная бипирамида
с атомами O группы NpO2 в апикальных позициях. Экваториальную плоскость бипирамиды формируют
один атом O соседней группы NpO2 и четыре атома O трех анионов C4H7COO-. В структуре найдено
катион-катионное (КК) взаимодействие (взаимная координация линейных диоксокатионов NpO+), в
результате которого образуются цепочки из катионов NpO+. Мостиковые анионы связывают катионы
NpO+ вдоль цепочек, образуя бесконечные анионные цепочки [NpO2(cbc)2]nn-, вытянутые вдоль направ-
ления [001] в кристалле. Катионы Na+, расположенные между анионными цепочками [NpO2(cbc)2]n-,
связывают их в направлении [010]. В результате в кристалле образуются электронейтральные слои, па-
раллельные плоскости (011).
Ключевые слова: нептуний(V), циклобутанкарбоновая кислота, синтез, кристаллическая структура,
катион-катионное взаимодействие.
DOI: 10.1134/S0033831119040051
В последнее время были достаточно подробно
зовывались мелкокристаллические продукты.
изучены комплексы шестивалентных актинидов с
Рентгенодифракционный эксперимент выполнен
анионами циклопропанкарбоновой и циклобутан-
на автоматическом четырехкружном дифрактометре
карбоновой кислот [1-7], однако отсутствуют сведе-
с двумерным детектором Bruker Kappa Apex II
ния о соединениях Np(V) с вышеуказанными анио-
(излучение MoKα, графитовый монохроматор) при
нами. В случае Np(V) отсутствуют существенные
100 К. Параметры элементарной ячейки уточнены
ограничения методов синтеза, связанные с окисле-
по всему массиву данных. В экспериментальные
нием анионов этих кислот, например, при использо-
интенсивности введены поправки на поглощение с
вании гидротермального синтеза. Однако предвари-
помощью программы SADABS [8]. Структура рас-
тельные опыты показали, что практически всегда в
шифрована прямым методом (SHELXS97 [9]) и уточ-
реакционных системах формируются исключитель-
нена полноматричным методом наименьших квадра-
но мелкокристаллические продукты, не подходящие
тов (SHELXL-2014 [10]) по F2 по всем данным в ани-
для структурных исследований. Тем не менее, нам
зотропном приближении для всех неводородных ато-
удалось синтезировать в виде монокристаллов ком-
мов как рацемический двойник с вкладом второго
плекс состава Na[NpO2(cbc)2] (cbc- = C4H7COO-).
домена 0.14(2). Атомы H у анионов C4H7COO- введе-
Его строение изучено методом рентгеноструктурно-
ны на геометрически рассчитанные позиции с Uизо =
го анализа (РСА).
1.2Uэкв(C). Детали рентгеноструктурного экспери-
мента и основные кристаллографические данные
Экспериментальная часть
приведены в табл. 1. Координаты атомов депониро-
В работе использовали Hcbc фирмы Aldrich (98%)
ваны в Кембриджский центр кристаллографических
без дополнительной очистки. Гидроксид Np(V) осаж-
данных, депонент CCDC 1832943.
дали из водного раствора нитрата нептуноила
1 моль/л NaOH, промывали водой и растворяли в
Результаты и обсуждение
минимальном количестве водного раствора
~0.5 моль/л Hcbc. К полученному раствору добавля-
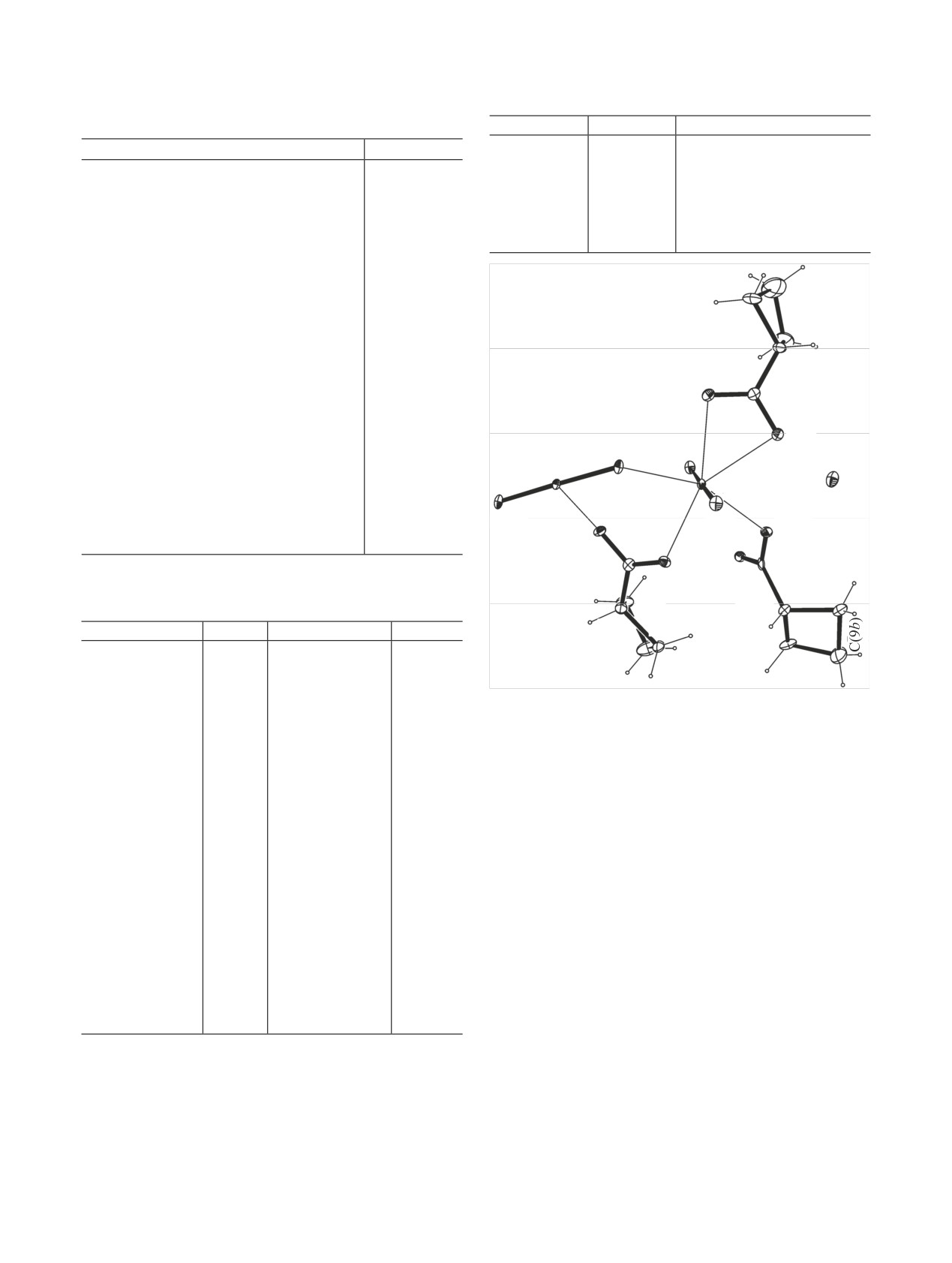
Основу структуры составляют анионные ком-
ли водный раствор ~0.5 моль/л соли Mcbc, где М -
плексы [NpO2(cbc)2]- и катионы Na+ (рис. 1). В ани-
катион щелочного металла (Li, Na, K, Rb, Cs), гуа-
онном комплексе атом Np(1) имеет пентагонально-
нидиния, аммония или тетраметиламмония. При
бипирамидальное окружение с атомами O группы
медленном испарении при комнатной температуре
NpO2 в апикальных позициях. Экваториальную
(~18-20°C) в реакционной смеси только в случае
плоскость бипирамиды формируют один атом O
Na+ формировались сростки очень тонких светло-
соседней группы NpO2 и четыре атома O трех анио-
зеленых кристаллов, из которых удалось отобрать
нов C4H7COO-, максимальное отклонение атомов O
образцы для РСА. Во всех остальных случаях обра-
от среднеквадратичной плоскости экватора состав-
Катион-катионное взаимодействие в комплексе Np(V)
315
Таблица 1. Кристаллографические данные и характери-
Таблица 3. Длины связей (d) в КП Na(1)
стики рентгеноструктурного эксперимента
Связь
d, Å
Операция симметрии
Na(1)-O(1)
2.673(6)
x, 1 - y, z + 1/2
Параметр
Значение
Na(1)-O(2)
2.300(9)
x, y, z + 1
Формула
C10H14O6NaNp
Na(1)-O(2)
2.361(6)
x, 2 - y, z + 1/2
М
490.20
Na(1)-O(4)
2.253(10)
Сингония
Моноклинная
Na(1)-O(4)
2.784(7)
x, 2 - y, z + 1/2
Пространственная группа
Cc
Na(1)-O(6)
2.367(8)
x, 1 - y, z + 1/2
a, Å
26.4812(8)
b, Å
7.6843(2)
C(4)
c, Å
6.3714(2)
C(3)
β, град
97.304(2)
C(5)
V, Å3; Z
1285.99(7); 4
ρвыч., г/см3
2.532
C(2)
C(1)
μ(MoKα), мм-1
5.273
O(3)
Число измеренных/независимых отраже-
9693/3636
ний
O(4)
Число независимых отражений с I > 2σ(I)
3444
O(1a)
O(1)
Число уточняемых параметров
164
Na(1)
Np(1a)
R(F); wR(F2) [I > 2σ(I)]
0.0218; 0.0359
Np(1)
R(F); wR(F2) [весь массив]
0.0243; 0.0366
GOOF
0.999
O(2a)
O(2)
O(6b)
O(6)
Δρmax и Δρmin, e·Å-3
0.599; -1.125
C(6)
C(6b)
O(5b)
O(5)
Таблица 2. Длины связей (d) и валентные углы (ω) в
C(8b)
C(8)
структуре
C(7b)
C(7)
C(10)
Связь
d, Å
Угол
ω, град
Np(1)=O(1)
1.875(5)
O(1)Np(1)O(2)
177.87(18)
C(9)
C(10b)
Np(1)=O(2)
1.830(5)
O(1)Np(1)O(1a)
98.48(10)
Np(1)-O(1a)
2.431(4)
O(2)Np(1)O(1a)
83.60(18)
Рис. 1. Фрагмент структуры Na[NpO2(cbc)2]. Эллипсоиды тем-
Np(1)-O(3)
2.496(4)
O(3)Np(1)O(4)
52.37(13)
пературных смещений даны с 50%-ной вероятностью. Пунк-
Np(1)-O(4)
2.489(4)
O(1a)Np(1)O(3)
78.07(14)
тирными линиями показаны катион-катионные связи; то же на
Np(1)-O(5)
2.428(4)
O(1a)Np(1)O(5)
81.89(14)
рис. 2. Операции симметрии: a - (x, 1 - y, -1/2 + z); b - (x, 1 - y,
Np(1)-O(6b)
2.408(4)
O(4)Np(1)O(6b)
72.67(14)
1/2 + z).
O(5)Np(1)O(6b)
75.91(14)
C(1)-O(3)
1.264(7)
O(3)C(1)O(4)
119.2(6)
внутри КП атома Na(1) приведены в табл. 3. Поли-
C(1)-O(4)
1.288(7)
O(3)C(1)C(2)
122.0(6)
эдры атомов Na связываются общими ребрами
C(1)-C(2)
1.490(9)
O(4)C(1)C(2)
118.8(5)
[O(2)···O(4)] в зигзагообразные цепочки вдоль на-
Среднее (C-C)цикл
1.538(12)
C(1)C(2)C(3)
119.9(6)
правления [001].
C(1)C(2)C(5)
114.5(6)
В структуре найдены два кристаллографически
Среднее (CCC)цикл
88.5(6)
неэквивалентных аниона C4H7COO-. Один анион
C(6)-O(5)
1.254(8)
O(5)C(6)O(6)
123.4(6)
[атомы углерода C(1)-C(5)] является бидентатно-
C(6)-O(6)
1.289(7)
O(5)C(6)C(7)
120.0(6)
циклическим, второй [атомы углерода C(6)-C(10)]
C(6)-C(7)
1.497(9)
O(6)C(6)C(7)
116.6(6)
выполняет мостиковую функцию, связывая два со-
Среднее (C-C)цикл
1.546(10)
C(6)C(7)C(8)
116.2(5)
седних атома Np. Бидентатно-циклический (cbc1) и
C(6)C(7)C(10)
120.9(6)
бидентатно-мостиковый (cbc2) анионы образуют
Среднее (CCC)цикл
88.6(6)
разные по прочности координационные связи внут-
а Операции симметрии: a - (x, 1 - y, z - 1/2); b - (x, 1 - y, z + 1/2).
ри КП атома Np(1), средние длины связей Np-Ocbc
равны 2.492 (cbc1) и 2.418 Å (cbc2). При этом длины
ляет 0.200(3) Å [атом O(3)]. Длины связей и валент-
связей в карбоксилатных группах COO анионов
ные углы внутри координационного полиэдра (КП)
cbc1 и cbc2 одинаковы в пределах погрешности
атома Np(1) приведены в табл. 2.
(табл. 2).
Катионы Na+ имеют кислородное окружение в
Разница в строении анионов проявляется в кон-
виде нерегулярного 6-вершинника, длины связей
формационных характеристиках. В табл. 4 приведе-
316
М. С. Григорьев и др.
Таблица 4. Конформационные характеристики анионов C4H7COO-: торсионные углы (град), отклонение атомов от сред-
неквадратичной плоскости циклического фрагмента (Δ, Å), углы перегиба (φ, град) по средней линии циклических фраг-
ментов
cbc1
cbc2
параметр
значение
параметр
значение
[O(3)C(1)C(2)C(3)]
4.1(10)
[O(5)C(6)C(7)C(8)]
-115.5(7)
[O(4)C(1)C(2)C(3)]
-179.9(6)
[O(6)C(6)C(7)C(8)]
62.3(7)
[O(3)C(1)C(2)C(5)]
-99.5(7)
[O(5)C(6)C(7)C(10)]
-9.5(9)
[O(4)C(1)C(2)C(5)]
76.4(8)
[O(6)C(6)C(7)C(10)]
168.3(6)
Δцикл
±0.126(5)
Δцикл
±0.120(4)
φ
26.0(9)
φ
24.6(8)
0
c
а
O(1)
Np(1)
O(2)
b
б
O(5)
O(6)
O(2a)
Np(1)
O(2)
Np(1a)
O(1)
O(1a)
O(4)
O(3)
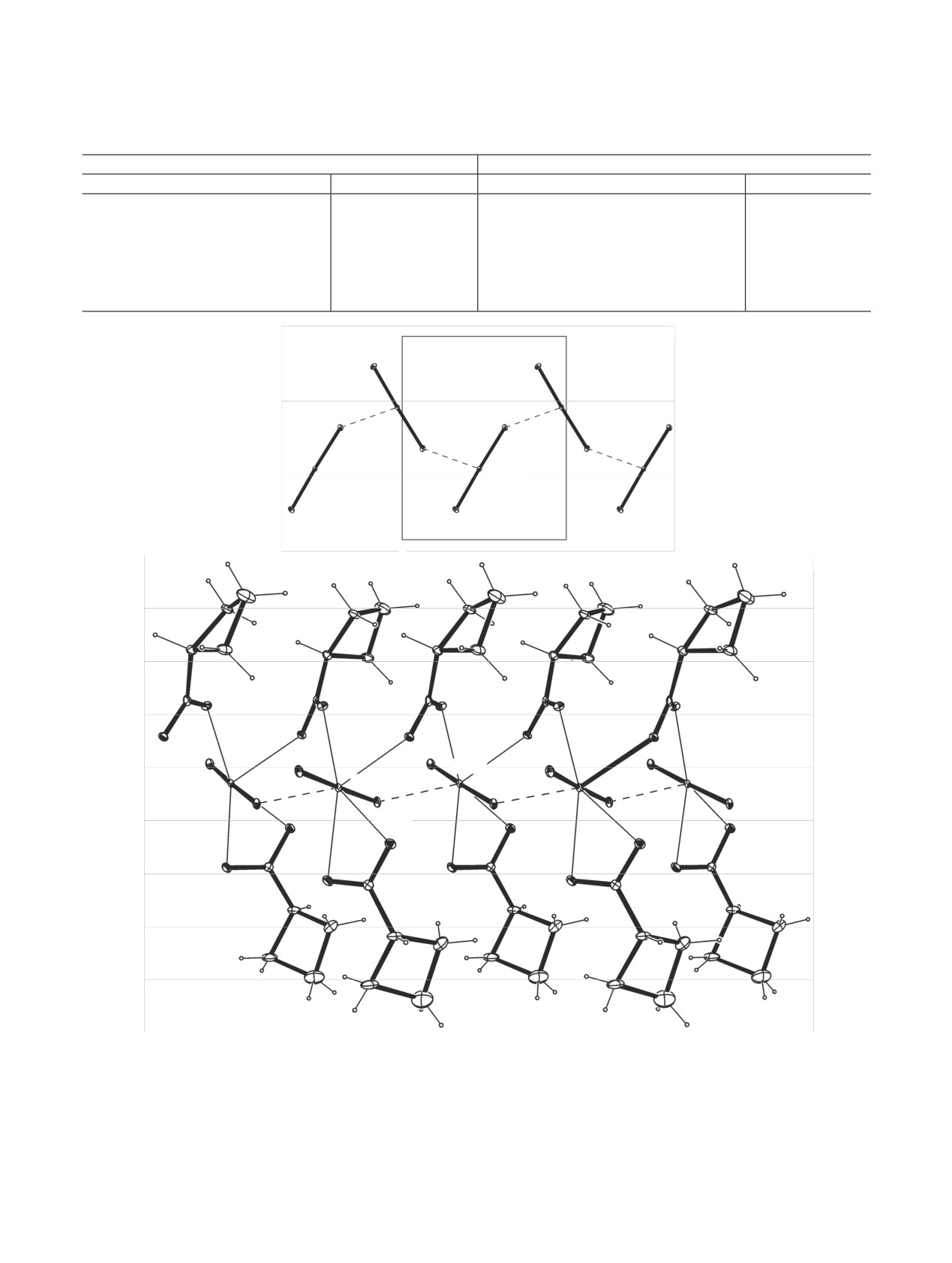
Рис. 2. КК взаимодействие в структуре Na[NpO2(cbc)2]: а - цепочка из катионов NpO+, б - анионная цепочка [NpO2(cbc)2]n-.
ны торсионные углы, показывающие поворот цик-
лерода от среднеквадратичной плоскости цикличе-
лического фрагмента относительно карбоксилатной
ского фрагмента (Δ). В анионах cbc1 и cbc2 дву-
группы в анионах cbc1, cbc2. Здесь же приведены
гранные углы между плоской частью аниона (атомы
углы перегиба (φ) по средней линии циклических
CCOO) и циклическим фрагментом равны 55.8(3)° и
фрагментов и максимальное отклонение атомов уг-
45.3(3)° соответственно.
Катион-катионное взаимодействие в комплексе Np(V)
317
c
0
b
Na(1)
Np(1)
a
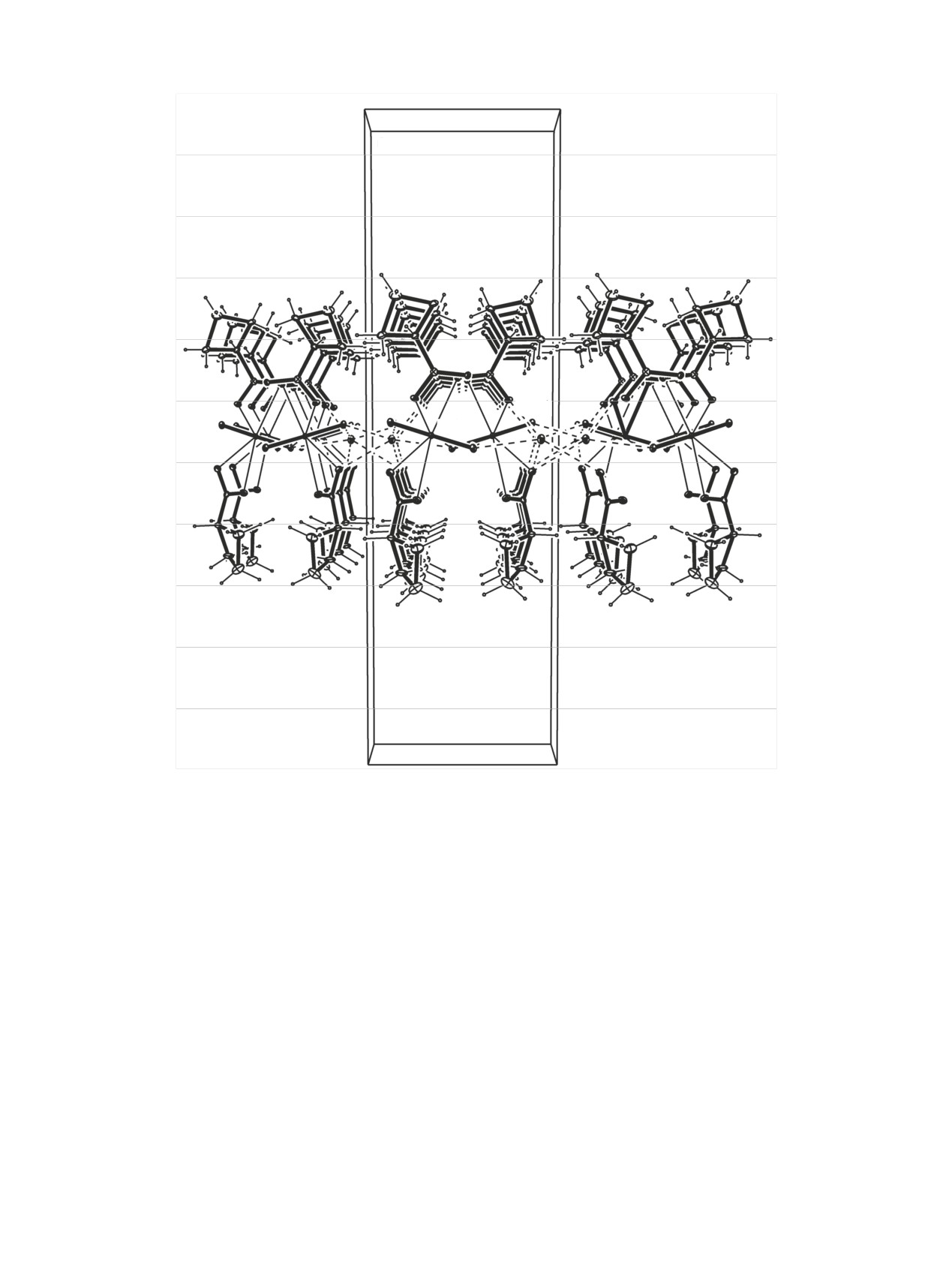
Рис. 3. Электронейтральный слой Na[NpO2(cbc)2]n.
В структуре найдено катион-катионное (КК)
ла. Так, в структуре
[NpO2(bipy)(OOCCH2OH)]·
взаимодействие, или взаимная координация линей-
1.5H2O [11] катионы NpO+ связаны КК взаимодей-
ных диоксокатионов NpO+, в результате которого
ствием в бесконечные цепочки, а бидентатно-
образуются цепочки из катионов NpO+ (рис. 2, а).
мостиковые гликолят-ионы дополнительно связыва-
ют соседние в цепочках атомы Np. В структуре
Мостиковые анионы связывают катионы NpO+
[NpO2(OOCH)(H2O)]
[12] бидентатно-мостиковые
вдоль цепочек (рис. 2, б), образуя бесконечные ани-
формиат-ионы дополнительно связывают атомы Np
онные цепочки [NpO2(cbc)2]n-, вытянутые вдоль на-
в четырехсвязанной «квадратной» катионной сетке.
правления [001] в кристалле. Межатомное расстоя-
В соединениях с димерными катионами (NpO+)2 c
ние Np···Np в цепочке из катионов NpO+ равно
«боковой» координацией, при которой нептуноил-
3.9445(3) Å.
ионы объединяются в димеры за счет двух связей
Наиболее распространенным типом координации
Np-O, бидентатно-мостиковые анионы монокарбо-
анионов монокарбоновых кислот к диоксокатионам
новых кислот дополнительно связывают атомы Np в
пяти- и шестивалентных актинидов является биден-
димерах и, вероятно, способствуют образованию
татно-циклический. В соединениях Np(V) при нали-
таких димеров [13, 14]. В ряде случаев бидентатные
чии КК взаимодействия часто наблюдается мости-
карбоксильные группы проявляют повышенную
ковая координация, при которой карбоксильные
(больше двух) координационную емкость. В струк-
группы координированы к двум атомам Np, связан-
туре безводного формиата нептуноила
[NpO2·
ным за счет взаимной координации ионов нептунои-
(OOCH)] [12] c четырехсвязанной «алмазной» кати-
318
М. С. Григорьев и др.
ные слои, параллельные плоскости (011) (рис. 3). В
слоях можно выделить плоские смешанно-эле-
ментные катионные сетки из NpO2+ и Na+ (рис. 4). В
сетке каждая группа NpO2 задействована в двух КК
связях - как лиганд и как координирующий центр,
и, кроме того, связывается с тремя катионами Na+.
0
c
Известно, что КК взаимодействие впервые было
Na(1)
обнаружено при изучении поведения Np(V) и ура-
O(1)
нила в перхлоратных растворах [24, 25]. Было также
установлено, что в растворах катионы Na+ неактив-
ны по отношению к катионам NpO+. Следовательно,
Np(1)
можно полагать, что возникновение таких катион-
O(2)
ных сеток в кристалле Na[NpO2(cbc)2] происходит
b
не из-за специфического взаимодействия, подобно-
го найденному в смешанно-элементных соединени-
ях, содержащих в своей структуре КК связи одноза-
рядного NpO2+ c более высокозарядными катионами
f-элементов, такими как Np4+ или Th4+ [26-32]. Ве-
роятной причиной образования таких катионных
сеток является маленькие размеры щелочных катио-
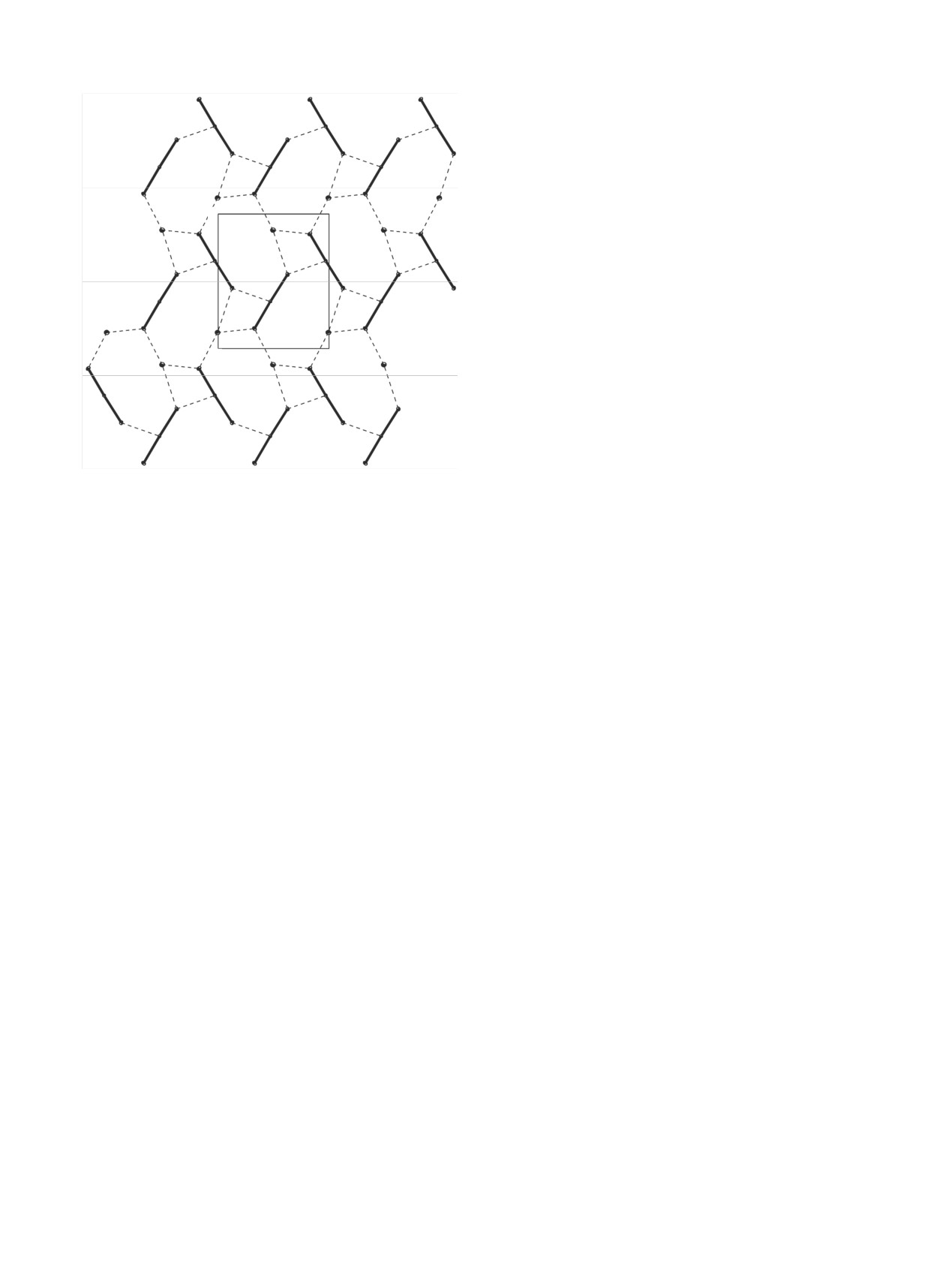
Рис. 3. Смешанно-элементная катионная сетка в структуре
Na[NpO2(cbc)2].
нов, позволяющих им поместиться между цепочка-
ми из катионов NpO+. Расстояния Np···Na в сетке
онной сеткой один из атомов O бидентатно-
лежат в пределах 3.525(7)-4.091(3) Å (среднее зна-
мостикового формиат-иона выступает в качестве
чение 3.745 Å). Внутри полиэдра атома Na(1) на-
мостикового для двух атомов Np, при этом коорди-
блюдается заметная разница в длинах связей с
национная емкость формиат-иона достигает трех. В
«ильными» атомами O групп NpO2, заметно слабее
структурах ацетатов нептуноила [(NpO2)2(OOCCH3)2·
связь с атомом O(1), включенным в КК взаимодей-
(H2O)]·C2H3N [15] и [(NpO2)2(OOCCH3)2(H2O)]·2H2O
ствие. Но при этом в группе NpO2 разница в длинах
[16] с «квадратными» катионными сетками один из
связей Np=O такая же, как в других соединениях с
ацетат-ионов бидентатно-мостиковый (координа-
катионными цепочками.
циионная емкость 2), второй демонстрирует не-
Таким образом, получен новый комплекс Np(V) с
обычный способ координации, при котором оба ато-
анионами циклобутанкарбоновой кислоты, в струк-
ма O являются мостиковыми для двух атомов Np,
туре которого КК взаимодействие связывает диок-
соединенных КК связями (координационная ем-
сокатионы NpO+ в цепочки. Малый радиус катионов
кость этого ацетат-иона 4). При значительном раз-
Na+ позволяет им локализоваться между цепочками
нообразии типов координации анионов монокарбо-
с КК связями, и это способствует образованию сме-
новых кислот в соединениях Np(V) с КК взаимодей-
шанно-элементных сеток с катионами разной при-
ствием ионов нептуноила единственным аналогом
роды.
(по типам координации ацидолиганда) рассматри-
Рентгенодифракционный эксперимент выпол-
ваемого в настоящей работе комплекса можно счи-
нен в ЦКП ФМИ ИФХЭ РАН. Работа выполнена
тать соединение NH4[(NpO2)3(C2H5COO)4(H2O)]·
3H2O [17], в котором одновременно присутствуют
при частичном финансировании Министерством
науки и высшего образования Российской Федера-
бидентатно-циклические и бидентатно-мостиковые
пропионат-ионы, последние связывают два атома
ции (тема N АААА-А18-118040590105-4).
Np, соединенные КК взаимодействием.
Список литературы
Цепочки, в которых диоксокатионы NpO+ явля-
[1] Андреев Г. Б., Буданцева Н. А., Федосеев А. М., Анти-
ются одновременно и лигандами и координирующи-
пин М. Ю. // Пятая Рос. конф. по радиохимии «Радиохи-
ми центрами, встречаются довольно часто в струк-
мия-2006»: Тез. докл. Дубна, 23-27 октября 2006 г. С. 73-
74.
турах соединений Np(V) [18-23].
[2] Grigoriev M. S., Fedosseev A. M. // Acta Crystallogr., Sect. C.
В организации структуры Na[NpO2(cbc)2] имеет-
2011. Vol. 67, N 6. P. m205-m207.
ся принципиальное отличие от других цепочечных
[3] Иванова А. Г., Юсов А. Б., Григорьев М. С., Федосе-
ев А. М. // Радиохимия. 2014. Т. 56, N 4. С. 317-321.
структур с КК взаимодействием. Катионы Na+, ло-
[4] Чарушникова И. А., Григорьев М. С., Федосеев А. М. //
кализуясь между анионными цепочками
[NpO2·
Радиохимия. 2017. Т. 59, N 5. С. 385-392.
(cbc)2]n-, связывают их в направлении [010]. В ре-
[5] Чарушникова И. А., Григорьев М. С., Федосеев А. М. // Ра-
зультате в кристалле образуются электронейтраль-
диохимия. 2017. Т. 59, N 6. С. 488-494.
Катион-катионное взаимодействие в комплексе Np(V)
319
[6] Григорьев М. С., Чарушникова И. А., Федосеев А. М. // Ра-
ЖНХ. 1996. Т. 41, N 4. С. 539-542.
диохимия. 2018. T. 60, N 5. C. 442-446.
[20] Budantseva N. A., Andreev G. B., Fedoseev A. M. et al. //
[7] Чарушникова И. А., Григорьев М. С., Федосеев А. М. //
Radiochim. Acta. 2006. Vol. 94, N 2. P. 69-74.
Радиохимия. 2019. T. 61, N 4. C. 308-313.
[21] Григорьев М. С., Батурин Н. А., Бессонов А. А., Крот Н. Н. //
[8] Sheldrick G. M. SADABS. Madison, Wisconsin (USA):
Радиохимия. 1995. Т. 37, N 1. С. 15-18.
Bruker AXS, 2008.
[22] Андреев Г. Б., Буданцева Н. А., Антипин М. Ю., Крот Н.
[9] Sheldrick G. M. // Acta Crystallogr., Sect. A. 2008. Vol. 64,
Н. // Координац. химия. 2002. Т. 28, N 6. С. 465-469.
N 1. P. 112-122.
[23] Andreev G., Budantseva N., Tananaev I., Myasoedov B. //
[10] Sheldrick G. M. // Acta Crystallogr., Sect. C. 2015. Vol. 71,
Inorg. Chem. Commun. 2010. Vol. 13. P. 679-682.
N 1. P. 3-8.
[24] Sullivan J. C., Hindman J. C., Zielen A. J. // J. Am. Chem.
[11] Charushnikova I. A., Krot N. N., Starikova Z. A. // Radiochim.
Soc. 1961. Vol. 83. P. 3373-3378.
Acta. 2009. Vol. 97, N 10. P. 587-592.
[25] Sullivan J. C. // J. Am. Chem. Soc. 1962. Vol. 84. P. 4256-
[12] Григорьев М. С., Яновский А. И., Стручков Ю. Т. и др. //
4259.
Радиохимия. 1989. Т. 31, N 4. С. 37-44.
[26] Almond P. M., Sykora R. E., Skanthakumar S. et al. // Inorg.
[13] Grigoriev M. S., Krot N. N., Bessonov A. A., Suponitsky K. Yu. //
Chem. 2004. Vol. 43, N 3. P. 958-963.
Acta Crystallogr., Sect. E. 2007. Vol. 63, N 2. P. m561-m562.
[27] Charushnikova I., Bossé E., Guillaumont D., Moisy P. //
[14] Charushnikova I. A., Krot N. N., Starikova Z. A. // Radiochim.
Inorg. Chem. 2010. Vol. 49, N 5. P. 2077-2082.
Acta. 2007. Vol. 95, N 9. P. 495-500.
[28] Jin G. B. // Inorg. Chem. 2013. Vol. 52, N 21. P. 12317-
[15] Чарушникова И. А., Перминов В. П., Кацер С. Б. // Радио-
12319.
химия. 1995. Т. 37, N 6. С. 493-498.
[29] Чарушникова И. А., Федосеев А. М. // Радиохимия. 2014.
[16] Андреев Г. Б., Антипин М. Ю., Буданцева Н. А., Крот Н. Н. //
Т. 56, N 1. C. 3-7.
Координац. химия. 2005. Т. 31, N 11. С. 844-847.
[30] Чарушникова И. А., Крот Н. Н., Григорьев М. С. // Радио-
[17] Григорьев М. С., Антипин М. Ю., Крот Н. Н. // Радиохи-
химия. 2014. Т. 56, N 5. С. 400-406.
мия. 2006. Т. 48, N 1. С. 7-10.
[31] Чарушникова И. А., Крот Н. Н. // Радиохимия. 2015.
[18] Григорьев М. С., Чарушникова И. А., Батурин Н. А.,
T. 57, N 4. C. 324-328.
Крот Н. Н. // ЖНХ. 1995. Т. 40, N 5. С. 732-735.
[32] Чарушникова И. А., Крот Н. Н., Федосеев А. М. // Радио-
[19] Григорьев М. С., Чарушникова И. А., Крот Н. Н. и др. //
химия. 2016. Т. 58, N 5. C. 385-389.