320
Радиохимия, 2019, т. 61, N 4, c. 320-323
Особенности электрохимического окисления Pu(III) в ячейке без
диафрагмы в азотнокислых растворах, содержащих гидразин
© В. И. Марченкоа, К. Н. Двоеглазов*а
а Высокотехнологический научно-исследовательский институт неорганических материалов им. акад. А. А. Бочвара,
123060, Москва, ул. Рогова, д. 5а; * e-mail: KNDvoeglazov@bochvar.ru
Получена 16.07.2018, после доработки 27.12.2018, принята к публикации 28.12.2018
УДК 546.798.22: 544.653.2
Изучено окисление Pu(III) в ячейке без диафрагмы с электродами из Ti (катод) и Pt (анод) в раство-
рах HNO3 (1.0-3.9 моль/л), содержащих гидразин (4.5·10-2-1.8·10-1 моль/л). Установлено, что конечные
растворы помимо Pu(IV) содержат также небольшое количество Pu(VI), которое увеличивается при по-
вышении плотности тока. Предложены методы, позволяющие минимизировать содержание Pu(VI) в
растворах после электролиза. Рассмотрен возможный механизм процесса, включающий реакции ионов
Pu на электродах и в объеме раствора с HNO2.
Ключевые слова: плутоний, растворы, окисление, валентность, электролиз, азотная кислота, гидра-
зин, азотистая кислота.
DOI: 10.1134/S0033831119040063
Технологические схемы водной переработки
Экспериментальная часть
ОЯТ включают в качестве одной из стадий перевод
Pu в экстрагируемую форму на стадии его аффина-
Исследование проводили в термостатируемой
жа путем окисления Pu(III) до Pu(IV) в водном рас-
стеклянной ячейке с неразделенными электродными
творе HNO3, содержащем стабилизатор (гидразин).
пространствами с катодом из Ti и анодом из Pt. От-
В качестве окислителя предлагаются различные
ношение площадей поверхности анода (Sa) и катода
реагенты, свойства и особенности применения ко-
(Sc) составляло 10, температуру во всех опытах под-
торых в экстракционной технологии рассмотрены в
держивали равной 25°C. Исходные растворы содер-
работе [1]. На радиохимических заводах за рубе-
жали HNO3, Pu(III) и гидразин, раствор перемешива-
жом для окисления Pu(III) и стабилизации его в
ли магнитной мешалкой. В процессе электролиза,
четырехвалентном состоянии преимущественно
проводимого в амперостатическом режиме, периоди-
используют газообразную смесь оксидов азота
чески отбирали пробы для записи спектров поглоще-
NOx. В России применительно к технологии завода
ния в интервале длин волн от 250 до 1100 нм с целью
РТ прорабатывается вариант перевода Pu(III) в
определения содержания валентных форм Pu. В от-
Pu(IV) пероксидом водорода в присутствии катали-
дельных опытах для установления полноты окисле-
затора - ионов Fe [2]. Для новых технологических
ния Pu(III) использовали метод контактирования али-
схем, использующих органические восстановители
квоты рабочего раствора с равным объемом 30%-
Pu (диформилгидразин, карбогидразид), проводят-
ного ТБФ в н-парафинах; в этом случае содержание
ся испытания способа окисления Pu(III) на углесо-
Pu в обеих фазах устанавливали радиометрически по
держащих катализаторах (СКН, СКНО) [3]. В связи
α-счету. Плутоний очищали от примесей сорбцией
с проблемой сокращения количества солей в жид-
на анионообменной смоле ВП-1АП. Запасной рас-
ких отходах производства в технологии водной
твор Pu(III) в HNO3 готовили восстановлением
переработки ОЯТ представляет интерес безреа-
Pu(IV) гидразином в 1 моль/л HNO3. Концентрацию
гентный электрохимический метод, который в те-
гидразина и HNO2 определяли колориметрическим
чение более 20 лет используется на заводе РТ на
методом с применением соответственно п-диметил-
другой технологической операции - восстановле-
аминобензальдегида и реагента Грисса-Илосвая в
ния Pu и Np в первом экстракционном цикле при
качестве окрашивающих агентов. Потенциал анода
отделении их от U [4]. В литературе сообщается
(Еа) и окислительно-восстановительный потенциал
[4, 5] о возможности применения этого метода для
раствора (Еов) измеряли с использованием хлорсереб-
окисления Pu(III) в Пурекс-процессе в простом по
ряного электрода сравнения.
конструкции бездиафрагменном электролизере. В
настоящей работе изучены основные особенности
Результаты и обсуждение
окисления Pu(III) в электрохимическом устройстве
такого типа в азотнокислых растворах, содержа-
Условия проведения и результаты опытов по
щих гидразин, и предпринята попытка дать объяс-
окислению Pu(III) приведены в таблице. Полноту
нение наблюдаемым закономерностям.
окисления Pu(III) рассчитывали по формуле
Особенности электрохимического окисления Pu(III) в ячейке без диафрагмы
321
Условия и результаты опытов по электрохимическому
окислению Pu(III) в ячейке без диафрагмы. Sa/Sc = 10,
[Pu(III)] = 2.4 г/л. ia - анодная плотность тока, α - полно-
та окисления Pu(III)
[HNO3],
[N2H4]·102,
ia, мА/см2
α, %
Pu(VI),a %
моль/л
моль/л
2.0
9.0
5.0
~99
1.6
2.0
9.0
8.3
~99
Н/ов
2.0
9.0
13.5
~99
4.5
2.0
8.9
20.0
99.6б
Н/о
2.0
9.5
27.0
~99
6.0
1.0
9.0
13.5
97.0б
Н/о
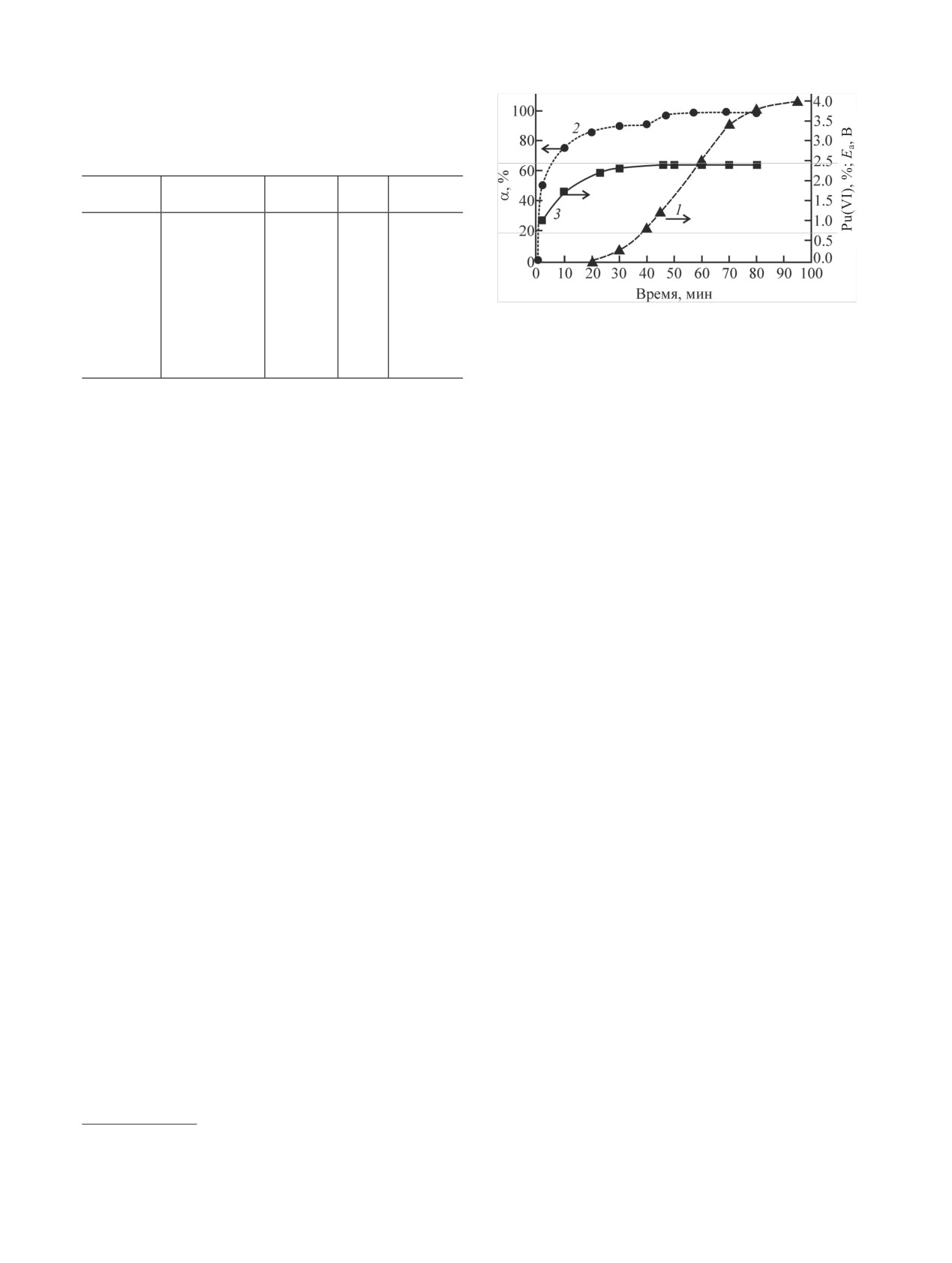
Рис. 1. Изменение содержания Pu(VI) (1), полноты окисления
3.9
9.0
13.5
99.5б
Н/о
Pu(III) (2) и потенциала анода (3) при окислении Pu(III) в ячей-
2.0
4.5
13.5
~99
Н/о
ке без диафрагмы. [HNO3] = 2 моль/л, [N2H4] = 9·10-2 моль/л,
ia = 13.5 мА/см2.
2.0
18.0
13.5
~99
Н/о
а Содержание Pu(VI) в растворе после опыта.
на аноде потенциала выделения кислорода и нача-
б По данным экстракции.
лом окисления Pu(IV) по реакции
в Не определяли.
Pu4+ + 2H2O + 2e → PuO22+ + 4H+,
(7)
α = {[Pu(III)]нач - [Pu(III)]кон}·100%/[Pu(III)]нач,
(1)
которая протекает очень медленно вследствие пе-
рестройки структуры ионов Pu от акваиона Pu4+ к
в которой [Pu(III)]нач и [Pu(III)]кон - концентрация
оксигенированному иону PuO2+. На катоде ионы
Pu(III) в растворе до и после электролиза соответст-
плутонила легко восстанавливаются до Pu(V)
венно.
Из приведенных данных следует, что при [HNO3]
PuO22+ + e → PuO+,
(8)
≥ 2 моль/л полнота окисления Pu(III) составляет не
но последующий переход Pu(V) в Pu(IV), по наше-
менее 99%. При меньшей кислотности ([HNO3] =
му мнению, реализуется не путем восстановления
1 моль/л) окисление Pu(III) протекает не полностью и
его на катоде
часть Pu (~3%) остается в трехвалентном состоянии.
На рис. 1 представлены типичные кривые измене-
PuO+ + e + 4H+ → Pu4+ + 2H2O,
(9)
ния полноты окисления Pu(III) и потенциала анода
(здесь и далее значения потенциалов приведены от-
а через реакции диспропорционирования Pu(V)
носительно н.в.э.) в ходе электролиза, на которых
2PuO+ + 4H+ ⇄ Pu4+ + PuO2+ + 2H2O
(10)
можно выделить 3 участка. Первый относится к на-
чальному периоду, в ходе которого происходит окис-
и репропорционирования Pu(IV)
ление основной части Pu(III) (на ~80%) и гидразина
PuO2+ + Pu3+ + 4H+ ⇄ 2Pu4+ + 2H2O,
(11)
на аноде1
протекающие в растворе.
Pu3+ - e → Pu4+,
(2)
Наблюдающееся на этом участке замедление
N2H+ - 4e → N2
+ 5H+
(3)
окисления Pu(III) (плато на кривой зависимости α-
и восстановление Pu(IV) и нитрат-ионов (азотной
время) может быть следствием возрастания скорости
кислоты) на катоде
реакции (4) из-за увеличения концентрации Pu(IV), а
также изменения состояния поверхности Pt электро-
Pu4+ + e → Pu3+,
(4)
да (образование оксидов платины) или адсорбции на
NO3- + 3H+ + 2e → HNO2 + H2O.
(5)
его поверхности промежуточных продуктов окисле-
Гидразин расходуется также по реакции в рас-
ния гидразина азотистой кислотой (радикалов N2H2
творе с образующейся по реакции (5) азотистой
и др.) [7]. Второй этап завершается полным разру-
кислотой [7]
шением гидразина, которое сопровождается скачко-
образным ростом окислительно-восстановитель-
7N2H+ + 12HNO2 → NH+ + HN3 + 5N2 + 6N2O + 18H2O +
ного потенциала раствора (рис. 2) и появлением в
+ 6H+.
(6)
растворе HNO2, которая обнаруживается действием
Второй участок характеризуется достижением
реактива Грисса-Илосвая. Специальные опыты, в
1
которых измеряли Eов при различных концентрациях
По мнению авторов работы [6], окисление гидразина может
гидразина, показали, что скачок потенциала, как
протекать также с потерей одного или двух электронов с
образованием кроме N2 также ионов аммония и HN3.
видно из приводимых ниже данных (при [HNO3] =
322
В. И. Марченко, К. Н. Двоеглазов
сдвигу вследствие этого равновесия (14) в правую
сторону.
Электрохимическое окисление Pu(III) эффек-
тивно протекает не только в гомогенном водном
растворе, но и в двухфазных системах с ТБФ. При
этом одновременно происходят процессы окисле-
ния Pu и его распределения между фазами, однако
и в этом случае полное окисление Pu(III) достига-
ется только после завершения разрушения гидрази-
на. Так, при проведении электролиза в перемеши-
ваемой двухфазной системе 30%-ный ТБФ в н-па-
рафинах-водный раствор 3 моль/л HNO3 + 0.5 г/л
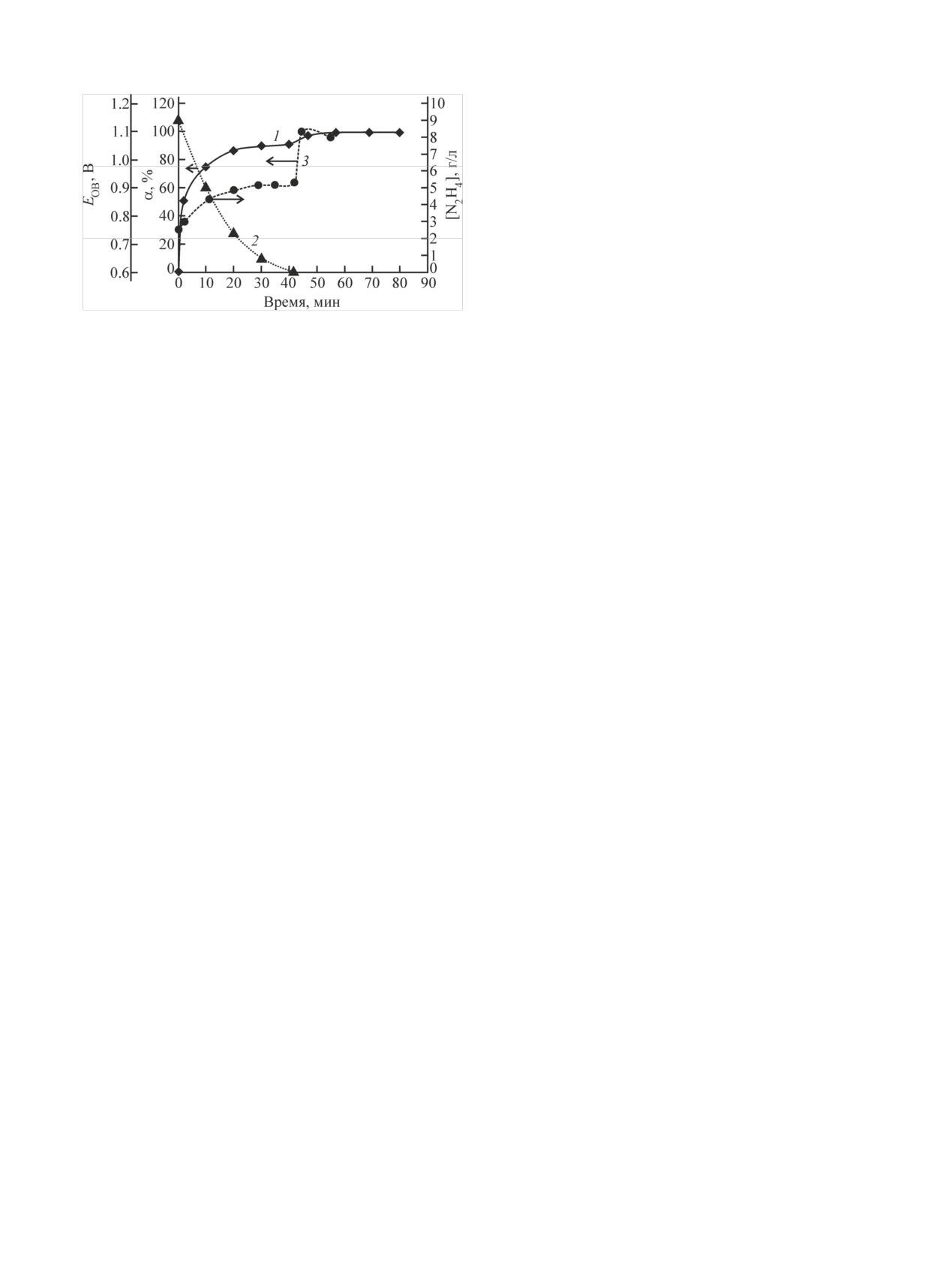
Рис. 2. Изменение полноты окисления Pu(III) (1), концентра-
ции гидразина (2) и окислительно-восстановительного потен-
Pu(III) + 0.1 моль/л N2H4 до достижения величины
циала раствора (3) при окислении Pu(III) в ячейке без диафраг-
Еов = +1.1 В, свидетельствующей о завершении раз-
мы. [HNO3] = 2 моль/л, [N2H4] = 9·10-2 моль/л, ia = 13.5 мА/см2.
рушения гидразина, неокисленным оставалось
только 0.05% Pu(III), тогда как при остаточной
3 моль/л), происходит при снижении концентрации
концентрации гидразина 5.3·10-3 и 3.0·10-3 моль/л
гидразина до 10-5-10-6 моль/л.
(т.е. при разрушении его на ~95 и 97%) содержание
Pu(III) в водной фазе составляло 3.1 и 2.5% соот-
[N2H4], моль/л
10-1
10-2 10-3 10-4 10-5 10-6
10-8
ветственно.
Eов, мВ
450
480
535
630
740
960
1020
Растворы после электролиза при всех изучен-
На заключительном, третьем, участке в отсутст-
ных условиях помимо Pu(IV) содержат также не-
вие гидразина Pu(III) окисляется как по реакции (2)
большое количество (несколько процентов) Pu(VI),
на аноде, так и азотистой кислотой в объеме рас-
содержание которого в конечных растворах увели-
твора
чивается с ростом плотности тока. Можно предпо-
лагать, что содержание Pu(VI) определяется не
Pu3+ + HNO2 + H+ → Pu4+ + NO + H2O.
(12)
только реакциями (7) и (8) на электродах, но и
Образующийся оксид азота взаимодействует с
взаимодействием Pu(VI) с HNO2 в растворе, проте-
HNO3 по быстрой обратимой реакции
кающим после разрушения гидразина по сложному
механизму [9] и включающему быструю обрати-
2NO + HNO3 + H2O ⇄ 3HNO2,
(13)
мую реакцию
и cуммирование уравнения (12), умноженное на
2PuO2+ + HNO2 + H2O ⇄ 2PuO+ + NO– + 3H+
(16)
два, с уравнением (13) приводит к брутто-реакции
между Pu(III) и HNO2 в азотнокислом растворе
и последующие реакции (10)-(12) с участием других
валентных форм Pu.
2Pu3+ + NO– + 3H+ ⇄ 2Pu4+ + HNO2 + H2O,
(14)
Присутствие в растворе после электролиза кроме
для которой экспериментально установленное вы-
Pu(IV) также и Pu(VI) не должно заметно повлиять
ражение константы равновесия имеет вид [8]
на извлечение Pu при последующей многоступенча-
той экстракции в ТБФ вследствие достаточно высо-
K = [Pu(III)][H+]1.5[NO–]0.5/{[Pu(IV)][HNO2]0.5},
(15)
ких коэффициентов распределения этих валентных
форм при кислотности, характерной для аффинаж-
откуда следует, что полнота окисления Pu(III) уве-
ной операции (~3 моль/л HNO3). Действительно,
личивается с ростом кислотности раствора. Следу-
после электрохимической обработки в ячейке без
ет отметить, что с появлением в растворе HNO2
диафрагмы при ia = 20 мА/см2 водного раствора,
переход Pu(III) в Pu(IV) происходит и после отклю-
содержавшего первоначально
2.5 г/л Pu(III),
чения тока, причем в соответствии с данными ра-
0.11 моль/л гидразина и 3 моль/л HNO3, и после-
боты [8] практически полное окисление Pu(III) дос-
дующих 4 последовательных контактов его с рав-
тигается при относительно высокой кислотности
ными объемами 30%-ного ТБФ в н-парафинах в
([HNO3] ≥ ~2 моль/л). В технологическом плане
водной фазе оставалось лишь 0.013% (0.325 мг/л) от
неполное окисление Pu(III) при невысокой кислот-
количества Pu в исходном растворе. При сорбцион-
ности ([HNO3] ~1 моль/л) не является препятстви-
ном извлечении Pu на анионообменной смоле поте-
ем для достаточно глубокого извлечения Pu при
ри Pu из-за присутствия Pu(VI) могут быть сущест-
последующей его экстракции раствором ТБФ бла-
венными и в этом случае следует стремиться макси-
годаря переходу Pu(IV) в органическую фазу и
мально снизить его содержание в растворе, посту-
Особенности электрохимического окисления Pu(III) в ячейке без диафрагмы
323
пающем на эту операцию. Как следует из результа-
лей-отстойников [4]. Эффективность использования
тов в таблице, для этого следует проводить электро-
величины Еов для контроля за полнотой стабилиза-
лиз при низкой плотности тока, но в этом случае
ции Pu в четырехвалентном состоянии подтвержде-
увеличивается продолжительность процесса окисле-
на нами [10] также для процесса перевода Pu(VI) в
ния. Уменьшить содержание Pu(VI), не увеличивая
Pu(IV) гидроксиламином в азотнокислом растворе.
значительно время электролиза, можно, изменяя
Список литературы
плотность тока в процессе электролиза. Так, сниже-
ние ia от 13.5 до 3.3 мА/см2 после завершения перво-
[1] Марченко В. И., Двоеглазов К. Н., Волк В. И. // Радиохи-
го участка [окисление основной части Pu(III)] позво-
мия. 2009. Т. 51, N 4. С. 289-302.
[2] Bugrov K., Korotaev V., Korchenkin K. et al. // Procedia
лило уменьшить содержание Pu(VI) почти в 3 раза
Chem. 2016. Vol. 21. P. 162-166.
(от 4.6 до 1.6%) при увеличении продолжительности
[3] Nazarova P., Volk V., Dvoeglazov K.
// Proc. Conf.
электролиза всего в 1.5 раза по сравнению с тем, ко-
RAD2017. Budva (Montenegro), June 12-16, 2017. P. 30-33.
гда плотность тока ia, равная 13.5 мА/см2, поддержи-
[4] Косяков В. Н., Марченко В. И. // Радиохимия. 2008. Т. 50,
валась неизменной в течение всего опыта. Другой
N 4. С. 289-300.
[5] Schmieder H., Galla U. // J. Appl. Electrochem.
2000.
путь снижения содержания Pu(VI) заключается в
Vol. 30. P. 201-207.
контроле окислительного потенциала раствора в
[6] Moisy Ph., Cames B., Blanc P. // Proc. RECOD’98. Nice
процессе электролиза и в прекращении подачи тока
(France), Oct. 25-28, 1998. Vol. 3. P. 827-829.
после скачкообразного возрастания Еов примерно до
[7] Колтунов В. С., Марченко В. И. // Кинетика и катализ.
+1.1 В. Успешное применение такого приема проде-
1966. T. 7, N 2. С. 224-229.
[8] Колтунов В. С., Марченко В. И. // Радиохимия. 1973.
монстрировано в экспериментах по окислению
Т. 15, N 5. С. 748-750.
Pu(III) в проточном трехсекционном бездиафрагмен-
[9] Колтунов В. С., Журавлева Г. И., Марченко В. И., Шапо-
ном электролизере с последующим практически
валов М. П. // Радиохимия. 1984. Т. 26, N 2. С. 187-192.
полным извлечением Pu 30%-ным раствором ТБФ в
[10] Марченко В. И., Журавлева Г. И., Двоеглазов К. Н. // Хим.
н-парафинах на многоступенчатом блоке смесите-
технология. 2007. Т. 8, N 7. С. 318-323.