Радиохимия, 2019, т. 61, N 5, c. 363-367
363
Устойчивость нептуния(V) в концентрированных растворах
уксусной кислоты
© А. В. Гоголев*а, В. П. Шилова, А. А. Бессонова, А. М. Федосеева
Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; *e-mail: gogolev@ipc.rssi.ru
Получена 05.08.2018, после доработки 24.02.2019, принята к публикации 25.02.2019
УДК 546.799.3
Ацетат Np(V) в ледяной уксусной кислоте и водных уксуснокислых растворах устойчив к диспро-
порционированию и находится в равновесии с осадком NpO2(Ac)·H2O. За время обезвоживания с помо-
щью избытка уксусного ангидрида Np(V) диспропорционирует. Обратный процесс репропорциониро-
вания имеет место после внесения избытка воды в безводную уксусную кислоту, содержащую уксус-
ный ангидрид, Np(IV) и Np(VI). Внесение HClO4 вызывает быстрое диспропорционирование Np(V) в
безводной уксусной кислоте и концентрированных уксуснокислых растворах. В спектрах взвесей в кон-
центрированной уксусной кислоте, содержащих Np(V) и ацетат калия, имеются полосы поглощения с
максимумами при 990 и 1020 нм, отнесенные нами к анионам NpO2(Ac)2- и частицам соединения
K2NpO2(Ac)3 соответственно.
Ключевые слова: нептуний(V), уксусная кислота, диспропорционирование.
DOI: 10.1134/S0033831119050010
Нептунилтриацетат натрия был одним из пер-
Была сделана попытка получать раствор Np(VI)
вых полученных соединений Np [1, 2]. За прошед-
путем озонирования взвесей 2 ммоль/л Np(V) в ук-
шее время накоплен значительный объем информа-
сусной кислоте, содержащей 2.6 моль/л H2O. Отно-
ции, относящейся к взаимодействию ацетат-ионов
сительно быстро (~5 мин) Np(V) переходит полно-
с ионами Np различной валентности в твердой и
стью в Np(VI). В спектре оптического поглощения
жидкой фазе и подробно цитированной в работах
таких растворов присутствует только полоса погло-
[3, 4]. Тем не менее, интерес к этой теме сохраняет-
щения с максимумом около 1220 нм. Однако при
ся и в настоящее время [5]. Ион NpO+, способный
дальнейшем озонировании в растворе снова появля-
координировать до трех ацетат-ионов, является
ется Np(V). После прекращения озонирования в рас-
наиболее устойчивой формой в водных уксусно-
творе также быстро возникает Np(V). Вероятно, во
кислых растворах. Мы предположили, что при уве-
время и после окончания озонирования имеет место
личении концентрации уксусной кислоты (HAc)
взаимодействие Np(VI) с продуктами реакции озона
устойчивость нептуноил-ионов снижается подобно
с растворителем.
тому, что наблюдается в случае Am(V) [6]. Реакция
Присутствие валентных форм Np контролирова-
диспропорционирования Np(V)
ли спектрофотометрически в кварцевой кювете (l =
1 см) на приборе Shimadzu UV 3101 PC (Япония) в
2NpO+ + 4H+ ⇄ NpO2+ + Np4+ + 2H2O (K1)
(1)
диапазоне 380-1300 нм. Для расчетов концентрации
протекает обычно либо в сильнокислых средах,
Np использовали полосу поглощения аква-иона око-
либо в присутствии лигандов, образующих ком-
ло 980 нм {молярный коэффициент погашения ε =
плексы c Np(IV) и Np(VI), либо в растворах с пони-
395 л/(моль·см) [8]}. Так как положение максимумов
женным содержанием воды. В представленной ра-
полос поглощения зависит от состава раствора, были
боте изучена устойчивость Np(V) в концентриро-
изучены спектры поглощения ацетатно-уксусно-
ванных растворах уксусной кислоты.
кислых растворов ионов Np.
Экспериментальная часть
ИК спектры твердых соединений регистрировали
на приборе UR-20 (бывшая ГДР). Для приготовле-
В работе использованы соединения изотопа
ния твердых матриц, содержащих соединения Np,
237Np, преимущественно NpO2Ac·H2O. Хлорная ки-
использовали плавленый KBr.
слота х.ч. содержала 11 моль/л HClO4 и 29.6 моль/л
H2O. Уксусная кислота (HАс) и уксусный ангидрид
Результаты и обсуждение
(CH3CO)2О (Ac2O) имели квалификацию ч.д.а. Рас-
творы ацетата лития (LiAc) готовили из СН3COOH и
Нептуноил-ионы NpO+ в ацетатных и уксусно-
LiOH. Соединения KNpO2(CO3)·nH2O (n ~ 2) и
кислых растворах образуют осадок NpO2Ac·H2O,
K3NpO2(CO3)2·nH2O осаждали из растворов K2CO3
растворимость которого снижается при уменьшении
согласно работе [7]. При необходимости использо-
концентрации воды [9]. В процессе синтеза необхо-
вали дважды дистиллированную воду.
димого нам в исследованиях ацетата нептуноила
364
А. В. Гоголев и др.
нами было отмечено, что в спектрах ледяной уксус-
ной кислоты после отделения осадка NpO2Ac·H2O
появляются слабые полосы оптического поглоще-
ния, вероятно, принадлежащие Np(IV) и (VI). В
дальнейшем были выполнены эксперименты, необ-
ходимые для выяснения устойчивости Np(V) в кон-
центрированных уксуснокислых растворах.
В результате добавления в ледяную уксусную
кислоту ацетата нептуноила NpO2(Ac)·H2O мы полу-
чили взвеси, пригодные для записи спектров оптиче-
ского поглощения. В спектрах таких взвесей присут-
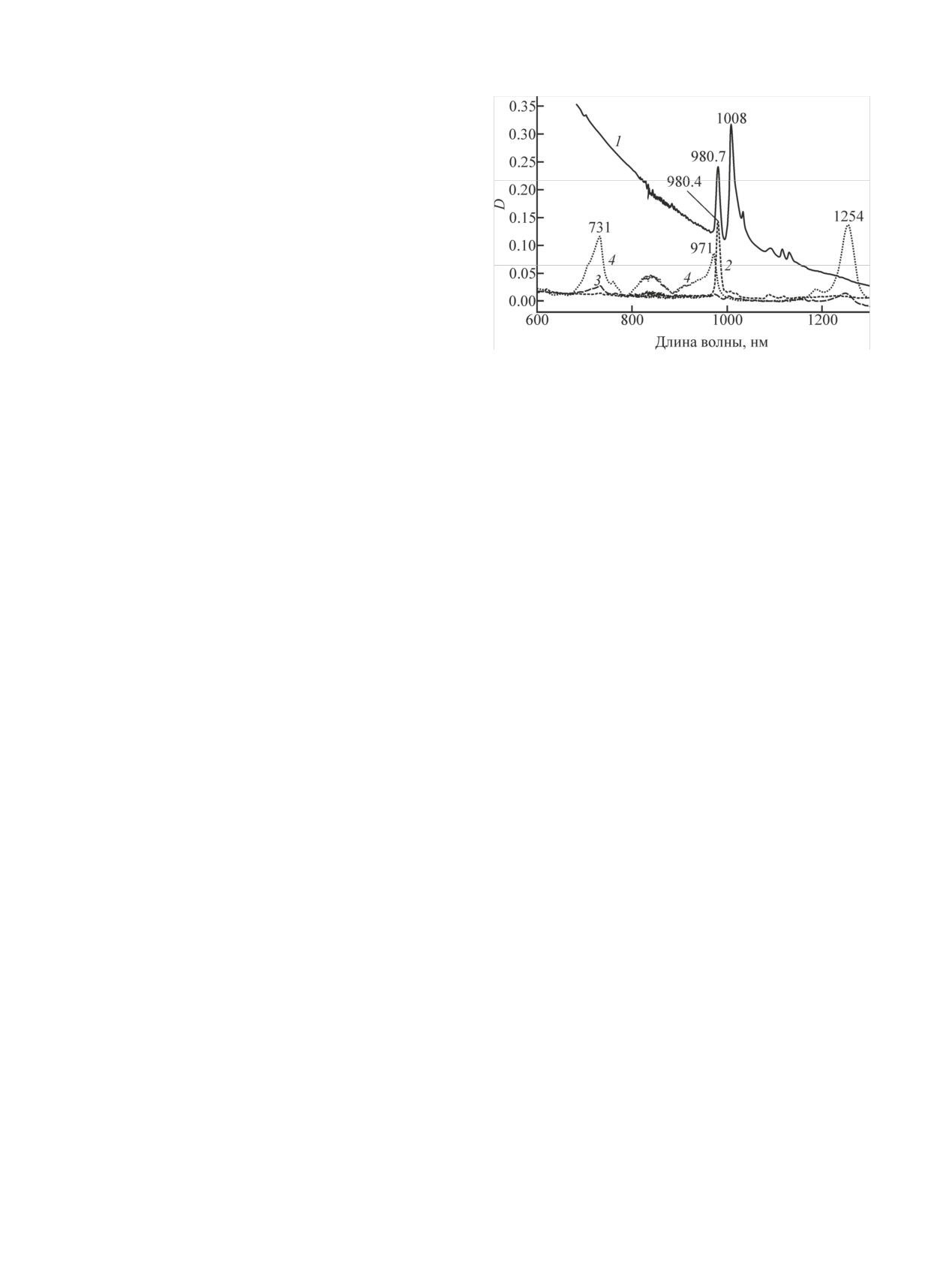
ствуют явно выраженные полосы поглощения с мак-
симумами (λмакс) при 980.2-980.7 и 1008 нм (рис. 1,
спектр 1). Центрифугирование приводит к отделе-
Рис. 1. Спектры растворов и взвеси, содержащих NpO2(Ac): 1 -
нию взвеси и исчезновению принадлежащей ей по-
взвесь 1.6 мг NpO2(Ac)·H2O в 17.5 моль/л HAc; 2 - раствор по-
лосы поглощения с λмакс = 1008 нм (рис. 1, спектр 2).
сле центрифугирования вышеуказанной взвеси; 3 - [HAc] = 14,
[(Ac)2O] = 2.1, ∑[Np] = 6·10-4 моль/л; 4 - [HAc] = 15.2, [(Ac)2O] =
В растворе остается полоса с λмакс = 980.7 нм,
0.25, [HClO4] = 0.4, ∑[Np] = 1.76·10-3 моль/л.
обусловленная, вероятно, равновесной смесью аква-
ионов и моноацетатных комплексов Np(V)
Значение константы равновесия K1 зависит от со-
отношения концентраций HAc, H2O и HClO4. Напри-
NpO2(Ac)aq ⇄ NpO+aq + Ac-.
(2)
мер, в HAc, содержащей
0.9 моль/л НClO4
+
Внесение в содержащую Np(V) ледяную уксус-
5.3 моль/л Н2О Kравн = 0.217. В безводной уксусной
ную кислоту уксусного ангидрида вызывает исчез-
кислоте, содержащей HClO4, Np(V) полностью дис-
= 982 нм) и
новение полосы поглощения Np(V) (λмакс
пропорционирует в соответствии с реакцией
(1).
=
рост полос в области поглощения Np(IV) (λмакс
Пример спектра раствора, полученного в результате
= 1249 нм) (рис. 1, спектр 3).
полного диспропорционирования Np(V), приведен
733 нм) и Np(VI) (λмакс
Такие изменения связаны с удалением из ледяной
на рис. 1, спектр 4.
уксусной кислоты примеси воды по реакциям
Спектры ионов Np в растворах, содержащих аце-
(Ac)2O + H2O + HAc → 3HAc.
(3)
таты лития или калия, свидетельствуют о присутст-
вии различных комплексных форм.
Замещение молекул воды ацетат-ионами или мо-
Для ионов Np(IV) наблюдается сдвиг λмакс в сто-
лекулами уксусной кислоты смещает равновесие ре-
рону длинных волн и уменьшение коэффициентов
акции (1) вправо. Автокаталитическая реакция (3)
погашения. Например, в спектре 4 на рис. 1 λмакс на-
протекает в концентрированных растворах уксусной
ходятся при 731 и 974 нм. Полоса с λмакс 973 нм в
кислоты достаточно быстро [10]. Реакция (1) также
значительной степени перекрывается с полосой по-
относительно быстрая. Например, к 0.95 мл раствора,
глощения Np(V) c λмакс 980.7 нм. Смещение полосы
содержащего 16.6 моль/л HAc + 1.7 моль/л H2O +
поглощения Np(IV) с интервале λмакс 723-733 нм в
0.53 моль/л HClO4 + NpO2(Ac) добавили 0.3 мл
водно-органическом растворителе ранее наблюдали
(Ac)2O. Полоса поглощения с λмакс = 980.7 нм и на-
в работе [10]. В растворе, содержащем 13 моль/л
чальной оптической плотностью 0.57 в полученном
НАс + 2.3 моль/л (Ас)2О + 0.4 моль/л HClO4, значе-
растворе исчезла полностью через 28 мин после сме-
ния λмакс для Np(IV) составляют 731.4 и 973.6 нм.
шивания. В таком процессе параллельно протекают
Вероятно, в ацетатных и уксуснокислых растворах
реакции (2) и (3) и смещается в правую сторону рав-
имеет место образование полимерных частиц Np(IV),
новесие (1). Безводную уксусную кислоту при необ-
как это происходит в уксуснокислых растворах
ходимости получали, добавляя в НАс (Ac)2O, и хра-
Pu(IV) [11].
нили до начала экспериментов ~20 ч.
Обратный процесс репропорционирования проте-
В спектре Np(VI) λмакс и ε также зависят от [H+] и
кает при добавлении H2O к смешанному растворите-
[H2О]. Значительный рост εмакс для Np(VI) может
лю HAc-(Ac)2O, содержащему Np(IV) и Np(VI). Из-
быть объяснен полным замещением молекул воды на
быток воды удаляет из раствора (Ac)2O и смещает
молекулы недиссоциированной HAc в координаци-
равновесие реакции (1) влево вследствие протекания
онной сфере иона металла. Подтверждением этого
реакций (2) и (3) и гидратации возникающих ионов
предположения может быть рост εмакс при увеличе-
Np(V). В HAc, содержащей ~0.06 моль/л H2O, Np(IV)
нии концентрации НСlО4 и (Ac)2О. Для раствора,
и Np(VI) полностью превращаются в Np(V) за
содержащего 16.7 моль/л НАс + 0.5 моль/л (Ac)2О +
~40 мин.
4.54·10-3 моль/л Np(VI), λмакс = 1252 нм и ε1251 =
Устойчивость нептуния(V) в концентрированных растворах уксусной кислоты
365
119 л/(моль·см). Максимальный сдвиг длинноволно-
Таблица 1. Влияние [LiAc] на спектр водных растворов
вой полосы Np(VI) (λмакс = 1256 нм) в наших экспери-
в области наиболее интенсивной полосы поглощения
при [Np(V)]0 = 3 ммоль/л
ментах наблюдался для раствора, содержащего
13 моль/л НАс + 2.3 моль/л (Ac)2О + 0.4 моль/л
[LiAc], моль/л
λмакс, нм
εмакс, л/(моль·см)
HClO4. В работе [3] изменения в спектре Np(VI) при
0
980
395а
росте pH ацетатных растворов связаны с последова-
0.11
981.4
279
тельным образованием моно-, ди- и триацетатных
0.22
983
245
комплексов.
0.41
984.2
226
Характерная для гидратированных ионов Np(V)
0.58
985.4
212
полоса поглощения с λмакс = 980.4 нм при увеличении
0.81
985.8
193
концентрации НАс почти не сдвигается в длинновол-
0.72б
985.8
194
новую сторону (λмакс = 980.7 нм). В безводной уксус-
0.65в
980.8
375
ной кислоте λмакс сдвигается до 982 нм, при этом оп-
а Из работы [8].
тическое поглощение невелико вследствие малой
б Раствор содержит 1.9 моль/л НАс.
растворимости NpO2(Ac)·H2O. По-видимому, вслед-
в Раствор содержит 1.7 моль/л НАс + 1.1 моль/л HCl.
ствие малой величины константы автопротолиза кон-
Таблица 2. Влияние [H2O] на спектр ацетатных раство-
центрация ацетат-ионов в уксусной кислоте недоста-
ров в области наиболее интенсивной полосы поглоще-
точна для образования ди- и триацетатных комплек-
ния Np(V)
сов Np(V). Устанавливается равновесие в соответст-
[AcH], моль/л
[KAc], моль/л
[H2O], моль/л
λмакс, нм
вии с реакцией (2). Рост концентрации LiАс вызыва-
16.5
1.0
1.0
990
ет более существенный сдвиг λмакс, при этом коэф-
15.7
0.95
3.6
988.6
фициент погашения εмакс значительно снижается
15
0.91
6
987.6
(табл. 1). Аналогичный эффект вызывает рост кон-
13.7
0.83
10
986.2
центрации NaAc [4, 5] и рост pH ацетатных раство-
12.7
0.77
13.6
985.2
ров [3].
11
0.67
19
985.7
Из табл. 1 следует, что добавка HAc не влияет на
9.5
0.9
23.7
985.2а
λмакс и εмакс. В растворе, содержащем 9.5 моль/л НАс +
а Для этого раствора εмакс = 197 л/(моль·см), что соответствует
0.93 моль/л LiАс, λмакс
=
985.2 нм и εмакс
=
зависимости λмакс-εмакс для содержащих Np(V) растворов LiAc
199 л/(моль·см), что близко к приведенным в табл. 1
(табл. 1).
значениям при длинах волн 985.4 и 985.8 нм. Добав-
ка сильной кислоты превращает ацетат-ионы в уксус-
Введение (Ac)2О в уксуснокислые растворы, со-
ную кислоту
держащие 1 моль/л KАс и растворимые ацетатные
комплексы Np(V), не вызывает диспропорциониро-
LiAc + HCl → HAc + LiCl
(4)
вания. Внесение сильной кислоты приводит к быст-
рому диспропорционированию Np(V) в тех же усло-
и подавляет ее диссоциацию. Такое снижение кон-
виях.
центрации ацетат-ионов приводит к диссоциации
ацетатных комплексов нептуноила и возвращает
В отсутствие (Ac)2О ледяная уксусная кислота
медленно растворяет NpO2Ac·H2O. Через 3 сут кон-
λмакс и εмакс к значениям, характерным для аква-иона
нептуноила. Приведенная в табл. 1 в численном ви-
центрация Np(V) в растворе над осадком составляла
де для растворов LiAc эмпирическая зависимость
~6·10-4 моль/л. В спектре относительно устойчивой
взвеси (рис. 1, спектр 1) присутствует полоса погло-
εмакс от λмакс в графическом виде является линейной
и может быть использована для определения наблю-
щения с λмакс около 1008-1009 нм, которая исчезает
даемого коэффициента погашения по спектру и рас-
после центрифугирования раствора.
чета концентрации Np(V).
Аналогичный спектр был получен для кристалли-
В концентрированных растворах уксусной кисло-
ческих NpO2Ас·Н2О и NpO2Ac в матрицах из NaCl
ты, содержащих внесенные в составе соединений
[12]. По-видимому, взвесь с λмакс около
1008-
KNpO2(CO3)·nH2O и K3NpO2(CO3)2·nH2O ионы K+,
1009 нм содержит мелкокристаллический ацетат
ацетатные соединения нептуноила практически не-
нептуноила.
растворимы. Однако в НАс, содержащей 1 моль/л
В содержащих KAc уксуснокислых растворах
KAc, ацетатные соединения нептуноила растворя-
спектр взвеси имеет два максимума при 1009 и
ются, очевидно, вследствие комплексообразования с
1018-1022 нм (рис. 2, спектр 2). Соединение с λмакс ~
избытком ацетат-ионов. В спектре таких растворов
1020 нм образуется в чистом виде при внесении
имеется полоса поглощения с λмакс = 990 нм. При
K3NpO2(CO3)2·nH2O в безводную уксусную кислоту
последовательном добавлении Н2О λмакс смещается в
(рис. 2, спектр 1). Электронный спектр поглощения
сторону коротких длин волн (табл. 2).
(ЭСП) этого соединения в матрице из KBr содержит
366
А. В. Гоголев и др.
венной неравноценности связей Np-O в диоксока-
тионе. Это часто имеет место при монодентатной
КК координации ильных катионов. На наличие та-
кой особенности строения соединения указывает
присутствие в ЭСП второй полосы поглощения
(1001 нм). Таким образом, по данным спектрального
анализа можно предполагать наличие в структуре
соединения двух кристаллографически неэквива-
лентных нептуноильных группировок, причем одна
из них является бидентатно связанной, тогда как
другая монодентатно координирована к соседнему
атому Np. Однако окончательное заключение о
Рис. 2. Спектры взвесей соединений Np(V) в уксусной кисло-
строении синтезированного соединения может быть
те: 1 - 5 мг K3NpO2(CO3)2·nH2O, [HAc] = 16.7, [(Ac)2O] =
сделано только после приготовления его в виде мо-
0.5 моль/л; 2 - 4 мг NpO2(Ac)·H2O + KxNpO2(Ac)x+1·nH2O, [HAc] =
нокристаллов и проведения прямого структурного
16.7, [(Ac)2O] = 0.5 моль/л; 3 - 0.7 мг NpO2Ac·nH2O, [HAc] = 14.6,
исследования.
[(Ac)2O] = 1.7 моль/л; 4 - 2.928 мг KxNpO2(Ac)x+1·nH2O + 212 мг
KBr.
Термическое разложение ацетата нептуноила-
калия при нагреве до 800°С приводит к черному ос-
татку, который в растворе 0.1 моль/л HNO3 мгновен-
но становится зеленовато-желтым. В раствор пере-
ходит Np(V), однако бóльшая часть осадка не рас-
творяется. Потеря массы при термическом разложе-
нии составляет 33%. Расчеты показывают, что в ис-
ходном веществе на 1 моль NpO2Ас приходится
1.9 моль KАс. Вероятно, основным веществом в
твердой фазе, дающим спектр 4 на рис. 2, является
K2NpO2(Ac)3.
Взвеси NpO2(Ac)·H2O, имеющие в спектре поло-
су поглощения с λмакс ~ 1008 нм, были получены на-
ми в уксуснокислых и содержащих ацетат лития рас-
Рис. 3. ИК спектр предполагаемого соединения K2NpO2(Ас)3.
творах. В таких растворах присутствуют также по-
Взято 2.982 мг К2NpO2(Ас)3 в 212 мг KBr.
лосы поглощения с λмакс в интервале 980-985 нм.
Согласно работам [4, 5], они принадлежат аква-иону
полосу с λмакс = 1018 нм (рис. 2, спектр 4). Для срав-
и моноацетатному комплексу Np(V). Следовательно
нения на рис. 2 дан спектр 3, принадлежащий взвеси
в растворе устанавливается равновесие согласно ре-
NpO2Ас·Н2О в HAc в отсутствие ионов калия с од-
акциям (2) и (5)
ним максимумом при 1009 нм. Очевидно, что полоса
NpO2(Ac)·H2Osolid ⇄ NpO2(Ac)aq.
(5)
поглощения с λмакс = 1018-1022 нм обусловлена при-
сутствием ионов калия в твердой фазе взвеси.
Однако, согласно рисунку в статье [3], моноаце-
Интенсивную полосу поглощения в ИК спектре с
татный комплекс имеет полосу поглощения, почти
максимумом при 736 см-1 и плечом при 796 см-1
идентичную полосе аква-иона Np(V). Для NpO2(Ac)–
(рис. 3), очевидно, следует отнести к антисимметрич-
и NpO2(Ac)32- расчетные максимумы находятся при
ным валентным колебаниям нептуноила(V). Ранее
~981.2 и 985.4 нм соответственно. Образование трех
неоднократно отмечалось [13], что заметное смеще-
ацетатных комплексов Np(V) подтверждено мето-
ние этой полосы в низкочастотную область однознач-
дом EXAFS [3]. Содержащая в своем составе ионы
но свидетельствует о наличии в структуре соедине-
K+ взвесь [предположительно K2NpO2(Ac)3] была
ний катион-катионного (КК) взаимодействия непту-
получена в безводной уксусной кислоте в присутст-
ноильных групп. Кроме того, расщепление νas(NpO+)
вии KAc. Спектр такой взвеси содержит полосы по-
может служить свидетельством их взаимной биден-
глощения с λмакс ~1020 и 990 нм. При разбавлении
татной координации, что подтверждается положени-
водой полоса 990 последовательно сдвигается до
ем максимума основной полосы в электронном спек-
985 нм. Следовательно, для комплекса NpO2(Ac)32-
тре поглощения соединения (1018 нм, рис. 2).
нахождение λмакс при 985 нм представляется малове-
роятным.
Слабая полоса при 652 см-1 может быть отнесена
к симметричным валентным колебаниям νs(NpO+). В
В уксуснокислых растворах Np(V) устойчив и
этом случае можно сделать заключение о сущест-
находится в виде NpO+aq и NpO2(Ac)aq. Вследствие
Устойчивость нептуния(V) в концентрированных растворах уксусной кислоты
367
малой растворимости из уксуснокислых водных рас-
[3] Takao K., Takao S., Scheinost A. C. et al. // Inorg. Chem.
2009. Vol. 48, N 18. P. 8803-8810.
творов осаждается NpO2(Ac)·H2O, из безводной ук-
[4] Rao L., Tian G., Srinivasan T. G.·et al. // J. Solution Chem.
сусной кислоты также осаждается NpO2(Ac), вероят-
2010. Vol. 39, N 12. P. 1888-1897.
но, безводный. Ацетат нептуноила более растворим
[5] Maiwald M. M., Skerencak-Frech A., Panak P. J. // New J.
в ледяной уксусной кислоте, содержащей KAc. Из
Chem. 2018. Vol. 42, N 10. P. 7796-7802.
безводной и ледяной уксусной кислот, содержащих
[6] Ананьев А. В., Шилов В. П. // Радиохимия. 1992. Т. 34, N 1.
С. 125-132.
ацетат калия, осаждается соединение, в состав кото-
[7] Висящева Г. И., Волков Ю. Ф., Симакин Г. А. и др. // Ра-
рого входят ионы калия. Предположительно осадок
диохимия. 1974. Т. 16, N 6. С. 853-859.
содержит K2NpO2(Ac)3. Ассоциация ионов становит-
[8] Hagan P. G., Cleveland J. M. // J. Inorg. Nucl. Chem. 1966.
ся возможной вследствие низкой диэлектрической
Vol. 28, N 12. P. 2905-2909.
проницаемости уксусной кислоты (ε = 6.2) по срав-
[9] Бессонов А. А., Григорьев М. С., Афонасьева Т. В.,
Крот Н. Н. // Радиохимия. 1989. Т. 31, N 4. С. 33-37.
нению с водой (ε = 80).
[10] Cohen B., Amis E. S., Sullivan J. C., Hindeman J. C. //
J. Phys. Chem. 1956. Vol. 60, N 5. P. 701-702.
Список литературы
[11] Alei M., Jonson Q. C., Cowan H. D., Lemons J. F. // J. Inorg.
Nucl. Chem. 1967. Vol. 29, N 9. P. 2327-2339.
[1] Magnusson L. B., LaChapelle T. J. // J. Am. Chem. Soc. 1948.
[12] Бессонов А. А., Афонасьева Т. В., Крот Н. Н. // Радиохи-
Vol. 70, N 11. P. 3534-3538.
мия. 1990. Т. 32, N 5. С. 31-35.
[2] Fried S., Davidson N. // J. Am. Chem. Soc. 1948. Vol. 70,
[13] Крот Н. Н., Григорьев М. С. // Успехи химии. 2004. Т. 73,
N 11. P. 3539-3547.
N 1. С. 89-100.