386
Радиохимия, 2019, т. 61, N 5, c. 386-396
Теоретический расчет температуры осаждения
в термохроматографии из термодинамических данных
© Б. Л. Жуйков*
Институт ядерных исследований РАН, 117312, Москва, пр. 60-летия Октября, д. 7а;
*e-mail: bz@inr.ru
Получена 27.08.2018, после доработки 03.03.2019, принята к публикации 11.03.2019
УДК 543.544.33 ± 544.584
Предложена модель для расчета энтальпии адсорбции или температуры осаждения в термохромато-
графии ультрамикроколичеств веществ исходя из термодинамических данных. В данной модели энтро-
пия адсорбции на инертной поверхности принимается такой же, как при адсорбции молекул адсорбата
на поверхности макроколичества того же вещества, а энтальпия адсорбции, вычисленная с этим предпо-
ложенем, хорошо и универсальным образом коррелирует с энтальпией процесса десублимации макро-
количеств веществ. В данном подходе описывается также процесс, сопровождающийся химическими
реакции на поверхности. Экспериментальные данные по термохроматографии в разных условиях Zr, Hf,
W, Re, Tl, Pb, Bi (без носителя) и других аналогов трансактинидных элементов находятся в хорошем
согласии с вычислениями. Таким образом, предлагаемая модель применима для интерпретации и пред-
сказания термохроматографических результатов.
Ключевые слова: газовая хроматография, термохроматография, сверхтяжелые элементы.
DOI: 10.1134/S0033831119050058
Разделение элементов и соединений методом га-
взаимодействии адсорбата с поверхностью. Это су-
зовой хроматографии играет большую роль в радио-
щественно для предсказания и интерпретации полу-
химии. Один из вариантов хроматографии - термо-
чаемых результатов.
хроматография (разделение на отрицательном по
В случае осаждения на температурном градиенте
ходу газа температурном градиенте) - является весь-
макроколичеств веществ температура осаждения
ма информативным методом, позволяющим в одном
может быть довольно просто оценена как температу-
эксперименте определить температуру осаждения и
ра конденсации, исходя из зависимости давления
теплоту адсорбции (десорбции) нескольких веществ
паров от температуры (в пренебрежении кинетикой
в состоянии без носителя на определенной поверх-
осаждения). Определенная сложность возникает,
ности. Этот метод широко используется для разделе-
когда составы газообразной и конденсированной фаз
ния радионуклидов, полученных в ядерных реакци-
отличаются, как это особенно часто бывает в случае
ях на ускорителях. Особенно большое значение тер-
оксидов, т.е. происходят химические реакции в про-
мохроматография сыграла при изучении свойств
цессе возгонки или осаждения. В опытах с ультра-
новых трансактинидных элементов в Дубне, начиная
микроколичествами элементов или соединений во-
с пионерских работ И. Звары с сотр. по химии эле-
прос о правильности интерпретации термохромато-
мента 104 - резерфордия (Rf) [1]. Позднее метод был
графических данных и о возможности корректного
использован разными авторами для химической
предсказания температуры осаждения в термохрома-
идентификации и исследования химических свойств
тографических колонках более сложный. Как отме-
и других трансактинидных элементов, а также тяже-
чается в работе [2], к удивлению малое количество
лых актинидов.
атомов нужно, чтобы установить химическую иден-
С теоретической точки зрения термохроматогра-
тичность, т.е. поведение отдельных атомов или мо-
фия ранее рассматривалась в работах И. Звары,
лекул вещества может достаточно определенно ха-
Б. Айхлера, А. Ф. Новгородова и других авторов, где
рактеризовать его поведение в макроколичествах.
устанавливалась зависимость положения и формы
Однако в случае химического взаимодействия с по-
термохроматографического пика от энтальпии ад-
верхностью это не совсем так: отличие в поведении
сорбции и параметров эксперимента. Однако неко-
макроколичеств и ультрамикроколичеств может ока-
торые важные аспекты остались до конца не выяс-
заться очень существенным, когда наличие макроко-
ненными: как могут меняться и какое значение для
личеств препятствует контакту с поверхностью и
процесса имеют частота колебаний адсорбирован-
соответственно химической реакции молекул сорба-
ной молекулы на поверхности и коэффициент акко-
та и сорбента. Кроме того, большее значение приоб-
модации (прилипания); какие особенности с теоре-
ретает влияние микропримесей в газе, которые мо-
тической точки зрения возникают при химическом
гут участвовать в химических реакциях.
Теоретический расчет температуры осаждения в термохроматографии из термодинамических данных
387
Температура осаждения в термохроматографии в
Энтальпию десорбции (адсорбции) обычно опре-
основном определяется энтальпией адсорбции ΔH0,
деляют исходя из линейных корреляций со стандарт-
которая коррелирует с энтальпией сублимации. Но
ной энтальпией сублимации (ΔН0), при этом корре-
при переходе из газового в адсорбированное состоя-
ляционные соотношения различны для разных типов
ние химический состав адсорбата нередко меняется,
соединений, и в ряде случаев наблюдаются значи-
и в этом случае некорректно говорить только об эн-
тельные отклонения от эмпирических зависимостей
тальпии сублимации или адсорбции одного конкрет-
[11-13]. Используются также корреляции непосред-
ного соединения. Кроме того, энтропийный фактор
ственно между ΔНs и Тa [15, 16], справедливые толь-
может играть очень существенную роль.
ко в случае, если опыты проведены в одинаковых
условиях.
В этой работе предлагается модель для описания
поведения ультрамикроколичеств элементов и со-
Энтропию десорбции (адсорбции) определяют
единений в термохроматографии, основанная на
исходя из молекулярно-кинетического рассмотрения
обоснованной корреляции с термодинамическими
[7, 8]
данными. Предварительные результаты данной ра-
ΔS0 = R ln[s0ν(2πM/RTa)1/2]
(3)
боты были изложены еще в 1982, 1996 и 2005 гг. [3-
6], а в данной работе результаты представлены с
или по сходным выражениям [8, 13].
учетом также некоторых более поздних публикаций.
Здесь ν - частота колебаний адсорбированной
молекулы по нормали к поверхности (скорость де-
Основные положения модели расчета
сорбции пропорциональна частоте этих колебаний),
температуры осаждения элементов
s0 - стандартное значение площади колонки на еди-
и соединений без учета химических реакций
ницу ее длины (принимается здесь равным 1 см2/см),
М - молекулярная масса адсорбата. Обычно значе-
Данная модель базируется на частичной анало-
ние ν принимают равным частоте колебания кри-
гии процессов десорбции и сублимации. В рамках
сталлической решетки адсорбента, одинаковой для
этой модели можно описать также процессы с хи-
всех адсорбатов (обычно около 1012-1013 с-1), что
мическими реакциями на поверхности.
определяет также весьма близкие значения ΔS0 для
В предположении об установлении адсорбцион-
всех типов адсорбатов (ΔS0/R ≈ 20).
ного равновесия в случае линейного распределения
Такое рассмотрение не учитывает, во-первых,
температуры по колонке температура осаждения
специфику различных атомов и молекул адсорбата
(т.е. температура максимума термохроматографи-
при их колебании на поверхности. Во-вторых, ско-
ческого пика), Тa (К), определяется из известного
рость адсорбции пропорциональна в молекулярно-
соотношения [7, 8]
кинетическом представлении коэффициенту акко-
модации, или прилипания (α). В предыдущих моде-
(tQg/sТ0) exp (ΔS0/R) = Ei*(ΔH0/RTa) - Ei*(ΔН0/RTst),
(1)
лях при соударении молекул или атомов адсорбата с
где ΔН0 - стандартная энтальпия десорбции (ΔН0 =
поверхностью фактически α принимается равным
-ΔН0); ΔS0 - стандартная энтропия десорбции (ΔS0 =
единице, однако в реальности α может быть намного
ниже [14]. Этот вопрос особенно существенен при
-ΔSa0); t - продолжительность транспортировки ад-
адсорбции сложных молекул, где, вероятно, можно
сорбата по колонке; Q - расход газа-носителя при
говорить лишь об эффективном значении νeff, равном
стандартных условиях (обычно при давлении 1 бар
ν/α. В-третьих, данная модель практически не должна
и Т0 = 298 К); Тst - стартовая температура колонки,
действовать в случае химических реакций на поверх-
К; Т0 - стандартная температура колонки, 298 К;
ности, если десорбция по определенному механизму
g - величина температурного градиента (Т = Тst - gl),
происходит не до химической реакции, а лишь при
g > 0; s - поверхность стационарной фазы на едини-
соударении с молекулой реагента, находящейся в
цу длины колонки; Ei*(z) - интегральная показатель-
газовой фазе или адсорбированной на поверхности.
ная функция
Тогда вообще некорректно принимать за νeff частоту
Ei*(z) = (ez/z)(1 + 1/z + 1/z2 + ...).
(2)
колебания в кристаллической решетке адсорбента, как
предполагалось ранее в процессах адсорбции с разло-
Предложен ряд простых аппроксимаций уравне-
жением газообразных молекул в работах [15-19].
ния (1), связывающего Тa, ΔНd, ΔSd0 и параметры экс-
Можно экспериментально измерить νeff и соот-
перимента (см., например, работы [3, 5, 9, 10]).
ветственно ΔS0, варьируя в различных опытах пара-
Таким образом, чтобы оценить теоретически Тa и,
метры (t, Q) [10, 11, 20, 21], либо по форме термо-
следовательно, интерпретировать результаты опы-
хроматографического пика [22, 23], а также в опы-
тов, кроме параметров эксперимента необходимо
тах по изотермической хроматографии при разных
знать ΔНd0 и ΔSd0.
температурах (см., например, работы [24, 25]), что
388
Б. Л. Жуйков
достаточно эффективно, когда сорбция в системе
При рассмотрении сублимации как адсорбции-
происходит только по одному механизму. Но это
десорбции молекул с поверхности того же вещест-
довольно сложные и трудоемкие эксперименты.
ва ΔН0 = ΔН0 (с точностью до энергии перехода
Имеются эмпирические оценки ΔS0 хлоридов, полу-
между различными структурами в конденсирован-
ченные в такого рода экспериментах [23].
ном состоянии).
В данной работе предлагается оценивать νeff и ΔS0
В данном случае N будет равно количеству мо-
из значений энтропии сублимации ΔSs0 исходя из не-
лекул в монослое, оно может быть оценена как
которой аналогии между процессами конденсации и
N = (Аρ/М)2/3 [см-2],
адсорбции, хотя сам характер процессов десорбции-
где А - число Авогадро, ρ - плотность, г/см3.
адсорбции, конечно, принципиально отличается от
По известному соотношению давление насы-
сублимации-десублимации [26, 27]. Десорбция в га-
зовую фазу вещества с поверхности вещества такого
щенных паров приблизительно можно оценить как
же состава, как и возгоняющееся вещество, сопрово-
р = exp(ΔS0/R)exp(-ΔH0/RT) [бар],
(5)
ждается изменением энтропии десорбции. Эта вели-
или, в единицах атом/см3,
чина отличается от энтропии сублимации. Энтропии
этих процессов даже некорректно количественно
C = (A·106/RT) exp (ΔS0/R) exp (-ΔH0/RT) [см-3].
(6)
сравнивать, так как энтропия десорбции требует оп-
Подставляя в (4) значения C и N и далее численные
ределения дополнительного термодинамического
значения А = 6.02·1023 и R = 8.314·107 эрг/(моль·К),
стандарта - стандартной площади колонки на едини-
получаем (в единицах СГС)
цу ее длины s0 (здесь принимается 1 см2/см). Однако
ν/α = νeff = 106(2π)-1/2A1/3ρ-2/3M1/6R-1/2T-1/2 exp (ΔS0/R) =
энтропии сублимации и десорбции определяются в
большей степени не положением молекул в решетке
= 3.7·109ρ-2/3М1/6Т-1/2 exp(ΔS0/R).
(7)
и на поверхности, а энтропией самих газообразных
Подставляя это выражение ν/α вместо ν в (3) и
молекул. Энтропия газообразных молекул вносит
далее s0 = 1 см, а также численные значения для A
основной вклад в разницу энтропий десорбции для
и R, получаем связь между энтропиями сублима-
разных веществ. Энтропия плавления для простых
ции и адсорбции в данном случае:
веществ и веществ со сферически симметричным
ΔS0 = ΔS0 + R ln(106s0A1/3М2/3ρ-2/3R-1Т-1) =
взаимодействием сама по себе очень невелика
[порядка 8 Дж/(моль·К) - правило Ричардса]; для дру-
= ΔS0 + Rln(1.02·106М2/3ρ-2/3Т-1) = ΔS0 + Rln(4·106r0A/RT).
гих неорганических соединений она может быть зна-
(8)
чительно больше [28], но все же, как правило, намно-
Здесь ρ измеряется в г/см3, r0 - радиус молекулы
го меньше энтропии перехода в газовое состояние.
на поверхности (предполагая плотную упаковку).
Это говорит об относительно слабом влиянии кри-
В табл. 1, приведены, в частности, значения эн-
сталлической структуры на энтропию сублимации и
тропии десорбции ΔSd,298 для различных элементов и
десорбции. Таким образом, достаточно обоснованно
соединений, рассчитанные по уравнению
(8) из
предполагать, что энтропия десорбции с поверхности
имеющихся в литературе [31] значений энтропии
вещества того же химического состава (это не энтро-
сублимации ΔSs,298, а также значения νeff (т.е. ν/α),
пия сублимации) будет близка или, по крайней мере,
вычисленные по уравнению (7). Как видно, значения
будет коррелировать с энтропией десорбции с инерт-
энтропии десорбции для различных элементов и со-
ной поверхности, которая к тому же под действием
единений значительно отличаются, а вычисленные
газа-реагента может трансформироваться и напоми-
значения νeff оказываются, как правило, выше, чем
нать поверхность вещества-сорбата (хлорида, оксида)
1012-1013 с-1, особенно в случае хлоридов и других
[14, 23]. Дальнейшее рассмотрение производится ис-
сложных молекул. Это можно объяснить низким зна-
ходя из данного предположения об энтропии десорб-
чением коэффициента аккомодации α, который бли-
ции (конечно, в случае истинных химических реак-
зок к единице лишь в случае адсорбции атомов. Так-
ций на поверхности или специфической адсорбции
же возможно, что в этом случае в больших молеку-
энтропия может довольно сильно изменяться).
лах сорбата для десорбции существенны также коле-
Адсорбцию-десорбцию молекул с поверхности в
бания атомов между собой, а ν не определяется про-
условиях равновесия можно описать следующим
сто частотой вибрации кристаллической решетки
известным кинетическим уравнением [4]:
фонона в веществе сорбента.
∂N/∂t = Wads - Wdes = αC(RT/2πM)1/2 - Nν exp (-ΔНd0/RT),
Вышеприведенные уравнения получены для слу-
чая адсорбции на том же веществе, пока без химиче-
(4)
ского взаимодействия.
где N - концентрация молекул на поверхности; C -
Для описания процесса термохроматографии
концентрация молекул в газовой фазе.
ультрамикроколичеств веществ предположим те-
При равновесии ∂N/∂t = 0.
перь, что отношение ν/α (или, менее строго, отноше-
Теоретический расчет температуры осаждения в термохроматографии из термодинамических данных
389
Таблица 1. Сравнение экспериментальных и расчетных данных по термохроматографии различных элементов и соедине-
ний
ΔHs,298,
ΔHd,298,
ΔSs,298,
ΔSd,298,
νeff, с-1
Тa, К
Тa, К
Ссылка на
Элемент/
кДж/моль
кДж/моль
Дж/(моль·К)
Дж/(моль·К)
[уравне-
[уравне-
(экспери-
экспе-
соединение
(табличная)
[уравнение (13)]
(табличная)
[уравнение (8)]
ние (7)]
ние (16)]
мент)
римент
Pb
196.0 ± 0.8
194 ± 14
110.5 ± 2.1
185
3.6·1013
857
840 ± 60
[29, 30]
Bi
208.5 ± 1.3
209 ± 11
130.3 ± 0.4
206
4.4·1014
835
830 ± 50
[29, 30]
Hg
63.3 ± 0.1
63 ± 3
98.9 ± 0.4
181
1.3·1013
300
298 ± 10
[29, 30]
Au
367 ± 1
342 ± 11
133 ± 0.2
201
2.9·1014
1433
1388 ± 45
[29, 30]
Ag
284 ± 4
299 ± 5
130 ± 0.2
199
3.0·1014
1169
1223 ± 50
[30]
AgCl
220
221 ± 9
149 ± 2
226
5.7·1015
815
813 ± 30
[21]
AgBr
217
211 ± 8
149 ± 2
227
5.6·1015
801
775 ± 30
[21]
CsCl
210
203 ± 5
156 ± 5
237
1.8·1016
748
718 ± 15
[21]
CsBr
200
198 ± 4
154 ± 2
236
1.4·1016
715
703 ± 15
[21]
ZnCl2
149
159 ± 4
168 ± 1
252
1.1·1017
506
533 ± 15
[21]
ZnBr2
144
146 ± 5
165 ± 5
250
6.6·1016
485
493 ± 15
[21]
ZrBr4
119 ± 7
125 ± 4
192 ± 5
282
1.9·1018
368
383 ± 10
[21]
HfBr4
106 ± 7
117 ± 4
183 ± 4
273
6.0·1017
338
368 ± 10
[21]
NbBr5
88
89 ± 7
151 ± 20
240
1.4·1016
314
313 ± 10
[21]
OsO4
67 ± 8
69 ± 7
157 ± 13
250
3.7·1016
233
233 ± 20
[12]
ние констант скорости адсорбции и десорбции) оста-
[4, 3, 6]
нется тем же при адсорбции на другой химически
ΔH0/RTa = ΔS0/R + ln(0.11tQg/s),
(12)
инертной поверхности.
Учитывая, что при реальных соотношениях пара-
или
метров Еi(z) ~ ez/z, логарифмируем (1), пренебрегая в
ΔH0 = Ta[ΔSd0 + R ln(0.11tQg/s)],
(12a)
правой части (1) вторым слагаемым (ввиду того, что
Тs >>Тa). В результате получаем
или
ΔH0/RTa = ΔS0/R + ln(tQg ΔH0/sT0RTa),
(9)
Ta = ΔH0[ΔSd0 + Rln(0.11tQg/s)]-1.
(12б)
или, с учетом (3) и (7),
C использованием (8)
ΔH0/RTa = ΔS0/R + ln(1.02·106M2/3ΔH0tQg/sρ2/3T0RT2). (10)
ΔHd0/RTa = ΔS0/R + ln(1.12·105M2/3tQg/ρ2/3Tas).
(13)
Уравнения (9) и (10) содержат определяемую ве-
Величина и размерность коэффициента под лога-
личину ΔH0 в неявной форме, но отношение ΔH0/RТa
рифмом предполагает использование системы СГС
в левых частях уравнений слабо зависит от Тa, ΔH0 и
для параметров эксперимента. Это приближение
параметров экспериментов, и эти уравнения удобно
наиболее употребительно при расчетах Ta или ΔH0 в
решать методом последовательных приближений:
реальных условиях.
приняв некоторые первые значения ΔH0/Тa и Тa в
Третье приближение, приведенное в работе [4],
правой части уравнений, вычислить вторые значе-
практически не употребительно с учетом точности,
ния и т.д., и таким образом выразить ΔHd0 в явной
достижимой в реальных экспериментах.
форме.
В табл. 1 приведены значения энтальпии десорб-
Первое приближение [4], определенное для час-
ции ΔHd0, вычисленные в данной модели по форму-
то используемых значений параметров эксперимен-
ле
(12а) из опубликованных экспериментальных
тов в режиме off-line, приведенных, например, в ра-
данных по температурам осаждения Ta с использова-
боте [12] (t = 60 мин, Q = 20 см3/мин, g = 20 К/см, s =
нием значений энтропии десорбции ΔS0, вычислен-
10 см2/см). При Тa, М и ΔS0, приведенных в табл. 1,
ной по формуле (8). В табл. 1 приведены только те
получаем
случаи, когда существование данного химического
ΔH0/RTa = 33 ± 7.
(11)
состояния и в газовой фазе, и на поверхности, со-
Это простейшее соотношение для оценки энталь-
гласно термодинамическим расчетам, не вызывает
пии десорбции или, наоборот, температуры осажде-
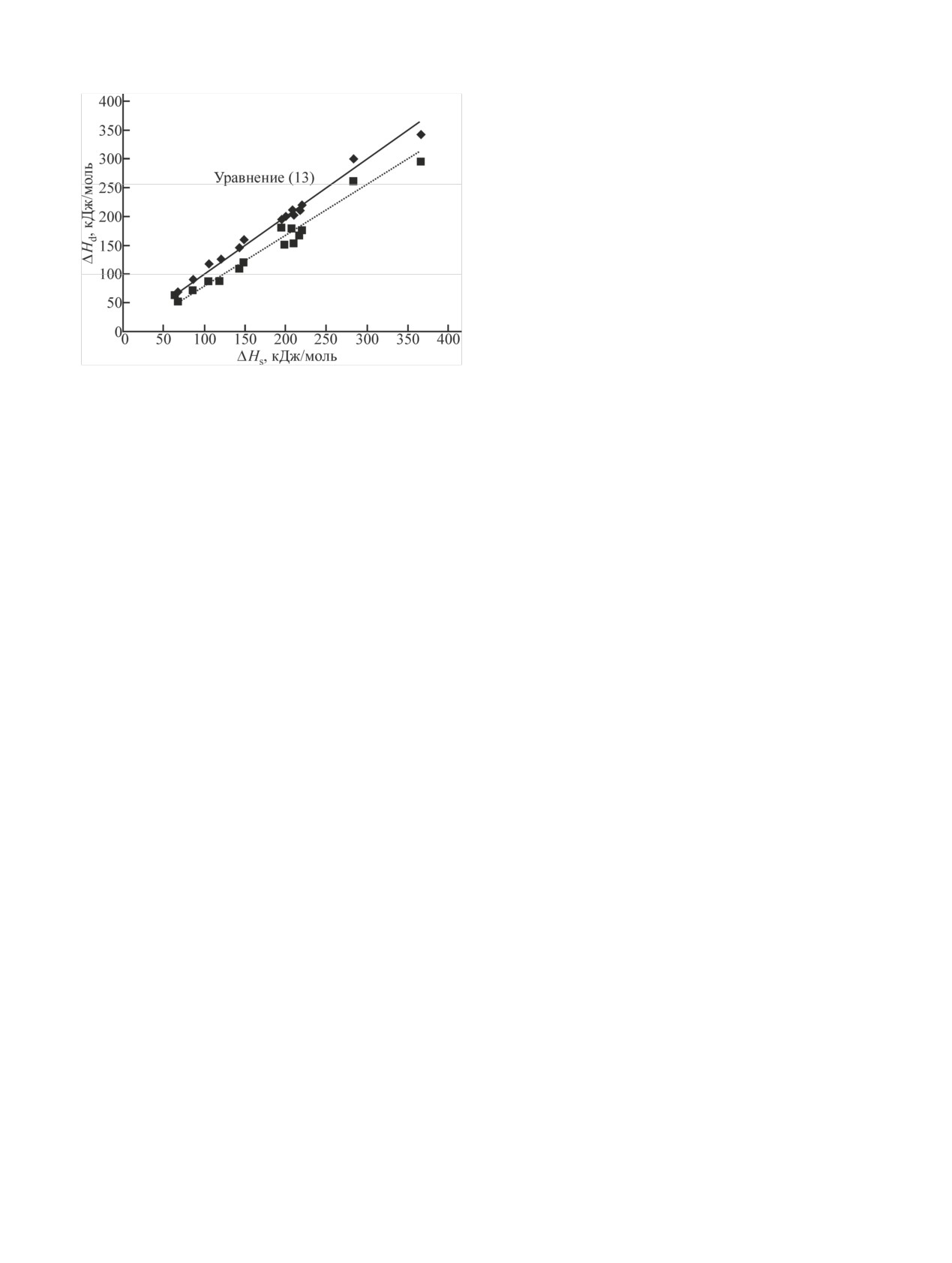
сомнений. На рисунке представлена корреляция ме-
ния при наиболее распространенных условиях про-
жду энтальпией сублимации ΔH0 и энтальпией де-
ведения термохроматографических экспериментов.
сорбции ΔHd0, вычисленной по нашей модели [урав-
Однако оно совершенно неприменимо при возмож-
нение (13)]. Обработка данных из табл. 1 по крите-
ных химических реакциях на поверхности.
рию минимального χ2 дает следующую зависимость
(наша модель):
Второе приближение. В уравнении (10) в правой
части полагаем ΔH0/RTa = 33, Т0 = 298 К и получаем
ΔHd,298 = 0.998ΔHs,298 + 1.9 [кДж/моль]
(14)
390
Б. Л. Жуйков
при обработке данных по старой модели корреляции
обычно строятся для одного типа соединений). По
данным ряда экспериментальных работ (для адсорб-
ции на химически инертной поверхности) c Pb [10]
(см. ниже), Cf [20] и различными хлоридами [22, 23,
32, 33], где ΔH0 определялась независимо от величи-
ны ν или ΔSd0, также получается, что значения ΔH0 и
Уравнения (3), (12а)
ΔH0 довольно близки. Так, энтальпия адсорбции Cf
на титане была найдена равной 162 ± 8 кДж/моль
[20], в то время как энтальпия его сублимации со-
ставляет 163 кДж/моль.
И наоборот, пользуясь теперь этим обстоятельст-
вом, решая обратную задачу и положив для любого
соединения ΔHd,298 = 0.998ΔHs,298 + 1.9, мы можем
рассчитывать Тa для ультрамикроколичеств веществ
Корреляция между стандартной энтальпией сублимации ΔHs и
стандартной энтальпией десорбции ΔHd, вычисленной по
при их адсорбции на инертных поверхностях, зная
предлагаемой нами модели [уравнение (13)] и по ранее ис-
лишь стандартные термодинамические значения и
пользовавшейся модели [уравнения (3) и (12а)].
условия экспериментов.
Преобразуем уравнение (13), выразив Тa в явном
при χ2/(m - 2) = 1.07.
виде, подставив для этого в правой части под лога-
В то же время при определении ΔHd,298 с расче-
рифмом Тa ≈ ΔH0/33R [согласно (11)] и 0.998ΔHs,298 +
том энтропии по старой модели [рассчитано нами
1.9 вместо ΔHd0:
по формулам (3) и (12а)] при одном и том же ν =
Тa = ΔH0/{Rln[3.7·106М2/3QtgR/sρ2/3(0.998ΔHs,298 + 1.9)] +
5·1012 получаем
+ ΔS0}.
(16)
ΔHd,298 = 0.82ΔHs,298 + 3.7 [кДж/моль]
(15)
В табл. 1 приведены значения Тa для различных
при значительно большем значении минимального
элементов и соединений, вычисленные по форму-
χ2/(m - 2) = 2.63. А только для хлоридов (в работе
ле (16). Они хорошо совпадают с эксперименталь-
[15]) - вообще ΔHd,298 = 0.655ΔHs,298 + 18, т.е. вычис-
ными значениями.
ленные значения энтальпии здесь получаются значи-
тельно более низкими.
Расчет температуры осаждения в случае
Таким образом, при вычислении ΔH0 по нашей
химических реакцией на поверхности
модели значения ΔHs,298 и ΔH0 коррелируют гораздо
лучше (при том же наборе экспериментальных дан-
Конкретные случаи адсорбции-десорбции с хи-
ных), чем при вычислении ΔHd0 по ранее предложен-
мическими реакциями на поверхности рассматри-
ной модели с одним и тем же значением ν даже в тех
вались и раньше [15, 16] в предположении, что ха-
случаях, когда нет химических реакций на поверхно-
рактер процесса не влияет на ν. Мы рассмотрели
сти.
[5] общий случай с другим предположением - что
νeff и соответственно энтропия адсорбции в случае
Более того, наш подход позволяет объяснить не-
химических реакций такие же, как и при адсорб-
которые экспериментальные результаты, которые
ции микроколичеств газообразного вещества на
количественно не объясняются в рамках старой мо-
макроколичество вещества в соответствующей ре-
дели (см. ниже). Еще более существенен данный
акции в конденсированной фазе.
подход в случае химических реакций на поверхно-
сти, когда изменение энтропии и, следовательно, эф-
Рассмотрим десорбцию или сублимацию веще-
фективное значение ν, вообще говоря, может ме-
ства X, когда она происходит под действием реа-
няться в очень широких пределах.
гента А и сопровождается химической реакцией на
В данной модели в случае адсорбции (при расче-
поверхности с образованием газообразного веще-
те энтропии десорбции нашим методом) на инерт-
ства Y и реагента B
ной поверхности значения энтальпии сублимации и
Xads + аА = Ygas + bВ.
десорбции получаются довольно близкими, хотя ис-
Кинетическое уравнение для реакции адсорб-
тинная энтальпия адсорбции вещества даже на хи-
ции-десорбции в этом случае будет выглядеть сле-
мически инертной поверхности, конечно, не должна
дующим образом:
точно совпадать с энтальпией сублимации. При этом
такая близость наблюдается для разных типов соеди-
∂N/∂t = [Ygas][В]bKa exp(-Ea/RT) - N[А]aKd exp(-Ed/RT),
нений в одной единой корреляции (в то время как
(17)
Теоретический расчет температуры осаждения в термохроматографии из термодинамических данных
391
где Еa и Еd - энергии активации реакций адсорбции и
ские свойства начальных и конечных продуктов в
десорбции, Еd - Еa = ΔНrd - энтальпия реакции де-
реакции возгонки (табл. 2). Как видно из табл. 2, ес-
сорбции, Ka и Kd - коэффициенты в уравнениях ско-
ли вычислять энтропию реакции десорбции указан-
рости реакций адсорбции и десорбции соответствен-
ным способом (которая меняется в широких преде-
но.
лах) и использовать общую корреляцию энтальпии,
полученную для элементов и соединений, расчетная
Константа равновесия реакции десорбции (∂N/∂t =
температура осаждения также во многих случаях
0)
оказывается близка к экспериментальной, что де-
K = Kd/Ka = [Y][B]b/[X][A]a = exp (ΔSrd/R) exp (-ΔНrd/RT)
монстрирует применимость данной модели для са-
(18)
мых разных случаев.
(ΔSrd - энтропия реакции десорбции).
С другой стороны, сравнивая рассчитанную из
термодинамических параметров температуру осаж-
При наличии адсорбата в ультрамикроколичест-
дения и температуру осаждения, полученную непо-
вах реакции на поверхности и в газовой фазе воз-
средственно в термохроматографических экспери-
можны не только при а, b = 1, но и при других значе-
ментах, можно подтвердить или опровергнуть пред-
ниях. Это возможно, например, когда определяющей
положение о химическом характере процесса воз-
стадией реакции является взаимодействие с метаста-
гонки. И наоборот, зная из термохроматографиче-
бильным соединением, ионом или радикалом, кон-
ских опытов температуру осаждения, можно оце-
центрация которого зависит от степенной функции
нить ΔН0 возгонки элементов или соединений либо
макрокомпонента. Впрочем, при равновесии резуль-
ΔН0 реакции. Ниже мы обсудим соответствие между
тат не зависит от механизма реакции, а лишь от на-
рассчитанными таким образом температурами осаж-
чальных и конечных продуктов и их термодинами-
дения и определенными в термохроматографиче-
ческих (энергетических) характеристик. В то же вре-
ских экспериментах (табл. 1, 2).
мя в принципе возможно значительное замедление
процессов химической сорбции или десорбции из-за
Сравнение экспериментальных результатов
малого количества молекул адсорбата, особенно при
с теоретическими расчетами
низких температурах. Это должно сказываться в
большей степени на форме (ширине), чем на поло-
Рассмотрим более подробно данные по термохро-
жении максимума термохроматографического пика.
матографии в различных условиях некоторых эле-
ментов (табл. 1 и 2), которые интересны в первую
Предположим, что в случае реакции на поверхно-
очередь как аналоги сверхтяжелых элементов. Эти
сти, как и в случае адсорбции на инертной поверхно-
примеры показывают, как предложенный нами под-
сти, энтальпии реакций десорбции и сублимации
ход позволяет количественно объяснить имеющиеся
также близки и будут коррелировать по соотноше-
экспериментальные результаты.
нию ΔНrd,298 = 0.998ΔН
rs,298
+ 1.9, если вычислять
энтропию процесса вышеизложенным методом. И
В первую очередь в каждом конкретном случае
сравним затем полученные результаты с экспери-
мы произвели термодинамическую оценку возмож-
ментальными данными, чтобы проверить последнее
ности существования различных соединений в газо-
предположение.
вой фазе и на поверхности, а также возможных хи-
мических реакций. Мы не приводим здесь все воз-
Проведя преобразования, схожие с (6)-(13), полу-
можные варианты, в табл. 1 и 2 даны только наибо-
чаем приближенное выражение для температуры
лее реальные из возможных химических состояний.
осаждения в случае химических реакций
Ta = (0.998ΔНrs,298 + 1.9){ΔSrd + Rln(0.11tQg[A]a/[B]bs)}-1,
Свинец и висмут
(19)
Свинец и висмут (аналоги элемента 114 - флеро-
или
вия, Fl и элемента 115 - московия, Mc), как было
показано в ряде работ [29, 30, 34], в токе водорода
Тa = (0.998ΔНrs,298 + 1.9)/{Rln(3.7×
имеют близкие температуры осаждения на кварце-
(20)
×106M2/3QtgR[A]a/[B]bρ2/3sΔНrs) + ΔSrs}.
вой поверхности. Однако, несмотря на то что Bi
имеет более высокое значение энтальпии сублима-
Здесь М и ρ относятся к конденсированной фазе
ции, чем Pb, обычно Bi осаждается при несколько
адсорбата.
более низкой температуре. Это становится особенно
Таким способом, в рамках данной модели можно
заметным, когда термохроматографию обоих эле-
рассчитать температуру осаждения Тa веществ в со-
ментов проводят в одном опыте. Согласно данной
стоянии ультрамикроколичеств, зная параметры про-
модели, эти экспериментальные результаты количе-
ведения экспериментов (Q, g, t, s) и термодинамиче-
ственно объясняются тем, что расчетное значение
392
Б. Л. Жуйков
Таблица 2. Сравнение экспериментальных и расчетных данных по термохроматографии в случаях, когда возможны
химические реакцииa
Эле-
Газ-
Материал
Возможная реакция возгонки
ΔHrs,298,
ΔSrs,298,
Тa, К
Та, К
Ссылка
мент
носитель
колонки
(десорбции)
кДж/моль
Дж/(моль·К)
(расч.)
(эксп.)
на эксп.
–
-
Tl(тв) = Tl(г)
181
117
766
-
-
He + 3% H2O
Au
Tl(тв) + H2O(г) = TlOH(г) + 1/2 H2(г)
142
67
900
923 ± 30
[13]
Tl
H2 + 3% H2O
Fe, Ni, Cu
TlOH(тв) = TlOH(г)
133
167
461
473 ± 30
[4, 34]
H2 + 3% H2O
SiO2
Tl(тв) + H2O(адс) = TlOH(г) + 1/2 H2(г)
186
186
606
617 ± 20
[3, 29, 30]
Au
Pt(тв) + O2(г) = PtO2(г)
171
13
1440
>1425
[4, 35]
Pt
Воздух
SiO2
Pt(тв) + O2(адс) = PtO2(г)
171
197
553
553
[36]
SiO2
IrO2(тв) + 1/2 O2(адс) = IrO2(г)
246
218
674
700 ± 30
[12]
Ir
Воздух
SiO2, Au
IrO2(тв) = IrO2(г)
249
188
734
700 ± 30
[4, 12]
RuO2(тв) = RuO2(г)
55
160
160
<298
[37]
Ru
Воздух
SiO2
RuO2(тв) + 1/2 O2(г) = RuO3(г)
255
201
685
670 ± 60
[12]
RuO2(тв) + O2(адс) = RuO4(г)
121
209
334
360 ± 40
[37, 38]
W
O2 + H2O
SiO2
WO3(тв) + H2O(г) = WO2(OH)2(г)
179
87
799
810 ± 40
[39]
Ar + SOCl2 +
ZrCl4(тв) = ZrCl4(г)
113
190
355 ± 16
393 ± 10
[21]
Zr
SiO2
SO2
ZrOCl2(тв) + SOCl2(г) = ZrCl4(г) + SO2(г)
129
170
430
423
[40]
Ar + SOCl2 +
HfCl4(тв) = HfCl4(г)
110
181
349 ± 16
373 ± 10
[21]
Hf
SiO2
SO2
HfOCl2(тв) + SOCl2(г) = HfCl4(г) + SO2(г)
148
175
488
423
[40]
* Значения ΔHrs и ΔSrs рассчитаны исходя из данных в справочных изданиях [31] и [41], а также данных работы [42].
ΔS0 (и соответственно ΔSd0) для Bi значительно вы-
энтропия десорбции ΔS
rd
составляет от
288 до
ше, чем для Pb (табл. 1).
384 Дж/(моль·К), а это значительно ниже экспери-
ментальной величины. Однако в этой работе факти-
В работе [10] использовали в качестве газа-
чески была измерена эффективная энтропия, кото-
носителя водород или аргон при изучении термохро-
рая, согласно (19), выше ΔSrd на член Rln[O2]-x/2. Со-
матографии свинца на кварцевом стекле. Температу-
держание кислорода в газе-носителе в работе [10] не
ру осаждения измеряли в зависимости от параметров
приведено. Но при реальных его концентрациях по-
эксперимента. Таким образом, ΔHd0 и ΔSd0 определя-
лучаются расчетные значения эффективной энтро-
ли независимо, меняя расход газа и время проведе-
пии, также соответствующие эксперименту. Так, при
ния термохроматографии.
среднем значении x =1.5 и [O2] = 10-6 получаем
В данном случае в газовой фазе должно реализо-
ΔS0 = 422 Дж/(моль·К). Таким образом, эксперимен-
ваться элементарное состояние свинца. На поверх-
ты, описанные в работе [10], также количественно
ности кварцевого стекла в водороде должно реализо-
объясняются предложенной нами теоретической мо-
ваться элементарное состояние, а в токе аргона веро-
делью, хотя экспериментальные значения энтальпии
ятно образование оксида. В результате определенная
десорбции немного выше, возможно в результате
таким образом энтальпия десорбции в токе водорода
взаимодействия с образованием силиката.
составила 222 ± 8 кДж/моль и оказалась близка и
даже несколько больше, чем энтальпия сублимации
Термохроматография таллия в токе водорода
свинца (196 кДж/моль), а энтропия десорбции -
222 ± 8 Дж/(моль·К) [вычисленная по нашей моде-
Изучение поведение таллия (аналог элемента 113 -
ли - 185 Дж/(моль·К)].
нихония, Nh) дает другой пример, как данная модель,
учитывающая химические реакции, позволяет количе-
А токе аргона были получены очень высокие зна-
ственно объяснить экспериментальные результаты,
чения: ΔH0 = 498 ± 17 кДж/моль и ΔSd0 = 427 ±
полученные и нами, и другими авторами.
21 Дж/(моль·К). Как показывают наши расчеты, на
кварцевой поверхности свинец здесь должен нахо-
Энтальпия сублимации металлических Tl и Pb
диться в виде различных оксидных форм PbOx (x от
отличаются не сильно (соответственно
181 и
1 до 2), и реакция сублимации должна быть следую-
196 кДж/моль), однако в противоречии с простыми
щей:
корреляциями при термохроматографии в токе водо-
рода Tl осаждается при значительно более низких
PbOx(тв) = Pb(г) ± x/2 O2(г).
температурах, чем Pb: 200-340°С на кварце [5, 12,
Энтальпия этой реакции, рассчитанная в зави-
22], 200°С на железе [23], 220-330°С на никеле [10,
симости от величины x, составляет от
415 до
27], 230°С на меди [27]. В то же время температура
473 кДж/моль, что близко к экспериментально полу-
осаждения (и энтальпия десорбции) на некоторых
ченным значениям. Но рассчитанная по формуле (8)
других металлах намного выше: на золоте 650°С [5],
Теоретический расчет температуры осаждения в термохроматографии из термодинамических данных
393
на палладии [10] и титане [35] - более 1350°C.
модействие с образованием интерметаллических
соединений, температура осаждения Tl гораздо вы-
Простые корреляции между Ta и ΔHs0 для возгон-
ше, чем на Cu, Ni, где такие соединения не образу-
ки элементов, предполагающие, что Tl находится в
ются. Однако для количественного применения дан-
элементарной форме и в газовой фазе, и на поверх-
ной модели к случаям интерметаллических соедине-
ности, не объясняют такие температуры осаждения
ний необходимы соответствующие термодинамиче-
Tl в кварцевых и металлических колонках. Эти ре-
ские данные, и корректные квантово-химические
зультаты можно количественно объяснить, если
расчеты для определения энтальпии также примени-
учесть, что в процессе термохроматографии ультра-
мы в комбинации с данной моделью.
микроколичеств Tl могут происходить химические
реакции. В присутствии воды, которая при термо-
Таким образом, имеющиеся результаты по термо-
хроматографии в токе водорода всегда присутствует
хроматографии Tl находят свое количественное объ-
в газе в виде примеси или может образовываться,
яснение. Учет рассмотренных химических реакций
например, из кислорода, диффундирующего из квар-
важен при изучении газохимического поведения Nh
цевого стекла или других материалов, возможно об-
(элемента 113), причем нахождение этого элемента в
разование газообразного гидроксида TlOH в ультра-
виде NhOH будет характеризовать его склонность к
микроколичествах. Согласно термодинамическим
одновалентному состоянию. При этом для подтвер-
ждения химического состояния элемента необходи-
расчетам, вне зависимости от концентрации Tl в газе
при температуре около 400°С отношение [TlOH(г)]/
мо независимо оценить ΔH0 и ΔS0 (которые сильно
[Tl(г)] при давлении паров воды 20 мм рт.ст. состав-
отличаются для разных химических процессов сорб-
ции-десорбции, табл. 2) путем измерения темпера-
ляет 2·102, при 1 мм рт.ст. - 10, а при 0.1 мм рт.ст. -
туры осаждения в присутствии водорода в зависимо-
1. Как показывают оценки, концентрация ОН-
сти от условий эксперимента.
радикалов в газе достаточно велика, чтобы реакция
Tl(г) + OH(г) = TlOH(г)
Поведение платиноидов в токе
кислородосодержащего газа
не была замедлена из-за наличия Tl в ультрамикро-
количествах. Следует отметить, что согласно расче-
Термохроматографическое поведение различных
там, образование гидрида таллия в данных условиях
платиноидов в состоянии без носителя в кислород-
термодинамически невыгодно.
содержащем газе экспериментально изучалось мно-
гими авторами [3, 12, 15, 16, 36, 38, 39, 44-47]. Со-
Из возможных химических реакций в процессе
гласно имеющимся термодинамическим данным,
десорбции Tl на кварцевых колонках эксперимен-
процесс возгонки платиноидов, переходящих из
тальным данным лучше всего соответствует расчет-
конденсированной в газообразную фазу, часто со-
ное значение температуры осаждения около 606 К,
провождается повышением их степени окисления
соответствующее реакции десорбции Tl с водой, об-
[41]. При термохроматографии платиноидов и их
разующейся на поверхности кварцевого стекла, с об-
разованием TlOH в газовой фазе [5]. Аналогичный
соединений на кварцевом стекле кислород, выде-
ляющийся из стекла, ввиду низкой энтропии являет-
процесс предложили позднее в работах [25, 43], но
ся более сильным реагентом, чем газообразный ки-
предполагая образование какой-то формы гидроксида
таллия на поверхности. Хроматографические экспе-
слород. И в результате, как видно из табл. 2, экспе-
рименты для Tl на кварце, но в вакууме, позволяю-
риментальные температуры осаждения Pt, Ir и Ru
щие независимо определить ΔHa0 и ΔSa0, были прове-
отвечают реакциям на поверхности с кислородом,
дены в работе [25], и эти результаты находятся в про-
поступившем из конденсированной фазы.
тиворечии с результатами термохроматографии, ос-
Согласно расчетам, проведенным по данной мо-
нованными на предположении о значении ν для квар-
дели [4, 5], платина осаждается на колонке, переходя
ца 5·1012 - одном для всех соединений и процессов.
из газообразного PtO2 в элементарную Pt на поверх-
В определенных условиях, в частности, при тер-
ности (табл. 2). В то же время, температура осажде-
мохроматографии на Fe, Au, Ni и Cu могут происхо-
ния Pt на золоте (которое не содержит кислорода
дить другие процессы, которые не сопровождаются
при высокой температуре [48]) гораздо выше [3, 4,
поступлением кислорода или воды из материала ко-
35] и соответствует реакции Pt не с адсорбирован-
лонки, а только из газовой фазы (табл. 2). По нашей
ным, а с газообразным кислородом. При этом Ir, как
модели образование собственно адсорбированного
и на кварцевой колонке, осаждается на поверхности
TlOH на поверхности соответствует более низкой
Au при относительно низкой температуре [4]. При
температуре - около 461 К, наблюдавшейся на ко-
термохроматографии Ir в кислороде часто наблюда-
лонках Ni, Сu и нержавеющей стали [34, 13]. А при
ются два близко расположенных пика [4, 16, 46].
термохроматографии таллия в колонках из Ti [44] и
Согласно нашим расчетам, один из этих пиков дол-
Pd [13], а также Au [43], с которыми возможно взаи-
жен соответствовать осаждению IrO2, а другой -
394
Б. Л. Жуйков
переходу газообразного IrO3 в адсорбированный IrO2
нашей модели, иные). При отсутствии воды химиче-
(табл. 2). Расчеты показывают, что другие процессы
ское состояние и в газовой фазе, и на поверхности,
осаждения, в том числе восстановление до металли-
очевидно, будет WO3, что соответствует гораздо бо-
ческого Ir, термодинамически невыгодны. Для объ-
лее высокой температуре осаждения - 800-900°С.
яснения имеющихся данных нет нужды привлекать
Аналогично влияют пары воды на поведение
образование гипотетических соединений Pt и Ir [16]
Re - аналога элемента 107 (Bh). Температура осажде-
в газовой фазе. В результате на колонке из золота Pt
ния Re на кварце зависит от условий опытов. В ре-
и Ir хорошо разделяются (температура осаждения
зультате могут образовываться разные химические
отличается на многие сотни градусов), в то время
состояния в газовой фазе и на поверхности. В наших
как на кварцевой поверхности и на поверхности дру-
экспериментах [3, 52], в том числе в режиме on-line,
гих оксидов (TiO2, Nb2O5, Al2O3 [49]) такого хороше-
температура осаждения Re была около 100°С. Со-
го разделения не происходит.
гласно расчетам по данной модели [5], это соответст-
Рутений, как правило, находится в газовой фазе в
вует наиболее вероятному состоянию в газовой фазе
виде RuO4, а при высокой температуре - также в ви-
HReO4, а на поверхности - ReO3, что также предпо-
де RuO3 [41]. Три наиболее вероятных процесса, свя-
ложили в работе [19]. В других условиях наблюда-
занных с десорбцией и адсорбцией Ru, приведены в
лось образование пиков при более высокой и более
табл. 2, и расчетные температуры осаждения хорошо
низкой температуре [12, 19, 44].
совпадают с приведенными экспериментальными
данными. RuO4 является легколетучим, очень близ-
Термохроматография галогенидов и
ким по летучести к OsO4. Однако в отличие от OsO4
оксигалогенидов циркония и гафния
RuO4 может легко восстанавливаться на инертной
поверхности с образованием адсорбированного
Понимание особенностей в поведении Zr и Hf
важно для правильной интерпретации эксперимен-
RuO2 [5, 15, 50]. Расчетная температура осаждения
тов с их трансактиноидным аналогом - резерфорди-
Ru без носителя для этого процесса вполне соответ-
ствует экспериментальной температуре осаждения
ем (Rf).
50-100°С (табл. 2).
Как было показано нами в работе [5] и также
предположено в работе [17], при термохроматогра-
Таким образом, термохроматографическое пове-
фии хлоридов циркония и гафния в токе газа, содер-
дение Ru говорит не собственно о «летучести» тет-
жащего SOCl2, возможно образование как тетрахло-
раоксида, а больше о его термодинамической устой-
ридов, так и оксихлоридов типа МеOCl2 на поверх-
чивости. Восстановление же более устойчивого ок-
ности. Эти соединения подробно исследованы в мак-
сида OsO4 происходит гораздо труднее, чем RuO4, и
роколичествах в работе [42]. В то же время газооб-
зависит от характера поверхности и условий экспе-
разные оксигалогениды Zr и Hf экспериментально
римента. Учет этих обстоятельств также важен для
интерпретации поведения нового элемента 108 -
не обнаружены, а оценка их ΔНf по энергиям связи
(ΔНf0 ≈ -240 кДж/моль), исходя их данных работы
хассия (Hs) - в экспериментах по его химической
[42], позволяет заключить, что газообразные оксихло-
идентификации [51].
риды этих элементов неустойчивы в данных услови-
Термохроматография вольфрама и рения в токе
ях даже в ультрамикроколичествах и должны мгно-
кислородосодержащего газа
венно необратимо реагировать, например, с SOCl2 с
образованием хлоридов. Поэтому имеет смысл гово-
Поведение радиоизотопов W и Re (аналогов си-
рить не о собственно десорбции оксихлоридов цирко-
боргия Sg и бория Bh) экспериментально исследова-
ния и гафния, а только о реакции десорбции. Данная
лось в работах [3, 12, 18, 19, 35, 39, 44, 46, 49, 51-56].
модель позволяет количественно оценить температу-
Эти эксперименты показали, что во влажном воздухе
ры осаждения и в случае такого процесса.
летучесть Re и W значительно выше, чем в сухом,
Согласно уравнению (19), температура осажде-
очевидно ввиду образования летучих гидроксидов,
ния Zr и Hf в данных условиях должна зависеть от
что давно было известно для макроколичеств ве-
соотношения [SOCl2]/[SO2]. При низких содержани-
ществ [41]. Термодинамические расчеты показыва-
ях SO2 осаждение может происходить в виде тетра-
ют, что в газовой фазе вольфрам здесь находится в
хлоридов. Несмотря на то, что летучести тетрахло-
виде гидроксида WO2(OH)2, а на поверхности наибо-
лее вероятное состояние - WO3. Рассчитанная по
ридов циркония и гафния очень близки, в работах,
данной модели для такого процесса температура оса-
где определение давления паров и ΔН0 для ZrCl4 и
ждения вольфрама [5] - около 520°С (табл. 2) - так-
HfCl4 проводилось одновременно [57], показана не-
же хорошо соответствует экспериментальным дан-
сколько большая летучесть HfCl4. Это отвечает и
ным [39]. То же позднее предположили в работе [18]
экспериментальным термохроматографическим дан-
(но значения энтальпии адсорбции, рассчитанные по
ным [21].
Теоретический расчет температуры осаждения в термохроматографии из термодинамических данных
395
При образовании оксихлоридов на поверхности
сорбции из термодинамических данных, приводит
расчетная температура осаждения 150-210°С (для
к иным значениям энтальпии адсорбции (чем пред-
условий эксперимента [40]), что заметно выше, чем
положение об одинаковых ν для всех сорбатов),
в случае осаждения собственно хлоридов (70-110°С,
которые укладываются в единую корреляцию с
табл. 2). Кроме того, ввиду большего отрицательно-
энтальпией сублимации для всех типов соедине-
го значения ΔНf0 для твердого HfOCl2 по сравнению
ний. Такой подход позволяет количественно объяс-
с ZrOCl2 температура осаждения Hf должна быть
нить ряд термохроматографических данных, в том
несколько выше, чем Zr (а в случае чистых хлоридов
числе с химическими реакциями на поверхности, а
- наоборот). Это также соответствует эксперимен-
также предсказывать температуры осаждения в
там [40]. Истинное содержание кислорода в системе
самых различных химических системах. Расчетные
(главным образом связанного в различные соедине-
температуры осаждения хорошо совпадают с экс-
ния), как правило, очень трудно контролировать,
периментальными.
особенно в опытах on-line. Но соотношение летуче-
Для большей надежности интерпретации химиз-
сти Zr и Hf может служить, таким образом, индика-
ма процесса по данной модели важно независимое
тором, имеем ли мы дело с чистыми хлоридами или
определение ΔН0 и ΔSd0 путем измерения Ta в зави-
же с газообразными хлоридами и оксихлоридами на
симости от t и Q или от концентрации реагента.
поверхности.
Такие эксперименты необходимо проводить, когда
При изучении термохроматографии бромидов
идентификация химического состояния является
циркония и гафния используют BBr3(г) в качестве
принципиальной.
бромирующего агента [21, 58], который является
Автор глубоко признателен проф. И. Зваре, а
более активным галогенирующим агентом, чем
также коллегам из ОИЯИ (Дубна), HZDR (Россен-
SOCl2. Поэтому образование оксигалогенидов здесь
дорф, Германия), GSI (Дармштадт, Германия) и PSI
менее вероятно.
(Филлиген, Швейцария) за полезные рекомендации
Процесс возгонки тетрагалогенидов, так же как и
и критику.
процесс
«химической возгонки» оксигалогенид-
тетрагалогенид, характеризуется довольно высокими
Список литературы
значениями энтропии сублимации (табл. 1, 2) и, сле-
довательно, энтропии десорбции. Согласно уравне-
[1] Zvara I., Belov V. Z., Chelnokov L. P. et al. // Inorg. Nucl.
Chem. Lett. 1971. Vol. 7. P. 1109-1116.
ниям (12б) и (19), это приводит к относительно сла-
[2] Borg R. J., Dienes G. J. // J. Inorg. Nucl. Chem.
1981.
бой зависимости температуры осаждения от време-
Vol. 43. P. 1129-1133.
ни транспортировки по колонке (t), а также от дру-
[3] Жуйков Б. Л. Разделение летучих элементов и окислов:
гих параметров эксперимента (Q, g). Так, в условиях
термохроматография и использование химических фильт-
экспериментов [58, 59] при увеличении t (периода
ров: Сообщ. ОИЯИ. Дубна, 1982. N Р12-82-63. 20 c.; Re-
port ORNL-TR-5125. Oak Ridge (USA), 1984.
полураспада изотопа) в 5 раз, согласно расчетам,
[4] Жуйков Б. Л. Методы разделения летучих элементов и
температура осаждения должна уменьшаться только
оксидов в поиске сверхтяжелых элементов и при получе-
на 10 К, а при оценке по ранее предложенным моде-
нии радиоизотопов: Дис. … к.х.н. М.: МГУ, хим. факуль-
лям - на 20 К.
тет, 1982. 233 с.
[5] Жуйков Б. Л. Расчет температуры осаждения в термохро-
Очевидно, что и элемент
104
- резерфордий
матографии из термодинамических данных: Сообщ. ИЯИ
(Rf) - в ряде проведенных ранее экспериментов так-
РАН. М., 1996. N 0936/96. 13 с.
же мог находиться в газовой фазе в виде тетрагало-
[6] Zhuikov B. L. // J. Radioanal. Nucl. Chem. 2005. Vol. 263.
генидов, а на поверхности - не только виде тетрага-
P. 65-70.
логенидов, но и в виде оксигалогенидов. Рассчитан-
[7] Айхлер Б., Звара И. Определение теплоты адсорбции из
термохроматографических данных. Основные положения:
ные по данной модели температуры осаждения Rf в
Сообщ. ОИЯИ. Дубна, 1975. N Р12-8943. 16 с.
определенных экспериментальных условиях даны в
[8] Eichler В., Zvara I. // Radiochim. Acta. 1982. Vol.
30.
нашей работе [60]. При этом необходимые термоди-
P. 233-238.
намические характеристики оценивались исходя из
[9] Fremont-Lanouranne R., Legoux Y., Merini J. et al. // Hand-
проведенных квантово-химических вычислений по
book on the Physics and Chemistry of the Actinides / Eds
A. J. Freeman, C. Keller. Elsevier, 1985. P. 331-345.
Дираку-Слейтеру и Дираку-Фоку для различных
[10] Fan W., Gaeggeler H. //Radiochim. Acta. 1982. Vol. 31.
возможных электронных состояний Rf, а также из
P. 95-97.
построенных корреляций. Однако точность таких
[11] Айхлер Б., Доманов В. П., Звара И. Определение теплоты
вычислений невысока.
адсорбции на основе термохроматографических данных.
II. Хлориды металлов. Адсорбция на кварце: Сообщ. ОИ-
Заключение
ЯИ. Дубна, 1976. N Р12-9454. 18 с.
[12] Eichler B., Domanov V. P. // J. Radioanal. Chem.
1975.
Теоретическая модель термохроматографии,
Vol. 28. P. 143-152.
базирующаяся на вычислении νeff и энтропии де-
[13] Айхлер Б., Хюбенер З., Жуйков Б. Л., Россбах Г. Адсорб-
396
Б. Л. Жуйков
ция летучих металлов на металлических поверхностях и
[35] Zhuikov B. L. // Isotopenpraxis. 1981. Vol. 17. P. 411-416.
возможности ее использования в ядерной физике и хи-
[36] Доманов В. П., Айхлер Б. А.с. СССР N 580000 // Б.И. 1977.
мии. Сравнение рассчитываемых значений теплот адсорб-
N 42.
ции с данными термохроматографических экспериментов:
[37] Вахтель В. М., Винель Г. В., Вылов Ц. и др. // Радиохимия.
Сообщ. ОИЯИ. Дубна, 1981. N Р12-81-717. 14 с.
1976. Т. 18. С. 886-893.
[14] Акимов А. Г., Казанский Л. П. // Успехи химии. 1981.
[38] Жуйков Б. Л., Круз Х., Звара И. // Физика тяжелых ионов-
1985. Дубна: ОИЯИ, 1986. N Р7-86-332. C. 26.
Т. 50, N 1. С. 3-23.
[15] Eichler B., Zude F., Fan W. et al. // Radiochim. Acta. 1992.
[39] Баяр Б., Воцилка И., Зайцева Н. Г., Новгородов А. Ф. //
Vol. 56. P. 133-140.
Радиохимия. 1974. Т. 16. С. 336-342.
[40] Доманов В. П., Ким У Зин // Радиохимия. 1989. Т. 31.
[16] Eichler B., Zude F., Fan W. et al. // Radiochim. Acta. 1993.
С. 19-23.
Vol. 61. P. 81-90.
[41] Казенас Е. К., Чижиков Д. М. Давление и состав пара над
[17] Eichler B. // Radiochim. Acta. 1996. Vol. 72. P. 19-26.
окислами химических элементов. М.: Наука, 1976. 342 с.
[18] Vahle A., Huebener S., Funke H. et al. // Radiochim. Acta.
[42] Цирельников В. И. Исследования в области физико-
1999. Vol. 84. P. 43-51.
химических свойств галогенидов циркония и гафния:
[19] Eichler R., Eichler B., Gaeggeler H. et al. // Radiochim. Acta.
Автореф. дис
д.х.н. М.: МГУ, 1975. 31 c.
1999. Vol. 87. P. 151-159.
[43] Serov A., Eichler R., Dressler R. et al. // Radiochim. Acta.
[20] Hubener S., Zvara I. // Radiochim. Acta. 1982. Vol. 31.
2013. Vol. 101. P. 421-425.
P. 89-94.
[44] Hübener S., Zvara I. // Radiochim. Acta. 1980. Vol. 27.
[21] Ким У Зин, Тимохин С. Н., Звара И. // Isotopenpraxis. 1988.
P. 157-160.
Vol. 24. P. 30.
[45] Steffen A., Bachmann K. // Talanta. 1978. Vol. 25. P. 677-683.
[22] Зварова Т. С., Чубурков Ю. Т., Звара И. Быстрое разделе-
[46] Адилбиш М., Баяр Б., Воцилка И. и др. // Радиохимия.
ние смесей некоторых элементов III-V групп конденсаци-
1979. Т. 21, N 2. С. 296-307.
ей и адсорбцией летучих хлоридов из газового потока на
[47] Доманов В. П., Айхлер Б., Звара И. // Радиохимия. 1984.
температурном градиенте: Сообщ. ОИЯИ. Дубна, 1968.
Т. 26, N 1. С. 66-76.
N Р6-4130. 16 с.
[48] Вол А. Е., Коган И. К. Строение и свойства двойных ме-
[23] Чубурков Ю. Т., Себ Нам Хо, Альперт Л. К., Звара И. //
таллических систем. М.: Наука, 1976. Т. 3. С. 41.
Радиохимия. 1995. Т. 37, N 6. С. 528-536.
[49] Zhuikov B. L., Popeko G. S., Ortega H. D. // J. Radioanal.
[24] Gaeggeler H., Dornhoefer H., Greulich N., Eichler B. //
Nucl. Chem. Lett. 1987. Vol. 117. P. 11-21.
Radiochim. Acta. 1985. Vol. 38. P. 103-106.
[50] Mun C., Cantrel L., Madic C. // Radiochim. Acta. 2007.
[25] Steinegger P., Asai M., Dressler R. et al. // J. Phys. Chem. C.
Vol. 95. P. 643-656.
2016. Vol. 120, N 13. P. 7122-7132.
[51] Duellmann Ch. E., Bruelle W., Dressler R. et al. // Nature.
[26] Zvara I. // Isotopenpraxis. 1990. Vol. 26, N 6. Р. 251-258.
2002. Vol. 418. P. 859-862.
[27] Бердоносов С. С. Радиохимическое изучение десублима-
[52] Звара И., Доманов В. П., Хюбенер З. и др. // Радиохимия.
ции и новые подходы к определению физико-химических
1984. T. 26, N 1. C. 76-80.
характеристик веществ и материалов: Дис
д.х.н. М.:
[53] Доманов В. П., Тимохин С. Н., Жуйков Б. Л. и др. // Физи-
МГУ им. М. В. Ломоносова, 2003. 104 с.
ка тяжелых ионов-1985. Дубна: ОИЯИ, 1986. N Р7-86-332.
[28] Уббелоде А. Плавление и кристаллическая структура /
С. 16.
[54] Доманов В. П., Хюбенер З., Шалаевский М. Р. и др. // Ра-
Пер. с англ. под ред. А. И. Китайгородского. М.: Мир,
диохимия. 1983. Т. 25, N 1. C. 25-31.
1969; Ubbelohde A. R. Melting and Crystal Structure. Ox-
[55] Bayar B., Vocilka I., Zaitseva N. G., Novgorodov A. F. // Ra-
ford: Clarendon, 1965.
diochem. Radioanal. Lett. 1978. Vol. 34, N 1. P. 75-88.
[29] Айхлер Б. Исследование распределения некоторых про-
[56] Адилбиш М., Зайцева Н. Г., Ковач З. и др. // Радиохимия.
дуктов ядерных реакций без носителей методом термо-
1978. Т. 20, N 5. С. 761-771.
хроматографии в потоке водорода: Сообщ. ОИЯИ. Дубна,
[57] Палко А., Рион А., Кюн Д. // Гафний / Под ред. Л. Н. Ко-
1972. N Р12-6662. 22 с.
миссаровой. М.: Изд-во иностран. литературы,
1962.
[30] Eichler B. // J. Inorg. Nucl. Chem. 1973. Vol. 35. P. 4001-
C. 112.
4015.
[58] Тимохин С. Н., Ким У Зин, Доманов В. П. и др. // Между-
[31] Рузинов Л. П., Гуляницкий Б. С. Равновесные превращения
нар. конф. «Актиниды-89» (Ташкент, 1989): Тез. докл. М.:
металлургических реакций. М.: Металлургия, 1975. 416 с.
Наука, 1989. С. 227-228.
[32] Rudolph J., Bachmann K. // J. Radioanal. Nucl. Chem. 1978.
[59] Звара И., Белов В. З., Короткин Ю. С. и др. Опыты по
Vol. 43, N 1. P. 113-120.
химической идентификации спонтанно делящегося изото-
[33] Rudolph J., Bachmann K. // J. Chromatogr. A. 1979. Vol. 178,
па 105 элемента: Сообщ. ОИЯИ. Дубна, 1970. N Р12-5120.
N 2. P. 459-469.
19 с.
[34] Айхлер Б., Реетц Т., Доманов В. П. Определение теплоты
[60] Zhuikov B. L., Glebov V. A., Nefedov V. S. // Proc. 1st Int.
адсорбции на основе термохроматографических данных.
Conf. on Chemistry and Physics of Transactinide Elements:
III. Элементы. Адсорбция на кварце и металлах: Сообщ.
Extended Abstracts. Seeheim, Germany, 1999. Darmstadt:
ОИЯИ. Дубна, 1976. N Р12-10047. 11 с.
GSI, 1999. O-25.