Радиохимия, 2019, т. 61, N 6, c. 453-463
453
Возможности метода ПЭТ в тераностике онкологических заболеваний
© Р. Н. Красикова*
Институт мозга человека им. Н. П. Бехтеревой РАН, 197376, Санкт-Петербург, ул. Акад. Павлова, д. 9;
*e-mail: raisa@ihb.spb.ru
Получена 31.07.2019, после доработки 16.10.2019, принята к публикации 17.10.2019
УДК 539.163:61
В настоящее время таргетная радионуклидная терапия (ТРТ) является одним из наиболее эффектив-
ных методов лечения онкологических заболеваний. Использование концепции тераностики позволяет
осуществлять персонализированный подход к выбору тактики лечения на основе диагностического ис-
следования методами молекулярной визуализации, среди которых ПЭТ является наиболее чувствитель-
ным и информативным. В данном кратком обзоре рассмотрены важнейшие тераностические пары изо-
топов и соответствующие РФЛП для ТРТ на основе β-эмиттеров, применяемые в клинической практи-
ке, обсуждаются возможности и ограничения хорошо известных агентов и перспективы использования
новых РФЛП в ТРТ.
Ключевые слова: тераностика, таргетная радионуклидная терапия, ПЭТ, дозиметрия, радиотрейсе-
ры, РФЛП, НЭО, ПСМА агенты, α-эмиттеры, β-эмиттеры.
DOI: 10.1134/S0033831119060017
Введение
таболизма, экспрессии рецепторов, антигенов и др.
Отбор пациентов для ТРТ осуществляется на осно-
В настоящее время одним из наиболее многообе-
вании данных этого предтерапевтического исследо-
щающих и динамично развивающихся методов лече-
вания только после подтверждения достаточности
ния онкологических заболеваний является таргетная
накопления диагностического РФЛП в активных
(направленная) радионуклидная терапия (ТРТ). В
центрах мишени с тем, чтобы обеспечить макси-
отличие от классической дистанционной лучевой
мальное накопление в опухолевом очаге при мини-
терапии в ТРТ для облучения опухоли используют
мальном воздействии на окружающие ткани и выво-
так называемое внутреннее излучение радиоизото-
дящие органы (почки, печень).
пов, входящих в состав радиофармацевтических ле-
Метод позитронной эмиссионной томографии
карственных препаратов (РФЛП), таргетно достав-
(ПЭТ) в гибридном варианте ПЭТ/КТ позволяет по-
ляемых в опухолевую ткань с помощью различных
лучать in vivo информацию об основных патологи-
механизмов и процессов, характерных для конкрет-
ческих процессах, ассоциирующихся со злокачест-
ной опухоли. ТРТ основана на концепции терано-
венностью опухолей (гликолиз, транспорт амино-
стики [1-4], объединяющей радионуклидные мето-
кислот, пролиферация, апоптоз и ангиогенез, уро-
ды диагностики и последующей радиотерапии с ис-
вень гипоксии, экспрессия определенного типа ре-
пользованием (в идеальном случае) пары изотопов
цепторов и др.) на молекулярном уровне [5]. В отли-
одного и того же элемента
(124I/131I,
44Sc/47Sc,
чие от однофотонной эмиссионной компьютерной
64Cu/67Cu,
86Y/90Y и др.) в составе однотипного
томографии (ОФЭКТ) ПЭТ дает возможность опре-
РФЛП. Отличительной особенностью ТРТ является
делять количественные характеристики физиологи-
индивидуальный подход к лечению пациента - вы-
ческих и биохимических процессов с участием
бор изотопа и РФЛП, схема применения, сопутст-
РФЛП, поэтому использование ПЭТ в ТРТ более
вующая терапия и др. (персонализированная меди-
предпочтительно. В более 90% ПЭТ исследований в
цина). В дополнение к данным КТ или МРТ о лока-
клинической онкодиагностике используют РФЛП на
лизации и распространенности опухолевого процес-
основе 18F (T1/2 110 мин; 97% β+, 3% ЭЗ; Еβ+
са для ТРТ необходима подробная информация об
0.635 МэВ), часто называемого «идеальным» ПЭТ-
уникальных для данной опухоли патологических
радионуклидом. Малый пробег испускаемых пози-
процессах на молекулярном уровне. Таким образом,
тронов в ткани (2.4 мм) обеспечивает максимальное
предшествующее диагностическое (предтерапев-
пространственное разрешение ПЭТ-изображения, а
тическое) исследование методами молекулярной
относительно большой период полураспада дает воз-
визуализации с использованием РФЛП на основе
можность получения десятков клинических доз
опухолево-специфичных биомаркеров является не-
РФЛП за один синтез и доставки в центры, не имею-
отъемлемой частью ТРТ. Оно позволяет не только
щие собственного циклотронно-радиохимического
определить фенотип опухоли, но и получить количе-
комплекса. Большинство рутинных ПЭТ-иссле-
ственную информацию о нарушении процессов ме-
дований проводится с 2-[18F]фтор-2-дезокси-D-глю-
454
Р. Н. Красикова
козой ([18F]FDG) - уникальным радиотрейсером гли-
В настоящее время ТРТ с использованием клини-
колиза [6], позволяющим решать различные задачи
чески значимых РФЛП является методом выбора
онкодиагностики [7]. В дополнение к [18F]FDG в
при лечении целого ряда онкологических заболева-
ПЭТ-исследованиях опухолей применяют целый ряд
ний [1, 12]; параллельно растет число работ по созда-
РФЛП на основе 18F: 3'-дезокси-3'-[18F]фтортимидин
нию и доклиническим испытаниям новых перспек-
(оценка пролиферации),
[18F]фторомизонидазол
тивных РФЛП [1, 2, 13]. Получению изотопов для
(гипоксические состояния), O-2'-[18F]фторэтил-L-ти-
ТРТ посвящено множество обзоров; стоит отметить
розин ([18F]FET) и 6-L-[18F]FDOPA (метаболизм ами-
работу [14], где рассмотрены результаты исследова-
нокислот), [18F]фторметилхолин и многие другие [8].
ний за период с 2008 по 2018 г., включая не только
Однако в рамках концепции тераностики востре-
методы производства, но и возможности наработки
бованы высокоспецифичные РФЛП на основе мече-
радионуклидов в дозах, достаточных для клиниче-
ных пептидов, протеинов, интактных моноклональ-
ского применения. В зависимости от локализации и
ных антител (мкАТ) или их фрагментов, где в каче-
размера опухоли, а также характеристик патологиче-
стве метки используют изотопы металлов
(68Ga,
ского процесса в ТРТ используют β--эмиттеры с
64Cu, 86Y, 89Zr и др.) [9]. В сравнении с «эталонным»
энергией β-частиц в диапазоне 200-2000 кэВ, α-из-
18F ПЭТ-изотопы металлов отличаются более слож-
лучатели с высокой линейной передачей энергии и
ными схемами распада, наличием сопутствующего
коротким пробегом частиц (50-100 мкм) и радиоизо-
γ-излучения и других видов излучения, а также
топы, претерпевающие распад путем электронного
меньшим выходом позитронов с более высокой
захвата (ЭЗ) и внутренней электронной конверсии
энергией, что приводит к ухудшению пространст-
(ВЭК). Однако в клинической практике ТРТ приме-
венного разрешения и качества ПЭТ-изображения в
няются в основном β--эмиттеры [15], тогда как воз-
целом. Однако, эта проблема решается за счет ис-
можности других групп изотопов, подробно рас-
пользования новых алгоритмов обработки ПЭТ-
смотренных в обзорах [16-18], используются явно
изображения [10].
недостаточно. В табл.
1 приведены ядерно-
физические характеристики радиотерапевтических
Первоочередной задачей ПЭТ в рамках ТРТ явля-
изотопов, широко применяемых в клинической
ется проведение предтерапевтического исследова-
практике (131I, 90Y, 177Lu), а также используемых в
ния, на основании которого уточняется диагноз, де-
синтезе новых РФЛП, проходящих разные этапы
лается заключение о биораспределении РФЛП при
доклинических и клинических испытаний
(67Cu,
последующей радиотерапии с аналогичным по хи-
47Sc, 161Tb), и соответствующие ПЭТ изотопы.
мической структуре агентом в органах и тканях, оп-
ределяется специфичность РФЛП в отношении ми-
В России имеются все предпосылки для развития
шени, уровень экспрессии рецепторов, антигенов и
ТРТ: успешные научные разработки новых методов
др., а также накопление в близлежащих тканях, вы-
получения широко востребованных терапевтических
водящих органах (почках, печени) и костном мозге.
радионуклидов - 177Lu, 225Ac, 223Ra, 227Th и др., а так-
Кроме того, ПЭТ-сканирование проводится и в тече-
же возможноcть проведения ПЭТ/КТ-исследований
ние всей радиотерапии по определенной схеме, в
в сети современных ПЭТ-центров. Вместе с тем,
промежутках между циклами ТРТ, что позволяет
на территории РФ для радиотерапии используют
оценить эффективность лечения и при необходимо-
лишь три зарегистрированных РФЛП - [131I]NaI,
сти провести корректировки протокола. Результаты
[89Sr]SrCl2 и [153Sm]оксабифор, причем два послед-
количественного ПЭТ исследования могут использо-
них являются паллиативными агентами. В связи с
ваться для оценки дозовой нагрузки на опухолевые
этим представленный краткий обзор РФЛП, приме-
ткани и близлежащие органы и прогноза эффектив-
няемых в клинической практике ТРТ, и соответст-
ности ТРТ на индивидуальной основе. Однако прове-
вующих диагностических ПЭТ радиотрейсеров яв-
дение точной дозиметрии является достаточно слож-
ляется актуальным.
ным, трудоемким и дорогостоящим, поскольку для
Рассмотрение радионуклидной терапии с исполь-
этого необходимо несколько последовательных коли-
зованием паллиативных агентов для подавления бо-
чественных ПЭТ-исследований через определенные
левого синдрома при костных метастазах, радиоси-
интервалы времени с тем, чтобы построить кривые
новэктомии при воспалительных заболеваниях сус-
зависимости активности от времени, а также новые
тавов, радиоэмболизации при опухолях печени вы-
алгоритмы обработки данных. В целом ценность до-
ходит за рамки данного обзора.
зиметрии для оптимизации терапевтической дозы на
основании данных ПЭТ нуждается в дальнейшем
ТРТ с использованием 131I
подтверждении [1, 11], тогда как экстраполяция дан-
ных дистанционно-лучевой терапии, где рассчитыва-
Наиболее широко применяемым в практике ТРТ,
ется направленная, а не поглощенная опухолью доза,
в том числе и в таких развитых странах, как Япония
будет приводить к ошибочным результатам.
(более
95% всех радиотерапевтических процедур
Возможности метода ПЭТ в тераностике онкологических заболеваний
455
Таблица 1. Изотопные пары терапевтических β-эмиттеров и ПЭТ-радионуклидов
ПЭТ-радионуклиды (РН)
Терапевтические радионуклиды (РН)
тип распада
Eβ+,max,
тип распада
энергия частиц
пробег в
РН
T1/2
Eγ, кэВ
РН
T1/2
Eγ, кэВ
(%)
кэВ
(%)
E
max, кэВ
ткани, мм
ЭЗ (78)
602.7
364.5
124I
4.18 сут
131I
8.02 сут
β- (100)
607
2.2
β+ (22)
2137
722.8
637.0
627.8
ЭЗ (67)
86Y
14.7 ч
1076.7
90Y
2.7 сут
β- (100)
2290
-
12
β+ (33)
2335
1153.2
ЭЗ (89)
β- (100)
149.0
68Ga
68 мин
177Lu
6.65 сут
500
1.6
β+ (11)
1899
1345.8
208.0
ЭЗ (43.8)
64Cu
12.7 ч
β+ (17.8)
653
67Cu
2.58 сут
β- (100)
577
184.6
2.4
β- (38.4)
571
1346.0
ЭЗ (5.7)
441 (68%)
44Sc
3.9 ч
47Sc
3.35 сут
β- (100)
159.4
-
β+ (94.3)
1470
1157.0
600 (32%)
ЭЗ (82)
152Tb
17.5 ч
161Tb
6.9 сут
β- (100)
590
74.6
0.29
β+ (18)
2500
344.3
[19]), является изотоп 131I, который по праву считают
дартной активности, надежно гарантирующей абла-
первым тераностическим агентом. 131I в смеси с 130I
цию (разрушение радиоактивным иодом остаточной
был впервые применен для лечения токсического
ткани ЩЖ после проведенного хирургического ле-
диффузного зоба (болезни Грейвса) в 1942 г. [20, 21].
чения), или индивидуальный расчет терапевтиче-
С развитием методов получения медицинских изото-
ской дозы, основанный на проведении радионуклид-
пов и доступности реакторного 131I метод радиоио-
ной диагностики (предтерапевтический скан). В на-
дотерапии с использованием [131I]NaI стал широко
стоящее время в большинстве развитых стран при-
применяться в развитых странах для лечения различ-
менение 131I для in vivo диагностики запрещено, по-
ных заболеваний щитовидной железы (ЩЖ), таких
скольку при этом пациент получает необоснованно
как гипертиреоз, токсический или нетоксический
большую дозовую нагрузку. Кроме того, воздейст-
узловой зоб и автономно функционирующие токси-
вие диагностической дозы 131I может приводить к
ческие или нетоксические узлы. Радиоиодотерапия
снижению захвата терапевтической дозы 131I (так
является основным и высокоэффективным методом
называемый stanning). Для планирования радиотера-
выявления и лечения метастазов дифференцирован-
пии при дифференцированном раке ЩЗ рекомендо-
ных карцином ЩЖ - папиллярных и фолликуляр-
вано использование ОФЭКТ/КТ с изотопом 123I
ных. Удобный период полураспада (8.04 сут) обес-
(T1/2 13.6 ч) [22]. Однако в рамках концепции терано-
печивает возможность избирательного накопления
стики для предтерапевтической дозиметрии пред-
значительной дозы радионуклида за сравнительно
почтительнее проведение ПЭТ/КТ исследования с
небольшой временной интервал. Ввиду малого про-
124I с периодом полураспада (T1/2 4.176 сут), позво-
бега испускаемых электронов (Еβmax 0.61 МэВ) в тка-
ляющим накапливать данные по распределению
ни (не более 2 мм) облучение близко расположен-
изотопа в течение нескольких дней после его введе-
ных областей минимально. Поскольку распад 131I
ния [23]. Кроме того, более высокое пространствен-
сопровождается эмиссией γ-квантов (основная ли-
ное разрешение ПЭТ по сравнению с ОФЭКТ и воз-
ния 0.364 МэВ), этот изотоп долгое время использо-
можность получения количественной информации
вался и в диагностике заболеваний ЩЗ методом пла-
позволяют более точно рассчитать максимальную
нарной сцинтиграфии для планирования радиотера-
толерантную терапевтическую дозу для конкретного
певтической дозы.
пациента, а также проводить оценку эффективности
радиотерапии после лечения и стратификацию ин-
Радиоиодотерапия заболеваний ЩЗ основана на
дивидуального риска рецидивов [24].
механизме активного транспорта 131I из крови по-
средством NaI-симпортера в фолликулярный эпите-
Недостатком 124I является то, что позитронный
лий щитовидной железы и способности клеток ЩЗ,
распад (β+ 23%, ЭЗ 77%) сопровождается эмиссией
в том числе и высокодифференцированных опухо-
γ-квантов энергией
0.603
(62.9%) и 0.723 МэВ
лей, к накоплению иода. Важную роль в эффектив-
(10.35%), что приводит к нежелательной (но сущест-
ности радиотерапии опухолей играет вводимая тера-
венно более низкой по сравнению с 131I) дозовой на-
певтическая (лечебная) доза изотопа. Существует
грузке пациента. Кроме того, 124I является не столь
два подхода к определению рекомендуемой терапев-
широко доступным из коммерческих источников,
тической активности: введение так называемой стан-
как 123I, и, несмотря на то, что большинство совре-
456
Р. Н. Красикова
[131I]NaI, Cu(I),
160°C, 40 мин
A
[131I]NaI,
H2O2/CH3COOH,
Б
25°C, 60 мин
Полимер
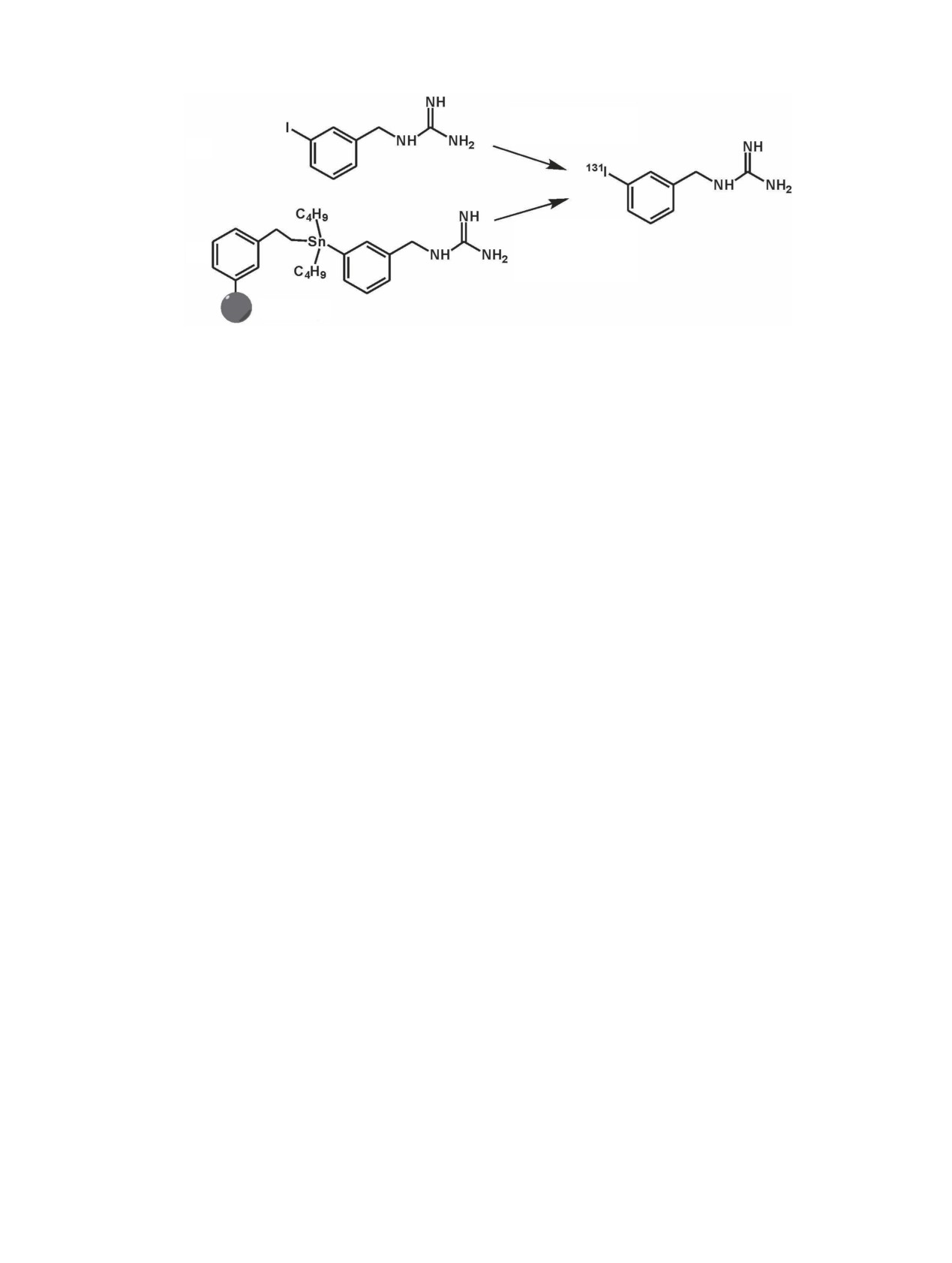
Схема 1. Синтез [131I]MIBG нуклеофильным (А) и электрофильным (Б) методами.
менных циклотронов снабжено твердотельной ми-
дят катализатор [соль Cu(I)], генерируемый in situ в
шенью и системой для выделения данного изотопа,
присутствии метабисульфита натрия [27] (схема 1,
его применение остается ограниченным. Для полу-
А). После нагревания при 160°С в течение 40 мин
чения 124I чаще всего используют ядерную реакцию
продукт выделяют ионообменной хроматографией
124Te(p,n)124I; радионуклид выделяют из облученной
на небольшой колонке, заполненной смолой Dowex.
мишени сухой дистилляцией и улавливают в
Ввиду изотопного обмена удельная мольная актив-
0.2 моль/л NaOH.
ность полученного [131I]MIBG существенно ниже.
Присутствие в препарате нерадиоактивного MIBG
Вторым по значимости и частоте применения
может влиять на эффективность радиотерапии [26],
РФП на основе изотопов иода (после [131I]NaI) явля-
хотя до настоящего времени прямого сравнения
ется меченый м-йодбензилгуанидин (MIBG) - ана-
LSA (low specific activity) и HSA [131I]MIBG не про-
лог нейротрансмиттера норадреналина, экспресси-
водилось. Метод электрофильного радиоиодирова-
руемого адреналин-секретирующими нейроэндок-
ния применяют и в синтезе диагностических агентов
ринными опухолями. [123I/131I]MIBG в течение мно-
[123I]MIBG [26] и [124I]MIBG [28] c использованием
гих лет используется в тераностике метастатической
различных станнильных предшественников. Не-
феохромоцитомы, параганглиомы и нейробластомы -
смотря на преимущества диагностики методом ПЭТ,
злокачественных опухолей, наиболее часто встре-
в недавних рекомендациях Европейской ассоциации
чающихся у детей. [131I]MIBG - один из немногих
ядерной медицины в качестве диагностического
радиотерапевтических препаратов, разрешенных к
агента при радиотерапии феохромоцитом и пара-
клиническому применению управлением по контро-
ганглиом с [131I]MIBG предлагается [123I]MIBG [29].
лю качества пищевых продуктов и лекарственных
Это, возможно, связано с трудностями проведения
препаратов США (Food and Drug Administration,
точной дозиметрии в случае 124I, имеющего слож-
FDA) под маркой Azedra. Он используется в форме
ную схему распада [30]. Вместе с тем, в недавней
«без добавления носителя» {HSA (high specific activ-
работе [31] разработан эффективный протокол ПЭТ-
ity) [131I]MIBG}. Синтез основан на реакции электро-
исследования с [124I]MIBG (два скана вместо тради-
фильного замещения трибутилстаннила («уходящей
ционно используемых четырех) для оценки радиаци-
группы») в молекуле предшественника - трибутил-
онной дозовой нагрузки на опухоль и другие органы
станнилгуанидина - в присутствии окислителя, про-
у пациентов с нейробластомами. Важную роль игра-
текающей при комнатной температуре [25] (схема 1,
ет предтерапевтическое дозиметрическое ПЭТ-
Б). При этом предшественник иммобилизован на
исследование при радиоиодотерапии опухолей у
полимерном сорбенте, что позволяет удалять его из
детей [32], где дозовые нагрузки должны быть све-
реакционной смеси продуктов радиоиодирования
дены к минимуму.
простым фильтрованием. После очистки методом
твердофазной экстракции на одноразовом катионо-
В последние годы отмечается огромный интерес
обменном картридже полученный по этой Ultratrace-
к меченым моноклональным антителам (мкАТ) и их
технологии [131I]MIBG имеет удельную мольную
фрагментам в качестве РФЛП для радиоиммуноди-
активность >1600 мКи/мкмоль [26]. Для производст-
агностики и радиоиммунотерапии [33, 34]. Благода-
ва
[131I]MIBG продолжают использовать и
ря высокой специфичности мкАТ и их фрагменты
«классический» нуклеофильный метод синтеза, ос-
считаются одними из лучших молекул-транс-
нованный на реакции изотопного обмена 127I, нахо-
портеров для ТРТ. В большинстве злокачественных
дящегося в мета-положении бензольного кольца
новообразований наблюдается гиперэкспрессия ха-
MIBG (2-4 мг), на 131I. Для ускорения процесса вво-
рактерных для данной опухоли антигенов, и изго-
Возможности метода ПЭТ в тераностике онкологических заболеваний
457
товление с помощью гибридомной технологии соот-
нуклида бифункциональным хелатирующим аген-
ветствующего антитела и получение соответствую-
том (БХА), способным, в свою очередь, образовы-
щего меченого производного дает огромные воз-
вать ковалентные связи с различными биомолекула-
можности для радиоиммунотерапии. Ввиду доста-
ми (векторами) с высокой специфичностью и селек-
точно долгой циркуляции мкАТ в крови и относи-
тивностью к определенным мишеням. Этот простой
тельно длительных процессов накопления мкАТ в
и удобный метод синтеза обеспечивает доступ к
мишени (несколько дней) для целей и диагностики,
широкому кругу радиотрейсеров - меченых пепти-
и терапии нужны изотопы с периодом полураспада,
дов, протеинов, интактных мкАТ и их фрагментов и
сравнимым со временем накопления терапевтиче-
др. Кроме того, в последние годы для таргетной
ского нуклида в мишени. В настоящее время управ-
доставки предложены различные транспортные сис-
лением FDA к клиническому использованию одоб-
темы, такие как различные типы наночастиц, липо-
рены два РФЛП
-
[90Y]ибритумомаб тиуксетан
сомы, мицеллы, аффибоди, биодеградируемые по-
(Zevalin®,
2002 г.) и
[131I]тозитумомаб (Bexxar,
лимеры, агрегаты альбумина и многие другие (см.
2003). Оба рекомендованы для радиоиммунотерапии
обзоры [17, 39]), большинство из которых пока еще
рецидивирующей или резистентной формы фолли-
находится на стадии доклинических испытаний.
кулярной В-клеточной неходжкинской лимфомы
Лидирующую роль в клинической практике ТРТ
(НХЛ) низкой степени злокачественности. Препара-
играет пептидно-рецепторная радиотерапия (ПРРТ)
ты получены на основе мышиных мкАТ к CD20-
(peptide receptor radionuclide therapy, PRRT) нейро-
антигену, присутствующему на поверхности как
эндокринных опухолей (НЭО), таких как феохромо-
нормальных В-лимфоцитов, так и большинства
цитомы, нейробластомы, карциноидные опухоли,
В-клеточных лимфом [33]. Эффективность радиоим-
инсулиномы и другие [40]. Гиперэкспрессия рецеп-
мунотерапии с РФЛП «[131I]тозитумомаб» подтвер-
торов сомастотина различного типа (sstr1-sstr5),
ждена результатами мультцентровых исследований
характерная для НЭО, дает возможность радионук-
[35]. Однако по коммерческим причинам с 2013 г.
лидной диагностики и радиотерапии с РФЛП на
его поставки прекращены, тогда как
[90Y]ибри-
основе меченых пептидов с высокой аффинностью
тумомаб тиуксетан успешно используется
[36].
к этому типу рецепторов.
Несмотря на наличие «тераностического» 86Y (T1/2
Для конъюгирования металлов с молекулами
14.7 ч), при радиотерапии данным РФЛП в качестве
пептидов предложены различные БХА как линейно-
диагностического агента используют ибритумомаб
го типа (с «открытой» цепью, например DTPA), так
тиуксетан, меченный более долгоживущим 89Zr (T1/2
и циклические - DOTA, NOTA, TETA и др. Послед-
78.4 ч) [37].
ние характеризуются более эффективным связыва-
нием металлов и высокой in vitro и in vivo стабиль-
Уникальным примером эффективности использо-
ностью [41]. Наибольшее применение в ПРРТ полу-
вания изотопов иода является ТРТ пациентов с ней-
чили два РФЛП - [90Y]DOTATOC (Tyr3-OC) и
робластомой - самого распространенного нейроэн-
[177Lu]DOTATATE (Tyr3-Thr8-OC) - конъюгирован-
докринного злокачественного новообразования у
ные с DOTA
(1,4,7,10-тетраазациклододекан-
детей, составляющего 8% внечерепных солидных
N,N',N'',N'''-тетрауксусной кислотой) меченые произ-
опухолей. Нейробластома дает метастазы в трудно-
водные октреотида (ОС), являющиеся агонистами
доступный лептоменингиальный район мозга с
ssrt [40]. Иттрий-90 (100% β-), получаемый в радио-
очень плохим прогнозом и медианой выживаемости
изотопном генераторе 90Sr/90Y, был предложен для
6 мес. Для радиоиммунотерапии было предложено
радиотерапии опухолей еще в 1970-е гг., однако
использовать антитело 8H9 (Буртомаб) - мышиный
использование комбинации двух изотопов - 86Y/90Y
иммуноглобулин [IgG (1)], который распознает B7-
(диагностического и терапевтического, табл. 1) -
H3 антиген, экспрессируемый различными видами
началось лишь в 1992 г., с чего ведет отсчет эра те-
солидных раковых опухолей. После диагностическо-
раностики с использованием изотопов металлов
го ПЭТ исследования с [124I]8H9 дозированно вводи-
[42]. Основным недостатком [90Y]DOTATOC явля-
ли [131I]8H9, при этом использовали метод компар-
ется миелотоксичность, а главное - высокая нефро-
тментальной интратекальной радиоиммунотерапии
токсичность [43, 44], что обусловлено высоким про-
(cRIT), где РФЛП вводится непосредственно в пора-
бегом β-частиц в клетке. Применение в качестве
женную область мозга [38]. В итоге пятилетний пе-
радиотерапевтического радионуклида 177Lu с «ща-
риод выживаемости составил более 30%.
дящими» ядерно-физическими характеристиками
(минимальный пробег β--частиц в ткани 2 мм про-
ТРТ с использованием изотопов металлов:
тив 11 мм для 90Y) оказалось гораздо более эффек-
пептидно-рецепторная радиотерапия (ПРРТ)
тивным ввиду гораздо меньшей нефротоксичности
Введение изотопов металлов в молекулы РФЛП
[177Lu]DOTATATE по сравнению с [90Y]DOTATOC
основано на связывании (инкорпорировании) радио-
[43]. Недавние исследования группы из 807 пациен-
458
Р. Н. Красикова
68Ga/177Lu
DOTA-TATE
68Ga/177Lu-DOTA-TATE
Схема 2. Синтез [68Ga/177Lu]DOTATATE.
тов показали, что ПРРТ с [177Lu]DOTATATE лишь в
дов позволяет элюировать 68Ga несколько раз в день
незначительной степени приводит к нарушению
(обычно дважды в день через 4 ч) [46]. Вместе с
функции почек (нефротоксичности); при этом для
тем, после недавней GMP-сертификации стоимость
снижения дозовой нагрузки на почки одновременно
генератора 68Ga сильно возросла, что стимулирова-
с РФЛП вводят аминокислоты (L-лизин и L-ар-
ло разработку методов его получения по реакции
гинин), ингибирующие реадсорбцию пептида [43].
68Zn(p,n)68Ga путем облучения жидкой или твердой
[177Lu]DOTATATE (Lutathera) является единствен-
мишени циклотрона протонами средних энергий
ным РФЛП, одобренным FDA к применению в
[47, 48]. Важно, что для получения [68Ga/177Lu]
ПРРТ НЭО желудочно-кишечного тракта и подже-
DOTATATE используют один и тот же хелатор
лудочной железы (gastro-entero-pancreatic, GEP) с
(схема 2) [49], хотя состав реагентов в диагностиче-
повышенной экспрессией рецепторов соматостати-
ском и терапевтическом наборе для синтеза РФЛП,
на, подтвердившим свою высокую эффективность.
различается.
Успешное применение данного РФЛП стимулирова-
Так, типичная доза [177Lu]DOTATATE для введе-
ло исследования по созданию технологий производ-
ния пациенту содержит 7.4 ГБк 177Lu с удельной
ства 177Lu для медицинских целей, подробный обзор
активностью 740 ГБк/мг Lu и 140 наномолей (около
которых дан в работе [45].
200 мкг) DOTATATE, тогда как NetSpot содержит
Становлению метода ПРРТ в его современном
40 мкг пептида; кроме того, различается и состав
варианте в большой степени способствовали разра-
дополнительных компонентов [50].
ботки «пептидных» РФЛП на основе 68Ga - наибо-
В отличие от 90Y 177Lu является так называемым
лее широко применяемого генераторного ПЭТ-изо-
«тераностиком»; его распад сопровождается низко-
топа металлов
[46]. Меченные галлием-68 (T1/2
энергетическим γ-излучением (208 и 113 кэВ), и
68 мин) аналоги октреотида широко применяются в
проводимое количественное ОФЭКТ/КТ-исследо-
ПЭТ-диагностике НЭО
[9]. В настоящее время
вание может быть использовано для оценки радио-
[68Ga]DOTATATE, одобренный FDA в 2018 г. под
терапевтической дозы. Однако для точной оценки
маркой NetSpot, рекомендован к клиническому при-
необходимо
4-5 посттерапевтических ОФЭКТ-
менению в ПЭТ-диагностике НЭО. Количественное
сканирований, начиная с момента введения РФЛП и
ПЭТ-исследование в этом случае особенно важно,
далее в течение 3 сут, в каждом цикле лечения. Это
так как НЭО относятся к группе диссеминирован-
является крайне сложным для пациента и увеличи-
ных опухолей без четкой локализации, и выявление
вает стоимость ТРТ. В качестве альтернативы пред-
всех опухолевых участков (lesions) с высокой экс-
ложен метод трехмерной аппроксимации распреде-
прессией ssrt необходимо для последующей радио-
ления дозы 177Lu по данным единичного ОФЭКТ/
терапии с 177Lu, не имеющим собственной «тера-
КТ-исследования, проводимого на четвертый день
ностической пары». По некоторым данным, в ре-
после радиотерапии, при этом, по мнению авторов,
зультате проведения ПЭТ-исследования с NetSpot
достигается удовлетворительная точность оценки
изменение курса лечения было отмечено в более
дозовой нагрузки [51].
70% случаев. Несомненным преимуществом 68Ga
Период полураспада 68Ga (68 мин) явно недоста-
перед другими ПЭТ радионуклидами металлов яв-
точен для проведения дозиметрического исследова-
ляется возможность его получения в изотопном ге-
ния при ПРРТ с 177Lu, более подходящим изотопом
нераторе 68Ge/68Ga, где материнским радионукли-
для этой цели является 64Cu (T1/2 12.7 ч). Интерес к
дом служит долгоживущий 68Ga (T1/2 270.8 сут).
использованию изотопов меди в ТРТ быстро растет
Срок использования такого генератора составляет
[52, 53], хотя работ по клиническому применению
1-2 года, а оптимальное соотношение периодов по-
пока мало. В отличие от изотопов трехвалетных ме-
лураспада материнского и дочернего радионукли-
таллов конъюгирование изотопов меди с DOTA-
Возможности метода ПЭТ в тераностике онкологических заболеваний
459
177Lu, 111In, 90Y, 44Sc, 68Ga
68Ga
PSMA-11
PSMA-617
Схема 3. Структурные формулы PSMA-11 и PSMA-617.
TATE оказалось проблематичным, а полученные
гена обнаруживается при кастратационно-
РФЛП недостаточно устойчивы во времени in vivo.
резистентном неоперабельном раке предстательной
Для решения этой проблемы исследовались самые
железы (КРРПЖ) с метастазом в кости, резистент-
разные БХА (см. обзор [54]), из которых наиболее
ном к гормональной и химиотерапии [58]. В 2012 г.
перспективным считается новый БХА - MeCOSar,
группой ученых из Гейдельберга (Германия) был
образующий очень стабильные комплексы путем
получен меченый 68Ga ингибитор PSMA - малый
образования циклического амина (саркофагина);
пептид, модифицированный мочевиной, - [68Ga]Glu-
новый конъюгат, называемый SarTATE, получают
urea-Lys(Ahx)-HBED-CC ([68Ga]PSMA-11, схема 3)
реакцией MeCOSar с классическим туморотропным
[59]. Для РФЛП этого класса характерны благопри-
пептидом Tyr3-октреотатом
[55]. Полученный
ятная фармакокинетика, высокое и длительное нако-
[64Cu]SarTATE, отличающийся высокой селективно-
пление в опухоли и метастазах, быстрое выведение
стью к ssrt2, хорошо зарекомендовал себя в качестве
из организма, что необходимо для визуализации
ПЭТ-агента в рамках клинических испытаний [56].
мелких опухолевых очагов. В рекордные сроки
В 2018 г. в Австралии начаты клинические испыта-
[68Ga]PSMA-11 прошел путь от разработки и первых
ния с целью проведения ТРТ с [64Cu/67Cu]SarTATE,
исследований на пациентах [60] до клинического
и в случае успеха можно надеяться на внедрение
применения. Проведенное в европейских ПЭТ-
терапевтических РФЛП на основе изотопов меди в
центрах мультицентровое исследование подтверди-
клиническую практику ПРРТ. Следует отметить,
ло исключительно высокие диагностические свойст-
что ввиду большого разнообразия типов и подтипов
ва [68Ga]PSMA-11, позволяющего выявлять рецидив
НЭО в диагностическом ПЭТ-исследовании исполь-
РПЖ даже при очень низких (0.2 нг/мл) уровнях
зуют и другие агенты, выбор которых определяется
простат-специфического антигена (PSA) в плазме
типом опухоли, экспрессией рецепторов, характери-
крови, что невозможно в традиционном ПЭТ-ис-
стиками связывания РФЛП с активными сайтами и,
следовании с [18F]фторметилхолином. В 2015 г. той
конечно, доступностью в рамках конкретного ПЭТ
же группой в рамках концепции тераностики полу-
центра. Широко применяются радиотрейсеры на
чен и [177Lu]PSMA-617 [60, 61], структурно отли-
основе
68Ga с другими БХА (DOTATOC, DO-
чающийся от PSMA-11 наличием хелатирующего
TANOC), а также известный РФЛП класса амино-
агента DOTA (схема 3). В настоящее время [177Lu]-
кислот - 6-[18F]-L-FDOPA.
PSMA-617 широко применяется в клинической
Радиолигандная ТРТ
практике в различных центрах ядерной медицины.
Основным биохимическим показателем эффектив-
Новейшие разработки в ТРТ направлены на соз-
ности радиотерапии являетя уровень PSA в плазме
дание агентов, специфичных к простат-специфи-
крови, снижение которого отмечалось у 70% паци-
ческому мембранному антигену (ПСМА, PSMA) -
ентов с КРРПЖ после циклов терапии с [177Lu]-
интегрированному мембранному протеину, состоя-
PSMA-617 [62].
щему из 750 аминокислот (100-120 кДа) с интрацел-
люлярным, интрамембранным и экстрацеллюляр-
Для дальнейшего увеличения дозы у пациентов,
ным доменами [57]. Высокая экспрессия этого анти-
не реагирующих на «стандартную» радиотерапию
460
Р. Н. Красикова
(non-respondents), необходима предтерапевтическая
ности производства генераторов 68Ga. ПЭТ-центры,
дозиметрическая оценка. Несмотря на высокий уро-
оборудованные собственным циклотроном и уже
вень диагностики КРРПЖ с [68Ga]PSMA-11, 68Ga не
инвестировавшие в дорогостоящие циклотрон и ра-
может применяться в дозиметрическом исследова-
диохимию, могут получать 40-700 ГБк 18F за одно
нии ТРТ с [177Lu]Lu-PSMA-617, так как его период
облучение и соответственно производить PSMA-
полураспада (68 мин) не сравним с таковым для
специфичные радиотрейсеры с туморотропными
177Lu
(6.7 сут). Проведение дозиметрического
характеристиками, близкими к [68Ga]PSMA-11, но
ОФЭКТ-исследования с использованием самого
содержащие в качестве радиоактивной метки 18F
[177Lu]PSMA-617 возможно, но имеет ряд ограниче-
(T1/2 110 мин). Как уже отмечалось, для 18F пробег
ний ввиду необходимости проведения серии скани-
позитронов в ткани составляет всего 2.4 мм (против
рований в разные интервалы времени, а также по-
9.6 мм в случае 68Ga), что дает наилучшее про-
бочными эффектами, связанными с накоплением
странственное разрешение ПЭТ. Начатые в 2008 г.
радионуклида в слюнных и слезных железах, также
работы по синтезу первых PSMA-агентов [67, 68]
экспресси-рующих PSMA, такими, как сухость во
дали толчок исследованиям в этой области. Наи-
рту (ксеростомия), ухудшающими качество жизни
большее применение в настоящее время получил
пациента.
[18F]PSMA-1007 [69, 70], структура которого близка
к PSMA-617, входящего в состав радиотерапевтиче-
В качестве альтернативы [177Lu]PSMA-617 в на-
ского агента. Метод синтеза [18F]PSMA-1007 разра-
стоящее время рассматривается
[161Tb]PSMA-617
ботан в сотрудничестве с фирмой АВХ (Германия) -
[63], поскольку 161Tb (T1/2 6.89 сут) является не толь-
крупнейшим производителем предшественников
ко мягким β-эмиттером с пробегом β-частиц в клетке
для синтеза РФЛП для ПЭТ и ОФЭКТ - и включает
0.27 мм, но и Оже-эмиттером с большим выходом
электронов Оже (12 электронов на распад). Облуче-
всего одну стадию с очисткой продукта методом
твердофазной экстракции (схема 4). Это позволило
ние опухоли электронами Оже существенно улучша-
адаптировать синтез к условиям GMP (good manu-
ет профиль поглощенной дозы и обеспечивает более
facturing practice) [71, 72] и автоматизировать техно-
эффективный терапевтический эффект. Следует от-
логию синтеза на практически всех известных моду-
метить, что в отличие от 177Lu 161Tb образует терано-
лях синтеза РФЛП для ПЭТ, включая кассетные, что
стическую пару с ПЭТ-изотопом 152Tb (T1/2 17.5 ч) и
обеспечивает очень быстрое внедрение. Одной из
ОФЭКТ-изотопом 155Tb (T1/2 5.32 сут), что дает воз-
последних разработок является синтез агента [18F]-
можность более точной дозиметрической оценки
JK-PSMA-7 [73], преимуществом которого является
терапевтической дозы. Представляет интерес и дру-
детектирование метастазов при биохимическом ре-
гой изотоп тербия - 149Tb (T1/2 4.1 ч), который может
быть использован для α-радиотерапии с одновремен-
цидиве КРРПЖ с очень низким уровнем PSA.
Структура нового агента кардинально отличается от
ной регистрацией ПЭТ-изображения (7% β+). Одна-
PSMA-617, однако по туморотропным характери-
ко возможность наработки терапевтических изото-
стикам он успешно конкурирует с [18F]PSMA-1007;
пов Tb в клинически значимых дозах и выбор мето-
в то же время синтез [18F]-JK-PSMA-7 намного
да получения до сих пор являются предметом дис-
сложнее и требует полупрепаративной ВЭЖХ-
куссии
[64]. Большой интерес для тераностики
очистки.
КРРПЖ представляют радиоизотопы скандия - 43Sc
(T1/2 3.9 ч) и 44Sc (T1/2 4.0 ч), которые могут приме-
няться в ПЭТ-диагностике, и 47Sc (T1/2 3.35 сут), при-
РФЛП на основе α-эмиттеров
годный для радиотерапии [64]. Генераторный ПЭТ-
для радиотерапии КРРПЖ
изотоп 44Sc (44Ti/44Sc) успешно использован в синте-
В последние годы большие надежды возлагаются
зе [44Sc]PSMA-617 [65], однако получение терапев-
тического нуклида 47Sc до сих пор остается пробле-
на РФП на основе α-эмиттеров (табл. 2), которые за
счет высокой энергии последовательных альфа-
матичным [66].
переходов приводят к большему числу разрывов
Таким образом, в тераностике КРРПЖ лидирую-
ДНК и обладают высокой поражающей способно-
щую роль играет изотопная пара 68Ga/177Lu. Однако,
стью в отношении раковых клеток.
несмотря на широко известные преимущества «гене-
По сравнению с β-эмиттерами α-эмиттеры обла-
раторного» 68Ga, его использование имеет ряд огра-
дают более высокой линейной передачей энергии
ничений, одним из которых является малая актив-
(ЛПЭ) - ~100 кэВ/мкм - и малым пробегом в тканях
ность изотопа, получаемая при однократном элюи-
и органах [74], что дает преимущества в радиотера-
ровании дорогостоящего 68Ge/68Ga-генератора, высо-
пии опухолей малого размера. В радиотерапии
кая стоимость самого генератора, а также тот факт,
КРРПЖ отличные результаты получены с примене-
что потребность в проведении диагностических
нием [225Ac]PSMA-617 [75]. Лечение пациента с
ПЭТ-сканов с PSMA-агентами превышает возмож-
Возможности метода ПЭТ в тераностике онкологических заболеваний
461
[18F]TBA,
DMSO,
95-105°C
[18F]PSMA-1007
Схема 4. Синтез [18F]PSMA-1007 методом прямого нуклеофильного радиофторирования.
очень высоким уровнем PSA (294 нг/мл) двумя кур-
FDA в 2013 г., является 223RaCl2 (Xofigo), примене-
сами [177Lu]PSMA-617 не привело к какому-либо
ние которого было начато более
15 лет назад.
результату, тогда как при последующей радиотера-
223RaCl2 таргетно воздействует на участки ремодели-
пии с [225Ac]PSMA-617 (3 курса) уровень PSA сни-
рования костной ткани. Встраиваясь в зоны повы-
зился до нормального - 0.1 нг/мл. Посттерапевтиче-
шенной активности остеокластов (опухолевый очаг)
ский ПЭТ-скан с [68Ga]PSMA-11 показал полное от-
подобно кальцию, 223Ra способствует поломкам в
сутствие метастазов в кости скелета. На настоящий
структуре ДНК опухолевых клеток, приводя к выра-
момент радиотерапия α-излучателями считается
женному местному цитотоксическому эффекту на
наиболее эффективным методом лечения КРРПЖ
метастатические очаги. Тем не менее, данный РФЛП
[76], однако, применение важнейшего из них - 225Ac,
не относится к категории таргетных, и рассмотрение
а также и генераторного 213Bi (225Ac/213Bi) ограниче-
возможностей его использования выходит за рамки
но труднодоступностью 233U (исходного радионук-
обзора.
лидного сырья для выделения 225Ac) в связи с требо-
Таким образом, таргетная радионуклидная тера-
ваниями о нераспространении оружейных материа-
пия является одним из наиболее эффективных мето-
лов. Получение 225Ac на ускорителях протонов высо-
дов лечения онкологических заболеваний. Использо-
ких энергий (их всего 5 в мире) является крайне до-
вание концепции тераностики позволяет осуществ-
рогостоящим и требует сложной технологии радио-
лять персонализированный подход к выбору тактики
химического выделения [77, 78].
лечения на основе диагностического исследования
На сегодняшний день первым и единственным
методами молеклярной визуализации, среди кото-
РФЛП на основе α-эмиттеров, зарегистрированным
рых ПЭТ является наиболее чувствительным и ин-
формативным. В данном кратком обзоре рассмотре-
Таблица 2. Ядерно-физические характеристики основ-
ны важнейшие тераностические пары изотопов и
ных α-эмиттеров для ТРТ
соответствующие РФЛП для β- и в меньшей степени
α-радиотерапии, применяемые в клинической прак-
Радионуклид
T1/2
Испускаемые частицы
Emax, МэВ
тике, обсуждаются возможности и ограничения хо-
211At
7.2 ч
1α/1α/1β+
5.982
рошо известных агентов и перспективы использова-
212Bi
1 ч
1α/1β-
6.207
ния новых РФЛП в ТРТ.
213Bi
46 мин
2α/2β-
5.982
223Ra
11.43 сут
4α/2β-
5.979
Список литературы
225Ac
9.95 сут
4α/2β-
5.935
[1] Turner J. H. // Br. J. Radiol. 2018. Vol. 91, N 1091. Paper
227Th
18.68 сут
5α/2β-
6.147
20170893.
462
Р. Н. Красикова
[2] Dash A., Knapp F. F., Pillai M. R. // Curr. Radiopharm. 2013.
[34] Чернов В. И., Брагина О. Д., Синилкин И. Г. и др. // Сиб.
Vol. 6, N 3. P. 152-180.
онкол. журн. 2016. Т. 15, N 2. С. 101-106.
[3] Чернов В. И., Медведева А. А., Синилкин И. Г. и др. // Бюл.
[35] Leahy M. F., Seymour J. F., Hicks R. J., Turner J. H. //
сиб. медицины. 2018. Т. 17, N 1. С. 220-231.
J. Clin. Oncol. 2006. Vol. 24, N 27. P. 4418-4425.
[4] Крылов В. В., Гарбузов П. И., Дроздовский Б. Я. и др. //
[36] Mondello P., Cuzzocrea S., Navarra M., Mian M. // Oncotar-
Терапевтическая радиология: Руководство для врачей /
get. 2016. Vol. 7, N 7. P. 7597-7609.
Под ред. А. Ф. Цыба, Ю. С. Мардынского. М., 2010.
[37] Rizvi S. N., Visser O. J., Vosjan M. J. et al. // Eur. J. Nucl.
С. 383-407.
Med. Mol. Imag. 2012. Vol. 39, N 3. P. 512-520.
[5] Wood K. A., Hoskin P. J., Saunders M. L. // Clin. Oncol. 2007.
[38] Kramer K., Kushner B. H., Modak S. et al. // J. Neurooncol.
Vol. 19. P. 237-255.
2010. Vol. 97, N 3. P. 409-418.
[6] Gallagher B. M., Fowler J. S., Gutterson N. I. et al. // J. Nucl.
[39] Chakravarty R., Hong H., Cai W. // Mol. Pharm.
2014.
Med. 1978. Vol. 19. P. 1154-1161.
Vol. 11, N 11. P. 3777-3797.
[7] Петриев В. М., Тищенко В. К., Красикова Р. Н. // Хим.-
[40] Sabet A., Biersack H.-J., Ezziddin S. // Sem. Nucl. Med. 2016.
фармацевт. журн. 2016. Т. 50, N 4. С. 3-14.
Vol. 46. P. 40-46.
[8] Coenen H. H., Elsinga P. H., Iwata R. et al. // Nucl. Med.
[41] Price E. W., Orvig C. // Chem. Soc. Rev. 2014. Vol. 43.
Biol. 2010. Vol. 37. P. 727-740.
P. 260-290.
[9] Krasikova R. N., Aliev R. A., Kalmykov S. N. // Mendeleev
[42] Rösch F., Herzog H., Qaim S. M. // Pharmaceuticals. 2017.
Commun. 2016. Vol. 26. P. 85-94.
Vol. 10, N 2. P. E56.9.
[10] Laforest R., Liu X. // Quart. J. Nucl. Med. Mol. Imag. 2008.
[43] Otte A., Herrmann R., Heppeler A. et al. // Eur. J. Nucl. Med.
Vol. 52. P. 151-158.
1999. Vol. 26. P. 1439-1447.
[11] Eberlein U., Cremonesi M., Lassmann M. // J. Nucl. Med.
[44] Bodei L., Cremonesi M., Ferrari M. et al. // Eur. J. Nucl.
2017. Vol. 58. P. 97S-103S.
Med. Mol. Imag. 2008. Vol. 35. P. 1847-1856.
[12] Dolgin E. // Nature Biotechnol. 2018. Vol. 36, N 12. P. 1125-
[45] Кузнецов Р. А., Бобровская К. С., Светухина В. В. // Ра-
1127.
диохимия. 2019. T. 61, N 4. C. 273-285.
[13] Müller C., Domnanich K. A., Umbricht C. A., van der Meu-
[46] Rosch F. // Appl. Radiat. Isot. 2013. Vol. 76. P. 24-30.
len N. P. // Br. J. Radiol. 2018. Vol. 91 (1091). P. 20180074.
[47] Riga S., Cicoria G., Pancaldi D. et al. // Phys. Med. 2018.
[14] Uccelli L., Martini P., Cittanti C. et al. // Molecules. 2019.
Vol. 55. P. 116-126.
Vol. 24, N 3. P. E640.
[48] Lin M., Waligorski G. J., Lepera C. G. // Appl. Radiat. Isot.
[15] Qaim S. M., Scholten B., Neumaier B. // J. Radioanal. Nucl.
2018. Vol. 133. P. 1-3.
Chem. 2018. Vol. 318, N 3. P. 1493-1509.
[49] Liu F., Zhu H., Yu J. et al. // Tumour Biol. 2017. Vol. 39,
[16] Müller C., van der Meulen N. P., Benesova M. et al. // J. Nucl.
Med. 2017. Vol. 58. P. 91S-96S.
[50] Breeman W. A., Chan H. S., de Zanger R. M. et al. // Curr.
[17] Соболев А. С., Алиев Р. А., Калмыков С. Н. // Успехи хи-
Radiopharm. 2016. Vol. 9, N 1. P. 8-18.
мии. 2016. Т. 85, N 9. С. 1011-1032.
[51] Hanscheid H., Lapa C., Buck A. K. et al. // J. Nucl. Med.
[18] Гаращенко Б. Л., Корсакова В. А., Яковлевa Р. Ю. // Ядер-
2018. Vol. 59. P. 75-81.
ная физика и инжиниринг. 2017. Т. 8, N 6. C. 582-592.
[52] Ahmedova A., Todorov B., Burdzhiev N., Goze C. // Eur. J.
[19] Nishiyama Y., Kinuya S., Kato T. et al. // Ann. Nucl. Med.
Med. Chem. 2018. Vol. 157. P. 1406-1425.
[53] Follacchio G. A., De Feo M. S., de Vincentis G. // Curr. Ra-
[20] Hertz S., Roberts A. // J. Clin. Invest. 1942. Vol. 21, N 5.
diopharm. 2018. Vol. 11. P. 22-33.
P. 624.
[54] Marciniak A., Brasuń J. // J. Radioanal. Nucl. Chem. 2017.
[21] Hertz B., Schuller K. E. // Endocr. Pract. 2010. Vol. 16.
Vol. 313, N 2. P. 279-289.
P. 713-715.
[55] Paterson B. M., Roselt P., Denoyer D. et al. // Dalton Trans.
[22] Luster M., Clarke S. E., Dietlein M. et al. // Eur. J. Nucl. Med.
2014. Vol. 43. P. 1386-1396.
Mol. Imag. 2008. Vol. 35. P. 1941-1959.
[56] Hicks R. J., Jackson P., Kong G. et al. // J. Nucl. Med. 2019.
[23] Freudenberg L. S., Antoch G., Knust J. et al. // Eur. Radiol.
Vol. 60, N 6. P. 777-785.
2004. Vol. 14. P. 2092-2098.
[57] Demirkol M. O., Acar O., Ucar B. et al. // Prostate. 2015.
[24] Grewal R. K., Lubberink M., Pentlow K. S., Larson S. M. //
Vol. 75. P. 748-757.
PET Clinics. 2007. Vol. 2, N 3. P. 313-320.
[25] Hunter D. H., Zhu X. // J. Label. Compd. Radiopharm. 1999,
[58] Eder M., Schafer M., Bauder-Wust U. et al. // Bioconjug.
Vol. 42. P. 653-661.
Chem. 2012. Vol. 23. P. 688-697.
[26] Barrett J. A., Joyal J. L., Hillier S. M. et al. // Cancer Biother.
[59] Afshar-Oromieh A., Malcher A., Eder M. et al. // Eur. J. Nucl.
Radiopharm. 2010. Vol. 25, N 3. P. 299-308.
Med. Mol. Imag. 2013. Vol. 40. P. 486-495.
[27] Neves M., Paulo A., Patricio L. // Appl. Radiat. Isot. 1992.
[60] Kratochwil C., Giesel F. L., Eder M. et al. // Eur. J. Nucl.
Vol. 43. P. 737-740.
Med. Mol. Imag. 2015. Vol. 42. P. 987-988.
[28] Green M., Lowe J., Kadirvel M. et al. // J. Radioanal. Nucl.
[61] Rahbar K., Ahmadzadehfar H., Kratochwil C. et al. // J. Nucl.
Chem. 2017. Vol. 311, N 1. P. 727-732.
Med. 2017. Vol. 58, N 1. P. 85-90.
[29] Taïeb D., Hicks R. J., Hindié E. et al. // Eur. J. Nucl. Med.
[62] Ahmadzadehfar H., Wegen S., Yordanova A. et al. // Eur. J.
Mol. Imag. 2019. Vol. 46, N 10. P. 2112-2137.
Nucl. Med. Mol. Imag. 2017. Vol. 44. P. 1448-1454.
[30] Kuker R., Sztejnberg M., Gulec S. // Mol. Imag. Radionucl.
[63] Müller C., Umbricht C. A., Gracheva N. et al. // Eur. J. Nucl.
Ther. 2017. Vol. 26, Suppl. 1. P. 66-73.
Med. Mol. Imag. 2019. Vol. 46, N 9. P. 1919-1930.
[31] Seo Y., Huh Y., Huang S. Y. et al. // Med. Phys. 2019. Vol. 46,
[64] Müller C., Umbricht C. A., Gracheva N. et al. // Eur. J. Nucl.
N 5. P. 2477-2486.
Med. Mol. Imag. 2019. Vol. 46, N 9. P. 1919-1930.
[32] Huang S., Bolch W., Lee C. et al. // Mol. Imag. Biol. 2015.
[65] Eppard E., de la Fuente A., Benešová M. et al.
//
Vol. 17, N 2. P. 284-294.
Theranostics. 2017. Vol. 7, N 18. P. 4359-4369.
[33] Larson S., Carrasquillo J. A., Cheung N.-K. V., Press O. W. //
[66] Domnanich K. A., Müller C., Benešová M. et al. // EJNMMI
Nature Rev. Cancer. 2015. Vol. 15. P. 347-360.
Radiopharm. Chem. 2017. Vol. 2, N 1. P. 2-17.
Возможности метода ПЭТ в тераностике онкологических заболеваний
463
[67] Mease R. C., Dusich C. L., Foss C. A. et al. // Clin. Cancer
[73] Dietlein F., Hohberg M., Kobe C. et al. // J. Nucl. Med. 2019.
Res. 2008. Vol. 14. P. 3036-3043.
pii: jnumed.119.229542
[68] Szabo Z., Mena E., Rowe S. P. // Mol. Imag. Biol. 2015.
[74] Makvandi M., Dupis E., Engle J. W. et al. // Target Oncol.
Vol. 17. P. 565-574.
2018. Vol. 13, N 2. P. 189-203.
[69] Cardinale J., Schäfe M., Benešová M. et al. // J. Nucl. Med.
[75] Kratochwil C., Bruchertseifer F., Giesel F. L. // J. Nucl. Med.
2017. Vol. 58. P. 425-431.
2016. Vol. 57, N 12. P. 1941-1944.
[70] Giesel F. L., Hadaschik B., Cardinale J. et al. // Eur. J. Nucl.
[76] Kratochwil C., Bruchertseifer F., Rathke H. et al. // J. Nucl.
Med. Mol. Imag. 2017. Vol. 44, N 4. P. 678-688.
Med. 2018. Vol. 59. P. 795-802.
[71] Cardinale J., Martin R., Remde Y. et al. // Pharmaceuticals
[77] Griswold J. R., Medvedev D. G., Engle J. W. et al. // Appl.
(Basel). 2017. Vol. 10, N 4. pii: E77
Radiat. Isot. 2016. Vol. 118. P. 366-374.
[72] Shamni O., Nebeling B., Grievink H., Mishani E. // J. Label.
[78] Жуйков Б. Л., Калмыков С. Н., Ермолаев С. В. и др. // Ра-
Compd. Radiopharm. 2019. Vol. 62, N 6. P. 252-258.
диохимия. 2011. Т. 53, N 1. С. 66-72.