Радиохимия, 2019, т. 61, N 6, c. 477-480
477
Термическая устойчивость растворов гидразиннитрата
в азотной кислоте
© Е. Р. Назина, Г. М. Зачиняева, Е. В. Белова*б, А. С. Емельянова,б, Б. Ф. Мясоедовб
а Научно-технический центр по ядерной и радиационной безопасности,
107140, Москва, ул. Малая Красносельская, д. 2/8, корп. 5; * e-mail: bl174@bk.ru
б Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
Получена 17.04.2019, после доработки 17.04.2019, принята к публикации 24.04.2019 УДК 541.11:541.127:542.61
Исследована термическая устойчивость гидразиннитрата (ГН) в растворах 4-12 моль/л HNO3 в ин-
тервале температур 70-150°С. При определенных условиях в них возникают экзотермические реакции,
сопровождающиеся газовыделением, интенсивность которых зависит от концентрации компонентов и
температуры. Определены характеристики экзотермических процессов для оценки взрывобезопасности
технологических операций. Показано, что из-за резкого повышения давления в аппаратах экзотермиче-
ские процессы при упаривании азотнокислых растворов с ГН могут представлять опасность возникно-
вения радиационных аварий.
Ключевые слова: гидразиннитрат, азотная кислота, термическая устойчивость, экзотермические
реакции.
DOI: 10.1134/S0033831119060054
Азотнокислые растворы гидразиннитрата (ГН,
ных аппаратах избыточных давлений вплоть до их
N2H5NO3) используются в радиохимической техно-
деформации и разрушения [6].
логии при регенерации отработавшего ядерного то-
Для оценки опасности смесей восстановителей с
плива (ОЯТ) и упаривании отходов [1-4]. Условия
окислителями необходима информация об их взры-
проведения таких операций различаются по темпе-
воопасных характеристиках. К ним относятся тем-
ратуре, времени, мощности дозы излучения радио-
пература начала возникновения экзотермической
нуклидов, концентрации HNO3 и ГН. В процессах
реакции (Тнэ), максимальная скорость газовыделе-
восстановительной реэкстракции концентрация
ния (Wмакс), удельный объем выделяющихся газооб-
НNО3 не превышает 7-8 моль/л, а температура -
разных продуктов реакции (Vуд). Такая информация
70-75°С. В азотнокислых растворах ГН, поступаю-
для азотнокислых растворов ГН в литературе отсут-
щих на упаривание, концентрация HNO3 может дос-
ствует. Цель работы - определение условий возник-
тигать 12 моль/л, а температура - 110-115°С.
новения в азотнокислых растворах ГН экзотермиче-
На разложение гидразина в азотнокислой среде
ских реакций и характеристик этих реакций в зави-
влияет ряд факторов - концентрация НNО3, темпе-
симости от температуры, концентрации НNО3 и ГН,
ратура, катализаторы, присутствие органических
условий теплообмена.
веществ [5]. Существенное влияние оказывает облу-
чение с образованием продуктов радиолиза гидра-
Экспериментальная часть
зиннитрата и HNO3. Среди них определены HN3 и
NH4NO3 [5], выходы которых возрастают с увеличе-
Возникновение и развитие экзотермических ре-
нием температуры и концентрации НNО3. Радиаци-
акций в существенной степени зависит от соотно-
онно-термическая деструкция гидразина в азотно-
шения между тепловыделением в зоне химической
кислых средах определяется преимущественно его
реакции (ЗХР) и отводом тепла, поэтому в экспери-
взаимодействием с продуктами радиолиза водных
ментах использовали варианты с различным тепло-
растворов НNО3. Процесс разложения ГН в облу-
отводом из ЗХР:
ченных растворах продолжается долго - десятки
- нагревание растворов в тонкостенной стеклян-
часов. Настоящая работа посвящена малоизученной
ной колбе, погруженной в масляную баню, с изме-
стороне взаимодействия ГН с HNO3, а именно не-
рением скорости газовыделения и удельного объе-
контролируемому экзотермическому окислению ГН
ма газообразных продуктов реакции волюмометри-
(тепловому взрыву) и условиям его возникновения.
ческим методом;
Потенциальная опасность этого процесса определя-
ется возможностью возникновения в промышлен-
- нагревание растворов в открытой металличе-
478
Е. Р. Назин и др.
Таблица 1. Характеристики экзотермических процессов в азотнокислых растворах ГН при нагревании в тонкостен-
ной стеклянной колбе
Концентрация
Концентрация ГН,
Экзотермическое
Температура, °С
Wмакс, л/(мин·кгГН)
Vуд, л/кгГН
HNO3, моль/л
г/л
взаимодействие
4-7
50
70
Нет
12
80
100
30
Нет
6
170
100
80
200
Есть
12
170
100
100
400
Есть
ской пробирке объемом 20 см3, помещенной в воз-
Таблица 2. Характеристики экзотермических процессов
душный термостат (меньший теплоотвод из ЗХР), с
в азотнокислых растворах ГН при нагревании в воздуш-
измерением температуры раствора и объемов вы-
ном термостате
деляющихся газов;
HNO3, моль/л
Тнэ, оС
Wмакс, л/(мин·кгГН)
Vуд, л/кгГН
- нагревание растворов в автоклаве объемом
4
Нет взаимодействия
300 см3, размещенном в воздушном термостате, с
7
70
5
216
измерением температуры и давления в автоклаве в
9
60
18
266
условиях, близких к адиабатическим.
12
35
32
300
При нагревании в воздушном термостате или
автоклаве снижаются теплопотери из системы и
при 70°С в течение 4 и 8 ч, величины Wмакс и Vуд при
создаются условия для возникновения экзотерми-
110°С снижаются практически на порядок. Замече-
ческих процессов. Определены температура начала
но, что растворы ГН в 9 и 12 моль/л НNО3, просто-
таких реакций, максимальные скорости газовыде-
явшие перед опытом сутки при комнатной темпера-
ления и удельные объемы газообразных продуктов.
туре, в процессе нагрева при 110°С разлагаются без
Результаты
Результаты экспериментов при нагревании рас-
творов в тонкостенной стеклянной колбе представ-
лены в табл. 1 и на рис. 1.
При восстановительной реэкстракции взаимодей-
ствия компонентов растворов не происходит. При
температурах, близких к температурам упаривания,
экзотермические процессы возможны, но только
если имеется достаточное количество ГН.
Результаты экспериментов в металлических про-
бирках, обогреваемых в воздушном термостате,
представлены в табл. 2. Содержание ГН в растворе
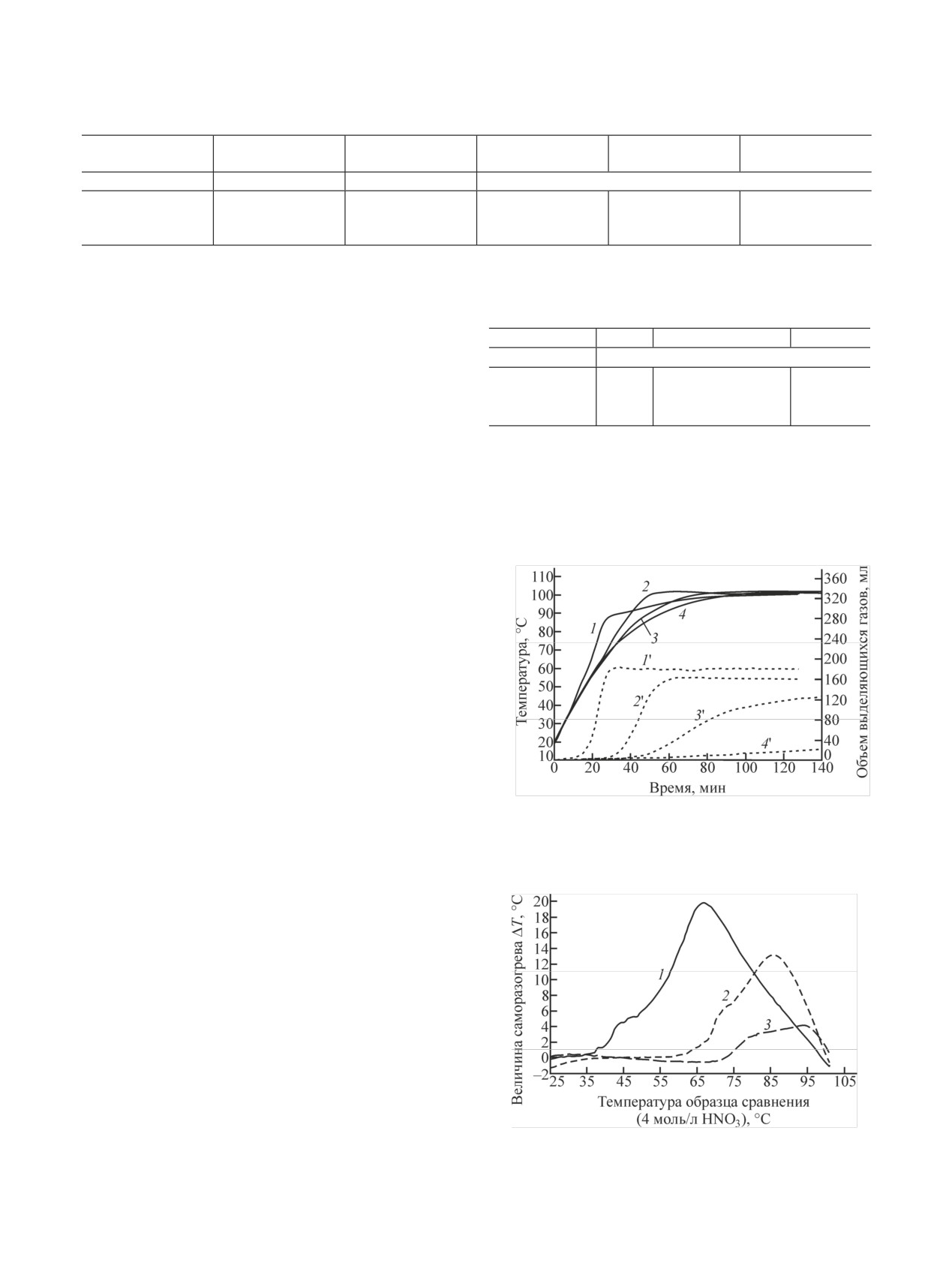
Рис. 1. Динамика изменения температуры раствора (1-4) и
составляет 47.5 г/л, температура термостата - 100°С.
объема выделяющихся газов (1'-4') при нагревании раствора
концентрации (моль/л): 1, 1' - 12; 2, 2' -
0.5 моль/л ГН в HNO3
При нагревании в воздушном термостате (сни-
9; 3, 3' - 7; 4, 4' - 4. Температура термостата 100°С.
жение теплоотвода из ЗХР) экзотермические реак-
ции с газовыделением начинаются при меньших
концентрациях НNО3 и при температурах значитель-
но ниже, чем температуры кипения растворов. Они
растянуты во времени на десятки минут, тепловыде-
ление и скорость газовыделения невысокие (рис. 2).
Несмотря на относительно невысокую скорость эк-
зотермических реакций, объемы выделяющихся га-
зов значительны. После прекращения тепловыделе-
ния заканчивается и выделение газов.
Предварительная выдержка растворов при темпе-
ратурах 40-60°С существенно уменьшает интенсив-
ность экзотермических реакций при последующем
нагревании растворов до температуры кипения. Так,
Рис. 2. Величины саморазогрева ΔТ в растворах 0.5 моль/л ГН
для раствора ГН с 12 моль/л НNО3, выдержанного
в HNO3 концентрации (моль/л): 1 - 12, 2 - 9, 3 - 7.
Термическая устойчивость растворов гидразиннитрата в азотной кислоте
479
Таблица 3. Характеристики экзотермических процессов разложения азотнокислых растворов с 100 г/л ГН при давле-
нии выше атмосферного
Концентрация HNO3
Величина самора-
Продолжительность
Скорость роста темпе-
Wмакс,
Vуд,
Тнэ, ºС
в растворе, моль/л
зогрева, ºС
процесса, мин
ратуры, ºС/мин
л/(мин·кгГН)
л/кгГН
2.4
130
10-15
2,5
>370
4.8
90-97
47-60
6-10
5-9
35-75
300-470
9.6
60-64
75-83
6-7.5
10-13
54-65
395-405
9.6а
64
85
5.5
15.7
95
510
а Температура термостата 200°С.
видимого экзотермического эффекта с менее интен-
Wмакс. В отсутствие HNO3 в 53%-ном водном раство-
сивным газовыделением. Это означает, что разложе-
ре ГН разложение проходит медленно, без выделе-
ние ГН происходит даже при комнатных температу-
ния тепла.
рах, и оно тем сильнее, чем выше температура и кон-
Повышение температуры нагрева автоклава до
центрация НNО3.
200°С слабо влияет на температуру начала экзотер-
В автоклаве в условиях минимального теплооб-
мического процесса и его продолжительность, но
мена ЗХР с окружающей средой изучены растворы
примерно в полтора раза увеличивает скорость газо-
100 г/л ГН в 2.4-9.6 моль/л HNO3 при температуре
выделения.
термостата 150°С (табл. 3). Объем образцов состав-
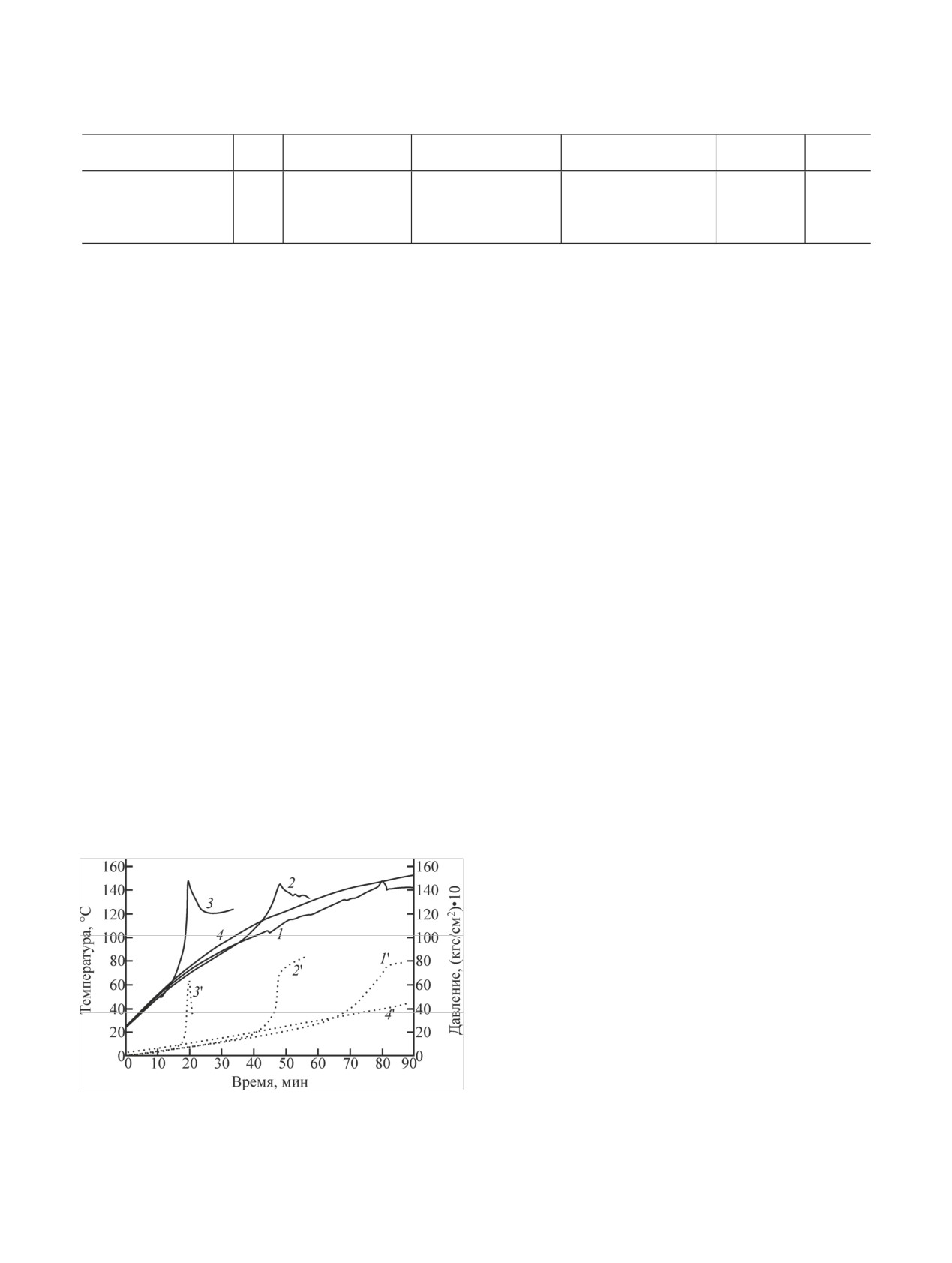
Динамика изменения характеристик экзотермиче-
лял 30 мл.
ских процессов при нагревании в автоклаве раство-
Следует отметить значительную интенсифика-
ров ГН в HNO3 представлена на рис. 3.
цию экзотермических реакций при слабом теплоот-
воде из ЗХР. Это выражается в сокращении времени
Обсуждение результатов
реакции при увеличении тепловыделения, скорости
В условиях проведения экспериментов при нагре-
газовыделения и объема газообразных продуктов,
вании до 150°С водные растворы ГН экзотермиче-
что доказывается данными из табл. 3. Слабый экзо-
ски не разлагаются. В азотнокислых растворах ГН
термический эффект наблюдается при температуре
реагирует с HNO3 или продуктами ее разложения -
130°С в растворе 2.4 моль/л НNО3 с разогревом на
оксидами азота. При нагревании растворов протека-
10-15°С. Температура начала экзотермической реак-
ции снижается с повышением концентрации НNО3,
ет ряд реакций, одна из которых - реакция окисле-
и для раствора 4.8 моль/л НNО3 экзотермический
ния. Как показано в работах [4, 7], среди жидкофаз-
процесс начинается при 90-97°С, что ниже темпера-
ных продуктов окисления облученных растворов ГН
туры операций упаривания. Выделяющегося тепла
помимо НN3 образуется нитрат аммония. Таким об-
достаточно для разогрева раствора до температуры
разом, только часть ГН реагирует с образованием
порядка 150°С. Еще энергичнее проходит процесс
газообразных продуктов. Имеются сведения [8], что
при концентрации НNО3 в растворе 9.6 моль/л, Тнэ
гидразин в зависимости от типа окислителя разлага-
экзотермического процесса снижается до 60-65°С,
ется с выделением в газовую фазу N2, NH3 и HN3.
его продолжительность уменьшается, возрастает
Относительно газообразных продуктов взаимодейст-
вия ГН с HNO3 можно полагать, что в азотнокислой
среде экзотермическая реакция окисления гидразина
связана не с HNO3, а с NO2, и уравнение взаимодей-
ствия представляется в виде
N2H4·HNO3 + NО2 = 2Н2О + 1.5N2 + НNО3
(1)
Для растворов с низким содержанием ГН вода
(продукт экзотермической реакции) будет в жидком
состоянии, поэтому количество выделяющихся газов
по этому уравнению составит около 350 л/кгГН.
В реальных условиях тепло экзотермической ре-
акции расходуется на нагревание раствора, газооб-
разных продуктов реакции, стенок сосуда, нагрев
Рис. 3. Изменение температуры (1-4) и давления (1'-4') при
окружающей среды. С увеличением продолжитель-
нагревании растворов ГН в HNO3 с концентрацией (моль/л):
1, 1' - 2.9; 2, 2' - 4.8; 3, 3' - 9.67. 4, 4' - 53%-ный водный рас-
ности экзотермической реакции потери тепла по
твор ГН.
двум последним каналам возрастают.
480
Е. Р. Назин и др.
Таким образом, при температурах операции вос-
становительной реэкстракции интенсивные экзотер-
мические процессы окисления ГН не происходят.
При концентрировании упариванием азотнокислых
растворов, содержащих макроколичества ГН, экзо-
термические процессы окисления гидразина неиз-
бежны. Количество выделяющихся газообразных
продуктов будет определяться содержанием ГН в
растворах. В этих случаях можно ориентировочно
оценить максимальный объем газов, выделяющихся
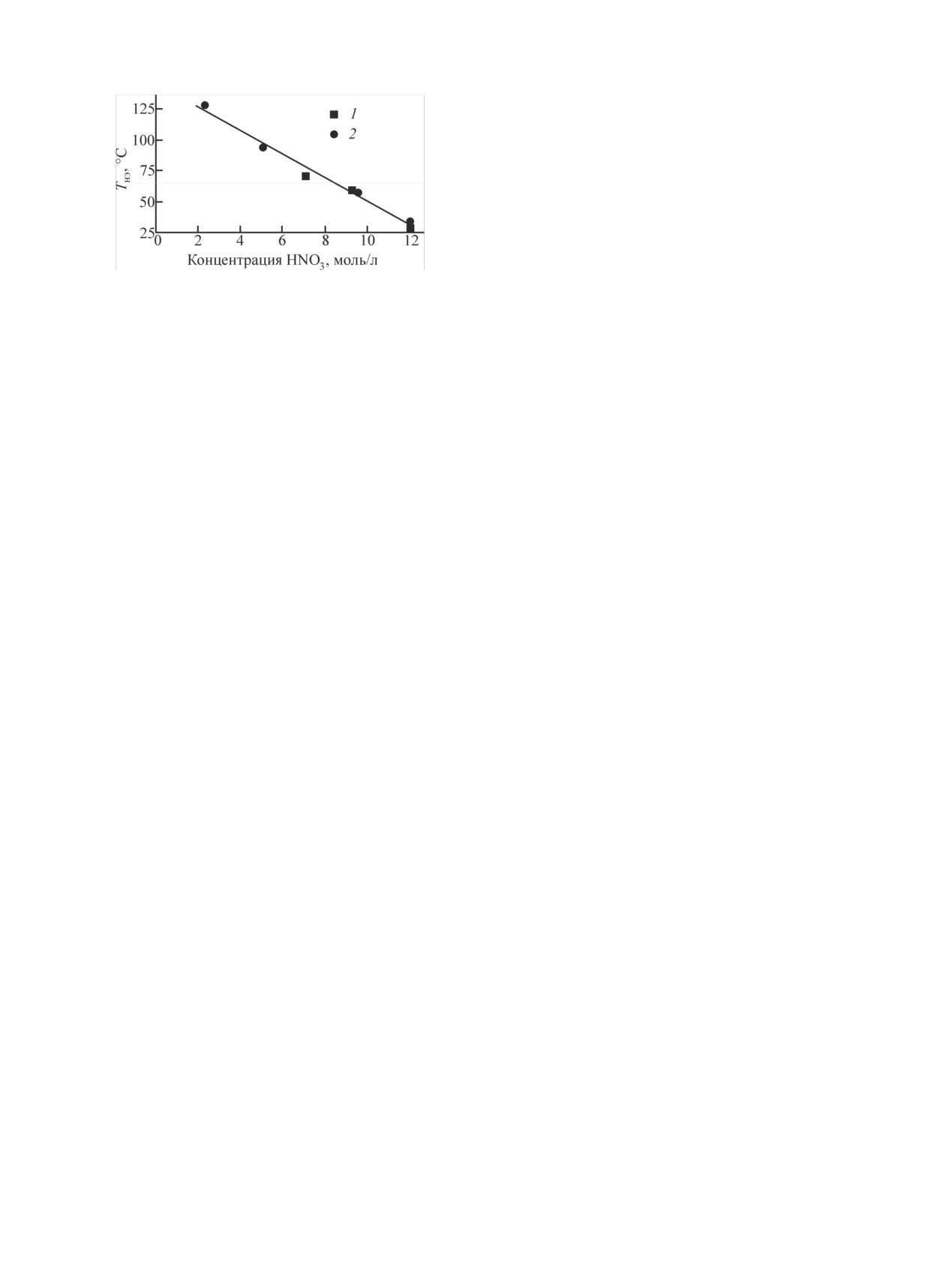
Рис.
4. Зависимость температуры начала экзотермического
из объема раствора. Величину Vуд можно консерва-
процесса (Тнэ) от концентрации HNO3 при атмосферном давле-
тивно оценить в 500 л/кг ГН. Такая оценка позволит
нии (1) и давлении выше атмосферного (2).
установить исходную концентрацию ГН в упаривае-
Таким образом, интенсивность экзотермических
мых растворах, обеспечивающую безопасность опе-
реакций в исследуемых растворах (величина самора-
рации упаривания. Азотистоводородная кислота в
зогрева, скорость газовыделения) зависит от условий
упариваемых растворах не представляет опасности
теплопередачи из ЗХР в стенки сосуда, окружаю-
ввиду незначительного содержания, но выделение ее
щую среду, и от потерь окислителя из ЗХР в газовую
в газовую фазу может создать проблему образования
фазу. Эти зависимости были полностью подтвержде-
азидов металлов, некоторые из которых являются
ны в экспериментах. Наибольшая интенсивность
взрывчатыми веществами.
экзотермических реакций получена в закрытом сосу-
Работа выполнена при финансировании Мини-
де при нагревании в воздушном термостате при ми-
стерством науки и высшего образования РФ (тема
нимальных потерях тепла и окислителя из ЗХР. В
АААА-А18-118021990023-6).
открытых сосудах часть окислителя удаляется в га-
зовую фазу, большие теплопотери снижают интен-
сивность экзотермических реакций.
Список литературы
Величины Тнэ для открытого и закрытого сосудов
оказались близкими, а их зависимость от концентра-
[1] Kelmers A. D., Brawning D. N. // Inorg. Nucl. Chem. Lett.
1977. Vol. 13, N 10. P. 505-510.
ции НNО3 - практически линейной (рис. 4). Из рис.
[2] Kelmers A. D., Brawning D. N. Hydrazoic acid distribution
4 следует, что при концентрациях 3.8-4.5 моль/л
coefficient in Purex processing // Conf. on the Plutonium Fuel
НNО3 в растворе достигаются температуры возник-
Recycle. Miami Beach (USA), May 2-4, 1977.
новения экзотермических реакций.
[3] Коровин Н. В. Гидразин. М.: Химия, 1980. С. 280.
[4] Безопасность ядерного топливного цикла / Материал
Для растворов с концентрацией НNО3 от 2.5 до
Агентства по ядерной энергии при ОЭСР. Информ-Атом,
12 моль/л объемы выделяющихся за счет экзотерми-
2002.
ческих реакций газов составляют в открытом сосуде
[5] Егоров Г. Ф., Белова Е. В., Тхоржницкий Г. П. и др. //
200-300 л/кгГН, в закрытом - от 400 до 500 л/кгГН.
Вопр. радиац. безопасности. 2010. N 4. С. 32-36.
[6] Усачев В. Н., Марков Г. С. // Радиохимия. 2003. Т. 45, N 1.
Эти величины Vуд сопоставимы с расчетными вели-
C. 3-10.
чинами Vуд при н.у. с учетом теплового расширения
[7] Зильберман Б. Я., Лелюк Г. А., Машкин А. Н., Ясновиц-
газо-паровоздушной смеси. Объемы газообразных
кая А. Н. // Радиохимия. 1988. T. 30, N 6. C. 833-837.
продуктов, выделяющихся за счет экзотермических
[8] Одрит Б., Огг Л. Химия гидразина. М.: Изд-во иностран.
реакций, зависят и от количества ГН в растворе.
литературы, 1954. C. 155.