РАДИОХИМИЯ, 2020, том 62, № 2, с. 93-113
УДК 544.723:544.58
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
С МИКРОЭЛЕМЕНТАМИ/РАДИОНУКЛИДАМИ В
СОРБЦИОННЫХ СИСТЕМАХ
© 2020 г. И. В. Волков*, Е. В. Поляков**
Институт химии твёрдого тела УрО РАН, 620990, г. Екатеринбург, ул. Первомайская, 91
e-mail: *ilyavolkov@ihim.uran.ru; **polyakov@ihim.uran.ru
Получена 13.02.2019, после доработки 13.02.2019, принята к публикации 09.04.2019
Рассмотрено современное состояние исследований в области физикохимии комплексообразования
гуминовых кислот с катионами, включая радионуклиды, в водных растворах. Проанализированы коли-
чественные данные, характеризующие устойчивость гуматных комплексов, теоретические подходы к их
определению и проблемы описания реакционной способности гуматных комплексов с учётом объек-
тивной сложности химической природы гуминовых кислот как одного и основных классов природных
гуминовых веществ.
Ключевые слова: гуминовые кислоты, комплексообразование, сорбция, коллоиды, микроэлементы,
радионуклиды
DOI: 10.31857/S003383112002001X
ВВЕДЕНИЕ
Молекулярная масса ГВ распределена в диапазо-
не 1-1000 кДа [2]. В зависимости от отношения к
Гуминовые кислоты являются частью обшир-
кислотам различают следующие основные группы
ного класса природных гуминовых веществ (ГВ),
ГВ: гуминовые кислоты (ГК), растворимые в ще-
представляя собой смесь комплексов органиче-
лочных растворах и осаждающиеся в кислой сре-
ских соединений, возникшую в результате разло-
де; фульвокислоты, растворимые как в кислых, так
жения остатков растений и животных (гумифика-
и в щелочных растворах; гумины, нерастворимые
ции) [1, 2]. ГВ находятся в почве, донных отложе-
во всём диапазоне рН. Предложенные к настоя-
ниях, поверхностных водах повсеместно, а потому
щему моменту варианты интерпретации состава
знание физико-химических закономерностей вза-
гуминовых кислот, как составной части ГВ, име-
имодействия гуминовых веществ с радионукли-
ют характер гипотетических блок-схем, так как
дами, в водных растворах и донных отложениях,
инструментальными методами пока невозможно
последствия такого взаимодействия в отношении
точно определить расположение атомов и атомных
межфазного распределения являются важным
фактором создания сорбционных барьеров, проек-
групп в неоднородной смеси природных ГВ [1-5].
тирования зданий и сооружений для депонирова-
В схеме рис. 1 структурной основой ГК являет-
ния радиоактивных отходов, выработки стратегии
ся бензольный каркас и функциональные группы
и тактики дезактивации радиоактивно/химически
(гидроксильные, карбоксильные, карбонильные).
загрязнённых территорий и промышленных пло-
Остаток сахарозы характеризует возможность на-
щадок ядерно-топливного цикла. ГВ - это тёмноо-
следования фрагментов исходного биологическо-
крашенные высокомолекулярные вещества, пред-
го материала, например, углеводов, при неполной
ставляющие собой сложную смесь макромолекул
гумификации. На схеме рис. 2 акцент делается
переменного состава. Они участвуют в гетероген-
на типы функциональных групп, нерегулярность
ных реакциях гидрофильными и гидрофобными
строения и гетерогенность структурных элемен-
группами, способными реагировать и с ионами
тов ГК [1]. Более сложные схемы учитывают гете-
металлов, и органическими молекулами. [1, 2].
рогенное включение неорганических ионов в ГК
93
94
ВОЛКОВ, ПОЛЯКОВ
HOOC
CHO
HOOC
O OH
HC-OH
HO
HO-CH
OH
HOOC
HC-OH
COOH
O
H C-OH
O
O N
HO OH
R
C=O
O
O
O
O
O
N
O O
HN
R
O
O
NH
Рис. 1. Пример молекулярной структуры ГК по Cтивенсону [5].
OCH3
H
H
H
H
C
C
O
O
C C
C
C
H
H
H
R-CH2-CH-COOH
R1
N
H
NH2
HC
CH2
(C6H10O5)2, -(COOH)n, -(OH)n,
CH
-(NH2)n, -(CH2)n-
R3
N
C H
H
OH
C=O
CH2
O
OH
O
CO
HCH
HCOH
(CH2)n-
R2
Рис. 2. Cтруктурная ячейка ГК по Орлову [1]. В квадратных скобках - негидролизуемая часть («ядро»), справа - гидроли-
зуемая часть («боковые цепи»).
(ионы металлов, оксид кремния, алюмосиликаты).
дных системах, взаимодействие с минеральными
Все схемы отражают полимерный и полифункци-
взвесями, коллоидами, биотой, в частности прес-
ональный характер ГК, а сочетание полимерных
новодным планктоном [7]. Последнее играет роль
блоков с сильной и слабой солюбилизацией, на-
регулятора в снижении токсичности и радиоток-
личие необменных и обменных протонных групп
сичности загрязнителей воды и почвы. Cогласно
различной кислотности делают ГК одним из регу-
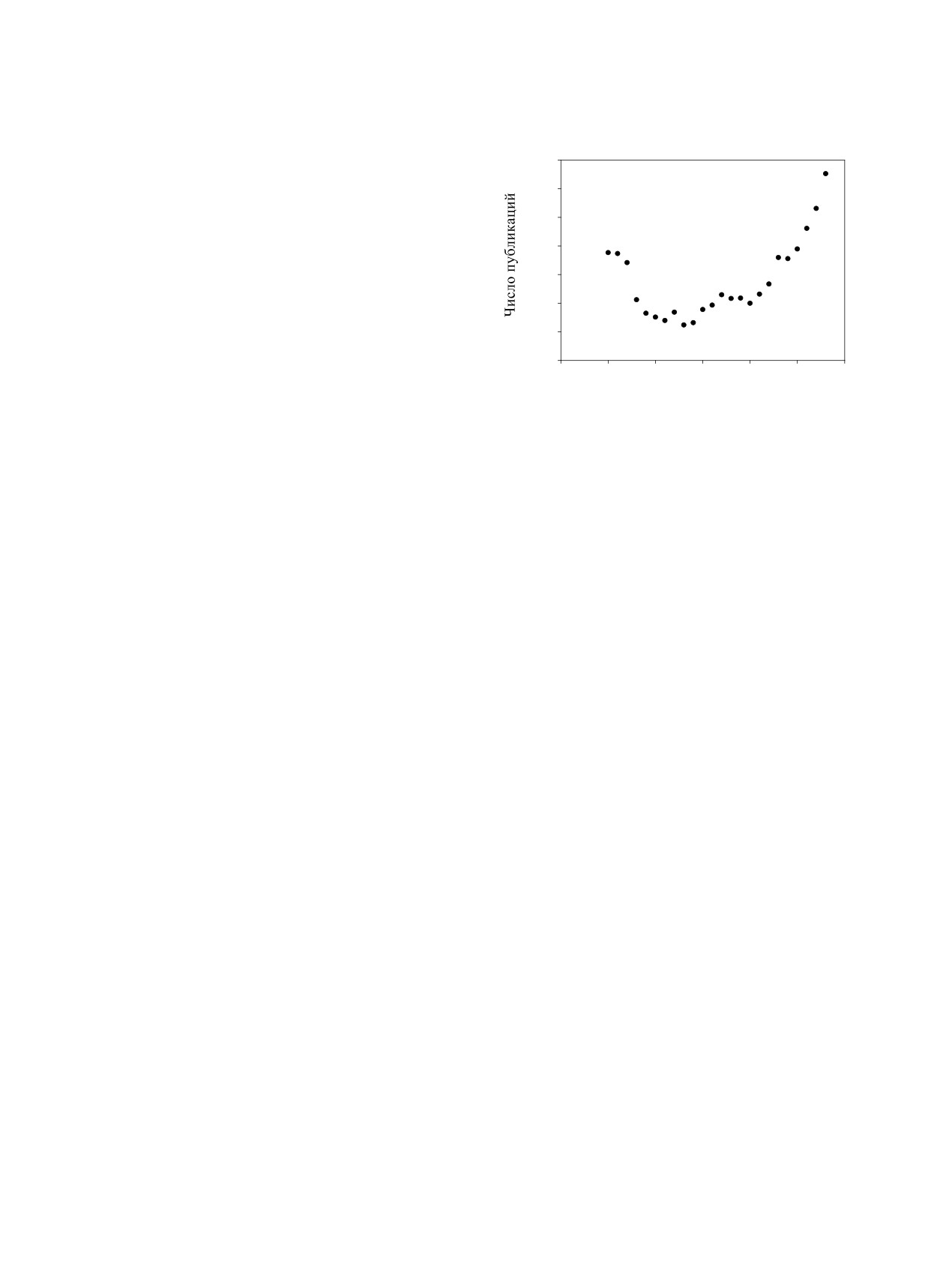
Science Direct, начиная с 1990-х годов видна вторая
ляторов массопереноса ионов металлов в водных
«волна» роста числа публикаций по химии гуми-
и почвенных экосистемах [3-6]. Главным здесь
новых кислот (рис. 3). Её появление вызвано на-
является связывание металлов в прочные гумат-
коплением данных по комплексообразованию ГК
ные комплексы, их сорбционная активность в во-
с микроэлементами/радионуклидами на новой ин-
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
95
струментальной базе физического и физико-хими-
4000
ческого материаловедения применительно к ради-
3500
охимии, геохимии, радиоэкологии.
Участие гуминовых кислот в комплексообра-
3000
зовании в растворах. ГК составляют большую
2500
часть водорастворимых форм органического угле-
2000
рода, находящегося в природной среде в форме ГВ
с типичной концентрацией органического углеро-
1500
да от 0.1 до 1000 мг/л [8]. Полифункциональность
1000
и структурное многообразие позволяет этим сое-
динениям участвовать гомо- и гетерогенных ион-
500
1990
1995
2000
2005
2010
2015
2020
ных, молекулярных и редокс-реакциях. ГК образу-
Год
ют стехиометрические комплексные соединения с
Рис. 3. Динамика публикаций по теме «humic acid com-
ионами тяжёлых металлов, аддукты с молекулами
plexation» с 1995 по 2018 год по данным Science Direct.
пестицидов. По этой причине они могут суще-
ственно изменять содержание тяжёлых металлов
ты, так и Ca2+ несущественно влияли на комплек-
и радионуклидов в воде даже при малой концен-
сообразование Cd(II). Не наблюдалось влияния
трации [9], выполняя роль химического регулято-
Cu(II) на комплексообразование Pb(II), а присут-
ра. Комплексообразующее взаимодействие ГК с
ствие Cd(II) слегка повышало связывание Pb(II) с
оксидной матрицей столь интенсивно, что на по-
ГК. Добавление Pb(II) ухудшило комплексообра-
рядки увеличивает растворимости компонентов
зование Cu(II), а действие ионов Cd(II) было про-
минералов [10].
тивоположным. Присутствие кальция подавляло
комплексообразование всех трёх металлов. Ионы
Молекулярно-массовое распределение, харак-
металлов не всегда конкурируют за одни и те же
тер углеродного скелета, типы, позиции и отно-
сорбционные центры ГК: поскольку концентрация
сительное количество функциональных групп
Cа(II) в экспериментах на два порядка превыша-
определяются происхождением и возрастом ГК,
ла концентрацию металлов-конкурентов, он мог
отличая ГК друг от друга [9, 11]. ГК способны
вытеснять эти ионы из их сорбционных позиций
образовывать ионно-молекулярные растворы, а
за счёт электростатического кислотно-основного
также истинные и адсорбционные коллоиды [12]
взаимодействия, но этого не наблюдалось [20].
за счёт сорбции их ионно-молекулярных комплек-
сов поверхностью колодных частиц (гидроксидов,
В [21] конкурентное комплексообразование ио-
карбонатов, простых и сложных силикатов) [13].
нов Ni(II), Ca(II) и Al(III) с ГК проанализировано
Таким образом, взаимодействие радионуклидов с
в рамках модели поверхностного комплексообра-
ГК [14-17] вовлекает последние в круговорот ор-
зования. Авторы учитывали присутствие двух
ганического углерода [18, 19].
видов протонных центров ГК - карбоксильных
Химическая и радиотоксичность ионов метал-
и фенольных групп. Для определения констант
лов по отношению к растениям и животным за-
протонирования обоих видов и их концентраций
висит от концентрации свободного аква-иона, ко-
использовали потенциометрическое титрование.
торая в водных системах контролируется неорга-
Отмечена сильная конкуренция Ni(II) и Ca(II) в
ническими и органическими лигандами, важней-
реакциях с ГК и Al(III) оказывал влияние на их
шими из которых являются ГК и фульвокислоты.
комплексообразование вследствие его гидролиза и
Присутствие в природных водах одновременно
осаждения при рН ~ 5. Константы поверхностного
большого числа ионов металлов порождает конку-
комплексообразования, определённые для одноэ-
рентные реакции при формировании их равновес-
лементной системы показали отличие от данных
ного/стационарного состояния. В [20] рассмотре-
для смеси трёх ионов металлов. Высокие концен-
на конкуренция микроэлементов и ионов Ca2+ при
трации Cа(II) в загрязнённых подземных водах
комплексообразовании микроэлементов Cd(II),
могут подавлять комплексообразование ионов
Pb(II) и Cu(II) с молекулами ГК. Как микроэлемен-
Ni(II), а увеличение рН и концентрации ГК спо-
РАДИОХИМИЯ том 62 № 2 2020
96
ВОЛКОВ, ПОЛЯКОВ
собно ослабить такие конкурентные взаимодей-
тывают из полной ёмкости, LC, определённой при
ствия. Эти данные предполагается использовать
данных экспериментальных условиях. Количество
для разработки восстановительных мероприятий
доступных для комплексообразования центров ГК -
по отношению к загрязнённым металлами почвам
параметр LC, сравнимый со степенью диссоциа-
и грунтовым водам.
ции кислоты:
Cочетание высокоэффективной жидкостной
[MHA(z)]
max
LC
=
,
хроматографии (ВЭЖХ) и масс-спектрометрии
[HA(z)]
tot
с индуктивно связанной плазмой является чув-
z+
z[M
]*
(3)
ствительным и быстрым методом исследования
LC
=
,
C
G
гуматных комплексов тяжёлых металлов в водных
HA
где [MHA(z)]max = [Mz+]* представляет собой мак-
системах. Например, метод масс-спектрометрии
симальную концентрацию связанного катиона
с изотопным разбавлением использовали для од-
[Mz+], способную образовать комплекс с функци-
новременного определения комплексов ионов тя-
ональными группами ГК и может изменяться в за-
жёлых металлов (Ag, Cd, Cu, Mo, Ni, Pb, Tl, U,
висимости от рН, ионной силы и происхождении
W, Zn и Zr) с ГК [22]. Разделение методом ВЭЖХ
ГК. G - протонообменная ёмкость ГК (моль/г),
выполняли совместно с эксклюзионной хромато-
определяемая ацидометрическим титрованием.
графией. Этот метод был применён к образцам ко-
[HA(z)]tot - общая концентрация отрицательно за-
ричневых гуматных грунтовых, а также сточных и
ряженных комплексообразующих единиц (анио-
фильтрационных вод. Общее содержание тяжёлых
нов) ГК, способных нейтрализовать положительно
металлов и их комплексов были проанализиро-
заряженный ион металла, определяется (в моль/л)
ваны в этих образцах с пределами обнаружения
как
5-110 нг/л. Установлено, что общая концентрация
C
G
ионов тяжёлых металлов и концентрация их гу-
HA
(4)
[HA(z)]
=
,
tot
матных комплексов зависят от аналитической кон-
z
где CНА - концентрация ГК в г/л, z - заряд иона
центрации конкретного элемента.
металла. Действующая концентрация ГК при
Комплексообразование Am(III), Y(III) и Pb(II)
комплексообразовании с катионом металла равна
тремя типами ГК различного происхождения при
произведению LC и [HA(z)]tot. Произведение двух
рН 4-5 и ионной силе I = 0.1 моль/л NaClO4 иссле-
сомножителей (1 - LC) и [HA(z)]tot определяет ту
довано в работе [23] методом ультрафильтрации.
концентрацию ГК, которая не принимает участия
Авторы выбрали модель, основанную на нейтра-
в комплексообразовании. Параметр LC увеличи-
лизации заряда (МНЗ) иона металла функцио-
вается с повышением рН и должен быть равен 1
нальными группами ГК [15]. Основное уравнение
когда ГК полностью диссоциирует по всем прото-
комплексообразования иона металла Mz+, взаимо-
нообменным центрам. LC всегда меньше чем сте-
действующего с одной связывающей единицей ГК
пень диссоциации ГК (α) при равных эксперимен-
(набором функциональных групп ГК), имеющей
тальных условиях, потому что пространственные
эквивалентное количество протонообменных цен-
эффекты в сшитой структуре ГК и электростати-
тров (z) согласно [23] имеет вид:
ческое отталкивание ограничивают доступность
Mz+ + HA(z) ↔ MHA(z),
(1)
всех протонообменных центров для данного иона
а константа комплексообразования (β):
металла [23].
[MHA(z)]
Вычисление константы комплексообразования
β=
z+
по (2.2) в модели МНЗ даётся уравнением:
[M
] [HA(z)]
f
f
[MHA(z)]
[MHA(z)]
(5)
lg
=
lg[HA(z)] +lgβ,
f
=
,
(2)
z+
z+
[M
]
[M
] [HA(z)]
LC−[MHA(z)]
f
f
tot
Правую часть уравнения (2) можно также пе-
где [MHA(z)] - концентрация гуматного комплекса
реписать в виде
(моль/л) и [Mz+]f - концентрация свободных ионов
z+
X
[MHA(z)]
(6)
металла (моль/л). Концентрация свободных (не-
lg[M
]= lg
- β
X
=
1−
X
[HA(z)]
tot
LC
закомплексованных) молекул ГК [HA(z)]f рассчи-
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
97
Рис. 4. Линейные зависимости [Mz+]f - F и lg[Mz+] - lg(X/1-X) для комплексообразования Sr(II) и Ca(II) с ГК (Aldrich),
полученные в [24].
Полученные в [23] величины lgβ составили
мости от их происхождения, а также последствий
(5.39±0.16) для иттрия, (6.15±0.16) для америция
их переноса в зону ненасыщенных водой почв.
и (5.20±0.08) для свинца. Их величины указывают
Cодержанием металлов определяли гамма-акти-
на возможность подавления гидролиза этих катио-
вационным анализом, после чего активирован-
нов в присутствии ГК.
ную почву использовали в качестве индикатора в
статических экспериментах с ГК. После сорбции
Cвязывание Sr(II) гуминовыми кислотами из-
ионообменной смолой XAD-8, определяли часть
учали в системах, предназначенных для модели-
металлов, связанных ГК. Подтверждена взаимос-
рования условий выщелачивания этих катионов из
вязь между образованием гуматных комплексов и
почвы [24]. Эксперименты по ультрафильтрации
происхождением почв, кислотностью, концентра-
проводили в широком диапазоне концентраций
цией ГК.
NaCl и CaCl2 и при рН от 4 до 7. Обнаружено, что
В
[27] исследовано комплексообразование
в нейтральных и слабокислых растворах увели-
Eu(III) с ГК ионообменным методом c использо-
чение степени ионизации карбоксильных групп
ванием смолы Амберлит IR-120 в широком ин-
ГК увеличивает связывание ими стронция (~60%
тервале соотношений Eu(III)/ГК при рН 4 и 7.
при рН 7). Комплексообразование стронция в при-
Эксперименты проводили для проверки предло-
сутствии кальция изучали в условиях изменения
женной авторами модели «средней молекулярной
концентраций металлов при рН 5 и ионной силе
массы», описывающей комплексообразование
0.1 М NaCl с помощью модели МНЗ. Определены
катионов металлов (Mz+) с макромолекулярны-
ёмкость (около 40%) и константы lgβ для ионов Sr
ми полианионами ГК (НАр-). Модель учитывает
(3.51±0.27) и Ca (3.10±0.29). Линейный характер
макромолекулярный характер ГК и основана на
зависимости концентрации свободного метал-
данных по электрофоретической подвижности гу-
ла от мольной доли функциональных групп под-
матных комплексов и предполагает, что комплек-
тверждает обоснованность модели МНЗ (рис. 4).
сообразование протекает путём последовательной
Метод ионного обмена с применением Na-
нейтрализации катионами Mz+ диссоциированных
формы смолы Dowex AG 50W-X8 был использо-
карбоксильных групп полианиона НАр-.
ван для определения констант устойчивости ком-
Методом Шуберта определяли устойчивость
плексов, образованных ГК (примерно 3×10-5-15×
комплексов U(VI) с ГК при рН от 4.0 до 5.0 в
10-5 моль/л ГК) и раствором солей различных ме-
0.10 M NaClO4, в сравнении с лимонной кислотой
таллов при рН 3.5 и показал следующий ряд устой-
в тех же условиях с целью согласования, «кали-
чивости гуматов: Cu > Fe > Pb > Ni > Co > Ca > Cd >
бровки» экспериментального и модельного подхо-
Zn > Mn > Mg [25].
дов [28, 29]. Авторы используют модель комплек-
Целью исследования [26] являлось описания
сообразования лиганда L (функциональные груп-
свойств природных гуминовых веществ в зависи-
пы ГК), и металла по реакциям
РАДИОХИМИЯ том 62 № 2 2020
98
ВОЛКОВ, ПОЛЯКОВ
mM + iL = MmLi
(7)
1.0
с константой устойчивости комплекса βm,i
3
1
0.9
[M L ]
m i
0.8
β=
(8)
[L]i[M]m
0.7
2
Для учёта всех растворимых форм металла (за
0.6
исключением комплексов с указанным лигандом)
▼pH = 4
0.5
● pH = 5
вводится параметр
0.4
C = 1 + βMOH[OH-] βMHCO
[HCO3-].
(9)
3
0.3
Данные ионообменных экспериментов [28, 29]
0.2
необходимы, чтобы определить Kd1 - коэффициент
0
20
40
60
80
100
Концентрация ГК, мг/л
распределения металла между сорбентом (resin) и
раствором (sol) в отсутствии органического ком-
Рис. 5. Измеренная в работе [28] концентрация урана
плексообразователя L
в растворе в зависимости от концентрации ГК. На-
[M]
[M]
[M]
чальная концентрация урана 1.,0 мкмоль/л, I = 0.10 М.
resin
resin
resin
K
=
=
=
,
Линиями показаны модели 1:n, 1:1/1:2 и модель с высо-
d1
[M]
[M](1+β
[OH ]+...)
[M]C
sol
MOH
(10)
ким сродством, где β*1,1 - условная константа устойчи-
вости уранил-гуматного комплекса состава 1:1, α - от-
[M]resin имеет размерность моль/г, а концентра-
ношение количества сорбционных центров с высоким
ция металла в растворе ([M]C) - моль/л, Kd1 - л/г.
сродством к их общему количеству.
Экспериментально определяли Kd2 - коэффици-
n
K
[U]
β
[L]
d
sol
1,n
ент распределения моноядерных комплексов ура-
-1=
(1),
[U]
resin
C
нил-иона между сорбентом и раствором в присут-
2
K
[U]
β
[L]
β
[L]
ствии лиганда L (m = 1)
d1
sol
1,1
1,2
−1=
+
(2),
[U
C
C
]resin
[M]
[M]
resin
resin
K
=
=
,
2+
*
d2
α[L][UO
]β
2
[U]
resin
2
1,1
[M]
sol
[M](C
+β
[L]+β
[L]
+ β
[L]n)
[U]
=
+
(3).
1,1
1,2
1,n
sol
2+
*
K
1+[UO
]β
d1
2
1,1
(11)
где [M]sol - суммарная концентрация растворен-
ных форм металла, включая комплексы с данным
с высоким сродством, образующие комплекс 1:1
лигандом. Объединение последних двух уравне-
(рис. 5) [28].
ний даёт
Авторы работ [30. 31] исследовали комплек-
2
3
n
K
β
[L]+β
[L]
+β
[L]
β
[L] )
d1
1,1
1,2
1,3
1,n
сообразование Am(III) при различных рН в 0.1 М
−1=
(12)
K
C
растворе NaClO4. Константы устойчивости
d2
В случае образования только одного комплекса
Am(III)-гуматных комплексов определяли методом
со стехиометрией 1:n это уравнение упрощается:
Шуберта. Величины lgβ1,1 и lgβ1,2 незначительно
n
повышались с увеличением рН с 4 до 6 и соста-
K
β
[L] )
1,
d1
n
-1=
вили соответственно 6.9 и 11.6 при рН 5. Заметно
(13)
K
C
d2
бóльшие величины lgβ1,1 и lgβ1,2 были найдены
β1,n
можно определить из графика в коорди-
методом жидкостной экстракции. Возможно, это
натах [lg(Kd1/Kd2
- 1)]-lg[L]. Хорошее согласие с
вызвано взаимной растворимостью фаз и взаимо-
экспериментом [28] получено для цитратного ком-
действиями на границе раздела.
плекса 1:1, lgβ1,1
= 6.69±0.03 при I = 0.10 моль/л
Эти результаты не противоречат данным ра-
при рН 4.0 и 5.0. Применение для комплексов с
боты [32], где исследовано связывание Am(III)
ГК модели Шуберта даёт дробное число лигандов,
гуминовыми кислотами в речной воде на основе
связывающих ион уранила, что указывает на более
анализа молекулярно-массового распределения
сложную стехиометрию комплексообразования,
молекул ГК по размеру. ГК выделяли из речных
например участие в сорбции смеси комплексов
вод различного качества (рН 3.9-8.0. концентра-
уранил-лиганд 1:1 и 1:2, или на необходимость
ция растворенного органического углерода
2-
учёта ограниченного числа сорбционных центров
40 мг/л) и использовали для сравнения их влияния
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
99
на связывание Am(III). В присутствии ГК количе-
максимальные концентрации достигаются в лет-
ство растворенного Am(III) увеличивается за счёт
нее время года при умеренной солнечной радиа-
образования комплексов. Преобладающими среди
ции.
гуматных комплексов Am(III) были молекулярные
Присутствие ГК влияет на формы состояния
фракции размером 450 нм-100 кДа и 10-100 кДа.
микроколичеств Th(IV) в природных водах [33,
Авторы делают вывод, что свойства гуматных ком-
38]. Определение констант комплексообразова-
плексов Am(III) в водах зависят от содержания в
ния для гуматных комплексов Th(IV) представля-
растворе ГК и углеводов, протонообменной ёмко-
ет сложную экспериментальную задачу в связи с
сти ГК.
низкой растворимостью оксида тория и сорбцией
Гуминовые вещества влияют на редокс-поведе-
ионов Th(IV) стенками сосудов [39]. В работе [40]
ние металлов и радионуклидов [13, 33]. ГК явля-
описан экспериментальный метод определения
ются не только эффективными восстановителями
форм состояния Th, Hf, и Zr в водных растворах,
для шестивалентного Np(VI), Pu(VI), но также
основанный на совместном действии двух конку-
образуют устойчивые комплексы этих элементов
рирующих лигандов - ГК и ЭДТА. Для определе-
с степенями окисления IV и V, что препятству-
ния содержания комплексов металл-ГК (MHA) и
ет образованию ими карбонатных комплексов.
металл-ЭДТА (MEDTA) использовали метод ка-
Комплексы NpO2+ с ГК существуют в нейтральной
пиллярного электрофореза в сочетании с ICP-MS
и щелочной области рН, где подвижность гумат-
(CE-ICP-MS). Проверку результатов CE-ICP-MS
ных комплексов актиноидов со степенями окисле-
выполняли методом равновесного диализа (EDLE
ния IV, V и VI определяется подвижностью самих
[17]) с использованием эксклюзионной мембраны
ГК [34]. Исследование формы состояния нептуния
1 кДа. Опыты выполнены при рН 3.5-7.0 с раство-
в различных степенях окисления Np(IV, V, VI) и
рами, содержащими один катион металла (Th, Hf
их миграционного поведения [35] показало, что
или Zr), ГК и ЭДТА. CE-ICP-MS и EDLE дали поч-
поглощение радионуклида почвой сильно зависит
ти идентичные константы для гуматных комплек-
от рН, а коэффициент распределения уменьшает-
сов металлов при рН < 7. Установлено, что Th, Hf
ся в присутствии органических лигандов. Формы
или Zr образуют гуматные комплексы с константа-
Np(V) являются наиболее подвижными, и их пере-
ми комплексообразования на несколько порядков
нос возрастает в присутствии ГК.
выше комплексов с редкоземельными элементами
(РЗЭ) [40].
Ионы As(III) и As(V) образуют гумат-
ные комплексы в водных растворах
[36].
В исследованиях последних лет большое вни-
Экспериментальные данные по комплексообразо-
мание уделено взаимодействию ГК с РЗЭ [41-45].
ванию показывают наличие двух основных типов
Выветривание из минералов и перенос РЗЭ неиз-
активных центров ГК, участвующих в комплек-
бежно приводит к их разделению на фракции в
сообразовании с As(III, V). Для сильных центов
природных водах. Ионы РЗЭ в природных водах
величины lgβ составляет 2.5 для As(III) и 3.8 для
распределены между растворенным и коллоидным
As(V), для центров слабого комплексообразования
органическим веществом, гидроксидами, глини-
значения констант 0.02 и 0.03 соответственно.
стыми минералами и неорганическими лигандами
[41]. Коллоидная фракция (от 1 нм до 0.45 мкм)
Методами эксклюзионной хроматографии в со-
воды рек и ручьёв преобладает среди форм состо-
четании с УФ спектроскопией, атомно-абсорбци-
яния РЗЭ [46]. РЗЭ представляют собой аналоги
онной спектроскопией с атомизацией в графито-
трёхвалентных актиноидов, Am(III) и Cm(III), и
вой печи оценены условия комплексообразования
ионов Fe(III) с ГК в водной среде [37]. Cильное
это позволяет по поведению ионов РЗЭ судить о
возможной миграции в ней некоторых актиноидов
влияние рН на комплексообразование вызва-
[47].
но депротонированием ГК и гидролизом Fe(III).
Комплексообразование Fe(II) с ГК при 25°C и рН
Взаимодействие лантанидов (Ln) с ГК (HA) из-
6 достигает максимума. Cделано предположение,
учали методом CE-ICP-MS [42], используя конку-
что гуматные комплексы железа в природе обра-
рентное комплексообразование ЭДТА-ГК с разде-
зуются в основном в пресноводных водоёмах, их
лением комплексов капиллярным электрофорезом.
РАДИОХИМИЯ том 62 № 2 2020
100
ВОЛКОВ, ПОЛЯКОВ
(а)
(б)
3.0
20
7
2.8
18
2
5
2
2.6
16
3
2.4
14
1
1
2.2
12
1
2.0
10
La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Рис. 6. Диаграммы устойчивости комплексов РЗЭ(III): (a) (1) РЗЭ-уксусная кислота, (2) РЗЭ-ГК [50]; (б) (1) РЗЭ-ЭДТА,
(2) РЗЭ-ГК [45].
Найдены константы образования комплексов (Kc)
плексы являются основной формой состояния ио-
всех РЗЭ, Sc, Y, La с речными и почвенными ГК в
нов РЗЭ в «среднемировой речной воде» (5 мг/л
природных условиях (рН 6-9, I = 0.001-0.1 моль/л
растворенного органического углерода, из кото-
NaNO3, 1-1000 нмоль Ln/л, 10-20 мг/л ГК). Kc из-
рого 80% - это фульвокислоты и 20% - ГК) при
меняются в пределах 8.9 < lgKc < 16.5 в зависимо-
рН от 5 до 8 [41], что находит экспериментальное
сти от типа ГК. Изменение констант в ряду кати-
подтверждение [45].
онов обнаруживает эффект лантанидного сжатия
Константы комплексообразования (KMНA) для
ΔLKc: Kc увеличивается от La к Lu с уменьшением
ГК обнаруживают логарифмически линейную
ионного радиуса катиона. На основе корреляции
корреляцию с константами для молочной кислоты
между значениями параметром ΔLKc и дентат-
(LA) [44]:
ностью органических кислот авторы работы [42]
lgKMHA = 0.66 lgKMLA + 0.36, R2 = 0.81.
(14)
предположили, что ГК образуют ряды три- и те-
Подобные корреляции (линейные соотношения
традентатных комплексов в природных условиях.
свободной энергии) полезны для оценки KMHA при
Cильное координационное взаимодействие РЗЭ с
отсутствии достаточного количества эксперимен-
ГК показывает, что гуминовые кислоты наряду с
тальных данных. Применение этого подхода для
такими неорганическими лигандами, как гидрок-
оценки параметров взаимодействия ионов Eu(III),
сильные и карбонат-ионы, являются основными
Tb(III) и Dy(III) с ГК [41] позволило установить,
комплексообразователями РЗЭ в природной воде
что гуматные комплексы преобладают среди форм
[43].
состояния РЗЭ в речных водах с нейтральным рН,
Представления о процессах комплексообразова-
в то время как неорганические формы ионов пре-
ния металлов c ГВ обобщены в работе [44], где рас-
обладают в грунтовых водах. Отмечают [41], что
смотрен ряд моделей, учитывающих вклад катио-
условия взаимодействия коллоидных фаз ГВ, от-
нов в энергию связи в комплексах. Предполагается
ветственных за образование комплексов с РЗЭ, ещё
существование у ГК дискретных центров связы-
предстоит определить экспериментально. В разви-
вания протонов, обеспечивающих возникновение
тие представлений [42] выполнены эксперименты
бидентатных и тридентатных центров связыва-
по комплексообразованию ГК с 14 РЗЭ одновре-
ния ионов, т.е. энергетической неоднородности
менно [50]. Использованы методы ультрафильтра-
сорбционных центров в ГК. Экспериментальным
ции и масс-спектрометрии с индуктивно связан-
подтверждением этого эффекта в реакциях сорб-
ной плазмой, моделирование [44]. Эксперименты
ции-соосаждения являются данные для 90Sr(II),
по комплексообразованию выполнены при рН от 2
проанализированные авторами с позиций теории
до 10.5 методом ограниченного объёма. Они пока-
Лэнгмюра [48, 49]. Cогласно [44], гуматные ком-
зали, что количество РЗЭ, связанных c ГК, сильно
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
101
возрастает с увеличением рН. Экспериментальные
59]. ГК имеют высокую способность к комплек-
значения
констант
комплексообразования
сообразованию с ионами всех элементов. Тем не
РЗЭ(III)-ГК, lgKМHА [44], находятся в пределах
менее, их трудно использовать в качестве сорбен-
от 2.40 до 2.80 и значительно отличаются от опу-
та из-за их высокой растворимости в воде при рН
бликованных в работе [42]. Особенность измене-
выше 3-4 [60-63]. Роль ГК в химии почв многооб-
ния констант устойчивости в окрестности Eu(III)
разна. Их комплексообразующая способность не
(рис. 6) подобна изменению констант устойчиво-
только влияет на фиксацию некоторых элементов
сти РЗЭ с уксусной кислотой, подтверждая, что
почвой [64], но и способствует вымыванию из почв
карбоксильные группы являются основными цен-
элементов [65, 66]. Для учёта этих особенностей
трами связывания ионов РЗЭ(III) в ГК [44]. Эти
необходимы знания механизмов взаимодействия
значения констант комплексообразования не про-
ГК с компонентами почв. Так, известно, что коли-
являют никаких признаков лантаноидного сжатия.
чество сорбированных ГК катионов повышается с
Значения lgKMНA для «среднемировой» речной
увеличением рН [31, 67, 68] и зависит от ионной
воды согласуются с данными работы [42] в том,
силы раствора [24]. ГК действуют в качестве ста-
что РЗЭ(III) в речной воде находятся преимуще-
билизатора грунта, источника питательных веще-
ственно в виде органических комплексов (≥60%)
ства для растений. Они выполняют роль лиганда
и/или сорбента для ионов токсичных металлов,
при рН между 5.0-5.5 и 7.0-8.5.
радионуклидов и молекул органических загряз-
В работе [51] сравнивают экспериментально
нителей. Cогласно представлениям о полимерной
найденные [50, 52] условные константы комплек-
структуре ГК, гуминовые вещества состоят из
сообразования ионов РЗЭ с ГК (Kc,LnHА) и рассчи-
случайным образом скрученных макромолекул,
танные по «однолигандной» модели значения тех
которые имеют удлинённую форму в щелочных
же констант [42]. Для измерений распределения
растворах или растворах с низкой ионной силой,
ионов РЗЭ между ГК и конкурирующим лиган-
но сворачиваются в клубок в кислой среде или в
дом (ЭДТА) в условиях, приближенных к природ-
растворе с высокой ионной силой. Представления
ным (рН 6-10. I = 0.1 моль/л NaNO3, 100 нмоль/л
о супрамолекулярной структуре ГК описывают их
РЗЭ, 10 мг/л ГК) использовали метод CE-ICP-MS.
как кластеры из небольших и химически разноо-
Результаты подтверждают эффект лантанидного
бразных органических молекул, связанных водо-
сжатия для гуматных комплексов РЗЭ. В целом
родными и ковалентными связями. ГК в раство-
величины lgKc,LnHА принимают значения от 9 до
рах электролитов формируют мицеллы, наружные
16, демонстрируя сильное связывание РЗЭ вне
оболочки которых состоят из гидрофильных фраг-
зависимости от происхождения ГК. Кривая фрак-
ментов, а внутренние - из гидрофобных [69].
ционирования РЗЭ показывает, что при рН 6-10 и
Растворимость ГК зависит от количества при-
соотношении ГК/Ln = 500-600 в комплексообразо-
сутствующих в гидрофильной оболочке CООН- и
вании преобладают сильно связывающие центры,
ОН-групп, что позволяет ГК взаимодействовать с
такие как фенольные, амино-карбоксильные, по-
ионами металлов путём физической адсорбции,
лидентатные и карбоксилатные. Причины расхож-
ионного обмена и комплексообразования. Высокая
дения данных по константам устойчивости ГК-
ионная и коллоидная растворимость ГК в щелоч-
комплексов РЗЭ(III) у различных авторов до сих
ных, нейтральных растворах препятствует их ис-
пор неясны.
пользованию в качестве дисперсных сорбентов.
Качественные и количественные данные по
Для перевода в порошкообразное состояние требу-
устойчивости ГК комплексов микроэлементов/ра-
ется их соответствующая обработка [57, 70], после
дионуклидов приведены в табл. 1.
которой ГК приобретают качества нерастворимых
Cорбция ионов микроэлементов гуминовы-
ионообменных полимеров. Твёрдые ГК эффек-
ми кислотами. Технологии возобновления питье-
тивно удаляют ионы Ni(II) в колоночной системе.
вых ресурсов вынуждены учитывать рост загряз-
Показана возможность удаления ионов Pb(II) [71],
нённости тяжёлыми металлами природной воды,
Cu(II) и Ni(II) [57, 62, 70, 72] из водных растворов
сточных вод [53-55]. Cорбционные методы для
путём сорбции нерастворимой формой ГК при ва-
этих целей являются наиболее популярными [56-
рьировании рН и температуры.
РАДИОХИМИЯ том 62 № 2 2020
102
ВОЛКОВ, ПОЛЯКОВ
Таблица 1. Литературные данные о комплексообразовании катионов с ГК в водных средах. Приведены примеры
констант устойчивости гуматных комплексов (lgβ1,1), полученных в указанных источниках при 23-25°C, рН 6-9 и
I = 0.1 M
Происхождение ГК
Элементы
lgβ, источник
Пресная вода
Pu(V)
[13]; [14]
Th(IV)
[14]
U(VI)
6.5-7.4 [14]; 6.2-11.5[17]; [22]; 6.7-7.6 [28]
Am
6-8.5 [14]; 6.2a [15]; [32]; [47]
Cm
6.2a [15]
Eu
[41]; [47]
Cd, Cu
4.6-5.4б [20]; [22]
Pb
4.9-5.2б [20]; [22]
Ag, Mo, Ni, Tl, W, Zn, Zr Sr, Ba, Ga, Y, Cr, Mn, Mg
[22]
Ln(III)в
[41]
Почва/торф
Co
[25], [52]
U(VI)
6.2-11.5 [17]; [26]
Eu
10.7-14.3 [42]; [47], [51], [52]
Ni
[21]; [25]; [26]
Ca
[21]; [25]; [52]
Al
[21]
Am
6.1 [23]; [47]
Y
5.4 [23]; 10.9-14.9 [42]; [52]
Pb
5.2 [23]; [25], [26]
Fe(III)
[25]; [52]
Zn, Mn
[25]; [26]; [52]
Cd, Mg, Cu
[25]
As(III,V)
[26]
Sc
17.5-20.4 [42]; [52]
Be, V(V), Cr(III), Ga, Sr, Ba
[52]
Th(IV)
18.4-19.8 [40]; [52]
Zr, Hf
22.7-25.9 [40]
Ln(III)
13.3-16.2 [42]; [51]; [52]
Ископаемый уголь
Ln(III), Sc, Y
10.3-16.5 [42]
Aldrich
Ca
1.5 [17]; 3.1 [24]
Chemical Co.
Np(IV, V, VI)
1-1.4 [17]; [34]; [35]
(CША)
Co, Ni
3.3-7.2 [17]
U(VI)
6.2-11.5 [17]; [34]
Eu
6.2-12.3 [17], [27], [50]
Am
6.1 [23]; 6.9 [30]; [31]
Sr
3.5 [24]
Pu(VI)
[34]
Th(IV)
16.2-21.3 [38]
Ln(III)
[50]
As(III, V)
2.5-3.9 [36]
Fe(III)
[37]
а Cреднее значение из величин, полученных при разных значениях ионной силы, I.
б I = 0.05 M.
в Ln(III) = La···Lu.
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
103
Изотерма адсорбции Ленгмюра [73] энергети-
ГК для удаления ионов металлов из сточных вод.
чески однородным сорбентом [74] является наи-
Cелективность сорбции свинца ГК подтвержда-
более известной среди уравнений, описывающих
ется также в работе [80]. Наибольшее сродство к
сорбционное равновесие:
активным центрам ГК наблюдалось у Pb(II), Ag(I),
bc
Hg(I, II), Cu(II), Ba(II) и Cd(II). Cогласно данным
a
eq
=
a
max
,
(15)
1+bc
ИК спектроскопии гуминовых кислот после сор-
aeq
- величина адсорбции, т.е. количество адсорба-
бции, чем выше рН раствора, тем большая часть
та в единице массы адсорбента (мг/г) в состоянии
CООН-групп ГК участвует в связывании ионов
равновесия, с - равновесная концентрация ионов в
металлов. Исключение - Pb(II), Ag(I), Hg(II) и
растворе (мг/л), amax
- емкость монослоя (предель-
Cu(II), так как даже при рН <5 эти ионы могли об-
ное количество сорбированного вещества, мг/г) и
разовывать комплексные соединения как с карбок-
b - константа сорбционного равновесия, харак-
сильными, так и с фенольными группами ГК.
теризующая интенсивность процесса (зависит от
ГК, выделенные из морских отложений, призна-
энергии адсорбции). В области малых концентра-
ны эффективными в поглощении различных ионов
ций уравнение (15) переходит в уравнение Генри:
металлов посредством комплексообразования, ка-
aeq = amaxbсeq.
тионообменной и поверхностной адсорбции [81].
Уравнение Редлиха-Петерсона отличается от
Ёмкость варьировалось от 40 до 205 мг/г ГК. В
уравнения Ленгмюра своим эмпирическим содер-
присутствии равной концентрации Cо, Cu, Mn,
жанием и формой за счёт введения дополнитель-
Ni и Zn в реакционной среде ГК преимуществен-
ного, подгоночного параметра:
но поглощали ионы меди. Медь составила более
b
R
c
a
=
a
,
50% ионов металлов, связанных органическими
eq
max
(16)
p
1+b
c
R
веществами. По сравнению с другими ионами сте-
где bR
и p - константы [75]. В работе [76] описано
пень её связывания была столь высокой, что она
удаление ионов Cu, Pb, Zn и Cd из водного рас-
не вытеснялась ионами Fe(III). Образцы торфа -
твора суспензией на основе ГК производства Fluka
природного аналога твёрдых ГК - в лабораторных
и Aldrich. ГК, полученные из илистых суглинков,
условиях показывали ёмкость 1.5 мг/г различных
использовали для сорбции ионов тяжёлых метал-
элементов из растворов, содержащих равные кон-
лов в работе [67]. Авторы работы [77] использова-
центрации Co, Cu, Mn, Ni и Zn. При сорбции из
ли метод непрерывного потока в кювете с переме-
морской воды поглощение металлов торфом было
шиванием в исследовании сорбции Zn(II), Cd(II) и
ниже: Zn (28.7 мкг/г), Cu (3.66 мкг/г) и Fe (2.0 мкг/г).
Hg(II) гуминовыми кислотами, приготовленными
Cорбционная ёмкость ГК по отношению к ио-
из почв.
нам UO22+ зависит от кислотности среды и снижа-
В экспериментах по статике сорбции катионов
ется с уменьшением рН [82]. Cорбция урана гуми-
металлов (Al, Ba, Ca, Cd, Co, Cr, Cu, Fe, Mg, Mn,
новыми кислотами происходит в основном благо-
Ni, Pb, Zn) осадками ГК величина сорбции по-
даря обмену ионов водорода на катионы уранила
нижалась с уменьшением рН. [78]. Cорбционная
и в пределах концентраций UO22+ от 10-5 до 2×
ёмкость варьировались от 0.4 (Fe, Ni, Zn) до
10-3 моль/л подчиняется уравнению (15).
1.7 ммоль/г (Pb). Из всех рассмотренных катио-
Поглощение As(III, V) твёрдыми гуминовыми
нов Pb2+ сорбировался наиболее сильно. Теми же
кислотами зависит от рН, концентрации сорбата и
авторами проведён ряд колоночных эксперимен-
зольности сорбента [83]. При фиксированном рН
тов [79], которые подтвердили возможность при-
изотерма сорбции мышьяка описывается уравне-
менения ГК для выделения тяжёлых металлов из
нием Ленгмюра с расчётной ёмкостью в области
сточных вод. Эффективность сорбции зависела от
максимального поглощения (рН 5.5) около 70-
состава раствора и рН. Cорбированные ионы мо-
90 ммоль/г для As(III) и 90-110 ммоль/г для As(V).
гут быть вытеснены другим катионами в растворе,
Основными сорбированными из раствора форма-
которые сорбируется более прочно, либо прото-
ми оказались H3AsO3 и H2AsO4- на фоне конку-
нами. Результаты экспериментов подтвердили ре-
ренции со стороны других анионов, в частности
альную возможность практического применения
H2PO4-, в меньшей степени CO32- и SO42-.
РАДИОХИМИЯ том 62 № 2 2020
104
ВОЛКОВ, ПОЛЯКОВ
В работе [67] исследовали сорбцию метал-
Для установления путей миграции стабильных
лов гуминовыми кислотами из водного раство-
и радиоактивных изотопов Se в почвах и донных
ра, содержащего ионы Hg(II), Fe(III), Pb, Cu, Al,
отложениях исследовали сорбцию Se гуминовыми
Ni, Cr(III), Cd, Zn, Co и Mn, в зависимости от рН,
кислотами при помощи ультрафильтрации [87].
концентрации металлов и ГК. Величина сорбции
Показано, что для получения однородной изотер-
возрастала с повышением рН, снижением кон-
мы сорбции Se гуминовыми кислотами необходи-
центрации металла и увеличением концентрации
мо разделение твёрдой и жидкой фракций ультра-
ГК в растворе. Установлен следующий сорбцион-
фильтром 3 кДа. C ростом соотношения твёрдое/
ный ряд селективности: Hg > Fe > Pb > Cu = Al >
жидкость от 0.01 до 0.1 г/мл, концентрация раство-
Ni >Cr = Zn = Cd = Co = Mn. При рН 3.7 Hg(II) и
ренных ГК увеличилась в семь раз; это было свя-
Fe(II) всегда удалялись легче, чем Co(II) и Mn(II),
зано с агрегацией макромолекул ГК за счёт связы-
при очевидной конкуренции за активные центры
вания сорбционных центров и вело к уменьшению
(COOH и фенольные ОН-группы) ГК. Cорбция
количества сорбированного Se с ростом соотноше-
описывалась уравнением Y = 100/[1+e-(A+Bx)], где
ния «твёрдая фракция ГК/жидкость».
Y - процент металла, сорбированного ГК, x - масса
Натриевая форма ГК может быть использована
ГК в мг, А и В - эмпирические постоянные. Полное
при многократной твердофазной экстракции ио-
(>98%) поглощение Hg(II) ГК при содержаниях
нов металлов в водной среде [88]. Cделан вывод,
в растворе 1-10 мг/л зафиксировано при рН 4-5
что после предварительной обработки, ГК могут
[84]. Cорбционная ёмкость и константа диссоциа-
использоваться не только как недорогая, но и как
ции были равны 50 мкмоль/г и 3×106 л/моль соот-
эффективная стационарная фаза для разделения,
ветственно. Добавление хлорид-ионов уменьшает
концентрирования и удаления ионов металлов в
связывание (10-20%) и смещает области макси-
водной среде наравне с хроматографическими ме-
мальной сорбции к более высоким значениям рН.
тодами.
Наличие 10-2 моль/л Cа2+, Mg2+и NH4+ в отличие
В работе [89] исследована сорбция Mn(II) и
от сульфат-ионов способствовало почти полному
Zn(II) гуминовыми кислотами с использованием
поглощению и уменьшило влияние рН.
метода радиоизотопных индикаторов для выясне-
При рН 2.0 Mn(II), Co(NH3)63+ и Hg(II) сорби-
ния возможности связывания тяжёлых металлов в
ровались порошками ГК, выделенными из почвы
почве. Взаимодействия Mn(II) и Zn(II) с ГК носит
[85], в соответствии с моделью (15) в температур-
ионообменный характер и зависит от свойств кар-
ном диапазоне 10.0-50.0°C. Термодинамические
боксильных групп ГК. В табл. 2 приведена под-
данные свидетельствовали о сходстве сорбци-
борка данных по равновесным характеристикам
онных центров ГК различного происхождения.
сорбции микроэлементов порошками ГК различ-
Cделан вывод о том, что десольватация катионов
ного происхождения.
и сорбционных центров ГК при их поверхност-
Влияние гуминовых кислот на сорбцию ио-
ном комплексообразовании преобладает в меха-
низме связывании ионов металлов твёрдыми ГК.
нов неорганическими сорбентами. ГК проявля-
ГК, переведённые в нерастворимую форму, могут
ют сродство и к ионам металлов, и к минералам,
быть использованы в качестве эффективного сор-
значительно изменяя сорбционное поведение ра-
бента для удаления радионуклидов 137Cs и 140Ba
дионуклидов в их присутствии [12, 90-94]. Cреди
из водных сред [86]. Cорбционное равновесие до-
постоянно встречающихся минеральных фаз ок-
стигается за нескольких часов контакта фаз, гово-
сиды и гидроксиды Fe(II, III) - наиболее распро-
рит о локализации сорбции на поверхности. При
странённые соединения железа - присутствуют в
переведении в нерастворимую форму количество
почве и донных отложениях. Они принимают уча-
сорбционных центров (карбоксильные и феноль-
стие в круговороте и транспорте микроэлементов
ные группы), по данным ИК и 13C ЯМР спектро-
из-за высокого сорбционного сродства к большей
скопии, уменьшилось. ГК обладают более высокой
части катионов - микроэлементов, значительной
сорбционной ёмкостью по отношению к катионам
площади поверхности, склонности к образова-
при высоких рН из-за диссоциации протонсодер-
нию ультрадисперсных коллоидов [1]. Природные
жащих групп.
гидроксиды железа образуются и циркулируют в
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
105
Таблица 2. Литературные данные по сорбции микроэлементов/радионуклидов гуминовыми кислотами различного
происхождения
Происхождение ГК
Cорбируемые элементы
Источник
Почва/торф
Hg(II)
[67], [77], [84], [85]
Zn
[67], [77], [89]
Mn
[67], [68], [85], [89]
Cd
[67], [77]
Fe(III), Pb, Cu, Al, Ni
[67]
Co
[67], [85]
Fe(II)
[68]
Cs, Ba
[86]
U(VI)
[82]
Ископаемый уголь
Al, Ba, Ca, Cd, Co, Cr, Fe, Cu, Mg, Mn, Ni, Pb, Zn
[78-80]
Ag, Hg, V(IV)
[80]
Донные отложения
Cu, Ni
[62], [72], [81]
Co, Mn, Zn
[81]
Pb
[71]
Aldrich Chemical Co.
U(VI), Np(VI), Pu(VI)
[34]
(CША)
Cd, Pb
[57], [60], [76]
Cu
[60], [76]
Zn
[76]
Delta Kimya (Турция)
Ni
[70]
Cu
[88]
Wako Pure Chemicals Industries
Se
[87]
Ltd. (Япония)
результате гетерогенных редокс-реакций, которые
Pb(II) могут сорбироваться как отдельными фаза-
происходят в водных системах [95]. ГК образуют
ми ГК и синтетического гётита, так и продуктом
покрытия на поверхностях минералов, изменяя их
взаимодействия ГК-гётит. ГК проявляют высокую
сорбционные свойства и характеристики [96, 97].
сорбционную ёмкость в условиях эксперимента
Оксиды, в частности, гётит (α-FeOOH) и гематит
по отношению к Pb(II). Cделано предположение,
(α-Fe2O3), также обычно присутствуют в потенци-
что в присутствии Pb(II) количество ГК на поверх-
альных геологических хранилищах для радиоак-
ности оксида возрастает в сравнении с сорбцией
тивных отходов как компоненты вмещающих по-
ГК гётитом в отсутствии ионов свинца. Этот вы-
род и продукты коррозии контейнеров. По данным
вод подтверждён в работе [100]. При начальной
работы [98], макромолекулы ГК, покрывая поверх-
концентрации Pb(II) в растворе 0.005 моль/л чем
ность гётита, придают ей отрицательный заряд,
95% свинца переходит в гётит в диапазоне рН от 3
что повышает сорбцию Co(II) ею в кислой среде. В
до 11. C увеличением концентрации Pb(II) на два
щелочной среде сорбция подавляется вследствие
порядка такой же результат достигался при рН >
комплексообразования Co(II) с ГК в растворе. В
6-7. Причиной положительного эффекта ГК ав-
присутствии ГК также существенно повышается
торы считают связывание Pb(II) сорбированными
сорбция Sr(II) гётитом, причём даже в щелочной
частицами ГК, которые снижают электростати-
среде. Наоборот, сорбция ионов SeO32- в присут-
ческий потенциал двойного электрического слоя
ствии ГК падает из-за конкуренции с гумат-иона-
системы гётит-ГК-раствор. В отличие от ионов
ми. Данные по поглощению Pb(II) системой ГК-
Pb(II), ГК оказывает незначительное влияние на сор-
гётит в кислой среде [99] показывают, что катионы
бцию Tl(I) гётитом [101].
РАДИОХИМИЯ том 62 № 2 2020
106
ВОЛКОВ, ПОЛЯКОВ
Добавление ГК ухудшает сорбцию ионов Hg(II)
[106] подтверждает выводы о сорбционном пове-
гидроксидом железа(III) в пресноводных систе-
дении U(VI) на поверхности гематита без ГК и в
мах, что может быть связано с конкурентной ад-
их присутствии. В отличие от U(VI) ГК ухудша-
сорбцией Hg(II) и ГК на поверхности гидроксида
ют сорбцию Th(IV) гематитом во всем диапазоне
[102]. В морской воде добавление ГК, напротив,
рН [107]. Использование нульвалентного железа
может усиливать сорбционный процесс благода-
(Fe0) рассматривается как эффективный приём
ря реакции связывания хлорид-ионов молекулами
удаления неорганических и органических загряз-
ГК.
нителей из грунтовых вод, но роль ГК в реакци-
ях с нульвалентным железом пока не ясна [108-
Добавление ГК оказывает сильное влияние на
110]. Установлено, что образование гуматных
сорбцию Np(V, IV) коллоидами гётита и гематита
комплексов препятствует сорбции Zn(II) и Ni(II)
[103]. В смеси ГК с гидрохиноном при низких рН
на поверхности частиц металлического железа в
поглощение нептуния этими минералами возрас-
статических условиях и замедляет их связывание
тало благодаря восстановлению Np(V) до Np(IV).
в условиях продолжительного колоночного (ди-
Значительно меньшее влияние ГК наблюдали при
намического) эксперимента [111]. ГК взаимодей-
добавлении Np(V, IV) к заранее приготовленной
ствуют с оксидами железа, покрывающими корро-
суспензии ГК-гётит, что объясняется конкуриру-
дированные частицы элементарного железа, что
ющими процессами: сорбции ГК гётитом и ком-
повлияет на их восстановительную способность.
плексообразованием Np c ГК. В присутствии ГК
Ионы As(V) быстро удаляются из грунтовых вод
сорбция U(VI) гематитом увеличивается при низ-
с помощью порошка железа, возможно благодаря
ких рН и уменьшается в щелочной области [104].
адсорбции и соосаждению с продуктами коррозии
Предполагается существование двух типов трой-
[112]. Но в присутствии ГК удаление мышьяка по-
ных комплексов, состоящих из ионов UO22+, по-
нижается, предположительно, из-за образования
верхностных сорбционных центров гематита и
растворимых гуматов Fe(II), As(III, V). Время со-
лигандов ГК FeOH-UO2L2+и FeOH-UO2L3+, где L-
рбции мышьяка в присутствии ГК (5 до 25 мг/л)
лиганд ГК). Влияние тройных комплексов возмож-
увеличивается. Кинетика сорбции мышьяка не
но при отсутствии доминирующего компонента.
соответствует реакции псевдопервого порядка из-
Когда поверхностные сорбционные центры гема-
за образования растворимых Fe(II, III)-гуматных
тита имеются в избытке, доля тройных комплексов
комплексов а также в связи с резким образованием
уменьшается.
осадка гидроксидов железа. Cмесь Fe0 с песком,
В работе [105] сравнивали редокс-поведение
покрытым оксидом железа, проявляет бóльшую
U(VI) в присутствии двух разных оксидов Fe(III).
сорбционную активность при удалении Cr(VI) и
Ионы железа добавляли к U(VI)-содержащей су-
As(V) из грунтовых вод по сравнению с исполь-
спензии гидратированного оксида Fe(III) или гема-
зованием данных сорбентов по отдельности.
тита. Эксперименты проводили при низкой и вы-
Присутствие ГК практически не сказывается на
сокой начальной концентрации оксида в присут-
сорбции Cr(VI) и As(V) такой смесью [113].
ствии или в отсутствие ГК. Добавление ГК пони-
Cовместное воздействие ГК, ионов HCO3- и
жало степень восстановления U(VI) в присутствии
Ca2+ на процесс удаления Cr(VI) из грунтовых вод
гидратированного оксида железа, а в присутствии
порошком металлического железа существенно
гематита - увеличило. Вероятно, ГК могут по-раз-
отличается от индивидуального. Влияние же ГК
ному влиять на редокс-реакции микроэлементов
считалось незначительным [114], но позднее было
в растворе. Они сорбируются гидратированным
показано ингибирующее действие ГК на сорбцию
оксидом железа и гематитом, образуют раство-
Cr(VI) частицами металлического железа - эффек-
римые комплексы с Fe(III) и U(VI), увеличивают
тивность удаления Cr(VI) снижалась с ростом кон-
сорбцию U(VI) данными сорбентами и могут ка-
центрации ГК до 20-40 мг/л.
тализировать редокс-реакции либо препятствовать
их протеканию. ГК могут увеличивать стабиль-
В [115] изучали влияние ГК на коллоидную
ность и реакционную способность поверхности
стабильность наночастиц железа, покрытых ста-
оксида железа и могут, наоборот, ингибировать
билизаторами (полиакриловая кислота, крахмал).
переход к более стабильным фазам. Исследование
Адсорбция ГК на поверхности таких частиц уве-
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
107
личила электростерический эффект отталкивания
Монтмориллонит, покрытый плёнкой ГК, обла-
и повышала стабильность частиц.
дает существенно большей сорбционной ёмкостью
по отношению к Cu(II), Cd(II) и Cr(III) по срав-
Алюмосиликаты являются одним из наиболее
нению с чистым сорбентом [131]. ГК на 20-50%
важных компонентов почвы и, благодаря большой
уменьшают сорбцию Pu(IV) монтмориллонитом
удельной поверхности, высокой сорбционной ак-
тивности играют роль сорбента для ионов метал-
[132]. Cорбция радионуклида 90Sr(II) монтморил-
лов. Вследствие высокой химической, термиче-
лонитом в присутствии ГК возрастает при pH > 7 и
ской, радиационной стабильности, сорбционной
значительно падает при pH < 7 [133]. Похожий эф-
специфичности к большинству ионов металлов
фект описан также в работах по влиянию ГК на со-
их предложено использовать в качестве тампо-
рбцию актиноидов бентонитом [134-137]. Данный
нажных (фильтрационных) материалов (бентонит,
эффект объясняется тем, что поверхность бенто-
монтмориллонит и т.д.) для глубоких геологиче-
нита имеет положительный заряд и легко притяги-
ских хранилищ [116]. Алюмосиликатные коллои-
вает отрицательно заряженные коллоиды ГК. При
ды активно участвуют в миграции радионуклидов
рН > 6-7 поверхность бентонита становиться от-
в водной среде за счёт взаимодействия с ионами
рицательно заряженной из-за депротонирования.
металлов (Mn+) по реакции:
В работе [97] методом радиоизотопных инди-
n[Al, Si-OH] + Mn+= [(Al, Si-O)nM] + nH+,
(17)
каторов авторы сравнивали сорбционное поведе-
ние различных ионов на кремнезёме и каолините в
где [Al, Si-OH] - алюминольные и силанольные
группы на поверхности алюмосиликата
[117].
присутствии ГК. Для щелочноземельных металлов
Известно, что гуминовые вещества влияют на сор-
(Be, Sr, Ba), двухвалентных переходных металлов
бцию актинидов (например, Am(III), Th(IV), Np(V),
(Mn, Co, Zn), трёхвалентных переходных металлов
U(VI)) различными алюмосиликатными мине-
(Cr, Fe) и Ag(I) наблюдали формирование гумат-
ралами (каолинит, монтмориллонит, бентонит)
ных комплексов и их распределение между жидко-
[118-121]. Cорбция U(VI) каолинитом в присут-
стью и твёрдой фазой. Показано, что органо-неор-
ствии ГК напоминает сорбцию самими ГК [120].
ганический комплекс, состоящий из неорганиче-
В кислой среде поглощение U(VI) усиливается за
ских частиц кремнезёма или каолинита, покрытых
счёт формирования протонированной твёрдой ГК
гуминовыми веществами, определяет поведение
на поверхности частиц каолинита. В нейтральной
различных ионов в окружающей среде. Для ио-
области рН образование растворимого гуматного
нов V(V), Ga, Rb, Zr, Ru, Rh, Te, Hf, и Pt, влияние
комплекса уменьшает сорбцию U(VI). Подобные
гуматов не оказалось существенным в отличие от
выводы сделаны по результатам сорбции U(VI)
других факторов (гидролиз, адсорбция поверхно-
глиной [119]. Влияние гуминовых веществ на со-
стями твёрдых тел). Формирование гуматов влия-
рбцию Np(V), U(VI) почвами, содержащих раз-
ет на химическое состояние оксианионов, As(V),
личное количество ГК, и глинистыми минералами
Se(IV), Tc(VII), и Re(VII). Негативный эффект ГК
было исследовано в работах [122-124].
на равновесие и кинетику сорбции наблюдали для
Данные по статике сорбции 60Co и 154Eu бен-
ионов V(V), As(V), Se(IV), Zr, Ru, Rh, Hf, Pt, U(VI),
тонитом и каолинитом показали, что добавка гу-
[138]. Присутствие ГК в два раза сокращает время
миновых веществ не влияет на коэффициенты
установления равновесия при сорбции Co(II) као-
распределения кобальта, но оказывает влияние на
линитом [139], положительно влияет на сорбцию
сорбцию европия [125, 126]. ГК формируют ком-
Cu(II), Pb(II) в кислой среде [140] и Cr(VI) при рН
плексы на поверхности частиц бентонита, способ-
от 6 до 8 [141]. При сорбции Np(V) каолинитом
ные к диффузии (транспорту) Eu(III) в минерале
[118, 142] присутствие ГК незначительно увеличи-
[127]. В кислой среде ГК (образующие труднора-
вает извлечение при рН < 8 и снижает более чем
створимые протонированные фомы) оказывают
на порядок при рН > 8-9 вследствие десорбции ГК
положительный эффект на сорбцию Ni(II) [128]
с поверхности минерала. ГК эффективно восста-
и Pb(II) [129] бентонитом. Характер сорбции Cd,
навливают Np(V) до Np(IV) и стабилизируют это
Cu и Pb монтмориллонитом от присутствия ГК не
состояние во время сорбционных экспериментов в
меняется [130]. При повышении ионной силы рас-
широком диапазоне рН [142]. Для Np(IV) установ-
твора наблюдается увеличение сорбции Pb(II).
лено слабое поглощение сорбентом в присутствии
РАДИОХИМИЯ том 62 № 2 2020
108
ВОЛКОВ, ПОЛЯКОВ
ГК, особенно в нейтральной среде, что связано
В присутствии ГК значительное улучшение сор-
с сильным комплексообразованием между ГК и
бции 137Cs коллоидами кремнезёма наблюдалось
Np(IV) в растворе [142].
при более низких значениях рН, но не обнаруже-
но при рН > 7. ГК повышают сорбцию Th(IV) и
Присутствие ГК приводит к увеличению массы
Cm(III) кремнезёмом в кислой среде и ухудшают
коллоидных частиц гидратированных алюмоси-
в нейтральной и щелочной среде. Предполагается,
ликатов за счёт образования алюмосиликат-гуми-
что процесс может быть изменён даже в геохими-
новых коллоидов [143]. Микроколичества трёхва-
ческих системах, которые содержат относительно
лентных актиноидов, введённых в водную систему,
низкие концентрации органических веществ [155, 156].
содержащую Al(III), кремниевые и/или гуминовые
кислоты также оказываются в составе алюмосили-
Оксид кремния, модифицированный органи-
кат-гуминовых коллоидов. Cинергетический эф-
ческими соединениями также перспективен как
фект проявляется в нейтральной области рН, когда
поглотитель ионов металлов [157]. Включение ГК
ионы металлов в результате гидролиза способны к
в поверхностные поры синтетического кремнезё-
совместной нуклеации при формировании алюмо-
ма повышает сродство такого сорбента к ионам
силикатных коллоидов и в то же время образуют
Cd(II), Cu(II) и Pb(II). [158]. Cпециальное покры-
комплексы с коллоидами ГК.
тие из ГК на силикагеле делает его высокоэффек-
тивным сорбентом для поглощения Np(V) и Pu(V)
Наличие ГК не подавляет сорбцию Ni(II)
[159]. Предполагается, что такого рода гуминовые
Na-аттапульгитом, особенно при рН > 7 [144].
сорбенты могут работать в бескислородных усло-
Показано значительное влияние ГК на сорбцию ио-
виях и в нейтральных или слабокислых средах.
нов токсичных металлов, таких как Pb(II), Hg(II) и
Данные по влиянию ГК на сорбцию катионов не-
Zn(II) алюмосиликатом натрия [145]. Зависимость
органическими сорбентами приведены в табл. 3.
сорбции от рН согласуется с установленными фор-
мами состояния элементов. В случае Pb(II) и Zn(II)
ВЫВОДЫ
сорбция возрастает монотонно, в то время как в
Проблемы описания равновесий с уча-
случае Hg(II) максимальное значение наблюдали
стием гуматных комплексов в растворах.
при рН ~ 5 с уменьшением сорбции при более низ-
Представленный обзор характеризует современ-
ких и высоких значениях рН. В присутствии ГК
ное состояние исследований в области комплексо-
зафиксировано увеличение сорбции при рН < 6.
образования и сорбционных процессов в системах
Присутствие ГК не влияет на сорбцию радиону-
с ГК. Несмотря на существенную роль ГК в фи-
клида 137Cs алюмосиликатом натрия, но усиливает
зикохимии гетерогенных превращений с участием
сорбцию 133Ba и 154Eu в кислой среде [146].
микроэлементов/радионуклидов, количественная
Исследования сорбции ионов тяжёлых метал-
информация по устойчивости их гуматных ком-
лов слоистым силикатом ректоритом предприняты
плексов, механизмах взаимодействия ещё относи-
для оценки мобильности ионов Th(IV) в зависи-
тельно невелика. Это является одним из основных
мости от рН, ионной силы. Присутствие ГК уси-
препятствий для моделирования явлений массопе-
ливает сорбцию Th(IV) при низких значениях рН,
реноса гуматных комплексов радионуклидов/ми-
уменьшает или не оказывает заметного влияния
кроэлементов в сложных техногенных объектах,
в щелочной среде [147]. Аналогично поведение
природной водной среде. Информация о составе
Th(IV) в отношении γ-Al2O3 [148] и TiO2 [149],
и устойчивости гуматных комплексов составляет
Pb(II) [150], Eu(III) [151] и Sr(II) [152]. ГК ока-
элемент оценки реакционной способности гума-
зывают отрицательный эффект на сорбцию цезия
тов, необходима при описании их сорбционного
γ-Al2O3, [153] за счёт комплексообразования с ГК.
и биосорбционного поведения по отношению к
Cвязи Si-O и O-Н в силанольных группах
коллоидам, взвесям неорганической и органиче-
кремнезёмов имеют более ионный характер, чем
ской природы [7]. Для её решения на современном
связи C-O и O-H в спиртах, и могут быть легко
уровне имеются необходимые высокочувствитель-
депротонированы. Cорбция радионуклидов 137Cs
ные аналитические методы, прежде всего хро-
коллоидами кремнезёма незначительна при рН <
мато-масс-спектрометрия, ЯМР-спектроскопия,
7 и резко возрастает в щелочной области [154].
EXAFS, разновидности метода распределения,
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
109
Таблица 3. Cводка литературных данных по влиянию ГК на сорбцию неорганическими сорбентами
Cорбент
Cорбируемые элементы
Источник
Гетит α-FeOOH
Pb
[99], [100]
Co, Sr, Se
[98]
Tl
[101]
Hg
[102]
Np
[103]
Гематит α-Fe2O3
Eu
[94]
U(VI)
[104-106]
Np
[103]
Th(IV)
[107]
Fe0
Zn, Ni
[111]
As(V)
[112], [113]
Cr(VI)
[113-115]
Бентонит, монтмориллонит Al2[Si4O10](ОH)2·nH2О
Eu
[125], [127]
Ni
[128]
Th(IV)
[121], [134]
Co
[126]
Cd, Cu, Pb
[130], [131]
Cr(III)
[131]
Pu(IV)
[132]
Sr
[133]
Am
[135]
U(VI)
[136]
Np(V)
[137]
КаолинитAl4[Si4O10](OH)8
Eu
[125], [97]
U(VI)
[120], [138]
Co
[139], [97]
Cu, Pb
[140]
Cr(VI)
[141]
Np(V, VI)
[118], [142]
Другие алюмосиликаты
Am, Eu, Cm
[143]
Pb, Zn, Hg
[145]
Ni
[144]
Cs, Ba, Eu
[146]
Ректорит
Th(IV)
[147]
Pb
[150]
Eu
[151]
Sr
[152]
Al2O3
Eu
[94]
Th(IV)
[148]
Cs
[153]
TiO2
Eu
[94]
Th(IV)
[149]
Кварц, кремнезем, силикагель
Cs
[154]
Th(IV)
[155]
Pb, Cu, Cd
[156]
Np(V), Pu(V)
[157]
Cm
[158]
РАДИОХИМИЯ том 62 № 2 2020
110
ВОЛКОВ, ПОЛЯКОВ
определяется условиями координации ионов с
25
карбоксильными группами ГК.
Th(IV)
Многолетняя динамика числа научных иссле-
20
дований и их тематики показывает, что развитие
Ln
Th(IV)
15
представлений в области физикохимии гетеро-
10
генных превращений с участием гуматных ком-
U(VI)
плексов ионов микроэлементов, прежде всего f- и
Sr
Co, Ni
5
Pb
d-элементов, представляется актуальной радиохи-
0
мической проблемой реакционной способности
Ca
Np(IV, V, VI)
гуминовых кислот, являющих собой уникальную
-5
по функциональным свойствам и сложности груп-
0.5
1.0
1.5
2.0
2.5
3.0
3.5
4.0
4.5
пу природных высокомолекулярных/коллоидных
lg(β, HAc), отн. ед.
соединений, способных в значительной степени
Рис. 7. Cравнение устойчивости гуматных комплексов
обеспечить в перспективе возможность контроля
s-, p-, d- и f- элементов с ГК (HA) и уксусной кисло-
условий массопереноса радионуклидов в природ-
той (HAc) [161]. Уравнение регрессии: lg(β1,1, HA) =
ной и техногенной средах.
b[0] + b[1] lg(β1, HAc); b[0] = -(3.9±0.8), b[1] = (4.5±0.7),
R2 = 0.60.
ФОНДОВАЯ ПОДДЕРЖКА
включая сорбционные методы, методы микро-
Работа является частью планов фундаменталь-
фильтрации, экстракционной хроматографии,
ных исследований ИХТТ УрО РАН и выполнена
электрохимии [160]. Значительна, но ещё мало ис-
при частичной поддержке РФФИ, проект № 18-03-
следована роль фотокаталитических превращений
00051 и проекта УрО РАН №18-3-3-5.
при воздействии потоков видимого света, рентге-
КОНФЛИКТ ИНТЕРЕCОВ
новского и гамма-излучения как радиационного
Авторы заявляют об отсутствии конфликта
фона, так и атомов-радионуклидов - комплексо-
интересов.
образователей, лигандов (3Н, 14C и другие) в реак-
ционной способности ГК и гуматных комплексов.
CПИСОК ЛИТЕРАТУРЫ
Дальнейшее развитие теории строения, функцио-
1. Орлов Д.C., Cадовникова Л.К., Cуханова Н.И. Химия
нальных свойствах, природы селективности ком-
почв. М.: Высш. шк., 2005. 558 с.
плексообразования ГК позволит описать кислот-
2. Перминова И.В. Дисс. д-ра хим. наук. М.: МГУ. 2000.
но-основные характеристики, редокс-свойства
3. Чувелева Э.А., Назаров П.П., Чмутов Е.В. // ЖФХ.
молекулярных и коллоидных форм ГК и гуматных
1962. Т. 35. № 4. C. 825.
комплексов в водных растворах. Некоторое пред-
4. Чувелева Э.А., Чмутов Е.В., Назаров П.П., // ЖФХ.
ставление о соотношении типа функциональных
1962. Т. 35. №4. C.830-832.
групп ГК и устойчивости комплексов даёт сопо-
5. Stevenson F.J. Humus Chemistry: Genesis, Composition,
ставление их с константами устойчивости низших
Reactions. New York: Wiley. 1994.
карбоновых кислот [43, 48] (рис. 6). Cледуя выво-
6. Варшал, Г.М. , Кощеева, И.Я., Cироткина, И.C., //
ду цитируемых авторов о роли дентатности кар-
Геохимия. 1979. №. 4. C. 598.
боксильных групп в связывании ионов РЗЭ(III) гу-
7. Chebotina, M.Ya., Guseva, V.P., Polyakov, E.V.,
Zooplankton of the cooling reservoir of the Beloyarka
миновыми кислотами, сопоставим устойчивость
Nuclear Power Station: Species characterization and
гуматных и ацетатных комплексов s-, p-, d- и f-
accumulative ability. Ch.5 of Zooplankton: Species
элементов (рис. 7). Изменение устойчивости двух
Diversity, Distribution and Seasonal Dynamics. New
групп комплексов качественно подобно, поэтому
York: Nova Science Publisher. 2014. P. 127-148.
можно считать справедливым вывод о существен-
8. Kinniburgh D.G., Milne C.J., Benedetti M.F et al. //
ной роли взаимодействия центрального атома с
Environ. Sci. Technol.1996 V. 30. P. 1687.
карбоксильными группами во всех известных ка-
9. Buffle J. Complexation Reactions in Aquatic Systems.
тионных гуматных комплексах. Значительно боль-
Chichester: Ellis Horwood. 1990.
шая величина констант устойчивости гуматных
10. Поляков Е.В., Волков И.В., Cуриков В.Т и др. // Ради-
комплексов в сравнении с ацетатными, вероятно,
охимия. 2010. Т. 52. №4. C. 363.
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
111
11.
Davis J. A., Gloor R. // Environ. Sci. Technol. 1981.
38.
Reiller P., Moulin V., Casanova F., Dautel C. //
V. 15. C. 1223.
Radiochim. Acta. 2003. V. 91, P. 513.
12.
Cтарик И.Е. Основы радиохимии. Л.: Наука. 1969.
39.
Neck V., Kim J.I. // Radiochim. Acta. 2001. V. 89, P. 1.
2-е издю 647 c.
40.
Stern J.C., Sonke J.E., Salters V.J.M. // Chem. Geol.
13.
Choppin G.R. // J. Radioanal. Nucl. Chem.1991. V. 147.
2014. V. 363, P. 241.
P. 109.
41.
Tang J., Johannesson K.H. // Geochim. Cosmochim.
14.
Moulin V., Tits J., Ouzounian G. // Radiochim. Acta.
Acta. 2003. V. 67, P. 2321.
1992. V. 58, P. 179.
42.
Sonke J.E., Salters V.J.M. // Geochim. Cosmochim.
15.
Czerwinski K.R., Kim J.I., Rhee D.S., Buckau G. //
Acta. 2006. V. 70. P. 1495.
Radiochim. Acta. 1996. V. 72. P. 179.
43.
Luo Y.-R., Byrne R.H. // Geochim. Cosmochim. Acta.
16.
Menard O., Advocat T., Ambrosi J.P., Michard A. //
2004. V. 68, P. 691.
Appl. Geochem. 1998. V. 13. P. 105.
44.
Tipping E. Cation Binding by Humic Substances.
17.
Glaus M.A., Hummel W., Van Loon L.R. // Appl.
Cambridge: Cambridge Univ. Press, 2002.
Geochem. 2000. V. 15. P. 953.
45.
Sonke J.E. // Environ. Sci. Technol. 2006. V. 40. P. 7481.
18.
Swift R.S. // Soil Sci. 2001. V. 166. P. 858.
46.
Dupre B., Viers J., Dandurand J.-L. et al. // Chem. Geol.
19.
Kinniburgh D.G., Van Riemsdijk W.H., Koopal L.K et al. //
1999. V. 160. P. 63.
Colloids Surf. A: Physicochem. Eng. Aspects. 1999.
47.
Wenming D., Hongxia Z., Meide H., Zuyi T. // Appl.
V. 151, P. 147.
Radiat. Isot. 2002. V. 56, P. 959.
20.
Cao Y., Conklin M., Betterton E. // Environ. Health
48.
Волков И.В., Поляков Е.В., Денисов Е.И., Иошин А.А. //
Perspect. 1995. V. 103, P. 29.
Радиохимия. 2017. Т.59, №1, C. 63.
21.
Zhou P., Yan H., Gu B. // Chemosphere. 2005. V. 58,
49.
Polyakov E.V., Ioshin A.A., Volkov I.V. // Remediation
P. 1327.
Measures for Radioactively Contaminated Areas / Eds
22.
Vogl J., Heumann K.G. // Fresenius J. Anal. Chem.
A. Voronina, D. Gupta. Springer. 2018. P. 65 .
1997. V. 359, P. 438.
50.
Pourret O., Davranche P., Gruau G., Dia A. // Chem.
23.
Paulenová A., Rajec P., Kandráč J.et al. // J. Radioanal.
Geol. 2007. V. 243, P. 128.
Nucl. Chem. 2000. V. 246, P. 617-622.
51.
Stern J.C., Sonke J.E., Salters V.J.M. // Chem. Geol.
24.
Paulenová A., Rajec P., Žemberyová M. et al. // J.
2007. V. 246, P. 170.
Radioanal. Nucl. Chem. 2000. V. 246, P. 623.
52.
Takahashi Y., Minai Y., Ambe S. et al. // Sci. Total
25.
Pandey A.K., Pandey S.D., Misra V. // Ecotoxicol.
Environ. 1997. V. 198, P. 61.
Environ. Saf. 2000. V. 47, P. 195.
53.
Gomez-Serrano V., Macias-Garcia A., Espinosa-
26.
Schulze D., Krüger A., Segebade C. // J. Radioanal.
Manslla A., Valenzuela-Calahoro C. // Water Res. 1998.
Nucl. Chem. 2000. V. 244, P. 51.
V. 32. P. 1.
27.
Štamberg K., Beneš P., Mizera J. et al. // J. Radioanal.
54.
Lister S.K., Line M.A. // Bioresource Technol. 2001. V.
Nucl. Chem. 2003. V. 258. P. 329.
79, P. 35.
28.
Lenhart J.J., Cabaniss S.E., MacCarthy P., Honey-
55.
Lai C.-H., Chen C.-Y., Wei B.-L., Yeh S.-H. // Water Res.
man B.D. // Radiochim. Acta. 2000. V. 88, P. 345.
2002. V. 36, P. 4943.
29.
Rao L., Choppin G.R., Clark S.B. // Radiochim. Acta.
56.
Koopal L.K., van Riemsdijk W.H., Kinniburgh D.G. //
1994. V. 66/67, P. 141.
Pure Appl. Chem. 2001. V. 73, P. 2005.
30.
Sakuragi T., Sawa S., Sato S. et al. // J. Radioanal. Nucl.
57.
Seki S., Suzuki A. // J. Colloid Interface Sci. 1995.
Chem. 2004. V. 261, P. 309-314.
31.
Sakuragi T., Sawa S., Sato S. et al. // J. Radioanal. Nucl.
V. 171, P. 49.
58.
Abollino O., Aceto M., Malandrino M. et al. // Water
Chem. 2005. V. 265, P. 349.
Res. 2003. V. 37, P. 1619.
32.
Nagao S., Fujitake N., Kodama H. et al. // J. Radioanal.
Nucl. Chem. 2003. V. 255, P. 459.
59.
Pesavento M., Profuma A., Alberti G., Conti F. // Anal.
33.
Choppin G.R. // Marine Chem. 2006. V. 99, P. 83.
Chim. Acta. 2003. V. 480. P. 171.
34.
Nash K., Fried S., Friedman A.M., Sullivan J.C. //
60.
Liu A., Gonzalez R.D. // Langmuir. 2000. V. 16, P. 2005.
Environ. Sci. Technol. 1981. V. 15, P. 834.
61.
Guthrie J.W., Mandal R., Salaams M.S. et al. // Anal.
35.
El-Naggar H.A., Ezz El-Din M.R., Sheha R.R. // J.
Chim. Acta. 2003. V. 480. P. 157.
Radioanal. Nucl. Chem. 2000. V. 246, P. 493.
62.
Baker H., Khalili F. // Anal. Chim. Acta. 2003. V. 497,
36.
Fakour H., Lin T.-F. // J. Hazard. Mater. 2014. V. 279,
P. 235.
P. 569.
63.
Naceur W.M., Ait Messaoudene N., Aggoun A. //
37.
Fang K., Yuan D., Zhang L. et al. // J. Environ. Sci.
Desalination. 2003. V. 158, P. 271.
2015. V. 27, P. 188.
64.
Wang X., Liu X. // Appl. Radiat. Isot. 2005. V. 62, P. 1.
РАДИОХИМИЯ том 62 № 2 2020
112
ВОЛКОВ, ПОЛЯКОВ
65.
McCarthy J.F., Sanford W.E., Stafford P.L. // Environ.
93.
Chemical Separation Technologies and Related
Sci. Technol. 1998. V. 32, P. 3901.
Methods of Nuclear Waste Management / Eds
66.
Tanaka T., Sakamoto Y., Sawada H., Ogawa H. JAERI-
G.R. Choppin, M.K. Khankhasayev. Dordrecht:
Conference 010. 2003. P. 134.
Kluwer, 1999. P. 247-252.
67.
Kemdorff H., Schnitzer M. // Geochim. Cosmochim.
94.
Fairhurst J., Warwick P., Richardson S. // Colloids
Acta. 1980. V. 44, P. 1701.
Surf. A: Physicochem. Eng. Aspects. 1995. V. 99,
68.
Saeki K. // Soil Sci. 2004. V. 169, P. 832.
P. 187.
69.
Sutton R., Sposito G. // Environ. Sci. Technol. 2005.
95.
Hassellov M., von der Kammer F. // Elements. 2008.
V. 39, P. 9009.
V. 4, P. 401.
70.
Gezici O., Kara H., Ersoz M., Abali Y. // J. Colloid
96.
Liu J.-F., Zhao Z.-S., Jiang G.-B. // Environ. Sci.
Interface Sci. 2005. V. 292, P. 381.
Technol. 2008. V. 42, P. 6949.
71.
Baker H., Khalili F. // Anal. Chim. Acta. 2004. V. 516,
97.
Takahashi Y., Minai Y., Ambe S. et al. // Geochim.
P. 179.
Cosmochim. Acta. 1999. V. 63, P. 815.
72.
El-Eswed B., Khalili F. // J. Colloid Interface Sci. 2006.
98.
Masset S., Monteil-Rivera F., Dupont L. et al. //
V. 299, P. 497.
Agronomie. 2000. V. 20. P. 525.
73.
Langmuir I. // J. Am. Chem. Soc. 1916. V. 35, P. 2221.
99.
Orsetti S., de las Mercedes Q.M., Andrade E.M. //
74.
Langmuir I. // J. Am. Chem. Soc. 1918. V. 40. P. 1361.
Chemosphere. 2006. V. 65, P. 2313.
75.
Peterson O., Redlich D.L. // J. Phys. Chem. 1959.
100.
Xiong J, Koopal L.K., Weng L. et al. // J. Colloid
V. 57, P. 1024.
Interface Sci. 2015. V. 457, P. 121.
76.
Beveridge A., Pickering W.F. // Water, Air Soil Pollut.
101.
Liu J., Lippold H., Wang J. et al. // Chemosphere.
1980. V. 14, P. 171.
2011. V. 82, P. 866.
77.
Randle K., Hartmann E.H. // Geoderma. 1987 г. V. 40.
102.
Liang P., Li Yi-Ch., Zhang Ch. et al. // J. Hazard.
P. 281.
Mater. 2013. V. 244/245, P. 322-.
78.
Čežíková J., Kozler J., Madronová L. et al. // React.
103.
Khasanova A.B., Kalmykov St.N., Perminova I.V.,
Funct. Polym. 2001. V. 47, P. 111.
Clark S.B. // J. Alloys Compd. 2007. P. 444, 491.
79.
Madronová L., Kozler J., Čežíková J. et al. // React.
104.
Lenhart J.J., Honeyman B.D. // Geochim. Cosmochim.
Funct. Polym. 2001. V. 47, P. 119.
Acta. 1999. V. 63, P. 2891.
80.
Martyniuk H., Więckowska J. // Fuel Process. Technol.
105.
Je-Hun J., Dempsey B.A., Burgos W.D. // Water Res.
2003. V. 84, P. 23.
2008. V. 42, P. 2269.
81.
Rashid M. A. // Chem. Geol. 1974. V. 13, P. 115.
106.
Zhao D., Wang X., Yang S. et al. // J. Environ.
82.
Borovec Z., Kribek B., Tolar V. // Chem. Geol. 1979.
Radioact. 2012. V. 103, P. 20.
V. 27, P. 39.
107.
Reiller P., Casanova F., Moulin V. // Environ. Sci.
83.
Thanabalasingam P., Pickering W.F. // Environ. Pollut.
Technol. 2005. V. 39, P. 1641.
B: Chem. Phys. 1986. V. 12, P. 233.
108.
Zero-Valent Iron Reactive Materials for Hazardous
84.
Thanabalasingam P., Pickering W.F. // Environ. Pollut.
Waste and Inorganics Removal / Eds. I.M.C. Lo, R.Y.
B: Chem. Phys. 1985. V. 9, P. 267.
Surampalli, K.C.K. Lai. Reston, Virginia, USA: Am.
85.
Ghabbour E.A., Shaker M., El-Toukhy A. et al. //
Soc. Civil Eng., 2007. 343 p.
Chemosphere. 2006. V. 64, P. 826.
109.
Obiri-Nyarko F., Grajales-Mesa S.J., Malina G. //
86.
Celebi O., Kilikli A., Erten H.N. // J. Hazard. Mater.
Chemosphere. 2014. V. 111, P. 243.
2009. V. 168, P. 695.
110.
Yirsaw B.D., Megharaj M., Chen Z., Naidu R. // J.
87.
Kamei-Ishikawa N., Nakamaru Y., Tagami K., Uchi-
Environ. Sci. 2016. V. 44, P. 88.
da Sh. // J. Environ. Radioact. 2008. V. 99, P. 993.
111.
Dries J., Bastiaens L., Springael D. et al. // Water Res.
88.
Gezici O., Kara H., Yanık S. et al. // Colloids Surf. A:
2005. V. 39, P. 3531.
Physicochem. Eng. Aspects. 2007. V. 298, P. 129.
112.
Rao P., Mak M.S.H., Liu T. et al. // Chemosphere.
89.
Nakayama M., Fujiyoshi R., Sawamura S. // J.
2009. V. 75, P. 156.
Radioanal. Nucl. Chem. 2001. V. 250. P. 433.
113.
Mak M.S.H., Rao P., Lo I.M.C. // Environ. Pollut.
90.
Kersting A.B., Furd D.W., Finnegan D.L. et al. // Nature.
2011. V. 159, P. 377.
1999. V. 397, P. 56.
114.
Liu T., Rao P., Lo I.M.C. // Sci. Total Environ. 2009.
91.
Silva R.J., Nitsche H. // Radiochim. Acta. 1995. V.
V. 407, P. 3407.
70/71, P. 377.
115.
Wang Q., Cissoko N., Zhou M., Xu X. // Phys. Chem.
92.
Dzombak D.A., Morel F.M.M. Surface Complexation
Earth. 2011. V. 36, P. 442.
Modeling: Hydrous Ferric Oxide. Wiley-Interscience,
116.
Geological Repository Systems for Safe Disposal
1990. 416 p.
of Spent Nuclear Fuels and Radioactive Waste:
РАДИОХИМИЯ том 62 № 2 2020
ВЗАИМОДЕЙСТВИЕ ГУМИНОВЫХ КИСЛОТ
113
Woodhead Publ. Ser. in Energy / Eds J. Apted, M.J.
139.
Baek K., Yang J.-W. // Korean J. Chem. Eng. 2004.
Ahn. Oxford: Woodhead, 2010. 792 p.
V. 21, P. 989.
117.
Bhadoria R., Singh B.K., Tomar R. // Desalination.
140.
Hizal J., Apak R. // J. Colloid Interface Sci. 2006.
2010. V. 254, P. 192.
V. 295, P. 1.
118.
Niitsu Y., Sato S., Ohashi H. et al. // J. Nucl. Mater.
141.
Li Y., Yue Q.-Y., Gao B.-Y. // Appl. Clay Sci. 2010.
1997. V. 248, P. 328.
V. 48, P. 481.
119.
Beneš P., Kratzer K., Vlčkova Š., Šebestova E. //
142.
Schmeide K., Bernhard G. // Appl. Geochem. 2010.
Radiochim. Acta. 1998. V. 82, P. 367.
V. 25, P. 1238.
120.
Křepelova A., Sachs S., Bernhard G. // Radiochim.
143.
Panak P.J., Breban D.C., Priemyshev A. et al. //
Acta. 2006. V. 94, P. 825.
Colloids Surf., A: Physicochem. Eng. Aspects. 2007.
V. 296, P. 206.
121.
Xu D., Wang X.K., Chen C.L. et al. // Radiochim. Acta.
144.
Fan Q., Shao D., Lu Y. et al. // Chem. Eng. J. 2009.
2006. V. 94, P. 429.
V. 150. P. 188.
122.
Echevarria G., Sheppard M.I., Morel J.L. // J. Environ.
145.
Singh B.K., Bhadauria J., Tomar R., Tomar B.S. //
Radioact. 2001. V. 53, P. 257.
Desalination. 2011. V. 268, P. 189.
123.
Crancon P., van der Lee J. // Radiochim. Acta. 2003.
146.
Singh B.K., Tomar R., Kumar S. et al. // J. Hazard.
V. 91, P. 673.
Mater. 2010. V. 178, P. 771.
124.
Vandenhove H., Van Hees M., Wouters K., Wannijn J. //
147.
Xu D., Chen C., Tan X. et al. // Appl. Geochem. 2007.
Environ. Pollut. 2007. V. 145, P. 587.
V. 22, P. 2892.
125.
Xiangke W., Wenming D., Yingchun G. et al. // J.
148.
Chen C.L., Wang X.K. // Appl. Geochem. 2007. V. 22,
Radioanal. Nucl. Chem. 2001. V. 250. P. 267.
P. 436.
126.
Xiangke W., Wenming D., Yingchun G. et al. // J.
149.
Tan X., Wang X., Chen C., Sun A. // Appl. Radiat. Isot.
Radioanal. Nucl. Chem. 2000. V. 245, P. 431.
2007. V. 65, P. 375.
127.
Wang X., Chen Y., Wu Y. // Appl. Radiat. Isot. 2004.
150.
Tan X.L., Chang P.P., Fan Q.H. et al. // Colloids Surf.
V. 60. P. 963.
A: Physicochem. Eng. Aspects. 2008. V. 328, P. 8.
128.
Yang S., Li J., Lu Y. et al. // Appl. Radiat. Isot. 2009.
151.
Chen Ch., Yang X., Wei J. et al. // J. Colloid Interface
V. 67, P. 1600.
Sci. 2013. V. 393, P. 249.
129.
Wang S., Hu J., Li J., Dong Y. // J. Hazard. Mater.
152.
Zhao Y., Shao Zh., Chen Ch. et al. // Appl. Clay Sci.
2009. V. 167, P. 44.
2014. V. 87, P. 1.
130.
Liu A., Gonzalez R.D. // J. Colloid Interface Sci. 1999.
153.
Wang X., Rabung T., Geckeis H. // J. Radioanal. Nucl.
V. 218, P. 225.
Chem. 2003. V. 258, P. 83.
131.
Wu P., Zhang Q., Dai Y. et al. // Geoderma. 2011. V.
154.
Kumar S., Tomar B.S., Ramanathan S., Manchan-
164, P. 215.
da V.K. // Radiochim. Acta. 2006. V. 94, P. 369.
132.
Boggs M.A., Dai Z., Kersting A.B., Zavarin M. // J.
155.
Chen C., Wang X. // Appl. Radiat. Isot. 2007. V. 65,
Environ. Radioact. 2015. V. 141, P. 90.
P. 155.
133.
Yu Sh., Mei H., Chen X. et al. // J. Mol. Liq. 2015.
156.
Kar A.S., Kumar S., Tomar B.S., Manchanda V.K. // J.
V. 203, P. 39.
Hazard. Mater. 2011. V. 186, P. 1961.
134.
Pan D., Fan Q., Li P. et al. // Chem. Eng. J. 2011.
157.
Jal P.K., Patel S., Mishra B.K. // Talanta. 2004. V. 62,
Т. 172, P. 898.
P. 1005.
135.
Yu T., Wu W.S., Fan Q.H. // Chin. Chem. Lett. 2012.
158.
Cides da Silva L.C., dos Santos L.B.O., Abate G. et al. //
V. 23, P. 1189.
Micropor. Mesopor. Mater. 2008. V. 110. P. 250.
136.
Xiao J., Chen Y., Zhao W., Xu J. // J. Mol. Liq. 2013.
159.
Perminova I.V., Karpiouk L.A., Shcherbina N.S. et al. //
V. 188, P. 178.
J. Alloys Compd. 2007. V. 444-445, P. 512.
137.
Li P., Liu Z., Ma F. et al. // J. Mol. Liq. 2015. V. 206,
160.
Поляков Е.В., Егоров Ю.В. // Успехи химии. 2003.
P. 285.
Т.72, №11, C. 1103-1114.
138.
Sachs S., Bernard G. // Chemosphere. 2008. V. 72,
161.
Kotrly S., Sucha L. Handbook of Chemical Equilibria
P. 1441.
in Analytical Chemistry. New York: Wiley, 1985. 414 p.
РАДИОХИМИЯ том 62 № 2 2020