РАДИОХИМИЯ, 2020, том 62, № 2, с. 161-164
УДК 547.857:547.853.3
СИНТЕЗ МЕЧЕННЫХ ТРИТИЕМ НЕПРИРОДНЫХ
АНАЛОГОВ ПУРИНОВЫХ И ПИРИМИДИНОВЫХ
НУКЛЕОЗИДОВ
© 2020 г. Г. В. Сидоров*, Н. Ф. Мясоедов
Институт молекулярной генетики РАН, 123182, Москва, пл. акад. Курчатова, д. 2
*e-mail: sidgv@img.ras.ru
Получена 24.12.2018; после доработки 13.03.2019; принята к публикации 14.03.2019
Разработаны удобные препаративные пути синтеза меченных тритием неприродных производных, со-
держащих цитозиновый и гуаниновый фрагменты. Главное отличие этих соединений от уже известных
заключается в том, что они содержат хиральный центр. Для синтеза меченного тритием 2'-дезокси-3'-
оксацитидина использовали реакцию каталитического дегалогенирования в растворе соответствующе-
го 5-бромзамещенного соединения, для 6-аминоциклопропил-2'-дезокси-3'-оксагуанозина - реакцию
каталитического гетерогенного изотопного обмена в растворе, для остальных соединений применяли
реакцию твердофазной каталитической гидрогенизации (ТКГ).
Ключевые слова: тритий, изотопный обмен, пурины, пиримидины
DOI: 10.31857/S0033831120020094
ВВЕДЕНИЕ
требует применения разнообразных подходов к
синтезу подобных соединений, меченных трити-
Неприродные аналоги пуринов и пиримидинов
ем. С нашей точки зрения универсальным под-
представляют интерес исследователей в качестве
ходом к решению задачи введения трития в эти
терминаторов синтеза ДНК. Для изучения меха-
и подобные соединения является реакция твер-
низма действия этих соединений на молекуляр-
дофазной каталитической гидрогенизации три-
ном уровне необходимы их аналоги, меченные
тием. С помощью этого метода были получены
радиоактивным изотопом, в частности меченные
меченные тритием азидотимидин (30 Ки/ммоль),
тритием. Для введения трития в подобные сое-
азидотимидинфосфонат (6.3 Ки/ммоль), ацикло-
динения применяют различные реакции изотоп-
вир
(124
Ки/ммоль), ацикловирфосфонат
ного обмена и химического синтеза. Препаратом,
(56.5 Ки/ммоль) [5] и 5'-О-фосфонилметилтимидин
широко применяемым до настоящего времени
(71 Ки/ммоль) [6].
для лечения больных СПИДом и инфицирован-
ных, является азидотимидин. Описан химический
Задачей настоящей работы являлось разработка
синтез меченного тритием азидотимидина исходя
удобных препаративных путей синтеза меченных
из [метил-3Н]тимидина [1] и восстановление ме-
тритием неприродных производных, содержащих
ченным тритием боргидридом натрия соответ-
цитозиновый (схема 1) и гуаниновый (схема 2)
ствующего 5'-альдегидного производного [2]. В
фрагменты. Главное отличие соединений, струк-
работе [3] изучали новые пути синтеза меченно-
тура которых приведена на схемах 1 и 2, от уже
го тритием 3'-азидо-3'-дезокситимидина с высо-
известных заключается в том, что они содержат
кой молярной радиоактивностью и локализацией
хиральный центр у N1 (схема 1) и N9 (схема 2).
тритиевой метки в азотистом гетероциклическом
Для синтеза меченных тритием соединений I-IV
основании. Для соединений другой структуры
и VI (схемы 1 и 2) применяли реакцию твердофаз-
описано применение каталитических реакций
ной каталитической гидрогенизации (ТКГ). Ранее
восстановления и изотопного обмена в растворе
нами было показано, что побочными процессами
[4, 5] с участием газообразного трития. Количество
в условиях реакции ТКГ помимо термической де-
соединений, представляющих интерес в качестве
струкции исходных соединений являются гидри-
терминаторов синтеза ДНК, так же как и их стро-
рование 5,6-двойной связи пиримидинов [7] и изо-
ение, весьма разнообразно. Это, в свою очередь,
меризация при 100°С 3',5'-ApApA с образованием
161
162
СИДОРОВ, МЯСОЕДОВ
Схема 1.
NH2
NH2
NH2
F
N
N
N
N O
N O
N O
S
S
S
HO
HO
HO
O
O
O
I
II
III
NH2
NH2
F
N
N
N O
N O
S
O
HO
HO
O
O
IV
V
Схема 2.
O
NH
N
N
HN
HN
H2N
N N
H2N
N N
O
O
OH
OH
O
O
VI
VII
2',5'-ApApA [8]. Изомеризацию пентоз в реакции
нием. Во всех случаях проводили очистку от ла-
ТКГ наблюдали в работе [9]. При проведении ре-
бильного трития двукратной отгонкой растворите-
акций изотопного обмена с тритием (особенно в
ля в вакууме при 37°С, сухой остаток растворяли
твердой фазе, протекающих в довольно жестких
в подвижной фазе и проводили очистку целевого
условиях) возможна рацемизация хирального цен-
соединения.
тра исследуемых соединений. В литературе отсут-
Все соединения были производства фирмы
ствуют данные о рацемизации подобных соедине-
Biochem Pharma. Применяли катализаторы 5% Pd/
ний при проведении различных реакций изотопно-
BaSO4 (Aldrich) и 5% PdO/Al2O3 (РНЦ ГИПХ).
го обмена с тритием.
Использовали жидкостную колоночную хромато-
Для синтеза меченного тритием соединения V
графию на Sephadex G-10. (20×900 мм), элюция
применяли реакцию каталитического дегалоге-
водой 100 мл/ч, и высокоэффективную жидкост-
нирования соответствующего 5-иодзамещенного
ную хроматографию (ВЭЖХ) на колонке YMC
соединения, а в случае VII - реакцию каталити-
ODS-A 5 мкм 20×500 мм. Насосы высокого давле-
ческого гетерогенного изотопного обмена с газо-
ния Gilson 806, УФ детектор с переменной длиной
образным тритием в растворе.
волны Specra-Physics 8480. Колонку уравновеши-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
вали 250 мл подвижной фазы [20% ацетонитрила
в 0.01%-ной трифторуксусной кислоте (ТФУ)].
После проведения реакции ТКГ продукты смы-
Скорость элюции 2.0 мл/мин, давление 53 атм.
вали с катализатора водой, отделяли катализатор
центрифугированием. После проведения реакции
Хиральную чистоту препаратов определяли на
в растворе отделяли катализатор центрифугирова-
колонке Cyclobond I RSP 4.6×250 мм. Для соедине-
РАДИОХИМИЯ том 62 № 2 2020
СИНТЕЗ МЕЧЕННЫХ ТРИТИЕМ НЕПРИРОДНЫХ АНАЛОГОВ
163
2609 mv
100
50
0
0
100
200
300
400
500
600
700
V, мл
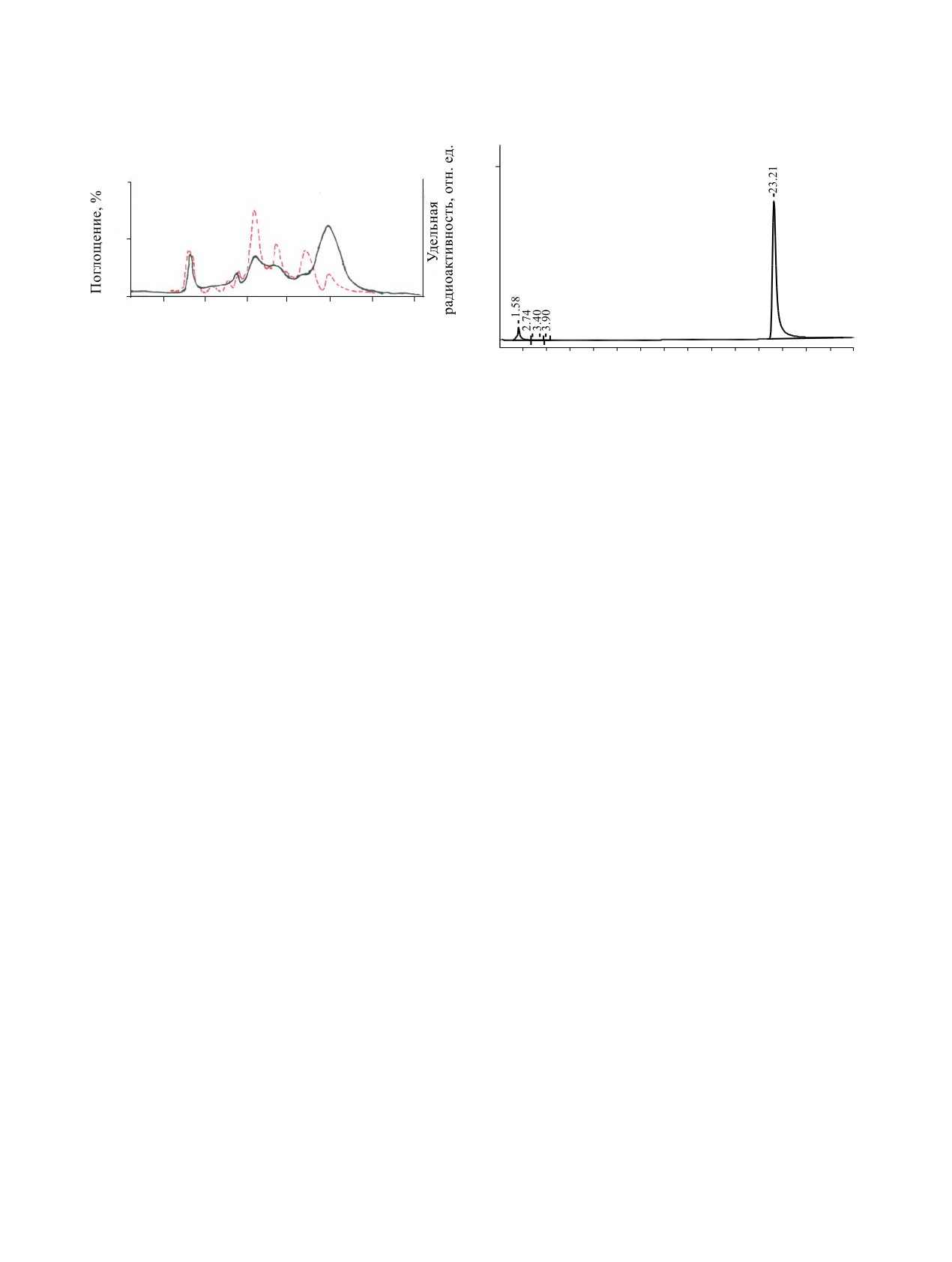
Рис. 1. Очистка меченного тритием соединения I на
2
6
10
14
18
22
26
30
Sephadex G-10.
Время удерживания, мин
ний I-IV подвижная фаза - 0.05%-ный триэтилам-
Рис. 2. Хиральная чистота [G-3H] I на Cyclobond I RPS
монийацетат (ТЭАА), pH 6.86, 0.25 мл/мин; для
4.6×250 мм, температура 20°C; 0.05% ТЭАА, pH 6.86,
V - 1%-ный раствор ацетонитрила в 0.25%-ном
0.25 мл/мин, λ 254 нм.
ТЭАА, рН 5.86, 0.15 мл/мин; для VII - 0.02 моль/л
хроматографии на YMC ODS-А было выделено
NaH2PO4 + 5 моль/л тетра-н-бутиламмонийброми-
28.1 мКи соединения с молярной радиоактивно-
да (ТБАБ), pH 6,77, 0.15 мл/мин; для VI - элюент
стью 2.3 Ки/ммоль.
A: 0.01 моль/л CH3COONH4, pH 6.0, элюент B -
ацетонитрил, градиент 10% → 20% B/A за 20 мин,
Синтез меченного тритием соединения III.
В реакцию ТКГ брали 3.1 мг (12.5 мкмоль) сое-
1.0 мл/мин.
динения, нанесенного на 35.5 мг катализатора 5%
Оптическую плотность УФ поглощения изме-
Pd/BaSO4. Реакцию изотопного обмена с газо-
ряли на спектрофотометре ПЭ-5400 УФ (Экрос,
образным тритием проводили при 160°C 20 мин.
Санкт-Петербург). Радиоактивность измеряли на
После очистки на Sephadex G-10 получили 52 мКи
жидкостном сцинтилляционном счетчике Triathler
(4.2 мкмоль) сырого продукта. После очистки на
(Финляндия), используя сцинтилляционную жид-
колонке YMC ODS-А получили 12.2 мКи соедине-
кость EcoLM TM (ICN).
ния (2.26 мкмоль, 5.4 Ки/ммоль).
Радиохимическую чистоту определяли мето-
Синтез меченного тритием соединения IV.
дом тонкослойной радиохроматографии на ПЭИ-
В реакцию ТКГ брали 3.1 мг (12.5 мкмоль) сое-
целлюлозе в воде и на пластинках Silufol в систе-
динения, нанесенного на 40 мг катализатора 5%
ме растворителей бутанол-уксусная кислота-вода
Pd/BaSO4. Реакцию изотопного обмена с газо-
(2 : 1 : 1).
образным тритием проводили при 150°C 15 мин.
Синтез меченного тритием соединения I. В
После очистки на Sephadex G-10 получили 33 мКи
реакцию ТКГ брали 35 мг катализатора 5% Pd/
(6.8 мкмоль) сырого продукта. После очистки на
BaSO4, на который наносили 10 мкмолей соеди-
колонке YMC ODS-А получили 11.8 мКи соедине-
нения I. Реакцию с газообразным тритием вели
ния (5.6 мкмоль, 2.1 Ки/ммоль).
при 160°C 15 мин. После хроматографии на ко-
Синтез меченного тритием соединения V. В
лонке Sephadex G-10 было получено 47.5 мКи
реакционную ампулу из стекла объёмом 5.0 мл по-
(4.6 мкмоль) сырого продукта. После хроматогра-
мещали раствор 5-бромзамещенного соединения
фии на YMC ODS-А выделили 11.7 мКи соедине-
V в 1.0 мл метанольного раствора 0.1 моль/л NaOH
ния с молярной радиоактивностью 2.3 Ки/ммоль.
и 25 мг катализатора 5% PdO/Al2O3. Реакцию
Выход составил 50.9% по веществу и 6.72% по ра-
вели в атмосфере газообразного трития (4.1 Ки)
диоактивности.
16 ч. Меченное тритием соединение V выделяли
на колонке с Sephadex G-10. Получили 26.3 мКи
Синтез меченного тритием соединения II.
(1.14 мкмоль, 23 Ки/ммоль) меченого соединения.
В реакцию ТКГ брали 11.7 мг (50 мкмоль) сое-
динения, нанесенного на 150 мг катализатора 5%
Синтез меченного тритием соединения VI.
Pd/BaSO4. Реакцию изотопного обмена с газо-
В реакцию ТКГ брали 1.28 мг (5.0 мкмоль) сое-
образным тритием проводили при 150°C 15 мин.
динения, нанесенного на 25 мг катализатора 5%
После хроматографии на Sephadex G-10 получили
Pd/BaSO4. Реакцию с газообразным тритием
125 мКи (27.6 мкмоль) сырого продукта. После
проводили при 200°C 20 мин. После очистки на
РАДИОХИМИЯ том 62 № 2 2020
164
СИДОРОВ, МЯСОЕДОВ
Таблица 1. Влияние температуры на реакцию твердо-
зирующихся» соединений, таких как пуриновые и
фазного каталитического гетерогенного изотопного об-
пиримидиновые основания, протекает на Sephadex
мена соединений I и III с тритий-протиевой (1 : 1000)
G-10 по адсорбционному механизму при линейной
(Aldrich)
смесью. Катализатор 5% Pd/BaSO4
изотерме сорбции.
Амол, Ки/моль
Выход, %
Как следует из данных, представленных на
T, °C
I
III
I
III
рис. 1, хроматография на Sephadex G-10 позволяет
140
14
15
95
95
сбросить до 80-90% примесей по радиоактивно-
150
22
23
95
95
сти. Это существенно облегчило очистку методом
160
21
65
63
61
ВЭЖХ на второй стадии.
Таблица 2. Результаты анализа оптической чистоты ме-
На рис. 2 приведены результаты анализа оп-
ченных тритием препаратов
тической чистоты меченного тритием соедине-
ния I (детекция при 254 нм). Время удерживания
Оптическая (хиральная) чистота, %
Соединение
23.21 мин соответствует целевому соединению.
I
II
III
IV
VI
VII
Время удерживания оптического изомера соедине-
Исходное
95.3
92.8
98.0
98.0
99.0
98.0
ния I - 24.4 мин. В табл. 2 суммированы результа-
Меченное
95.2
92.8
97.8
97.7
99.8
97.5
тритием
ты анализа оптической чистоты всех полученных
препаратов. Из полученных данных видно, что в
ходе реакции ТКГ не происходит изменения кон-
Sephadex G-10 получили 82.5 мКи (4.12 мкмоль,
фигурации асимметрического центра. Все соеди-
20.0 Ки/ммоль) продукта. Дальнейшую очистку не
нения имели высокую (более 97%) радиохимиче-
проводили, так как хиральная и ахиральная ради-
скую ахиральную чистоту, определенную методом
охимическая чистота препарата были более 99%.
тонкослойной радиохроматографии.
Синтез меченного тритием соединения VII. В
реакционную ампулу из стекла объёмом 5.0 мл по-
КОНФЛИКТ ИНТЕРЕСОВ
мещали раствор соединения VII (3.0 мг, 10 мкмоль)
Авторы заявляют об отсутствии конфликта
в 0.3 мл 1 моль/л NH4OH и 50 мг катализатора
интересов.
5% Pd/BaSO4. Реакцию изотопного обмена с га-
зообразным тритием проводили при комнатной
СПИСОК ЛИТЕРАТУРЫ
температуре 16 ч. После очистки на колонке YMC
1. Aggarwal S.K., Shalinsky D.R., Agrawal K.C. // J. Label.
ODS-А получили 53 мКи соединения (6.65 мкмоль,
Compd. Radiopharm. 1988. Vol. 25, N 10. P. 1055.
8.0 Ки/ммоль).
2. Hill J.A., Freeman G.A. // J. Label. Compd. Radiopharm.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
1988. Vol. 25, N 3. P. 277.
В табл. 1 приведены данные по влиянию тем-
3. Sidorov G.V., Zverkov Yu.B., Myasoedov N.F. // J. Label.
пературы на выход и молярную радиоактивность
Compd. Radiopharm. 2003. Vol. 46, N 7. P. 669.
(Амол) соединений I и III в реакции ТКГ тритием.
4. Taylor G.F., Kepler J.A. // J. Label. Compd. Radiopharm.
Полученные данные говорят о том, что реакцию
1989. Vol. 27, N 6. P. 683.
ТКГ предпочтительнее проводить при 150-160°С.
5. Sidorov G.V., Myasoedov N.F., Yasko M.V. // J. Label.
Наличие сильного электроноакцепторного атома
Compd. Radiopharm. 1994. Vol. 34, N 4. P. 339.
фтора в молекуле III заметно изменяет распреде-
6. Ясько М.В., Сидоров Г.В., Кондратов Р.В., Прасолов
ление электронной плотности, что, в свою оче-
В.С., Мясоедов Н.Ф., Краевский А.А. // Биоорган.
редь, влияет на подвижность протонов в реакции
химия. 1998. Т. 24, № 1. С. 21.
ТКГ. Этот эффект особенно заметен при увеличе-
7. Сидоров Г.В., Мясоедов Н.Ф. // Биоорган. химия.
нии температуры со 150 до 160°С. Анализ реак-
1996. Т. 22, № 4. С. 291.
ционной смеси методом ВЭЖХ показал, что про-
8. Сидоров Г.В., Мясоедов Н.Ф. // Радиохимия. 1995. Т.
дукты реакции содержат большой набор соедине-
37, № 3. С. 270.
ний, близких по хроматографическим свойствам,
9. Баитов А.А., Сидоров Г.В., Мясоедов Н.Ф. // Радио-
что затрудняло получение достаточно чистого
химия. 2007. Т. 49, N 1. С. 91.
продукта при проведении очистки в одну стадию.
10. Яковлева Л.А., Каминский Ю.Л., Соснова Л П., На-
Поэтому на первой стадии очистки применяли
хроматографию на Sephadex G-10. В работе [10]
горский А.И. // Органические соединения, меченные
было установлено, что хроматография «неиони-
радиоактивными изотопами. М., 1982. Ч. 2. С. 255.
РАДИОХИМИЯ том 62 № 2 2020