РАДИОХИМИЯ, 2021, том 63, № 2, с. 185-192
УДК 544.722.22+546.11.027*3
МЕТОД ТРИТИЕВОГО ЗОНДА В ИССЛЕДОВАНИИ
АДСОРБЦИОННЫХ СЛОЕВ ЛИЗОЦИМА
НА ПОВЕРХНОСТИ ДЕТОНАЦИОННЫХ
НАНОАЛМАЗОВ
© 2021 г. М. Г. Чернышеваа,*, Г. А. Бадуна, А. В. Синолица, А. В. Егорова, Т. Б. Егороваа,
А. Г. Попова, А. Л. Ксенофонтовb
а Химический факультет Московского государственного университета им. М.В. Ломоносова,
119991, Москва, Ленинские горы, д. 1, стр. 3
б Институт физико-химической биологии им. А.Н. Белозерского Московского государственного университета
им. М.В. Ломоносова, 119234, Москва, Ленинские горы, д. 1, стр. 40
*e-mail: chernysheva@radio.chem.msu.ru
Получена 10.10.2019, после доработки 06.11.2019, принята к публикации 13.11.2019
С помощью меченного тритием лизоцима определена его адсорбция на поверхности наноалмазов
детонационного синтеза. Обнаружено, что количество адсорбированного белка зависит от заряда
поверхности наноалмазов. На исходных положительно заряженных наноалмазах образуется монослойное
покрытие, а на отрицательно заряженных наноалмазах, полученных из исходных в результате отжига
на воздухе, адсорбция возрастала в 4-5 раз. По данным ИК спектрометрии, в результате адсорбции
лизоцима уменьшается количество петель и поворотов в структуре белка при адсорбции на двух типах
наноалмазов. С помощью тритиевого зонда не обнаружено существенной разницы в структуре молекулы
белка при адсорбции на наноалмазах с разным функциональным составом поверхности, и ориентация
молекул в поверхностном слое оказалась одинаковой: участки белка, содержащие аминокислотные
остатки фенилаланина, контактируют с сорбентом, а аминокислотные остатки пролина, входящие в
состав петель, находятся на поверхности адсорбционного слоя.
Ключевые слова: тритиевый зонд, лизоцим, наноалмазы, адсорбция.
DOI: 10.31857/S0033831121020118
ВВЕДЕНИЕ
В качестве твердой подложки использовали
наноалмазы детонационного синтеза (ДНА). От-
Обработка атомарным тритием органических
метим, что в настоящее время ДНА активно ис-
мишеней сложного состава с последующим ана-
пользуются в научных исследованиях, поскольку
лизом распределения трития по компонентам ми-
их уникальные свойства, такие как наличие ал-
шени является информативным методом для опре-
мазного ядра размером 4-6 нм и высокая удельная
деления структуры белковой оболочки вирусов
поверхность с большим количеством различных
[1, 2], структурной организации молекул в адсор-
функциональных групп, открывают перспективы
бционных слоях на границе раздела водный рас-
использования этого материала в различных сфе-
твор-воздух [3, 4]. В данной работе такой подход
рах, включая косметологию и медицину [5-9]. По-
впервые применен для анализа структуры белка в
этому изучение взаимодействия белков с наноал-
адсорбционном слое, образовавшемся на межфаз-
мазами и строения образующихся адсорбционных
ной границе водный раствор-твердое тело.
слоев является актуальной научной задачей. Обра-
185
186
ЧЕРНЫШЕВА и др.
зование белковой «короны» на поверхности ДНА
Таким образом, несмотря на интерес к ДНА и,
определяется рядом факторов, такими как набор
в частности, к его биологическому применению,
функциональных групп на поверхности, размер
ряд вопросов, касающихся взаимодействия ДНА с
белками, до сих пор неясен. В работе использова-
частиц ДНА в суспензии, их поверхностный заряд,
ли лизоцим куриного яйца, поскольку данный бе-
заряд белковой глобулы, а также pH и ионная сила
лок мало подвержен денатурации при адсорбции
среды. В ряде работ показано, что образование ад-
[13, 14] и хорошо изучен, в том числе с помощью
сорбционных комплексов между белком и поверх-
тритиевого зонда, в составе адсорбционных слоев,
ностью ДНА в случаях одноименно заряженных
образованных на границе раздела фаз водный рас-
сорбента и сорбата, а также для случая нейтрально
твор-воздух [3, 4, 15]. Белок в водных растворах
заряженного ДНА происходит преимущественно
при нейтральных значениях pH имеет положитель-
за счет гидрофобных взаимодействий [10, 11]. На-
ный заряд. Целью настоящего исследования было
ряду с этим существуют работы, в которых сказа-
выявить влияние поверхностного заряда алмазных
но об электростатическом механизме образования
наночастиц на адсорбцию лизоцима и специфику
адсорбционного комплекса белок-наноалмаз [12,
организации получаемых адсорбционных слоев.
13].
Таблица 1. Характеристики наноалмазов
Основные полосы в
Отнесение ИК полос,
Удельная поверх-
ζ-Потенциал
Наноалмаз
ИК спектре
по данным работы
ность по БЭТ, м2/г
в воде, мВ
[19]
Широкая полоса 3400
ОН-группы воды
2800-2900
СН2- и СН3-группы
Aldrich
280
1730
С=О карбонил
37 ± 5
1630
Вода
1100
С-О-С
Широкая полоса 3400
ОН-группы воды
2800-2900
СН2- и СН3-группы
1795 слабый сигнал
С=О лактон
1723
С=О карбонил
1631
Вода
PlasmaChem
250
1452
СНх асимметриче-
21 ± 3
1319
ские
1117
С=О депротониро-
1063
ванный карбоксил
С-О-С
С-О гидроксил
Широкая полоса 3400
ОН-группы воды
2800-2900
СН2- и СН3-группы
1723
С=О карбонил
AdamasNano
270
1631
Вода
27 ± 3
1319
С=О депротониро-
1117
ванный карбоксил
С-О-С
Широкая полоса 3400
ОН-группы воды
2800-2900
СН2- и СН3-группы
Aldrich подвер-
1790
С=О лактон
гнутые отжигу
280
1630 слабый сигнал
Вода
-46 ± 4
на воздухе
1269
С-О эфир,
1112
эпоксигруппа
С-О-С
РАДИОХИМИЯ том 63 № 2 2021
МЕТОД ТРИТИЕВОГО ЗОНДА
187
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ризовали с помощью метода динамического све-
торассеяния и определяли распределение частиц
по размеру и распределение электрокинетического
В работе использовали лизоцим куриного яйца
потенциала.
(MP Biomedicals). Тритиевую метку в лизоцим для
Адсорбция лизоцима на наноалмазах. K су-
исследования его адсорбции на наноалмазах вво-
спензии ДНА, содержащей 1 мг твердой фазы, до-
дили с помощью метода термической активации
бавляли раствор меченного тритием лизоцима до
трития [16]. Для удаления трития из лабильных
конечной удельной радиоактивности 1.5 мКи/л и
положений молекулы использовали диализ через
концентрации от 0.4 до 4 г/л раствора. Суспензии
мембраны с диаметром пор 12 кДа против фосфат-
инкубировали в течение 48 ч, затем осаждали цен-
ного буферного раствора (0.018 М, pH 7.3 ± 0.1).
трифугированием и измеряли активность надосад-
[3H]Лизоцим выделяли методом эксклюзионной
чного раствора. Осадок декантировали, промывали
хроматографии с использованием ВЭЖХ систе-
водой, суспендировали в сцинтилляционной жид-
мы Waters (Breeze) на колонке Suerdex200 Increase
кости Ultima Gold (Perkin Elmer) и измеряли актив-
10/300 GL (GE Healthcare), в качестве подвиж-
ность [17, 18]. Значения равновесной концентрации
ной фазы использовали фосфатно-солевой буфер
лизоцима и его количество на ДНА рассчитывали
(рН 7.3 ± 0.1). Детектирование проводили по УФ
по уравнениям (1) и (2) соответственно:
поглощению при длине волны 280 нм, радиоактив-
ность элюата измеряли с помощью жидкостного
c
,
(1)
сцинтилляционного спектрометра RackBeta 1215.
Очищенный [3H]лизоцим обладал удельной радио-
активностью 1 Ки/г.
,
(2)
Порошки наноалмазов производства компа-
ний Aldrich, PlasmaChem (Германия), AdamasNano
где I1 и I2 - скорость счета надосадочного раствора
(США) использовали как без дополнительной об-
и осадка ДНА соответственно, V - объем аликвоты
работки, так и после отжига на воздухе при 450°С
надосадочного раствора, ε - эффективность реги-
в течение 1 ч [17]. Наноалмазы характеризовали с
страции β-излучения трития, ауд - молярная радио-
помощью просвечивающей электронной микроско-
активность лизоцима, mДНА - масса наноалмаза.
пии и ИК спектрометрии, удельную поверхность
Определение структуры лизоцима на поверх-
определяли методом низкотемпературной адсорб-
ности наноалмаза. По описанной выше методике
ции азота. Методики характеризации нанаолмазов
получали адсорбционные комплексы ДНА-лизо-
были описаны ранее [17, 18]. Основные характери-
цим, которые затем суспензировали в воде, наноси-
стики использованных наноалмазов приведены в
ли на стенки реакционного сосуда, замораживали
табл. 1.
жидким азотом и высушивали с помощью лиофи-
Порошки ДНА супензировали в воде по разра-
лизации. Сосуд с готовой мишенью присоединя-
ботанной ранее методике [18]. Суспензии характе-
ли к системе для работы с газообразным тритием,
Таблица 2. Значения параметров адсорбции в уравнении, аналогичном уравнению Ленгмюра, для необратимой ад-
сорбции лизоцима на наноалмазах
Максимальная адсорбция
Константа адсорбции в уравнении
Наноалмаз
R2
(Гmax), мг/г
Ленгмюра (A), л/г
Aldrich
452 ± 54
1.0 ± 0.4
0.934
PlasmaChem
321 ± 26
0.4 ± 0.1
0.981
AdamasNano
364 ± 32
0.4 ± 0.1
0.974
Aldrich, подвергнутые
2060 ± 109
0.8 ± 0.1
0.992
отжигу на воздухе
РАДИОХИМИЯ том 63 № 2 2021
188
ЧЕРНЫШЕВА и др.
раствора или с помощью спектрофотомерии оказа-
1600
1
лось невозможным. Поэтому в работе определяли
2
1400
3
только связывание лизоцима с ДНА, который не
4
удаляется при промывке осадка водой в течение
1200
1-2 ч. Данные представлены на рис. 1.
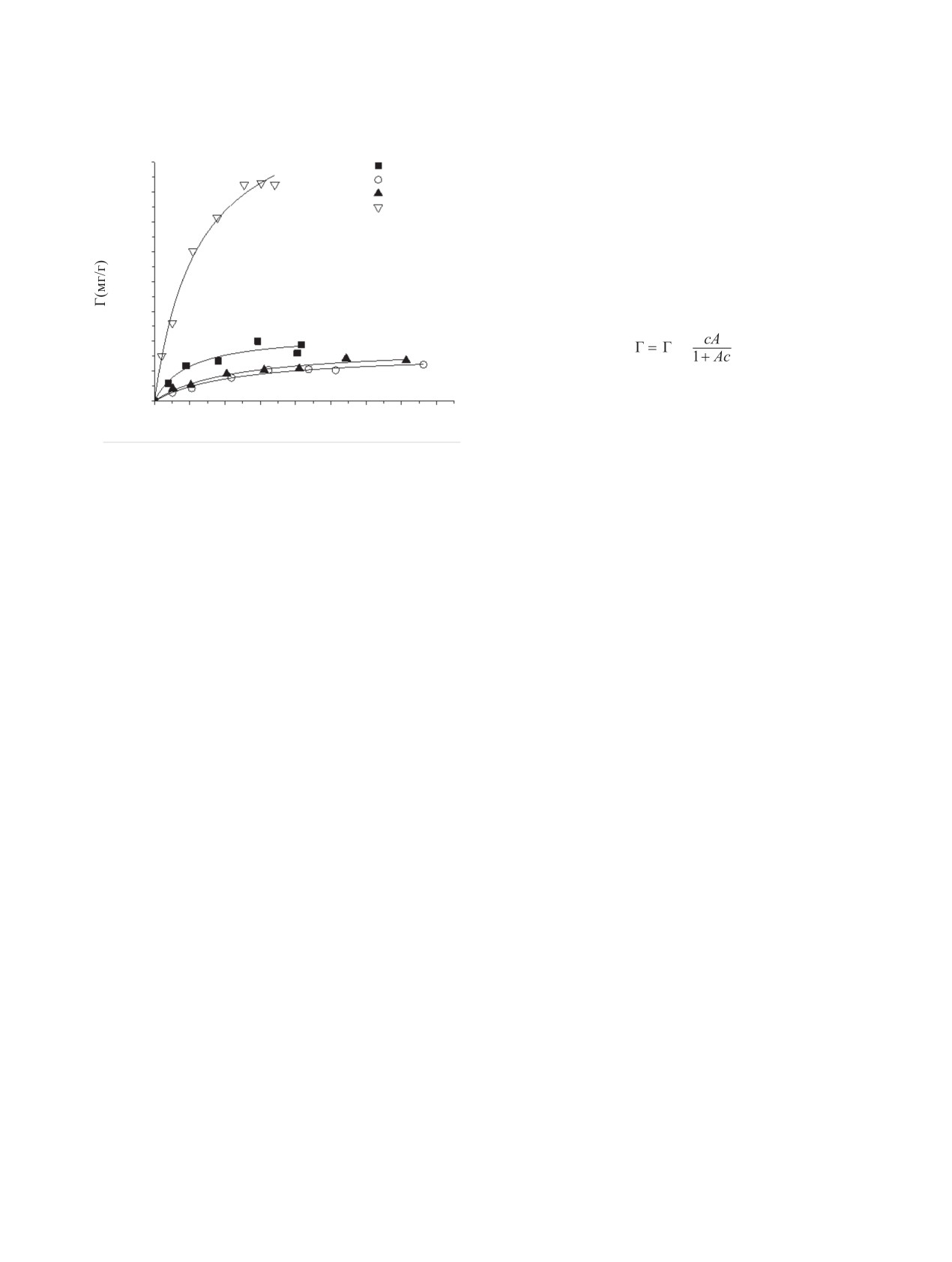
1000
Зависимости удельного содержания лизоцима в
комплексе с ДНА от его объемной концентрации
800
были описаны уравнением, аналогичным уравне-
600
нию Ленгмюра:
400
max
200
Здесь с - концентрация вещества в растворе, Г и
0
Гmax - адсорбция при концентрации с и максималь-
0
1
2
3
4
5
6
7
8
ная адсорбция соответственно, А - константа.
[лизоцим] (г/л)
Рассчитанные параметры приведены в табл. 2, а
Рис.
1. Зависимость удельного содержания лизоцима
результат аппроксимации показан сплошной лини-
в комплексе с ДНА от его равновесной концентрации в
ей на рис. 1.
водном растворе. Наноалмазы Aldrich (1), PlasmaChem
(2), AdamasNano (3) и Aldrich, подвергнутые отжигу на
Для всех исходных наноалмазов адсорбция лизо-
воздухе (4).
цима была близка, однако после отжига на воздухе
у ДНА Aldrich изменялся электрокинетический по-
вакуумировали и обрабатывали атомами трития в
тенциал в воде с положительного на отрицательный
следующих условиях: температура стенок реактора
(табл. 1), что увеличивало адсорбцию лизоцима в
25°С, температура атомизатора 1850 K, время об-
4.5 раза.
работки 10 с, давление трития 1 Па [16, 20]. После
реакции мишень суспендировали в воде, выдержи-
Для оценки величины удельного покрытия ча-
вали несколько часов и воду отгоняли на роторном
стиц наноалмаза белком надо принимать во вни-
испарителе для удаления обменного трития. Затем
мание структуру агломератов, существующих в
твердую фазу суспендировали в гидролизной сме-
водном растворе [22]. По данным метода динами-
си, состоящей из смеси соляной и трифторуксусной
ческого светорассеяния, в водном растворе сред-
кислот в объемном соотношении 2 : 1 и содержа-
ний диаметр наночастиц составляет 150 ± 30 нм,
щей 0.001% β-меркаптоэтанола. Полученную смесь
и они состоят из алмазных зерен диаметром 5 нм.
переносили в стеклянную ампулу, запаивали и на-
По данным БЭТ, средний диаметр пор исходного
гревали до 155°C в течение 1 ч. Отделяли раствор
наноалмаза Aldrich составляет 10 нм, а отожженно-
от осадка, дважды лиофилизовывали, а лиофилизат
го - 11 нм, так как отжиг приводит к деагломера-
растворяли в 0.1 н. HCl. Аминокислотный анализ
ции наноалмазов [23]. Для двух типов наноалмаза
проводили на анализаторе Amino Acid Analyzer
основная часть пор имеет диаметр более 20 нм и
Hitachi L-8800 с определением количества амино-
доступна для адсорбции лизоцима, размер глобу-
кислот [21] и их активности с помощью проточ-
лы которого 3×3×4.5 нм. Известно, что при плот-
ного счетчика Radiomatic 150TR Flow Scintillation
ной упаковке и вертикальной ориентации молекул
Analyzer (Packard Instrument Co., США).
(большая ось молекулы перпендикулярна поверх-
ности) лизоцим занимает на поверхности 9.0 нм2,
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
а при горизонтальной ориентации - 13.5 нм2 [24].
Тогда удельное покрытие поверхности при мак-
Меченный тритием лизоцим использовали для
симальной адсорбции на исходном наноалмазе
получения изотерм адсорбции белка на поверхности
450 мг/г составит 1.5 мг/м2, и на одну молекулу бу-
наноалмазов. Отметим, что адсорбция лизоцима на
дет приходиться 16 нм2. Можно предположить, что
ДНА, не подвергнутых окислению, мало изменяла
при адсорбции лизоцима на исходных ДНА обра-
концентрацию белка в растворе, и ее определение с
зуется адсорбционный слой с плотной упаковкой и
приемлемой точностью по изменению активности
ориентацией молекул параллельно поверхности.
РАДИОХИМИЯ том 63 № 2 2021
МЕТОД ТРИТИЕВОГО ЗОНДА
189
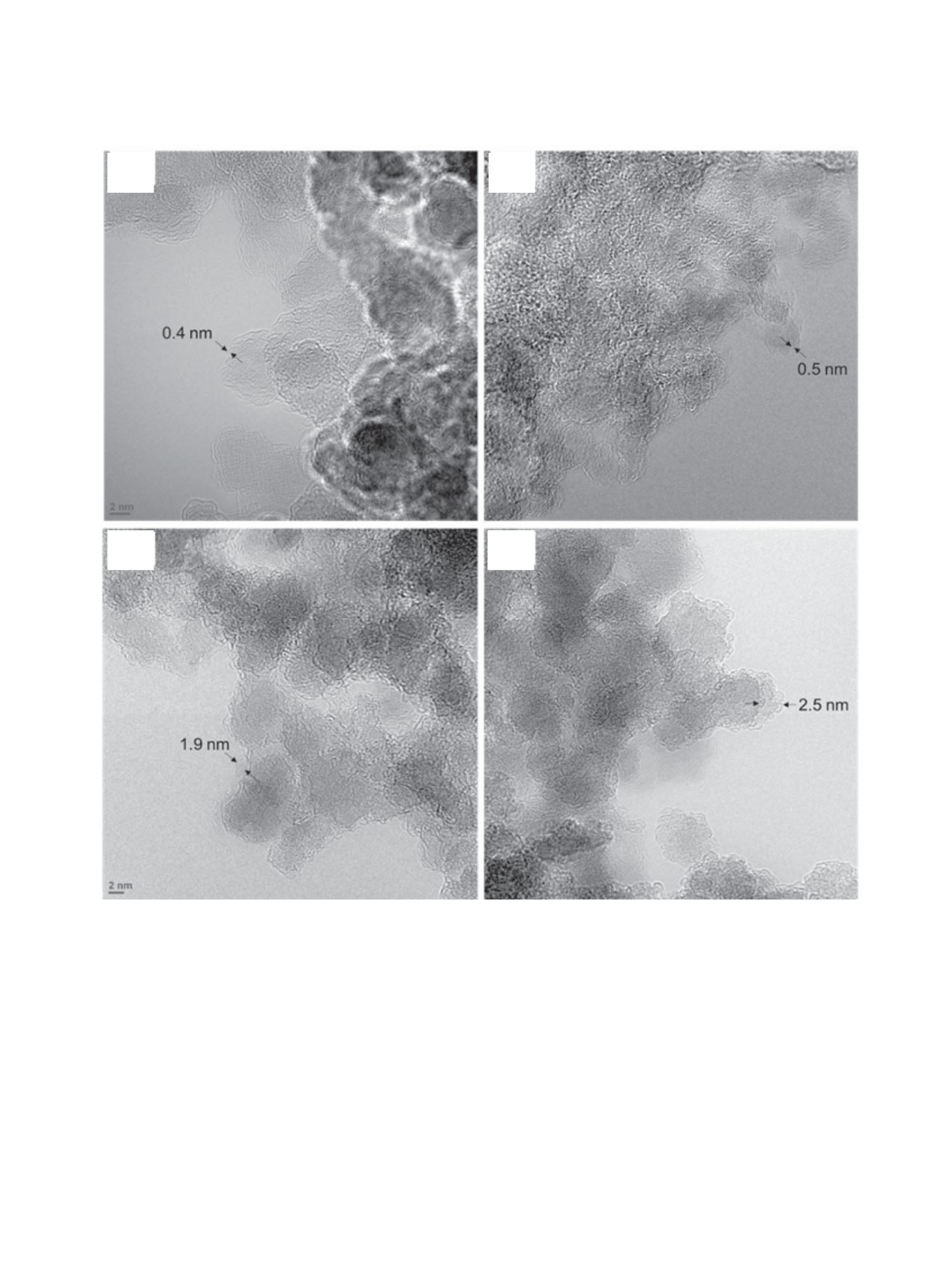
(а)
(б)
(в)
(г)
Рис. 2. ПЭМ изображения наноалмазов и комплексов наноалмаз-лизоцим. (a) наноалмаз (Aldrich); (б) наноалмаз (Aldrich)
подвергнутый отжигу; (в) ДНА-лизоцим; (г) ДНА (отожженный)-лизоцим.
На отожженном наноалмазе Aldrich при макси-
Изменения структуры лизоцима при его адсорб-
мальной адсорбции 2060 мг/г удельное покрытие
ции на поверхности наноамазов можно оценить из
достигает 7.1 мг/м2, что соответствует образова-
ИК спектра (рис. 3).
нию полислоев. Действительно, «корона» белка на
Полосы в ИК спектрах при 1662 и 1527 см-1
отожженном на воздухе наноалмазе обнаружена с
соответствуют колебаниям связей амид I и амид
помощью просвечивающей электронной микро-
II соответственно [25-27]. Полоса при 1662 см-1
скопии (рис. 2).
чувствительна к изменениям вторичной структуры,
РАДИОХИМИЯ том 63 № 2 2021
190
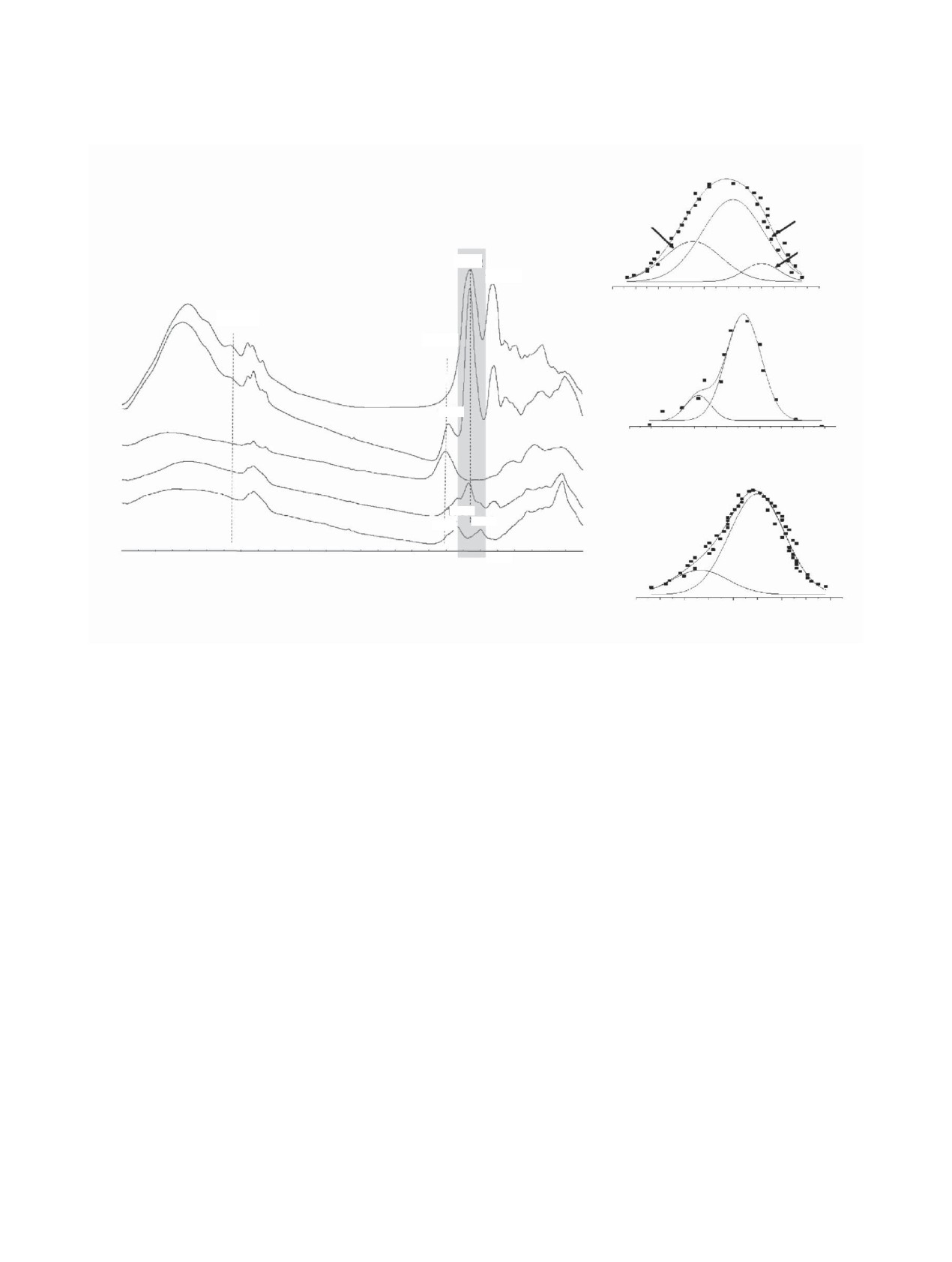
ЧЕРНЫШЕВА и др.
Лизоцим
а-спирали
β-складки
петли
1662
1527
1500
1600
1640
1680
1720
1740
Волновое число, см-1
3060
Лизоцим на
1804
наноалмазах
1
1787
2
1560
1600
1640
1660
1700
Волновое число, см-1
Лизоцим на
3
отожженных
наноалмазах
4
1737
1797
1598
5
3500
3000
2500
2000
1500
Волновое число, см-1
1560
1600
1640
1660
1700
Волновое число, см-1
Рис. 3. ИК-спектры лизоцима (1) и его адсорбционных комплексов с наноалмазами: (2) лизоцим - отожженный наноалмаз,
(3) отожженный наноалмаз, (4) лизоцим - наноалмаз, (5) наноалмаз. Справа приведено разложение полосы при 1662 см-1 на
компоненты, отвечающие определенным структурным элементам белка.
поэтому этот сигнал можно разложить на компо-
алмаза оказалось сходным, что позволяет пред-
ненты, отвечающие тем или иным структурным
положить отсутствие принципиальной разницы в
элементам белка [26, 28]. Наши результаты сви-
структурной организации адсорбционных слоев.
детельствуют об изменениях в структуре белка,
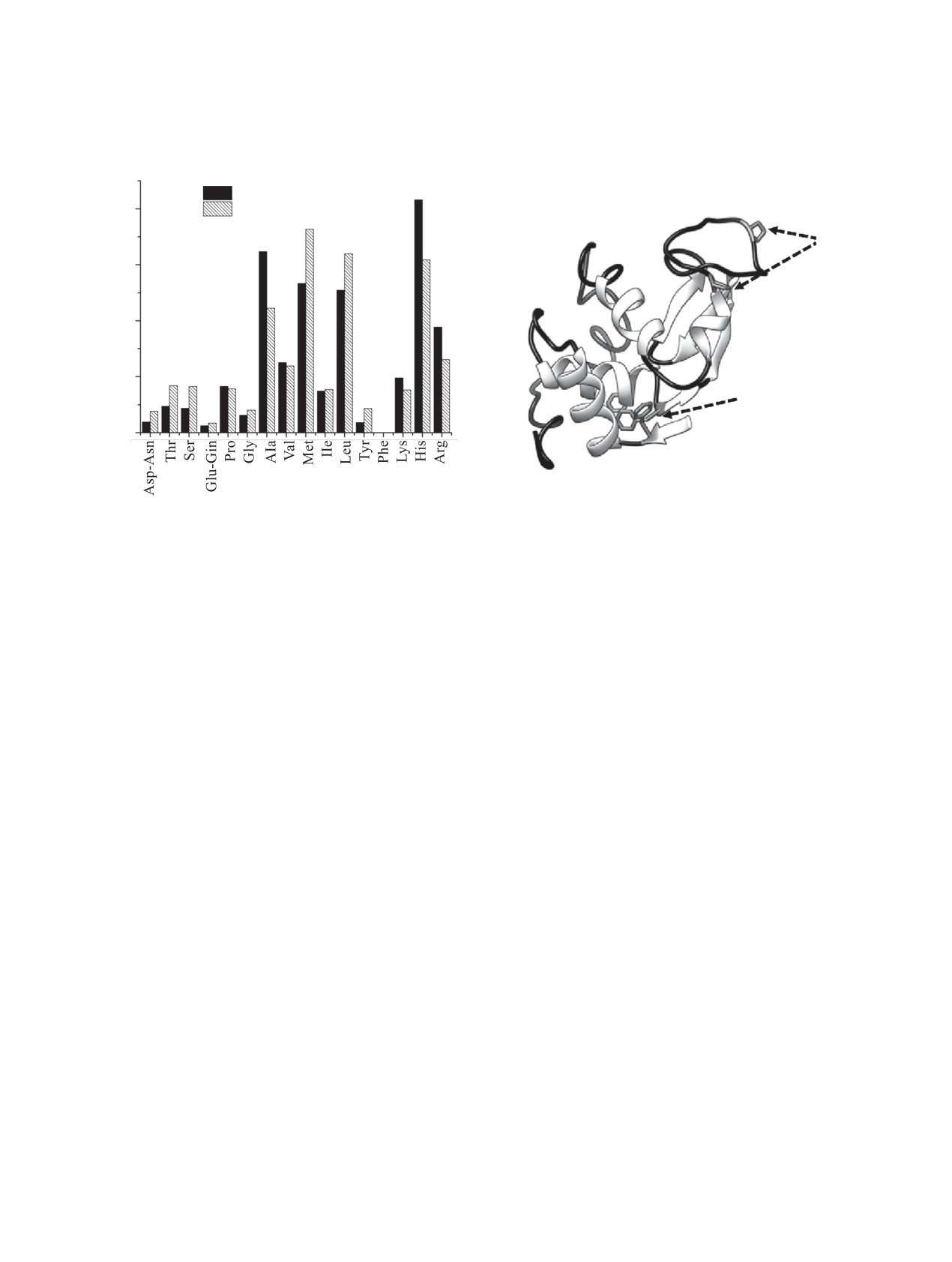
Информацию об ориентации молекулы относи-
когда он адсорбируется как на положительных,
тельно поверхности можно получить, анализируя
так и на отрицательных ДНА: адсорбция на обоих
отношение молярных активностей фенилалани-
типах поверхностей приводит к изменению кон-
на и пролина, которые располагаются на разных
формации петель. Кроме того, сдвиг полосы при
участках глобулы [рис. 4, (б)] [15]. Для поверх-
1804 см-1 отожженных ДНА до 1787 см--1 после
ностей обоих типов удельная активность фенила-
адсорбции лизоцима указывает на взаимодействие
ланина была пренебрежимо мала по сравнению с
поверхностных карбоксильных групп с положи-
активностью пролина. Аминокислотные остатки
тельно заряженными сайтами белка.
пролина входят в состав петель, структура кото-
Для определения ориентации белка на поверх-
рых из данных, полученных методом ИК спек-
ности наноалмазов адсорбционные комплексы ли-
трометрии, меняется при адсорбции на алмазной
зоцим-наноалмаз и лизоцим-отожженный наноал-
поверхности (рис. 4). Можно предположить, что
маз подвергли обработке атомами трития и провели
молекулы белка взаимодействуют с наноалмазами
анализ распределения трития по аминокислотам
участками, содержащими фенилаланин, а амино-
после тотального гидролиза белка (рис. 4).
кислотные остатки пролина, входящие в состав
Распределение трития по типам аминокислот-
петель, остаются на поверхности адсорбционного
ных остатков для исходного и отожженного нано-
слоя.
РАДИОХИМИЯ том 63 № 2 2021
МЕТОД ТРИТИЕВОГО ЗОНДА
191
(а)
(б)
%
1
20
2
Pro
15
10
5
Phe
0
Рис. 4. Распределение радиоактивности трития, нормированное на радиоактивность белка, в аминокислотных остатках
лизоцима при реакции с адсорбционными комплексами лизоцима на исходном (1) и отожженном (2) наноалмазах (а).
Структура лизоцима (PDB 6LYZ), в которой выделены аминокислотные остатки фенилаланина (Phe) и пролина (Pro), а
также черным цветом отмечены петли (б).
ЗАКЛЮЧЕНИЕ
низмах и откроет новые перспективы их приме-
нения в медицине.
ФОНДОВАЯ ПОДДЕРЖКА
Исследование с применением меченных три-
тием соединений как радиоактивных индика-
Работа выполнена при финансовой поддержке
торов с целью определения состава комплекса
Российского фонда фундаментальных исследова-
лизоцим-ДНА и с обработкой атомным тритием
ний (грант № 17-03-00985-а, 18-33-20147-мол-а-
комплексов с целью получения информации об
вед).
их структурной организации показало, что устой-
чивый комплекс лизоцим-ДНА образуется даже
КОНФЛИКТ ИНТЕРЕСОВ
на положительно заряженных частицах ДНА.
Авторы заявляют об отсутствии конфликта
При этом происходит образование плотного ад-
интересов.
сорбционного слоя, заполняющего как внешнюю
поверхность, так и внутренние поры частиц.
СПИСОК ЛИТЕРАТУРЫ
При использовании отожженных на воздухе ча-
стиц ДНА связывание лизоцима увеличивалось
1. Nemykh M.A. et al. // Virology. 2008. Vol. 373, N 1.
до образования полислоев белка на поверхно-
P. 61-71.
сти частиц. Вместе с тем расположение молекул
2. Ksenofontov A.L. et al. // PLoS One 2019. Vol. 14, N 5.
лизоцима в слое не зависело от заряда частиц с
P. e0216905.
преимущественной ориентацией каталитическим
3. Chernysheva M.G. et al.
// Colloids Surf. A:
центром фермента наружу. Полученный резуль-
Physicochem. Eng. Asp. 2018. Vol. 537. P. 351-360.
тат стимулирует изучение ферментативной ак-
4. Lukashina E.V., Badun G.A., Chulichkov A.L. // Biomol.
тивности лизоцима в составе рассматриваемого
Eng. 2007. Vol. 24, N 1 Spec. issue. P. 125-129.
комплекса, что поможет выявить некоторые осо-
5. Schrand A.M. et al. // J. Phys. Chem. B. 2007. Vol. 111,
бенности поведения наночастиц в живых орга-
N 1. P. 2-7.
РАДИОХИМИЯ том 63 № 2 2021
192
ЧЕРНЫШЕВА и др.
6. Wehling J. et al. // ACS Nano. 2014. Vol. 8, N 6.
18. Chernysheva M.G., Myasnikov I.Y., Badun G.A. //
P. 6475-6483.
Diam. Relat. Mater. 2015. Vol. 55. P. 45-51.
7. Schrand A.M., Hens S.A.C.C., Shenderova O.A. // Crit.
19. Petit T., Puskar L. // Diam. Relat. Mater. 2018. Vol. 89.
Rev. Solid State Mater. Sci. 2009. Vol. 34, N 1-2.
P. 52-66.
P. 18-74.
20. Badun G.A. et al. // Radiochim. Acta. 2014. Vol. 102,
8. Долматов В.Ю. и др. // ФТТ. 2004. Т. 46, № 4.
N 10. P. 941-946.
С. 596-600.
21. Лукашина Е.В. и др. // Радиохимия. 2002. Т. 44, № 1.
9. Яковлев Р.Ю. и др. // Рос. хим. журн. 2012. Т. 56, №
С. 78-82.
3-4. С. 114-125.
22. Wang H.-D. et al. // Nanotechnology. 2011. Vol. 22,
10. Wang H.D. et al. // Nanotechnology. 2011. Vol. 22,
N 14. P. 145703.
N 14. P. 145703.
23. Dideikin A.T. et al.
// Carbon.
2017. Vol. 122.
11. Eldawud R. et al. // Nanotechnology. 2016. Vol. 27,
P. 37-745.
N 8. P. 085107.
24. Lu J.R., Su T.J., Howlin B.J. // J. Phys. Chem. B. 1999.
12. Huang L.-C.L.C.L., Chang H.-C.C. // Langmuir. 2004.
Vol. 103, N 28. P. 5903-5909.
Vol. 20, N 14. P. 5879-5884.
25. Boyaci I.H. et al. // RSC Adv. 2015. Vol. 5, N 70.
13. Aramesh M. et al. // Nanoscale. 2015. Vol. 7, N 13.
P. 56606-56624.
P. 5726-5736.
26. Miller L.M., Bourassa M.W., Smith R.J. // // Biochim.
14. Nepal D., Geckeler K.E. // Small. 2006. Vol. 2, N 3.
Biophys. Acta - Biomembr. Elsevier B.V.,
2013.
P. 406-412.
Vol. 1828, N 10. P. 2339-2346.
15. Chernysheva M.G. et al.
// Colloids Surf. A:
Physicochem. Eng. Asp. 2017. Vol. 520. P. 1-8.
27. Yeung P.S.W., Eskici G., Axelsen P.H. // Biochim.
Biophys. Acta-Biomembr.
2013. Vol. 1828, N 10.
16. Badun G.A., Chernysheva M.G., Ksenofontov A.L. //
Radiochim. Acta. 2012. Vol. 100, N 6. P. 401-408.
P. 2314-2318.
17. Chernysheva M.G. et al.
// Colloids Surf. A:
28. Kretlow A. et al. // Biochim. Biophys. Acta-Biomembr.
Physicochem. Eng. Asp. 2019. Vol. 565. P. 25-29.
2006. Vol. 1758, N 7. P. 948-959.
РАДИОХИМИЯ том 63 № 2 2021