РАДИОХИМИЯ, 2021, том 63, № 3, с. 203-212
УДК 546.718:546.262.3
ВЫСШИЕ КАРБОНИЛЫ ТЕХНЕЦИЯ(I) И
ВОЗМОЖНОСТЬ ИХ ИСПОЛЬЗОВАНИЯ В ЯДЕРНОЙ
МЕДИЦИНЕ: ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
© 2021 г. Г. В. Сидоренко*, А. Е. Мирославов
Радиевый институт им. В. Г. Хлопина, 194021, Санкт-Петербург, 2-й Муринский пр., д. 28
*e-mail: gevasid@mail.ru
Получена 23.01.2020, после доработки 18.02.2020, принята к публикации 25.02.2020.
Результаты работ, проведенных в Радиевом институте им. В. Г. Хлопина в кооперации с другими рос-
сийскими и зарубежными институтами, а также литературные данные в области химии высших карбо-
нильных соединений технеция обобщены в контексте ядерно-медицинских задач. Проанализированы
химические проблемы, возникающие на пути использования высших карбонилов технеция в ядерной
медицине и связанные с условиями синтеза и реакционной способностью данных комплексов, а также
пути решения этих проблем. Основными проблемами являются необходимость использования высоких
давлений при синтезе, невозможность прямого замещения атома галогена в пентакарбонилгалогенидах
(непосредственные продукты синтеза из пертехнетат-иона) на другие монодентатные лиганды, ограни-
ченная устойчивость ряда высших карбонилов к декарбонилированию и склонность высших карбони-
лов технеция к нуклеофильным реакциям (включая гидролиз в щелочной среде). Последняя проблема
представляется наиболее критической. Подведены научные итоги исследований, проведено сравнение
с рениевыми аналогами. Комплекс [99mTcI(CO)5] перспективен для визуализации легких; высказаны
предположения о механизме его накопления в легких.
Ключевые слова: технеций-99, технеций-99m, карбонилы, синтез, реакционная способность, потенци-
альные радиофармпрепараты.
DOI: 10.31857/S0033831121030011
ность связывания с биомолекулами с помощью от-
ВВЕДЕНИЕ
носительно простых тридентатных хелатирующих
Разработка
методики
получения
ком-
групп, вследствие чего можно ожидать меньшее
плекса
[99Tc(CO)3(H2O)3]+
из
пертехне-
влияние технецийсодержащего фрагмента на био-
тат-иона в одну препаративную стадию
[1]
логическое поведение молекулы. Однако и триден-
TcO4- + BH3CO2- → [Tc(CO)3(H2O)3]+, адаптиро-
татные хелатирующие группы достаточно громозд-
ванной к короткоживущему 99mTc, и ее реализация
ки, и представляется заманчивым использовать
в форме «reagent kit» (набор сухих реагентов, к ко-
высшие карбонилы в качестве координационного
торому прибавляют раствор 99mTcO– из технециево-
ядра. В частности, для связывания тетракарбониль-
го генератора и выдерживают заданное время при
ного ядра достаточно более простых бидентатных
заданной температуре) Isolink, позволяющей про-
хелатирующих групп, а для связывания пентакарбо-
водить синтез непосредственно в клиниках, сти-
нильного ядра вообще достаточно монодентатных
мулировали развитие химии карбонилов технеция
лигандов.
применительно к задачам ядерной медицины. Пре-
имуществами трикарбонильного ядра по сравне-
Имеется значительный опыт использования ко-
нию с другими формами технеция являются низкий
ординационных ядер, к которым биомолекулы под-
заряд (+1), сравнительная компактность и возмож-
соединяются через монодентатную изонитрильную,
203
204
СИДОРЕНКО, МИРОСЛАВОВ
тиольную или HYNIC-группу [2-4]. Однако данные
Более перспективной в этом плане явилась методи-
ядра являются в той или иной степени гидрофиль-
ка, основанная на реакции KTcO4 со смесью гало-
ными, а ядро TcI(CO)5 - гидрофобным, что позво-
геноводородной и муравьиной кислот (последняя
лило бы видоизменить биологическое поведение
является одновременно восстановителем и источ-
препаратов в зависимости от цели исследования.
ником СО) при нагревании в автоклаве. Реакция
Возможности влиять на биологическое поведение
протекает в одну препаративную стадию, описыва-
биоконъюгатов путем варьирования координацион-
емую суммарным уравнением:
ного ядра уделяется немало внимания в литературе
KTcO4 + 8HCOOH + 2HX = [TcX(CO)5]↓ +
[5]. Так, влияние заместителей в координационном
ядре на биораспределение было наглядно проде-
+ KX + 3CO2 + 9H2O.
монстрировано в работе [3] на примере биоконъю-
Условия реакции: температура 170°С, давление в
гата на основе 99mTc, аминотритиольной хелатиру-
автоклаве 100-150 атм, время реакции 3 ч [8]. Про-
ющей группы и пептида RGD.
дукты реакции были охарактеризованы методом хи-
Кроме того, высшие карбонилы технеция могут
мического анализа, ИК спектроскопии, масс-спек-
представить и самостоятельный интерес в качестве
трометрии и рентгеноструктурного анализа [9-14].
потенциальных радиофармпрепаратов. В частно-
Следует отметить, что реакция проходит только в
сти, многие соединения данного класса весьма ле-
случае X = Cl, Br, I, тогда как в случае X = F образу-
тучи, что в принципе позволяет использовать их
ется тетрамерный гидроксофторид [15].
для исследования органов дыхания.
Данную методику удалось адаптировать к синте-
В настоящей статье обобщаются результа-
зу [99mTcI(CO)5]. Синтез проводят в мини-автокла-
ты работ, проведенных в Радиевом институте
ве при температуре 170°С и давлении СО 160 атм
им. В. Г. Хлопина в кооперации с другими россий-
в течение 40 мин, по окончании реакции продукт
скими и зарубежными институтами, а также ли-
стравливается с избытком СО после неполного
тературные данные в области химии высших кар-
остывания автоклава и может быть поглощен в вод-
бонильных соединений технеция(I) в свете задач
ном растворе для непосредственного использова-
ядерной медицины. Кратко рассмотрены основные
ния или в неводном растворителе для проведения
химические проблемы, возникающие на пути ис-
последующих реакций [8]. Процесс выделения про-
пользования высших карбонилов технеция, а также
дукта, вероятно, является неравновесным. Можно
возможности и пути их решения. Безусловно, поми-
предположить, что в условиях высокотемператур-
мо химических нельзя упускать из виду экономиче-
ного синтеза индикаторные количества летучего
ские и организационные (обеспечение стандартов
[99mTcI(CO)5] будут находиться в газовой фазе и за
GMP) вопросы [6], но именно решение химических
время частичного остывания автоклава не успеют
проблем определяет принципиальную возможность
перераспределиться между газовой фазой и водой.
внедрения тех или иных радиофармпрепаратов в
Продукт, поглощенный холодной водой, при после-
клиническую практику.
дующем продувании газа практически не выдува-
ется из раствора. Реакцию можно проводить как
ПРОБЛЕМЫ СИНТЕЗА
путем генерации СО in situ из муравьиной кислоты,
ПЕНТАКАРБОНИЛГАЛОГЕНИДОВ Tc(I)
так и при использовании внешнего источника СО.
В последнем случае исходная реакционная смесь
Первая опубликованная методика синтеза кар-
будет содержать только раствор 99mTcO– из генера-
бонилов технеция предусматривала получение де-
тора и подкисленный раствор KI.
какарбонила технеция из твердого Tc2O7 или TcO2
Выход продукта составляет 40-50% от введен-
при высоком давлении CO с последующим превра-
ной в автоклав активности. Таким же путем могут
щением в пентакарбонилгалогениды технеция по
быть получены [99mTcBr(CO)5] и [99mTcCl(CO)5], но
реакции с галогенами [7]. Очевидно, что данная
с меньшим выходом.
методика не может быть адаптирована к синтезу
препаратов на основе 99mTc из водных растворов
Недавно была разработана методика получения
99mTcO–, получаемых из технециевых генераторов.
[99TcBr(CO)5] при атмосферном давлении путем
РАДИОХИМИЯ том 63 № 3 2021
ВЫСШИЕ КАРБОНИЛЫ ТЕХНЕЦИЯ(I)
205
кипячения K2TcBr6 со смесью HCOOH и H2SO4
Следует отметить, что реакция пентакарбонилга-
[16]. По аналогичной методике удается также полу-
логенидов технеция с бидентатными хелатирующи-
чить [99TcCl(CO)5], однако [99TcI(CO)5] образуется в
ми лигандами (β-дикетонаты, ксантогенаты, дити-
смеси с [99TcI(CO)4]2. Возможность адаптации дан-
окарбаматы) в инертном растворителе в принципе
ной методики к синтезу пентакарбонилгалогенидов
позволяет получить тетракарбонильные комплексы
99mTc пока неясна.
с потерей только одной группы CO, замещаемой на
второй донорный атом бидентатного лиганда [18,
Очевидно, что методика синтеза [99mTcI(CO)5]
19]: [TcX(CO)5] + MZ → [TcZ(CO)4] + MX + CO
при высоком давлении не может быть реализована
(X - галоген; M = Na, K; Z - хелатирующий биден-
в форме «reagent kit» и требует для своего осущест-
татный лиганд).
вления специализированной лаборатории и квали-
фицированных радиохимиков. Кроме того, необхо-
Однако при проведении аналогичной реак-
димо удаление избытка СО до безопасного уров-
ции в донорном растворителе (Q) (например. эта-
ня, и его содержание в конечном растворе должно
ноле) образуются трикарбонильные комплексы:
контролироваться. Поэтому, если в будущем вести
[TcX(CO)5] + MZ + Q → [TcZ(CO)3Q] + MX + 2CO,
речь о внедрении высших карбонилов в радиохи-
а информация из ранней работы [23] о получе-
мическую практику, следует ставить вопрос о цен-
нии [Tc(R2NCS2)(CO)4] по реакции [TcCl(CO)5] с
трализованном получении готового препарата в
Na(R2NCS2) (R = Me, Et) в ацетоне при 50°С ока-
радиохимической лаборатории с его последующей
залась ошибочной (фактически образуется трикар-
бонильный комплекс [19]). В связи с этим вызыва-
доставкой в клиники.
ют сомнение и данные работы [23] об образовании
меркаптидных комплексов [Tc(RS)(CO)4]2 при на-
ПРОБЛЕМЫ ЗАМЕЩЕНИЯ ГАЛОГЕНА
гревании [TcCl(CO)5] с меркаптаном RSH или его
В ПЕНТАКАРБОНИЛГАЛОГЕНИДАХ
натриевой солью в растворе спирта или ТГФ. В
описанных условиях декарбонилирование до три-
Данная проблема связана с тем, что в отличие
карбонильного ядра представляется неизбежным
от множества галогенидных соединений углерода и
(см. следующий раздел). Однако в любом случае
других элементов, в которых атом галогена может
можно говорить о невозможности прямого замеще-
быть легко замещен на другие атомы или группы по
ния галогена в [TcX(CO)5] на меркаптидную группу
реакции нуклеофильного замещения, в пентакарбо-
с сохранением пентакарбонильного ядра с целью
нилгалогенидах технеция невозможно осуществить
получения биоконъюгатов, например, на основе ци-
данное превращение напрямую без разрушения
стеина.
пентакарбонильного ядра. Взаимодействие пента-
карбонилгалогенидов технеция [TcX(CO)5] с ней-
Проблема получения пентакарбонильных
тральными лигандами Q (например, пиридином)
комплексов с другими лигандами из пентакар-
бонилгалогенидов может быть решена путем от-
идет по пути замещения групп СО с образовани-
рыва галогена и его замещения на слабосвязан-
ем комплексов fac-[TcX(CO)3Q2] [17]. Взаимодей-
ный анион Y (например, перхлорат или трифлат)
ствие с нуклеофильными анионными лигандами
также сопровождается частичной потерей групп
по реакции с соответствующей солью серебра:
[TcX(CO)5] + AgY = [TcY(CO)5] + AgX (Y = ClO4,
CO [18, 19]. Обусловлено это, очевидно, тем, что
CF3SO3).
связь Tc-X является прочной и носит ковалентный
характер [20], тогда как связи Tc-CO, находящи-
Реакцию целесообразно проводить в гетеро-
еся в транс-положении друг к другу, ослаблены
генных условиях. Следует выбирать органический
вследствие эффекта транс-влияния, и именно эти
растворитель, в котором [TcX(CO)5] растворим, а
связи оказываются «слабым звеном» в молекуле и
соль серебра нерастворима (например, CH2Cl2 [8]).
разрываются в первую очередь. С другой стороны,
При проведении реакции в донорном растворите-
замещение групп СО на σ-донорные лиганды лаби-
ле в гомогенных условиях возрастает вероятность
лизирует связь Tc-X [15, 21, 22], так что замещение
декарбонилирования. Кроме того, при проведении
галогена значительно облегчается после частично-
реакции с индикаторными количествами 99mTc соль
го декарбонилирования.
серебра будет находиться в заведомом избытке, а
РАДИОХИМИЯ том 63 № 3 2021
206
СИДОРЕНКО, МИРОСЛАВОВ
этот избыток необходимо отделить для проведе-
дельных жирных кислот) были детально охарак-
ния последующей реакции с вводимым лигандом,
теризованы, включая рентгеноструктурный анализ
чтобы последний не связывался с ионом серебра. В
[8, 26, 27]. Принципиальная возможность адапта-
образующемся комплексе [TcY(CO)5] «слабым зве-
ции методики их синтеза для получения комплек-
ном» уже будет связь Tc-Y, и группу Y можно будет
сов [99mTc(CO)5L]+, где L - фосфин или изонитрил,
легко заместить на желаемый лиганд (при условии,
была продемонстрирована в работе [8]. Безусловно,
что образуемый им комплекс будет устойчив к де-
необходимость проведения реакции в органическом
карбонилированию, см. следующий раздел). Была
растворителе, который затем для получения гото-
проведена идентификация (включая рентгено-
вого радиофармпрепарата нужно будет полностью
структурный анализ) промежуточного соединения
удалить и заменить на биологически совместимую
[Tc(ClO4)(CO)5]
[24]. По реакции
[TcBr(CO)5]
среду (физиологический раствор), существенно ус-
с трифторацетатом серебра в инертном рас-
ложняет процесс. Однако данное препятствие не яв-
творителе (CCl4) был также получен комплекс
ляется непреодолимым, судя по накопленному опы-
[Tc(CF3COO)(CO)5], однако при проведении реак-
ту проведения многостадийных синтезов с коротко-
ции с NaCH3COO в донорной среде (этаноле) обра-
живущими изотопами (см., например, работу [28]).
зовывались трикарбонильные комплексы [25].
Предварительное удаление галогена необходимо
Сами по себе комплексы [TcY(CO)5] со сла-
и для синтеза катиона [Tc(CO)6]+, который можно
босвязанными анионами Y вряд ли могут представ-
рассматривать как частный случай замещения гало-
лять интерес для ядерной медицины по причине
гена в [TcX(CO)5] на нейтральный лиганд. При вы-
их лабильности, однако получаемые из них пен-
держивании комплекса [Tc(CO)3(H2O)3]+ в растворе
такарбонильные комплексы, например, с фосфи-
2 моль/л HClO4, не содержащем хлорид-ионов, под
нами и изонитрилами оказываются относительно
высоком давлении СО наблюдали последователь-
устойчивыми. Некоторые такие комплексы (в том
ное замещение воды в координационной сфере ато-
числе комплексы с ω-изоцианопроизводными мо-
ма Тс на СО вплоть до образования [Tc(CO)6]+ [29].
В работе [30] были найдены условия препара-
[TcCl(CO)5], который предварительно переводили
тивного синтеза [Tc(CO)6]+ исходя из комплекса в [Tc(OH)(CO)3]4 с целью удаления хлорид-ионов:
T
(HY - кислота со слабокоординирующимся анио-
переведен в [99mTc(CO)3(H2O)3]+, который, в свою
ном, например HClO4).
очередь, может быть переведен в [99mTc(CO)6]+ по-
Катион [Tc(CO)6]+ был охарактеризован мето-
вторным нагреванием в мини-автоклаве при высо-
дами ЯМР и ИК спектроскопии, ВЭЖХ, а в форме
ком давлении СО в присутствии сильной кислоты
перхлората - методами химического и рентгено-
со слабокоординирующимся анионом, например
структурного анализа [30, 31]. Методику синтеза
HPF6 или CF3SO3H. [99mTc(CO)6]+ образуется в
[Tc(CO)6]+ удалось адаптировать к короткоживу-
смеси с непрореагировавшим [99mTc(CO)3(H2O)3]+
щему 99mTc [30]. Процесс основан на «отдувании»
и с 99mTcO4-. Однако для медицинского использо-
[99mTcCl(CO)5] из мини-автоклава аналогично син-
вания комплекса [99mTc(CO)6]+ (который в прин-
тезу [99mTcI(CO)5] [8]. Переноса значимых коли-
ципе мог бы быть интересен как изоэлектронный
честв хлорид-ионов, мешающих синтезу, при этом
аналог известного кардиотропного препарата
не наблюдается. Хлорид был выбран как более
[99mTc(MIBI)6]+[4]) необходимо его отделение не
лабильное соединение в плане последующих пре-
только от других технецийсодержащих продуктов,
вращений; при нагревании он может быть легко
но и от избытка кислоты, что представляет опреде-
РАДИОХИМИЯ том 63 № 3 2021
ВЫСШИЕ КАРБОНИЛЫ ТЕХНЕЦИЯ(I)
207
ленную сложность (не говоря о многостадийности
Еще более устойчив катион [Tc(CO)6]+, заметно раз-
и длительности синтеза). В работе [30] данный во-
лагающийся лишь при нагревании [40] (опыты про-
прос не рассматривался.
водили в ацетонитриле). Не проявляют выраженной
склонности к декарбонилированию и комплексы с
фосфинами и изонитрилами [8, 26, 27]. Комплексы
ПРОБЛЕМЫ УСТОЙЧИВОСТИ ВЫСШИХ
Tc(CO)5 с ω-изоцианидными производными эфиров
КАРБОНИЛОВ ТЕХНЕЦИЯ
модельных жирных кислот при физиологической
К ДЕКАРБОНИЛИРОВАНИЮ
температуре разлагаются в существенной степени
лишь за время в десятки часов, намного превыша-
Высшие карбонилы технеция неизбежно содер-
ющее период полураспада 99mTc; для комплекса
жат в своем составе группы СО, находящиеся в
[Tc(CO)5(CNCH2COOEt)]+ были получены деталь-
транс-положении друг к другу. Как уже указыва-
ные кинетические данные [27].
лось выше, связь атома Тс с такими группами СО
Пентакарбонилгалогениды
технеция
в
ослаблена (количественные квантово-химические
твердом состоянии и в инертных раствори-
оценки проведены в работе [20]), и они сравнитель-
телях претерпевают ступенчатое декарбони-
но легко отщепляются. Однако энергия активации
лирование с образованием полиядерных ком-
отщепления СО, определяющая кинетику процесса
плексов с галогенидными мостиками
[9,
10]:
(замещение СО на другие лиганды в отсутствие ос-
4[TcX(CO)5] → 2[TcX(CO)4]2 → [TcX(CO)3]4 (X =
новного катализа [32] протекает по диссоциативно-
Cl, Br, I). Продукты реакции были охарактеризова-
му механизму), зависит не только от энергии связи
ны методом рентгеноструктурного анализа [41-43].
Tc-CO, но и от энергии стабилизации переходного
пятикоординированного состояния [20]. Лиганды,
В донорных растворителях замещение СО в пен-
обладающие π-донорными свойствами (в частно-
такарбонилгалогенидах технеция на σ-донорные
сти, O-доноры, галогениды), стабилизируют пере-
лиганды Q (например, ацетонитрил) идет сразу
ходное состояние за счет дополнительного дони-
с образованием трикарбонильных комеплексов,
рования π-электронной плотности на атом Тс, тем
а промежуточные тетракарбонильные комплек-
самым облегчая отрыв группы СО (это называется
сы экспериментально не фиксируются [11, 38]:
эффектом цис-лабилизации [33-36]), тогда как ли-
[TcX(CO)5] + 2Q → [TcX(CO)3Q2] (со слабыми доно-
ганды, не обладающие π-донорными свойствами
рами возможно также образование [TcX(CO)3Q]2).
(СО, фосфины, изонитрилы), эффекта цис-лабили-
При этом, как показано на примере [TcBr(CO)5]
зации не проявляют, и соответствующие комплек-
[38], декарбонилирование в инертном (CCl4) и до-
сы оказываются достаточно устойчивыми к декар-
норном (CH3CN) растворителе идет с близкой ско-
бонилированию. Среди галогенидов эффект цис-
ростью, что согласуется с диссоциативным меха-
лабилизации усиливается в ряду I < Br < Cl < F
низмом реакции.
[20, 37-39]: наименее устойчивый [TcF(CO)5] (кото-
В тетракарбонильных комплексов с σ-донор-
рый не может быть получен прямым синтезом, как
ными лигандами эффект цис-лабилизации «удваи-
другие пентакарбонилгалогениды, а образуется при
вается», поэтому данные комплексы оказываются
реакции [TcI(CO)5] с AgF [37, 39]) быстро разлага-
менее устойчивы к декарбонилированию в донор-
ется в растворе CH2Cl2 уже при комнатной темпе-
ном растворителе, чем соответствующие пентакар-
ратуре, а за час при физиологической температуре
бонильные комплексы [37]. Этим и объясняется не-
(37°С) [TcCl(CO)5] разлагается примерно наполо-
возможность выделения промежуточных тетракар-
вину, [TcBr(CO)5] - примерно на 20%, а наиболее
бонильных комплексов при декарбонилировании
устойчивый [TcI(CO)5] - всего на несколько процен-
пентакарбонилгалогенидов технеция в σ-донорных
тов (оценка по данным работы [38], полученным для
растворителях. Замещение галогена на бидентат-
растворов в CCl4), что можно считать приемлемым
ные σ-донорные лиганды (β-дикетонаты, дитио-
для клинического применения (в отсутствие нукле-
карбамат) в донорной среде, как уже указывалось,
офильного катализа влияние природы растворителя
сопровождается замещением одной из групп СО
на кинетику декарбонилирования пентакарбонил-
на нейтральный лиганд с образованием трикарбо-
галогенидов технеция сравнительно невелико [38]).
нильных комплексов, а тетракарбонильные ком-
РАДИОХИМИЯ том 63 № 3 2021
208
СИДОРЕНКО, МИРОСЛАВОВ
плексы могут быть получены только в инертном
фиксирован; вероятно, он (или сопряженный ани-
растворителе. В инертном растворителе комплекс
он) быстро теряет молекулу СО2 с образованием
[Tc(S2COMe)(CO)4] сравнительно устойчив, однако
[TcH(CO)5] (или сопряженного аниона [Tc(CO)5]-),
в донорном растворителе (CH3CN) он сравнительно
который далее претерпевает вторичные превра-
быстро превращается в трикарбонильный комплекс
щения (окислительное сдваивание с образовани-
и поэтому не может рассматриваться в качества по-
ем декакарбонила, дальнейшую нуклеофильную
тенциального радиофармпрепарата [37]. Еще менее
атаку на группу СО и т.п.). При варьировании ус-
устойчивы тетракарбонил-β-дикетонатные [18] и
ловий реакции образование [TcH(CO)5] удалось
тетракарбонидитиокарбаматный [19] комплексы.
зафиксировать экспериментально
[47]. В поль-
В целом гексакарбонилтехнециевый катион и
зу данного механизма свидетельствуют данные
ряд пентакарбонильных комплексов технеция об-
об идентификации промежуточной карбоновой
ладают достаточной устойчивостью к декарбони-
кислоты [Tc(CO)3(COOH)(PPh3)2] при действии ще-
лированию, чтобы рассматривать их применение
лочи на [Tc(CO)4(PPh3)2]+ с последующим декарбок-
в качестве радиофармпрепаратов. Таким образом,
силированием и образованием [TcH(CO)3(PPh3)2]
данная проблема также не является непреодолимой.
[48]. Детальный механизм гидролиза [Tc(CO)6]+
требует дальнейшего исследования, но в любом
ПРОБЛЕМА СКЛОННОСТИ
случае данная реакция, протекающая уже при рН
К НУКЛЕОФИЛЬНЫМ РЕАКЦИЯМ,
около 7, ставит под вопрос саму возможность ис-
ВКЛЮЧАЯ ГИДРОЛИЗ
пользования данного комплекса в ядерной медици-
не (рН крови составляет около 7.4). С учетом данно-
К сожалению, реакционная способность выс-
го обстоятельства нами была оценена устойчивость
ших карбонилов Tc(I) не ограничивается отщепле-
некоторых пентакарбонильных комплексов тех-
нием групп СО. Ослабление π-дативного взаимо-
неция с фосфинами и изонитрилами к щелочному
действия атома Tc с лигандом СО вследствие эф-
гидролизу; некоторые комплексы оказались устой-
фекта транс-влияния при транс-положении двух
чивы при рН в области 7.4, и такие комплексы (при
лигандов СО относительно друг друга приводит к
условии разработки эффективной методики синте-
увеличению эффективного положительного заря-
за) могут рассматриваться в качестве потенциаль-
да на атоме С [20], тем самым повышая его склон-
ных радиофармпрепаратов. В частности, комплекс
ность к нуклеофильным реакциям. Нуклеофильный
Tc(CO)5 с P-координированным фосфатриазаада-
катализ замещения групп СО в родственных карбо-
мантаном [26] устойчив в водном растворе при pH 7
нильных соединениях хорошо известен [32]. Дру-
и 8, хотя и разлагается за 0.5 ч при pH 10 и мгновен-
гой побочной реакцией, ограничивающей возмож-
но при pH 14; комплекс в водном растворе устойчив
ности применения высших карбонилов технеция
к действию гистидина, что является стандартным
в ядерной медицине, является гидролиз в водных
тестом при оценке устойчивости радиофармпрепа-
растворах. Трикарбонилтехнециевый фрагмент не
ратов в биологической среде («histidine challenge»
разрушается в водных щелочных растворах [44];
более того, сам синтез [Tc(CO)3(H2O)3]+ с исполь-
[49]). Комплекс Tc(CO)5 с этил-ω-изоцианоацета-
зованием стандартного набора реагентов Isolink
том (изонитрильное производное простейшего со-
происходит в щелочной среде [45]. Однако при
единения, моделирующего жирную кислоту) также
подщелачивании водного раствора [Tc(CO)6]+ClO–
устойчив к действию гистидина в фосфатном бу-
мгновенно выпадает желтоватый осадок, при нагре-
ферном растворе [27].
вании которого в вакууме образуются Tc2(CO)10 и
[TcH(CO)4]3 [46]. Позднее данный осадок был
СРАВНЕНИЕ С РЕНИЕМ
идентифицирован как карбонилгидридный кла-
стер Tc3H(CO)14 [47]. Высказано предположение,
У рения имеются радиоактивные изотопы 186Re
что реакция протекает путем нуклеофильной ата-
[T1/2 = 3.7186(5) сут, 93.1% β-, 6.9% ЭЗ] и 188Re
ки гидроксид-иона на карбонильный атом угле-
[T1/2 = 17.0040(22) ч, β-], которые могут представить
рода с образованием кислоты
[Tc(CO)5COOH].
интерес для терапевтических целей в ядерной ме-
Данный комплекс экспериментально не был за-
дицине. Поскольку рений во многом является ана-
РАДИОХИМИЯ том 63 № 3 2021
ВЫСШИЕ КАРБОНИЛЫ ТЕХНЕЦИЯ(I)
209
логом технеция, а образуемые ими соединения ча-
ступности и радиоактивности его химия изучена в
сто бывают изоструктурными, в комбинации с 99mTc
намного меньшей степени по сравнению с другими
можно говорить о перспективах тераностического
d-элементами, и в химии d-элементов технеций ча-
подхода. Химия карбонилов рения изучена гораздо
сто оказывается «недостающим звеном». В полной
лучше по сравнению с технецием, однако о получе-
мере это относится и к карбонильным комплексам.
нии высших карбонилов для короткоживущих изо-
Проведенные систематические и разносторонние
топов рения до недавнего времени не сообщалось.
исследования позволили не только разработать эф-
В связи с этим нами была изучена возможность по-
фективные методы синтеза и получить представи-
лучения высших карбонильных соединений рения,
тельный ряд новых комплексов (как уникальных
аналогичных соответствующим комплексам техне-
для технеция, так и известных для рения и/или
ция, с изотопом 188Re. В связи с меньшей реакци-
марганца, но ранее не полученных для технеция),
онной способностью ReO– по сравнению с TcO4- в
но и лучше понять реакционную способность выс-
реакциях восстановления для синтеза потребова-
ших карбонилов технеция, выявить общие черты и
лись более жесткие условия (210°С, 2 ч, начальное
различия с марганцевыми и рениевыми аналогами,
давление СО 100-120 атм). В остальном использо-
научиться предсказывать их поведение в различных
ванная методика была аналогична методике синтеза
условиях. В частности, показано, что высшие кар-
[99mTcI(CO)5], с отдувкой продукта из автоклава вме-
бонилы технеция на несколько порядков лабильнее
сте с избытком СО. Только [188ReI(CO)5] удалось по-
своих рениевых аналогов в реакциях замещения СО
лучить с выходом 10-20% (оценка по активности),
и по кинетическим характеристикам близки к мар-
выход хлоридного и бромидного производных не
ганцевым аналогам [38]. Объяснены существенные
превышал ~1%. Тем не менее, принципиальная воз-
различия в реакционной способности тетракарбо-
можность получения [188ReI(CO)5] была продемон-
нильных комплексов в реакциях декарбонилиро-
стрирована [50]. Интересно, что при проведении
вания в инертных и донорных растворителях; они
реакции в аналогичных условиях с весовыми коли-
связаны с практической необратимостью реакции
чествами NH4ReO4 [ReI(CO)5] образуется в следо-
в донорных растворителях и обратимостью - в
вых количествах, а основным продуктом является
инертных [20]. Получены количественные данные,
черный осадок (предположительно ReO2) [50], тог-
характеризующие эффект цис-лабилизации приме-
да как в случае Tc побочных продуктов при синтезе
нительно к соединениям технеция. Углубленный
[TcX(CO)5] практически не образуется [8].
анализ данного эффекта позволил объяснить ано-
мальное (с точки зрения π-донорной способности
Высшие карбонилы рения намного устойчивее
лиганда) повышение реакционной способности
своих технециевых аналогов в реакциях замещения
[TcX(CO)5] в ряду I-Br-Cl-F; данная аномалия, ко-
СО [38], поэтому данный фактор вряд ли будет огра-
торая ускользала от внимания авторов в предыду-
ничивать возможности применения данного класса
щих работах по анализу эффекта цис-лабилизации
соединений в ядерной медицине. С другой стороны,
[51], связывается с влиянием электростатического
в случае Re сохраняются сложности с замещением
фактора [20, 37]. Полученный вывод, очевидно, мо-
галогена на другие лигандные группы для связыва-
жет быть распространен и на аналогичные комплек-
ния биомолекул; как и в случае Тс, требуется пред-
сы других d-элементов. Эксперименты по щелочно-
варительное замещение галогена на легко уходящий
му гидролизу высших карбонильных комплексов
анион под действием соответствующей соли серебра
открывают новое направление в химии карбонилов
[26]. Остается и проблема с гидролитической устой-
технеция.
чивостью. Более того, комплекс Re(CO)5 с этилизо-
цианоацетатом оказался менее устойчив к действию
В целом полученные данные указывают на
гистидина в фосфатном буферном растворе, чем его
то, что в реакционной способности технецие-
технециевый аналог [27]. Это, вероятно, обусловле-
вых комплексов и их рениевых аналогов часто
но именно щелочным гидролизом комплекса.
наблюдаются существенные различия. Поэтому не-
обходимо проявлять осторожность при использова-
НАУЧНЫЕ ИТОГИ
нии рениевых аналогов в качестве моделей при ана-
Технеций занимает центральное положение в
лизе технециевых комплексов и прогнозировании
блоке d-элементов, однако вследствие трудной до-
их поведения.
РАДИОХИМИЯ том 63 № 3 2021
210
СИДОРЕНКО, МИРОСЛАВОВ
Более того, летучесть данного комплекса позволя-
ет параллельно исследовать вентиляцию легких
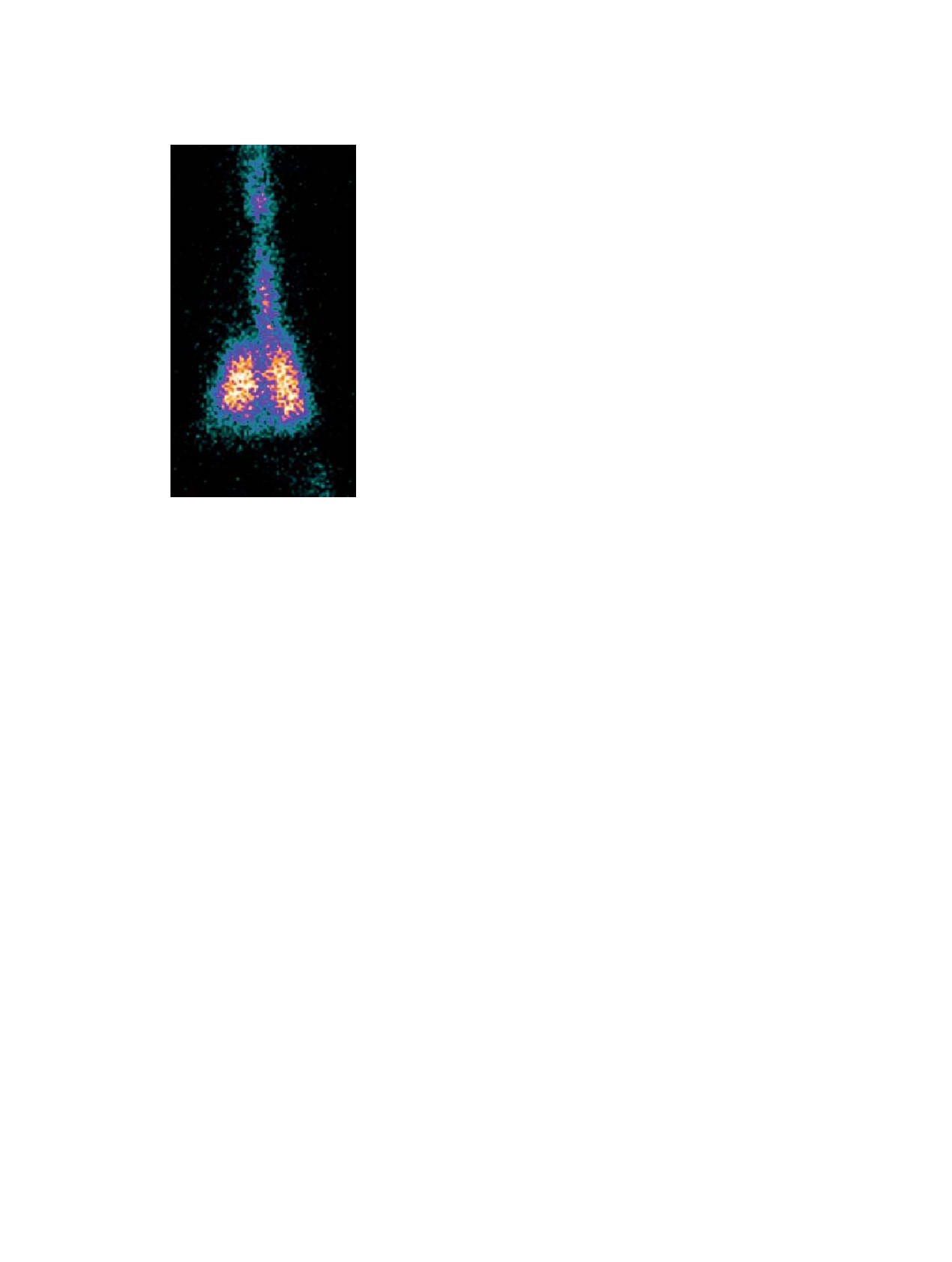
[56] (рис. 1). Недавно было показано, что по ана-
логичной методике могут быть получен и пента-
карболнилгалогенидные комплексы радиоизотопов
рения (на примере 188Re) [50], а это уже позволя-
ет рассматривать возможности тераностического
подхода. Однако для оценки медицинского потен-
циала [99mTcI(CO)5] (как и его рениевого аналога)
самого факта накопления в легких недостаточно,
необходимо определить селективность препара-
та по отношению к тем или иным заболеваниям
легких. К сожалению, с тех пор не было получе-
но новых биологических данных (как и данных по
биораспределению рениевого аналога). Также не-
обходимо понять механизм накопления препарата
в легких. Было высказано предположение, что это
может быть связано с окислением комплекса под
Рис. 1. ОФЭКТ-изображение легких кролика после вды-
действием оксигенированного гемоглобина при
].
хания препарата [99mTcI(CO)5
попадании комплекса с кровотоком в насыщенную
кислородом среду. В пользу такой гипотезы сви-
ЕСТЬ ЛИ ПРАКТИЧЕСКИЕ
детельствует исчезновение эффекта при проведе-
ПЕРСПЕКТИВЫ?
нии опытов на животных в состоянии наркоза. Для
подтверждения этого предположения были начаты
С учетом сложностей, которые необходимо пре-
исследования окисления [99TcI(CO)5] в модельных
одолеть при синтезе, и ограниченной устойчивости
системах. Первые опыты с простейшей модельной
в физиологических условиях говорить о перспек-
системой - O2 и FeCl3 в ацетонитриле - показали,
тивах использования пентакарбонильного ядра для
что соединение устойчиво к действию молекуляр-
присоединения биомолекул (например, через изо-
ного кислорода в отсутствие катализатора, а в при-
нитрильную или фосфиновую группу) пока трудно.
сутствии FeCl3 постепенно разрушается с образо-
Преодоление всех вышеописанных затруднений
ванием [Tc(CO)3(CH3CN)3]+ и молекулярного иода
может быть оправдано только, если полученный
[57]. Таким образом, из трех потенциально восста-
продукт будет существенно превосходить по своим
новительных центров - атом Tc(I), формально двух-
валентный атом углерода в группе СО и иодидный
свойствам (накопление в целевых органах и тканях)
аналогичные биомолекулы, конъюгированные с
лиганд - окисляется в первую очередь иодидный
99mTc с использованием «традиционных» координа-
лиганд. Однако данная модельная система весьма
ционных узлов, например того же изонитрильного в
далека от биологической системы с гемоглобином,
комбинации с ядром TcNS3 (подход «4 + 1») [3] или
и необходимы дальнейшие опыты с более сложны-
с трикарбонильным ядром в комбинации с сильным
ми системами, лучше моделирующими биологиче-
бидентатным лигандом, занимающим оставшие-
скую систему.
ся две координационные позиции [52]. Данные о
В заключение отметим, что разработка методик,
биораспределении биоконъюгатов на основе ядра
позволяющих получать радиофармпрепараты на
99mTc(CO)5 пока не получены.
основе высших карбонилов технеция в обычных
Вместе с тем, имеются перспективы прямого
условиях с использованием смесей сухих реагентов
использования [99mTcI(CO)5] в ядерной медицине.
(«reagent kit»), представляется малореальной. Мож-
Еще в начале нынешнего столетия было обнаруже-
но вести речь только о централизованном синтезе
но селективное и устойчивое накопление данного
препаратов в специализированных лабораториях
комплекса в легких подопытных животных [53-55].
силами квалифицированных радиохимиков. И неза-
РАДИОХИМИЯ том 63 № 3 2021
ВЫСШИЕ КАРБОНИЛЫ ТЕХНЕЦИЯ(I)
211
висимо от практических перспектив отметим науч-
13. Григорьев М.С., Мирославов А.Е., Сидоренко Г.В.,
ную важность исследования соединений технеция
Суглобов Д.Н. // Радиохимия. 1997. Т. 39, № 3.
С. 204-206.
(включая карбонилы как типичные координацион-
14. Сидоренко Г.В., Гуржий В.В., Мирославов А.Е.,
ные соединения элементов данного класса) для не-
Сизова О.В., Кривовичев С.В., Лумпов А.А., Су-
органической химии в плане построения целостной
глобов Д.Н.
// Радиохимия.
2009. Т.
51,
№ 3.
картины химии d-элементов.
С. 207-213.
15. Мирославов А.Е., Горшков Н.И., Григорьев М.С.,
КОНФЛИКТ ИНТЕРЕСОВ
Сидоренко Г.В., Суглобов Д.Н. // Радиохимия. 1997.
Т. 39, № 1. С. 41-45.
Авторы звявляют об отсутствии конфликта
16. Miroslavov A.E., Braband H., Sidorenko G.V.,
интересов.
Stepanova E.S., Lumpov A.A., Alberto R.
//
J. Organomet. Chem. 2018. Vol. 871. P. 56-59.
СПИСОК ЛИТЕРАТУРЫ
17. Борисова И.В., Мирославов А.Е., Сидоренко Г.В., Су-
глобов Д.Н. // Радиохимия. 1991. T. 33, № 6. C. 1-9.
1.
Alberto R., Ortner K., Wheatley N., Schibli R.,
18. Борисова И.В., Мирославов А.Е., Сидоренко Г.В., Су-
Schubiger A.P. // J. Am. Chem. Soc. 2001. Vol. 123.
глобов Д.Н., Щербакова Л.Л. // Радиохимия. 1991.
P. 3135-3136.
Т. 33, № 4. С. 27-38.
2.
Abram U., Alberto R. // J. Braz. Chem. Soc. 2006.
19. Miroslavov A.E., Sidorenko G.V., Suglobov D.N.,
Vol. 17, N 8. P. 1486-1500.
Lumpov A.A., Gurzhiy V.V., Grigor’ev M.S.,
3.
Kunstler J.-U., Seidel G., Bergmann R., Gniazdowska E.,
Mikhalev V.A.
// Inorg. Chem.
2011. Vol.
50.
Walther M., Schiller E., Decristoforo C., Stephan H.,
P. 1098-1104.
Haubner R., Steinbach J., Pietzsch H.-J. // Eur. J. Med.
20. Sidorenko G.V., Maltsev D.A., Miroslavov A.E.,
Chem. 2010. Vol. 45, N 9. P. 3645-3655.
Suglobov D.N., Baranovskii V.I., Gurzhiy V.V.,
4.
Mazzi U., Schibli R., Pietzsch H.J., Künstler J.U.,
Lumpov A.A., Tyupina M.Yu. // Comput. Theor. Chem.
Spies H. Technetium in Medicine // Technetium-99m
2016. Vol. 1093. P. 55-66.
Radiopharmaceuticals / Ed. I. Zolle. Berlin: Springer,
21. Батурин Н.А., Григорьев М.С., Крючков С.В., Ми-
2007. P. 7-58.
рославов А.Е., Сидоренко Г.В., Суглобов Д.Н. //
5.
Decristoforo C., Santos I., Pietzsch H.J., Kuenstler J.U.,
Радиохимия. 1994. Т. 36, № 3. C. 202-204.
Duatti A., Smith C.J., Rey A., Alberto R., Von Guggenberg
22. Сидоренко Г.В., Мирославов А.Е., Мальцев Д.А.,
E., Haubner R. // Q. J. Nucl. Med. Mol. Imaging. 2007.
Лумпов А.А., Полоцкий Ю.С., Тюпина М.Ю., Сугло-
Vol. 51. P. 33-41.
бов Д.Н.// Радиохимия. 2014. Т. 56, № 2. С. 134-138.
6.
Technetium-99m Radiopharmaceuticals: Manufacture
23. Hieber W., Lux F., Herget C. // Z. Naturforsch. B. 1965.
of Kits: IAEA Tech. Rep. Ser. no. 466. Vienna: IAEA,
Vol. 20. P. 1159-1165.
2008.
24. Miroslavov A.E., Gurziy V.V., Tyupina M.Yu.,
7.
Hileman J.C., Huggins D.K., Kaesz D.K. // Inorg. Chem.
Lumpov A.A., Sidorenko G.V., Polotskii Yu.S.,
1962. Vol. 1, N 4. P. 933-938.
Suglobov D.N.
//
J. Organomet. Chem.
2013.
8.
Miroslavov A.E., Lumpov A.A., Sidorenko G.V.,
Vol. 745-746. P. 219-225.
Levitskaya E.M., Gorshkov N.I., Suglobov D.N.,
25. Борисова И.В., Мирославов А.Е., Сидоренко Г.В., Су-
Alberto R., Braband H., Gurzhiy V.V., Krivovichev S.V.,
глобов Д.Н. // Радиохимия. 1991. Т. 33, № 6. С. 1-8.
Tananaev I.G. // J. Organomet. Chem. 2008. Vol. 693.
26. Miroslavov A.E., Britvin S.N., Braband H., Alberto R.,
P. 4-10.
Stepanova E.S., Shevyakova A.P., Sidorenko G.V.,
9.
Мирославов А.Е., Сидоренко Г.В., Борисова И.В., Ле-
Lumpov A.A. // J. Organomet. Chem. 2019. Vol. 896.
гин Е.К., Суглобов Д.Н. // Радиохимия. 1990. Т. 32,
P. 83-89.
№ 4. С. 6-14.
27. Miroslavov A.E., Polotskii Yu.S., Gurzhiy V.V.,
10. Мирославов А.Е., Сидоренко Г.В., Борисова И.В., Ле-
Ivanov A. Yu., Lumpov A.A., Tyupina M.Yu.,
гин Е.К., Лычев А.А., Суглобов Д.Н. // Радиохимия.
Sidorenko G.V., Tolstoy P.M., Maltsev D.A., Suglo-
1990. Т. 32, № 6. С. 14-21.
bov D.N. // Inorg. Chem. 2014. Vol. 53. P. 7861-7869.
11. Мирославов А.Е., Борисова И.В., Сидоренко Г.В., Су-
28. Красикова Р.Н., Кузнецова О.Ф., Федорова О.С.,
глобов Д.Н. // Радиохимия. 1991. T. 33, № 6. C. 14-20.
Мосевич И.К., Малеев В.И., Белоконь Ю.Н.,
12. Адамов В.В., Беляев Б.Н., Борисова И.В., Миросла-
Савельева Т.Ф., Сагиян А.С., Дадаян С.А.,
вов А.Е., Сидоренко Г.В., Суглобов Д.Н. // Радиохи-
Петросян А.А. // Радиохимия. 2007. Т. 49, № 5.
мия. 1991. T. 33, № 4. C. 38-53.
С. 449-454.
РАДИОХИМИЯ том 63 № 3 2021
212
СИДОРЕНКО, МИРОСЛАВОВ
29. Aebischer N., Schibli R., Alberto R., Merbach A.E. //
P. 183-185.
Angew. Chem. Int. Ed. 2000. Vol. 39, N 1. P. 254-256.
46. Сидоренко Г.В., Мирославов А.Е., Григорьев М.С.,
30. Мирославов А.Е., Сидоренко Г.В., Лумпов А.А., Ми-
Гуржий В.В., Лумпов А.А., Михалев В.А., Сугло-
халев В.А., Суглобов Д.Н. // Радиохимия. 2009. Т. 51,
бов Д.Н. // Радиохимия. 2011. Т. 53, № 1. С. 42-47.
№ 2. С. 107-114.
47. Miroslavov A.E., Shishkina A.P., Sidorenko G.V.,
31. Gurzhiy V.V., Miroslavov A.E., Sidorenko G.V.,
Gurzhiy V.V., Maltsev D.A., Kurysheva E.V. // Inorg.
Lumpov A.A., Krivovichev S.V., Suglobov D.N. // Acta
Chem. 2020. Vol. 59. P. 9238-9243.
Crystallogr., Sect. E. 2008. Vol. 64. P. m1145.
48. Cook J., Davison A. // J. Organomet. Chem. 1996.
32. Bellus P.A., Brown T.L. // J. Am. Chem. Soc. 1980.
Vol. 57, N 1-2. P. 47-51.
Vol. 102. P. 6020-6026.
49. Contrast Agents III. Radiopharmaceuticals. From
33. Atwood J.D., Brown T.L. // J. Am. Chem. Soc. 1975.
Diagnostics to Therapeutics / Ed. W. Krause. Springer,
Vol. 97. P. 3380.
2005.
34. Atwood J.D., Brown T.L. // J. Am. Chem. Soc. 1976.
Vol. 98. P. 3155.
50. Miroslavov A.E., Alekseev I.E., Tyupina M.Yu.,
35. Atwood J.D., Brown T.L. // J. Am. Chem. Soc. 1976.
Lumpov A.A., Stepanova E.S., Kol’tsov V.V.,
Vol. 98. P. 3160.
Sidorenko G. V. // J. Radioanal. Nucl. Chem. 2016.
36. Lichtenberger D.L., Brown T.L. // J. Am. Chem. Soc.
Vol. 308. P. 1039-1042.
1978. Vol. 100. P. 366.
51. Macgregor S. A., MacQueen D. // Inorg. Chem. 1999.
37. Сидоренко Г.В., Мальцев Д.А., Мирославов А.Е.,
Vol. 38. P. 4868.
Степанова Е.С., Тюпина М.Ю., Лумпов А.А., Су-
52. Ellis B.L., Gorshkov N.I., Lumpov A.A., Miroslavov A.E.,
глобов Д.Н.
// Радиохимия.
2017. Т.
59,
№ 3.
Yalfimov A.N., Gurzhiy V.V., Suglobov D.N., Braddock R.,
С. 210-215.
Adams J.C., Smith A.M., Prescott M.C., Sharma H.L. //
38. Мирославов А.Е., Сидоренко Г.В., Лумпов А.А., Ми-
J. Label. Compd. Radiopharm. 2013. Vol. 56. P. 700-
халев В.А., Суглобов Д.Н. // Радиохимия. 2009. Т. 51,
707.
№ 1. С. 6-10.
53. Soukhov V., Fadeev N., Suglobov D., Lumpov A.,
39. Stepanova E.S., Gurzhiy V.V., Tyupina M.Yu.,
Miroslavov A., Gorshkov N., Kodina G. // J. Label.
Miroslavov A.E., Sidorenko G.V., Lumpov A.A. // Dalton
Compd. Radiopharm.
2001. Vol.
44, Suppl.
1.
Trans. 2016. Vol. 45. P. 8428-8432.
P. S597-S599.
40. Miroslavov A.E., Sidorenko G.V., Lumpov A.A.,
Suglobov D.N., Sizova O.V., Maltsev D.A., Gurzhiy V.V.,
54. Miroslavov A.E., Gorshkov N.I., Lumpov A.A.,
Polotskii Yu.S. // J. Organomet. Chem. 2012. Vol. 720.
Yalfimov A.N., Suglobov D.N., Ellis B.L.,
P. 1-6.
Braddock R., Smith A.M., Prescott M.C., Lawson R.S.,
41. Григорьев М.С., Мирославов А.Е., Сидоренко Г.В.,
Sharma H.L. // Nucl. Med. Biol. 2009. Vol.
36.
Суглобов Д.Н. // Радиохимия. 1997. Т. 39, № 3.
P. 73-79.
С. 207-209.
55. Gorshkov N.I., Levitskaya E.M., Lumpov A.A.,
42. Батурин Н.А., Григорьев М.С., Крючков С.В., Ми-
Miroslavov A.E., Sidorenko G.V., Suglobov D.N. //
рославов А.Е., Сидоренко Г.В., Суглобов Д.Н. // Ради-
Labeling of Small Biomolecules Using Novel
охимия. 1994. Т. 36, № 3. С. 199-201.
Technetium-99m Cores: Tech. Rep. Ser. no. 459. Vienna:
43. Григорьев М.С., Мирославов А.Е., Сидоренко Г.В.,
IAEA, 2007. Ch. 7. P. 233-248.
Стручков Ю.Т., Суглобов Д.Н., Яновский А.И. // Ра-
56. Мирославов А.Е. Карбонильные комплексы техне-
диохимия. 1995. Т. 37, № 3. С. 193-195.
ция(I)-99 и 99m: синтез, структура, координацион-
44. Горшков Н.И., Мирославов А.Е., Лумпов А.А.,
ная химия в растворах: Дис
д.х.н. СПб.: Радиевый
Суглобов Д.Н. // Радиохимия. 2000. Т. 42, № 3.
ин-т им. В. Г. Хлопина, 2009.
С. 213-217.
45. Kodina G.E., Malysheva A.O., Klement’eva O.E.,
57. Наумова Ю.А., Мирославов А.Е., Сидоренко Г.В. //
Inkin A.A., Gorshkov N.I., Lumpov A.A., Suglo-
IX Рос. конф. с междунар. участием «Радиохимия
bov D.N. // J. Nucl. Radiopharm. Sci. 2005. Vol. 6, N 3.
2018»: Тез. докл. СПб., 17-21 сентября 2018 г. С. 508.
РАДИОХИМИЯ том 63 № 3 2021