РАДИОХИМИЯ, 2021, том 63, № 3, с. 213-219
УДК 621.039.73
РУТЕНИЙ В ТЕХНОЛОГИИ ОСТЕКЛОВЫВАНИЯ
РАДИОАКТИВНЫХ ОТХОДОВ
(ОБЗОР НАУЧНО-ТЕХНИЧЕСКОЙ ИНФОРМАЦИИ)
© 2021 г. О. А. Устинов, С. А. Якунин, Ю. А. Воскресенская*
Высокотехнологический научно-исследовательский институт неорганических материалов
им. акад. А. А. Бочвара, 123098, Москва, ул. Рогова, д. 5а
*e-mail: YAVoskresenskaya@bochvar.ru
Получена 12.02.2020, после доработки 25.11.2020, принята к публикации 01.12.2020
Применительно к технологии остекловывания радиоактивных отходов установлено, что в растворах азот-
ной кислоты рутений существует в виде нитратных комплексов, которые при нагревании разлагаются с
выделением летучего RuO4 при концентрации азотной кислоты выше 4 М. и при наличии разлагающихся
при нагревании до NO2 нитратов. Выделение RuO4 при нагревании азотнокислых растворов подавляет-
ся введением восстановителей или удалением азотной кислоты из зоны реакции. Снижение летучести
рутения возможно также созданием холодного защитного слоя на поверхности расплавленного стекла.
RuO4 неустойчив при температуре выше 100°С и разлагается до нелетучего RuO2, который каталитически
ускоряет реакцию разложения. Наличие металлических поверхностей также ускоряет процесс разложе-
ния RuO4. Рассмотрены способы улавливания рутения из газовой фазы, показана нецелесообразность
использования силикагеля для улавливания рутения.
Ключевые слова: ОЯТ, переработка, радиоактивные отходы, кальцинация, остекловывание, рутений.
DOI: 10.31857/S0033831121010023
ВВЕДЕНИЕ
настоящей статье собраны и рассмотрены сведения
о формах существования рутения в азотнокислых
При переработке отработавшего ядерного то-
растворах, об условиях его перехода в газовую
плива (ОЯТ) образуются жидкие радиоактивные от-
фазу в виде RuO4, о его устойчивости и о способах
ходы, содержащие основную массу продуктов деле-
улавливания из газового потока.
ния, в том числе и рутений, β-активность которого
Соединения рутения в азотнокислых рас-
составляет около 60% активности всех продуктов
творах. В литературе приводятся соединения ру-
деления [1]. Рутений в ОЯТ содержится в виде не-
тения в азотнокислых растворах: нитрозотрини-
скольких изотопов, из которых два радиоактивных:
трат рутения в двух формах: RuNO(NO3)3·4H2O
103Ru (период полураспада 39.5 сут), 106Ru (период
и RuNO(NO3)3·2H2O; нитрозодинитрат рутения
полураспада 1.01 года) [2].
RuNO(NO3)2·H2O и предполагаемый двуядерный
При растворении ядерного топлива в азотной
нитрозонитрат (RuNO)2(NO3)4. Следует отметить,
кислоте рутений может переходить в раствор в виде
что нитрозотринитрат рутения RuNO(NO3)3·4H2O
нитрозонитратных, нитрозонитро- и нитрозонитро-
образуется в растворе азотной кислоты при восста-
нитратных комплексов.
новлении оксидом азота тетраоксида рутения или
В литературе содержится много информации о
при действии на него концентрированной азотной
свойствах рутения, но обобщающая характеристика
кислоты [3].
его поведения в технологии остекловывания
Нитрозотринитрат рутения термически неустой-
отсутствует. Для освещения этого вопроса в чив, при температуре выше 130°С разрушается с
213
214
УСТИНОВ и др.
40
В работе [7] обнаружено, что в азотнокислых рас-
творах с концентрацией HNO3 0.1-3 М. помимо ни-
тратных комплексов присутствуют нитрокомплек-
30
сы нитрозила рутения [Ru(NO)(H2O)(NO2)3(OH)]-
(ранее описанные в работе [6]), которые обладают
значительной химической устойчивостью. При
20
увеличении концентрации кислоты в растворе сна-
чала увеличивается количество комплексных форм
рутения. Последующий рост кислотности среды
приводит к последовательному замещению нитро-
10
и нитритолигандов на воду
{Ru(NO)Ln}(3-n)+ + H+ + H2O =
0
={Ru(NO)(H2O)Ln-1}(2-n)+ + HNO2,
(3)
0
1
2
3
4
Концентрация азотной кислоты, М.
где L = ONO-, NO–, сопровождающемуся появле-
нием в системе комплексов рутения с координи-
рованным нитрат-ионом, доля которых становится
Рис. 1. Летучесть рутения в зависимости от концентра-
существенной при концентрации HNO3 более 1 М.:
ции азотной кислоты в ВАО (тигельное кальцинирование
при 350°С) [8].
{Ru(NO)(H2O)(NO2)m}(3-m)+ + NO3- =
(4)
={Ru(NO)(NO2)m(NO3)}(2-m)+ + H2O.
выделением азотнокислых паров и уносом рутения
[4]. Нитрозотринитрат рутения гидролизуется в
Относительно слабые рутенийнитрозилнитрат-
водном растворе по реакциям (1), (2) [3]:
ные комплексы в присутствии азотистой кислоты
могут быть превращены в рутенийнитрозил-нитро-
[RuNO(NO3)3(H2O)2] + H2O =
комплексы, которые разлагаются при 170°С с обра-
= [RuNO(NO3)2OH(H2O)2] + HNO3,
(1)
зованием летучего RuO4 [8, 9].
[RuNO(NO3)2 OH(H2O)2] + H2O =
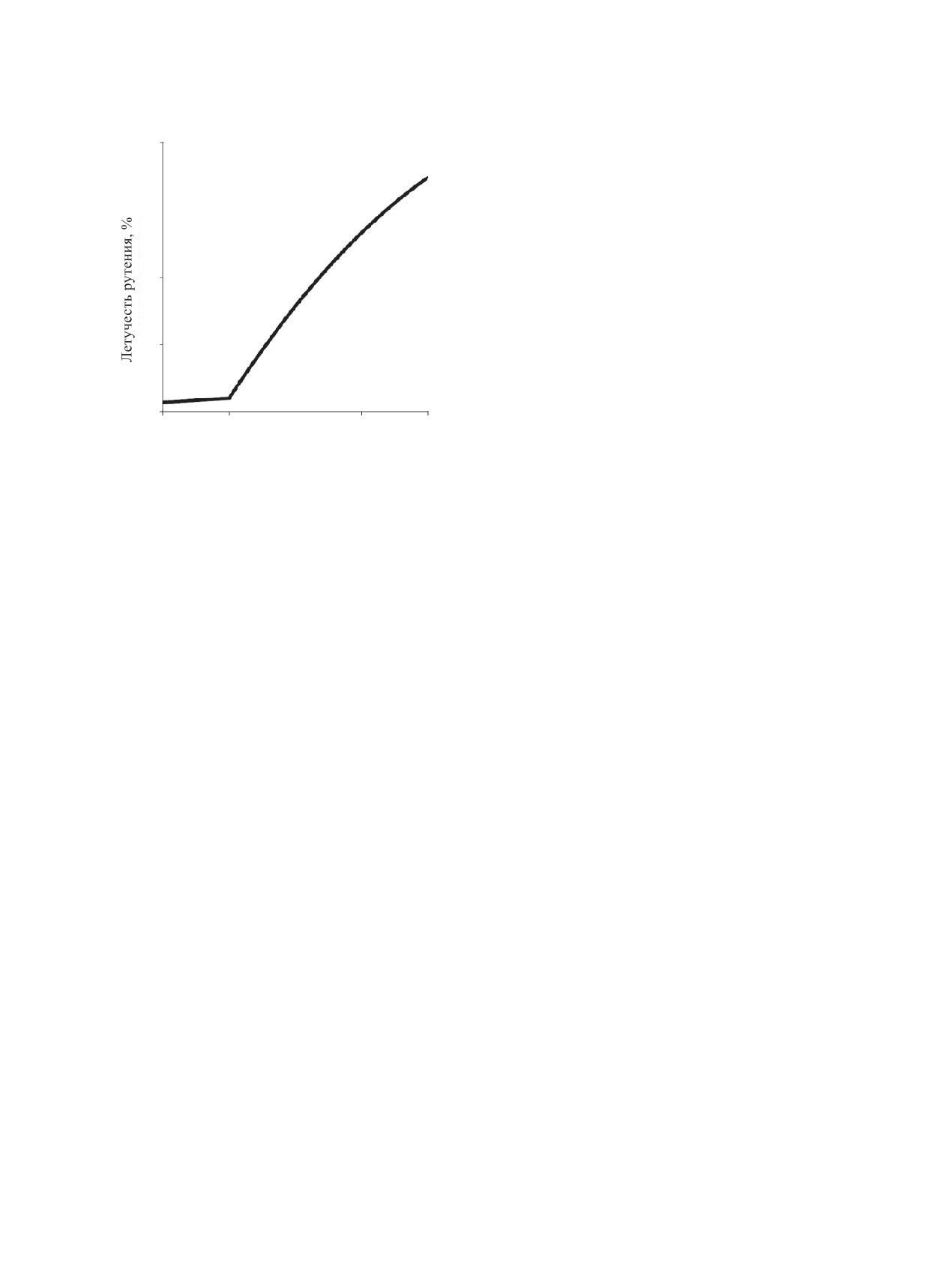
В работе [8] приводится график зависимости
= [RuNO(NO3)(OH)2(H2O)2] + HNO3.
(2)
летучести рутения от концентрации HNO3 в рас-
Нитрозодинитратные соединения RuNO(NO3)2·
творах, подвергаемых кальцинации (рис. 1). Под
2H2O и RuNO(NO3)2·3H2O образуются при восста-
летучестью здесь и далее понимается доля рутения,
новлении RuO4 оксидом азота в сильно разбавлен-
выделяющегося в газовую фазу.
ном азотнокислом растворе. Нитрозодинитратные
Летучесть рутения зависит также от поступле-
соединения, по данным работы [3], термически
ния диоксида азота при разложении присутствую-
устойчивы.
щих в маточнике нитратов [10]. Это наглядно видно
Авторы работы [4] обобщают: рутений в азотно-
на рис. 2. Начало интенсивного разложения нитрата
кислых растворах присутствует в виде ранее иден-
обеспечивает повышение летучести рутения.
тифицированного и описанного ряда соединений
Итак, литературные данные по соединениям
RuNO(NO3)x(OH)3-x(H2O)2, причем х изменяется, в
рутения в азотнокислых растворах, полученные в
частности, в зависимости от концентрации NO–.
1950-1960-х гг. в чисто химических исследованиях
Более широкое обобщение приводится в ра-
[3, 6, 9, 11], используются в более поздних иссле-
боте [5], в которой отмечены формы нитрозони-
дованиях процессов переработки радиоактивных
трата рутения(III) типа [RuNO(NO3)n(H2O)5-n]3-n
отходов, в т.ч. остекловывания [2, 8, 10].
или
[RuNO(NO3)5-n-mOHm(H2O)n]p- (ранее опи-
Летучесть рутения. В литературе приво-
санные в работе
[6]), либо форма полимер-
дятся различные данные по летучести руте-
ных аквагидроксокатионов рутения(IV) типа
ния. При кальцинации раствора, имитирующего
[Ru(OH)x(H2O)6-x](NO3)4-x. Также в растворе могут
концентрат низкообогащенных отходов (low
присутствовать и ионы Ru(III) при наличии окисля-
enriched waste concentrate, LEWC) и содержащего,
ющих агентов.
наряду с 84 г/дм3 нитратов различных металлов,
РАДИОХИМИЯ том 63 № 3 2021
РУТЕНИЙ В ТЕХНОЛОГИИ ОСТЕКЛОВЫВАНИЯ
215
сообщалось, что при кальцинации в кипящем слое
имитаторов отходов переработки топлива легково-
дного реактора (light water reactor, LWR) при 375°С
в газовую фазу выделялось до 100% рутения.
Информация по различиям в летучести рутения
представлена в обобщающем материале МАГАТЭ
[2], где также показано влияние разложения нитра-
тов.
Различие в летучести рутения авторы работы [8]
объясняют следующим образом. Термическая де-
нитрация соли приводит к удалению NOx с образо-
ванием щелочного осадочного кальцината (оксида
металла). Щелочная оксидная матрица фиксирует
рутений в форме рутената и подавляет образова-
-, %
Потери NO3
ние летучего RuO4, который обычно образуется при
Рис. 2. Летучесть рутения в зависимости от концентра-
концентрировании раствора HNO3. Если термиче-
ции нитрат-иона при термическом разложении имитато-
ская денитрация медленная, добавление кислотной
ра отходов переработки топлива Magnox [9].
загрузки приводит к созданию высокой местной
кислотности с выделением летучего RuO4, т.е. по-
─ способствует летуче-
вышение концентрации NO3
1 г/дм3 RuNO(NO3)x, при 1100°С в отходящие газы
сти рутения.
выделялось до 7 % Ru [12].
Некоторые данные по испарению и удержанию
При остекловывании растворов, имитирующих
рутения перечислены в табл. 1.
отходы пурекс-процесса, летучесть рутения колеба-
Свойства RuO4. Температура плавления RuO4
лась от 6.1 до 15%, что зависело, по мнению авто-
25.4°С, при нагревании от комнатной температуры
ров, от возрастания содержания сульфатов и увели-
до 100-110°С RuO4 разлагается со взрывом, пары
чения диаметра кальцинатора [13].
устойчивы только при температуре выше 1000°С.
При повышенной температуре наблюдалось
При высокой температуре пары тетраоксида руте-
уменьшение летучести рутения. Так, в работе [14]
ния очень устойчивы и их разложение имеет об-
сообщалось о летучести рутения в процессе каль-
ратимый характер. Это связано с тем, что реакция
цинации модельных растворов ~17% при 300°С,
образования тетраоксида рутения из металла и кис-
~3.5% при 400°С, < 1% при 500-800°С.
лорода менее экзотермична, чем реакция образова-
В работе [8] сообщалось о выделении 15% ру-
ния диоксида рутения. Поэтому при температурах
тения в виде RuO4 при кальцинации и остекловы-
выше 1000°С, когда в уравнении для свободной
вании высокоактивных отходов (ВАО) на пилотной
энергии (ΔG = ΔH - TΔS) энтропийный член стано-
установке. Выделение рутения возрастало до 30%
вится больше энтальпийного, термодинамическое
при 180°С в результате внесения в упариваемый
равновесие между диоксидом и тетраоксидом руте-
раствор нитрата натрия. Авторы объясняют это
ния смещается в сторону образования тетраоксида,
образованием достаточно высокого количества ни-
и диоксид диссоциирует на тетраоксид и металл.
трат-ионов в жидкой фазе, которые окисляют руте-
Ниже 600°С преобладающей реакцией является
ниевые компоненты до RuO4 [15].
разложение тетраоксида на диоксид и кислород [3].
При кальцинации при 350°С нитратных ВАО, со-
Найдено
[18], что кинетика восстановления
держащих 4 М. HNO3, в газовую фазу выделялось
RuO4 зависит от присутствия водяного пара. Влаж-
около 30% рутения [16].
ность, по-видимому, играет роль катализатора, так
же как и присутствие осадка диоксида рутения.
В работе [4] утверждается, что испаряемое коли-
чество рутения в зависимости от рабочих условий
Авторы работы [10] провели исследование ста-
может достигать 50% от введенного. В работе [17]
бильности RuO4 и установили следующее: RuO4
РАДИОХИМИЯ том 63 № 3 2021
216
УСТИНОВ и др.
Таблица 1. Испарение и удержание рутения в различных процессах отверждения жидких ВАО (средние величины) [2]
Потери Ru в газовую
Тип кальцинации
Завод/проекта
Страна
фазу,б %
Кальцинация в кипящем слое
WCFв
США
50г
WSEP
США
60д
Распылительная кальцинация
HLWIP
США
10-3-10-1
Кальцинирование во вращающейся печи
AVM
Франция
30
WSEP
США
20
Fingal
Великобритания
30
Тигельная кальцинация
Harvest
Великобритания
40е
Piver
Франция
15
–
Индия
20
-
СССР
80
Керамический плавитель с жидкой
-
США
10-1
загрузкой
-
ФРГ
20
а WCF - Waste Calcination Facility; WSEP - Waste Solidification Engineering Prototypes; HLWIP - High-Level Waste Immobilization
Program.
б Включая рутений в газообразной форме и частицы; без восстановителей.
в Без остекловывания.
г С непрямым нагревом; в кипящем слое потери рутения в 10 раз меньше.
д С непрямым нагревом; в кипящем слое потери рутения около 10%.
е Загрузка пульпой; загрузка частицами около 10%.
разлагается при температуре выше 120°С в течение
кислоте, или при взаимодействии RuO4 c NOx. По
десятков секунд; моментальное разложение проис-
утверждению авторов указанной работы, RuNO бо-
ходит в присутствии восстанавливающих веществ,
лее стабилен, чем RuO4, легче адсорбируется на си-
таких как NO и HNO2.
ликагеле (десятикратное увеличение емкости) при
температуре до 120°С, каталитически восстанавли-
На металлических поверхностях при температу-
вается на Fe/Cr при 300°C, имеет более низкое дав-
ре выше 100°С RuO4 разлагается или до RuO2, или
ление пара, чем RuO4. При 20°С парциальное дав-
до металлического рутения, который взаимодей-
ление RuNO ниже 196 Па, тогда как соответствую-
ствует с металлической поверхностью. RuO2 или
щее парциальное давление RuO4 составляет 980 Па.
металлический рутений взаимодействует с новой
порцией RuO4, обеспечивая таким образом проте-
Однако авторы работы [10] при изучении раство-
кание автокаталитической реакции [4, 8].
рения имитатора топлива Magnox отметили отсут-
ствие убедительных доказательств существования
RuO4, обладая значительной растворимостью в
летучего соединения нитрозила рутения или других
кислотных растворах (0.07-0.10 ммоль/дм3) восста-
газообразных соединений Ru, кроме RuO4.
навливается в них пероксидом водорода, образую-
щимся при облучении воды или азотистой кислоты
Снижение летучести рутения. Как сказано
[9, 19].
выше, снижению летучести рутения способству-
ет связывание его в нелетучие рутенаты отгонкой
В случае присутствия в газовом потоке
азотнокислых паров [8].
NO2 вместе с RuO4 при мольном соотношении
NO2/RuO4 = 189 доля тетраоксида рутения в газо-
Другим способом фиксации соединений рутения
вой фазе снижается в 168 раз, а в присутствии NO в
в азотнокислых растворах и уменьшения его лету-
соотношении NO/RuO4 = 22 - в 1180 раз [20].
чести является использование восстановителей,
таких как фосфит, гипофосфит, нитрит, формальде-
В работе [12] помимо RuO4 упоминается летучее
соединение нитрозилрутения RuNO, которое обра-
гид, муравьиная кислота и сахар. Восстановители
зуется или путем частичного разложения нитрозил-
(например, NO, H2O2) могут образовываться в рас-
нитрата при прокаливании его растворов в азотной
творе в результате радиолиза [2].
РАДИОХИМИЯ том 63 № 3 2021
РУТЕНИЙ В ТЕХНОЛОГИИ ОСТЕКЛОВЫВАНИЯ
217
Наиболее применяемым способом минимизации
В окончательном проекте установки Pamela было
летучести RuO4 является разложение HNO3 добав-
решено отказаться от силикагелевого фильтра.
лением муравьиной кислоты [8]. Как сообщалось
Югославские авторы [25] обсуждали адсорб-
в этой работе, из кислотных ториевых нитратных
цию газообразного RuO4 на голубом силикагеле,
отходов при температуре 250-300°С испарялось
который содержал железо, кобальт, никель и хром.
26.2 и 27.5% рутения соответственно. Когда эти же
Испытания проводили при 25°С, относительной
отходы предварительно обрабатывали муравьиной
влажности 60% и времени контакта 0.3 с. В этих
кислотой в количестве 2.0 моль на моль нитрата,
испытаниях было показано, что голубой силикагель
доля испарения снижалась до 0.07 и 0.15% соответ-
удерживал 97.3-99.9% испаренного рутения. При
ственно. Испарение могло быть снижено до 0.007%
этом на гранулах силикагеля образовывался черный
добавлением 15%-ного избытка муравьиной кисло-
осадок. По-видимому, примеси восстанавливали
ты. Декарбоксилирование рутениевоформиатного
RuO4 до RuO2.
комплекса ведет к образованию нелетучего RuO2.
На силикагеле получен высокий КО (>100) при
Для восстановления RuO4 также могут быть добав-
температуре ниже 90°С (но выше точки росы газо-
лены малые количества щавелевой кислоты [8]. По
вого потока), и силикагель мог быть частично ре-
утверждению авторов работы [21], RuO4 в водных
генерирован промывкой водой и полностью регене-
растворах восстанавливается большинством орга-
рирован промывкой 0.1 М. азотной кислотой. Более
нических веществ до гидратированного диоксида.
поздний опыт показал, что примеси (в частности,
Еще одним способом снижения летучести руте-
железо) в первоначально использованном силика-
ния является создание холодного слоя над распла-
геле имели значительное влияние на возможность
вом стекла, что существенно (в 6-10 раз) снижает
удаления Ru, т.е. силикагель адсорбирует RuO4, а
летучесть рутения [22, 23].
примесь железа его восстанавливает до RuO2 [26].
Улавливание летучего рутения. В нашей пре-
В работах [27, 28] серьезная надежда возлагалась
дыдущей работе способы улавливания тетраоксида
на колонны, заполненные силикагелем в качестве
рутения подробно перечислены и систематизирова-
сорбента для улавливания RuO4. Для регенерации
ны [24]. Они включают жидкостные, сорбционные
силикагеля рутений вымывали из колонны водой
на твердых сорбентах (силикагель, оксид железа,
(примерно 90% адсорбированных соединений руте-
оксид хрома), хемосорбционные на угле, пропитан-
ния могут быть смыты горячей водой), т.е. улавли-
ном триэтилендиамином, а также каталитические
вание силикагелем является ненадежной фиксацией
восстановительные.
рутения.
Отдельного рассмотрения требует вопрос при-
Если использовать силикагель, то его надо или
менения силикагеля для улавливания RuO4.
нагреть выше 110°С, или пропитать восстановите-
В проекте Pamela [12] применительно к техно-
лями. Но силикагель неустойчив при температур-
логии остекловывания рассмотрена физическая
ных и влажностных перепадах, гигроскопичен и
адсорбция на силикагеле при температуре ниже
подвержен радиационному разрушению; следова-
80°С, выше этой температуры адсорбционная спо-
тельно, применять его для улавливания RuO4 в лю-
собность резко снижается. Вторым барьером для
бом виде нецелесообразно.
Ru в проекте после пылевого скруббера в линии
отходящего газа изначально был слой силикагеля,
ЗАКЛЮЧЕНИЕ
работающий при 120°С. Такой фильтр, который да-
вал великолепные результаты, когда помещался на
Летучесть рутения в зависимости от условий
выходе из кальцинатора, оказался бесполезным по-
процесса изменяется в широких пределах. Показа-
сле пылевого скруббера. Это может быть объяснено
но, что рутений в растворах азотной кислоты суще-
тем, что фильтры из силикагеля были разработаны
ствует в виде многочисленных комплексов, которые
для улавливания газообразных соединений руте-
при нагревании разлагаются с выделением летучего
ния, тогда как после насадочного пылевого скруб-
RuO4 при условии концентрации азотной кислоты
бера присутствуют только твердые аэрозоли RuO2.
выше 4 М. и при наличии разлагающихся до NO2
РАДИОХИМИЯ том 63 № 3 2021
218
УСТИНОВ и др.
нитратов. RuO4 неустойчив при температурах выше
te: Oak Ridge Natl. Lab. Rep. ORNL-5562. 1980. 49 p.
100°С и разлагается до нелетучего RuO2, наличие
9. Fletcher J.M. // J. Inorg. Nucl. Chem. 1958. Vol. 8.
которого катализирует разложение RuO4. Нали-
P. 277-287.
чие металлических поверхностей также ускоряет
10. Cains P.W., Yewer K.C., Waring S. Radiochim. Acta.
процесс разложения RuO4. Выделение RuO4 при
1992. Vol. 56. P. 99-104.
нагревании азотнокислых растворов подавляется
11. Fletcher J.M., Jenkins I.L., Lever F.M., Martin F.S.,
введением восстановителей или удалением азотной
Powell A.R., Todd R. // J. Inorg. Nucl. Chem. 1955.
кислоты из зоны реакции. Снижение летучести ру-
Vol. 1. P. 378-401.
тения возможно также созданием защитного холод-
12. Klein M., Weyers C., Goossens W.R.A. // Proc. 18th
ного слоя на поверхности расплавленного стекла.
DOE Nuclear Airborne Was te Management and
Рассмотрены способы улавливания рутения из га-
Air Cleaning Conf. Held in Baltimore, Maryland,
зовой фазы, показана нецелесообразность исполь-
12-16 Augus t, 1984. CONF-840806. 1985. Vol. 1.
зования силикагеля.
P. 702-731.
13. McElroy J.L., Hartley J.N., Mendel J.E.,
Richardson G.L. Pot Solidification Performance
КОНФЛИКТ ИНТЕРЕСОВ
during Final Radioactive Tets in Waste Solidification
Engineering Prototypes. Was te Solidification Program.
Авторы звявляют об отсутствии конфликта ин-
Vol.
9.
BNWL-1628. Richland, Washington:
тересов.
Battelle Pacific Northwest Lab., 1972. 216 p.
14. Igarashi H., Kato K., Takahashi T. // J. Nucl. Sci.
СПИСОК ЛИТЕРАТУРЫ
Technol. 1992. Vol. 29. P. 576-581.
15. Kayo S., Yasuyuki U., Youichi E. // Procedia Chem. 2016.
1.
Matus L., Prokopiev O., Alföldy B., Pinter A., Hozer Z.
Vol. 21. P. 82-86.
Oxidation and Release of Ruthenium in High
16. Ross W.A., Mendel J.E., Bradley D.J., Roberts F.P.,
Temperature Air. Budapes t: KFKI Atomic Energy
Bunnell L.R., Turcotte R.P., Gray W.J., Wald J.W.,
Research Institute, 2002. 44 p.
Katayama Y.B., Weber W.E., Mellinger G.B.,
2.
Control of Semivolatile Radionuclides in Gaseous
Wes tsik J.H. Annual Report on the Characteris tics
Effluents at Nuclear Facilities: Tech. Rep. Ser. N 220.
of High-Level Waste Glasses. BNWL-2252. Richland,
Vienna: IAEA, 1982. 68 p.
Washington: Battelle Pacific Northwes t Lab.,
3.
Звягинцев О.Е., Колбин Н.И., Рябов А.Н., Автокра-
1977. P. 81.
това Т.Д., Горюнов А.А. Химия рутения. М.: Наука,
17. Korn D., McWhorter R., Field E.L., Raudenbush M.,
1965. 300 с.
Goldstein L., Stoller S.M. Technical Support of Standards
4.
Jouan A., Bonniaud R., Laude F., Sombret C. // Proc.
for High-level Radioactive Waste Management. Vol. B:
Seminar on Radioactive Effluents from Nuclear Fuel
Engineering Controls. EPA 520/4-79-007B. Cambridge,
Reprocessing Plants (Karlsruhe, Nov. 23-25, 1977).
Massachusetts: Arthur D. Little, 1977. 273 p.
Luxembourg: Commission of European Communities,
18. Mun C., Cantrel L., Madic C. // Radiochim. Acta. 2007.
1978. P. 621-652.
Vol. 95. P. 643-656.
5.
Гинзбург С.И., Езерская Н.А., Прокофьева И.В. Ана-
19. Anderson J.S., McConnell J.D.M. // J. Inorg. Nucl.
литическая химия платиновых металлов. М.: Наука,
Chem. 1955. Vol. 1, N 6. P. 371-377.
1972. 616 с.
20. Mun C., Cantrel L., Madic C. // Nucl. Technol. 2006.
6.
Walles R.M. // J. Inorg. Nucl. Chem. 1961. Vol. 20.
Vol. 156, N 3. P. 332-346.
P. 283-289.
21. Matsuoka S., Kodama T., Izumi I. // J. Nucl. Sci. Technol.
7.
Кабин Е.В. Образование и превращения нитрато-
2004. Vol. 41, N 4. P. 466-472.
комплексов нитрозорутения в нитритно-нитратных
22. Goles R.W., Perez J.M., MacIsaac B.D., Siemer D.D.,
азотнокислых растворах: Автореф. дис. … к. х. н.
Новосибирск: ИНХ СО РАН, 2012. 24 с.
McCray J.A. Test Summary Report INEEL Sodium-
Bearing Was te Vitrification Demons tration
8.
Rimshaw S.J., Case F.N., Tompkins J.A. Volatility of
RSM-01-1. PNNL-13522. Richland, Washington:
Ruthenium-106, Technetium-99 and Iodine-129, and
Pacific Northwes t National Lab., 2001. 225 p.
the Evolution of Nitrogen Oxide Compounds during the
Calcination of High-Level, Radioactive Nitric Acid Was
23. Goles R.W., Del Debbio J.A., Kirkham R.J., MacIsaac J.A.,
РАДИОХИМИЯ том 63 № 3 2021
РУТЕНИЙ В ТЕХНОЛОГИИ ОСТЕКЛОВЫВАНИЯ
219
McCray J.A., Siemer D.D., Soelberg N.R. Test
of Gaseous Radioactive Was te. Annex to Treatment
Summary
Report
INEEL
Sodium-Bearing
of Radioactive Gaseous Was te. Vienna: IAEA, 2014.
Was te Vitrification Demons tration RSM-01-2. PNNL-
494 p.
13869. Richland, Washington: Pacific Northwest
27. Christian J.D., Pence D.T. Critical Assessment of
National Lab., 2002. 18 p.
Methods for Treating Airborne Effluents from
24. Воскресенская Ю.А., Устинов О.А., Якунин С.А. //
High-level Was te Solidification Processes: Report
Атом. энергия. 2013. Т. 115, вып. 1. С. 155-158.
PNL-2486. Richland, Washington: Battelle Pacific
25. Vujisić Lj., Nikolić R. // Proc. 17th DOE/NRC Nuclear
Northwest Labs, 1977. 162 p.
Air Cleaning and Treatment Conf. Cambridge, MA:
28. Schindler R.E. // Proc. 15th DOE Nuclear Air Cleaning
Harvard Air Cleaning Lab., 1983. P. 123-130.
Conf. Held in Bos ton, MA, 7-10 Augus t 1978. 1979.
26. CD-ROM: Capture, Retention and Conditioning
Vol. 1. P. 82-94.
РАДИОХИМИЯ том 63 № 3 2021