РАДИОХИМИЯ, 2021, том 63, № 3, с. 227-235
УДК 548.736
СИНТЕЗ И РЕНТГЕНОСТРУКТУРНОЕ
ИССЛЕДОВАНИЕ ДИОКСАЛАТНЫХ КОМПЛЕКСОВ
УРАНИЛА И ПЛУТОНИЛА С КАРБАМИДОМ
© 2021 г. Л. Б. Сережкинаа,*, М. С. Григорьевб, Е. Ф. Рогалеваа,
А. М. Федосеевб, В. Н. Сережкина
а Самарский национальный исследовательский университет им. акад. С. П. Королева,
443011, Самара, ул. Акад. Павлова, д. 1;
б Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
*e-mail: lserezh@samsu.ru
Получена 27.02.2020, после доработки 18.05.2020, принята к публикации 25.05.2020
Проведено рентгеноструктурное исследование кристаллов двух оксалатсодержащих комплексов ура-
нила: (NH4)2UO2(C2O4)2·Urea·H2O (I), Rb2UO2(C2O4)2·Urea·H2O (II) и нового комплекса плутонила
(NH4)2PuO2(C2O4)2·Urea·H2O (III), где Urea - карбамид. Кристаллы I-III содержат островные комплексы
[AnO2(C2O4)2(Urea)]2- (An = U или Pu), принадлежащие к группе AB012M1 (A = UO22+ или PuO22+, B01 =
C2O2-, M1 = Urea). Установлена изоструктурность I-III. С помощью метода молекулярных полиэдров
Вороного-Дирихле обсуждено влияние природы внешнесферных катионов на особенности межмоле-
кулярных взаимодействий в структурах кристаллов.
Ключевые слова: комплексы, оксалаты, уранил, плутонил, рентгеноструктурный анализ, полиэдры
Вороного-Дирихле, ИК-спектры
DOI: 10.31857/S0033831121030047
Оксалаты актинидов давно и сравнительно
ка известна группа оксалатокомплексов состава
широко используются в разнообразных техноло-
R2UO2(C2O4)2·Urea·H2O (R = Na, K, Rb, Cs, NH4)
гических процессах. В частности, оксалат урани-
[19, 20], однако до настоящего времени установле-
ла и его производные применяют для очистки и
но строение только калиевого производного [21].
получения металлического урана и его оксидов, а
Данная работа предпринята с целью выяснения
также при переработке и утилизации ядерного то-
влияния природы внешнесферных одновалент-
плива [1]. Оксалат-ионы совместно с некоторыми
ных катионов и металла-комплексообразователя
другими представителями гомологического ряда
на строение кристаллов R2UO2(C2O4)2·Urea·H2O
[OOC-(CH2)n-COO]2- дианионов алифатических
(R = NH4 (I) или Rb (II), Urea - карбамид) и
α,-дикарбоновых кислот часто используются в
(NH4)2PuO2(C2O4)2·Urea·H2O (III).
качестве линкеров, связывающих атомы металлов
в структурах гибридных металлоорганических кар-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
касов (в том числе и уранорганических [2-12]), ко-
Соединения I и II синтезировали по ранее опи-
торые активно изучаются в последние десятилетия.
санным [19, 20] методикам.
Оксалатсодержащие соединения U(VI) чаще
всего принадлежат к классу гетеролигандных ком-
Новый комплекс (NH4)2PuO2(C2O4)2·Urea·H2O
плексов, в которых оксалат-ионы сосуществу-
(III) получали по следующей методике. Аликвоту
ют с ацидо- или электронейтральными лиганда-
0.1 мл раствора 239Pu(NO3)4 (0.02 ммоль) в трехмо-
ми разной природы [13-18]. Так, более полуве-
лярной азотной кислоте упаривали с концентри-
227
228
СЕРЕЖКИНА и др.
рованной хлорной кислотой. Полученный сухой
щение с использованием программы SADABS
остаток растворяли в 0.2 мл воды, добавляли 0.1 мл
[23]. Структуры расшифрованы прямым методом
насыщенного при комнатной температуре раствора
(SHELXS97
[24]) и уточнены полноматричным
оксалата аммония (0.04 ммоль) и 0.2 мл одномо-
методом наименьших квадратов (SHELXL-2014
лярного раствора карбамида (0.2 ммоль). Исходные
[25]) по F2 в анизотропном приближении для всех
мольные соотношения реагентов составляли 1 : 2
неводородных атомов. Атомы H групп NH2 разме-
: 10. Полученный раствор выдерживали при 6°C в
щены в геометрически вычисленных позициях с
течение нескольких часов до появления кристаллов
Uизо = 1.2Uэкв(N). Атомы H молекул воды и катионов
III.
аммония локализованы на разностных Фурье-син-
Рентгеноструктурный анализ. Рентгенодиф-
тезах электронной плотности и уточнены с Uизо =
ракционные эксперименты проведены на автома-
1.5Uэкв(O,N) и ограничением длин связей O-H и
тическом четырехкружном дифрактометре Bruker
угла H-O-H для молекул воды или с наложением
Kappa Apex II. Параметры элементарных ячеек
условий равенства длин связей N-H и углов H-N-H
уточнены по всему массиву данных по програм-
для катионов аммония. Кристаллографические ха-
ме SAINT-Plus [22]. В экспериментальные интен-
рактеристики и детали дифракционных экспери-
сивности рефлексов внесены поправки на погло-
ментов приведены в табл. 1. Значения основных
Таблица1.Кристаллографическиеданные,параметры экспериментаиуточнения структур(NH4)2UO2(C2O4)2·Urea·H2O
(I), Rb2UO2(C2O4)2·Urea·H2O (II) и (NH4)2PuO2(C2O4)2·Urea·H2O (III)
Параметр
I
II
III
Сингония, пространственная группа, Z
Моноклинная, P21/c, 4
a, Å
8.8353(3),
8.9061(11),
8.8453(3),
b, Å
6.4682(2),
6.5265(9),
6.3948(2),
c, Å
24.7305(6)
24.470(3)
24.6883(8)
β, град
94.875(1)
96.248(3)
95.381(2)
V, Å3
1408.20(7)
1413.9(3)
1390.31(8)
Dx, г/см3
2.642
3.265
2.695
μ, мм-1
11.599
18.386
4.815
T, К
100(2)
Излучение, λ, Å
MoKa, 0.71073
Размер образца, мм
0.12×0.10×0.08
0.24×0.12×0.10
0.18×0.08×0.04
Тип сканирования
φ и ω
Tmin, Tmax
0.405, 0.457
0.105, 0.261
0.698, 0.831
Область сбора данных по q, град
4.168, 29.997
4.188, 29.997
4.188, 29.997
Область h, k, l
-12 ≤ h ≤ 12,
-12 ≤ h ≤ 12,
-11 ≤ h ≤ 12,
-9 ≤ k ≤ 9,
-8 ≤ k ≤ 9,
-8 ≤ k ≤ 8,
–34 ≤ l ≤ 33
-34 ≤ l ≤ 34
-30 ≤ l ≤ 34
Число отражений: измеренных/
12916/4082,
15069/4115,
11547/4017,
независимых (N1), Rint/с I > 2σ(I) (N2)
0.0442/3090
0.0816/3203
0.0605/2983
Метод уточнения
Полноматричный МНК по F2
Число уточняемых параметров
229
205
229
Факторы недостоверности:
wR2 по N1
0.0467
0.0939
0.0603
R1 по N2
0.0259
0.0410
0.0342
S
0.997
0.986
0.966
Δρmax/Δρmin, e/Å3
0.883/-1.064
2.615/-3.812
1.150/-1.780
РАДИОХИМИЯ том 63 № 3 2021
СИНТЕЗ И РЕНТГЕНОСТРУКТУРНОЕ ИССЛЕДОВАНИЕ
229
Таблица 2. Геометрические характеристики полиэдров An в структурах I, II и III
Структура I, пентагональная бипирамида UO7
Связь
d, Å
Ω, %a
Угол
ω, град
U1-O1
1.773(3)
21.32
O1U1O2
178.95(12)
U1-O2
1.773(3)
21.36
O11U1O9
78.22(9)
U1-O3
2.408(3)
10.55
O7U1O9
66.46(9)
U1-O5
2.402(2)
11.13
O11U1O5
79.15(10)
U1-O7
2.342(3)
11.31
O7U1O3
70.16(9)
U1-O9
2.374(3)
11.32
O5U1O3
66.01(9)
U1-O11
2.298(3)
13.02
Структура II, пентагональная бипирамида UO7
Связь
d, Å
Ω, %a
Угол
ω, град
U1-O1
1.781(6)
21.24
O2U1O1
178.6(2)
U1-O2
1.772(5)
21.37
O3U1O8
78.64(18)
U1-O3
2.324(5)
12.75
O8U1O10
66.61(17)
U1-O4
2.400(5)
11.05
O10U1O6
71.00(17)
U1-O6
2.391(5)
10.77
O3U1O4
77.74(18)
U1-O8
2.356(5)
11.64
O6U1O4
66.05(18)
U1-O10
2.358(5)
11.17
Структура III, пентагональная бипирамида PuO7
Связь
d, Å
Ω, %a
Угол
ω, град
Pu1-O1
1.737(4)
21.70
O1Pu1O2
179.20(18)
Pu1-O2
1.744(4)
21.64
O11Pu1O9
78.83(13)
Pu1-O3
2.410(4)
10.42
O7Pu1O9
67.30(13)
Pu1-O5
2.399(4)
10.95
O11Pu1O5
76.99(13)
Pu1-O7
2.336(4)
11.23
O5Pu1O3
66.69(13)
Pu1-O9
2.366(4)
11.33
O7Pu1O3
70.20(13)
Pu1-O11
2.303(4)
12.74
a - здесь и далее телесный угол (в процентах от полного телесного угла 4π ср), под которым общая грань ПВД соседних атомов
видна из ядра любого из них.
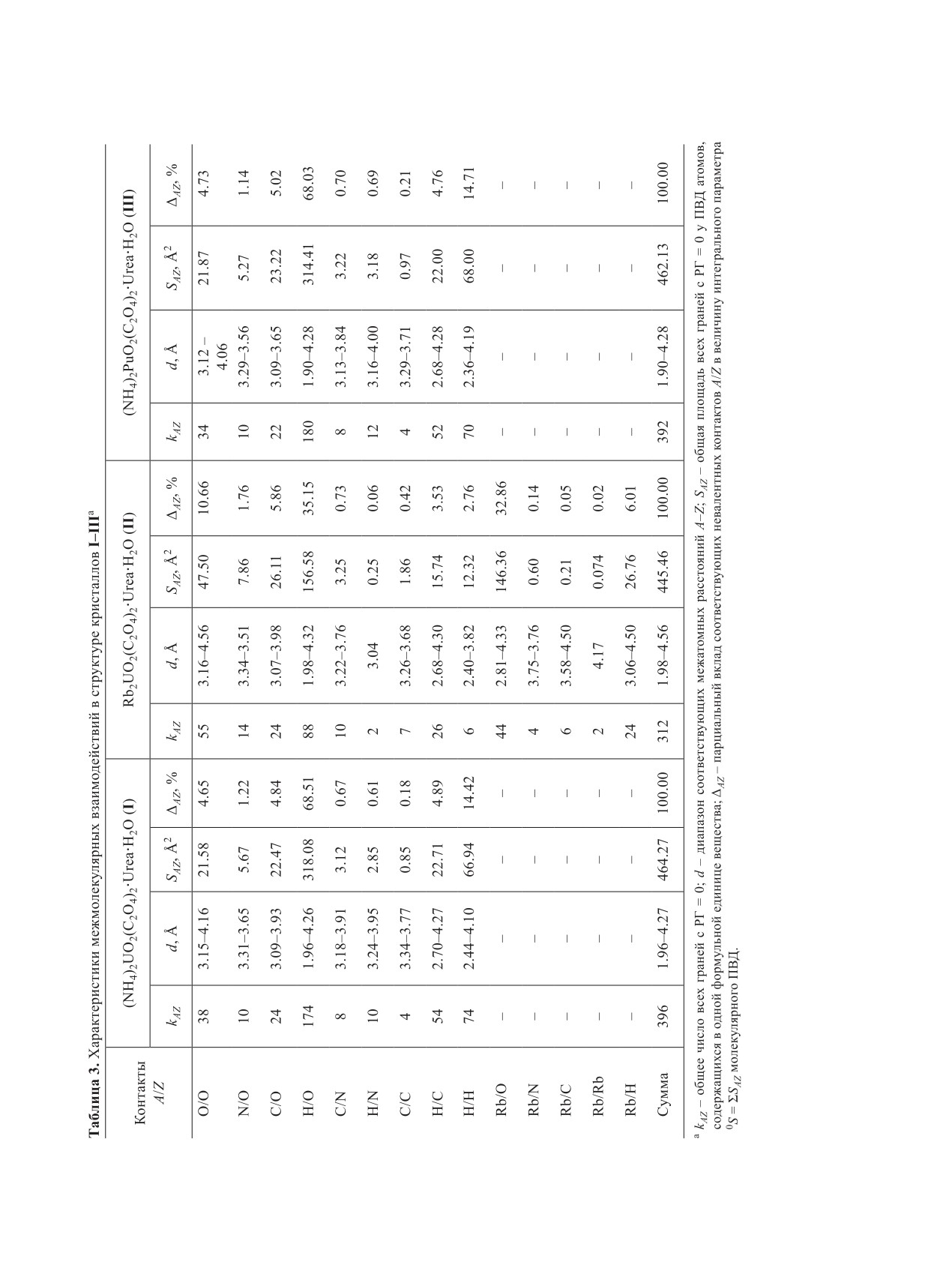
длин связей и валентных углов для полиэдров AnO7
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
приведены в табл. 2. Для определения координаци-
Полученные рентгенографические данные сви-
онных чисел (КЧ) атомов использовали метод пере-
детельствуют об изоструктурности соединений I-
секающихся сфер [26]. Координаты атомов и вели-
III и калиевого аналога [21], кристаллизующихся
чины температурных параметров кристаллических
в пространственной группе Р21/c. Атомы актинида
структур I-III депонированы в Кембриджском цен-
(An = U или Pu) проявляют КЧ 7. Координационны-
тре кристаллографических данных под номерами
ми полиэдрами (КП) An являются пентагональные
CCDC 1971566, 1971567 и 1971568 соответственно.
бипирамиды, на главной оси которых находятся
ИК спектры измерены при комнатной темпера-
атомы кислорода актинильных групп AnO22+. Диок-
туре в диапазоне 500-4000 см-1 на Фурье-спектро-
сокатионы AnO2+ имеют практически симметрич-
метре ФТ-801. Образцы готовили прессованием
ное (расстояния U-O равны 1.772 и 1.773 Å (I),
таблеток с KBr. Отнесение полос поглощения вы-
1.781 и 1.772 Å (II), а расстояния Pu-O - 1.737 и
полнено с учетом работ [27-29].
1.744 Å) и линейное строение (O-An-O ≈ 179°).
РАДИОХИМИЯ том 63 № 3 2021
230
СЕРЕЖКИНА и др.
Rb(2)
Rb(2)
Rb(1)
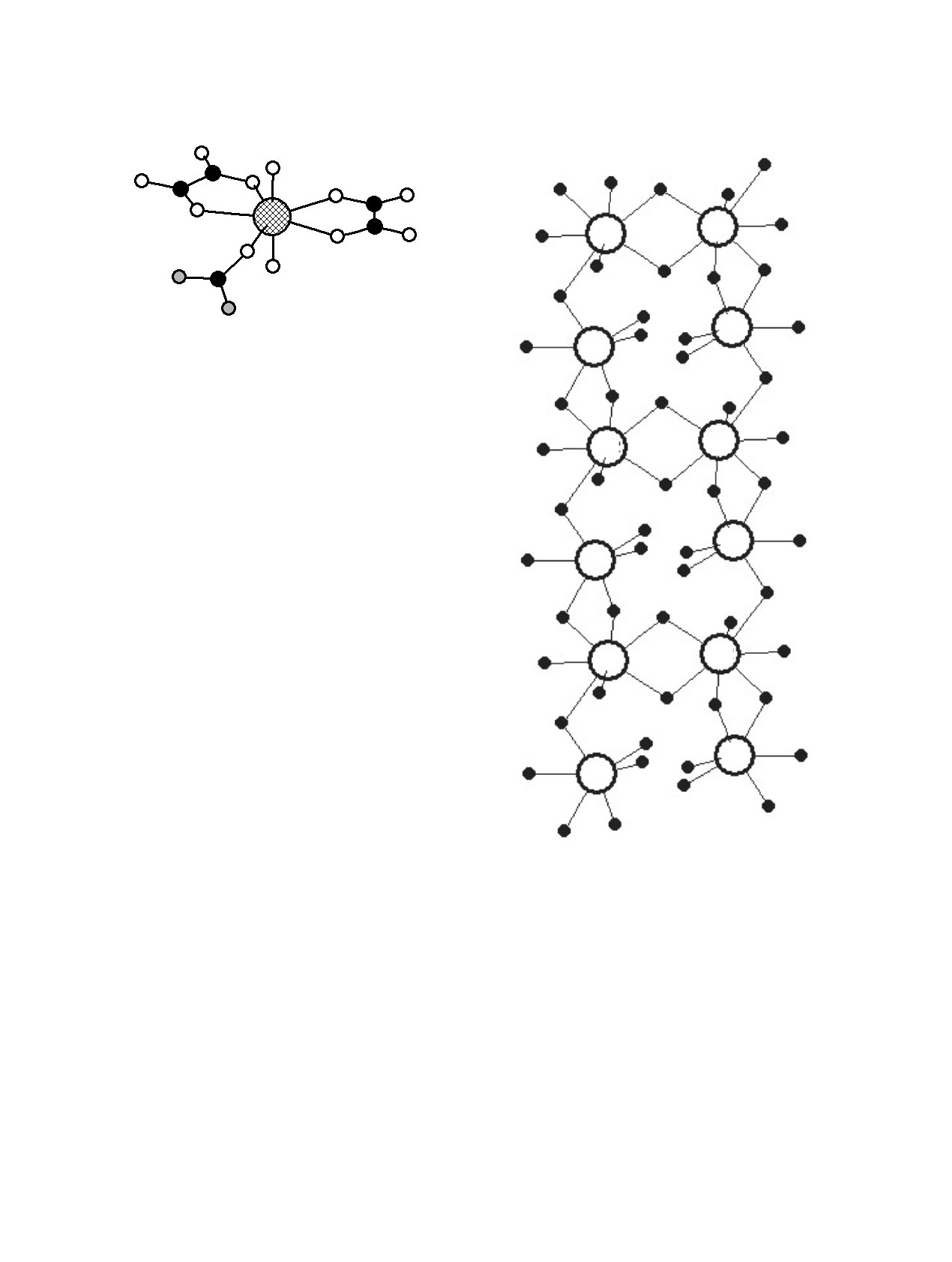
Рис. 1. Строение комплексов
[AnO2(C2O4)2·Urea]2- в
Rb(1)
структурах I-III. Светлые кружки - атомы кислорода,
черные - углерода, серые - азота, штриховкой выделен
атом An. Для упрощения атомы H не показаны.
Объемы полиэдров Вороного-Дирихле (ПВД) ато-
Rb(2)
Rb(2)
мов урана, имеющих форму пентагональной при-
змы, в структурах кристаллов равны 9.02 Å3 (I) и
9.06 Å3 (II) и приемлемо согласуются со средним
значением 9.3(2) Å3, установленным для атомов
U(VI) в составе КП UOn (n = 5-9) [30]. Объем ПВД
Rb(1)
Rb(1)
атома плутония в структуре кристаллов III равен
8.84 Å3 и в пределах 3 совпадает со средним зна-
чением 9.16(12) Å3 для атомов Pu(VI) в полиэдрах
PuOn (n = 6-8) [31]. Безразмерный второй момент
инерции (G3) для ПВД атомов урана (G3 = 0.08365
Rb(2)
Rb(2)
и 0.08361 соответственно в I и II) меньше, чем для
ПВД атома Pu (0.08390). Отметим, что указанные
изменения, которые в I-III сопровождают переход
от U к Pu (уменьшение объема ПВД и увеличение
G3), находятся в полном согласии с результатами
Rb(1)
анализа эффекта актинидного сжатия в изострук-
Rb(1)
турных соединениях An(VI) [32].
В экваториальной плоскости бипирамид AnO7
находятся четыре атома кислорода двух оксалат-и-
онов. Каждый анион реализует тип координации
Рис.
2. Фрагмент цепи Rb(1)O3/2O3/1·Rb(2)O5/2O2/1 =
B01-5, поскольку связан с атомом актинида биден-
Rb2O9 в структуре II.
татно-циклически с образованием пятичленного
(рис. 1), которым отвечает КХФ AB012М1 (A = AnO22+,
металлоцикла (рис. 1). Здесь и далее обозначения
типов координации лигандов и кристаллохимиче-
B01 = С2О2-, М1 = CO(NH2)2).
ские формулы (КХФ) комплексов указаны в соответ-
Как и в изоструктурном K2UO2(C2O4)2·Urea·H2O
ствии с методом [33, 34]. Пятую позицию в эквато-
[21], в структуре II содержится два разных иона
риальной плоскости бипирамид занимает атом кис-
рубидия, которые образуют координационные
лорода молекулы карбамида, выступающей в роли
полиэдры Rb(1)О6 и Rb(2)O7 c d(Rb-O) в диапа-
монодентатного лиганда (тип координации М1).
зоне 2.81-2.99 Å. Атомы кислорода, координиро-
Расстояния An-O в экваториальной плоскости ле-
ванные рубидием, принадлежат четырем разным
жат в области 2.30-2.41 Å (табл. 2). Основной струк-
комплексам [UO2(C2O4)2·Urea]2-. Атом Rb(2) ко-
турной единицей кристаллов I-III являются одно-
ординирует также атом кислорода (O12) внеш-
ядерные комплексы состава [AnO2(C2O4)2·Urea]2-
несферной молекулы воды. Полиэдры RbОn в II
РАДИОХИМИЯ том 63 № 3 2021
СИНТЕЗ И РЕНТГЕНОСТРУКТУРНОЕ ИССЛЕДОВАНИЕ
231
РАДИОХИМИЯ том 63 № 3 2021
232
СЕРЕЖКИНА и др.
Таблица 4. Характеристики водородных связей в структуре кристаллов I-IIIa
Характеристики водородных связей в структуре I
Расстояния, Å
Ранг грани
D-H···O
Углы D-H···O, град
Ω(D-H), %
Ω(H···O), %
H ···O
D-H
H ···O
D ···O
O12-H1···O4
0.828
2.015
2.837
171.7
33.26
22.22
0
N1-H4···O12
0.862
2.024
2.884
175.1
25.06
19.78
0
N1-H5···O10
0.866
2.000
2.799
152.8
24.58
22.35
0
N1-H6···O6
0.859
2.127
2.815
136.7
25.03
17.53
0
N2-H7···O6
0.860
2.231
3.003
149.3
24.99
16.06
0
N2-H7···O4
0.860
2.287
2.960
135.3
24.99
16.58
0
N2-H8···O2
0.859
2.111
2.928
158.8
25.23
21.24
0
N2-H9···O3
0.858
2.040
2.888
169.4
25.11
18.85
0
N2-H10···O10
0.869
1.967
2.832
173.7
24.67
20.88
0
N3-H11···O9
0.880
2.231
2.982
143.1
33.16
20.33
5
N3-H12···O8
0.880
2.049
2.925
173.7
33.04
20.73
0
N4-H13···O6
0.880
2.214
2.999
148.4
33.24
15.27
0
N4-H14···O7
0.879
1.961
2.837
174.7
33.13
20.29
0
Характеристики водородных связей в структуре II
O12-H2···O7
0.854
1.982
2.815
164.8
33.18
23.02
5
N1-H3···O5
0.880
2.198
2.996
150.6
33.49
18.31
5
N1-H4···O10
0.881
1.981
2.856
172.6
33.34
20.40
9
N2-H5···O8
0.881
2.220
2.982
144.6
33.18
20.46
5
N2-H6···O11
0.880
2.078
2.951
171.5
33.00
20.51
11
Характеристики водородных связей в структуре III
O12-H1···O4
0.871
1.942
2.809
173.3
31.63
22.90
0
N1-H4···O12
0.920
1.979
2.946
166.4
24.58
19.54
0
N1-H5···O10
0.906
1.991
2.770
143.1
25.34
21.85
0
N2-H7···O6
0.913
2.194
2.984
144.4
25.12
15.98
0
N2-H7···O4
0.913
2.217
2.954
137.5
25.12
17.67
0
N2-H8···O2
0.915
2.207
3.019
147.6
25.03
19.74
0
N2-H9···O3
0.917
1.967
2.877
171.9
24.98
19.62
0
N2-H10···O10
0.916
1.903
2.816
175.3
24.88
21.51
0
N3-H11···O9
0.880
2.185
3.294
145.2
33.10
20.70
5
N3-H12···O8
0.880
2.076
2.952
173.0
32.96
20.09
0
N4-H13···O6
0.880
2.194
2.990
150.3
33.15
14.69
0
N4-H14···O7
0.880
1.951
2.828
173.9
33.07
20.20
0
a Учтены контакты с расстояниями H⋅⋅⋅O ≤ 2.5 Å, углами D-H···O ≥ 130 и Ω(H⋅⋅⋅O) >10%.
РАДИОХИМИЯ том 63 № 3 2021
СИНТЕЗ И РЕНТГЕНОСТРУКТУРНОЕ ИССЛЕДОВАНИЕ
233
соединены общими ребрами и вершинами в цепи
Таблица 5. Отнесение полос поглощения в ИК спектре
Rb(1)O3/2O3/1·Rb(2)O5/2O2/1
= Rb2O9, которые
II
проходят вдоль [100] (рис. 2). Из девяти кри-
Волновые числа, см-1 a
Отнесение
сталлографически разных атомов кислоро-
3457 с
ν(H2O)
да такой цепи пять принадлежит оксалат-и-
3436 c
онам, два
- иону уранила и по одному
-
3361 с
ν(NН)
молекулам воды и карбамида.
1717ср
asCOO)
В структурах I и III роль внешнесферных ка-
1652 с
asCOO
тионов играют ионы аммония, поэтому комплек-
1622 c
C = O)Urea, δH2O
сы [AnO2(C2O4)2·Urea]2- связаны в каркас как за
1574 с
asCOO, γ(NH2)
счет электростатических взаимодействий с про-
тивоионами, так и с помощью водородных связей
1505 ср
asCOO
N-H···O. Количественно оценить особенности ме-
1384 ср
sCOO, asCN
жмолекулярных взаимодействий в обсуждаемых
1348 ср
sCOO
соединениях можно с помощью метода молекуляр-
1307 ср
ных полиэдров Вороного-Дирихле (ММПВД) [35,
1158 ср
ρ(NH2)
36], который позволяет с единых позиций выявлять
1029 сл
ν(СС), sCN
и характеризовать как все межмолекулярные, так
951 с
νas(UO22+)
и внутримолекулярные невалентные контакты. В
796 ср
δCОO
рамках ММПВД важной характеристикой каждой
765 сл
грани A/Y двух ПВД соседних атомов А и Y является
669 ср
δ(NH)
ее ранг, который указывает минимальное число хи-
609 ср
(CОO)
мических связей, соединяющих ядра атомов А и Y в
575 ср
структуре вещества [35, 36]. В зависимости от зна-
541 ср
чения ранга грани (РГ) контакт A/Y относится к од-
a с - сильная, ср - средняя, сл - слабая.
ному из трех возможных типов: химические связи
(РГ = 1), межмолекулярные взаимодействия (РГ =
Для удобства сравнения с I или III в структуре
0) и внутримолекулярные взаимодействия (РГ > 1).
II в качестве межмолекулярных контактов учтены
Если в составе вещества присутствуют атомы p
все взаимодействия, в которых принимают участие
разных элементов, то теоретически могут реализо-
атомы Rb (5 нижних строк в табл. 3). С их учетом в
ваться невалентные взаимодействия p(p + 1)/2 ти-
II реализуется 14 из 21 возможного типа межмоле-
пов. Использование ММПВД возможно только при
кулярных контактов. Как и в аммонийных аналогах,
условии, что установлены координаты всех незави-
в кристаллах II важнейшая роль в связывании уран-
симых атомов в структуре кристалла [35, 36]. Струк-
содержащих комплексов принадлежит водородным
туры I, II и III, для которых соответственно p = 5, 6
связям. Однако по сравнению с I или III их парци-
и 5, отвечают этому требованию. Согласно получен-
альный вклад (ΔHO ≈ 35%, табл. 3) понижен почти
ным данным, в структурах I и III реализуется 9 из
в два раза из-за появления конкурирующих и сопо-
15 возможных типов межмолекулярных контактов
ставимых по значимости контактов Rb/O, для кото-
(табл. 3). В обоих случаях наибольший вклад в свя-
рых RbO ≈ 33%. На различие парциальных вкладов
зывание комплексов [AnO2(C2O4)2·Urea]2- принад-
межмолекулярных взаимодействий влияет также
лежит водородным связям (контакты H/O), на кото-
изменение мольной доли () атомов в рассматри-
рые приходится около 68% общей площади поверх-
ваемых комплексах. При переходе от I (или III) к
ности молекулярных ПВД (0S в табл. 3). Значитель-
II величина увеличивается для атомов кислорода
ную роль играют также межмолекулярные диспер-
(на 9.5%), тогда как для водорода сильно снижа-
сионные взаимодействия (контакты H/H, O/O и H/C),
ется (на 17.5%). Вследствие этого вклад дисперси-
суммарный парциальный вклад которых составляет
онных взаимодействий O/O в II по сравнению с I
≈24%.
или III увеличен примерно вдвое (до ≈11%), а для
РАДИОХИМИЯ том 63 № 3 2021
234
СЕРЕЖКИНА и др.
взаимодействий H/H понижен примерно в пять раз
мии. 2011. Т. 80. № 11. С. 1061-1086.
(до ≈3%, табл. 3).
7. Kerr A.T., Cahill C.L. // Crystal Growth Des. 2011.
Vol. 11, N 12. P. 5634-5641.
Таким образом, связывание структурных единиц
кристаллов I, II и III осуществляется за счет элек-
8. Сережкин В.Н., Артемьева М.Ю., Сережки-
на Л.Б. Михайлов Ю.Н. // ЖНХ. 2005. Т. 50, № 7.
тростатических взаимодействий, системы водород-
С. 1106-1117.
ных связей и дисперсионных контактов. Характе-
9.
Thuery P., Harrowfield J. // CrystEngComm. 2016. Vol. 18.
ристики важнейших водородных связей, которые
P. 3905-3918.
по классификации [37] являются средними по силе,
10. Zehnder R.A., Boncella J.M., Cross J.N. et al. // Cryst.
представлены в табл. 4.
Growth Des. 2017. Vol. 17. P. 5568-5582.
ИК спектры I-III похожи. В качестве примера
11. Bai Z., Wang Y., Li Y. et al. // Inorg. Chem. 2016. Vol. 55.
проанализирован ИК спектр II (табл. 5). Получен-
Р. 6358-6360.
ные данные согласуются с результатами рентге-
12. Xie J., Wang Y., Liu W. et al. // Angew. Chem. 2017.
ноструктурного анализа монокристаллов: спектр
Vol. 56. P. 7500-7504.
содержит характеристические полосы поглоще-
13. Артемьева М.А., Михайлов Ю.Н., Горбунова Ю.Е.,
ния ионов UO2+, С2О2- и молекул Urea. Колебание
Сережкина Л.Б., Сережкин В.Н. // ЖНХ. 2003. T. 48,
νas(UO2+) проявляется при 951 см-1. В интервалах
№ 9. C. 1470-1472.
1717-1505 и 1384-1307 см-1 наблюдаются соот-
14. Беломестных В.И., Свешникова Л.Б., Михай-
ветственно антисимметричные и симметричные
лов Ю.Н. // ЖНХ. 2013. Т. 58, № 6. С. 754-761.
валентные колебания карбоксильных групп окса-
15. Thuery P., Atoini Y., Harrowfield J. // Cryst. Growth
лат-иона. Понижение частоты колебания ν(С=О) до
Des. 2018. Vol. 18. P. 3167-3177.
1622 см-1 в спектре комплекса по сравнению с по-
16. Бейрахов А.Г., Орлова И.М., Ильин Е.Г. и др. // ЖНХ.
глощением при 1668 см-1 [29] в ИК спектре свобод-
2012. Т. 57, № 7. С. 1019-1026.
ного Urea свидетельствует о координации молекулы
17. Бейрахов А.Г., Орлова И.М., Ротов А.В. и др. // ЖНХ.
карбамида к U(VI) атомом кислорода.
2016. Т. 61, № 12. С. 1583-1590.
ФОНДОВАЯ ПОДДЕРЖКА
18. Артемьева М.А., Михайлов Ю.Н., Горбунова Ю.Е.,
Сережкина Л.Б., Сережкин В.Н. // ЖНХ. 2003. Т. 48,
Рентгенодифракционные эксперименты проведе-
№ 9. С. 1473-1475.
ны в ЦКП ФМИ ИФХЭ РАН при частичном финан-
19. Марков В.П., Цапкина И.В. // ЖНХ. 1959. Т. 4, № 10.
сировании Министерством науки и высшего обра-
С. 2255-2260.
зования РФ (тема № АААА-А18-118040590105-4).
20. Марков В.П., Цапкина И.В. // ЖНХ. 1963. Т. 8, № 2.
С. 285-289.
КОНФЛИКТ ИНТЕРЕСОВ
21. Михайлов Ю.Н., Горбунова Ю.Е., Артемьева Е.Ю.,
Авторы заявляют об отсутствии конфликта
Сережкина Л.Б., Сережкин В.Н. // ЖНХ. 2002. Т. 47,
интересов.
№ 6. С. 936-939.
22. SAINT-Plus (Version 7.68). Madison, Wisconsin (USA):
СПИСОК ЛИТЕРАТУРЫ
Bruker AXS, 2007.
1. Матюха В.А., Матюха С.В. Оксалаты редкоземель-
23. Sheldrick G.M. SADABS. Madison, Wisconsin (USA):
ных элементов и актиноидов. М.: ИздАТ, 2008. 607 с.
Bruker AXS, 2008.
2. Loiseau T., Mihalcea I., Henry N., Volkringer C. //
24. Sheldrick G.M. // Acta Crystallogr., Sect. A.
2008.
Coord. Chem. Rev. 2014. Vol. 266-267. P. 69-109.
Vol. 64, N 1. P. 112-122.
3. Wang K.-X., Chen J.-S. // Acc. Chem. Res. 2011. Vol. 44.
25. Sheldrick G.M. // Acta Crystallogr., Sect. C.
2015.
P. 531-540.
Vol. 71, N 1. P. 3-8.
4. Thuéry P., Harrowfield J. // Inorg. Chem. 2015. Vol. 54.
26. Сережкин В.Н., Михайлов Ю.Н., Бусла-
P. 8093-8102.
ев Ю.А. // ЖНХ. 1997. Т. 42, № 12. С. 2036-2077.
5. Su J., Chen J. // Lanthanide Metal-Organic Frame-
27. Nakamoto K. Infrared and Raman Spectra of Inorganic
works. Structure and Bonding. Berlin, Heidelberg:
and Coordination Compounds. New York: Wiley-
Springer, 2014. Vol. 163. P. 265-295.
Intersience, 1986. 4th ed.
6. Юткин М.П., Дыбцев Д.Н., Федин В.П. // Успехи хи-
28. Bougeard D., Villepin J., Novak A. // Spectrochim. Acta.
РАДИОХИМИЯ том 63 № 3 2021
СИНТЕЗ И РЕНТГЕНОСТРУКТУРНОЕ ИССЛЕДОВАНИЕ
235
A. 1988. Vol. 44, N 12. Р. 1281-1286.
34. Serezhkin V.N., Vologzhanina A.V., Serezhkina L.B.
29. Barlow G.B., Corish P.J. // J. Chem. Soc. 1959. P. 1706-
et al. // Acta Crystallogr., Sect. B. 2009. Vol. 65, N 1.
1710.
P. 45-53.
30. Сережкин В.Н., Карасев М.О., Сережкина Л.Б. // Ра-
35. Сережкин В.Н., Сережкина Л.Б. // Кристаллогра-
диохимия. 2013. Т. 55, № 2. С. 97-105.
31. Сережкин В.Н., Пушкин Д.В., Сережкина Л.Б. //
фия. 2012. Т. 57, № 1. С. 39-49.
Радиохимия. 2018. T. 60, № 3. C. 193-203.
36. Serezhkin
V.N.,
Serezhkina
L.B.,
Volog-
32. Сережкин В.Н., Савченков А.В., Сидоренко Г.В.,
zhanina A.V. // Acta Crystallogr., Sect. B. 2012. Vol. 68,
Сережкина Л.Б. // Радиохимия. 2019. Т. 61, № 4.
N 3. P. 305-312.
С. 297-307.
37. Steiner T. // Angew. Chem. 2002. Vol. 41, N
1.
33. Сережкин В.Н., Медведков Я.А., Сережкина Л.Б.,
Пушкин Д.В. // ЖФХ. 2015. Т. 89, № 6. С. 978-988.
P. 48-76.
РАДИОХИМИЯ том 63 № 3 2021