РАДИОХИМИЯ, 2021, том 63, № 4, с. 349-355
УДК 544.653.2, 621.039.73
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ
ОКСАЛАТ-ИОНОВ В ВОДНЫХ РАСТВОРАХ
© 2021 г. П. Г. Зеленина, В. В. Милютина, * , В. М. Бахирб, Д. В. Адамовичв
аИнститут физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский просп., д. 31, корп. 4,
бИнститут электрохимических систем и технологий Витольда Бахира,
123423, Москва, ул. Народного Ополчения, д. 34, стр. 3
вОАО «ТВЭЛ», 115409, Москва, Каширское шоссе, д. 49
*e-mail: vmilyutin@mail.ru
Получена 20.04.2020, после доработки 05.06.2020, принята к публикации 16.06.2020
Исследовано электрохимическое окисление (ЭХО) оксалат-ионов в водных растворах с использованием
электрохимического модульного элемента МБ-11Т-06. Показано, что ЭХО наиболее эффективно проте-
кает в слабокислых средах при анодной плотности тока не более 160 А/м2. Присутствие хлорид-ионов
в обрабатываемом растворе в нейтральных и слабокислых средах приводит к увеличению скорости
электрохимической деструкции оксалат-ионов. Сульфат- и борат-ионы во всем исследованном диапазоне
рН (3-10) снижают эффективность ЭХО. Показано, что проведение предварительного электрохимиче-
ского окисления оксалатсодержащего раствора позволяет увеличить коэффициент распределения 90Sr
на синтетическом цеолите NaA примерно в 4 раза.
Ключевые слова: электрохимическое окисление, диафрагменный электролиз, оксалат-ионы, радиоак-
тивные отходы.
DOI: 10.31857/S0033831121040067
ВВЕДЕНИЕ
Присутствие органических веществ, в частно-
сти органических комплексообразующих веществ
(солей этилендиаминтетрауксусной, щавелевой,
В процессе производственной деятельности,
лимонной и других органических кислот), оказы-
связанной с получением и использованием радио-
вает негативное влияние на протекание очистки
активных веществ, неизбежно происходит образо-
ЖРО сорбционными и осадительными методами.
вание жидких радиоактивных отходов (ЖРО) раз-
В частности, в присутствии комплексообразующих
личного химического состава и уровня активности.
веществ резко снижается эффективность сорбцион-
В составе ЖРО, кроме неорганических соединений,
ной очистки от 90Sr на цеолите NaA [1] и от 137Cs на
часто присутствуют органические вещества различ-
ферроцианидных сорбентах [2].
ной природы: органические комплексообразующие
Для удаления органических веществ из раство-
и поверхностно-активные вещества, нераствори-
ров могут быть использованы физико-химические
мые органические вещества (нефтяные масла, рас-
методы, основанные на их извлечении и концентри-
творители, экстрагенты и др.). Основными источ-
ровании без разложения. К таким методам относит-
никами попадания органических веществ в ЖРО
ся, в первую очередь, адсорбция на активных углях
являются растворы после дезактивации радиацион-
и других адсорбентах с высокой удельной поверх-
но-загрязненного оборудования, воды спецпрачеч-
ностью [3]. Недостатком адсорбционных методов
ных и санпропускников.
является образование больших количеств вторич-
349
350
ЗЕЛЕНИН и др.
ных радиоактивных отходов (отработанных адсор-
лителей, восстановителей с гарантийным сроком
бентов), которые требуют дальнейшей переработки.
эксплуатации не менее 5 лет.
Наиболее перспективными для удаления орга-
Установки, созданные на основе электрохимиче-
нических соединений из состава ЖРО являются де-
ских элементов ПЭМ и МБ, широко используются
структивные методы, основанные на окислении или
на практике для получения газообразного хлора,
разложении органических веществ с образованием
гипохлорита натрия, для дезинфекции медицинско-
газообразных или низкомолекулярных продуктов
го оборудования, обработки сточных вод и в ряде
реакции. К деструктивным методам относятся:
других областей [12]. Единственным примером
реагентное, гидротермальное, электрохимическое
применения электрохимических элементов типа
окисление; разрушение под действием излучений
ПЭМ в радиохимической практике является их ис-
высоких энергий (ультрафиолетовое и гамма-излу-
пользование для удаления аммиака и органических
чение, ускоренные электроны).
соединений из ЖРО Курской АЭС [13].
В настоящее время для разрушения органиче-
Целью настоящей работы являлось исследо-
ских веществ в составе ЖРО наиболее широко ис-
вание процесса электрохимического окисления
пользуется метод озонирования [4, 5]. Основным
оксалат-ионов в водных растворах с использова-
преимуществом метода озонирования при перера-
нием электрохимического реактора типа МБ, при-
ботке ЖРО является то, что озон окисляет с высокой
менительно, в первую очередь, к задаче удаления
скоростью практически все органические соедине-
щавелевой кислоты и ее солей из высокосолевых
ния, а продуктами реакций являются газообразные
жидких радиоактивных отходов, в частности, из
и низкомолекулярные вещества, что не приводит к
кубовых остатков АЭС. Присутствие органических
образованию дополнительных вторичных отходов.
соединений негативно влияет на процессы очистки
Однако наряду с достоинствами метод озонирова-
данного вида ЖРО от радионуклидов [14]. Кроме
ния обладает рядом недостатков, связанных, в пер-
этого, большое практическое значение имеют зада-
вую очередь, с высокой токсичностью озона.
чи переработки отработанных дезактивирующих
растворов, содержащих щавелевую кислоту [15], а
Одним из перспективных способов деструкции
также оксалатных маточных растворов, образую-
органических веществ в водных растворах явля-
щихся при осаждении РЗЭ и плутония щавелевой
ется метод электрохимического окисления (ЭХО),
кислотой [16].
основанный на анодном окислении вещества как
непосредственно на поверхности анода, так и за
счет протекания вторичных электродных реакций
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[6]. Данный метод достаточно широко использу-
ется при очистке нерадиоактивных сточных вод, в
Эксперименты по электрохимическому окис-
частности, для удаления красителей [7]. Сведения
лению (ЭХО) оксалат-ионов проводили на лабора-
об использовании электрохимических методов при
торной установке, состоящей из проточного элек-
переработке ЖРО крайне ограничены. В частности,
трохимического модульного элемента МБ-11Т-06,
проточный электрохимический реактор с волокни-
источника постоянного тока типа QJ 3005C, позво-
стым графитовым анодом был использован для раз-
ляющего регулировать и поддерживать напряжение
рушения органических веществ в жидких радиоак-
и силу тока в диапазоне 0-30В и 0-3А соответствен-
тивных отходах [8].
но, двух циркуляционных насосов для циркуляции
анолита и католита и емкостей для сбора анолита и
Важным фактором возможности использования
католита.
метода ЭХО в процессах переработки ЖРО явилось
создание российским Институтом электрохимиче-
Проточный электрохимический модульный эле-
ских систем и технологий Витольда Бахира серии
мент МБ-11Т-06 представляет собой цилиндриче-
проточных диафрагменных электрохимических
скую ячейку с внешним катодом из полированно-
элементов типа ПЭМ и МБ [9-11]. Конструкция
го титана и коаксиальным полым анодом, выпол-
электрохимических элементов позволяет исполь-
ненным из титана с покрытием из оксида иридия.
зовать их в среде сильных кислот, щелочей, окис-
Катод и анод разделены керамической пористой
РАДИОХИМИЯ том 63 № 4 2021
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ ОКСАЛАТ-ИОНОВ
351
и определяли в нем концентрацию оксалат-ионов
методом перманганатометрического титрования.
По результатам анализов рассчитывали степень
окисления (S) оксалат-ионов, удельное количество
электричества (Qуд), затраченное на разложение 1 г
оксалат-ионов, и выход по току (ВПТ) по формулам
(1)-(3) соответственно:
,
(1)
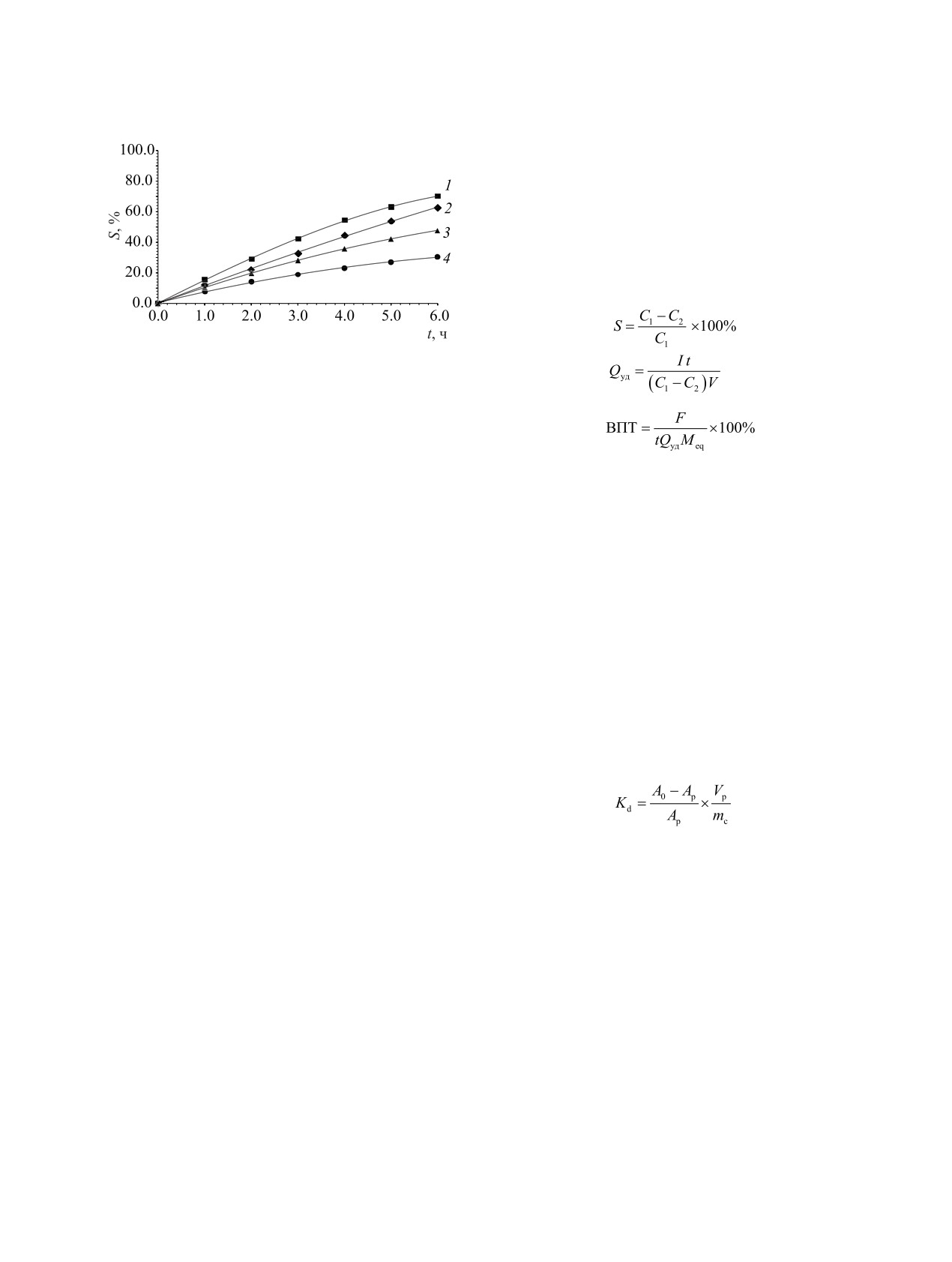
Рис. 1. Зависимости степени окисления (S) оксалат-ио-
нов от времени электрохимической обработки (t) при раз-
,
(2)
личных значениях рН раствора: 1 - 3.0, 2 - 7.0, 3 - 10.0,
4 - 12.0. I = 0.4 А, U = 2.7 В.
,
(3)
диафрагмой, изготовленной из оксида алюминия в
α-форме толщиной 1.3 мм. Размеры пор диафраг-
где С1, С2 - начальная и конечная концентрация
мы находятся в диапазоне 0.01-0.1 мкм. Ширина
оксалат-ионов, г/дм3; Qуд - удельное количество
обеих электродных камер (расстояние от электрода
электричества, А∙ч/г; I - сила тока, А; t - интервал
до диафрагмы) 1.2 мм. Внешний диаметр элемента
времени, ч; V - объем раствора, дм3; F - постоянная
МБ-11Т-06 18 мм, длина рабочего межэлектродного
Фарадея (96485 Кл/моль); Meq - масса г-эквивален-
пространства 200 мм. Площадь поверхности анода
та оксалат иона (44 г).
и катода элемента 50 и 94 см2 соответственно. Ка-
При исследовании влияния электрохимического
тодная и анодная части снабжены электрически-
окисления на сорбционные характеристики синте-
ми контактами и штуцерами для входа и выхода
тического цеолита NaA определяли значения коэф-
растворов. Элемент МБ-11Т-06 предоставлен для
фициента распределения (Kd) 90Sr в растворе до и
испытаний российским предприятием-изготови-
после ЭХО. Эксперименты проводили в статиче-
телем - Институтом электрохимических систем и
ских условиях при соотношении твердой и жидкой
технологий Витольда Бахира.
фаз Т : Ж = 1 : 200, время контакта 48 ч. Значения Kd
Процесс ЭХО проводили путем непрерывной
90Sr рассчитывали по формуле
циркуляции обрабатываемого раствора (анолита)
и вспомогательного раствора (католита) через ано-
,
(4)
дную и катодную камеру реактора соответствен-
но. Обрабатываемый раствор, содержащий около
4.5 г/дм3 оксалат-ионов и 10 г/дм3 нитрата натрия,
где А0, Ар - соответственно удельная активность
90Sr в исходном и конечном растворе, Бк/дм3; Vр -
получали путем растворения щавелевой кислоты и
объем жидкой фазы, см3; mс - масса сорбента, г.
нитрата натрия в дистиллированной воде. Коррек-
тировку рН анолита проводили растворами азотной
Удельную активность 90Sr в растворах определя-
кислоты или гидроксида натрия. При проведении
ли прямым радиометрическим методом с использо-
ЭХО в присутствии хлорид-, сульфат- и борат-ио-
ванием универсального спектрометрического ком-
нов в обрабатываемый раствор добавляли хлорид
плекса СКС-50М (Грин стар технолоджиз, Москва).
натрия, сульфат натрия и борную кислоту соответ-
ственно. В качестве вспомогательного раствора (ка-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
толита) использовали раствор 1.0 моль/дм3 гидрок-
сида натрия. Объем анолита и католита - по 250 см3.
На рис. 1 приведены зависимости степени окис-
После подачи постоянного напряжения на клем-
ления (S) оксалат-ионов от времени электрохими-
мы катода и анода через определенные промежутки
ческой обработки (t) при различных значениях рН
времени отбирали пробы циркулирующего анолита
обрабатываемого раствора, содержащего 4.5 г/дм3
РАДИОХИМИЯ том 63 № 4 2021
352
ЗЕЛЕНИН и др.
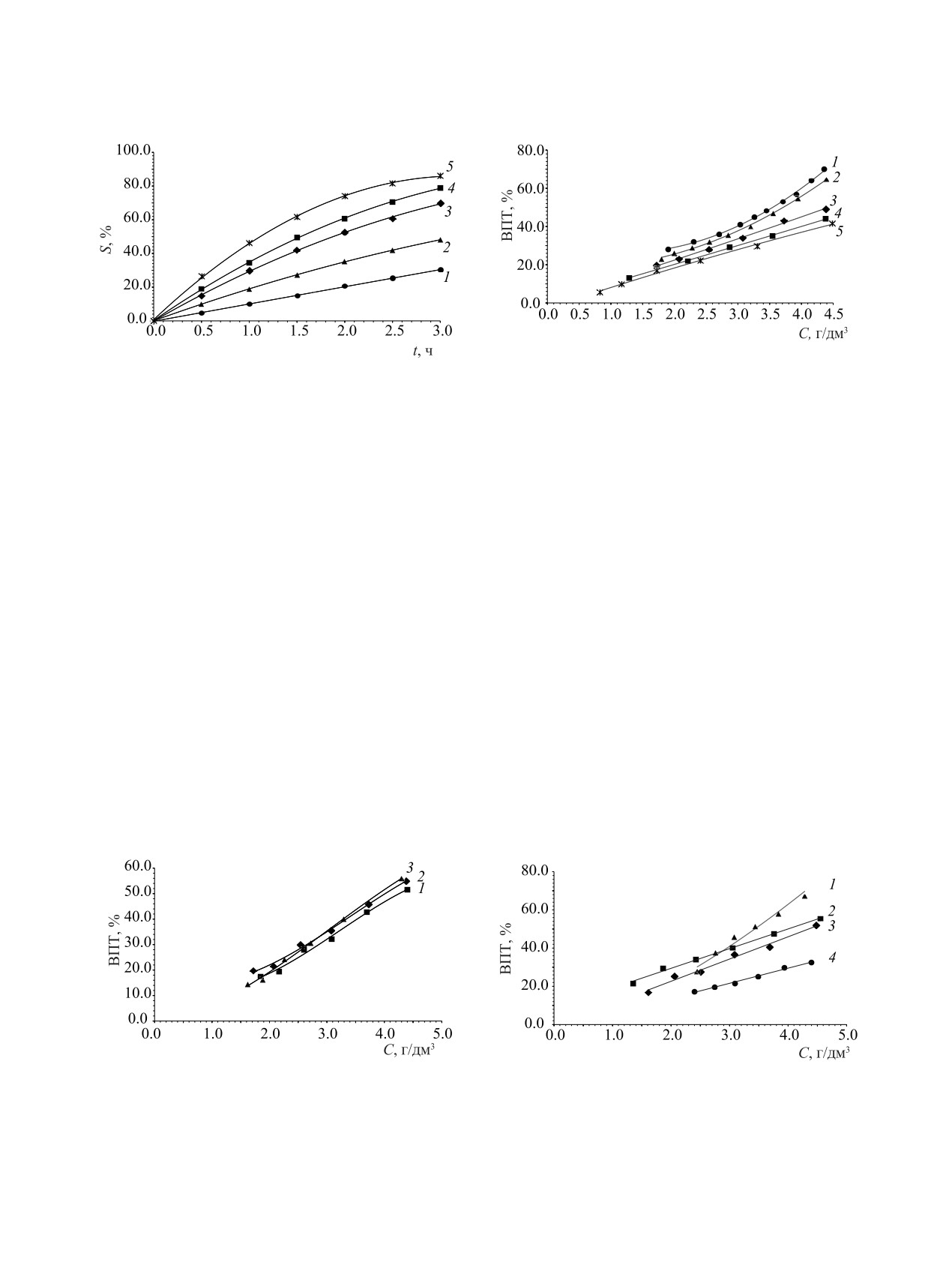
Рис. 2. Зависимость выхода по току (ВПТ) и удельного количества электричества (Qуд) от концентрации оксалат ионов при
различных значениях рН раствора: 1 - 3.0, 2 - 7.0, 3 - 10.0, 4 - 12.0. I = 0.4 А, U = 2.7 В.
оксалат-ионов и 10 г/дм3 нитрата натрия. Процесс
Одним из основных показателей электрохими-
проводили при силе тока I = 0.4 А и напряжении
ческого процесса является значение выхода по току
U = 2.7 В.
(ВПТ), которое показывает долю пропущенного
электричества, затраченного на осуществление це-
Полученные результаты показывают, что при
левого электрохимического процесса.
увеличении рН скорость ЭХО оксалат-ионов сни-
жается, что может быть объяснено следующим
Приведенные на рис. 2, а зависимости ВПТ от
образом. Окисление оксалат-ионов может происхо-
концентрации оксалат-ионов при различных значе-
дить либо непосредственно на поверхности анода
ниях рН раствора показывают, что ВПТ закономер-
но снижается при уменьшении концентрации окса-
[уравнение (5)], либо за счет окисления газообраз-
лат-ионов, что связано с увеличением доли побоч-
ным кислородом-продуктом анодного окисления
ных электродных реакций разложения воды. При
воды [уравнения (6) и (7)]:
увеличении рН при одной и той же концентрации
С2О2- - 2е- = 2СО2 (Е0 = - 0.49 В),
(5)
оксалат-ионов значения ВПТ закономерно умень-
2H2O - 4e- = 4H+ + O2 (Е0 = +1.23 В),
(6)
шаются. В кислых растворах при концентрации ок-
салат-ионов более 4.5 г/дм3 значение ВПТ прибли-
2С2О2- + O2 +4H+ = 4СО2 + 2H2O.
(7)
жается к 100%.
В соответствии с уравнением Нернста окисли-
Другой важной характеристикой электрохими-
тельно-восстановительный потенциал (ОВП) элек-
ческого процесса является значение удельного ко-
тродной реакции (6) уменьшается при увеличении
личества электричества (Qуд), затраченное на разло-
рН, это приводит к снижению движущей силы ре-
жение 1 г оксалат-ионов. Очевидно, что при сниже-
акции окисления оксалат-ионов (7) выделяющимся
нии ВПТ и концентрации оксалат-ионов значение
на аноде кислородом. Таким образом, в процессе
Qуд возрастает (рис. 2, б).
ЭХО оксалат-ионов большую роль играют продук-
Для определения оптимального режима работы
ты анодного окисления воды. Кроме молекулярного
электрохимической установки проводили экспери-
кислорода продуктами анодного окисления воды
менты с различными значениями плотности тока.
могут являться атомарный кислород, гидроксил-ра-
Для этого варьировали силу тока, проходящего
дикалы, пероксид водорода, обладающие высокой
через электроды, от 0.2 до 1.6 А, что соответству-
окислительной способностью [17].
ет анодной плотности тока (i) 40-320 А/м2. В каче-
РАДИОХИМИЯ том 63 № 4 2021
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ ОКСАЛАТ-ИОНОВ
353
Рис. 3. Зависимости степени окисления S оксалат-ионов
Рис. 4. Зависимость выхода по току (ВПТ) от концентра-
от времени электрохимической обработки t при различ-
ции-оксалат ионов при различной анодной плотности
ной анодной плотности тока i, А/м2: 1 - 40, 2 - 80, 3 - 160,
тока i, А/м2: 1 - 40, 2 - 80, 3 - 160, 4 - 240, 5 - 320. Напря-
4 - 240, 5 - 320. Напряжение U, В: 1 - 2.4, 2 - 2.7, 3 - 2.9,
жение U, В: 1 - 2.4, 2 - 2.7, 3 - 2.9, 4 - 3.2, 5 - 3.4. рН 10.0.
4 - 3.2, 5 - 3.4. рН 10.0.
стве анолита использовали раствор, содержащий
Эксперименты по ЭХО при различной концен-
4.5 г/дм3 оксалат-ионов, 10 г/дм3 нитрата натрия,
трации NaNO3 в анолите (рис. 5) показали, что в ди-
рН 10. Результаты представлены на рис. 3 и 4.
апазоне концентраций нитрата натрия 1-150 г/дм3
Из приведенных результатов видно, что при повы-
основные параметры процесса остаются практиче-
шении плотности тока скорость ЭХО оксалат-ионов
ски на одном уровне.
закономерно увеличивается (рис. 3). Однако, как
В связи с тем, что в составе ЖРО кроме ни-
следует из рис. 4, эффективность использования
трат-ионов могут содержаться другие анионы, было
электричества при увеличении плотности тока сни-
изучено влияние хлорид-, сульфат- и борат-ионов
жается. Особенно это заметно при высоких концен-
на ЭХО оксалат-ионов. Для этого в анолит с концен-
трациях оксалат-ионов в растворе. При низких кон-
трацией NaNO3 10 г/дм3 добавляли хлорид натрия,
центрациях (менее 2 г/дм3) эта разница в значитель-
сульфат натрия и борную кислоту до достижения
ной мере нивелируется. Оптимальным режимом
концентрации хлорид-, сульфат- и борат-ионов 1.0,
следует считать проведение процесса при I = 0.8 А,
что соответствует i = 160 А/м2. При этих параме-
1.35 и 2.0 г/дм3 соответственно. В экспериментах
трах процесс ЭХО протекает достаточно быстро и
использовали растворы с рН 10.0, 7.0 и 3.0. Коррек-
эффективно.
тировку рН анолита проводили растворами азотной
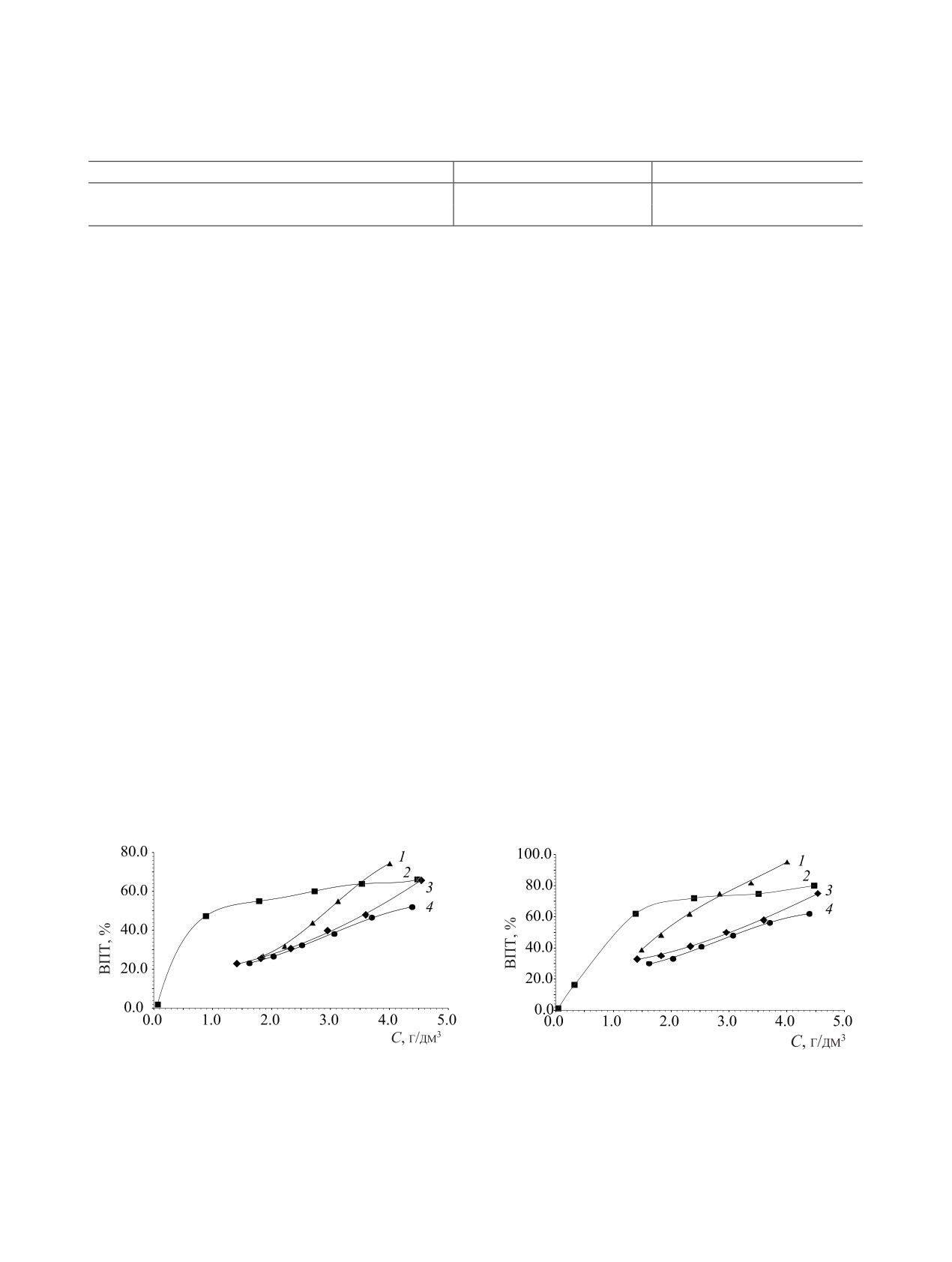
Рис. 6. Зависимость выхода по току (ВПТ) от концентра-
Рис. 5. Зависимость выхода по току (ВПТ) от концентра-
ции оксалат-ионов в растворе 10 г/дм3 NaNO3 c pH 10.0 (1)
ции оксалат-ионов в растворах с различной концентраци-
и в том же растворе, дополнительно содержащем хлорид
ей NaNO3, г/дм3: 1 - 1.0, 2 - 10, 3 - 150. pH 10.0. I = 0.8 А,
U = 2.9 В.
(2), сульфат (3) и борат-ионы (4). I = 0.8 А, U = 2.9 В.
РАДИОХИМИЯ том 63 № 4 2021
354
ЗЕЛЕНИН и др.
Таблица 1. Значения коэффициента распределения (Kd) 90Sr
Тип раствора
Исходный
После ЭХО
Концентрация оксалат-ионов, г/дм3
2.0
0.18
Kd 90Sr, см3/г
2100 ± 200
8500 ± 400
кислоты или гидроксида натрия. Полученные ре-
Такой же эффект присутствия хлорид-ионов на-
зультаты приведены на рис. 6-8.
блюдается и в кислой среде (рис. 8). Однако в дан-
ных условиях он выражен слабее ввиду того, что в
Приведенные результаты показывают, что в ще-
лочных средах (рис. 6) хлорид-, сульфат- и борат-
кислых средах хлорид-ионы окисляются на аноде
ионы несколько снижают величину ВПТ, что мо-
с выделением газообразного хлора, который ввиду
жет быть связано с расходом части электричества
относительно низкой растворимости в воде выво-
на окисление посторонних анионов с образовани-
дится из раствора с газовой фазой.
ем хлоратов, персульфатов и перборатов. Особенно
В табл. 1 приведены значения коэффициента
заметно влияние вышеперечисленных ионов прояв-
распределения (Kd) 90Sr на синтетическом цеолите
ляется при высоких концентрациях оксалат-ионов
NaA в исходном растворе состава, г/дм3: NaNO3 10,
в растворе.
оксалат-ион 2.0, рН 7.0 и в растворе приведенного
В нейтральных средах (рис. 7) характер влияния
состава после электрохимического окисления. Ус-
хлорид-ионов на процесс ЭХО резко меняется, в то
ловия ЭХО: I = 0.8 А, U = 2.9 В, время 6 ч.
время как для сульфат- и борат-ионов он остается
Значения коэффициента распределения (Kd) 90Sr
неизменным. В присутствии хлорид-ионов при кон-
на синтетическом цеолите NaA в исходном раство-
центрации оксалат-ионов менее 3 г/дм3 ВПТ в хло-
ре и после проведения ЭХО (I = 0.8 А, U = 2.9В ,
ридсодержащих растворах заметно превышает со-
время 6 ч)
ответствующие значения для нитратных сред. Это
Полученные результаты показывают, что при
связано, по- видимому, с тем, что в данном диапазоне
проведении электрохимического окисления кон-
рН продуктами анодного окисления хлорид-ионов
центрация оксалат-ионов снижается более, чем в
являются гипохлорит-ионы и свободная хлорнова-
тистая кислота [18], которые являются сильными
10 раз, при этом коэффициент распределения 90Sr
окислителями и с высокой скоростью реагируют с
на синтетическом цеолите NaA увеличивается при-
оксалат-ионами.
мерно в 4 раза.
Рис. 7. Зависимость выхода по току (ВПТ) от концентра-
Рис. 8. Зависимость выхода по току (ВПТ) от концентра-
ции оксалат-ионов в растворе 10 г/дм3 NaNO3 c pH 7.0 (1) и
ции оксалат ионов в растворе 10 г/дм3 NaNO3 c pH 3.0 (1) и
в том же растворе, дополнительно содержащем хлорид (2),
в том же растворе, дополнительно содержащем хлорид (2),
сульфат (3) и борат-ионы (4).
сульфат (3) и борат-ионы (4).
РАДИОХИМИЯ том 63 № 4 2021
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ ОКСАЛАТ-ИОНОВ
355
ЗАКЛЮЧЕНИЕ
2.
Милютин В.В., Гелис В.М., Ершов Б.Г., Селивер-
стов А.Ф. // Радиохимия. 2008. Т. 50, № 1. С. 60-61.
Проведенные исследования показали, что метод
3.
Когановский А.М. Адсорбция и ионный обмен в про-
электрохимического окисления (ЭХО) с использо-
цессах водоподготовки и очистки сточных вод. Киев:
Наук. думка, 1983. 240 с.
ванием электрохимического модульного элемента
МБ-11Т-06 может быть использован для удаления
4.
Драгинский В.Л., Алексеева Л.П., Самойлович В.Г.
оксалат-ионов из водных растворов. Деструкция
Озонирование в процессах очистки воды. М.: ДеЛи
принт, 2007. 363 с.
оксалат-ионов происходит за счет их анодного
окисления, а также за счет взаимодействия с про-
5.
Селиверстов А.Ф., Лагунова Ю.О., Милютин В.В.,
дуктами анодного окисления воды - молекулярным
Ершов Б.Г.
// Радиохимия.
2013. Т.
55,
№ 4.
и атомарным кислородом, гидроксил-радикалами,
С. 319-322.
пероксидом водорода, обладающими высокой окис-
6.
Фиошин М.Я., Смирнова М.Г. Электросинтез окис-
лительной способностью.
лителей и восстановителей. Л.: Химия, 1981. 2-е изд.
212 с.
Эффективность ЭХО зависит от рН раствора,
плотности тока, а также присутствия посторонних
7.
Яковлев С.В., Краснобородько И.Г., Рогов В.М.
анионов. Электрохимическое окисление наиболее
Технология электрохимической очистки воды. Л.:
Стройиздат, 1987. 312 с.
эффективно протекает в слабокислых средах при
анодной плотности тока не более 160 А/м2. Присут-
8.
Косяков В.Н, Яковлев Н.Г., Велешко И.Е. // Четвертая
ствие хлорид-ионов в обрабатываемом растворе в
Рос. конф. по радиохимии: Тез. докл. Озерск, 2003.
нейтральных и слабокислых средах приводит к уве-
С. 189.
личению скорости электрохимической деструкции
9.
Бахир В.М., Задорожний Ю.Г. Патент RU 2078737.
оксалат-ионов. В присутствии сульфат- и борат-ио-
Заявл. 26.05.1994. Опубл. 10.05.1997.
нов эффективность ЭХО во всем исследованном ди-
10. Бахир В.М., Задорожний Ю.Г. Патент RU 2091320,
апазоне рН (3-10) несколько снижается. Проведе-
Заявл. 9.02.1996. Опубл. 27.09.1997.
ние электрохимического окисления оксалат-содер-
11. Бахир В.М. // Водоснабжение и канализация. 2010.
жащего раствора в течение 6 ч позволяет увеличить
№ 3-4. С. 56-62.
коэффициент распределения 90Sr на синтетическом
12. Бахир В.М. Электрохимическая активация. Изобре-
цеолите NaA примерно в 4 раза.
тения, техника, технология. М: ВИВА-СТАР, 2014.
512 с.
ФОНДОВАЯ ПОДДЕРЖКА
13. Милютин В.В., Гелис В.М., Козлитин Е.А., Дми-
триев С.А., Адамович Д.В. // Шестая Рос. конф.
Работа выполнена при частичном финансирова-
по радиохимии «Радиохимия-2009»: Тез. докл. М.,
нии Министерства науки и высшего образования
12-16 октября 2009 г. Озерск: Маяк, 2009. С. 279.
Российской Федерации.
14. Савкин А.Е., Моренова А.Г., Захарова Е.В., Родыги-
на Н.И. // Радиохимия. 2003. Т. 45, № 4. С. 363-365.
КОНФЛИКТ ИНТЕРЕСОВ
15. Зимон А.Д., Пикалов В.К. Дезактивация. М.: ИздАТ,
1994. 336 с.
Авторы заявляют об отсутствии конфликта ин-
16. Матюха В.А., Матюха С.В. Оксалаты редкоземель-
тересов.
ных элементов и актиноидов. М.: ИздАТ,
2008.
3-е изд. 607 с.
17. Якименко Л.М. Электролиз воды. М.: Химия, 1970.
СПИСОК ЛИТЕРАТУРЫ
264 с.
1.
Рябчиков Б.Е. Очистка жидких радиоактивных отхо-
18. Никитин И.В. Химия кислородных соединений га-
дов. М.: ДеЛи принт, 2008. 516 с.
логенов. М.: Наука, 1985. 104 с.
РАДИОХИМИЯ том 63 № 4 2021