РАДИОХИМИЯ, 2022, том 64, № 1, с. 3-37
УДК 546.798.21+546.798.22
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ
АКТИНИДОВ(VII)
© 2022 г. Н. Н. Крот, И. А. Чарушникова*
Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский просп., д. 31, корп. 4
*e-mail:charushnikovai@ipc.rssi.ru
Поступила в редакцию 17.11.2020, после доработки 29.01.2021, принята к публикации 03.02.2021
Систематизированы и обобщены литературные сведения по синтезу, строению и физико-химическим
свойствам соединений семивалентных актинидов. Особое внимание обращено на соединения,
полученные в виде монокристаллов и изученные методом рентгеноструктурного анализа. Обоснован
вывод об отсутствии заметной аналогии соединений семивалентных актинидов и рения.
Ключевые слова: нептуний(VII), плутоний(VII), синтез, кристаллическая структура, электронные
спектры поглощения, ИК спектры, магнитные свойства, эффект Мессбауэра.
DOI: 10.31857/S0033831122010014
Возможность осаждения труднорастворимых со-
получен только в растворах и ни одно его соедине-
единений Np(VII) и Pu(VII) из щелочных растворов
ние до сих пор не идентифицировано.
катионами щелочноземельных и редкоземельных
Было установлено также, что существенное ос-
элементов была отмечена уже в первой публикации,
ложнение при синтезе соединений An(VII) создает
подтверждающей существование семивалентных
снижение устойчивости с уменьшением концентра-
актинидов [1]. Вскоре была выделена из раствора
ции ионов OH-. Поэтому только Np(VII) удалось
Np(VII) кристаллическая соль Co(NH3)6NpO5∙nH2O
выделить в виде твердых соединений из слабокис-
и получены методами твердофазных реакций сое-
лых или близких к нейтральным растворов. Соли
динения Li5NpO6 и Li5PuO6 [2, 3]. Впоследствии
Pu(VII) получены исключительно осаждением из
в ходе исследования химии An(VII) (An = Np, Pu,
щелочных растворов.
Am) проводились систематические синтезы их раз-
личных соединений как «сухими» методами, так и
Результаты ранних работ, посвященных синте-
путем кристаллизации из водных растворов различ-
зу, строению и важнейшим свойствам соединений
ного состава. При этом обнаружилось, что получе-
Np(VII) и Pu(VII) суммированы в монографии [4],
ние, изучение строения и свойств соединений се-
обзоре [5] и в докторской диссертации М.С. Григо-
мивалентных актинидов связаны с определенными
рьева [6]. Однако в последующие 25 лет сведения
трудностями, которые обусловлены высокой окис-
по данному вопросу были существенно уточнены
лительной способностью An(VII), резко возрастаю-
и расширены, особенно в случае Pu(VII). В связи
щей по ряду Np-Pu-Am. В итоге наиболее удобным
с этим назрела необходимость в новой системати-
для синтеза и исследования свойств соединений
зации и обобщении имеющихся в настоящее время
An(VII) оказался нептуний, основной изотоп кото-
данных по препаративной химии An(VII). Именно
рого (237Np) к тому же обладает сравнительно низкой
эта задача стала главной целью данной публикации.
удельной активностью. Поэтому большинство сое-
Авторы надеются, что представленный ниже обзор
динений семивалентных актинидов вначале были
будет полезен не только для понимания особенно-
представлены нептуниевыми производными. Число
же соединений Pu(VII), синтезированных преиму-
стей химии актинидов в семивалентном состоянии,
щественно методами твердофазных реакций, было
но и для планирования новых исследований в этой
весьма ограниченным. Что касается Am(VII), то он
области.
3
4
КРОТ, ЧАРУШНИКОВА
1. ПРИГОТОВЛЕНИЕ РАСТВОРОВ An(VII)
метного накопления Np(VI). Pu(VII) в щелочных
ДЛЯ СИНТЕЗА СОЕДИНЕНИЙ
растворах менее устойчив вследствие радиолити-
ческих процессов и восстановления водой. По-
Большинство
известных
соединений
этому для синтезов рекомендуется использовать
An(VII) получено с применением щелочных
свежеприготовленные растворы Pu(VII). По край-
растворов семивалентных нептуния и плутония.
ней мере, продолжительность их хранения даже в
Исключением служат лишь некоторые соли
2-3 моль·л-1 LiOH при температуре 10°С и ниже
Np(VII) и Pu(VII), приготовленные методами
не должна превышать 3 сут.
твердофазного окисления NpO2, PuO2, NpO3∙H2O
Кроме озонирования, для приготовления ще-
и электролиза слабокислых растворов Np(VI). Эти
лочных растворов An(VII) можно применять элек-
методы, а также различные реакции окисления
трохимическое окисление An(VI) на Pt аноде.
An(VI) до семивалентного состояния в растворах
Однако полученные таким путем растворы менее
достаточно подробно суммированы в обзорных
публикациях [4, 5]. Здесь следует лишь отметить,
устойчивы, особенно в случае Pu(VII), из-за ка-
что для препаративных исследований наиболее
тализа следами платины реакций восстановления
удобным и эффективным способом приготовления
An(VII) водой.
исходных растворовAn(VII) является озонирование
Для синтеза соединений An(VII) часто быва-
суспензий гидроксидов Np(VI), Np(V) или
ет желательным знать точно состав исходного
Pu(VI) в 1-3 моль·л-1 LiOH. Такие суспензии
щелочного раствора актинида. Концентрацию
рекомендуется получать добавлением щелочи
Np(VII) или Pu(VII) в растворах можно легко
к слабокислым (pH 3-5) растворам нитратов и
определить спектрофотометрически, путем из-
перхлоратов An(VI) или Np(V), предварительно
тщательно очищенных от примесей, которые могут
мерения (после контролируемого разбавления
взаимодействовать с An(VII) или катализировать
~2 моль·л-1 LiOH) светопоглощения раствора
их восстановление водой. По той же причине в
при длинах волн 620 и 635 нм в случае нептуния
работе следует использовать LiOH марки ос.ч. и
и плутония соответственно. При расчетах моляр-
дважды перегнанную воду.
ные коэффициенты погашения в указанных усло-
Применение О3 позволяет получать растворы с
виях можно принять равными 398 л·моль-1·см-1
концентрацией Np(VII) и Pu(VII) до 0.3 моль·л-1
для Np(VII) и 595 л·моль-1·см-1 в случае Pu(VII)
без примесей окислителя и продуктов его вос-
[7]. Избыточную концентрацию LiOH в исходных
становления. Конечные растворы содержат лишь
растворах Np(VII) и Pu(VII) можно с умеренной
избыточный LiOH, а также LiNO3 или LiClO4 в
погрешностью рассчитать, если на озонирование
мольном отношении к An(VII) 2 : 1 или 1 : 1. При-
брать известные объемы титрованных растворов
сутствия солей лития можно избежать, если для
озонирования вместо нитратов или перхлоратов
An(VI) и LiOH и измерить объем конечных рас-
An(VI) и Np(V) использовать их свежеосажденные
творов An(VII). В случае нептуния концентрацию
гидроксиды AnO3∙nH2O или NpO2OH. В том и дру-
избытка LiOH можно установить более точно
гом случае при расчете избыточной концентрации
следующим образом. Пробу анализируемого рас-
LiOH нужно учитывать расход ионов OH- в про-
твора с известной концентрацией Np(VII) раз-
цессе озонирования в соответствии со стехиоме-
бавляют водой в ~10 раз и добавляют небольшой
трией реакций
избыток 0.3 моль·л-1 Ba(NO3)2. Выпавший оса-
2AnO22+ + O3 + 10OH- = 2AnO4(OH)23- + O2 + 3H2O,
док Ba3(NpO5)2∙nH2O после коагуляции в течение
2AnO3∙nH2O + O3 + 6OH- = 2AnO4(OH)3- +
5-10 мин отделяют центрифугированием и тща-
+ O2 + (2n + 1)H2O,
тельно промывают водой. Маточный раствор и
NpO2OH + O3 + 3OH- = NpO4(OH)3- + O2 + H2O.
промывные воды объединяют, и содержание в них
Растворы Np(VII) с [OH-] ≥ 1 моль·л-1 сохра-
щелочи определяют титрованием стандартным
няются при 0-10°С в течение 1-2 месяцев без за-
раствором кислоты.
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
5
2. СИНТЕЗ И СТРОЕНИЕ СОЕДИНЕНИЙ
сти растворения кристаллов соединения Np(VII)
An(VII), ВЫДЕЛЕННЫХ ИЗ КРЕПКИХ
в воде полной их очистки от примеси достичь не
РАСТВОРОВ ЩЕЛОЧЕЙ
удалось. По результатам химического анализа в ко-
нечном продукте нептуний присутствовал на ~95%
в семивалентной форме и мольное отношение Na :
К настоящему времени достоверно
Np было близким к 3. С учетом этого полученному
установлено, что в широком интервале
соединению (или смеси соединений) была припи-
концентрации щелочей, по крайней мере в
сана общая формула Na3NpO4(OH)2∙nH2O.
пределах
[OH-]
=
0.5-15 моль·л-1, основной
формой существования семивалентных актинидов
Более детальное изучение кристаллизации на-
в растворах являются комплексные анионы
триевых солей с анионами [NpO4(OH)2]3- показа-
[AnO4(OH)2)]3- [4, 5, 8-10]. Они были выделены в
ло, что в ходе медленного упаривания растворов
виде многих солей, часто в виде монокристаллов,
Np(VII) с концентрацией LiOH 0.5-0.7 моль·л-1
с катионами щелочных, щелочноземельных
и NaOH 4-10 моль·л-1 над сухим KОН образуют-
элементов и некоторых комплексных трехзарядных
ся пять разных кристаллических фаз в виде тем-
катионов, относительно стабильных в щелочных
но-зеленых или черных кристаллов, имеющих
средах. Их синтез в виде монокристаллов,
индивидуальные порошковые рентгенограммы
исследование строения рентгеноструктурным
[13]. При дальнейшем изучении удалось получить
анализом (РСА) и некоторые свойства описаны
в виде монокристаллов три фазы, различающиеся
ниже.
числом молекул воды, и исследовать их строение
и свойства [14-16]. Их состав выражается форму-
2.1. Соединения анионов [AnO4(OH)2]3- с
лой Na3NpO4(OH)2·nH2O с n = 0, 2 и 4. Однако их
катионами Li+ и Na+
структура была определена фотометодом при от-
Первые сведения о литиевой соли Np(VII),
носительно большой погрешности позиционных
выделенной из щелочных сред, приведены в
и тепловых параметров атомов, поэтому в даль-
работе [11]. Медленным испарением раствора с
нейшем кристаллы этих соединений были выде-
концентрацией Np(VII) 0.04-0.06 моль·л-1 и LiOH
лены повторно, и уточнение их структуры было
0.2 моль·л-1 над СаСl2 и KОН были получены
проведено на основе экспериментальных данных,
темно-зеленые кристаллы, которые механически
полученных на автоматическом дифрактометре
отделяли от основной части неокрашенных твердых
[17-19].
частиц. На основе общих рассуждений и измерения
В ходе исследования [13] авторам не удалось
ИК спектров авторы приписали полученному
выявить условия раздельного образования ука-
соединению формулу NpO2(OH)3(OHLi)3. Она
занных выше гидратов. В примерно одинаковых
не была обоснована рентгеноструктурными
условиях наблюдалась кристаллизация разных
исследованиями и вызывает определенные
фаз или их смесей. Однако впоследствии было
сомнения с учетом результатов последующего
обнаружено [20], что на выход отдельных фаз
изучения химии An(VII).
существенное влияние оказывает температура
Предварительное изучение синтеза и неко-
высушивания растворов Np(VII) с высокой кон-
торых свойств натриевых солей с анионами
центрацией NaOH. Так, если образование соеди-
[NpO4(OH)2]3- было выполнено по методике, вклю-
нения Np(VII) проводится при 65-70°C, то полу-
чающей разбавление ~0.1 моль·л-1 Np(VII) в 0.5-
чаются черные игольчатые кристаллы безводного
0.7 моль·л-1 LiOH равным объемом ~16.5 моль·л-1
Na3NpO4(OH)2 (1) практически без примеси дру-
NaOH с последующей длительной выдержкой
гих фаз. При получении влажных солей в интерва-
раствора в эксикаторе над гранулированным KОН
ле 20-30°С кристаллизуется в основном дигидрат
[12]. В итоге получалась сухая масса с вкраплени-
Na3NpO4(OH)2∙2H2O (2) с той или иной приме-
ями крупных черных кристаллов. Последние отде-
сью тетрагидрата и безводной соли. Длительное
ляли механически, быстро промывали охлажден-
(сутки и более) выдерживание 0.03-0.05 моль·л-1
ной водой, метанолом, эфиром и сушили в струе
Np(VII) в 10-12 моль·л-1 NaOH при комнатной
воздуха. К сожалению, вследствие высокой скоро-
температуре в закрытых пробирках ведет к выде-
РАДИОХИМИЯ том 64 № 1 2022
6
КРОТ, ЧАРУШНИКОВА
лению из растворов крупных черных кристаллов
Na3NpO4(OH)2∙4H2O (3) без образования других
твердых фаз. Если же кристаллизация проводится
при низкой температуре (около -10°С), то из рас-
творов осаждаются хорошо ограненные черные
кристаллы гексагидрата Na3[NpO4(OH)2]∙6H2O (4).
Исследование его структуры показало (см. ниже),
Np
что гексагидрат идентичен с одной из фаз, обнару-
женных ранее в работе [13].
Для натриевых солей анионов [PuO4(OH)2]3- по
O
аналогии с соединениями [NpO4(OH)2]3- удалось
выделить только дигидрат Na3PuO4(OH)2∙2H2O
(2a), который оказался изоструктурен нептуниевой
H
соли [19].
Несколько необычными соединениями An(VII)
Рис. 1. Анион [NpO4(OH)2]3-.
оказались смешанно-анионные натриевые соли
Np(VII) и Pu(VII), содержащие в своем составе ги-
дроксил наряду с анионами [AnO4(OH)2)]3-. Они
соль, предположительно Li3NpO4(OH)2·nH2O, не
получены в виде черных кристаллов путем высу-
является структурным аналогом ни одному из из-
шивания в эксикаторе над гранулированным KОН
вестных гидратов натрия, описанных в работе [13].
смесей 0.05-0.08 моль·л-1 An(VII) в 2.5 моль·л-1
Соли Na3AnO4(OH)2∙nH2O. Исследование
LiOH с 3- и 4-кратным количеством 16.7 моль·л-1
строения натриевых солей общего состава
NaOH. РСА показал, что нептуниевое и плутоние-
Na3AnO4(OH)2∙nH2O показало, что An(VII) в
вое соединения изоструктурны и их состав описы-
структурах существует в виде комплексных
вается формулами Na4NpO4(OH)2(OH)·2H2O (5) и
анионов [AnO4(OH)2]3-, в которых кислородное
Na4PuO4(OH)2(OH)·2H2O (5a) [21].
окружение актинидных атомов представляет собой
На основе изученного строения натриевых солей
искаженную тетрагональную бипирамиду с группой
Np(VII) наиболее вероятно было предположить, что
AnO4 в средней плоскости бипирамиды и гидроксо-
выделенные кристаллы литиевой соли, упомянутой
группами в апикальных позициях. На рис. 1
выше [11], имели состав Li3NpO4(OH)2·nH2O. Для
представлено кислородное окружение An(VII) на
подтверждения этого предположения позже были
примере фрагмента структуры гексагидрата 4 [20].
выполнены дополнительные опыты по кристалли-
Усредненные величины межатомных рассто-
зации литиевых соединений Np(VII) из растворов
яний Np-O в группах NpO4 всех соединений
LiOH [20]. При этом все попытки воспроизвести
Na3NpO4(OH)2∙nH2O различаются несущественно
результаты работы [11] оказали безуспешными. Из
лежат в пределах 1.893-1.901 Å. Усредненные дли-
растворов с разными начальными концентрациями
ны связей Np-OH лежат в пределах 2.314-2.345 Å.
Np(VII) и LiOH после высушивания над гранулиро-
Для
изоструктурных
дигидратов
ванным KОН независимо от температуры в интерва-
Na3AnO4(OH)2∙2H2O наблюдается уменьшение
ле 5-25°С получались сухие остатки, состоявшие из
длин связей внутри координационного полиэдра
крупных кристаллов LiOH в смеси с очень мелкими
(КП) центрального атома An(VII) при переходе от
черными частицами соединений Np(VII). Высушен-
нептуния (соль 2) к плутонию (соль 2a) вследствие
ные образцы были практически рентгеноаморфны.
проявления актинидного сжатия [17-20].
Однако удалось получить порошковую рентгено-
грамму, снятую с образца влажной соли сразу после
В дальнейшем для всех структурно охарактери-
осаждения. Рентгенограмма состояла из уширен-
зованных изоструктурных пар солей с анионами
ных линий, что свидетельствует о низкой кристал-
[AnO4(OH)2]3- прослеживается тенденция к сокра-
личности образца. По данным рентгенофазового
щению длин связей в КП An(VII) при переходе от
анализа (РФА) было установлено, что полученная
Np(VII) к Pu(VII). При этом в большинстве случаев
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
7
H
Np
Na
O Pu
Na
H
O
Рис. 2. Слой из анионов [NpO4(OH)2]3- и катионов Na+ в
Рис. 3. Слой из анионов [PuO4(OH)2]3- и катионов Na+ в
структуре Na3NpO4(OH)2 (1) [17].
структуре Na3PuO4(OH)2·2H2O (2a) [19].
связи An-OH более чувствительны к актинидному
туры гексагидрата составляют электронейтральные
сжатию, чем связи с атомами кислорода группы
слои (рис. 5). В слое можно выделить цепочки из
NpO4.
катионов Na1+ (цепочка из КП атомов Na1 для на-
В
структурах
общего
состава
глядности выделена), окружение которых форми-
Na3AnO4(OH)2∙nH2O присутствуют два кристалло-
руют пять молекул воды и атом кислорода группы
графически независимых катиона Na+. В структу-
NpO4 аниона. Катионы Na2+ связываются с аниона-
рах солей с n = 0-4 один из независимых катионов
Na+ связывается с анионами [AnO4(OH)2]3-, образуя
анионные слои, второй независимый катион распо-
лагается в межслоевом пространстве. В безводной
соли 1 [14, 17] и дигидратах 2 [15, 18] и 2a [19] коор-
H
динационное окружение слоевого катиона Na+ фор-
Na
мируют атомы кислорода анионов [AnO4(OH)2]3-.
O
В структуре 1 (рис. 2) тетрагональные бипирамиды
Np
анионов [NpO4(OH)2]3- и искаженные октаэдры ато-
мов Na связываются общими ребрами, в структурах
2 и 2а двумя ребрами и двумя вершинами (рис. 3).
В структуре тетрагидрата 3 [16, 19] тетрагональные
бипирамиды анионов [NpO4(OH)2]3- и октаэдры
атомов Na в анионном слое связываются общими
вершинами (рис. 4) и в состав окружения слоевых
атомов Na включены две молекулы воды.
Строение гексагидрата
4
[20] отличается от
Рис. 4. Слой из анионов [NpO4(OH)2]3- и катионов Na+ в
строения остальных солей натрия. Основу струк-
структуре Na3NpO4(OH)2·4H2O (3) [19].
РАДИОХИМИЯ том 64 № 1 2022
8
КРОТ, ЧАРУШНИКОВА
Na1
O
H
Np
Na2
Рис. 5. Электронейтральный слой в структуре Na3NpO4(OH)2∙6H2O (4) [20].
ми [NpO4(OH)2]3- в бесконечные анионные цепочки
для гексагидрата 4. Следовательно в случае натрие-
[(Na2)NpO4(OH)2(H2O)2]2- так, что боковые ребра
вых солей в безводной соли 1, в структуре которой
аниона являются ребрами искаженного октаэдра
возникают очень слабые Н-связи с участием ОН-
атома Na2. Электронейтральные слои связаны меж-
групп (межатомные контакты О···О равны 3.025 Å),
ду собой водородными связями.
гидроксо-лиганд более предпочтителен для внеш-
несферного взаимодействия с катионами Na+. В ги-
На примере гидратов Na3AnO4(OH)2∙nH2O с
дратах ОН-группы участвуют в прочных Н-связях,
n = 0-4 можно попытаться проанализировать, какие
и это уменьшает внешнесферное взаимодействие с
из атомов кислорода анионов [AnO4(OH)2]3- (оксо
катионами Na+.
или гидроксо) более склонны к внешнесферным
взаимодействиям. В безводной соли связи Na-O с
Соли Na4AnO4(OH)2OH∙2H2O. Кристал-
атомами кислорода группы NpO4 на ~0.05 Å слабее
лические
смешанно-анионные
соединения
связей с атомами кислорода ОН-групп. Такая же
Na4AnO4(OH)2OH∙2H2O (5 и 5a) включают в свою
картина наблюдается и для межслоевого катиона
структуру внешнесферные ионы OH- [21]. Анио-
Na+ с тетрагональным кислородным окружением. В
ны [AnO4(OH)2]3- в кристаллах находятся в общем
случае дигидратов 2 и 2а взаимодействие слоевых
положении и усредненные значения длин связей
катионов Na+ с атомами кислорода ОН-групп силь-
An-O в группировках AnO4 равны 1.894 и 1.889 Å,
но ослабевает (на ~0.2 Å) под влиянием водородно-
у связей An-OH они равны 2.338 и 2.317 Å для сое-
го связывания, в котором ОН-группы выступают как
динений Np(VII) и Pu(VII) соответственно.
доноры и как акцепторы протонов. В тетрагидра-
В структурах 5 и 5a присутствуют четыре не-
те 3 ОН-группы вообще не входят в координацион-
зависимых катиона Na+, из которых три образуют
ную сферу слоевого катиона Na+. Для межслоевых
совместно с анионами [AnO4(OH)2]3- электроней-
катионов Na+ наблюдается то же самое, ОН-группа
тральные слои. Между слоями располагаются до-
либо не входит в координационную сферу межсло-
полнительный катион Na+, молекулы воды и внеш-
евого Na (2 и 2a), либо образует более слабую связь
несферный гидроксил. В кристаллах 5 и 5a присут-
Na-O (3). В целом такая же картина наблюдается и
ствует трехмерная сеть H-связей.
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
9
2.2. Соединения анионов [AnO4(OH)2]3- с
ляли при 70°С на сутки. В итоге были получены
катионами K+, Rb+ и Cs+
плотные осадки с вкраплениями черных призмати-
ческих (рубидиевая соль) и ромбовидных (цезиевая
Синтез
монокристаллов
солей
соль) монокристаллов, пригодных для структурных
M3AnO4(OH)2∙nH2O (M+ = K, Rb, Cs) был про-
исследований, которые подтвердили, что состав со-
веден преимущественно путем разбавления в
единений описывается формулами 9a и 10a.
2-3 раза растворов, содержащих 0.05-0.15 моль·л-1
An(VII) в 0.5-2 моль·л-1 LiOH, концентрирован-
Попытки приготовить монокристаллы низших
ными растворами MOH с последующим высуши-
гидратов калиевых солей Np(VII) и Pu(VII) по ана-
ванием смесей в эксикаторе над гранулирован-
логии с получением моногидратов рубидиевых и
ным KОН при комнатной или пониженной тем-
цезиевых солей An(VII) не дали положительных
пературе
[12,
22-26]. Рентгенодифракционные
результатов. В случае Np(VII) кристаллизация при
эксперименты подтвердили состав соединений,
70-75°С приводила к образованию только дигидра-
выражаемый формулами K3AnO4(OH)2∙2H2O
(6,
та 6, однако с повышением температуры до 105°С
6a) [22, 23], Rb3AnO4(OH)2∙3H2O (7, 7a) [24, 25] и
наблюдалось образование кристаллов безводной
Cs3AnO4(OH)2∙3H2O (8, 8a) [24-26].
соли K3NpO4(OH)2 (11) [28]. Получить таким путем
K3PuO4(OH)2 не удалось вследствие восстановле-
По другому варианту
[20] соединения
ния Pu(VII) до шестивалентного состояния.
M3NpO4(OH)2∙nH2O можно синтезировать путем
смешивания 0.1-0.2 моль·л-1 растворов Np(VII),
Структурные исследования показали, что все од-
приготовленных
озонированием
суспензии
нотипные калиевые, рубидиевые и цезиевые соли
NpO2OH в ~2 моль·л-1 LiOH, с трехкратным объ-
с анионами [NpO4(OH)2]3- изоструктурны с анало-
емом концентрированного (≥11 моль·л-1) гидрок-
гичными соединениями [PuO4(OH)2]3-. Кроме того,
сида MOH с последующей выдержкой смесей в
изоструктурность имеет место и в случае одинако-
холодильнике при температуре -10°С в течение
вых по количеству молекул воды солей и рубидия и
2-5 сут. Из растворов выделяются крупные черные
цезия (табл. 1). Структуры же K3AnO4(OH)2∙2H2O
кристаллы, которые отделяли путем фильтрации
(6 и 6а) существенно отличаются от структур соот-
под вакуумом на стеклянном фильтре, промывкой
ветствующих натриевых солей 2 и 2a. Не изострук-
охлажденным (T ≤ 0°C) спиртом и выдержкой 1-2 ч
турны также безводные соли K3NpO4(OH)2 (11) и
в струе осушенного воздуха. Соединения выделя-
Na3[NpO4(OH)2] (1).
ются с выходом более 90%.
Как и в случае натриевых солей, в структурах
В дальнейшем было показано [27], что высуши-
M3AnO4(OH)2∙nH2O (M+ = K, Rb, Cs; n = 0, 1, 2, 3)
вание смесей Np(VII) с концентрированными рас-
кислородное окружение актинидных атомов в анио-
творами RbOH или CsOH над гранулированным
нах [AnO4(OH)2]3- имеет форму слегка искаженных
KОН, как описано выше, но при 70-75°C, ведет к
тетрагональных бипирамид. Усредненные значения
кристаллизации моногидратов Rb3NpO4(OH)2∙H2O
межатомных расстояний Np-O групп NpO4 в эква-
(9) и Cs3NpO4(OH)2∙H2O (10). Подобным же обра-
ториальном поясе бипирамид в нептуниевых соеди-
зом были получены также соли Rb3PuO4(OH)2∙H2O
нениях различаются незначительно (1.888-1.905 Å)
(9a) и Cs3PuO4(OH)2∙H2O (10a). Однако, их синтез,
и практически не зависят от природы щелочного
учитывая меньшую устойчивость Pu(VII) в щелоч-
катиона и числа молекул воды в составе солей [24,
ных растворах по сравнению с Np(VII), проводили
25, 27, 28]. Аналогичная картина наблюдается и в
по несколько видоизмененной методике. Она вклю-
случае соединений плутония (1.879-1.889 Å) [23,
чала следующие стадии.
25-27]. Длины связей An-OH в отличие от связей
Пробы по 0.2 мл концентрированных растворов
An-O в группах AnO4 анионов [AnO4(OH)2]3- су-
RbOH и CsOH помещали в бюкс с гранулирован-
щественно варьируются. Разброс длин связей с
ным KOH и выдерживали в течение 30 мин при
OH-группой в анионах [NpO4(OH)2]3- находится
70°С. Затем к нагретым щелочам добавляли по
в пределах 2.323-2.410 Å (Δ = 0.087 Å), в анио-
0.05 мл свежеполученного раствора 0.11 моль·л-1
нах [PuO4(OH)2]3- - в пределах 2.328-2.373 Å (Δ =
Pu(VII) в 3 моль·л-1 LiOH и закрытые бюксы остав-
0.045 Å).
РАДИОХИМИЯ том 64 № 1 2022
10
КРОТ, ЧАРУШНИКОВА
Np O
K
Np
O
H
H
Рис. 6. Слой из анионов [NpO4(OH)2]3- и катионов K+ в
Рис. 7. Слой из анионов [NpO4(OH)2]3- в структуре
структуре K3NpO4(OH)2·2H2O (6) [23].
K3AnO4(OH)2 (11) [28].
Соли K3AnO4(OH)2·nH2O. В кристаллах ди-
ваться между тетрагональными бипирамидами
гидратов 6 [22, 23] и 6a [23] присутствуют два
[NpO4(OH)2]3-. Кроме того, маленькие катионы
независимых катиона K+. В структуре можно
Na+ не препятствуют образованию слабых H-свя-
выделить анионные слои, состоящие из катио-
зей типа O-H···ONpO4 между слоями (межатомные
нов K+ и анионов [AnO4(OH)2]3- (рис. 6). В слое
расстояния Np···Np в межслоевом пространстве
8-вершинники атомов K связаны с двумя аниона-
5.953 Å, в слое - 5.908 Å). В случае калиевой соли
ми общими ребрами и с двумя анионами общими
слабое водородное взаимодействие осуществля-
вершинами, подобно тому, как было найдено в
ется только в анионном слое, здесь расстояния
Na3AnO4(OH)2∙2H2O (2, 2a) [15, 18, 19]. 9-Вершин-
Np···Np 5.976 Å, расстояние Np···Np между слоями
ники межслоевого атома K объединяются общими
больше (6.353 Å).
гранями, образуя прослойку между анионными
СолиM3AnO4(OH)2∙3H2OиM3AnO4(OH)2∙H2O,
слоями.
M = Rb, Cs. Соединения с крупными катиона-
В структуре безводной калиевой соли 11 [28]
ми Rb+ и Cs+, представленные тригидратами
можно выделить слои из анионов [NpO4(OH)2]3-,
M3AnO4(OH)2∙3H2O (7, 7a, 8, 8a) и моногидратами
связанных между собой слабыми водородны-
M3AnO4(OH)2∙H2O (9, 9a, 10, 10a), имеют следую-
ми связями (межатомные контакты О···О равны
щее строение.
3.025 Å) (рис. 7). Два независимых катиона K+ рас-
В кристаллах четырех изоструктурных триги-
полагаются в межслоевом пространстве, имеют
дратов рубидия (7, 7a) [24, 25] и цезия (8, 8a) [24,
кислородное окружение в виде 7- и 8-вершинни-
26] присутствуют два независимых катиона M1+ и
ков и связываются общими гранями в катионные
M2+, их КП описываются как 11- и 12-вершинни-
слои.
ки. В кристаллах четырех изоструктурных моно-
Структуры безводных калиевой соли 11 и ис-
гидратов рубидия (9, 9a) и цезия (10, 10a) [27] при-
следованной ранее натриевой соли 1 [14, 17] су-
сутствуют три кристаллографически независимых
щественно отличаются друг от друга. Причиной
катиона M+: катион M1+ имеет координационное
является различие в ионных радиусах катионов
число (КЧ), равное 10, катионы M2+ и M3+ - КЧ 11.
Na+ и K+, позволяющее октаэдрами Na встраи-
Окружение анионов [AnO4(OH)2]3- катионами Rb+
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
11
(а)
(б)
Cs2
Cs1
Rb1
Cs3
Rb2
H
Rb1
Rb1
O
H
O
Cs3
Cs2
Pu
Cs1
Pu
Cs1
Cs3
Rb1
Rb1
Rb2
Cs1
Cs2
Rb1
Рис. 8. Окружение анионов [PuO4(OH)2]3- в структурах: (а) тригидрата Rb3PuO4(OH)2∙3H2O (7a) [25]; (б) моногидрата
Cs3PuO4(OH)2∙H2O (10a) [27].
или Cs+ в тригидратах (рис. 8, а) и моногидратах
для пары Na4AnO4(OH)2OH∙2H2O (5 и 5a) разница в
(рис. 8, б) показано на примере плутониевых солей
объеме, приходящемся на одну формульную едини-
7a [25] и 10a [27].
цу, составляет ~4 Å3. В целом же для изоструктур-
ных тригидратов Rb и Cs наблюдается бóльшая раз-
В структуре тригидратов 7, 7a, 8, 8a условно
ница в объемах, чем у моногидратов. Также налицо
можно выделить слои из анионов [AnO4(OH)2]3- и
тенденция к увеличению объема, приходящегося на
катионов M1+, где каждый анион окружен шестью
одну формульную единицу, при переходе от Rb к Cs
катионами M1+. Между слоями располагаются зиг-
как у солей типа M3AnO4(OH)2∙3H2O, так и у солей
загообразные цепочки из КП катионов M2+.
M3AnO4(OH)2∙H2O.
В структуре моногидратов 9, 9a, 10, 10a каждый
анион окружен десятью катионами, их КП связыва-
2.3. Смешанно-катионные соединения анионов
ются общими гранями в катионный каркас, в поло-
[AnO4(OH)2]3-
стях которого помещаются анионы [AnO4(OH)2]3-.
Все рассмотренные выше соединения общего
В формировании кристаллических упаковок со-
состава M3AnO4(OH)2∙nH2O c M+ = K-Cs были
лей рубидия и цезия состава M3AnO4(OH)2∙nH2O
приготовлены с использованием растворов
существенную роль играют H-связи, в которых
An(VII) в LiOH. Однако опыты показали, что при
донорами протонов выступают молекулы воды и
введении в исходный раствор Np(VII) или Pu(VII)
OH-группы анионов. Акцепторная способность
значительных количеств NaOH совместно с ионами
атомов кислорода различных групп уменьшается по
Rb+ или Cs+ можно получить смешено-катионные
ряду OH > AnO4 > Ow.
соли общего состава NaM2AnO4(OH)2·4H2O (M+ =
Как отмечалось выше, однотипные соли ще-
Rb, Cs) (12-16) и состава NaRb5(PuO4(OH)2)2·6H2O
лочных элементов с анионами
[NpO4(OH)2]3-
(17). Ниже приведены более подробные методики
синтеза этих соединений, а также комплекса с
изоструктурны с аналогичными
соединениями
[PuO4(OH)2]3-. При переходе от нептуниевой к соот-
гуанидинием состава Li(C(NH2)3)2NpO4(OH)2∙6H2O
(18).
ветствующей плутониевой соли наблюдается сокра-
щение параметров кристаллических решеток под
Соли с анионами [NpO4(OH)2]3-. В случае приго-
влияние актинидного сжатия (табл. 1). Например,
товления рубидиевых солей NaRb2NpO4(OH)2·4H2O
РАДИОХИМИЯ том 64 № 1 2022
12
КРОТ, ЧАРУШНИКОВА
(а)
Np
Na
O
H
(б)
H O
Na
Np
Рис. 9. Сдвоенные полиэдры Np(VII) и Na в структуре NaRb2NpO4(OH)2·4H2O (12) [30], связанные H-связями O-H···ONpO4 (а).
Цепочка из полиэдров Np(VII) и Na в структуре NaRb2NpO4(OH)2·4H2O (13) [30] (б).
(12, 13) [29, 30] к пробам 0.11 моль·л-1 Np(VII)
[NpO4(OH)2]3- связываются с октаэдрами Na в
в 1.3 моль·л-1 LiOH добавляли примерно рав-
пары общим ребром в средней плоскости бипира-
ный объем 7 моль·л-1 NaOH с концентрацией
миды (группа NpO4, рис. 9, а) [30]. Межатомное
RbCl ~5 моль·л-1. Для получения цезиевой соли
расстояние Np···Na в паре 3.376 Å. H-связи типа
NaCs2NpO4(OH)2·4H2O (14) к пробам 0.11 моль·л-1
Ow-H···ONpO4 объединяют пары между собой, об-
разуя трехмерную сеть. В структуре присутствуют
Np(VII) в ~1 моль·л-1 LiOH добавляли насыщенный
два кристаллографически независимых катиона
раствор Cs2SO4 в 6 моль·л-1 NaOH. Растворы остав-
Rb+ с КЧ 10 и 12. В кристаллической упаковке 12
ляли на медленное испарение в эксикаторе с грану-
полиэдры рубидия связываются в катионный каркас
лированным KОН. Спустя 2-3 сут Np(VII) практи-
с каналами, в которых располагаются пары из те-
чески количественно выделялся в виде кристаллов
трагональных бипирамид Np(VII) и октаэдров Na.
черного цвета.
В кристаллической упаковке рубидиевой соли 13
Важнейшие кристаллографические характери-
[30] центросимметричные анионы [NpO4(OH)2]3- и
стики указанных выше смешанно-катионных солей
октаэдры Na, связанные в цепочки общими верши-
представлены в табл. 2. Обе рубидиевых соли (12,
нами (рис. 9, б). Межатомное расстояние Np···Na в
13) имеют одинаковый состав, но разное строение.
цепочке 4.248 Å. H-связи с участием молекул воды
Цезиевая соль (14) также имеет подобный состав -
в гидратной оболочке катионов Na+ объединяют це-
это тетрагидрат, но она не изоструктурна ни одному
почки из полиэдров атомов Np и Na в слои. Слои
из соединений 12, 13.
между собой связываются прочными H-связями с
В кристаллической упаковке рубидиевой
участием OH-группы в качестве акцептора протона
соли
12 тетрагональные бипирамиды анионов (Ow···OOH 2.646 Å). В результате в кристалле обра-
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
13
РАДИОХИМИЯ том 64 № 1 2022
14
КРОТ, ЧАРУШНИКОВА
(а)
H2
Ow1
Na
H3
H4
Np
H1
Ow2
H5
(б)
Ow1
H3
H2H4
Na
Ow2
H5
Pu
H1
Рис.
10. Цепочки из сдвоенных полиэдров An(VII) и Na в структурах: (а) NaRb2NpO4(OH)2·4H2O
(14)
[30];
(б) NaCs2PuO4(OH)2·4H2O (16) [31].
зуется трехмерная сеть H-связей. Слой из цепочек
Слои из анионов [NpO4(OH)2]3- и катионов Na+
КП Np и Na перемежается слоем из крупных катио-
перемежается слоями из крупных катионов Cs+ с
нов Rb+ с КЧ 12.
КЧ 12.
В кристаллической упаковке цезиевой
Соли с анионами [PuO4(OH)2]3-. Синтез сме-
соли 14 КП атомов Np и Na, образуют пары, свя-
шанно-катионных солей с анионом [PuO4(OH)2]3-
занные общим ребром в средней плоскости бипира-
осуществляли с применением 0.16 моль·л-1 Pu(VII)
миды (группа NpO4) [30]. Межатомное расстояние
в ~3 моль·л-1 LiOH (15, 16) или 0.08 моль·л-1 Pu(VII)
Np···Na в паре равно 3.350 Å. H-связи через атомы
в ~4 моль·л-1 NaOH (17) [31].
H2 и H3 молекулы воды Ow1 и атома H4 молекулы
Для получения рубидиевых и цезиевых со-
воды Ow2 воды в гидратной оболочке Na объединя-
лей к пробе свежеполученного раствора Pu(VII)
ют сдвоенные полиэдры атомов Np и Na в цепочки
в LiOH добавляли равный объем 11.5 моль·л-1
(рис. 10а). Цепочки объединяются в слои Н-связя-
RbOH или ~7 моль·л-1 CsOH и полученные смеси
ми в участием атома H5 молекулы воды Ow2. На
разбавляли в три раза 16.7 моль·л-1 NaOH. Сме-
рис. 11а представлена проекция одного слоя вдоль
направления [001] в кристалле. Между слоями из
си оставляли в эксикаторе над гранулированным
полиэдров Np и Na практически отсутствует взаи-
KОН. Спустя 4 сут образовались черные пластин-
модействие с участием атомов H1 гидроксо-групп
чатые кристаллы, и РСА подтвердил образова-
и атомов кислорода из соседнего слоя, наименьший
ние солей состава NaRb2PuO4(OH)2·4H2O (15) и
межатомный контакт OOH···ONpO4 равен 3.436 Å.
NaCs2PuO4(OH)2·4H2O (16).
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
15
(а)
0
b
H
O
Np
Na
a
(б)
0
b
O
H
Pu
Na
a
Рис. 11. Цепочки в структуре NaRb2NpO4(OH)2·4H2O (14) [30], объединенные H-связями в слои, проекция вдоль [001] (а).
Цепочки в структуре NaCs2PuO4(OH)2·4H2O (16) [31], проекция вдоль [001] (б).
Монокристаллы соли NaRb5(PuO4(OH)2)2·6H2O
этом протоны OH-групп взаимодействуют с ато-
(17)
[29, 31] были приготовлены добавлением к
мами кислорода молекул воды Ow2 из гидратной
пробе свежеполученного раствора Pu(VII) в NaOH
оболочки связанного в пару атома Na (OOH···Ow
равного объема 11.5 моль·л-1 RbOH и 16.7 моль·л-1
3.142 Å). Образованию этой очень слабой H-связи
NaOH. Смесь выдерживали 4 сут в эксикаторе над
способствует эффект актинидного сжатия, так как
гранулированным KОН.
межатомное расстояние в паре Pu···Na на ~0.02 Å
По данным РСА оказалось, что рубидиевые те-
меньше межатомного расстояния в паре Np···Na.
трагидраты Pu(VII) 15 и Np(VII) 12 изоструктур-
Из-за того что полиэдры Pu и Na расположены друг
ны (табл. 2). Цезиевые тетрагидраты Np(VII) 14 и
относительно друга иначе, чем полиэдры Np и Na
Pu(VII) 16 кристаллизуются в одной и той же про-
в структуре 14, возникают Н-связи другой направ-
странственной группе, но с разными параметрами
ленности. Цепочки из полиэдров Pu и Na в струк-
ячейки. В структуре 16 КП атомов Pu и Na связыва-
туре 16 не связываются в слои (рис. 11б), крупные
ются в пары общим ребром и сдвоенные полиэдры
также связываются H-связями в цепочки (рис. 10б),
катионы Cs+ (КЧ 12) встраиваются в большие поло-
межатомное расстояние Pu···Na равно 3.330 Å. При
сти между цепочками.
РАДИОХИМИЯ том 64 № 1 2022
16
КРОТ, ЧАРУШНИКОВА
O
H
Pu
Na
Рис. 12. Фрагмент структуры NaRb5(PuO4(OH)2)2·6H2O (17) [31].
Соединение 17 выпадает из общего ряда, оно
ставу является в определенном смысле уникальным
отличается меньшим содержанием Na. В структуре
среди описанных выше солей аниона [NpO4(OH)2]3-
присутствуют 3 независимых катиона Rb+ с КП в
с однозарядными катионами щелочных элементов.
виде 11-, 12- и 13-вершинников. Они связываются в
Последние были синтезированы только из сильно-
катионный каркас, в который встраиваются не свя-
щелочных сред, в то время как соединение 18 уда-
занные между собой анионы [PuO4(OH)2]3- и гидра-
лось впервые получить из растворов с низкой (ме-
тированные катионы Na+, межатомное расстояние
нее 0.1 моль·л-1) концентрацией ионов OH-. Кроме
Pu···Na равно 5.1243(1) Å. Координационное окру-
того, гуанидиниевая соль является пока единствен-
жение атомов натрия формируют шесть молекул
ным структурно изученным и сравнительно устой-
воды, образуя КП в виде слабо искаженного октаэ-
чивым соединением Np(VII), в состав которого вхо-
дра. Каждый КП Na+ связывается с шестью аниона-
дит однозарядный органический катион. Синтез 18
ми [PuO4(OH)2]3- через H-связи (рис. 12).
проводили следующим образом.
Сравнивая строение соединений общего состава
К отмеренному объему раствора 0.15 моль·л-1
NaM2AnO4(OH)2·4H2O (M+ = Rb, Cs), прежде всего
Np(VII) в 0.8 моль·л-1 LiOH добавляли раствор
отметим тот удивительный факт, что только одно
0.5 моль·л-1 гуанидиннитрата в количестве, необхо-
плутониевое соединение 15 изоструктурно своему
димом для нейтрализации LiOH и создания избыт-
нептуниевому аналогу 12. В анионах [AnO4(OH)2]3-
ка, в ~3 раза превосходящего содержание Np(VII)
структур 12-17 усредненная длина связей An-O с
в пробе. Полученный раствор выдерживали в хо-
атомами кислорода групп AnO4 равна 1.893 Å для
лодильнике (T ~5°С) в бюксе с гранулированным
Np(VII) 1.886 Å для Pu(VII). Усредненная дли-
KОН. Для структурных исследований удалось ото-
на связей An-OH равна соответственно 2.363 и
брать тонкий пластинчатый кристалл из пробы на
2.326 Å. В структурах 12-17 проявляется отклоне-
начальном этапе кристаллизации продукта.
ние от идеального строения анионов [AnO4(OH)2]3-
В структуре
18 два независимых аниона
под влиянием водородного связывания.
[NpO4(OH)2]3- с центральными атомами Np1 и
Соль Li(C(NH2)3)2NpO4(OH)2∙6H2O. Комплекс
Np2 [32]. В кристалле можно выделить слои, об-
с гуанидинием 18 [32] по условиям получения и со- разованные анионами с центральным атомом Np2,
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
17
окруженным четырьмя ионами [C(NH2)3]+. Гидра-
они имеют различающиеся кристаллические решет-
тированные катионы Li+ имеют КП в виде тетраэ-
ки. Пластинчатая фаза легко получается в виде мо-
дров, образованного атомами кислорода четырех из
нокристаллов при выдержке в холодильнике 2-5 сут
шести независимых молекул воды, две молекулы
раствора с концентрацией 0.02 моль·л-1 Np(VII),
воды являются кристаллизационными. КП кати-
4-5 моль·л-1 LiOH и 0.025 моль·л-1 Co(NH3)6Cl3.
онов Li+ объединяются H-связями в зигзагообраз-
По данным РСА [34, 35], состав соединения соот-
ные цепочки. Анионы с центральным атомом Np1
ветствует формуле Co(NH3)6NpO4(OH)2·2H2O (19).
располагаются между цепочками гидратированных
Для изучения состава и структуры игольчатой
катионов Li+. Трехмерная сеть водородных связей
фазы Co(NH3)6NpO5·nH2O первоначально было
объединяет все составные части структуры. В отли-
уточнено влияние условий осаждения Np(VII) ио-
чие от соединений с внешнесферными катионами
нами [Co(NH3)6]3+ на фазовый состав осадков и его
Na+, K+, Rb+ и Cs+, где атомы кислорода анионов
изменение в маточном растворе во времени [35].
[NpO4(OH)2]3- включены в КП атомов щелочных
Эксперименты показали, что из разбавленных рас-
металлов, катионы Li+ и [C(NH2)3]+ взаимодейству-
творов Np(VII) с концентрацией LiOH 0.5-2 моль·л-1
ют с кислородным окружением Np(VII) только че-
в интервале 5-25°С образуются только пластинча-
рез атомы водорода с образованием сложной систе-
тые кристаллы. Однако с увеличением концентра-
мы H-связей типа Ow-H···O и N-H···O.
ции LiOH до ≥4 моль·л-1 при 5-15°С из раствора
первоначально выделяются чистая игольчатая фаза.
2.4. Соединения анионов [AnO4(OH)2]3- с трех-
Повышение температуры до 25°С способствует об-
зарядными комплексными катионами
разованию пластинчатой фазы даже при высокой
Кроме описанных выше катионов, для выде-
концентрации щелочи. Следует особо отметить,
ления Np(VII) и Pu(VII) из растворов с высокой
что с ростом концентрации LiOH и с понижением
концентрацией ионов ОН- пригодны некоторые
температуры скорость образования осадков замед-
трехзарядные комплексные катионы, относительно
ляется и увеличивается размер кристаллов обеих
устойчивые к действию щелочей. Из них особенно
фаз. Кроме того, одновременно снижается скорость
удобным и эффективным оказался [Co(NH3)6]3+.
перехода иголок в пластинки. Так, в маточном рас-
Так, уже в ранней работе [2] методом совместного
творе с T = 5°С и концентрацией щелочи 5 моль·л-1
слива растворов с концентрацией Np(VII) 3-5 г/л в
игольчатая фаза сохраняется без изменения более
1-2 моль·л-1 NaOH и 0.05-0.1 моль·л-1 Co(NH3)6Cl3
суток.
в 0.5-1 моль·л-1 NaOH было получено соединение
С учетом полученных результатов для приготов-
в виде темно-зеленых пластинчатых кристаллов,
ления игольчатых кристаллов Co(NH3)6NpO5·nH2O в
которое после промывки водой, ацетоном и эфи-
сухом виде были выбраны следующие условия осаж-
ром и сушки на воздухе имело состав, соответ-
дения: [Np(VII)] = 0.01 моль·л-1, [OH-] = 4 моль·л-1,
ствующий брутто-формуле Co(NH3)6NpO5·nH2O
[Co(NH3)6Cl3] = 0.015 моль·л-1 и T = 5-7°C. Обра-
c n ~3. Соединение практически нерастворимо в
зовался мелкокристаллический осадок, порошковая
воде и спирте, но заметно растворяется в щелочах
рентгенограмма которого показала, что продукт яв-
[33]. Его произведение растворимости в 1 моль·л-1
ляется чистой, хорошо закристаллизованной иголь-
NaOH при 20°C равно ~5 × 10-8 и резко снижается с
чатой фазой. Свежеприготовленное соединение
уменьшением [OH-]. Было также обнаружено, что
сразу же анализировали на Np(VII) спектрофотоме-
Co(NH3)6NpO5·nH2O может быть получен в виде
трически и на кобальт весовым методом. По данным
пластинчатых и игольчатых кристаллов. Игольчатая
анализов первоначальный состав соединения мож-
фаза Co(NH3)6NpO5·nH2O неустойчива под слоем
но выразить формулой Co(NH3)6NpO4(OH)2∙nH2O c
маточного раствора с невысокой концентрацией
n ≈ 1.
ионов ОН- (0.3-1.5 моль·л-1) и при комнатной тем-
Игольчатые кристаллы, пригодные для рентге-
пературе достаточно быстро переходит в пластин-
ноструктурных измерения, были получены мето-
чатую.
дом встречной диффузии. В пробирку была ото-
Анализ порошковых рентгенограмм игольчатой и
брана проба 0.05 моль·л-1 Np(VII) в 10 моль·л-1
пластинчатой фаз Co(NH3)6NpO5·nH2O показал, что
NaOH, затем осторожно залит промежуточный
РАДИОХИМИЯ том 64 № 1 2022
18
КРОТ, ЧАРУШНИКОВА
слой 7 моль·л-1 NaOH и сверху помещен раствор
трическое количество [Pt(NH3)5Cl]Cl3 и выпавший
0.05 моль·л-1 Co(NH3)6Cl3. Пробу выдерживали
мелкокристаллический темно-зеленый осадок бы-
в холодильнике при 5-7°С в течение 7 сут. Обра-
стро отделяли от маточного раствора на стеклянном
зовавшийся садок отделяли от маточного раство-
фильтре под вакуумом, промывали водой и сушили
ра декантацией, промывали охлажденной водой
в струе воздуха. Избыток осадителя недопустим,
и оставляли на воздухе до полного высыхания.
поскольку он вызывает быстрое восстановление
Из полученной сухой смеси выбирали игольчатые
Pu(VII). По результатам анализа состав соединения
кристаллы, пригодные для РСА. Результаты рент-
выражается формулой [Pt(NH3)5Cl]PuO5·nH2O.
генодифракционного исследования показали, что
Строение
соединений
[Cr(NH3)6]3+
и
игольчатая фаза Co(NH3)6NpO5·nH2O представляет
[Pt(NH3)5Cl]3+ с анионами
[AnO4(OH)2]3- не
собой соль (Co(NH3)6)3(NpO4(OH)2)3∙4H2O (20), что
изучалось. Однако, учитывая аналогию в ус-
удовлетворительно согласуется с данными химиче-
ловиях и характере их осаждения с синтезом
ских анализов.
Co(NH3)6NpO4(OH)2·2H2O, можно с большой веро-
Ионы [Co(NH3)6]3+ были опробованы в роли оса-
ятностью утверждать, что формулы этих соединений
дителей также для [PuO4(OH)2]3-. Первые попытки
следует записывать как Cr(NH3)6NpO4(OH)2·nH2O и
в этом направлении были безуспешными [36]. Опы-
[Pt(NH3)5Cl]AnO4(OH)2·nH2O.
ты показали, что добавление Co(NH3)6Cl3 к раство-
Соединение [Co(en)3]3+ c [NpO4(OH)2]3- пер-
ру Pu(VII) в 0.5-1 моль·л-1 щелочи вызывает бы-
воначально синтезировали добавлением избытка
строе восстановление последнего до шестивалент-
0.1 моль·л-1 Co(en)3Cl3 к 0.02-0.03 моль·л-1 Np(VII)
ного состояния. Однако позже [37] было установ-
в 2 моль·л-1 KОН с последующим отделением
лено, что при добавлении к раствору 0.02 моль·л-1
осадка на стеклянном фильтре, промывкой охлаж-
Pu(VII) в 5 моль·л-1 NaOH небольшого избытка
денной водой, спиртом и сушкой в струе воздуха
Co(NH3)6Cl3 выделяется темно-зеленый кристалли-
[39]. Оно выделялось в виде тонких темно-зеленых
ческий осадок, который неустойчив под слоем ма-
пластинок, обладающих повышенной растворимо-
точного раствора, но может быть выделен быстрой
стью в щелочах. Позже [40] на основе дополни-
фильтрацией на стеклянном фильтре, промыт водой
тельных опытов были выбраны условия получения
и высушен в эксикаторе над CaCl2. Полученный
соединения в виде монокристаллов, пригодных для
продукт имеет состав, выражаемый брутто-форму-
РСА. К пробе 0.05 моль·л-1 Np(VII) в 0.35 моль·л-1
лой Co(NH3)6PuO5·3H2O, и достаточно устойчив
LiOH, охлажденной в стакане со льдом, добавляли
при хранении в сухом виде.
трехкратный избыток 0.5 моль·л-1 Co(en)3Cl3. При
Помимо
[Co(NH3)6]3+, в качестве осадителя
этом выпадал объемистый мелкокристаллический
Np(VII) из щелочных растворов можно использо-
осадок, в котором через 15 мин появились быстро
вать катионы [Cr(NH3)6]3+, [Со(en)3]3+ (en - этилен-
растущие друзы зеленых кристаллов, состоящие
диамин, H2N(CH2)2NH2) и [Pt(NH3)5Cl]3+. Так, до-
из тонких ромбических пластинок. Перекристал-
бавление избытка Cr(NH3)6Cl3 к щелочным раство-
лизация осадка закончилась в течение примерно
рам Np(VII) приводит к выделению темно-бурого
получаса. Из полученного продукта был выбран
осадка состава Cr(NH3)6NpO5·nH2O c n в пределах
пластинчатый кристалл для рентгеноструктурно-
1-3 [38]. Это соединение неустойчиво при хране-
го исследования. Результаты последнего показа-
нии вследствие восстановления Np(VII). Было так-
ли, что состав соединения выражается формулой
же установлено, что при добавлении насыщенного
Co(en)3NpO4(OH)2∙5H2O (21).
раствора [Pt(NH3)5Cl]Сl3 к Np(VII) в 0.5-1 моль·л-1
NaOH выпадает плотный темно-зеленый осадок,
Соли с катионом [Co(NH3)6]3+. Важнейшие
который после промывки водой, спиртом и высу-
кристаллографические характеристики соединений
шивания на воздухе имеет состав, соответствую-
представлены в табл. 3. Структуры 19 и 20 при-
щий брутто-формуле [Pt(NH3)5Cl]NpO5·nH2O [33].
надлежат к островному типу и состоят из тетраго-
Аналогичное соединение было приготовлено и
нально-бипирамидальных анионов [NpO4(OH)2]3-,
в случае Pu(VII) [37]. Для его синтеза к раствору
октаэдрических катионов [Co(NH3)6]3+ и молекул
Pu(VII) в 2-5 моль·л-1 NaOH добавляли стехиоме-
кристаллизационной воды [34, 35].
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
19
Таблица 3. Кристаллографические данные комплексов с 3-х зарядными катионами и цепочечных соединений
Простран-
Параметры ячейки
V, Å3;
Соединение
ственная
Ссылки
Z
a, Å
b, Å
c, Å
α, град
β, град
γ, град
группа
Co(NH3)6NpO4(OH)2·2H2O (19)
P21/n
622.15; 2
6.7747
8.4633
10.8733
90
93.681
90
[35]
-
(Co(NH3)6)3(NpO4(OH)2)3∙4H2O
P1
867.27; 1
8.5967
10.0499
11.3250
68.060
73.966
89.544
[35]
(20)
[Co(en)3]NpO4(OH)2∙5H2O (21)
P21/c
1858.6, 4
10.4708
12.2302
14.8586
90
102.369
90
[40]
LiCo(NH3)6Np2O8(OH)2·2H2O
C2/c
1509.3; 4
10.739
10.450
15.013
90
116.38
90
[43]
(22)
NaCo(NH3)6Np2O8(OH)2·2H2O
C2/c
1549.7; 4
10.865
10.597
14.867
90
115.13
90
[43]
(22a)
CaNpO4OH∙3H2O (23)
P21/n
688.46; 4
7.8287
8.4611
10.8720
90
107.061
90
[44]
-
CaNpO4OH∙4H2O (24)
P1
391.67; 2
6.3757
8.0530
8.4035
80.551
68.856
77.944
[44]
-
BaNpO4OH∙H2O (25)
P1
284.24; 2
6.7632
6.9958
7.4052
88.948
65.287
65.411
[44]
-
SrNpO4OH∙H2O (25a)
P1
285.52; 2
6.7692
7.0073
7.4178
88.869
65.326
65.368
[44]
В соединении 19 атомы Np и Co находится в
Одной из причин различия в характеристиках
центрах симметрии, упаковка ионов близка к струк-
водородного связывания соединений 19 и 20 явля-
турному типу NaCl [34]. В структуре 20 одна пара
ется разное количество молекул воды, включенных
независимых атомов Np и Co находится в центре
в состав соединении. В структуре 19 на один ани-
симметрии, вторая пара - в общем положении [35].
он приходится две молекулы воды, тогда как в 20 -
Водородное связывание играет важную роль в
4/3 молекулы воды. В целом менее упорядочен-
формировании упаковки в кристаллах соединений
ная структура 20 характеризуется более слабыми
19 и 20. В структурах присутствуют три возможных
H-связями с участием молекул воды по сравнению
донора протонов: это молекулы воды, ОН-группы
со структурой 19. Кроме того, в структуре 19 кати-
комплексных анионов [NpO4(OH)2]3- и молекулы
оны [Co(NH3)6]3+ целиком задействованы в H-свя-
аммиака катионов [Co(NH3)6]3+. Как показал анализ,
зях типа N-H···O, а в структуре 20 - нет. Поэтому в
H-связи типа N-H···O в целом слабее связей типа
растворах игольчатая фаза 20 перекристаллизовы-
O-H···O. Очевидно, что H-связи с участием молекул
вается в более устойчивую пластинчатую фазу 19
воды и анионов [NpO4(OH)2]3- должны оказывать
с плотной упаковкой и трехмерной системой водо-
бóльшее влияние на формирование обеих структур,
родных H-связей.
чем связи с участием катионов [Co(NH3)6]3+.
Соль с катионом [Co(en)3]3+. Структура 21 так-
В пластинчатых кристаллах 19 образуется трех-
же принадлежит к островному типу и построена из
мерная сеть H-связей с участием молекул воды
анионов [NpO4(OH)2]3-, катионов [Co(en)3]3+ и моле-
и всех атомов кислорода ионов [NpO4(OH)2]3-.
кул кристаллизационной воды. Катионы и анионы в
В игольчатых кристаллах 20 молекулы воды, распо-
структуре 21 образуют электронейтральные слои, в
лагаясь между ионами [NpO4(OH)2]3-, через водо-
межслоевом пространстве расположены молекулы
родное взаимодействие связывают их в слои. При
воды [40]. Комплекс 21 является пока единствен-
этом не все атомы кислорода групп NpO4 в анионах
ным примером структурно охарактеризованного со-
задействованы в H-связях. В результате в кристалле
единения Np(VII), для которого можно проследить
20 образуется двумерная сеть H-связей между мо-
влияние водородного связывания на геометриче-
лекулами воды и анионами [NpO4(OH)2]3-. Катионы
ские характеристики аниона [NpO4(OH)2]3-. Здесь
[Co(NH3)6]3+ образуют прослойку между этими сло-
не имеющий центра симметрии катион [Co(en)3]3+
ями, связываясь с атомами кислорода водородными
является причиной того, что центросимметричный
связями типа N-H···O.
по своей природе анион [NpO4(OH)2]3- локализует-
РАДИОХИМИЯ том 64 № 1 2022
20
КРОТ, ЧАРУШНИКОВА
ся в общем положении и в нем не происходит вы-
Соединения M3(NpO5)2·nH2O (M2+ = Ba, Sr
равнивания связей и валентных углов по условиям
или Са) заметно растворяются в щелочах. В
симметрии. Кроме того, атомы кислорода аниона не
1 моль·л-1 NaOH произведение растворимости
включены в координационную сферу внешнесфер-
Ва3(NpO5)2·nH2O при 20°С составляет ~2 × 10-18
ного катиона [Co(en)3]3+.
[33]. В сопоставимых условиях растворимость
В кристаллах соединения 21 образуется трех-
Sr3(NpO5)2·nH2O и Ca3(NpO5)2·nH2O заметно выше,
мерная система H-связей трех типов в зависимо-
чем в случае бариевой соли. Плутониевые соли
сти от природы доноров протонов, в роли которых
Ba3(PuO5)2·nH2O и Sr3(PuO5)2·nH2O под слоем
выступают H2N-группы этилендиамина, молекулы
0.5-1.5 моль·л-1 щелочи в течение нескольких ча-
воды и OH-группы анионов [NpO4(OH)2]3-. Анализ
сов при комнатной температуре переходят в корич-
водородных связей показывает, что есть прямая за-
невые осадки соединений Pu(VI).
висимость длин связей в группе NpO4 от суммар-
В дополнение к изложенному, в работе [42] были
ной прочности водородных связей, приходящихся
получены новые уточнения о получении и свой-
на каждый атом кислорода - акцептор протона, раз-
ствах M3(NpO5)2·nH2O (M2+ = Ba, Sr или Са). В
брос в длинах связей Np-O Δ = 0.062 Å. Для связей
ходе многократных синтезов этих соединений было
Np-OH такая явная зависимость не просматривает-
замечено, что после осаждения Ca3(NpO5)2∙nH2O
ся (Δ = 0.010 Å), по-видимому, потому, что ОН-груп-
и в меньшей степени Sr3(NpO5)2∙nH2O маточные
пы являются и донорами и акцепторами протонов
растворы и промывные воды имеют слабую свет-
в водородном связывании, причем акцепторные
ло-зеленую окраску. Это свидетельствует о неболь-
H-связи весьма неравноценны по прочности.
шой растворимости данных соединений в воде и
2.5. Соединения An(VII) с катионами
разбавленных (0.1-0.2 моль·л-1) растворах LiOH.
щелочноземельных элементов
Из таких растворов путем медленного испарения
были выделены монокристаллы новых соединений
Образование труднорастворимых соединений
типа MNpO4OH∙nH2O (M2+ = Ca или Sr), структура
Np(VII) и Pu(VII) в щелочных растворах при добав-
которых рассмотрена ниже. Ba3(NpO5)2∙nH2O оса-
лении катионов щелочноземельных элементов было
ждается в указанных выше условиях практически
отмечено уже в первой публикации по получению
количественно и в воде нерастворим.
семивалентных нептуния и плутония [1]. Позже
Влажные осадки M3(NpO5)2∙nH2O проверяли
[33, 36] эти реакции были изучены более подроб-
на накопление в них Np(VI) в ходе приготовлений.
но. Было показано, что осаждение An(VII) ионами
Специальные анализы показали, что в образцах
Ba2+ и Sr2+ следует проводить из растворов с кон-
центрацией ОН- 0.5-1 моль·л-1 путем добавления
соединений непосредственно после осаждения и
промывки водой при комнатной температуре со-
0.1-0.2 моль·л-1 Ва(NO3)2 или Sr(NO3)2 в избыт-
ке, не превышающем растворимости Ba(OH)2 или
держится очень малая примесь Np(VI), граничащая
с погрешностью анализов. Сухие же свежеприго-
Sr(OH)2 в жидкой фазе. В подобных условиях было
получено также соединение Np(VII) с ионами Ca2+,
товленные препараты M3(NpO5)2∙nH2O содержат
аналогичное производным бария и стронция [38,
до 3-7% Np (VI). Очевидно, некоторое восстанов-
41]. Все эти соединения выделяются из щелочных
ление Np(VII) в соединениях протекает в процессе
растворов в виде рыхлых светло-зеленых (в слу-
их высушивания в струе воздуха. По содержанию
чае нептуния) и темно-синих (в случае плутония)
нептуния после восстановления до пятивалентного
осадков, состав которых после промывки водой и
состояния были вычислены молекулярные массы
высушивания при комнатной температуре можно
высушенных образцов M3(NpO5)2∙nH2O и оценены
описать общей брутто-формулой M3(NpO5)2·nH2O
величины n, равные примерно 12, 7 и 6 для кальцие-
(M2+ = Ba, Sr или Са). Однако, учитывая окраску
вой, стронциевой и бариевой солей соответственно.
и результаты измерений спектров ЯГР (см. ниже),
Сухие соединения на воздухе при комнатной темпе-
указанные соединения можно рассматривать как
ратуре весьма устойчивы и не гигроскопичны. По-
производные анионов
[AnO4(OH)2]3-, т.е. как
сле хранения в течение более 2 месяцев в закрытом
M3(AnO4(OH)2)2·nH2O.
бюксе содержание Np(VII), по данным анализов,
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
21
снизилось в образцах солей бария на ~15 , строн-
ся соединение, состав которого характеризуется от-
ция - на ~13 и кальция - на ~24% [42].
ношением [NpO4(OH)2]3- : [Co(NH3)6]3+ = 2 : 1. Сое-
динение было получено из раствора 0.0015 моль·л-1
Измерения
порошковых
рентгенограмм
M3(NpO5)2∙nH2O показали, что все соединения по-
Np(VII) в 0.005 моль·л-1 LiOH путем добавления
лучаются только в виде рентгеноаморфных осадков
Co(NH3)6Cl3 до концентрации 0.001 моль·л-1 с
[42]. Попытки перевести M3(NpO5)2∙nH2O с M2+ =
последующей коагуляцией осадка 15 мин в холо-
Sr и Ba в хорошо закристаллизованное состояние
дильнике, фугованием, тщательной промывкой
выдержкой их под слоем маточных растворов в те-
охлажденной водой и сушкой в струе кислорода.
чение 3 месяцев или коагуляцией при нагревании
Результаты анализа сухого продукта показали, что
до 80°С были безуспешными. Такое поведение этих
в полученном соединении спустя сутки после его
соединений, очевидно, обусловлено особенностями
приготовления практически весь нептуний находит-
их строения. Вероятно, они являются комплексны-
ся только в семивалентном состоянии и его содер-
ми полимерами, в которых центральными атомами
жание составляет 56.5%. В пределах погрешности
являются катионы щелочноземельных элементов, а
анализа это совпадало с содержанием Np (56.43%)
анионы [NpO4(OH)2]3- служат мостиковыми лиган-
в соединении LiCo(NH3)6Np2O8(OH)2·2H2O. Полу-
дами. Подобные сложные полимерные соединения
чить это соединение в хорошо закристаллизован-
часто бывает трудно получить в хорошо закристал-
ном виде не удалось, тем не менее, РФА подтвер-
лизованном состоянии.
дил, что выделилась соль 22.
2.6. Цепочечные соединения An(VII), родствен-
Кристаллографические параметры литиево-
го соединения 22 приведены в табл. 3. Кристаллы
ные солям с анионами [AnO4(OH)2]3-
изоструктурного натриевого соединения 22a имели
Все структуры, рассмотренные выше, относятся
двойниковую природу, и структура не была решена.
к островному типу, их основу составляют изолиро-
По результатам РСА [43] оказалось, что сое-
ванные анионные комплексы [AnO4(OH)2]3-, однако
динение LiCo(NH3)6Np2O8(OH)2·2H2O (22) имеет
оказалось, что в данных системах возможно также
строение, основу которого представляют цепочки,
образование цепочечных соединений.
в состав которых входят анионы [NpO4(OH)2]3-. На
Особый интерес вызвало получение в виде мо-
основе полученных результатов авторы высказали
нокристаллов изоструктурных соединений общего
предположение, что в растворах Np(VII) находит-
состава MCo(NH3)6Np2O8(OH)2·2H2O, где М+ = Li
ся в виде анионов [NpO4(OH)2]3-, которые при бы-
(22) или Na (22a), и на примере литиевого соедине-
стром осаждении катионами [Co(NH3)6]3+ образуют
ния изучить строение этих соединений [43]. Синтез
Co(NH3)6[NpO4(OH)2]·2H2O. Это предположение
осуществляли методом встречной диффузии. При
нашло впоследствии полное подтверждение.
получении литиевого соединения в пробирку по-
слойно помещали растворы 0.015 моль·л-1 Np(VII)
Кроме MCo(NH3)6Np2O8(OH)2·2H2O (М+ = Li
или Na) [43], цепочечную структуру имеют соеди-
в 1 моль·л-1 LiOH, 1 моль·л-1 LiOH и 0.02 моль·л-1
Co(NH3)6Cl3 и оставляли на две недели. В итоге на
нения Np(VII) c катионами щелочноземельных эле-
стенках образовались пирамидальные кристаллы,
ментов состава MNpO4OH∙nH2O (M2+ = Ca, Sr и Ba)
которые отбирали механически. Их состав опре-
[44]. Методика их синтеза в виде монокристаллов
делен химическим анализом и методом РСА. Ана-
зависит от природы щелочноземельного элемента.
логично готовили натриевую соль, калиевую соль
В случае CaNpO4OH∙nH2O синтез осуществлялся
получить не удалось.
следующим образом: отбирали пробу ~0.1 моль·л-1
Позже в ходе экспериментального изучения вли-
Np(VII) в 0.8 моль·л-1 LiOH, разбавляли в 10 раз
яния условий на взаимодействие Np(VII) с ионами
водой и осаждали Ca3(NpO5)2∙nH2O добавлением
[Co(NH3)6]3+ было обнаружено, что из растворов с
небольшого избытка 0.2 моль·л-1 Ca(NO3)2. Вы-
низкой концентрацией LiOH (0.05-0.15 моль·л-1)
павший осадок коагулировали в течение ~5 мин,
выделяются нерастворимые объемистые бурова-
отделяли от маточного раствора, промывали водой
то-черные осадки [35]. По результатам спектрофо-
и обрабатывали при перемешивании ~15 мин 5 мл
тометрических измерений оказалось, что осаждает-
0.05 моль·л-1 LiOH. Затем светло-зеленой щелочной
РАДИОХИМИЯ том 64 № 1 2022
22
КРОТ, ЧАРУШНИКОВА
раствор отделяли от оставшегося осадка и оставля-
единений. Отсюда был сделан вывод, что состав
ли на медленное испарение в течение 3-5 сут в эк-
стронциевого соединения выражается формулой
сикаторе с гранулированным KOH. В итоге после
SrNpO4OH∙H2O (25a).
сокращения объема раствора до ~1 мл образовыва-
К необычным следует, очевидно, отнести со-
лись монокристаллы черного цвета, которые имели
единение, полученное медленным добавлением
форму удлиненных призм и ромбов. Маточный же
0.1-0.5 моль·л-1 нитрата алюминия к ~10-2 моль·л-1
раствор был практически бесцветным. По результа-
Np(VII) в 0.4-0.5 моль·л-1 NaOH до достижения
там рентгеноструктурного исследования призмати-
pH 10-11 [45]. В конечном рентгеноаморфном про-
ческие кристаллы имели состав CaNpO4OH∙3H2O
дукте зеленого цвета мольное отношение Al : Np
(23), а ромбические - CaNpO4OH∙4H2O (24). Кри-
было близко к 1 : 1. ИК спектр соединения сходен
сталлы в воде нерастворимы и оставались без види-
со спектрами M3(NpO5)2∙nH2O (M2+ = Ba или Sr).
мого изменения под слоем 0.05-0.1 моль·л-1 щело-
Для описания его состава предложена формула
чи в течение, по крайней мере, трех недель.
AlNpO5∙nH2O. Строение и свойства данного соеди-
Методика приготовления CaNpO4OH∙nH2O ока-
нения нуждаются в дополнительном изучении.
залась непригодной для получения аналогичной
Соли МCo(NH3)6Np2O8(OH)2·2H2O (М+ = Li,
бариевой соли вследствие очень низкой раствори-
Na). В структуре 22 содержатся два кристаллогра-
мости Ba3(NpO5)2∙nH2O в 0.05-0.1 моль·л-1 LiOH.
фически независимых атома Np1 и Np2 и в кри-
Поэтому после ряда пробных опытов бариевое сое-
сталле образуются бесконечные цепочки из череду-
динение удалось синтезировать следующим спосо-
ющихся анионов [NpO4(OH)2]3- (атом Np1) и групп
бом.
NpO4 (атом Np2), связанных мостиковыми атомами
В центрифужной пробирке осаждали
кислорода (рис. 13а). Атом Np2 в группе NpO4 слу-
Ba3(NpO5)2∙nH2O из раствора Np(VII) в разбавлен-
жит координирующим центром для двух комплекс-
ном LiOH небольшим избытком Ba(NO3)2. Выпав-
ных анионов [NpO4(OH)2]3- (на рис. 13а для нагляд-
ший осадок тщательно промывали водой и залива-
ности в анионах добавлены атомы H), которые в
ли 3 мл 0.1 моль·л-1 LiOH. Затем добавляли 0.05 мл
свою очередь выступают как бидентатные мости-
~0.1 моль·л-1 Np(VII) в 0.8 моль·л-1 LiOH и после
ковые лиганды для соседних группировок NpO4. В
перемешивания оставляли на две недели в закры-
центросимметричном анионе [NpO4(OH)2]3- длины
той пробирке. В итоге на дне пробирки образова-
связей Np1-O в экваториальной группе NpO4 силь-
лись друзы черных призматических кристаллов.
но различаются (1.85 и 1.96 Å), длина связи Np1-OH
Результаты РСА показали, что состав бариевого со-
равна 2.31 Å. В группе NpO4 длины связей Np2-O
единения описывается формулой BaNpO4OH∙H2O
равны 1.88 и 1.89 Å, а расстояние до атомов кис-
(25).
лорода групп NpO4 анионов [NpO4(OH)2]3- равно
Стронциевое соединение типа MNpO4OH∙nH2O
~2.36 Å. Угол Np1-O-Np2 в цепочках равен 135.7°.
было приготовлено по методике, подобной получе-
Катионы Li+ в структуре 22 включены в цепочки.
нию кальциевых солей. Различие состояло только
В координационную сферу лития входят шесть ато-
в том, что вместо Ca(NO3)2 использовали Sr(NO3)2
мов кислорода: четыре атома от трех КП Np(VII) и
и осадок Sr3(NpO5)2∙nH2O обрабатывали не 0.05,
две молекулы воды. КП атома Li - сильно искажен-
а 0.1 моль·л-1 LiOH. Повышенная концентрация
ный октаэдр. Между цепочками состава [Li(NpO4)
щелочи была необходима для увеличения раство-
(NpO4(OH)2)(H2O)2]3- расположены октаэдриче-
римости осадка. После отделения последнего цен-
ские катионы [Co(NH3)6]3+.
трифугированием и выдержки маточного раствора
в эксикаторе с гранулированным KOH в течение не-
Соли MNpO4OH∙nH2O (M2+ = Ca, Sr, Ba). Ос-
скольких суток из раствора выделилось небольшое
нову структур MNpO4OH∙nH2O также составляют
количество сростков мелких кристаллов черного
бесконечные анионные цепочки, но они прин-
цвета. Они оказались крайне низкого качества. Тем
ципиально отличаются от цепочек, найденных в
не менее, удалось найти кристалл, на котором была
соединении 22. В структурах 23-25 группы NpO4
определена элементарная ячейка и подтверждена
связываются через ОН-группы в бесконечные це-
изоструктурность бариевого и стронциевого со-
почки [NpO4OH]2n-, показанные на рис. 13б на
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
23
(а)
H
Np2
O
Np1
Li
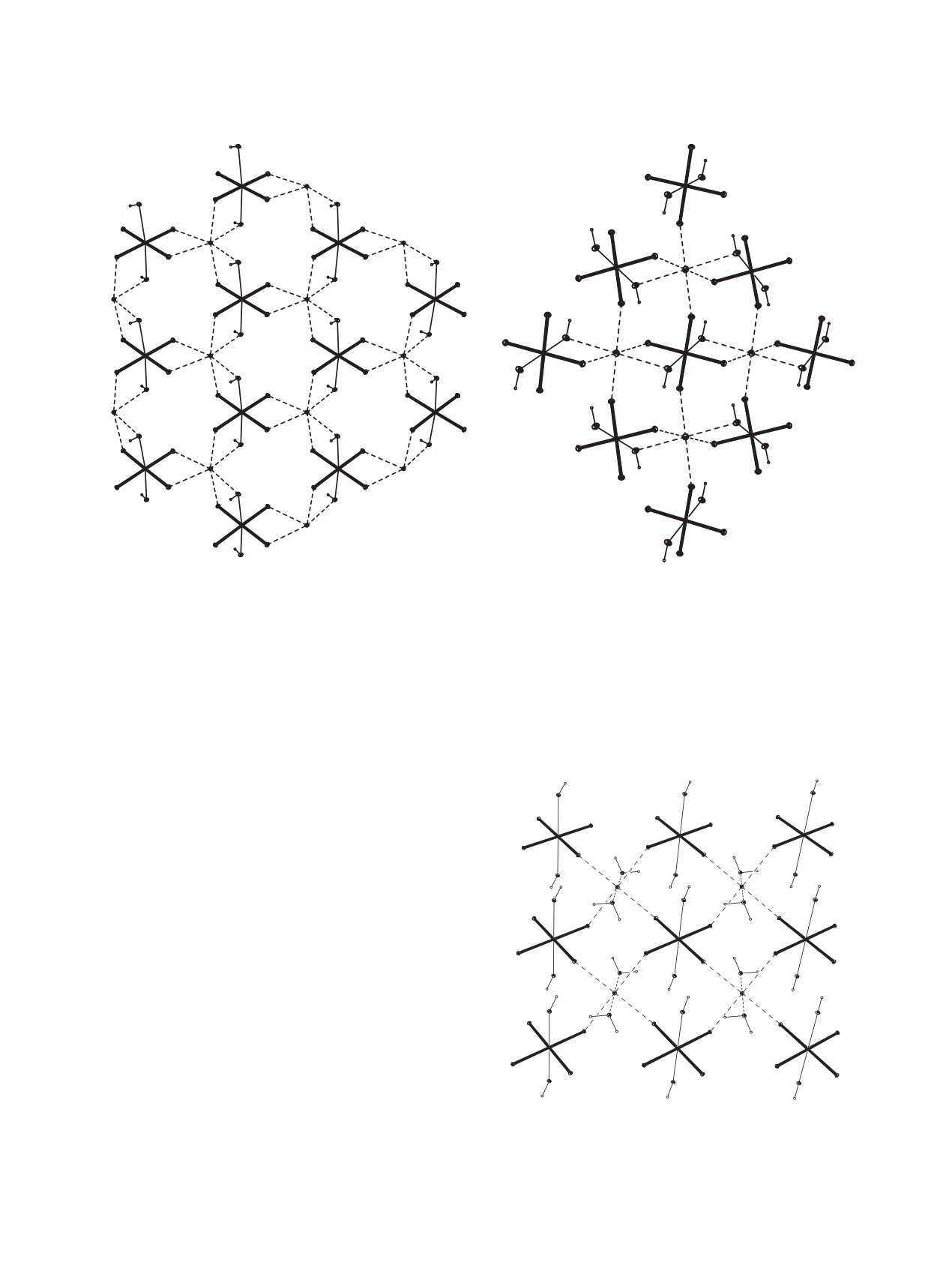
(б)
Np
O
H
Рис. 13. Анионные цепочки в структурах: (а) LiCo(NH3)6Np2O8(OH)2·2H2O (22) [43]; (б) MNpO4(OH)∙nH2O (M = Ca, Sr, Ba)
(23-25) [44].
примере соединения 23. Средняя длина связей
сталле связывают по три цепочки [NpO4OH]2n-, об-
Np-OH в цепочках равна 2.375 Å (23), 2.368 Å (24)
разуя каркас.
и 2.345 Å (25). Длины связей Np-O в группах NpO4
Внешнесферные катионы Ca2+ и Ba2+ влияют
в структурах 23-25 близки и имеют среднюю вели-
на строение анионных цепочек в структурах. В
чину 1.883 Å. Угол Np1-O-Np2 в цепочках 23-25
кристаллах 23 и 24 группы NpO4, связанные через
составляет ~126° [44].
OH-группы в одной цепочке, располагаются друг за
В структурах тригидрата 23 и тетрагидрата 24
другом, что соответствует заслоненной конформа-
присутствует по одному независимому катиону
ции. В кристалле 25 группы NpO4, расположенные
Ca2+, и состав их кислородного окружения одина-
вдоль цепочки, повернуты друг относительно друга
ков, в него включены по три молекулы воды и по
на ~45°, что соответствует заторможенной конфор-
мации.
пять атомов кислорода групп NpO4. КП атомов Ca
можно описать как двухшапочную тригональную
призму (КЧ 8). В структурах 23 и 24 анионные це-
3. СИНТЕЗ СОЕДИНЕНИЙ An(VII) ИЗ
почки [NpO4OH]2n- и катионы Ca2+ образуют элек-
СЛАБОЩЕЛОЧНЫХ И НЕЙТРАЛЬНЫХ
тронейтральные слои, различие в строении соеди-
РАСТВОРОВ
нений заключается лишь в том, что в кристалле 24
в межслоевом пространстве находятся молекулы
3.1. Соединения с катионами щелочных элементов
кристаллизационной воды.
В слабощелочных и нейтральных растворах
Кислородное окружение катиона Ba2+ в струк-
Pu(VII) малоустойчив, поэтому большинство сое-
туре 25 представляет собой девятивершинник, об-
динений семивалентных актинидов, выделенных
разованный восьмью атомами кислорода от групп
из таких сред, являются производными Np(VII).
NpO4 и одной молекулы воды. Катионы Ba2+ в кри-
Обычно их состав выражается общей формулой
РАДИОХИМИЯ том 64 № 1 2022
24
КРОТ, ЧАРУШНИКОВА
MNpO4∙nH2O, где М - однозарядный катион. Пер-
LiHCO3 для удержания в растворе Np(VI). Таким
вым соединением данного типа была соль CsNpO4,
путем были идентифицированы три соли состава
полученная в виде черного мелкокристаллического
LiNpO4·4H2O, LiNpO4·2.5H2O и LiNpO4·2H2O. Пер-
осадка озонированием раствора 0.01-0.02 моль·л-1
вая из них получена подкислением раствора с кон-
Np(VI) в ~1 моль·л-1 CsOH или смешением раство-
центрацией Np(VII) 25 г·л-1 до рН 11.7-11.4, вто-
ра 0.05-0.1 моль·л-1 Np(VII) в 0.5 моль·л-1 LiOH
рая - до рН 10.3-10.9. Последнее соединение син-
c насыщенным слегка подщелоченным раствором
тезировано быстрым подкислением более разбав-
CsNO3 [46]. Аналогичным путем, заменяя CsNO3 на
ленных растворов Np(VII). Соединения выделялись
нитрат соответствующего катиона, были получены
в плохо закристаллизованной виде, LiNpO4·2H2O
соединения MNpO4 c M+ = K и Rb. Все они оказа-
оказался рентгеноаморфным, а другие гидраты на
лись практически нерастворимыми в воде, спирте,
порошковых рентгенограммах давали лишь неболь-
ацетоне и эфире, но постепенно растворялись в ще-
шое число диффузных линий. Все соли относитель-
лочах, причем скорость и полнота растворения воз-
но устойчивы в сухом состоянии при комнатной
растали с повышением концентрации ионов ОН-. В
температуре, их состав существенно не изменяет-
сухом виде соединения достаточно устойчивы при
ся в течение недели. Уже слабое нагревание вело
хранении и выдерживают без значительного разло-
к обезвоживанию и одновременному разложению
жения слабое нагревание. Так, в CsNpO4 после вы-
соединений, а после прокаливания до 1000°С полу-
держивания в течение 30 мин при 150°С 90% непту-
чалась смесь NpO2 и Li3NpO4.
нии осталось в семивалентном состоянии.
Приготовление LiNpO4·2.5H2O и аналогично-
Было установлено также, что катионы Li+ и Na+
го по составу NaNpO4·2.5H2O было успешно про-
не образуют осадки в растворах с концентрацией
ведено электрохимическим окислением Np(VI) в
щелочи ~0.3 моль·л-1. Пробный эксперимент по
растворах 0.04-0.06 моль·л-1 MHCO3 (M+ = Li или
синтезу NaNpO4∙nH2O осаждением Np(VII) из рас-
Na) на Pt аноде при потенциалах 1.3-1.6 В (отно-
творов буры при pH ~9 привела к получению про-
сительно нормального водородного электрода) [49].
дукта с большим содержанием Np(VI). Однако бо-
Оба соединения выделялись в виде плотных осад-
лее детальное исследование в этом направлении не
ков с небольшой примесью Np(VI), которую можно
проводилось [46].
удалить двух- и трехкратной промывкой 1 моль·л-1
В дальнейшем был опубликован ряд дополни-
MHCO3. По данным РФА, натриевая соль изострук-
тельных исследований по изучению строения и
турна литиевой. Однако соединения оказались
свойств соединений An(VII) с ионами щелочных
плохо закристаллизованными, и проиндициро-
металлов, выделенных из слабощелочных и ней-
вать их порошковые рентгенограммы не удалось.
тральных сред. В частности, путем подкисления
Основным продуктом термического разложения
хлорной кислотой растворов Np(VII) в LiOH до
NaNpO4·2.5H2O при 500оС является Na2Np2O7.
рН 11.8-11.0 был получен бурый осадок, содержа-
Кроме бикарбонатных сред для электрохимиче-
щий семивалентный нептуний [47]. В воде он легко
ского синтеза LiNpO4·2.5H2O и NaNpO4·2.5H2O, а
пептизировался с образованием красно-коричне-
также солей MNpO4 c M+ = K-Cs можно использо-
вого раствора. После подкисления до рН 9.3 осаж-
вать ацетатные растворы Np(VI) и Np(V) [50]. Пе-
дался черный осадок Np(VII), который тоже легко
речисленные соединения выделялись с попутным
пептизировался. Относительно составов этих осад-
незначительным газовыделением на Pt аноде при
ков были высказаны предположения, которые пред-
потенциалах 1.5-1.9 В (относительно нормального
ставляются малообоснованными и сомнительными.
водородного электрода) в виде черных осадков из
Более определенные результаты по синтезу сое-
растворов (5-10) × 10-3 моль·л-1 ацетатов Np(VI)
динений семивалентного нептуния и лития из сла-
или Np(V), содержащих добавки соответствующих
бощелочных растворов приведены в работе [48].
катионов. В случае использования Np(V) первона-
Проводилось медленное подкисление растворов
чально происходило его окисление до шестивалент-
Np(VII) в 1 моль·л-1 LiOH парами азотной кисло-
ного состояния, и образование осадков на аноде на-
ты в токе озона до рН ~11.5 с последующим до-
чиналось до полного завершения этого процесса.
бавлением к полученной суспензии 0.05 моль·л-1
Для анализа полученные продукты механически
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
25
Таблица 4. Кристаллографические характеристики соединений MNpO4 [51, 52]
Параметры ячейки
Пространственная
Соединение
V Å3; Z
группа
a, Å
b, Å
c, Å
β, град
KNpO4
5.841
8.012
8.085
90
Pmcb
378.4; 4
RbNpO4
6.121
8.190
8.113
90
Pmcb
406.8; 4
CsNpO4
6.432
8.309
8.252
90.18
P21/c
441.2; 4
снимали с анода, промывали водой и растворяли в
по ИК и ЯГР спектрам, рассмотренные ниже, ука-
концентрированном LiOH или высушивали в струе
зывали на сходство структур этих соединений [51,
воздуха. Сухие образцы использовали для РФА и ре-
52]. Аналогичный вывод был сделан на основе ана-
гистрации ИК спектров. Измерение спектров погло-
лиза порошковых рентгенограмм применительно к
щения промытых и растворенных в щелочи осадков
LiNpO4·2.5H2O и NaNpO4·2.5H2O [49].
показало, что содержание Np(VII) в них составляло
По порошковой рентгенограмме была определе-
не менее 90% от общего количества нептуния. По
на кристаллическая структура KNpO4 [52], которая
результатам РФА, полученные из ацетатных рас-
оказалась близка к структуре соединения BaUO4
творов соединения лития и натрия изоструктурны
[53], имеющего ромбическую ячейку с параметра-
солям LiNpO4·2.5H2O, и NaNpO4·2.5H2O, выделен-
ми a = 5.744 Å, b = 8.166 Å, c = 8.237 Å и простран-
ным на аноде из карбонатно-бикарбонатных сред
ственную группу Pbcm. В табл. 4 приведены резуль-
[49]. Предполагается, что и в случае K+, Rb+ и Cs+
таты индицирования порошковых рентгенограмм
образуются соединения общего состава MNpO4,
соединений MNpO4 (M = K-Cs). При переходе от
описанные в работе [46].
Rb+ к более крупному катиону Cs+ наблюдается сла-
Интересные наблюдения были сделаны в ходе из-
бое моноклинное искажение ромбической решетки.
учения влияния ультразвукового (УЗ) поля (44 кГц,
Из анализа структуры KNpO4 следует, что соеди-
1 Вт·см-2) на озонирование Np(V) в щелочых средах
нения MNpO4 имеют слоистое строение и состоят из
и на выделение твердых соединений Np(VII) [51].
кислородных октаэдров Np(VII), связанных друг с
Было обнаружено, что на процесс озонирования
другом общими вершинами экваториального пояса
Np(V) в 1-3 моль·л-1 MOH (M+ = Li, Na, K) УЗ поле
(расстояния Np-O равны 2.002 и 2.020 Å) (рис. 14).
не влияет. Однако в случае 1.5-3 моль·л-1 RbOH
Перпендикулярно располагаются укороченные ли-
и CsOH озонирование ведет к образованию осад-
нейные группы NpO2 (расстояние Np=O 1.85 Å),
ков, содержащих MNpO4 (M+ = Rb или Cs). Выход
Np(VII) в твердых фазах увеличивается с 60 до 98%
с ростом концентрации щелочи от 1.5 до 3 моль·л-1.
Действие УЗ поля на заранее приготовленные рас-
творы 0.01 моль·л-1 Np(VII) в 1.5-3 моль·л-1 RbOH
и CsOH ведет к кристаллизации чистых MNpO4.
Если концентрация щелочи выше 3.5 моль·л-1,
образования твердой фазы не наблюдается. В рас-
O
творах RbOH или CsOH с концентрацией выше
Np
3 моль·л-1 при окислении Np(V) озоном в поле УЗ
получаются растворы Np(VII) с концентрацией
вплоть до 0.1 моль·л-1. Из них при высушивании
кристаллизуются соли M3NpO4(OH)2·nH2O, впер-
вые полученные авторами работы [12].
Все попытки получить пригодные для структурых
исследований кристаллы соединений MNpO4·nH2O
оказались безуспешными. Однако порошковые рент-
Рис. 14. Фрагмент структуры KNpO4 [52].
генограммы образцов MNpO4 (M+ = K-Cs) и данные
РАДИОХИМИЯ том 64 № 1 2022
26
КРОТ, ЧАРУШНИКОВА
связанные с межслоевыми щелочными катионами.
щих катионов. Указанные соединения выделялись
Следовательно, основным элементом полимерной
в виде черных слоев на Pt аноде при потенциа-
слоистой структуры MNpO4 выступают линейные
лах 1.5-1.9 В и концентрации ацетат-ионов 0.05-
катионы NpO3+, координирующие по 4 мостиковых
0.9 моль·л-1. Аммониевая соль оказалась изострук-
атома кислорода от соседних октаэдров. Это заклю-
турной NH4NpO4·nH2O, полученному в работе [56].
чение подтверждается результатами измерений ИК
Состав анодных осадков, которые были получены
спектров MNpO4, рассмотренных ниже.
их растворов с добавками органически соединений,
Из-за неустойчивости Pu(VII) при невысоких
подробно не изучался, однако присутствие в них од-
значениях [OH-] из соединений типа MPuO4·nH2O
нозарядных органических катионов подтверждено
измерением ИК спектров высушенных образцов,
были получены только безводные соли калия, ру-
бидия и цезия. Первоначально был синтезирован
измеренных в матрице плавленого NaCl.
мелкокристаллический продукт синевато-черного
Электрохимический метод синтеза соединений
цвета из ~0.03 моль·л-1 Pu(VII) в ~1 моль·л-1 NaOH
типа MNpO4·nH2O неудобен и сложен в случае
с добавкой CsNO3 до концентрации ~0.5 моль·л-1
получения больших количеств нужных продук-
[46]. Он медленно растворялся в 2 моль·л-1 LIOH
тов. Для приготовления NH4NpO4·nH2O и, види-
с образованием раствора Pu(VII). Мольное соотно-
мо, других подобных соединений более простым
шение Cs : Pu в осадке было около 1.2 : 1, по-види-
и эффективным оказался способ, основанный на
мому, вследствие примеси CsNO3 [54].
нейтрализации растворов Np(VII) в LiOH избытком
Описан также метод приготовления соединений
NH4NO3 или нитратами соответствующих слабых
MPuO4 c M = K, Rb, Cs путем высушивания соот-
оснований. При этом Np(VII) осаждается практи-
ветствующих влажных плутонатов в струе озона
чески мгновенно и количественно в виде черных
[55]. Соединения изоструктурны с аналогичными
аморфных осадков. В случае NH4NpO4·nH2O свеже-
солями Np(VII). Их можно хранить в течение не-
полученный осадок, выделенный из охлажденного
скольких дней только в сухой инертной атмосфере.
до ~0°C раствора, не содержит примеси Np(VI). Од-
На воздухе при комнатной температуре и нагрева-
нако после отделения от маточного раствора, про-
нии они довольно быстро разлагаются.
мывки охлажденной водой и сушки в струе воздуха
конечный продукт содержит 2-4% Np(VI). В сухом
3.2. Соединения An(VII) с аммонием и органиче-
виде NH4NpO4·nH2O относительно устойчив. Так,
скими катионами
в образце соединения после хранения в закрытом
Электрохимический метод, использованный для
бюксе при комнатной температуре в течение 8 ме-
приготовления LiNpO4·2.5H2O и NaNpO4·2.5H2O
сяцев еще осталось около 15% нептуния в семива-
[49], оказался эффективным также для получения
лентном состоянии.
соединения NH4NpO4∙nH2O [56]. Оно было выделе-
3.3. Соединения с другими катионами
но в виде плотного осадка на Pt аноде из раство-
ров Np(VI) с концентрацией свободного карбоната
К рассмотренным выше солям типа MNpO4·nH2O
аммония 0.05-0.1 моль·л-1, оптимальные значения
следует отнести также смешанно-валентное соеди-
потенциала анода 1.6-1.7 В. Осадок на аноде про-
нение состава NpO2(OH)NpO4·4H2O, полученное
мывали раствором 0.05 моль·л-1 карбоната и суши-
окислением свежеприготовленного гидроксида
ли в эксикаторе над KOH. Состав соединения, по
Np(V) озоном при комнатной температуре [57]. При
данным химического анализа, выражается форму-
температуре ~105°С оно теряет воду и переходит в
лой NH4NpO4·nH2O. Порошковая рентгенограмма
рентгеноаморфный NpO3·H2O. В ИК спектре соеди-
продукта сходна с таковой для MNpO4·2.5H2O (М =
нения имеются две полосы, типичные для соедине-
Li или Na).
ний MNpO4∙nH2O, и полоса антисимметричных ко-
лебаний нептунильной группы NpO22+. Измерения
Синтез NH4NpO4·nH2O, а также подобных со-
спектров ЯГР подтвердило присутствие в соедине-
единений с заменой NH+ на СN3H+ и R4N+ c R =
нии Np(VII) и отсутствие Np(V).
CH3, C2H5 и C4H9 был успешно осуществлен в ра-
боте [50] анодным окислением Np(VI) или Np(V) в
Описанный в работе [50] электросинтез соеди-
ацетатных растворах в присутствии соответствую-
нений Np(VII) анодным окислением Np(VI) или
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
27
Np(V) в ацетатных средах испытан в присутствии
Дозировку реагентов выбирали так, чтобы мольное
солей не только однозарядных катионов, но и ще-
отношение H3BO3 : LiOH превышало 2 : 1, а M2+ :
лочноземельных элементов, кадмия, меди, цинка,
Np было на уровне 1 - 2. Выпавшие черные осад-
уранила, неодима, а также в растворах без посто-
ки коагулировали 3-5 мин, отделяли от маточных
ронних добавок. В случае ацетатов двухзарядных
растворов центрифугированием, промывали охлаж-
катионов, за исключением уранила, на аноде выде-
денной водой и использовали непосредственно для
лялись рентгеноаморфные плотные осадки. Их вы-
анализов или высушивали в струе кислорода в те-
ход был мал, что затрудняло определение их точ-
чение 2-3 ч. Сухие соединения хранили в темном
ного состава, но наличие в них щелочноземельных
месте при комнатной температуре.
элементов, кадмия, цинка или меди было подтверж-
В случае приготовления соединений по второму
дено качественно. Электрохимическое окисление
варианту отбирали пробы раствора Np(VII) и осаж-
Np(VI) или Np(V) в чистых ацетатных растворах и
дали M3(NpO5)2∙nH2O (М2+ = Ca, Sr, Ba), как описа-
при наличии уранила и неодима протекает иначе,
но выше. Осадки промывали водой и быстро добав-
чем в случае выделения указанных выше соедине-
ляли при интенсивном перемешивании 5-10-крат-
ний. Это проявляется в том, что скорость образова-
ный избыток раствора 0.5 моль·л-1 борной кисло-
ния твердой фазы при прочих равных условиях зна-
ты, предварительно охлажденного в стакане со
чительно снижается и черный рыхлый осадок обра-
льдом. С полученными продуктами поступали так
зуется как на электроде, так и на стенках анодного
же, как и при синтезах по первому методу. В слу-
пространства. Конечный рентгеноаморфный про-
чае магниевой соли подобный синтез невозможен,
дукт не содержит уранила или неодима. Высказано
поскольку из щелочных растворов Np(VII) вместо
предположение, что анодное окисление Np(VI) или
Mg3(NpO5)2∙nH2O осаждается гидроксид магния.
Np(V) в чистых растворах в присутствии ацетатов
По результатам анализов на Np(VII), Np(VI) и
уранила или неодима ведет к образованию соедине-
М2+, независимо от способа получения, все соеди-
ния NpO3OH·nH2O. Это предположение нуждается
нения имеют однотипный состав, выражаемый об-
в дополнительном подтверждении. Не исключено,
щей формулой M(NpO4)2∙nH2O (M2+ = Mg, Ca, Sr,
что электрохимическое окисление ацетатов Np(VI)
Ba). Однако они содержат примесь Np(VI) на уров-
или Np(V) в отсутствие других катионов приводит
не 10-20% в свежеполученных влажных образцах
к образованию продукта, подобного или идентич-
и 30-40% в сухих продуктах. Степень восстанов-
ного рассмотренному выше соединению NpO2(OH)
ления Np(VII) в процессе синтеза M(NpO4)2∙nH2O
NpO4·4H2O, полученному длительным озонирова-
нием влажного осадка NpO2OH [57].
мало зависит от природы катиона. Соединения в
сухом состоянии сравнительно устойчивы во вре-
Вместо электрохимического метода для выделе-
мени при комнатной температуре. Так, через 20 сут
ния соединений Np(VII) c Mg и щелочноземельны-
хранения в закрытых бюксах в темноте содержание
ми элементами из растворов, близких к нейтраль-
Np(VI) в образцах кальциевой, стронциевой и ба-
ным, более удобным и эффективным оказалось
риевой солей возросло на ~15, ~12 и ~17% соответ-
смешение избытка 0.5 моль·л-1 борной кислоты, со-
ственно. Подобная картина наблюдалась также в
держащей добавки соответствующих двухзарядных
случае Mg(NpO4)2∙nH2O.
катионов, со щелочным раствором Np(VII) [42]. По
другому варианту те же соединения (кроме магние-
вой соли) можно получить обработкой свежеприго-
4. СИНТЕЗ СОЕДИНЕНИЙ An(VII)
товленных осадков M3(NpO5)2∙4H2O (М2+ = Ca, Sr,
МЕТОДАМИ ТВЕРДОФАЗНЫХ РЕАКЦИЙ
Ba) избытком раствора борной кислоты [42].
Для синтеза соединений по первому способу от-
Первым соединением An(VII), полученным су-
бирали пробы 0.5 моль·л-1 Н3ВО3, добавляли рас-
хими методами, была соль Li5NpO6. Ее готовили
четное количество M(NO3)2 (M2+ = Mg Ba) и после
спеканием в атмосфере очищенного кислорода рас-
охлаждения в стакане со льдом быстро при пере-
тертой и спрессованной смеси Li2O c NpO2 в моль-
мешивании приливали отмеренный объем раствора
ном отношении (2.75-3) : 1 при 400°С в течение
0.1-0.2 моль·л-1 Np(VII) в 0.8-1.7 моль·л-1 LiOH.
16 ч [3]. Сходным методом было получено анало-
РАДИОХИМИЯ том 64 № 1 2022
28
КРОТ, ЧАРУШНИКОВА
Таблица 5. Условия твердофазных реакций NpO2 и NpO3∙H2O с пероксидами лития, натрия и бария [59]
Реакция
T, °C
Время, ч
2.5 Li2O2 + NpO3·H2O → Li5NpO6
400
16
2.5 Na2O2 + NpO3·H2O → Na5NpO6
500, 600
24
2 BaO2 + 0.5 Li2O2 + NpO3·H2O → Ba2LiNpO6
420
16
2 BaO2 + 0.5Na2O2 + NpO3·H2O → Ba2NaNpO6
450
30
2 BaO2 + 0.5Na2O2 + NpO2 → Ba2NaNpO6
450
15
3BaO2 + 2NpO3·H2O → Ba3(NpO5)2
450
20
гичное соединение Pu(VII) - Li5PuO6 [58]. Отли-
На основе порошковой дифрактограммы образ-
чие состояло лишь в том, что смесь Li2O c PuO2 в
ца Na5NpO6 была расшифрована структура этой
мольном отношении 3 : 1 нагревали в токе кисло-
соли. Уточнение с использованием моноклинный
рода до 430°С и выдерживали в течение 2 ч. Позже
ячейки Li5ReO6 с пространственной группой C2/m
для синтеза Li5NpO6 было применено нагревание в
как стартовой модели привело к параметрам ячейки
токе О2 растертой смеси стехиометрических коли-
a = 5.829(3) Å, b = 9.996(3) Å, c = 5.757(3) Å, β =
честв Li2O2 и NpO3∙H2O при 400°С в течение 16 ч
110.73(1)° [62].
[59]. Аналогичным способом после замены Li2O2
Анализ строения Na5NpO6 показал, что главным
на Na2O2, повышения температуры до 500-600°С и
элементом структуры, несомненно, являются изо-
увеличения времени нагревания до 24 ч было полу-
лированные анионы NpO5- (рис. 15), симметрия
чено соединение Na5NpO6, но с примесью Np(VI).
которых несколько отличается от октаэдрической,
Это соединение было, по-видимому, получено ранее
что было подтверждено методом ЯГР (см. ниже).
[60] нагреванием смеси NpO2 с Na2O2 при 500°C, но
В экваториальной плоскости КП Np(VII) образ-
ца Na5NpO6 межатомные расстояния Np-O равны
принято как соль Np(VI) состава Na6NpO6. Позже
2.07 Å, длина же аксиальных связей составляет
[61] было установлено, что в условиях, указанных в
2.08 Å, причем линия аксиальных связей наклонена
работе [60], образуется соединение Np(VII).
к экваториальной плоскости под углом ~86°. Соот-
Новый метод синтеза Na5NpO6 без примесных
ветствующие величины в случае Na5PuO6 составля-
фаз описан в работе [62]. Он заключается в нагре-
ют 2.03 Å, 2.09 Å и 87° [63].
вании до 1100 K в токе кислорода растертой сте-
хиометрической смеси NpO2 и Na2CO3 в течение
Ряд новых соединений Np(VII) типа M3NpO5 по-
60-70 ч с включением промежуточных повторных
лучен спеканием диоксида нептуния с перекисями
щелочных элементов. Так, по реакции
растираний реагентов. Аналогичным образом было
получено в чистом виде соединение Pu(VII) состава
NpO2 + 3MO2 → M3NpO5 + 3/2O2
Na5PuO6 [63].
получены соединения с М = K, Rb и Cs [65-67].
Как показало сравнение порошковых рентгено-
Реакции начинаются около
300°С. Соединение
грамм, литиевые соли An(VII) изоструктурны с со-
K3NpO5 приготовлено в чистом виде нагреванием
ответствующими солями семивалентных технеция
стехиометрической смеси оксидов 24 ч при 355°С.
и рения [3, 59]. Порошковые рентгенограммы солей
Рубидиевую и цезиевую соли получали при 320°С
Li5AnO6 были проиндицированы в тригональной
за 20 и 24 ч соответственно. Судя по порошковым
ячейке (пространственная группа R-3) c параметра-
рентгенограммам, все синтезированные соедине-
ми: a = 5.21, c = 14.61 Å для Li5NpO6 [3] и a = 5.19,
ния изоструктурны. Нагревание до 600°С ведет к
c = 14.48 Å для Li5PuO6 [58]. Однако позже [64] для
полному их разложению с образованием M2NpO4.
порошковой дифрактограммы Li5ReO6 была найде-
Соединения M3ReO5 при нагреве ведут себя иначе.
на моноклинная ячейка с пространственной груп-
Диоксид плутония также реагирует с МО2 (М+ =
пой C2/m и было показано, что дифрактограмма об-
Rb, Cs), давая соединения Pu(VII) типа M3PuO5,
разца Li5NpO6 лучше индицируется в моноклинной
изоструктурные соответствующим соединениям
ячейке.
нептуния. При отношении PuO2 : MO2 1 : 3 спекание
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
29
в течение 6 ч при температуре около 250°С ведет к
полному завершению процесса. Однако соединения
М3PuO5 менее термически устойчивы. Они разлага-
ются с образованием M2PuO4 уже при 320°C [67].
Сухими методами с использованием пероксидов
лития, натрия и бария получены и другие соедине-
ния Np(VII) [59]. Состав и условия их образования
приведены в табл. 5. Реакции проводили в Рt тиглях
в атмосфере кислорода. Было обнаружено, что для
получения Ba2LiNpO6 диоксид NpO2 непригоден.
Оказались неудачными также попытки получения
Ba2KNpO6 или K5NpO6.
5. СВЕДЕНИЯ О ФИЗИКО-ХИМИЧЕСКИХ
СВОЙСТВАХ СОЕДИНЕНИЙ An(VII)
5.1. Электронные спектры поглощения
Сведения об электронных спектрах соединений
Рис. 15. Изолированные анионы NpO65- в структуре
Na5NpO6 [63].
An(VII) в твердом состоянии ограничены толь-
ко работой [68], в которой измерены оптический
5.2. ИК спектры
спектр Li5PuO6 в матрице тефлона в интервале
ИК спектры соединений An(VII) разного типа
λ = 400-1800 нм при температуре 4.2 K. Спектр
изучали в ряде работ с использованием только со-
оказался плохого качества. В нем обнаружено не-
лей Np(VII), поскольку Pu(VII) в процессе приго-
сколько линий и сделано их отнесение к определен-
товления образцов для съемки спектров претерпе-
ным переходам в предположении октаэдрического
вает восстановление. В части этих работ [11-13,
кислородного окружения атома плутония.
33, 47, 69] приведены результаты измерений ИК
Следует особо отметить, что цвет всех солей ани-
спектров солей с анионами [NpO4(OH)2]3-, выде-
онов [NpO4(OH)2]3- и [PuO4(OH)2]3- в тонком слое
ленных из крепких щелочей, в работах [46, 48, 50,
совпадает с окраской щелочных растворов Np(VII)
51] представлены данные по спектрам солей типа
MNpO4·nH2O, выделенных из слабощелочных и
и Pu(VII) соответственно. Поэтому имеются все
нейтральных растворов.
основания полагать, что оптические спектры ука-
занных солей в подходящих матрицах будут мало
В ИК спектре соединения предположительно-
го состава Li3NpO2(OH)6 обнаружены широкая
отличаться от спектров их щелочных растворов.
составная полоса с основным максимумом при
Для опытов по измерению оптических спектров
723 см-1, очень интенсивная узкая полоса с макси-
твердых соединений An(VII) наиболее перспектив-
мумом около 862 см-1 и три серии полос в интер-
ными представляются соли Ba3(NpO4(OH)2)2∙6H2O,
валах 1080-1150, 1445-1630 и 2500-3600 см-1 [11].
Co(NH3)6NpO4(OH)2∙2H2O, K3NpO4(OH)2∙H2O и
Как отмечалось выше, с учетом результатов более
KNpO4, которые легко получаются в достаточно чи-
поздних исследований химии An(VII) состав син-
стом виде и весьма устойчивы в сухом состоянии.
тезированной литиевой соли, по-видимому, следует
По порошковым рентгенограммам были опреде-
выразить формулой Li3NpO4(OH)2·nH2O. В таком
лены параметры ячеек для соединений Ba2LiNpO6
случае широкую полосу с максимумом при 723 см-1
и Ba2NaNpO6. Они имеют ГЦК решетку с параме-
можно отнести к колебаниям связей Np-O группы
трами а = 8.34 и 8.59 Å и проявляют структурную
NpO4 в анионе [NpO4(OH)2]3-, а узкую полосу око-
аналогию с соответствующими соединениями тех-
ло 862 см-1 - к νas группы NpO2+, образующейся
неция и рения [59].
вследствие частичного восстановления Np(VII) до
РАДИОХИМИЯ том 64 № 1 2022
30
КРОТ, ЧАРУШНИКОВА
Np(VI) в процессе подготовки образца для измере-
Необходимо особо отметить, что положение
ния ИК спектра.
максимумов широких полос в ИК спектрах солей
анионов [NpO4(OH)2]3- с Na+ [12, 13] или Ba2+,
Наиболее интересной особенностью ИК спек-
[Co(NH3)6]3+ и [Pt(NH3)5Cl]3+ [69] не одинаково
тров солей Na3NpO4(OH)2·nH2O c n = 0, 2, 4 [12, 13]
и колеблется в пределах 620-737 см-1. Это, несо-
является наличие в них широких составных полос
мненно, обусловлено изменениями характера водо-
в области 600-800 см-1, которые следует отнести к
родных связей в соединениях и влиянием природы
колебаниями связей Np-O в группе NpO4. Положе-
внешнесферных катионов на их взаимодействие с
ние основного максимума полос в спектрах разных
анионами [NpO4(OH)2]3-.
образцов соединений находится в интервалах 700-
710 или 620-630 см-1, что можно объяснить различ-
В низкочастотной области ИК спектров
ным числом молекул воды в их составе.
LiNpO4·nH2O [48] имеются интенсивные широкие и
узкие полосы в области 500-600 и 800-900 см-1 со-
По предварительным данным [33], в ИК спек-
ответственно. Узкие полосы имеют вид, характер-
тре Ba3(NpO5)2·nH2O имеются полосы с максиму-
ный для ИК спектров соединений Np(V) и Np(VI),
мами около 725, 865 и 1070 см-1. В другой работе
и поэтому они были отнесены к антисимметричных
[47] обнаружены полосы с максимумами при 700,
колебаниям «ильной» группы NpO3+, которая по
862-905,
1100,
1445-1582,
1660-1690 и
2500-
данным работы [52], является главным элементом
3370 см-1. Более детальные измерения показали
структуры солей типа MNpO4·nH2O. Поглощение
[69], что в ИК спектре Ba3(NpO5)2·nH2O, а также
же в интервале 500-600 см-1 обусловлено колеба-
Co(NH3)6NpO5·nH2O и
[Pt(NH3)5Cl]NpO5·nH2O
ниями связей -O-Np-O-, образующие сетчатые
наиболее характерными являются широкие интен-
слои в кристаллических решетках указанных солей.
сивные полосы в интервале 600-850 см-1с максиму-
В ИК спектрах LiNpO4·nH2O присутствуют также
мом около 732, 670 и 695 см-1 соответственно. Они
полосы деформационных (1616 см-1) и валентных
отнесены к валентным колебаниям связей Np-O.
(3400-3600 см-1) колебаний молекул воды.
Из характера полосы сделан вывод об отсутствии
По данным работ [46, 70], в ИК спектрах соеди-
в структурах указанных солей катионов NpO3+ и
нений MNpO4 (M = K - Cs), как и в случае литие-
наличии цепных связей -O-Np-O-Np-, в которых
вых солей, имеются две интенсивные полосы, об-
кратность в цепях, по-видимому, выше единицы с
условленные колебаниями «ильных» связей Np=O.
октаэдрическим окружением центрального атома.
Одна из них, достаточно широкая, расположена в
Тем самым было поставлено под сомнение перво-
интервале 500-730 см-1, и ее максимум смещается
начальное предположение [33] о том, что ионной
с 600 до 650 см-1 при переходе от KNpO4 к CsNpO4.
формой существования An(VII) в щелочных раство-
Другая полоса значительно ýже и проявляется в
рах служат анионы AnO3-. Это сомнение оказалось
области 750-840 см-1. Как и следовало ожидать, в
правильным, что было позже подтверждено син-
ИК спектрах высушенных MNpO4 отсутствуют по-
тезом и изучением структуры многих соединений
лосы деформационных колебаний молекул воды и
An(VII). Вместе с тем вывод о наличии в структуре
валентных колебаний гидроксила.
изученных соединений цепных связей представля-
ется некорректным. Дело в том, что широкая слож-
В работе [57] представлен фрагмент ИК спек-
ная интенсивная полоса в интервале 600-850 см-1
тра смешано-валентного соединения Np(VI,VII)
в ИК спектре Ba3(NpO5)2·nH2O весьма сходна с
NpO2(OH)NpO4∙4H2O. Он содержит две полосы в
полосой в спектре Co(NH3)6NpO4(OH)2·nH2O.
интервалах 600-700 и 850-1000 см-1, причем по-
Кроме того, по данным ЯГР (см. ниже), и в бари-
следняя расщеплена на две компоненты. Такая
евой соли Np(VII) присутствует в виде аниона
картина объяснена наложением колебаний Np-O в
[NpO4(OH)2]3-. Поэтому широкие полосы в интер-
анионе [NpO4(OH)2]3- и νas нептунильной группы
вале 600-850 см-1 в ИК спектрах Ba3(NpO5)2·nH2O,
NpO2+.
Co(NH3)6NpO5·nH2O и [Pt(NH3)5Cl]NpO5·nH2O сле-
ИК спектры соединений M(NpO4)2·nH2O (M2+ =
дует отнести к валентным колебаниям связей Np-O
Mg, Ca, Sr, Ba) [42] сходны друг с другом и со спек-
в анионах [NpO4(OH)2]3-.
трами MNpO4·nH2O, где М+ - щелочной элемент
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
31
[46, 51]. В обоих случаях в спектрах присутствуют
что при хранении в течение 2 месяцев накопления
интенсивные узкие полосы в области 900-750 и ши-
Np(VI) в цезиевой соли не происходит, а в натрие-
рокие в интервале 700-500 см-1. Природа катионов
вой и литиевой солях в закрытой ампуле оно равно
М2+ заметно влияет на положение узких и широких
2 и 3% соответственно.
полос в ИК спектрах M(NpO4)2·nH2O. По ряду Mg,
В работе [68] измерена магнитная восприимчи-
Ca, Sr максимумы узких полос закономерно смеща-
вость Li5PuO6 в интервале температур 4.2 - 293 К.
ются в низкочастотную область, а в случае широких
Найдено, что χm линейно уменьшается в зависи-
полос наблюдается менее регулярная картина. Как
мости от 1/T с 3698 × 10-6 до 389 × 10-6 (СГС) при
отмечено выше, подобное явление имеет место и в
возрастании температуры в интервале 4.2-293 К.
ИК спектрах соединений MNpO4 c M+ = Li, K, Cs.
Характер этой зависимости свидетельствует о вкла-
Оно может быть объяснено тем, что с уменьшением
де в величину χm температурно-независимого пара-
радиуса катионов M2+ или M+ усиливается их взаи-
магнетизма, равного 207 × 10-6 (СГС).
модействие с мостиковыми атомами кислорода и в
5.4. Термическое поведение соединений An(VII)
результате упрочняются связи в линейных группах
NpO23+.
Cведения о термическом поведении соедине-
ний Np(VII) и Pu(VII) очень ограничены. Относи-
5.3. Магнитные свойства
тельно подробно описано отношение к нагреванию
Поскольку Np(VII) не содержит свободных
лишь соединений Co(NH3)6NpO4(OH)2.2H2O [2, 4]
5f-электронов, то его соединения должны быть
и CsNpO4 [46, 72]. Cостав первого соединения до
диамагнитными или проявлять слабый температур-
100°С существенно не изменяется. В интервале
но-независимый парамагнетизм за счет поляриза-
100-140°С наблюдается эндотермическое отщепле-
ционного магнетизма, обусловленного химически-
ние воды и образование безводной соли, которая
ми связями. Первые измерения мольной магнитной
выше 300°С интенсивно разлагается с выделени-
восприимчивости (χm) соединения Ba3(NpO5)2·nH2O
ем аммиака и восстановлением Np(VII). Конечным
в интервале 15-80°С подтвердили указанные теоре-
продуктом нагревания соединения на воздухе до
тические соображения [71]. Определено, что значе-
>400°С является смесь NpO2 и Co3O4.
ние χm равно (250 ± 90) × 10-6 (СГС) и не зависит
При хранении на воздухе CsNpO4 устойчив, по
крайней мере, в течение 2 месяцев [72]. Нагревание
получена для раствора Np(VII) в 3 моль·л-1 NaOH.
соединения до 150°С приводит к началу его мед-
В работе [72] в интервале 80-300 К измерена маг-
ленного разложения. Этот процесс резко ускоряется
нитная восприимчивость χm соединений CsNpO4,
выше 300°С [46].
KNpO4, NaNpO4·H2O и LiNpO4·2H2O с небольшими
Некоторые выводы о термической устойчиво-
примесями Np(VI). Установлено, что χm можно вы-
сти ряда соединений An(VII) можно сделать ис-
разить уравнением
ходя из условий их приготовления. Основываясь
на этом, можно утверждать, что, по крайней мере,
'', χm'' = c/(T + Θ),
O (M+ = Rb и Cs) устойчивы
M3AnO4(OH)2·H2
'' - магнитная восприимчивость образца
при нагревании до 70-75°С [27], K3NpO4(OH)2 -
и соединений Np(VII) и Np(VI), n - мольная доля
до 105°C [28], M3PuO5 (M+ = Rb, Cs) - до 250°С
основного соединения в образце, c и Θ - констан-
[67], M3NpO5 (M+ = K, Rb, Cs) - до 320°С [66, 67],
ты Кюри и Вейса. Для всех соединений χm' не за-
Ba2MNpO6 (M+ = Na, Li) - до 450°С [59], Li5AnO6 -
висит от температуры и ее можно принять равной
до 400°С [58, 59] и Na5AnO6 - до 800°С [62, 63].
~200 × 10-6 (СГС). По зависимости χm'' от темпе-
Для более детального описания термического по-
ратуры найдены значения c, равные 0.021, 0.212 и
ведения большинства соединений An(VII) нужны
0.174 (см3·град)·моль-1, и Θ, равные 102, 192 и 88 К
дополнительные исследования.
для Np(VI) в цезиевой, натриевой и литиевой солях
5.5. Эффект Мессбауэра на соединениях Np(VII)
соответственно. Методом измерения магнитной
восприимчивости предложено определять примесь
Первые результаты измерения спектров ЯГР
нептуния(VI) в соединениях Np(VII). Показано,
на соединениях Np(VII) были приведены в работе
РАДИОХИМИЯ том 64 № 1 2022
32
КРОТ, ЧАРУШНИКОВА
Таблица 6. Параметры спектров ЯГР соединений Np(VII)
Соединение
T, К
δ, мм·с-1
1/4e2qQ, мм·с-1
η
Ссылки
Li5NpO6
4.2
-68.7
8.2
0.33
[41]
Li5NpO6
4.2
-71.2
8.8
0.3
[79]
Li5NpO6
78
-69
9
0.4
[75]
Na5NpO6
4.2
-74.8б
25.9
0.43
[62]
Na5NpO6
4.2
-75.7б
24
1
[83]
Ba2NaNpO6
4.2
-78.8б
0
0
[76, 83]
Li3NpO4(OH)2
77
-68
10
>0.1
[78]
Li3NpO4(OH)2 в 5 моль·л-1 LiOHа
4.2
-61.2
24.0
0.38
[80]
Na3NpO4(OH)2∙2H2O
78
-61.5
26
0.40
[74]
Na3NpO4(OH)2 в 10 моль·л-1 NaOHа
4.2
-61.4
25.1
0.32
[80]
Na3NpO4(OH)2 в 18 моль·л-1 NaOHа
4.2
-61.2
26.3
0.35
[80]
Rb3NpO5
4.2
-67.0
22.5
0.13
[79]
Cs3NpO5
4.2
-66.0
20.4
0.15
[79]
Co(NH3)6NpO5·nH2O, A
4.2
-62.8
31
0.83
[73]
Co(NH3)6NpO5·nH2O, B
4.2
-62.8
21
0.69
[73]
Co(NH3)6NpO5·nH2O, A
4.2
-63
24
0.40
[34]
Co(NH3)6NpO5·nH2O, B
4.2
-63
29
0.60
[34]
Co(en)3NpO5·nH2O
4.2
-61.1
24.5
0.23
[41]
Ba3(NpO5)2·nH2O
4.2
-60.2
23.1
0.40
[41]
Ca3(NpO5)2·nH2O
4.2
-60.7
18.1
0.38
[41]
LiNpO4∙2H2O
4.2
-60
37.6
0
[48]
LiNpO4∙2.5H2O
4.2
-62
31
0
[48]
KNpO4
78
-59
36
~0
[75]
RbNO4
4.2
-60.2
37.5
0.14
[79]
CsNpO4
78
-58
33
0.20
[75]
CsNpO4
4.2
-58.7
33.5
0.20
[70]
CsNpO4
1.7
-60.4
34.3
0.14
[79]
CsNpO4
4.2
-60.7
34.5
0.15
[79]
CsNpO4
80
-60.3
33.8
0.14
[79]
а В замороженном растворе.
б Изомерный сдвиг относительно NpAl2. Согласно данным работ [41, 62], приведенным для соли Li5NpO6, разница между
изомерным сдвигом для поглотителя NpO2 и NpAl2 составляет ~6 мм·с-1.
[73]. Объектами исследования стали: соединение
74, 77, 81, 84]. Поэтому в настоящем обзоре приве-
Co(NH3)6NpO5·nH2O, остаток после высушивания
ден лишь краткий анализ исследований соединений
раствора Np(VII) в NaOH и продукт озонирования
Np(VII) методами ЯГР c учетом закономерностей,
взвеси нептуната бария в щелочи, который содер-
изложенных в отмеченных выше работах.
жал смесь Np(VII) (~30%) и Np(VI). Было установ-
В табл. 6 перечислены соединения Np(VII), ис-
лено также, что изомерный сдвиг, относящийся к
следованные методом ЯГР, и приведены основные
Np(VII), в спектрах всех образцов имеет более отри-
параметры их спектров: изомерный сдвиг относи-
цательные значения по сравнению с любым соеди-
тельно NpO2 (δ), константа квадрупольного взаимо-
нением Np(VI), включая NpF6 [74]. Это послужило
действия (1/4е2qQ) и параметр асимметрии гради-
в то время одним из подтверждений существования
ента электрического поля (ГЭП) (η).
семивалентного состояния у нептуния. Позже были
Из представленных данных видно, что макси-
измерены и изучены спектры ЯГР многих соедине-
мально отрицательный изомерный сдвиг наблюда-
ний Np(VII) [34, 41, 48, 62, 64, 70, 73-83]. Результа-
ется в спектре ЯГР Ba2NaNpO6. Близкое значение δ
ты этих работ обобщены в докторской диссертации
наблюдается и в спектре Li5NpO6. Однако и в том,
М. С. Григорьева [6] и ряде других публикаций [62¸
и в другом случае изомерный сдвиг по абсолютной
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
33
величине значительно отличается от расчетного
NpO3- + [NpO4(OH)2]3- и NpO–) константы квадру-
значения для Np7+ (-92 мм·с-1 [73]), что обусловле-
польного взаимодействия, а следовательно, и кова-
но ковалентностью связей Np-O в указанных сое-
лентность связей Np-O, существенно возрастают.
динениях. Наличие квадрупольного расщепления и
Средние значения 1/4е2qQ для этих групп соедине-
ненулевое значение параметра асимметрии в спек-
ний составляют ~8, ~24 и ~35 мм·с-1 соответствен-
тре ЯГР Li5NpO6 и Na5NpO6 свидетельствуют о том,
но. Если сопоставить эти величины с приведенны-
что анион NpO5- не является идеальным октаэдром
ми выше средними значениями δ, то становится
[41, 62, 84]. Он слегка вытянут по оси z и имеет ром-
очевидной ранее отмеченная в работах [6, 76, 79]
бическое искажение в плоскости xy. Кроме того, не
корреляция между изомерным сдвигом и квадру-
исключено, что атом Np находится не в центре сим-
польным расщеплением в спектрах ЯГР соединений
метрии аниона.
Np(VII). Следовательно, по результатам измерения
При переходе к производным анионов
δ и 1/4е2qQ в спектре ЯГР соединения Np(VII),
структура которых не определена рентгенодифрак-
[NpO4(OH)2]3-, NpO3- и NpO– изомерный сдвиг по
ционными методами, можно достаточно уверенно
абсолютной величине уменьшается, что, несомнен-
судить о его строении. Так, данные по δ и 1/4е2qQ
но, связано с ростом ковалентности связей Np-O в
в спектрах Ba3(NpO5)2·nH2O и Сa3(NpO5)2·nH2O
указанной последовательности. Диапазон измене-
ния δ в спектрах ЯГР перечисленных соединений
[41] однозначно указывают, что в составе этих со-
лей Np(VII) присутствует не как тригонально-би-
Np(VII) находится в пределах от -72.8 до -58 мм·с-1
пирамидальные анионы NpO53-, а в виде ионов
(относительно NpO2). Он лишь в очень незначитель-
[NpO4(OH)2]3- c КЧ центрального атома 6. Поэтому
ной части перекрывается с диапазоном δ в спектрах
формулы соединений M3(NpO5)2·nH2O (M = Ca, Sr,
соединений Np(VI), верхнюю границу которого со-
Ba) следует записывать как M3[NpO4(OH)2]2·(n - 2)
ставляет δ для NpF6, равный -60.7 мм·с-1 [74, 84].
H2O. Далее, исходя из аналогичных соображений,
По величине изомерного сдвига соединения
в солях Rb3NpO5 и Cs3NpO5 [79] КЧ атома Np рав-
Np(VII) можно разбить на три группы. К первой
но 6, а его кислородное окружение представлено не
из них следует отнести соли с анионами NpO5-
тригональной, а тетрагональной бипирамидой. При
со средним значением δ в спектрах ЯГР поряд-
этом, учитывая состав соединений, можно с уве-
ка
-70 мм·с-1. Вторая группа включает произ-
ренностью утверждать, что в структуре Rb3NpO5 и
водные анионов NpO3- и [NpO4(OH)2]3- (кроме
Cs3NpO5 КП Np(VII) связаны друг с другом мости-
Li3NpO4(OH)2 [78]) и характеризуется средней ве-
ковыми атомами кислорода в цепочки.
личиной δ = -62.6 мм·с-1. К третьей группе отнесе-
ны соединения MNpO4·nH2O c M = Li-Cs со сред-
ним δ = -60 мм·с-1. Соединение Li3NpO4(OH)2 с
ЗАКЛЮЧЕНИЕ
аномально высокой абсолютной величиной δ, кото-
рая в пределах погрешности измерений совпадает с
Из представленных в обзоре сведений видно,
δ для Li5NpO6 [41], было получено высушиванием
что к настоящему времени синтезировано большое
раствора Np(VII) в водном LiOH [78]. Видимо, при
количество разнообразных по составу, строению и
выбранном режиме сушки произошло превращение
свойствам соединений Np(VII) и Pu(VII). Многие
аниона [NpO4(OH)2]3- в NpO5- Это предположение
из них достаточно устойчивы и были получены в
подтверждается тем, что в спектрах ЯГР заморо-
виде монокристаллов, пригодных для рентгено-
женных растворов Np(VII) в водном LiOH и NaOH
структурных исследований. Это позволило внести
[80] величины δ практически совпадают с изомер-
существенные уточнения в ранее высказанные су-
ным сдвигом (-61.5 мм·с-1) в спектре кристалличе-
ждения об особенностях химии актинидов в семи-
ского Na3NpO4(OH)2∙2H2O [75].
валентном состоянии.
Наличие квадрупольного расщепления в спек-
Все известные соединения An(VII) можно ус-
трах ЯГР соединений Np(VII) дополнительно под-
ловно разделить на 3 группы: производные анионов
тверждает значительную ковалентность связей в
AnO5-, [AnO4(OH)2]3- и AnO–. При этом соедине-
КП Np данных солей. По ряду указанных выше трех
ния первой группы получены только методом твер-
групп соединений (производных анионов NpO5-,
дофазных реакций и ограничены солями M5AnO6 и
РАДИОХИМИЯ том 64 № 1 2022
34
КРОТ, ЧАРУШНИКОВА
Ba2MNpO6 (M = Li или Na). Эти соединения не уда-
из слабощелочных растворов, а также выделенные
лось выделить в виде монокристаллов, пригодных
из растворов, близких к нейтральным (рН 6-11).
для РСА. Поэтому сведения об их строении получе-
Это соли MNpO4·nH2O (M+ = Li, Na, NpO2OH,
ны на основе измерения эффекта Мессбауэра и по
NH4, CN3H6 и R4N c R = CH3, C2H5 и C4H9 ) и
результатам РФА солей Na5AnO6. Было определено,
M(NpO4)2·nH2O (M2+ = Mg - Ba, Cd, Cu, Zn). Ни
что анион AnO5- является изолированным искажен-
одно из этих соединений не удалось приготовить
ным октаэдром, в котором присутствуют укорочен-
в виде монокристаллов, пригодных для РСА. Поэ-
ные связи An-O (в интервале 2.03-2.09 Å).
тому сведения об их строении получены на основе
Вторая группа соединений An(VII) наиболее до-
измерений ИК спектров и РФА порошковых рент-
ступна и многочисленна. Она включает соли ани-
генограмм хорошо закристаллизованных солей
онов [AnO4(OH)2]3-, в которых внешнесферными
KNpO4 и CsNpO4. В итоге сделан вывод, что основ-
катионами могут быть однозарядные ионы (Li+-
ным элементом структур производных ионов NpO4-
Cs+, смеси Na+ c Rb+ или Cs+, Li+ c CN3H+), двух-
являются полимерные сетки, состоящие из линей-
зарядные ионы щелочноземельных металлов или
ных групп NpO3+, каждая из которых содержит
трехзарядные комплексные катионы [Co(NH3)6]3+,
в экваториальной плоскости четыре мостиковых
[Co(en)3]3+, [Cr(NH3)6]3+ и [Pt(NH3)5Cl]3+. В эту
атома кислорода. Между сетками располагаются
группу следует также отнести цепочечные соедине-
одно- или двухзарядные катионы и молекулы воды.
ния MCo(NH3)6Np2O8(OH)2·2H2O (M+ = Li, Na) [43]
Формирование нептуний-кислородных сеток в про-
и MNpO4(OH)∙nH2O (M2+ = Ca, Sr, Ba) [44]. В этих
цессе осаждения производных анионов NpO–, веро-
соединениях анионы [NpO4(OH)2]3- связываются в
ятно, протекает через промежуточное образование
цепочки через мостиковые атомы кислорода групп
анионов [NpO2(OH)4]- при подкислении щелочных
NpO4 или гидроксил-ионов. Во всех соединениях
растворов Np(VII) по схеме:
данной группы кислородное окружение атомов Np
[NpO4(OH)2]3- + 2H+ → [NpO2(OH)4]-.
или Pu представлено в виде тетрагональных бипи-
Затем анионы [NpO2(OH)4]- быстро полимеризу-
рамид, искаженных в той или иной степени за счет
ются с отщеплением молекул воды:
воздействия водородных связей и внешнесферных
n[NpO2(OH)4]- → (NpO–)n + 2nH2O.
катионов. Составными частями бипирамид служат
четыре атома кислорода в экваториальной пло-
Поскольку соли MAnO4 (M = K-Cs) медленно
скости с укороченными связями An-O (в пределах
кристаллизуются из щелочных растворов An(VII),
1.88-1.90 Å) и два атома в вершинах с удлиненны-
то можно заключить, что в таких растворах суще-
ми расстояниями An-OH (в интервале 2.31-2.37 Å).
ствует равновесие:
Значения An-O в экваториальных группах AnO4
[NpO4(OH)2]3- + 2H+ ↔ [NpO2(OH)4]-,
близки к таковым в ионах AnO+. В этом плане
сильно смещенное влево и тем значительнее, чем
проявляется своеобразная аналогия групп AnO4
выше концентрация щелочи. Поэтому скорость
c «ильными» катионами AnO+ и AnO2+. С другой
кристаллизации MAnO4 резко замедляется с ростом
стороны, в анионах [AnO4(OH)2]3- гидроксильные
[OH-].
ионы можно принять как лиганды, координирован-
ные группой AnO4, поскольку расстояние An-OH
Катион NpO3+ можно рассматривать как послед-
близко к длине связей An-Olig в комплексах ионов
ний член гомологического ряда «ильных» групп
AnO+ и AnO22+ c кислородсодержащими лигандами.
AnO+-AnO2+-AnO23+. Его специфической особен-
Поэтому в принципе не исключена возможность
ностью является тот факт, что он идентифицирован
замещения OH-групп в анионах [AnO4(OH)2]3- на
только как фрагмент нептуний-кислородных сеток
другие монодентатные лигады, хотя решение этой
в структуре производных анионов NpO4- и как со-
задачи сильно осложнено условиями существова-
ставная часть комплексного катиона [NpO2(OH)2]+,
ния указанных анионов (щелочные растворы) и их
который является наиболее вероятной формой су-
высокой окислительной способностью.
ществования Np(VII) в кислых растворах [85]. В
Из производных анионов AnO– получены сое-
гидратированной форме в водных растворах NpO3+
динения MAnO4 (M = K-Cs), кристаллизующиеся
не обнаружен вследствие очень быстрого восста-
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
35
новления и перехода в нептунил. Стабилизация его
тельно, на основе изложенных выше соображений
в солях анионов NpO– обеспечивается прочностью
можно сделать вывод, что синтез и изучение соеди-
связей с четырьмя мостиковыми атомами кисло-
нений An(VII) полностью подтверждает ранее вы-
рода, выступающими в роли сильных лигадов, а в
сказанное утверждение о принципиальном разли-
случае катиона [NpO2(OH)2]+ стабилизаторами вы-
чии химии An(VII) и d-элеметов в семивалентном
ступают 2 иона гидроксила. Общей особенностью
состоянии [88].
всех рассмотренных в обзоре соединений An(VII)
является тот факт, что они являются солями только
КОНФЛИКТ ИНТЕРЕСОВ
кислородсодержащих анионов, причем КЧ атомов
Np и Pu всегда равно 6. Достоверные сведения о по-
лучении фторсодержащих соединений Np(VII) от-
Авторы заявляют об отсутствии конфликта ин-
сутствуют, хотя попытки в этом направлении пред-
тересов.
принимались [86]. По-видимому, если гептафторид
нептуния удастся получить, он окажется солью
СПИСОК ЛИТЕРАТУРЫ
состава [NpF+]F- [5]. Указанная особенность отра-
жает существенное различие в составе и структуре
1.
Крот Н.Н., Гельман А.Д. // Докл. АН СССР. 1967.
Т. 177, № 1. С. 124.
соединений An(VII), с одной стороны, и An(VI) и
2.
Крот Н.Н., Мефодьева М.П., Смирнова Т.В., Гель-
An(V), с другой. В последних КЧ центральных ато-
ман А.Д. // Радиохимия. 1968. Т. 10, № 4. С. 412.
мов обычно равно 7 или 8 и реже 6, а в состав КП
3.
Keller C., Seiffert H. // Inorg. Nucl. Chem. Lett. 1969.
могут входить помимо кислорода атомы других эле-
Vol. 5. P. 51.
ментов, чаще всего N, Cl и F.
4.
Крот Н.Н., Гельман А.Д., Мефодьева М.П., Ши-
Из других специфических черт препаративной
лов В.П., Перетрухин В.Ф., Спицын В.И. Семива-
химии An(VII) следует отметить использование ще-
лентное состояние нептуния, плутония, америция.
М.: Наука, 1977. 149 с.
лочных сред для синтеза большинства соединений
5.
Keller C. Heptavalent Actinides // Handbook of the
и наличие в их структуре уникальных групп AnO4
Physics and Chemistry of the Actinides / Eds A.J.
с четырьмя укороченными связями An-O. В случае
Freeman, C. Keller. Elsevier, 1985. Vol. V. P.143.
же An(V) и An(VI) соединения обычно выделяются
6.
Григорьев М.С. Дис. … д.х.н. М.: ИФХ РАН, 1995.
из кислых или нейтральных сред и являются про-
7.
Мефодьева М.П., Крот Н.Н., Афанасьева Т.В. //
изводными линейных групп AnO+ и AnO2+ c двумя
Радиохимия. 1977. Т. 19, № 2. С. 245.
прочными связями An=O.
8.
Bolvin H., Wahlgren U., Moll H., Reich T., Geipel G.,
Fanghänel T., Grenthe I. // J. Phys. Chem. A. 2001.
Из сравнения условий синтеза, состава и стро-
Vol. A105. P. 11441.
ения рассмотренных выше соединений An(VII) и
9.
Williams C.W., Blaudeau J.-P., Sullivan J.C.,
соединений d-элементов в семивалентном состоя-
Antonio M.R., Bursten B., Soderholm L. // J. Am. Chem.
нии можно отметить следующее. Только соли ани-
Soc.2001. Vol. 123. P. 4346.
онов AnO5- проявляют определенное структурное
10. Antonio M.R., Williams C.W., Sullivan J.C.,
сходство с аналогичными соединениями Re(VII) и
Skanthakumar S., Hu Y.J., Soderholm L. // Inorg. Chem.
Tc(VII). Производные же анионов [AnO4(OH)2]3- и
2012. Vol. 51. P. 5274.
AnO4- по составу, строению и свойствам не имеют
11. Чайхорский А.А., Зеленцов С.С., Лейкина Э.В. //
себе аналогов среди соединений семивалентных
Радиохимия. 1972. Т. 14, № 4. С. 622.
12. Мефодьева М.П., Афанасьева Т.В. // Изв. АН СССР.
d-элементов. Последние обычно являются солями
Сер. хим. 1980. C. 1436.
тетраэдрических анионов MO–. Попытки синтеза
13. Волков Ю.Ф., Томилин С.В., Висящева Г.И., Капшу-
производных анионов [ReO4(OH)2]3- добавлени-
ков И.И., Мефодьева М.П., Крот Н.Н., Рыков А.Г. //
ем к раствору Re(VII) в крепком растворе NaOH
Радиохимия. 1981. Т. 23, № 5. С. 690.
избытка Co(NH3)6Cl3 привели к образованию со-
14. Томилин С.В., Волков Ю.Ф., Капшуков И.И., Ры-
единения, состав которого выражался формулой
ков А.Г. // Радиохимия. 1981. Т. 23, № 5. С. 704.
Co(NH3)6(ReO4)3∙nH2O, кристаллическая структура
15. Томилин С.В., Волков Ю.Ф., Капшуков И.И., Ры-
которого ранее была определена РСА [87]. Следова-
ков А.Г. // Радиохимия. 1981. Т. 23, № 5. С. 710.
РАДИОХИМИЯ том 64 № 1 2022
36
КРОТ, ЧАРУШНИКОВА
16. Томилин С.В., Волков Ю.Ф., Капшуков И.И., Ры-
42. Крот Н.Н., Чарушникова И.А., Бессонов А.А. //
ков А.Г. // Радиохимия. 1981. Т. 23, № 6. С. 862.
Радиохимия. 2018. Т. 60, № 1. С. 14.
17. Grigoriev M.S., Krot N.N. // Acta Crystallogr. Sect. E.
43. Burns J. H., Baldwin W. H., Stokeley J. R. // Inorg.
2007. Vol. 63. P. i176.
Chem. 1973. Vol. 12, N 2. P. 466.
18. Grigoriev M.S., Krot N.N. // Acta Crystallogr. Sect. E.
44. Крот Н.Н., Чарушникова И.А., Перминов В.П. //
2008. Vol. 64. P. i6.
Радиохимия. 2015. Т. 57, № 5. С. 385.
19. Крот Н.Н., Чарушникова И.А., Григорьев М.С., Пер-
45. Nikonov M.V., Budantseva N.A., Fedoseev A.M. //
минов В.П. // Радиохимия. 2011. Т. 53, № 6. С. 491.
Mendeleev Commun. 2001. Vol. 11. P. 102.
20. Крот Н.Н., Чарушникова И.А., Перминов В.П., Ма-
46. Мефодьева М.П., Крот Н.Н., Гельман А.Д., Афана-
каренков В.И. // Радиохимия. 2012. Т. 54, № 6. С. 481.
сьева Т. В. // Радиохимия. 1976. Т. 18, № 1. С. 93.
21. Grigoriev M.S., Krot N.N. // Acta Crystalogr. Sect. C.
47. Чайхорский А.А., Лейкина Э.В. // Радиохимия. 1972.
2009. Vol. 65. P. i91.
Т. 14, № 3. С. 378.
22. Томилин С.В., Волков Ю.Ф., Висящева Г.И., Капшу-
48. Ananyev A.V., Grigoriev M.S., Krot N.N. // Radiochem.
ков И.И. // Радиохимия. 1983. Т. 25, № 1. С. 58.
Radioanal. Lett. 1980. Vol. 44, N 4. P. 217.
23. Чарушникова И.А., Крот Н.Н., Старикова З.А., По-
49. Дзюбенко В.И., Караваев С.А., Перетрухин В.Ф.,
лякова И.Н. // Радиохимия. 2007. Т. 49, № 3. С. 193.
Крот Н.Н. // Докл. АН СССР. 1979. Т. 248. С. 1362.
24. Григорьев М.С., Батурин Н.А., Тананаев И.Г.,
50. Федосеев А.М., Буданцева Н.А., Бессонов А.А., Ши-
Крот Н.Н. // Радиохимия. 1993. Т. 35, № 1. С. 12.
лов В.П. // Радиохимия. 2012. Т. 54, № 2. С. 118.
25. Крот Н.Н., Чарушникова И.А., Григорьев М.С., Пер-
51. Никонов М.В., Тананаев И.Г., Чарушникова И.А. //
минов В.П. // Радиохимия. 2012. Т. 54, № 3. С. 221.
Радиохимия. 1994. Т. 36, № 1. С. 10.
26. Grigoriev M.S., Krot N.N. // Acta Crystallogr. Sect. E.
52. Григорьев М.С., Глазунов М.П., Крот Н.Н., Гав-
2007. Vol. 63. P. i108.
риш А.А., Шах Г.Е. // Радиохимия. 1979. Т. 21, № 5.
27. Григорьев М.С., Крот Н.Н., Перминов В.П.
//
С. 665.
Радиохимия. 2013. Т. 55, № 3. С. 212.
53. Reis A.H., Hoekstra H.R., Gebert E., Peterson S.W. // J.
28. Крот Н.Н., Григорьев М.С., Чарушникова И.А. //
Inorg. Nucl. Chem. 1976. Vol. 38. P. 1481.
Радиохимия. 2014. Т. 56, № 5. С. 407.
54. Мефодьева М.П., Крот Н.Н. Соединения трансура-
29. Grigoriev M.S., Krot N.N. Plutonium Futures—The
новых элементов. М.: Наука, 1987. С. 227.
Science 2008: A Topical Conf. on Plutonium and the
55. Nikonov M., Bessonov A. // Int. Conf. Actinides-93:
Actinides. Dijon, 2008. P. 282.
Abstracts. Santa Fe (USA), 1993. P. 96.
30. Григорьев М.С., Чарушникова И.А., Крот Н.Н., Пер-
56. Дзюбенко В.И., Караваев С.А., Перетрухин В.Ф. //
минов В.П. // Радиохимия. 2018. Т. 60, № 2. С. 128.
Докл. АН СССР. 1981. Т. 257. С. 147.
31. Григорьев М.С., Крот Н.Н., Чарушникова И.А //
57. Никонов М.В., Бессонов А.А., Крот Н.Н., Перми-
Радиохимия. 2018. Т. 60, № 3. С. 204.
нов В.П. // Радиохимия. 1994. Т. 36, № 3. С. 237.
32. Чарушникова И.А., Крот Н.Н., Перминов В.П. //
58. Keller C., Seiffert H. // Angew. Chem. 1969. Bd 81, Hf.
Радиохимия. 2018. Т. 60, № 5. С. 447.
8. S. 294.
33. Крот Н.Н., Мефодьева М.П., Захарова Ф.А., Смир-
59. Awasthi S.K., Martinot L., Fuger J., Duyckaerts G. //
нова Т.В., Гельман А.Д. // Радиохимия. 1968. Т. 10,
Inorg. Nucl. Chem. Lett. 1971. Vol. 7. P. 145.
№ 6. С. 630.
60. Keller C., Koch L., Walter K.H. // J. Inorg. Nucl. Chem.
34. Григорьев М.С., Гулев Б.Ф., Крот Н.Н. // Радиохимия.
1965. Vol. 27. P. 1205.
1986. Т. 28, № 6. С. 690.
61. Smith A. L., Raison P. E., Konings R.J.M. // J. Nucl.
35. Чарушникова И.А., Крот Н.Н., Григорьев М.С., Ма-
каренков В.И. // Радиохимия. 2017. Т. 59, № 2. С. 110.
Mater. 2011. Vol. 413. P. 114.
36. Комков Ю.А., Крот Н.Н., Гельман А.Д. // Радиохимия.
62. Smith A.L., Hen A., Raison P.E., Colineau E.,
Griveau J.-C.,
Magnani N., Sanchez J.-P.,
1968. Т. 10, № 6. С. 625.
37. Захарова Ф.А., Орлова М.М., Гельман А.Д.
//
Konings R.J.M., Caciuffo R., Cheetham A.K. // Inorg.
Радиохимия. 1972. Т. 14, № 1. С. 123.
Chem. 2015. Vol. 54. P. 4556.
38. Gross. J. Diss. Univ. Stuttgart. KFK-1339. 1970.
63. Smith A. L., Martin P., Prieur D., Scheinost A.C.,
39. Мефодьева М.П., Крот Н.Н., Гельман А.Д.
//
Raison P.E., Cheetham A.K., Konings R.J.M. // Inorg.
Радиохимия. 1970. Т. 12, № 2. С. 232.
Chem. 2016. Vol. 55. P. 1569.
40. Чарушникова И.А., Крот Н.Н., Григорьев М.С. //
64. Morss L.R., Appelman E.H., Gerz R. R., Martin-
Радиохимия. 2017. Т. 59, № 3. С. 193.
Rovet D. // J. Alloys Compd. 1994. Vol. 203. P. 289.
41. Fröhlich K., Gütlich P., Keller C. // J. Chem. Soc. Dalton
65. Pagès M., Nectoux F., Freundlich W. // Radiochem.
Trans.1972. P. 971.
Radioan. Lett. 1971. Vol. 7. P. 155.
РАДИОХИМИЯ том 64 № 1 2022
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ АКТИНИДОВ(VII)
37
66. Pagès M., Nectoux F., Freundlich W. // Compt. Rend.
78. Илятов К.В., Матузенко М.Ю., Крижанский Л.М.,
Ser. C. 1971. Vol. 272. P. 1968.
Чайхорский А.А. // Радиохимия. 1975. Т. 17, № 6.
67. Pagès M., Nectoux F., Freundlich W. // Compt. Rend.
С. 905.
Ser. C. 1971. Vol. 273. P. 978.
79. Friedt J.M., Shenoy G.K., Pagès M.J. // Phys. Chem.
68. Kanellakopulos B., Henrich E., Keller C.,
Solids. 1978. Vol. 39. P. 1313.
Baumgärtner F., König E., Desai V.P. // Chem. Phys.
80. Григорьев М.С., Ананьев А.В. Прикладная ядер-
1980. Vol. 53. P. 197.
ная спектроскопия. Вып.12. М.: Энергоиздат, 1983.
69. Цивадзе А.Ю., Крот Н.Н. // Радиохимия. 1972. Т. 14,
С. 230.
№ 4. С. 629.
81. Dunlap B.D., Kalvius G.M. // Handbook on Physics and
70. Григорьев М.С., Глазунов М.П., Мефодьева М.П.,
Chemistry of the Actinides. Vol. 2 / Eds A.J. Freeman,
Крот Н.Н., Макаров Е.Ф., Пермяков Ю.В., Зем-
J.W. Lander. Amsterdam, 1985.
сков Б.Г. // Радиохимия. 1979. Т. 21, № 5. С. 659.
71. Чайхорский А.А., Романов Г.А. // Радиохимия. 1969.
82. Bickel M., Kanellakopulos B., Appel H., Heffner H.,
Т. 11, № 5. С. 598.
Geggus S. // J. Less-Common Met. 1986. Vol. 121.
72. Казин П.Е., Тананаев И.Г. // Радиохимия. 1989. Т. 31,
P. 291.
№ 4. С. 59.
83. Jové J., He L., Proust J., Pagès M., Pyykkö P. // J. Alloys
73. Stone J.A., Pillinger W.L., Karraker D.G. // Inorg. Chem.
Compd. 1991. Vol. 177. P. 285.
1969. Vol. 8. P. 2519.
84. Kalvius G.M., Dunlop B.D., Asch L., Weigel F. // J. Solid
74. Kalvius G.M. Mössbauer Spectroscopy and Its
State Chem. 2005. Vol. 178. P. 545.
Applications. Vienna: IAEA, 1972. P. 169-196.
85. Спицын В.И., Ионова Г.В., Киселева А.А. // ЖНХ.
75. Григорьев М.С., Глазунов М.П., Крот Н.Н. XIII Все-
1986. Т. 31. С. 1492.
союз. Чугаевское совещание по химии комплексных
86. Дробышевский Ю.В., Прусаков В.Н., Серик В.Ф., Со-
соединений: Тез. докл. М.: Наука, 1978. C. 105.
колов В.Б. // Радиохимия. 1980. Т. 22, № 4. С. 591.
76. Jové J., Gal J., Pagès M., Potzel W. // 27èmes Journees
87. Байдина И.А., Филатов Е.Ю., Макотченко Е.В.,
des Actinides: Program and Abstracts. Dijon (France),
Apr. 26-29, 1997. P. 47.
Смоленцев А.И. // ЖСХ. 2012. Т. 53, № 1. С. 117.
77. Чайхорский А.А. // Радиохимия. 1975. Т. 17, № 6.
88. Крот Н.Н., Гельман А.Д., Спицын В.И. // ЖНХ. 1969.
С. 910.
Т. 14, № 10. С. 2633.
РАДИОХИМИЯ том 64 № 1 2022