РАДИОХИМИЯ, 2022, том 64, № 1, с. 38-44
УДК 542.61: 546.442
ВЛИЯНИЕ СТРОЕНИЯ ДИОКСИДОВ
(О-ФЕНИЛЕНОКСИМЕТИЛЕН)ДИФОСФИНОВ
НА ИХ ЭКСТРАКЦИОННУЮ СПОСОБНОСТЬ
ПО ОТНОШЕНИЮ К U(VI), Th(IV) И РЗЭ(III) В
АЗОТНОКИСЛЫХ СРЕДАХ
© 2022 г. А. Н. Туранова,*, В. К. Карандашевб,
А. Н. Яркевичв
,
Д. В. Баулинг, В. Е. Баулинв
а Институт физики твердого тела им. Ю.А. Осипьяна.,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 2
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 6
в Институт физиологически активных веществ РАН,
142432, Черноголовка Московской обл., Северный проезд, д. 1
г Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119991, Москва, Ленинский пр., д. 31, корп. 4
* e-mail: turanov@issp.ac.ru
Поступила в редакцию 12.10.2020, после доработки 28.12.2020, принята к публикации 30.12.2020
Изучена экстракция микроколичеств U(VI), Th(IV) и РЗЭ(III) из азотнокислых растворов растворами
диоксидов (о-фениленоксиметилен)дифосфинов с фенильными и бутильными заместителями при атоме
фосфора во фрагменте OCH2P(O)R2. Определена стехиометрия извлекаемых комплексов. Рассмотрено
влияние строения экстрагента, концентрации HNO3 в водной фазе и природы органического растворителя
на эффективность извлечения ионов РЗЭ(III), U(VI) и Th(IV) в органическую фазу. Представленные
данные показали, что фосфорильные группы в молекуле диоксида (о-фениленоксиметилен)
дифосфина неэквивалентны. В отличие от заметного снижения эффективности экстракции РЗЭ(III) из
азотнокислых растворов при замене фенильных радикалов на бутильные в фосфорильной группе P(O)
R2, непосредственно присоединенной к фениленовому кольцу, замена в молекуле диоксида фрагмента
OCH2P(O)Ph2 на OCH2P(O)Bu2 лишь незначительно снижает коэффициенты распределения РЗЭ(III) в
таких средах. В то же время эффективность экстракции U(VI) и Th(IV) из азотнокислых растворов при
такой замене возрастает.
Ключевые слова: экстракция, уран(VI), торий(IV), РЗЭ(III), диоксиды (о-фениленоксиметилен)
дифосфинов.
DOI: 10.31857/S0033831122010026
Экстракционные методы широко используются
диоксиды метилендифосфинов [4], оксиды (ди-
для извлечения, концентрирования и разделения ак-
алкилкарбамоилметил)диарилфосфинов (КМФО)
тинидов и редкоземельных элементов (РЗЭ) из азот-
[5] и их производные [6], N-дифенилфосфорил-N'-
нокислых растворов, получаемых при переработке
алкилмочевины [7], фосфорилированные каликса-
отработанного ядерного топлива [1]. Высокой экс-
рены [8, 9], фосфорилированные пиридин-N-окси-
тракционной способностью по отношению к этим
ды [10], а также ациклические аналоги краун-эфи-
элементам обладают полидентатные нейтральные
фосфорорганические соединения [2, 3], среди ко-
ров - поданды с амидными [11-13] или фосфориль-
торых наиболее детально изучены замещенные
ными [14-16] концевыми группами.
38
ВЛИЯНИЕ СТРОЕНИЯ ДИОКСИДОВ (О-ФЕНИЛЕНОКСИМЕТИЛЕН)ДИФОСФИНОВ
39
Экстракционная способность и селективность
Схема 1.
фосфорилсодержащих подандов (ФП) существен-
но зависит от длины полиэфирной цепи, структуры
мостика между эфирным атомом кислорода и РО-
группой, а также природы заместителя при атомах
фосфора [14-16]. В ряде случаев замена алкилено-
вого мостика в молекулах диоксидов тетрафени-
лалкилендифосфинов на этиленгликолевые фраг-
менты приводит к повышению экстракционной
способности соответствующих ФП по отношению
к РЗЭ(III) [16]. Среди этих соединений диоксиды
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тетраарилзамещенных (о-фениленоксиметилен)ди-
фосфинов обладают наиболее высокой экстракци-
Окись
((2-(дифенилфосфорил)-4-этилфенок-
онной способностью по отношению к ионам акти-
си)метил)дифенилфосфина III получали ранее
нидов и РЗЭ(III) [16], превосходя таковую КМФО.
описанным методом [19], синтез соединения IV
В изученных ранее системах с диоксидами (о-фе-
приведен ниже.
ниленоксиметилен)дифосфинов I и II замена фе-
нильных заместителей при фосфорильной группе,
Окись дибутил ((2-(дифенилфосфорил)-4-этил-
непосредственно соединенной с о-фениленовым
фенокси)метил) фосфина IV. К суспензии 1.39 г
фрагментом, на бутильные приводит к резкому сни-
(4.32 ммоль) 2-дифенилфосфорил-4-этилфенола [20]
жению экстракционной способности соединения
в 35 мл сухого диоксана добавляли 1.40 г (4.33 ммоль)
II по отношению к Am(III) и РЗЭ(III) в азотнокис-
свежепрокаленного карбоната цезия, нагревали до
лых средах [14]. Это связано с проявлением в си-
100°С, перемешивали 0.5 ч, затем добавляли 0.97 г
стемах с реагентами I и II эффекта аномального
(4.3 моль) дибутил(хлорметил)фосфиноксида [21].
арильного упрочнения экстрагируемых комплексов
Смесь перемешивали при кипении 20 ч и упарива-
(ЭААУ) [17], обнаруженного ранее в системах с
ли в вакууме. К остатку добавляли 20 мл воды, под-
диоксидами метилендифосфинов [4] и КМФО [5].
кисляли концентрированной HCl до рН 1 и полу-
Не меньший интерес представляет выяснение осо-
ченную смесь экстрагировали СHCl3 (3 × 20 мл).
бенностей влияния заместителей в фосфорильной
Экстракт последовательно промывали разбавлен-
группе, отделенной от о-фениленового фрагмента
ной (1 : 2) HCl (3 × 20 мл), водой (2 × 20 мл) и
оксиметиленовым мостиком, на экстракционную
упаривали в вакууме. Остаток хроматографировали
способность реагентов в азотнокислых средах, так
на колонке с силикагелем марки L, элюент СHCl3 и
как ранее методом рентгеноструктурного анализа
СHCl3-i-PrOH (10 : 1). Выделено 0.88 г соедине-
показано, что фосфорильные группы в молекуле
ния IV, выход 42%, т. пл. 140-142°С (диэтило-
диоксида III не эквивалентны [18, 19]. В настоящей
вый эфир). Найдено, %: С 69.95, 70.19; H 7.61,
работе изучено влияние природы заместителя при
7.74; P 12.28, 12.39. C29H38O3P2. Вычислено, %:
неэквивалентных фосфорильных группах диокси-
дов (о-фениленоксиметилен)дифосфинов на их экс-
С 70.15; H 7.71; P 12.48. Спектр ЯМР 1Н (CDCl3),
тракционную способность по отношению к U(VI),
δ, м.д.: 0.87 м (6Н, 2СН3-СН2СН2СН2,); 1.08 т (3Н,
Th(IV) и РЗЭ(III) в азотнокислых средах.
СН3-CH2Ar, 3JH-H = 7.2 Гц); 1.41 м (12Н, 2СН3-
СН2СН2СН2);
2.49 к
(2H, CH3-CH2Ar,
3JH-H =
С этой целью исследованы некоторые законо-
мерности межфазного распределения U(VI), Th(IV)
7.5 Гц); 4.15 д (2Н, OCH2P, 2JH-P = 7.6 Гц); 6.86 д
и РЗЭ(III) между водными растворами HNO3 и рас-
(1H, 2JH-P =7.6 Гц, Ar-H); 6.98 м (1Н, Ar-H); 7.50 м
творами соединений III и IV в 1.2-дихлорэтане
(7Н, 1 Ar-H + 6Н Ph-H); 7.64 м (4H, Ph-H). Cпектр
(Схема 1).
ЯМР 31P (CDCl3), δ, м.д.: 29.36; 49.87.
РАДИОХИМИЯ том 64 № 1 2022
40
ТУРАНОВ и др.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Таблица 1. Эффективные константы экстракции HNO3
растворами соединений I-IV в дихлорэтане
Соединение
K1
K2
Процесс экстракции ионов металлов из азотно-
I
2.70 [14]
0.23 [14]
кислых растворов нейтральными фосфорорганиче-
II
8.03 [14]
1.03 [14]
скими соединениями сопровождается взаимодей-
III
2.80 ± 0.13
0.26 ± 0.02
ствием HNO3 с экстрагентом. Поэтому предвари-
IV
9.18 ± 0.43
1.52 ± 0.08
тельно исследована экстракция HNO3 растворами
соединений III и IV. Данные по распределению
В качестве органического разбавителя использо-
HNO3 между ее водными растворами и растворами
вали 1,2-дихлорэтан марки х.ч. без дополнительной
соединений III и IV в дихлорэтане указывают на то,
очистки. Растворы экстрагентов готовили по точ-
что при [HNO3] > 2 моль/л отношение концентра-
ным навескам.
ции HNO3, связанной в комплексы с экстрагентом,
Распределение РЗЭ(III), U(VI) и Th(IV) в экс-
и исходной концентрации экстрагента в органиче-
тракционных системах изучали на модельных
ской фазе превышает 1. Полагая, что в органиче-
растворах 0.1-7.0 моль/л HNO3. Водные растворы
скую фазу переходят комплексы экстрагента (L) с
U(VI), Th(IV) и РЗЭ(III) готовили растворением
одной и двумя молекулами азотной кислоты, про-
соответствующих нитратов в воде с последующим
цесс экстракции HNO3 может быть описан уравне-
добавлением HNO3. Исходная концентрация ионов
ниями
металлов составляла 2 × 10-6 моль/л. Контакт фаз
,
(1)
осуществляли при комнатной температуре на ро-
где символами (о) обозначены компоненты орга-
торном аппарате для перемешивания со скоростью
нической фазы, i = 1 и 2 - число молекул HNO3 в
60 об/мин в течение 1 ч. Предварительно установ-
экстрагируемом сольвате. Эффективные константы
лено, что этого времени достаточно для установле-
экстракции HNO3 (K1 и K2) выражаются как
ния постоянных значений коэффициентов распре-
Ki = [(HNO3)iL]/([L]ai),
(2)
деления элементов (D) в экстракционных системах.
где a - активность HNO3 в равновесной водной
Концентрацию U(VI), Th(IV) и РЗЭ(III) в ис-
фазе (a = [H+][NO–]γ2); [L] - равновесная концен-
ходных и равновесных водных растворах опреде-
трация свободного экстрагента в органической
ляли методом масс-спектрометрии с индуктивно
фазе). Значения K1 и K2, рассчитанные нелинейным
связанной плазмой (ИСП-МС) с использованием
методом наименьших квадратов с использованием
масс-спектрометра X-7 (Thermo Elemental, США).
уравнения
Содержание элементов в органической фазе опреде-
ляли после реэкстракции раствором 0.1 моль/л ок-
y/[L](исх) = (K1a + 2K2a2)/(1 + K1a + K2a2),
(3)
сиэтилидендифосфоновой кислоты. Коэффициенты
где y - общая концентрация комплексов HNO3 c экс-
распределения элементов рассчитывали как отно-
трагентом в органической фазе, [L](исх) - исходная
шение их концентраций в равновесных органиче-
концентрация экстрагента, приведены в табл.
1.
ской и водной фазах. Погрешность определения
Там же для сравнения приведены значения K1 и K2
коэффициентов распределения не превышала 5%.
для соединений I и II. Соединения II и IV с бутиль-
Концентрацию HNO3 в равновесной водной
ными заместителями при атомах фосфора прояв-
фазе определяли потенциометрическим титрова-
ляют более высокую экстракционную способность
нием раствором NaOH, в органической фазе - та-
по отношению к HNO3, чем их фенилзамещенные
ким же образом после реэкстракции HNO3 водой.
аналоги I и III, что связано с увеличением донор-
Параллельно определяли содержание HNO3 в ор-
ной способности группы P=O по мере снижения
ганической фазе при экстракции кислоты чистым
электроотрицательности заместителей при атоме
дихлорэтаном (холостой опыт). Результаты холо-
фосфора [22]. Это приводит к более заметному сни-
стого опыта учитывали при расчете общей концен-
жению концентрации свободного экстрагента II
трации комплексов HNO3 с экстрагентом в органи-
или IV в органической фазе, чем в системах с реа-
ческой фазе.
гентами I и III.
РАДИОХИМИЯ том 64 № 1 2022
ВЛИЯНИЕ СТРОЕНИЯ ДИОКСИДОВ (О-ФЕНИЛЕНОКСИМЕТИЛЕН)ДИФОСФИНОВ
41
При экстракции U(VI) и Th(IV) растворами со-
2.5
единений III и IV в дихлорэтане зависимости ко-
2.0
эффициентов распределения U(VI) и Th(IV) от кон-
центрации HNO3 в равновесной водной фазе харак-
1.5
1
теризуются кривыми с максимумами (рис. 1). Это
2
1.0
связано с высаливающим действием ионов NO– и
3
4
соэкстракцией HNO3, приводящей к снижению
0.5
концентрации свободного экстрагента в органиче-
0.0
ской фазе, и соответствует экстракции ионов U(VI)
и Th(IV) в виде координационно-сольватирован-
-0.5
ных нитратов. Смещение положения максимума на
-1.0
-1.5
-1.0
-0.5
0.0
0.5
1.0
кривой зависимости D-[HNO3] в область меньшей
lg [HNO3]
кислотности водной фазы при экстракции U(VI) и
Рис. 1. Зависимость коэффициентов распределения Th(IV)
Th(IV) растворами бутилзамещенного диоксида IV
(1, 2) и U(VI) (3, 4) от концентрации HNO3 в равновесной
соответствует увеличению основности этого соеди-
водной фазе при экстракции растворами 0.002 моль/л
соединений IV (1, 3) и III (2, 4) в дихлорэтане.
нения по сравнению с его фенилзамещенным ана-
логом III. В диапазоне концентрации HNO3 0.1-5
сти реагента в органических растворителях и сни-
моль/л значения DU и DTh при экстракции диок-
жению перехода его в водную фазу по сравнению
сидом IV заметно выше, чем при экстракции сое-
с соединением I [19], однако мало влияет на изме-
динением III (рис. 1). Стехиометрическое соотно-
нение его экстракционной способности по отноше-
шение металл : экстрагент в экстрагируемых ком-
нию к U(VI) и Th(IV). Эффективность экстракции
плексах определено методом сдвига равновесия.
U(VI) бутилзамещенными диоксидами II и IV не-
Полученные данные показали, что соединения III и
сколько выше, чем их фенилзамещенными аналога-
IV экстрагируют U(VI) из азотнокислых растворов
ми I и III. Однако такое увеличение значений DU
в форме в форме моно- и дисольватов (тангенс угла
(в 1.3-2.4 раза) значительно меньше, чем при заме-
наклона зависимости lgDU-lg[L] равен 1.48 ± 0.08)
не в молекуле мононодентатных фосфорорганиче-
(см. Дополнительные материалы, рис. S1). В анало-
ских экстрагентов двух фенильных радикалов на
гичных условиях диоксиды I и II также экстраги-
алкильные, когда константа экстракции урана уве-
руют U(VI) в виде моно- и дисольватов [23]. Ионы
личивалась в 300 раз [25].
Th(IV) экстрагируются соединением IV из раствора
При экстракции Th(IV) из азотнокислых раство-
3 моль/л HNO3 в основном в виде дисольватов (тан-
ров замена в молекуле диоксида II бутильных ради-
генс угла наклона зависимости lgDTh-lg[L] равен
калов при атоме фосфора на фенильные приводит к
1.93 ± 0.08), а соединением III - в виде моно- и дис-
заметному повышению DTh для диоксида I: отноше-
ольватов (тангенс угла наклона зависимости lgDTh-
ние DTh(I)/DTh(II) = 31. Напротив, аналогичная за-
lg[L] равен 1.78 ± 0.08) (рис. S1). Такое различие
мена радикалов при атоме фосфора, соединенного
в стехиометрии может быть связано с тем, что ал-
с фениленовым фрагментом оксиметиленовым мо-
кильные заместители (соединение IV) создают
стиком, в молекуле диоксида IV приводит к неко-
большие пространственные препятствия вращению
торому снижению величины DTh для диоксида III:
фрагментов R2P(O) вокруг связи C-P по сравнению
DTh(III)/DTh(IV) = 0.37. Соответственно, бутилза-
с фенильными (соединение III) [24].
Таблица
2. Коэффициенты распределения U(VI) и
Для сравнения экстракционной способности
Th(IV) при их экстракции из раствора 3 моль/л HNO3
соединений I-IV по отношению к U(VI) и Th(IV),
растворами 0.002 моль/л экстрагентов в дихлорэтане
а также фактора разделения тория и урана (βTh/U =
DTh/DU) в табл. 2 представлены данные по экстрак-
Экстрагент
lgDTh
lgDU
βTh/U
ции U(VI) и Th(IV) из азотнокислых растворов в
I [23]
1.81
0.05
57.5
сопоставимых условиях. Введение этильного заме-
II [23]
0.32
-0.16
3.02
стителя в 4-е положение фениленового фрагмента
III
1.82
0.03
61.6
IV
2.25
0.42
67.6
диоксида III приводит к повышению растворимо-
РАДИОХИМИЯ том 64 № 1 2022
42
ТУРАНОВ и др.
1.5
2.0
1.0
1.5
Lu
Lu
0.5
1.0
Er
Ho
Tb
Tb
0.0
0.5
Eu
Eu
Nd
Sm
-0.5
0.0
La
Nd
La
-0.5
-1.0
-1.0
-1.5
–1.0
-0.5
0.0
0.5
1.0
-0.6
-0.2
0.2
0.6
1.0
lg[HNO3]
lg[HNO3]
Рис.
3. Зависимость коэффициентов распределения
Рис.
2. Зависимость коэффициентов распределения
РЗЭ(III) от концентрации HNO3 в равновесной водной
РЗЭ(III) от концентрации HNO3 в равновесной водной
фазе при экстракции растворами 0.1 моль/л соединения
фазе при экстракции растворами 0.01 моль/л соединения
IV в дихлорэтане.
III в дихлорэтане.
мещенный диоксид IV экстрагирует Th(IV) значи-
(см. Дополнительные материалы, рис. S2, S3) по-
тельно более эффективно, чем бутилзамещенный
казали, что РЗЭ(III) экстрагируются этими соеди-
диоксид II: DTh(IV)/DTh(II) = 85. Следовательно,
нениями в виде смеси моно- и дисольватов. В виде
положение бутильных радикалов при атоме фосфо-
комплексов такой же стехиометрии РЗЭ(III) экстра-
ра в молекуле диоксидов II и IV существенно вли-
гируются растворами соединений I и II в дихлорэ-
яет на эффективность экстракции и величину βTh/U
тане [15]. Исходя из полученных данных, процесс
(табл. 2).
экстракции ионов РЗЭ(III) из растворов HNO3
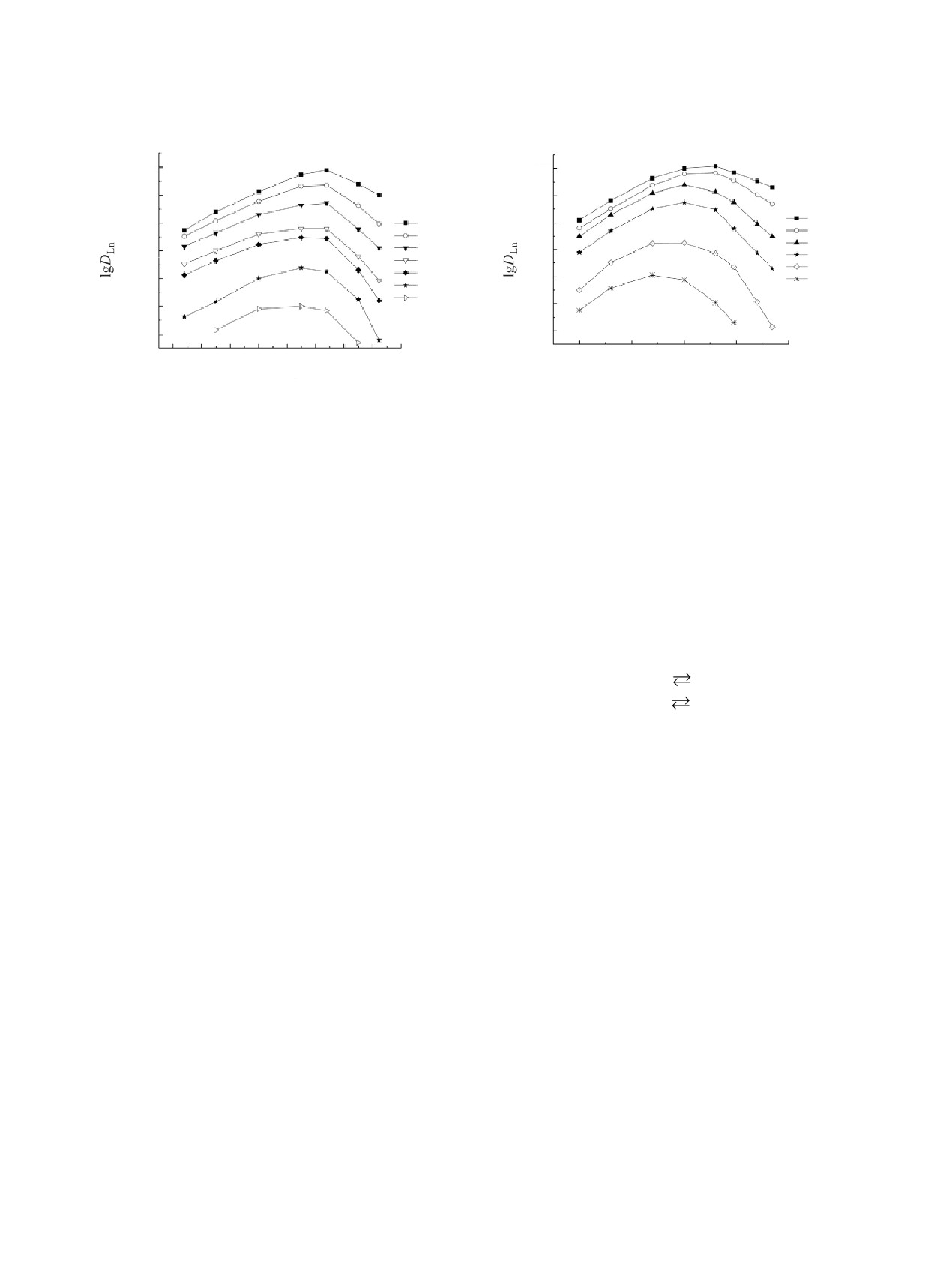
Рассмотрено влияние концентрации HNO3 в
умеренной концентрации соединениями III и IV в
равновесной водной фазе на изменение коэффи-
дихлорэтане может быть описан уравнениями:
циентов распределения РЗЭ(III) при экстракции
Ln3+ + 3NO– + L(о) LnL(NO3)3(о), KLn;
(4)
растворами соединений III и IV в дихлорэтане
Ln3+ + 3NO3- + 2L(о) LnL2(NO3)3(о), KLn.
(5)
(рис. 2, 3). Для этих двух реагентов получены за-
Эффективные константы экстракции РЗЭ(III)
висимости lgDLn-[HNO3] с максимумом, что связа-
но с высаливающим действием ионов NO3- и свя-
(KLn и KLn) рассчитаны нелинейным методом наи-
зыванием экстрагента азотной кислотой, а также
меньших квадратов с использованием уравнения
изменением коэффициентов активности нитратов
DLn = [NO–]3γ±4(K1Ln[L]o f -1 + KLn[L]o2 f -2),
(6)
РЗЭ(III) в зависимости от концентрации HNO3.
где γ± - коэффициент активности соответствующе-
Положение максимума смещается в область бо-
го нитрата РЗЭ(III) [26], f - поправка на связывание
лее высокой кислотности водной фазы по мере
экстрагента азотной кислотой (f = 1 + K1a + K2a2),
увеличения атомного номера (Z) РЗЭ, что связа-
приведены в табл. 3. Там же для сравнения приведе-
но с увеличением энергии гидратации ионов Ln3+
ны значения KLn для соединений I и II.
вследствие уменьшения их ионных радиусов с
возрастанием Z. Это приводит к увеличению коэф-
При экстракции РЗЭ(III) соединениями I-IV из
фициента разделения Lu/La, βLu/La = DLu/DLa, с ро-
растворов с умеренной концентрацией HNO3 на-
стом концентрации HNO3 (рис. 2, 3). Аналогичный
блюдается тенденция увеличения эффективности
характер зависимостей DLn-[HNO3] отмечался при
экстракции РЗЭ(III) с увеличением Z. Это связано
экстракции РЗЭ(III) растворами соединений I и II
с увеличением устойчивости комплексов РЗЭ(III)
в виде координационно-сольватированных нитра-
с жесткими (по Пирсону) лигандами по мере уве-
тов [15].
личения плотности заряда ионов Ln3+ вследствие
уменьшения их ионных радиусов c возрастанием Z.
Стехиометрическое соотношение металл : экс-
трагент в экстрагируемых комплексах определено
Экстракционная способность тетрафенилзаме-
методом сдвига равновесия. Полученные данные
щенных диоксидов I и III по отношению к РЗЭ(III)
РАДИОХИМИЯ том 64 № 1 2022
ВЛИЯНИЕ СТРОЕНИЯ ДИОКСИДОВ (О-ФЕНИЛЕНОКСИМЕТИЛЕН)ДИФОСФИНОВ
43
Таблица 3. Эффективные константы экстракции РЗЭ(III) из растворов HNO3 растворами соединений I-IV в
дихлорэтане
Ln(III)
lgKLn(III)
lgKLn(III)
lgKLn(IV)
lgKLn(IV)
lgKLn(I) [15]
lgKLn(II) [15]
La(III)
2.52
6.67
2.48
6.11
6.96
5.01
Ce(III)
2.87
7.01
3.04
6.67
7.16
5.10
Pr(III)
3.06
7.22
3.27
6.91
7.40
5.25
Nd(III)
3.20
7.35
3.48
7.12
7.68
5.49
Sm(III)
3.75
7.95
4.03
7.67
7.86
5.66
Eu(III)
3.92
8.09
4.13
7.77
8.01
5.76
Gd(III)
3.93
8.08
3.99
7.63
4.94
5.56
Tb(III)
4.32
8.45
4.55
8.19
8.38
5.80
Dy(III)
4.39
8.54
4.64
8.28
8.49
5.84
Ho(III)
4.42
8.55
4.63
8.26
5.01
5.84
Er(III)
4.41
8.56
4.64
8.27
8.66
5.91
Tm(III)
4.45
8.60
4.68
8.32
8.64
5.86
Yb(III)
4.46
8.61
4.70
8.33
8.62
5.81
Lu(III)
4.47
8.62
4.68
8.31
8.62
5.68
выше, чем их дибутилзамещнных аналогов II и IV.
и IV проявляется в значительно меньшей степени,
При этом замена фенильных радикалов при атоме
чем в системе с диоксидами I и II, в которых замена
фосфора, непосредственно присоединенного к фе-
бутильных радикалов на фенильные происходит в
ниленовому кольцу, на бутильные радикалы приво-
фосфорильной группе, непосредственно соединен-
дит к значительно большему снижению значений
ной с фениленовым фрагментом.
KLn и KLn, чем при замене в молекуле диоксида III
фрагмента OCH2P(O)Ph2 на OCH2P(O)Bu2 (диок-
ФОНДОВАЯ ПОДДЕРЖКА
сид IV). Соответственно, величина ЭААУ, выража-
емая как отношение констант экстракции комплек-
сов металлов одинаковой стехиометрии, при экс-
Работа выполнена в рамках государствен-
тракции РЗЭ(III) из азотнокислых растворов диок-
ного задания Института физики твердого тела
сидами I и II (KEu(I)/KEu(II) = 178 [15]) значительно
им. Ю.А. Осипьяна РАН, Института проблем техно-
выше, чем в системе с диоксидами III и IV (KEu(III)/
логии микроэлектроники и особо чистых материалов
KEu(IV) = 2.09). По-видимому, фосфорильная груп-
РАН, Института физиологически активных веществ
па фрагмента OCH2P(O)R2 (R = фенил, бутил) мо-
РАН (тема № 0090-2019-0008) и Института физи-
лекул диоксидов III и IV менее чувствительна к из-
ческой химии и электрохимии им. А.Н. Фрумкина
менению характера заместителя при атоме фосфора,
РАН при частичной финансовой поддержке РФФИ
чем фосфорильная группа P(O)R2, непосредственно
(грант № 18-29-24069).
соединенная с фениленовым фрагментом в экстра-
гентах I и II.
КОНФЛИКТ ИНТЕРЕСОВ
Представленные данные показали, что фосфо-
рильные группы в молекуле диоксида (о-фениле-
Авторы заявляют об отсутствии конфликта ин-
ноксиметилен)дифосфина неэквивалентны. Замена
в молекуле диоксида III фрагмента OCH2P(O)Ph2
тересов.
на OCH2P(O)Bu2 приводит к увеличению эффек-
тивности экстракции U(VI) и Th(IV) диоксидом
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
IV из азотнокислых растворов и снижению коэф-
фициентов распределения РЗЭ(III) в таких средах.
Дополнительная материалы для этой статьи до-
Эффект аномального арильного упрочнения экстра-
ступны по doi 10.31857/S0033831122010026 для ав-
гируемых комплексов в системе с диоксидами III
торизированных пользователей.
РАДИОХИМИЯ том 64 № 1 2022
44
ТУРАНОВ и др.
СПИСОК ЛИТЕРАТУРЫ
14. Туранов А.Н., Карандашев В.К., Евсеева Н.К.,
Баулин В.Е., Ушакова А.П. // Радиохимия. 1999. Т. 41,
1.
Myasoedov B.F., Kalmykov S.N. // Mendeleev Commun.
№ 3. С. 219.
2015. Vol. 25, N 5. P. 319.
15. Turanov A.N., Karandashev V.K., Baulin V.E. // Solv.
2.
Аляпишев М.Ю., Бабаин В.А., Устынюк Ю.А. //
Extr. Ion Exch. 1999. Vol. 17. P. 1423.
Успехи химии.
2016. Т.
85,
№ 9. С.
943.
https://doi.org/10.1080/07366299908934656
[Alyapyshev M Yu., Babain V.A., Ustynyuk Yu.A. // Russ.
16. Turanov A.N., Karandashev V.K., Baulin V.E.,
Chem. Rev. 2016. Vol. 85. N 9. P. 943.
Yarkevich A.N., Safronova Z.V. // Solvent. Extr. Ion
Exch. 2009. Vol. 27. P. 551.
3.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
17. Розен А.М., Николотова З.И., Карташева Н.А.,
2017. Vol. 46. P. 7229.
Юдина К.С. // ДАН СССР. 1975. Т. 222, № 5. С. 1151.
4.
Розен А.М., Николотова З.И., Карташева Н.А. //
Радиохимия. 1986. Т. 28, № 3. С. 407.
18. Демин С.В., Нефедов С.Е. Баулин В.Е., Демина Л.И.,
5.
Чмутова М.К., Литвина М.Н., Прибылова Г.А.
Цивадзе А.Ю. // Координац. химия. 2013. Т. 39, № 4.
Иванова Л.А., Смирнов И.В., Шадрин А.Ю,
С. 223.
Мясоедов Б.Ф. // Радиохимия. 1999. Т. 41, № 4.
19. Демин С.В., Жилов В.И., Нефедов С.Е. Баулин В.Е.,
С. 331.
Цивадзе А.Ю. // ЖНХ. 2012. Т. 57, № 6. С. 970.
6.
Sartain H.T., McGraw S.N., Lawrence C.L. // Inorg.
[Demin S.V., Nefedov S.E., Zhilov V.I. Baulin V.E.,
Chim. Acta. 2015. Vol. 426. P. 126.
Tsivadze A.Y.
// Russ. J. Inorg. Chem. 2012. Vol. 57,
7.
Горюнов Е.И., Горюнова И.Б., Баулина Т.В.,
N 6. P. 897-902.
Петровский П.В., Матросов Е.И., Лысенко К.А.,
https://doi.org/10.1134/S0036023612060095]
Григорьев М.С., Сафиулина А.М., Моргалюк В.П.,
20. Shuvaev S., Kotova O., Utochnikova V., Vaschenko A.,
Летюшов А.А., Тананаев И.Г., Нифантьев Э.Е.,
Мясоедов Б.Ф. // Росс. хим. журн. 2010. Т. 54, № 3.
Puntus L., Baulin V, Kuzmina N., Tzivadze A. // Inorg.
С. 45.
Chem. Comm. 2012. Vol. 20. Р. 73-76.
8.
Смирнов И.В., Караван М.Д., Ефремова Т.И.,
https://doi.org/10.1016/j.inoche.2012.02.020
Бабаин В.А., Мирошниченко С.И., Черенок С.А.,
21. Евреинов В.И., Сафронова З.В., Яркевич А.Н.,
Кальченко В.И. // Радиохимия. 2007. Т. 49, № 5.
Харитонов А.В., Бондаренко Н.А., Цветков Е.Н. //
С. 423.
ЖОХ. 1999. Т.69, № 7. С. 1088-1092. [Evreinov V.I.,
9.
Kamenik J., Sebesta F., John J., Bohmer V., Rudzevich V.,
Safronova Z.V., Yarkevich A.N., Kharitonov A.V.,
Gruner B. // J. Radioanal. Nucl. Chem. 2015. Vol. 304.
Bondarenko N.A., Tsvetkov E.N. // Russ. J. Gen. Chem.
P. 313.
1999. Vol. 69, N 7. P. 1047].
https://doi.org/10.1007/s10967-014-3543-x
22. Розен А.М., Беркман З.А., Бертина Л.Э., Денисов Д.А.,
10. Ouizem S., Rosrio-Amorin D., Dickie D.A., Paine R.T.,
de Bettencourt-Dias A., Hay B.P., Podair J.,
Зарубин А.И., Коссых В.Г., Николотова З.И.,
Delmau L.H. // Dalton Trans. 2014. Vol. 43. P. 8368.
Писарева С.А., Юдина К.С. // Радиохимия. 1976.
https://doi.org/10.1039/C3DT53611D
Т. 18, № 4. С. 493.
11. Sasaki Y., Sugo Y., Morita K., Nash K.L. // Solvent Extr.
23. Туранов А.Н., Карандашев В.К., Федосеев А.М.,
Ion Exch. 2015. Vol. 33. P. 625.
Радыгина Н.И., Баулин В.Е. // Радиохимия. 2005.
https://doi.org/10.1080/07366299.2015.1087209
Т. 47. № 2. С. 158.
12. Campbell E., Holfeltz V.E., Hall G.B., Nash K.L.,
24. Цветков Е.Н., Евреинов В.И., Бондаренко Н.А.,
Lumetta G.J., Levitskaia T.G. // Solvent Extr. Ion Exch.
Сафронова З.В. // ЖОХ. 1996. Т. 66, № 7. С. 1081.
2018. Vol. 36. P. 331.
25. Розен А.М., Николотова З.И., Карташева Н.А. //
13. Ansari S.A., Mohapatra P.K., Leoncini A., Ali S. M.,
ЖНХ. 1979. Т. 24, № 6. С. 1642.
Singhadeb A., Huskens J., Verboom W. // Dalton Trans.
2017. Vol. 46. P. 11355.
26. Власов В.С., Розен А.М. // Радиохимия. 1988. Т. 30,
https://doi.org/10.1039/C7DT03831C
№ 1. С. 146.
РАДИОХИМИЯ том 64 № 1 2022