РАДИОХИМИЯ, 2022, том 64, № 2, с. 103-119
УДК 53.06+54.052+615.038
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ:
НАРАБОТКА, ВЫДЕЛЕНИЕ И ПРИМЕНЕНИЕ
© 2022 г. А. Г. Казаков
Институт геохимии и аналитической химии им. В.И. Вернадского РАН,
119991, Москва, ул. Косыгина, д. 19
e-mail: adeptak92@mail.ru
Поступила в редакцию 03.03.2021, после доработки 22.04.2021, принята к публикации 29.04.2021
Тербий имеет четыре короткоживущих радиоактивных изотопа с массовыми числами 149, 152, 155 и
161, являющихся перспективными для применения в различных областях ядерной медицины, однако
данная тема на сегодняшний день находится на этапе исследований. В настоящее время активно
изучаются условия наработки данных изотопов, выделения без носителя из облученных мишеней,
а также проводятся доклинические и клинические испытания радиофармпрепаратов на основе
данных нуклидов. Результаты соответствующих работ систематизированы в представленном обзоре,
что позволяет определить основные достижения и направления исследований изотопов тербия на
сегодняшний день.
Ключевые слова: изотопы тербия, ядерная медицина, наработка, разделение, радиофармпрепараты.
DOI: 10.31857/S0033831122020010, EDN: ECPEZM
ВВЕДЕНИЕ
70 мин, 152Tb распадается значительно медленнее,
что существенно облегчает его транспортировку
от места получения к клиникам
[3]. При этом
Активное развитие ядерной медицины создает
152Tb также может быть использован для оценки
предпосылки для поиска способов получения и
биораспределения как самих изотопов Tb, так
применения все новых радионуклидов. В настоящее
и изотопов других лантанидов. 155Tb испускает
время десятки изотопов являются перспективными
низкоэнергетические γ-кванты, что предполагает
для визуализации и/или терапии, однако для
его эффективное применение в однофотонной
большинства из них остается открытым вопрос
эмиссионной компьютерной томографии (ОФЭКТ)
оптимального получения и выделения [1]. Элемент
без создания значительных дозовых нагрузок для
Tb уникален тем, что имеет четыре короткоживущих
пациента
[4]. Наконец,
161Tb рассматривается
изотопа,
ядерно-физические
характеристики
как более эффективная альтернатива широко
которых позволяют применять их в различных
применяемому в бета-терапии
177Lu благодаря
областях терапии и диагностики (табл. 1).
дополнительному испусканию Оже-электронов и
Так,
149Tb
- единственный среди лантанидов
электронов конверсии [5].
радионуклид для альфа-терапии, уникальность
которого для ядерной медицины состоит в том,
Таким образом, изотопы Tb имеют большой
что данный изотоп также испускает позитроны, и
потенциал применения, однако одобренные для
распределение его соединений в организме может
применения в медицине радиофармпрепараты
быть визуализировано методом позитронно-
(РФП), содержащие данные изотопы, на
эмиссионной томографии (ПЭТ) [2]. 152Tb испускает
сегодняшний день отсутствуют и соответствующие
позитроны, что обеспечивает возможность его
разработки находятся в настоящее время на стадии
применения в ПЭТ. В отличие от используемых в
НИР. В настоящем обзоре рассмотрены результаты
настоящее время ПЭТ-радионуклидов с T1/2 не более
исследований по наработке перечисленных
103
104
КАЗАКОВ
Таблица 1. Ядерно-физические характеристики медицинских изотопов тербия и области их применения
Вид распада, выход
Наиболее интенсивные
Нуклид
T1/2
Eα, МэВ
Eβ(ср), МэВ
Применение
на распад, %
γ-линии, кэВ (p, %)
165 (26)
149Tb
α (17), β+ (7)
4.1 ч
3.97
0.73
α-Терапия, ПЭТ
352 (29)
152Tb
β+ (17)
17.5 ч
Нет
1.08
344 (65)
ПЭТ
87 (32)
155Tb
ЭЗ (100)
5.3 сут
Нет
Нет
ОФЭКТ
105 (25)
26 (23)
β-- или Оже-терапия,
161Tb
β- (100)
6.9 сут
Нет
0.15
49 (17)
ОФЭКТ
нуклидов, способам выделения их из облученных
ускорителях заряженных частиц, так и в реакторах
мишеней и созданию РФП на их основе.
(для 161Тb). Ниже систематизированы результаты
исследований по изучению сечений и выходов
ядерных реакций образования
149,152,155,161Tb,
НАРАБОТКА ИЗОТОПОВ ТЕРБИЯ НА
полученные при использовании мишеней
УСКОРИТЕЛЯХ ЗАРЯЖЕННЫХ ЧАСТИЦ И В
различного элементного состава.
РЕАКТОРАХ
149Tb. Ядро нейтронно-дефицитного
149Tb
Для изотопов тербия, исходя из их положения
находится далеко от линии стабильности, что
на нуклидной карте, возможна наработка как на является основной трудностью при его наработке.
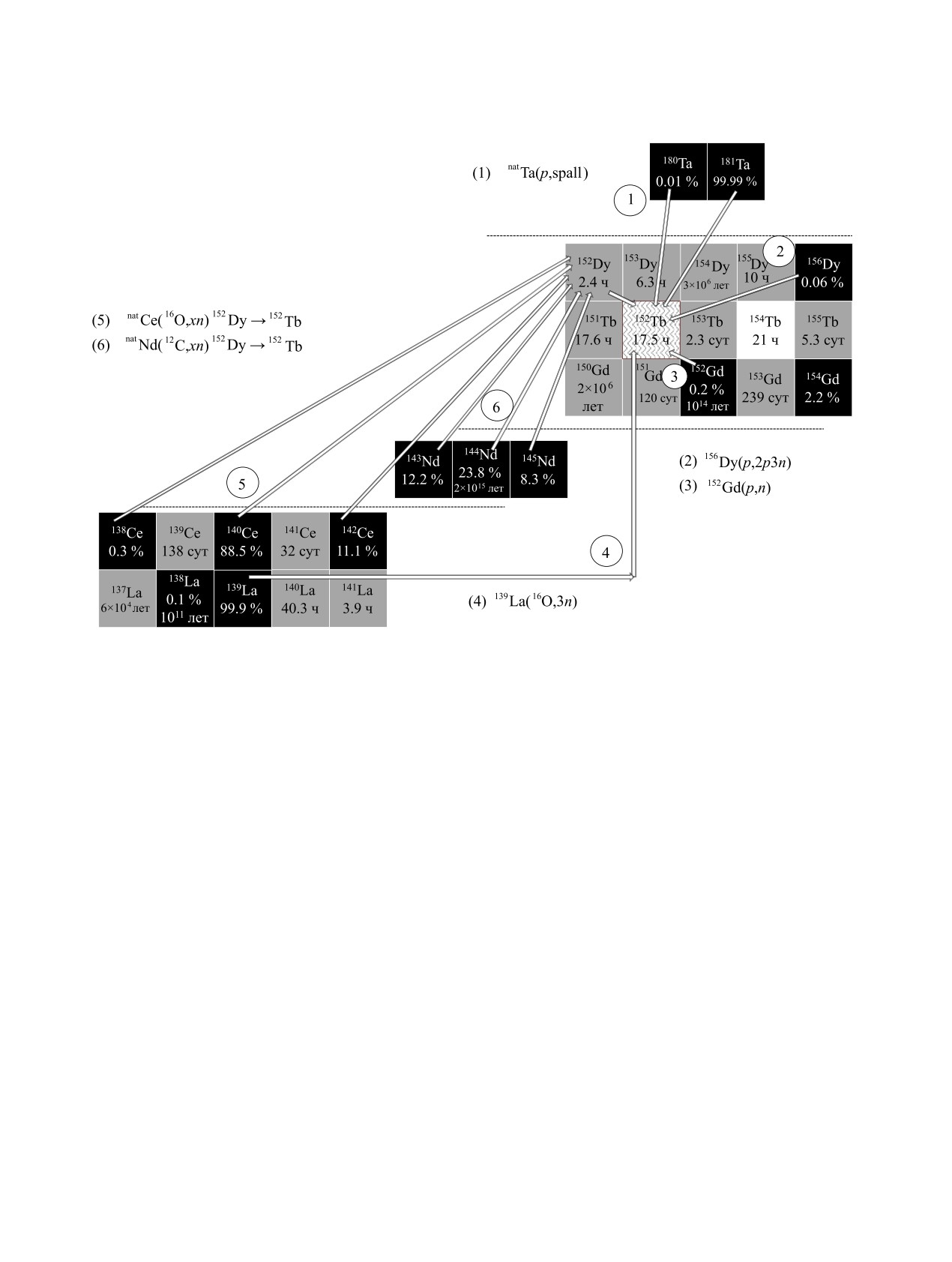
Рис. 1. Разработанные методы получения 149Tb для ядерной медицины. Черным цветом выделены клетки с
изотопами естественной смеси соответствующего элемента.
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
105
Таблица 2. Изученные экспериментально методы наработки 149Tb
Обогащение
Энергия частиц,
Образующиеся другие изотопы
Максимум сечения и/или
Реакция
Ссылки
мишени
МэВ
Tb
выход
197Au + p
Моноизотоп
600-3000
Присутствуют, количество не
1.8 мбарн при 1750 МэВ
[6]
обсуждается
200-450
0.8 мбарн при 434 МэВ
[8]
natTa + p
Нет
300-1700
Изобары, количество не
20 мбарн при 1100 МэВ
[12]
обсуждается
151Eu + 3He
97.5% 151Eu
70→40
АTb-151 = (6.5-12)АTb-149
150 МБк/мкА
[18]
АTb-150 = (2.6-5)АTb-149
70→12
150,151Tb
100 мбарн при 47 МэВ
[19]
(230 МБк/мкА)
152Gd + p
30.6% 152Gd
66→30
150-152Tb
250 мбарн при 45 МэВ;
[20]
2600 МБк/(мкА·ч) для
100%-ного 152Gd
Нет
68→58
150-153Tb
7 мбарн при 68 МэВ
[21]
142Nd + 12C
Нет
120
Не обсуждается
2.2 МБк/(мкА·ч)
[22]
Нет
100
152Tb
8.9 МБк/мкА
[23]
141Pr + 12C
Моноизотоп
66
Не обсуждается
2.7 МБк/мкА
71.5
АTb-151 = 0.08АTb-149
86 кБк/(мкА·ч)
[24]
АTb-150 = 0.43АTb-149
79→44
150,151Tb
27 мбарн при 62 МэВ
[25]
Изученные методы получения 149Tb без носителя
также образуются короткоживущие α-излучатели
систематизированы в табл. 2 и проиллюстрированы
150,151Dy с Т1/2
7 и
19 мин соответственно,
на рис. 1.
распадающиеся в 150,151Tb [7]. Позже были также
Впервые наработка 149Tb изучалась в 1960-х гг.,
исследованы функции возбуждения в области 0.2-
когда широко исследовались ядерные свойства
0.45 ГэВ, максимум сечения составил 0.84 мбарн
α-излучающих лантанидов, получение которых
при
434 МэВ
[8]. Несмотря на возможность
простыми способами затруднительно или
наработки необходимых количеств
149Tb таким
невозможно. Для этого использовали реакцию
методом, оставался открытым вопрос отделения
скалывания
- облучение мишеней протонами,
его от других образующихся изотопов Tb и ядер
ускоренными до единиц или десятков ГэВ, при
других элементов. Проблема была позже решена
котором происходит вылет из ядра мишени
путем масс-сепарации продуктов облучения после
множества нуклонов и образуется большое
наработки. Так, в 1967 г. в CERN (Швейцария)
количество изотопов с массовыми числами меньше,
запущена установка ISOLDE (Isotope Separator On
чем у материала мишени. Так, в ряде работ изучалось
Line DEvice), в конструкции которой реализована
образование 149Tb (или его материнского 149Dy с Т1/2
данная идея [11]. Пучок протонов энергии 1-1.4 ГэВ
около 4 мин) при облучении протонами фольг из
направлялся на мишень из Ta фольги, которую после
моноизотопного 197Au [6-10]. Экспериментальное
облучения нагревали и выдерживали при 2200°С,
определение функций возбуждения реакции
проводя ионизацию поверхности с помощью
197Au(p,spall) при энергиях протонов от 0.6 до 30 ГэВ
лазера. Изотопы в ионном состоянии разгонялись
показало, что максимум сечения находится в области
до 60 кэВ, разделялись с использованием масс-
энергии 1.7-1.8 ГэВ и составляет около 1.8 мбарн
сепарации, после чего целевой нуклид отделяли от
[6]. Было установлено, что в данных условиях
изобаров и дочерних продуктов радиохимическими
РАДИОХИМИЯ том 64 № 2 2022
106
КАЗАКОВ
методами. Облучение на ISOLDE может быть
Получение
149Tb по реакции
152Gd(p,4n)
использовано в том числе для получения
исследовано в работе
[20], в которой стопку
достаточных для проведения медицинских
гадолиниевых фольг, обогащенных по
152Gd
процедур количеств конкретного изотопа после его
(30.6%), облучали протонами энергии 66→30 МэВ.
отделения (соответствующим единицам ГБк). В
Определено, что максимум сечения достигается при
работе [11] выход 149Tb при облучении Ta-мишени
45 МэВ и составляет 250 мбарн, а максимальный
на ISOLDE составил 3.5 МБк/(мкА·ч), при этом
выход для обогащенной на 100% мишени, по
было показано, что большая часть 149Tb образуется
расчетам авторов, составил
2600 МБк/(мкА·ч).
при распаде 149Dy. Изучены кумулятивные сечения
Однако примерно при этой же энергии находится
и максимум сечения реакции
155Gd(p,4n)152Tb,
реакций образования
149Tb при облучении Ta
составляющего около 800 мбарн. Так как 155Gd
протонами энергии
0.3-1.7 ГэВ
[12], показана
неизбежно будет присутствовать в мишени в случае
сходимость данных с сечениями реакций при
ее обогащения менее чем на 100%, то 149Tb будет
облучении 197Au, проведенных в тех же условиях
иметь невысокую радионуклидную чистоту. В то
[6]. На сегодняшний день во всех опубликованных
же время даже в случае максимально обогащенной
доклинических и клинических исследованиях 149Tb
мишени при облучении образуются в заметных
был получен именно данным методом на ISOLDE
количествах ядра 150Tb и 151Tb c T1/2 = 3.7 и 17.6 ч
[13-17].
соответственно, а высокая стоимость обогащения
Еще одним методом наработки 149Tb является
Gd мишени негативно влияет на перспективность
облучение Eu-мишеней ядрами 3He [18, 19]. Так,
данного метода для практики. В недавней работе
в работе [18] облучали обогащенные на
97.5%
[21] путем облучения стопки natGd фольг (гадолиния
толстые мишени из 151Eu2O3 ядрами 3He с энергией
естественного изотопного состава) определены
от 40 до 70 МэВ при среднем токе 0.1-0.2 мкА,
сечения реакции 152Gd(p,4n)149Tb при энергиях до
определяя выходы изотопов Tb при насыщении.
70 МэВ, которые в диапазоне 60-70 МэВ составили
Для 149Tb такой выход составил от ~3 МБк/мкА
лишь от 1 до 8 мбарн. В результате получение 149Tb
при 40 МэВ до 100 МБк/мкА при 70 МэВ. Однако,
с высокой радионуклидной чистотой и достаточной
в каждом случае нарабатывались ядра 150-152Tb с
активностью таким методом затруднительно.
T1/2, равным или большим, чем у 149Tb, активность
На мощных ускорителях заряженных частиц
каждого из которых была от 0.8 до 12 раз больше,
возможна наработка 149Tb при облучении мишеней
чем у 149Tb. Таким образом, получение целевого
из Nd или Pr ядрами 12C. Так, в работе [22]
изотопа с высокой радионуклидной чистотой в
исследовали получение целевого нуклида, облучая
изученных условиях было невозможно, однако
тонкую мишень из natNd2O3 (12 мг/см2) при энергии
через 20 мин после облучения активность 149Tb
108 МэВ, наработанная активность 149Tb составила
составила несколько МБк, поэтому такой метод
чуть менее 3 МБк. В этом случае 149Tb образуется
получения может быть применен для обеспечения
по реакции 142Nd(12C,5n)149Dy→149Tb, при этом
доклинических исследований. Позже сечения
содержание 142Nd в природной смеси изотопов
реакций
151Eu(3He,xn)149-152Tb были определены
составляет 27.2%. В то же время в natNd также
экспериментально при облучении стопки фольг из
имеются шесть более тяжелых изотопов, из которых
97.5%-ного 151Eu при энергии 70→12 МэВ [19].
в условиях облучения образуются ядра 150Dy и
Максимум сечения реакции образования
149Tb
151Dy, быстро распадающиеся в 150Tb и 151Tb. В
находился при 47 МэВ и составил чуть менее
этой работе также дана оценка условий наработки
100 мбарн, что, по оценкам авторов, позволит
необходимых для медицины количеств, согласно
наработать до 230 МБк/мкА. Диапазон энергий
которой возможно получить 15-30 ГБк целевого
для получения 149Tb с минимальным содержанием
нуклида на углеродном пучке с энергией 120 МэВ
других ядер Tb составил от 40 до 70 МэВ, однако во
при токе 50-100 мкА за 10 ч, облучая толстую
всем диапазоне изученных энергий радионуклидная
минешь из обогащенного 142Nd (97%). Отношение
чистота была недостаточна для медицинского
активностей изотопов 150,151Tb к активности 149Tb в
применения.
работе не изучалось.
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
107
Одновременная наработка
149,152Tb
для
остается единственным методом получения 149Tb
дальнейшего мечения антител путем бомбардировки
с высокой радионуклидной чистотой, однако
ядрами 12С тонких мишеней из металлических Nd
единственная установка в мире, очевидно, не
и Pr исследована в работе [23]. В последнем случае
сможет удовлетворить мировой спрос на данный
на моноизотопном natPr нарабатывается 149Tb по
изотоп.
реакции 141Pr(12C,4n). Nd мишени были облучены
152Tb. Ядро 152Tb находится ближе к линии
при 100 МэВ, а Pr мишени - при 66 МэВ. При этом в
стабильности, чем
149Tb, но, как и в случае
первом случае выход 149Tb при насыщении составил
последнего, при наработке неизбежно возникает
8.9 МБк/мкА, во втором - 2.7 МБк/мкА, т.е., несмотря
проблема радионуклидной чистоты, так как
на моноизотопный материал мишени, выход
соседние ядра 151,153Tb обладают T1/2 17.6 ч и 2.3 сут
оказался в 3.5 раза меньше, чем в случае облучения
соответственно. Существование данных ядер делает
Nd. В каждом случае показана возможность
необходимым точный подбор энергии облучения.
одновременной наработки
152Tb вместе с 149Tb
На сегодняшний день изучено несколько способов
для применения в качестве тераностической пары,
наработки 152Tb (рис. 2, табл. 3).
однако активность образующихся 150,151Tb в работе
Получение изотопов при облучении Ta на ISOLDE
не определялась.
является одним из методов получения в том числе
Получение
149Tb
при облучении Pr
и 152Tb [26], и во всех представленных работах по
исследовалось также в работах [24, 25]. В первом
применению данного изотопа используется именно
случае [24] энергия ядер 12С составила 71.5 МэВ,
этот метод [16, 26-30].
и выход целевого изотопа при облучении тонкой
В работах [20, 31-33] изучена наработка 152Tb при
Pr фольги в течение 9.3 ч составил 86 кБк/(мкА·ч).
облучении протонами Gd мишеней (естественного
При этом суммарная активность примесей 150,151Tb
изотопного состава или обогащенных) по реакциям
была равна половине от наработанной активности
152Gd(p,n)152Tb и 155Gd(p,4n)152Tb. Первая реакция
149Tb. Согласно оценке авторов, для наработки
могла бы быть оптимальным способом получения
клинической дозы 149Tb необходимо облучать такую
152Tb, но недостатком ее использования является
же мишень в течение 1 ч при токе 1 мА. В работе
содержание 152Gd в природной смеси, составляющее
[25] экспериментально определяли сечения реакций
лишь 0.2%, в то время как содержание 155Gd - 14.8%.
образования 149-151Tb, облучая Pr6O11, запечатанный
Сечения реакций natGd с протонами в интервале
в конверт из алюминиевой фольги, пучками ядер
7-66 МэВ с шагом 1-2 МэВ исследовались в
12С при энергии 79→44 МэВ. Авторы указывают на
работе
[31]. На основе экспериментальных
однозначную непригодность изученного метода для
данных показано, что максимум кумулятивного
производства 149Tb для медицинского применения
сечения достигает
100 мбарн при
35 МэВ и
из-за наличия значительной активности 150,151Tb
сохраняется до 66 МэВ. Однако при дальнейшем
при энергиях до
70 МэВ. При дальнейшем
расчете сечений реакций образования продуктов
увеличении энергии ионов возможно получение
облучения в исследованном диапазоне энергий
целевого изотопа в отсутствие других нуклидов Tb,
установлено, что невозможно получить продукт
но в этом случае максимальное сечение реакции его
с необходимой радионуклидной чистотой даже
образования составляет лишь 12 мбарн.
для мишени из 100%-ного 155Gd. Таким образом,
На основании полученных результатов (табл. 2)
продемонстрирована невозможность использования
можно заключить, что, несмотря на существование
natGd-мишеней для наработки 152Tb для медицины.
различных путей получения 149Tb, для всех них
Дальнейшее экспериментальное исследование
требуются мощные ускорители, количество
функций возбуждения реакции 155Gd(p,4n)152Tb при
которых в мире мало. Основной проблемой
66→32 МэВ показало, что максимум ее сечения
изученных методов являются образование при
находится при 39 МэВ и составляет 900 мбарн [20],
облучении 150,151Tb с соизмеримыми или большими
в то же время образование нежелательных ядер
Т1/2 и в ряде случаев низкие сечения основной
Tb не изучалось. В работе [32] изучались сечения
ядерной реакции образования 149Tb. Таким образом,
реакции 152Gd(p,n)152Tb при малых энергиях (до
использование ISOLDE до настоящего времени
8 МэВ), при этом было установлено, что при 5 МэВ
РАДИОХИМИЯ том 64 № 2 2022
108
КАЗАКОВ
Рис. 2. Разработанные методы получения 152Tb для ядерной медицины. Черным цветом выделены клетки с изотопами
естественной смеси соответствующего элемента.
сечение не превышает 1 мбарн, а при дальнейшем
нарабатываются другие ядра Tb, и, таким образом,
увеличении энергии начинается образование 153Tb.
метод не представляет интереса для практики.
Кёстер c соавт. [33] изучали радионуклидный состав
Как и в случае 149Tb, 152Tb можно получать c
облученных при 8 и 12 МэВ мишеней из 99.9%-
использованием пучков тяжелых ионов (12С или
ного 152Gd, показав, что при 12 МэВ единственной
16O) [23, 35, 36]. Так, в работе [23] дана оценка
примесью является
153Tb, активность которого
отношения активности 152Tb к 149Tb при облучении
не превышает 1% от активности 152Tb. Согласно
natNd ядрами 12С. Основными реакциями являются
полученным ранее функциям возбуждения данной
143Nd(12C,5n),
144Nd(12C,4n) и
145Nd(12C,3n),
реакции, при 10 и 11 МэВ содержание 153Tb будет
ведущие к образованию 152Dy (T1/2 = 2,4 ч), который
еще меньше. Таким образом, метод является
распадается в целевой 152Tb. Кумулятивный выход
перспективным, однако в данном случае стоимость
152Dy составил 22 МБк/(мкА·ч). Найак с соавт.
обогащения мишени будет оказывать влияние на
получали 152Tb при облучении natLa2O3 (99.9% 139La)
стоимость полученного 152Tb.
ядрами кислорода энергии 85 МэВ [35]. Основная
Наработка 152Tb возможна также при облучении
реакция - 139La(16O,3n)152Tb, при этом установлено,
Dy мишеней по реакции 156Dy(p,2p3n)152Tb. В работе
что на момент конца облучения активность 152Tb
[34] изучены ее функции возбуждения при энергии
составила 15 кБк, а активность 151Tb в 2.5 раза
до 65 МэВ. Из-за очень низкого содержания 156Dy
больше. Наработка 152Tb при облучении natCeO2
в естественной смеси изотопов (0.06%) максимум
ядрами 16О энергии 80 МэВ изучена в работе
сечения составляет лишь 1 мбарн. В дополнение
[36]. Метод потенциально может быть применен
к этому, во всем изученном диапазоне энергии
для получения
152Tb, но требует подробного
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
109
Таблица 3. Экспериментально изученные методы наработки 152Tb
Обогащение
Энергия
Максимум сечения и/или
Реакция
Образующиеся другие изотопы Tb
Ссылки
мишени
частиц, МэВ
выход
natTa + p
Нет
1000-1400
Изобары, количество не обсуждается
Нет данных
[26]
152Gd + p
Нет
7-66
151,153-156,160Tb
100 мбарн при 35-66 МэВ
[31]
30.6% 152Gd
1-8
Отсутствуют до 5 МэВ
100 мбарн при 8 МэВ;
[32]
0.1 мбарн при 5.5 МэВ
99.9% 152Gd
8 и 12
АTb-153 = 0.01ATb-152 при 12 МэВ
Нет данных
[33]
155Gd + p
99.9% 155Gd
62→30
Нет данных
900 мбарн при 39 МэВ
[20]
natDy + p
Нет
7-65
ATb-153-156 ≥ 5АTb-152
1 мбарн при 65 МэВ
[34]
natNd + 12C
Нет
100
149Tb
22 МБк/(мкА·ч) для 152Dy
[23]
139La + 16O
Моноизотоп
85
АTb-151 = 2.5ATb-152
33 кБк/(мкА·ч)
[35]
natCe + 16O
Нет
80
151,153Dy, 151,153Tb
Нет данных
[36]
исследования функций возбуждения для получения
Изучена наработка 155Tb при облучении Gd
продукта с высокой радионуклидной чистотой.
мишеней α-частицами, протонами или дейтронами
по реакциям natGd(α,pxn), natGd(p,xn) и natGd(d,xn)
Описанные
выше методы наработки
[31, 38, 39]. При этом содержание каждого из
систематизированы в табл. 3, из данных которой
изотопов Gd с массовыми числами 155-158 и 160
видно, что оптимальными методами являются
в естественной смеси изотопов составляет от 15 до
использование ISOLDE и облучение обогащенных
25%. Очевидно, что в случае таких мишеней велико
на 100% мишеней из 152Gd протонами при энергии
количество образующихся примесей, особенно 156Tb.
чуть менее 12 МэВ. К их достоинствам можно
В работе [38] исследованы функции возбуждения
отнести возможность наработки достаточных
реакции natGd(α,pxn) при энергии 80→14 МэВ.
количеств 152Tb при облучении, но методы также
Установлено, что максимальное кумулятивное
имеют свои недостатки: как было описано выше,
сечение образования
155Tb наблюдается при
ISOLDE
- единственная в мире установка, а
энергиях больше 70 МэВ и составляет 300 мбарн.
обогащение Gd мишени существенно повышает
Во всем исследованном диапазоне энергий в
стоимость облучения. Методы облучения
продуктах облучения присутствуют также ядра
лантанидов тяжелыми ионами с целью получения
153,156,158-160Tb. Наработка
155Tb при облучении
152Tb требуют редких мощных ускорителей и
natGd протонами энергии 66→7 МэВ исследована
долгого облучения.
в работе [31]. Функция возбуждения имеет два
155Tb.
155Tb находится ближе к линии
пика при 21 и 37 МэВ (около 200 мбарн при
каждой энергии). Согласно выполненным на
стабильности на нуклидной карте, чем 149,152Tb,
основе экспериментов расчетам, при облучении
но его соседние ядра 154,156Tb (T1/2 21 ч и 5.4 сут
мишени из 100%-ного 155Gd при энергии 11 МэВ
соответственно) тоже являются радиоактивными и
выход 155Tb на толстой мишени будет составлять
создают проблемы при наработке. В случае 154Tb
5.6 МБк/(мкА·ч), при этом другие изотопы Tb
можно дождаться его полного распада для получения
будут отсутствовать. Однако такое обогащение
155Tb c высокой радионуклидной чистотой, но
мишени на практике трудно реализовать, и по этой
образования 156Tb необходимо избегать. Изученные
причине метод не нашел применения. В работе
методы наработки 155Tb представлены на рис. 3 и в
[39] исследованы сечения реакций образования
табл. 4.
изотопов Tb при облучении natGd дейтронами
Прежде всего стоит отметить, что, как и другие
энергии 21→4 МэВ. Максимум сечения составил
изотопы тербия, 155Tb может быть легко наработан
270 мбарн при 21 МэВ, однако, чтобы получить
с использованием протонов высокой энергии на
155Tb в отсутствие других изотопов Tb, в случае
ISOLDE [37].
облучения Gd дейтронами тоже необходима
РАДИОХИМИЯ том 64 № 2 2022
110
КАЗАКОВ
Таблица 4. Исследованные методы наработки 155Tb
Обогащение
Энергия
Максимум сечения и/или
Реакция
Образующиеся другие изотопы Tb
Ссылки
мишени
частиц, МэВ
выход
natTa + p
Нет
1400
Изобары, количество
Нет данных
[37]
не обсуждается
natGd + p
66→7
Изотопы Tb в большом количестве
200 мбарн при 21 и 37
[31]
МэВ
natGd + d
21→4
270 мбарн при 21 МэВ
[39]
natGd + α
80→14
300 мбарн при 70-80
[38]
МэВ
natDy + p
4-64
50 мбарн при 65 МэВ
[41] [34]
[43]
natDy + d
50→3
5 мбарн при 50 МэВ
[42]
natDy + α
87→7
Изотопы Tb, A каждого из них
34 мбарн при 87 МэВ
[40]
не более 0.01ATb-155
159Tb + p
Моноизотоп
66→8
157Tb, количество не обсуждается
520 мбарн при 48 МэВ
[20]
153Eu + α
Нет
27
153Gd, 153,154,154m2,156Tb,
3 кБк/(мкА·ч)
[44]
A = (0.02-1.3)ATb-155
148Nd + 16O
100% 148Nd
100→67
Не обсуждаются
1000 мбарн при 100 МэВ
[46]
мишень из 100%-ного 155Gd. В результате всех
всего с низким содержанием 156Dy в natDy. Позже
приведенных исследований становится очевидно,
теми же авторами были изучены сечения при
что без 100%-ного обогащения мишени получение
65→36 МэВ, при этом показано, что сечение
155Tb с использованием Gd мишеней является
достигает 50 мбарн при 65 МэВ [34]. Шахид с соавт.
непригодным для ядерной медицины.
получили близкие значения сечений, облучая natDy
Получение 155Tb при облучении Dy мишеней
протонами с энергией 45→4 МэВ [43]. Сечения
реакций natDy(d,x)155Tb изучены при энергии
α-частицами, протонами и дейтронами исследовано
50→3 МэВ, показано, что сечение образования
в работах [34, 40-43]. Так, Гейосо с соавт. [40]
155Tb составляет 5 мбарн при 50 МэВ [42]. В
изучали сечения реакций образования ядер Tb при
результате при облучении natDy α-частицами,
облучении natDy α-частицами энергии 87→7 МэВ.
протонами и дейтронами радионуклидная чистота
Максимум сечения составил 34 мбарн при 87 МэВ,
целевого изотопа и сечения реакций являются
при этом сечение образования других изотопов
было на два порядка ниже. Выход 155Tb в данных
слишком низкими для дальнейшего применения
155Tb в медицине.
условиях составил 50 МБк/(мкА·ч), что является
перспективным результатом, но исследованный
Изучены функции возбуждения реакции
метод требует мощных ускорителей. В работе [41]
159Tb(p,5n)155Dy при 66→8 МэВ, после прохождения
представлены экспериментально определенные
которой 155Dy распадается в 155Tb [20]. Максимум
сечения реакция взаимодействия natDy с протонами
сечения составляет 520 мбарн при 48 МэВ. Метод
энергии 36→4 МэВ. Основным каналом наработки
получения 155Tb при облучении 159Tb перспективен,
155Tb в этом случае являетсяреакция 156Dy(p,2n)155Ho,
так как при отделении наработанного 155Dy от
после которой 155Ho последовательно распадается в
макроколичеств облученного Tb и его полном
155Dy и 155Tb с T1/2 48 мин и 10 ч. Заметно меньший
распаде возможно получение 155Tb без носителя.
вклад в получение целевого ядра вносит канал
Необходимо учитывать, что при оптимальной
natDy(p,pxn)155Dy→155Tb. Кумулятивное сечение
энергии облучения единственным радиоактивным
образования 155Tb имеет максимум в 1 мбарн при
изотопом Tb, образующимся после распада
36 МэВ, и такое низкое значение связано прежде
изотопов Dy вместе с 155Tb, является 157Tb c T1/2
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
111
Таблица 5. Исследованные методы наработки 161Tb
Обогащение
Поток или
Выход или удельная
Реакция
Образующиеся другие изотопы Tb
Ссылки
мишени
энергия частиц
активность
160Gd + n
98.2% 160Gd
1014 n/(см2·с)
ATb-160 = 3 × 10-5ATb-161
4.03 ТБк/мг
[49]
1015 n/(см2·с)
4.2 ТБк/мг
natGd + d
Нет
60→7 МэВ
ATb-160 = (0.7-2)ATb-161
3.5 МБк/(мкА·ч)
[51]
natDy + p
65→7 МэВ
151-156Tb в больших количествах
3 МБк/(мкА·ч)
[34]
natDy + α
87→7 МэВ
155,156,160Tb в больших количествах
0.1 МБк/(мкА·ч)
[40]
99 лет. Присутствие долгоживущего изотопа крайне
подобрать более подходящую энергию пучка, при
нежелательно, однако сечение реакции образования
которой наработанная активность соседних ядер
157Dy в четыре раза ниже, и, как следствие,
154,156Tb будет пренебрежимо мала.
активность 157Tb может оказаться незначительной и
Исследовано
получение
155Tb
при
приемлемой для применения 155Tb в медицине.
взаимодействии 148Nd с ядрами
16O при энергии
Показано, что
155Tb образуется также при
100→67 МэВ [45, 46]. Установлено, что максимум
облучении natEu2O3 α-частицами энергии 27 МэВ
сечения реакции образования
155Tb составил
по реакции
153Eu(α,2n)
[44], при этом выход
155Tb составляет 3 кБк/(мкА·ч). Вероятно, при
1000 мбарн при 100 МэВ, но наработка других ядер
исследовании функций возбуждения возможно
Tb в работе не обсуждается.
Рис. 3. Разработанные методы получения 155Tb для ядерной медицины. Черным цветом выделены клетки с изотопами
естественной смеси соответствующего элемента.
РАДИОХИМИЯ том 64 № 2 2022
112
КАЗАКОВ
изотопов Gd. В результате облучения потоком
нейтронов 1014 см-2·с-1 в течение 2 недель, а затем -
8 × 1014 см-2·с-1 в течение 1 недели активность
161Tb на момент конца облучения составила 15 ГБк.
Также экспериментально показана возможность
наработки
161Tb с использованием в качестве
источника нейтронов реакции 9Be + p при 18 МэВ,
проведенной на циклотроне [50].
Альтернативой
получению
161Tb
с
использованием нейтронов может выступать
применение
циклотрона,
на
котором
возможно получение
161Tb по двум реакциям:
160Gd(d,p)161Gd→161Tb и
160Gd(d,n)161Tb. В этом
Рис.
4. Разработанные методы получения 161Tb для
случае также необходимо высокое обогащение
ядерной медицины. Черным цветом выделены клетки
мишени по 160Gd. В работе [51] исследовались
с изотопами естественной смеси соответствующего
элемента
кумулятивные сечения образования
161Tb по
указанным реакциям при энергии дейтронов
При рассмотрении изученных данных (табл. 4)
50→5 МэВ. Установлено, что максимум сечения
видно, что основная проблема получения 155Tb -
составляет
300 мбарн при энергии дейтронов
большое количество изотопов в природных смесях
10 МэВ, но в изученных условиях облучений всегда
материала мишеней. Перспективным методом
дополнительно образуется 160Tb с T1/2 72 сут по
является использование ISOLDE (таким методом
реакции 160Gd(d,2n)160Tb. При этом сечение реакции
155Tb был получен во всех опубликованных
образования 160Tb во всем изученном диапазоне
in vivo экспериментах с ним [16, 47, 48]), а также
составляет от 70 до 200% от кумулятивного сечения
облучение моноизотопного 159Tb и обогащенных
образования 161Tb. Таким образом, авторами сделан
мишеней из
155Gd. Таким образом, отсутствие
вывод о непригодности такого метода наработки
простых методов получения и необходимость
161Tb для ядерной медицины.
использования ускорителей с высокой энергией или
В работах [34, 40] изучена наработка медицинских
дорогих мишеней сдерживает производство 155Tb
изотопов Tb (в том числе 161Tb) при облучении natDy
для ядерной медицины.
протонами и α-частицами. Как и в случае 152,155Tb,
161Tb. 161Tb находится на нуклидной карте близко
такой метод неприемлем для ядерной медицины по
к линии стабильности, что позволяет получать его
причине большого количества ядер Tb в продуктах
с помощью легко реализуемых реакций (рис. 4).
облучения и низких сечений.
Изученные методы наработки 161Tb приведены в
Таким образом, из рассмотренных данных
табл. 5.
(табл. 5) видно, что единственный адекватный
Основным способом наработки 161Tb является
метод получения 161Tb для ядерной медицины -
облучение 160Gd нейтронами, при этом образуется
использование реактора или других источников
161Gd с T1/2 = 3.7 мин, распадающийся в 161Tb.
нейтронов. Другие изученные методы имеют
Cечение захвата тепловых нейтронов для 160Gd
недостатки, делающие применение данных методов
составляет около 1500 мбарн. Содержание 160Gd в
невозможным.
natGd около 22%, поэтому во избежание образования
других ядер Gd при облучении (прежде всего
В целом из рассмотренных в данном разделе
159Gd, который будет распадаться в стабильный
методов наработки изотопов Tb для ядерной
159Tb и снижать удельную активность) необходимо
медицины можно сделать следующие заключения.
использовать обогащенные мишени по
160Gd.
Наработка 149Tb с высокой радионуклидной чистотой
Так, в работе
[49] получали 161Tb облучением
возможна в настоящее время только на ISOLDE.
обогащенной мишени из
98.2%-ного
160Gd,
Реакция скалывания также является оптимальным
содержащей не более 0.4% каждого из других
способом получения
152,155Tb, при этом для
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
113
обоих данных изотопов возможна наработка из
элюируется Tb(III) раствором 0.25 М α-HIBA, затем
обогащенных на 100% Gd мишеней на компактных
последовательно другие лантаниды раствором
циклотронах. 155Tb с высокой чистотой также может
0.5 М α-HIBA. Очистка 152Tb от изобаров возможна
быть получен по реакции 159Tb(p,5n)159Dy→155Tb,
таким же методом. В недавней работе [37] 155Tb
которая требует более мощных циклотронов, но
был выделен из продуктов облучения Ta-мишени
не требует обогащения мишеней. Единственным
на ISOLDE, при этом в случае масс-сепарации
оптимальным способом получения 161Tb является
вместе с
155Tb выделяется 139CeO+. На первой
облучение Gd мишеней в реакторе. Таким образом,
стадии разделения в этой работе использовали
среди четырех изотопов Tb на сегодняшний день
анионообменную смолу AG1 для удаления
получение 149,152,155Tb существенно сдерживается
фрагментов Au и Zn
- материалов подложки.
трудностями их наработки, и лишь для 161Tb такие
На второй стадии применяли экстракционно-
проблемы отсутствуют.
хроматографические сорбенты TEVA или UTEVA
(основа
- четвертичные аммониевые соли и
дипентилпентилфосфонат
соответственно),
МЕТОДЫ ВЫДЕЛЕНИЯ ИЗОТОПОВ
позволившие выделить 155Tb в среде 8 М HNO3.
ТЕРБИЯ БЕЗ НОСИТЕЛЯ ИЗ РАЗЛИЧНЫХ
Выход целевого изотопа за всю процедуру очистки
ОБЛУЧЕННЫХ МИШЕНЕЙ
составил 95%, радионуклидная чистота - более
99.9%.
Необходимые для ядерной медицины
Получение 161Tb предполагает его выделение
изотопы без носителя должны быть выделены
из облученного Gd2O3; методы такого разделения
из облученных мишеней с максимальными
представлены в работых [49, 52-54]. Одним из
выходами и высокой степенью очистки. При
методов разделения является катионообменная
этом особенностью выделения является то, что
хроматография на сорбенте Aminex A6
[49].
целевой изотоп в ультрамалых количествах
Облученную мишень, содержащую 161Tb и следовые
должен быть отделен от макроколичеств мишени.
количества наработанного Dy, растворяли в HNO3,
При этом существующие методы разделения,
упаривали раствор досуха, растворяли в растворе
макроколичеств, например, Gd и Tb не могут быть
NH4Cl с рН 3, после чего Gd, Dy и 161Tb сорбировали
применены в медицине для выделения Tb без
на колонке. Затем раздельно элюировали Dy(III) и
дополнительного изучения возможности разделить
Tb(III) 0.13 M раствором α-HIBA с рН 4.5 и Gd(III) -
с помощью таких методов макроколичества
0.5 М раствором α-HIBA. Дальше проводили очистку
Gd (материала мишени) и микроколичества Tb
фракций, содержащих Tb, на катионообменной
(медицинского изотопа). В связи с этим в данном
смоле AG 50W-X8, после которой получали Tb(III) в
обзоре рассмотрены работы, в которых проводили
солянокислом растворе. В работе [52] исследовалось
разделение макроколичеств материала мишени
отделение 161Tb от макроколичеств Gd методом
и микроколичеств наработанного Tb, а также, в
экстракционной хроматографии на сорбенте
случае их присутствия, микроколичеств изотопов
LN resin (основа - ди-(2-этилгексил)фосфорная
других элементов. В литературе описано отделение
кислота, Д2ЭГФК). При изучении коэффициентов
Tb от изобаров, образующихся при получении на
распределения Gd(III) и Tb(III) на данном сорбенте
ISOLDE, соседних лантанидов (Eu, Gd) а также Nd,
было установлено, что максимальное различие
Pr, La и Ce при получении целевых изотопов Tb на
в коэффициентах наблюдается в растворах 0.7-
ускорителях с высокой энергией.
0.8 М HNO3
[52]. Авторы продемонстрировали
В случаях наработки 149Tb на ISOLDE требуется
возможность
количественного
разделения
дальнейшая очистка от дочерних 149Gd и 145Eu и
путем последовательного элюирования Gd(III) в
от 133Ce и 133La, образовавшихся из изобаров -
0.8 М HNO3 и Tb(III) в 3 М HNO3. Позже тем же
ионов 133CeO+ и 133LaO+ массой 149 а.е.м. [13-17].
коллективом авторов [53] показано, что в случае
Разделение проводят обычно на катионообменной
облученной мишени массой 100 мг наблюдалось
смоле Aminex A5, в качестве элюента выступает
заметное снижение выхода Tb(III) по сравнению
α-гидроксиизобутановая кислота (α-HIBA). Сначала
с тестовыми экспериментами. Таким образом,
РАДИОХИМИЯ том 64 № 2 2022
114
КАЗАКОВ
в оптимальных условиях разделения возможен
151-153Dy [36]. Tb выделяли методом многократной
выход 161Tb не более 61%. В работе [54] показана
экстракции-реэкстракции раствором Д2ЭГФК, его
возможность получения 161Tb, выделенного из 5 мг
выход при этом составил 60%.
Gd2O3 описанным выше методом, c радионуклидной
Изученные методы разделения систематизиро-
и радиохимической чистотой >99%.
ваны в табл. 6. Из данных таблицы видно, что для
Как указано выше,
149,152,155Tb могут быть
всех методов наработки изотопов Tb, несмотря на
получены облучением мишеней из Eu α-частицами
сложность задачи выделения изотопов Tb, включа-
или ядрами 3He, при этом образуются следовые
ющей их отделение от большой массы лантанидов
количества изотопов Gd. Для выделения изотопов
(материала мишеней) и изотопов других образую-
Tb предложен двухстадийный метод разделения,
щихся при наработке лантанидов, разработаны ме-
включающий отделение основной массы Eu путем
тоды, обеспечивающие количественное выделение
его восстановления в растворе до Eu(II) и осаждения
изотопов Tb и высокую степень очистки. Чаще все-
в форме нерастворимого EuSO4 [44]. Дальнейшее
го при этом используются ионообменная хромато-
разделение оставшегося Eu и микроколичеств
графия с раствором α-HIBA в качестве элюента или
наработанных Gd и Tb проведено методом
экстракционная хроматография с сорбентом на ос-
экстракционной хроматографии с использованием
нове Д2ЭГФК. Стоит отметить, что единственным
LN resin. Выход Tb за две стадии разделения без
исключением является выделение 161Tb из облучен-
учета распада составил 90%, время разделения не
ного Gd, где при увеличении массы мишени наблю-
превышало 2 ч, коэффициент разделения Eu/Tb -
дается снижение выхода.
5 × 105.
Выделение Tb из облученных Pr мишеней с
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ
выходом 99% описано в работе [15]. Для отделения
ИЗОТОПОВ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
Tb от материала мишени и следовых количеств
Gd использовали несколько актов экстракции и
На сегодняшний день исследования по приме-
реэкстракции раствором Д2ЭГФК в циклогексане.
нению изотопов Tb в ядерной медицине включа-
Метод выделения изотопов Tb из облученной
ют в себя описание in vitro и in vivo экспериментов,
Nd мишени предложен в работе [22]. Мишень
контроль качества и клинические исследования, и
растворяли в 2 M HCl, переносили раствор на колонку
полученные данные систематизированы в работах
с катионообменной смолой Dowex 50, элюировали
[2-5, 55, 56], основанных на использовании отдель-
Tb(III) раствором 0.35 M α-HIBA, при этом выход
ных изотопов Tb. В настоящем же обзоре рассмо-
составил не менее
90%. В другой работе Nd
трены основные достижения проведенных экспе-
мишень растворяли в 6 М HNO3, упаривали раствор
риментов по наработке, выделению и применению
досуха, растворяли в 0.16 М α-HIBA, элюировали
всех изотопов Tb, что дает возможность провести
через катионообменную смолу Aminex A5 [23]. В
сравнение достигнутых на сегодняшний день успе-
процессе разделения с колонки последовательно
хов в наработке и выделении изотопов Tb с успе-
элюировались Nd(III), Dy(III), Tb(III), Gd(III). Затем
хами в их применении. Кроме того, перечислены
Tb фракции упаривали, прокаливали осадок при
использованные в работах хелаторы и условия свя-
температуре 450°С для разложения α-HIBA, выход
зывания изотопов Tb с ними.
за все стадии разделения составил 96%.
149Tb
показал
эффективность
против
Для разделения макроколичеств La и
лейкемических клеток in vitro при мечении данным
микроколичеств Tb был успешно применен
изотопом моноклонального антитела WM-53 [13]. В
метод экстракции [35]. С помощью многократной
работе [14] проводили сравнение цитотоксичности
экстракции Tb раствором Д2ЭГФК из
0.1 М
меченного 149Tb и 213Bi моноклонального антитела
HCl и реэкстракции в 1 М HCl было достигнуто
d9, при этом было установлено, что эффект от
количественное выделение Tb.
α-излучения 149Tb ниже при той же активности
При получении изотопов Tb путем облучения Ce-
213Bi, но больший T1/2 позволяет проводить
мишеней тяжелыми ионами нарабатывались также
более точный контроль качества РФП на основе
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
115
Таблица 6. Методы выделения изотопов тербия без носителя из различных облученных мишеней
Материал
Другие элементы
Изотопы Tb, которые
Метод разделения
Выход, %
Ссылки
мишени
без носителя
можно выделить
Ta
Gd, Eu, Ce, La
149Tb
Масс-сепарация, затем
~50
[15]
ионообменная хроматография
Ce
152,155Tb
95
[37]
Gd
Dy
161Tb
Ионообменная хроматография
90
[49]
–
Экстракционная хроматография
100 (5 мг)
[52, 54]
61 (100 мг)
[53]
Eu
Gd
149,152,155Tb
Осаждение, затем экстракционная
90
[44]
хроматография
Pr
Gd
149Tb
Экстракция
99
[15]
Nd
-
149,152,155Tb
Ионообменная хроматография
90
[22]
Dy, Gd
96
[23]
La
-
152Tb
Экстракция
100
[35]
Ce
Dy
60
[36]
149Tb. Продемонстрирована in vivo возможность
Продемонстрирована возможность визуализации
уничтожения конъюгатом 149Tb с моноклональным
биораспределения комплекса
152Tb методом
антителом Rituximab одиночных лейкемических
ПЭТ, результаты которой сходятся с данными
клеток [15]. Изучено in vivo биораспределение и
ex vivo, что позволит вычислять дозовую нагрузку,
терапевтический эффект противолейкемического
создаваемую данным изотопом для каждого органа
конъюгата cm09, меченного каждым из четырех
[29]. В работе [30] проведены доклинические и
изотопов тербия, показавших и положительный
клинические исследования, в ходе которых была
терапевтический эффект (в случае 149Tb и 161Tb),
успешно визуализирована аденокарциома простаты
и возможность визуализации опухолей методами
с использованием конъюгата 152Tb-PSMA-617.
ПЭТ (152Tb) и ОФЭКТ (155,161Tb) [16]. Умбрихт с
В работе
[47]
продемонстрирована
соавт. [17], используя мышиную модель, показали
возможность визуализации опухолей мышей с
возможность применения конъюгата
149Tb-
использованием
155Tb, связанного с четырьмя
PSMA-617 как для терапии нейроэндокринных
различными биоконъюгатами.
Джейкобссон
опухолей, так и для их визуализации методом ПЭТ.
с соавт. изучили биораспределение пористых
В недавних исследованиях были проведены
кремниевых наночастиц, связанных с
155Tb и
доклинические испытания меченного комплексом
покрытых мембранами эритроцитов, в организме
152Tb-DOTANOC (структурные формулы описанных
мышей и показали, что такие конъюгаты могут
в данном разделе хелаторов представлены на рис. 5)
быть в дальнейшем использованы в медицине с
соматостатинового рецептора [28]. В результате
применением всех четырех изотопов Tb [48].
эксперимента было показано, что качество ПЭТ-
В исследовании [49] продемонстрирована in vivo
визуализации с использованием 152Tb не уступает
возможность получения ОФЭКТ-изображений
ОФЭКТ-визуализации с использованием того же
с использованием
161Tb-DOTATATE, более
соединения, меченного 177Lu, и, следовательно,
качественных в сравнении с
177Lu-DOTATATE.
комплекс 152Tb может быть применен для оценки
Грюнберг с соавт. в in vitro и in vivo исследованиях
распределения терапевтического изотопа
177Lu.
установили
[57], что некоторые конъюгаты на
Недавно впервые были проведены клинические
основе 161Tb могут эффективнее, чем конъюгаты
исследования
комплекса
152Tb-DOTATOC,
на основе 177Lu, уничтожать и визуализировать
показавшие
возможность
визуализации
новообразования, содержащие характерный для
нейроэндокринных
новообразований,
в
многих опухолей белок L1CAM. Показано in vitro
том числе метастазов малого размера
[27].
и in vivo, что
161Tb в составе конъюгата cm09
РАДИОХИМИЯ том 64 № 2 2022
116
КАЗАКОВ
также эффективнее уничтожает раковые клетки
соединениями данного типа является медленная
двух выбранных линий [58]. В результате in vivo
кинетика комплексообразования, которая в случае
экспериментов установлено [59], что применение
использования быстро распадающихся изотопов
161Tb-cm09 не создает дополнительной дозовой
является серьезным недостатком. Как правило,
для быстрого и количественного связывания
нагрузки для почек в сравнении с 177Lu-cm09,
лантанидов с DOTA используют растворы с рН
несмотря на испускание электронов конверсии и
4-6, которые нагревают почти до температуры их
Оже-электронов. Применение 161Tb-PSMA-617 in
кипения [5]. В работе [2] 149Tb связывали с DOTA
vitro и in vivo против опухолей простаты показало
в растворе L-лактата с рН 4.7 при 95°С, при этом
преимущества перед 177Lu-PSMA-617 [60]. В работе
количественное связывание достигалось за 10 мин.
[61] предложены новые комплексы, меченные
В другой методике количественное мечение было
161Tb, для потенциального применения в ядерной
проведено в тех же условиях за 15 мин из раствора
медицине. Marin с соавт. установили клинические
α-HIBA, в котором выделяли 149Tb [16]. В случае
протоколы для оптимальной визуализации
связывания 161Tb, который распадается значительно
поведения 161Tb методом ОФЭКТ [62].
медленнее, мечение проводили в течение 1 ч при
В перечисленных выше работах для
слабом нагревании (при 37°С) из ацетатного буфера
хелатирования изотопов Tb использовали широко
[57]. В работе [13] 149Tb связывали с циклическим
применяемые в РФП на основе лантанидов хелаторы
ангидридом DTPA в растворе ацетатного буфера с рН
DOTA, DTPA и производные DOTA (рис. 5).
7 за 30 мин. Связывание изотопов Tb с DOTANOC,
Известной проблемой связывания лантанидов с
DOTATOC и DOTATATE проводили при 95°С из
HO
OH
HOOC
COOH
N N
O
O
N N
H
H
HOOC
N
NH
O
N
N
O
N N
N
H
H
O
S
O
O O
S
NH
H
H
N
N
HO
N
NH2
H
O
N
N
O
O
O
HO
HO
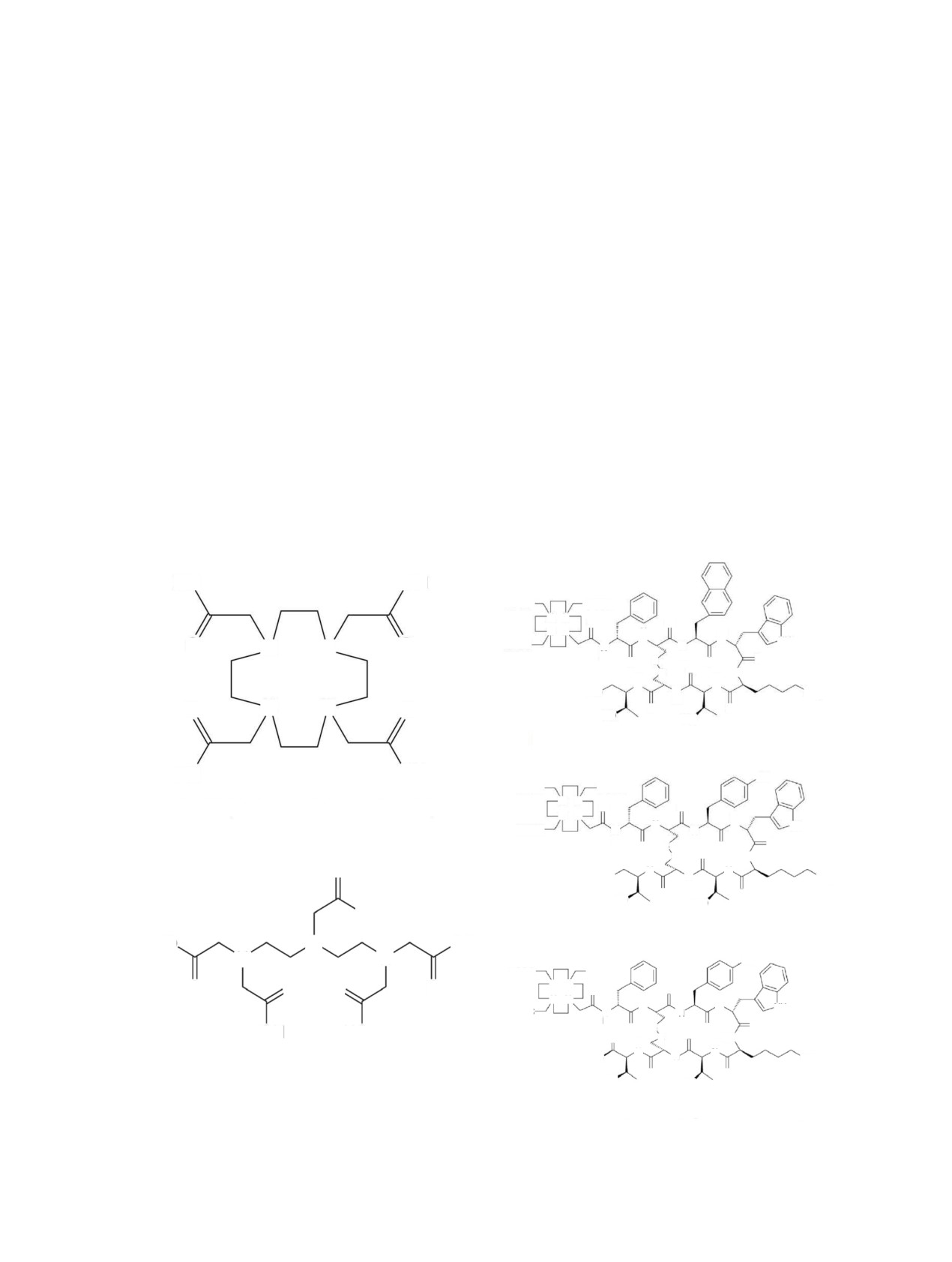
DOTANOC (DOTA-1-Nal3-octreotide)
HO
OH
OH
HOOC
COOH
N
N
DOTA (1,4,7,10-tetraazacyclododecanetetraacetic acid)
O
O
N
N
H
H
N
N
NH
HOOC
N
N
H
H
O
S
O
O
S
O
NH
H
H
O
N
HO
N N
NH2
H
O
O
HO
HO
OH
DOTATOC (DOTA-Tyr3-octreotide)
HO
N
OH
N
N
OH
HOOC
COOH
O
O O
O
N N
O
O
N
N
H
H
N
NH
HOOC
N
N N
H
H
O
O
S
OH
OH
O O
S
NH
O H
H
HO
N N N
NH2
H
O
O
DTPA (diethylenetriaminepentaacetic acid)
HO
HO
DOTATATE (DOTA-(Tyr3)-octreotate)
Рис. 5. Использованные в работах хелаторы для связывания изотопов Tb.
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
117
Таблица 7. Современное состояние исследований, связанных с изотопами 149,152,155,161Tb
Выделение из облученной
Стадия исследований по
Изотоп
Оптимальные методы наработки из изученных
мишени
применению
149Tb
Ta(p,spall)
Изучено
Доклинические
152Tb
Ta(p,spall), 152Gd(p,n)
Изучено
Клинические
155Tb
Ta(p,spall), 155Gd(p,n), 159Tb(p,5n)159Dy→155Tb
Изучено
Доклинические
161Tb
160Gd(n,γ)161Gd→161Tb
Изучено
Доклинические
растворов α-HIBA или ацетатного буфера в течение
образуют с ними устойчивые комплексы, но
15-40 мин [27, 28, 49]. С одной стороны, схожесть
комплексообразование характеризуется медленной
химических свойств лантанидов позволяет
кинетикой. Предположительно, одним из новых
хелатировать Tb уже известными соединениями, но
направлений исследований с изотопами Tb станет
с другой - необходимость нагревания при синтезе
поиск хелатора, лишенного таких недостатков.
комплексов создает предпосылки для исследований,
В заключение можно отметить, что, хотя
направленных на поиск новых хелаторов, лишенных
коммерческое производство изотопов тербия к
такого недостатка, что особенно актуально в случае
настоящему времени не налажено и только одна
149Tb с его Т1/2 = 4 ч.
установка в мире может производить 149,152,155Tb, все
изученные изотопы обладают большим потенциалом
ЗАКЛЮЧЕНИЕ
применения в медицине, и, несомненно, будут
появляться все новые исследования, нацеленные на
В настоящем обзоре представлены результаты
создание соответствующих РФП.
исследований по наработке, выделению и
применению четырех изотопов Tb, перспективных
БЛАГОДАРНОСТИ
для использования в ядерной медицине; данные
систематизированы в табл. 7.
Автор благодарит академика Б.Ф. Мясоедова и
Показано, что изученные методы наработки
С.Е. Винокурова (лаборатория радиохимии ГЕОХИ
изотопов 149,152,155Tb в отличие от методов наработки
РАН) за полезные комментарии к работе.
161Tb имеют трудности, поэтому разработка новых
методов и оптимизация изученных является
ФОНДОВАЯ ПОДДЕРЖКА
актуальной задачей.
Для каждого из изученных радионуклидов Tb
Исследование выполнено при финансовой
существуют методы выделения из соответствующих
поддержке РФФИ в рамках научного проекта № 20-
облученных мишеней без носителя.
13-50166.
Сегодня широко изучается применение
149,152,161Tb, в то время как сведения об
КОНФЛИКТ ИНТЕРЕСОВ
исследованиях с 155Tb ограничены. Показано, что
149Tb перспективен для таргетной альфа-терапии,
в том числе предложено его тераностическое
Автор заявляет об отсутствии конфликта
применение, основанное на испускании им
интересов.
позитронов.
152Tb перспективен для ПЭТ, что
подтверждается
недавними
клиническими
СПИСОК ЛИТЕРАТУРЫ
исследованиями РФП на его основе. Наконец,
161Tb по результатам многих исследований
1.
Blower P.J. // Dalton Trans. 2015. Vol. 44, N 11. P. 4819-
является лучшей альтернативой
177Lu, который
4844.
также нарабатывают в реакторе. Для связывания
2.
Müller C., Reber J., Haller S., Dorrer H., Köster U.,
изотопов Tb использовали широко применяемые
Johnston K., Zhernosekov K., Türler A., Schibliet R. //
в РФП на основе лантанидов хелаторы, которые
Pharmaceuticals. 2014. Vol. 7, N 3. P. 353-365.
РАДИОХИМИЯ том 64 № 2 2022
118
КАЗАКОВ
3.
Uusijärvi H., Bernhardt P., Rosch F., Helmut R.,
18. Zagryadskii V.A., Latushkin S.T., Malamut T.Y.,
Maecke H.R., Forssell-Aronsson E. // J. Nucl. Med.
Novikov V.I.,
Ogloblin
A.A.,
Unezhev V.N.,
2006. Vol. 47, N 5. P. 807-814.
Chuvilin D.Y. // At. Energy. 2017. Vol. 123, N 1. P. 55-
4.
Müller C., Domnanich K.A., Umbricht C.A., van
58.
der Meulen N.P. // Br. J. Radiol. 2018. Vol. 91, N 1091.
19. Moiseeva A.N., Aliev R.A., Unezhev V.N.,
ID 20180074.
Zagryadskiy V.A., Latushkin S.T., Aksenov N.V.,
5.
Talip Z., Favaretto C, Geistlich S., van der Meulen N.P. //
Gustova N.S., Voronuk M.G., Starodub G.Y.,
Molecules. 2020. Vol. 25, N 4. P. 966.
Ogloblin A.A. // Sci. Rep. 2020. Vol. 10, N 1. P. 1-7.
6.
Franz E.M., Friedlander G. // Nucl. Phys. 1966. Vol. 76.
20. Steyn G.F., Vermeulen C., Szelecsényi F., Kovács Z.,
P. 123-128.
Hohn A., van der Meulen N.P., Schibli R., van der
7.
Charalambus S. // Nucl. Phys., Sect. A. 1967. Vol. 94,
Walt T.N. // Nucl. Instrum. Meth. Phys. Res. Sect. B:
N 1. P. 26-32.
Beam Interact. Mater. At. 2014. Vol. 319. P. 128-140.
8.
Heydegger H.R. // Nucl. Phys., Sect. A. 1972. Vol. 196.
21. Formento-Cavaier R., Haddad F., Alliot C., Sounalet T.,
P. 156-160.
Zahi I. // Nucl. Instrum. Meth. Phys. Res. Sect. B: Beam
9.
Stehney A.F., Steinberg E.P. // Nucl. Instrum. Meth.
Interact. Mater. At. 2020. Vol. 478. June. P. 174-181.
1968. Vol. 59, N 1. P. 102-108.
22. Zaitseva N.G., Dmitriev S.N., Maslov O.D.,
10. Steinberg E.P., Stehney A.F., Stearns C., Spaletto I. //
Molokanova L.G., Starodub G.Y., Shishkin S.V.,
Nucl. Phys. A. 1968. Vol. 113, N 2. P. 265-271.
Shishkina T.V., Beyer G.J. // Czechoslov. J. Phys. 2003.
11. Köster U., Fedoseyev V.N., Andreyev A.N.,
Vol. 53. N S1. P. A455-A458.
Bergmann U.C., Catherall R., Cederkäll J.,
23. Sarkar S., Allen B.J., Iman S., Gouzee G., Leigh J.,
Dietrich M., De Witte H., Fedorov D.V., Fraile L.,
Meriaty H. // Second Int. Conf. on Isotopes. Sydney,
Franchoo S., Fynbo H., Georg U., Giles T., Gorska M.,
1997. P. 104.
Hannawald M., Huyse M., Joinet A., Jonsson O.C.,
24. Maiti M., Lahiri S., Tomar B.S. // Radiochim. Acta.
Kratz K.L., Kruglov K., Lau Ch., Lettry J., Mishin V.I.,
2011. Vol. 99, N 9. P. 527-534.
Oinonen M., Partes K., Peräjärvi K., Pfeiffer B.,
25. Maiti M. // Phys. Rev. C: Nucl. Phys. 2011. Vol. 84, N 4.
Ravn H.L., Seliverstov M.D., Thirolf P., Van de Vel K.,
P. 1-7.
Van Duppen P., Van Roosbroeck J., Weissman L. // Nucl.
26. Allen B.J., Goozee G., Sarkar S., Beyer G.J., Morel C.,
Instrum. Methods Phys. Res. Sect. B: Beam Interact.
Byrne A.P. // Appl. Radiat. Isot. 2001. Vol. 54. N 1.
Mater. At. 2003. Vol. 204. P. 347-352.
P. 53-58.
12. Verhoeven H., Cocolios T.E., Dockx K., Farooq-
27. Baum R.P., Singh A., Benešová M., Vermeulen C.,
Smith G.J., Felden O., Formento-Cavaier R., Gebel R.,
Gnesin S., Köster U., Johnston K., Müller D.,
Köster U., Neumaier B., Scholten B., Spahn I.,
Senftleben S., Kulkarni H.R., Türler A., Schibli R.,
Spellerberg S., Stamati M.E., Stegemann S. // Nucl.
Prior J.O., Van Der Meulen N.P., Müller C. // Dalton
Instrum. Meth. Phys. Res. Sect. B Beam Interact. Mater.
Trans. 2017. Vol. 46, N 42. P. 14638-14646.
At. 2020. Vol. 463. January. P. 327-329.
28. Müller C., Vermeulen C., Johnston K., Köster U.,
13. Abbas Rizvi S.M., Henniker A.J., Goozee G., Allen B.J. //
Schmid R., Türler A., van der Meulen N.P. // EJNMMI
Leuk. Res. 2002. Vol. 26, N 1. P. 37-43.
Res. 2016. Vol. 6. N 1.
14. Miederer M., Seidl C., Beyer G.-J., Charlton D.E.,
29. Cicone F., Gnesin S., Denoël T., Stora T., van der
Vranješ-Durić S., Comor J.J., Huber R., Nikula T.,
Meulen N.P., Müller C., Vermeulen C., Benešová M.,
Apostolidis C., Schuhmacher C., Becker K.-F.,
Köster U., Johnston K., Amato E., Auditore L., Coukos G.,
Senekowitsch-Schmidtke R.
//
Radiat. Res.
2003.
Stabin M., Schaefer N., Viertl D., Prior J.O. // EJNMMI
Vol. 159, N 5. P. 612-620.
Res. 2019. Vol. 9. ID 53.
15. Beyer G.-J., Miederer, M., Vranješ-Durić S., Čomor J.J.,
30. Müller C., Singh A., Umbricht C.A., Kulkarni H.R.,
Künzi G., Hartley O., Senekowitsch-Schmidtke R.,
Johnston K., Benešová M., Senftleben S., Müller D.,
Soloviev D., Buchegger F. // Eur. J. Nucl. Med. Mol.
Vermeulen C., Schibli R., Köster U., van der Meulen N.P.,
Imaging. 2004. Vol. 31. N 4, P. 547-554.
Baum R.P. // EJNMMI Res. 2019. Vol. 9, N 1. P. 1-10.
16. Müller C., Zhernosekov K., Köster U., Johnston K.,
31. Vermeulen C., Steyn G.F., Szelecsényi F., Kovács Z.,
Dorrer H., Hohn A., Van Der Walt N.T., Türler A.,
Suzuki K., Nagatsu K., Fukumura T., Hohn A., van der
Schibli R. // J. Nucl. Med. 2012. Vol. 53. N 12, P. 1951-
walt T.N. // Nucl. Instrum. Methods Phys. Res. Sect. B:
1959.
Beam Interact. Mater. At. 2012. Vol. 275. P. 24-32.
17. Umbricht C.A., Köster U., Bernhardt P., Gracheva N.,
32. Güray R.T., Özkan N., Yalçln C., Rauscher T., Gyürky G.,
Johnston K., Schibli R., van der Meulen N.P., Müller C. //
Farkas J., Fülöp Z., Halász Z., Somorjai E. // Phys. Rev.
Sci. Rep. 2019. Vol. 9, N 1. P. 1-10.
C: Nucl. Phys. 2015. Vol. 91, N 5. P. 1-9.
РАДИОХИМИЯ том 64 № 2 2022
ИЗОТОПЫ ТЕРБИЯ В ЯДЕРНОЙ МЕДИЦИНЕ
119
33. Köster U., Assmann W., Bacri C.-O., Faestermann T.,
Mizohata K., Santos H.A., Salonen J., Airaksinen A.J.,
Garrett P., Gernhäuser R., Tomandl I. // Nucl. Instrum.
Sarparanta M., Helariutta K. // Nucl. Med. Biol. 2020.
Meth. Phys. Res. Sect. B: Beam Interact. Mater. At.
Vol. 84-85. P. 102-110.
2020. Vol. 463. February. P. 111-114.
49. Lehenberger S., Barkhausen C., Cohrs S., Fischer E.,
34. Tárkányi F., Ditrói F., Takács S., Hermanne A.,
Grünberg J., Hohn A., Köster U., Schibli R., Türler A.,
Ignatyuk A.V. // Appl. Radiat. Isot. 2015. Vol. 98. P. 87-
Zhernosekov K. // Nucl. Med. Biol. 2011. Vol. 38, N 6.
95.
P. 917-924.
35. Nayak D., Lahiri S., Ramaswami A., Manohar S.B.,
50. Szelecsényi F., Fenyvesi A., Steyn G.F., Brezovcsik K.,
Das N.R. // Appl. Radiat. Isot. 1999. Vol. 51. N 6.
Kovács Z., Biró B. // J. Radioanal. Nucl. Chem. 2018.
P. 631-636.
Vol. 318, N 1. P. 491-496.
36. Lahiri S., Nayak D., Das S.K., Ramaswami A.,
51. Tárkányi F., Hermanne A., Takács S., Ditrói F., Csikai J.,
Manohor S.B., Das N.R. // J. Radioanal. Nucl. Chem.
Ignatyuk A.V. // J. Radioanal. Nucl. Chem.
2013.
1999. Vol. 241, N 1. P. 201-206.
Vol. 298, N 2. P. 1385-1392.
37. Webster B., Ivanov P., Russell B., Collins S., Stora T.,
52. Monroy-Guzman F., Salinas E.J. // J. Mex. Chem. Soc.
Ramos J.P., Köster U., Robinson A.P., Read D. // Sci.
2015. Vol. 59, N 2. P. 143-150.
Rep. 2019. Vol. 9, N 1. P. 10884-10893.
53. Aziz A., Artha W.T. // Indones. J. Chem. 2017. Vol. 16,
38. Gayoso R.E., Sonzogni A.A., Nassiff S.J. // Radiochim.
N 3. P. 283-288.
Acta. 1996. Vol. 72, N 2. P. 55-60.
54. Aziz A. // J. Phys. Conf. Ser. 2020. Vol. 1436. N 1.
39. Szelecsényi F., Kovács Z., Nagatsu K., Zhang M.R.,
ID 012097.
Suzuki K. // J. Radioanal. Nucl. Chem. 2016. Vol. 307,
55. Müller C., Schibli R. // Front. Oncol. 2013. Vol. 3.
N 3. P. 1877-1881.
September. P. 1-10.
40. Gayoso R.E., Barral M.A., Nassiff S.J. // J. Radioanal.
56. Zhang J., Singh A., Kulkarni H.R., Schuchardt C.,
Nucl. Chem. 1997. Vol. 218, N 2. P. 223-227.
Müller D., Wester H.J., Maina T., Rösch F., van
41. Tárkányi F., Ditrói F., Takács S., Hermanne A.,
der Meulen N.P., Müller C., Mäcke H., Baum R.P. //
Ignatyuk A.V. // Ann. Nucl. Energy. 2013. Vol.
62.
Semin. Nucl. Med. 2019. Vol. 49, N 5. P. 422-437.
P. 375-381.
57. Grünberg J., Lindenblatt D., Dorrer H., Cohrs S.,
42. Tárkányi F., Ditrói F., Takács S., Csikai J., Hermanne A.,
Zhernosekov K., Köster U., Türler A., Fischer E.,
Ignatyuk A.V. // Appl. Radiat. Isot. 2015. Vol. 83. P. 18-
Schibli R. // Eur. J. Nucl. Med. Mol. Imaging. 2014.
24.
Vol. 41, N 10. P. 1907-1915.
43. Shahid M., Kim K., Naik H., Kim G. // Nucl. Instrum.
58. Müller C., Reber J., Haller S., Dorrer H., Bernhardt P.,
Meth. Phys. Res. Sect. B: Beam Interact. Mater. At.
Zhernosekov K., Türler A., Schibli R. // Eur. J. Nucl.
2019. Vol. 464. December. P. 74-83.
Med. Mol. Imaging. 2014. Vol. 41, N 3. P. 476-485.
44. Kazakov A.G., Aliev R.A., Bodrov A.Y., Priselkova A.B.,
59. Haller S., Pellegrini G., Vermeulen C., van der
Kalmykov S.N. // Radiochim. Acta. 2018. Vol. 106, N 2.
Meulen N.P., Köster U., Bernhardt P., Schibli R.,
P. 135-140.
Müller C. // EJNMMI Res. 2016. Vol. 6, N 1. P. 1-11.
45. Giri P.K., Mahato A., Singh D., Linda S.B., Kumar H.,
60. Müller C., Umbricht C.A., Gracheva N., Tschan V.J.,
Tali S.A., Ali R. // Indian J. Pure Appl. Phys. 2019.
Pellegrini G., Bernhardt P., Zeevaart J.R., Köster U.,
Vol. 57. September. P. 619-623.
Schibli R., van der Meulen N.P. // Eur. J. Nucl. Med.
46. Giri P.K., Singh D., Linda S.B., Mahato A., Kumar H.,
Mol. Imaging. 2019. Vol. 46, N 9. P. 1919-1930.
Tali S.A., Afzal Ansari M., Kumar R., Singh R.P.,
61. Nizou G., Favaretto C., Borgna F., Grundler P.V.,
Muralithar S. // Indian J. Pure Appl. Phys. 2019. Vol. 57,
Saffon-Merceron N., Platas-Iglesias C., Fougère O.,
N 8. P. 552-556.
Rousseaux O., van der Meulen N.P., Müller C.,
47. Müller C., Fischer E., Behe M., Köster U., Dorrer H.,
Beyler M., Tripier R. // Inorg. Chem. 2020. Vol. 59.
Reber J., Haller S., Cohrs S., Blanc A., Grünberg J.,
N 16, P. 11736-11748.
Bunka M., Zhernosekov K., van der Meulen N.P.,
Johnston K., Türler A., Schibli R. // Nucl. Med. Biol.
62. Marin I., Rydèn T., van Essen M., Svensson J.,
2014. Vol. 41, N S. P. 58-65.
Gracheva N., Köster U., Zeevaart J.R., van der
48. Jakobsson U., Mäkilä E., Rahikkala A., Imlimthan S.,
Meulen N.P., Müller C., Bernhardt P. // EJNMMI Phys.
Lampuoti J., Ranjan S., Heino J., Jalkanen P., Köster U.,
2020. Vol. 7. N 1.
РАДИОХИМИЯ том 64 № 2 2022