РАДИОХИМИЯ, 2022, том 64, № 2, с. 120-132
УДК 639.3+639.6+579.68
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ
ВОДОЕМОВ С РАДИОНУКЛИДНЫМ ЗАГРЯЗНЕНИЕМ
© 2022 г. А. В. Сафонова, *, А. В. Огнистаяб, К. А. Болдыревв,
Д. А. Зеленинаа, Л. Г. Бондареваг, И. Г. Тананаева, б
а Институт физический химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
б Дальневосточный федеральный университет,
690922, Владивосток, пос. Аякс, д. 10
в Институт проблем безопасного развития атомной энергетики РАН,
115191, Москва, Большая Тульская ул., д. 52
г Федеральный научный центр гигиены им. Ф.Ф. Эрисмана,
141014, Мытищи Московской обл., ул. Семашко, д. 2
*e-mail: alexeysafonof@gmail.com
Поступила в редакцию 09.02.2021, после доработки 04.10.2021, принята к публикации 11.10.2021
В обзоре рассмотрено участие фитопланктона в процессах самоочищения водоемов от радионуклидного
загрязнения. Проведена оценка подвижности основных радионуклидов в пресноводных водоемах
и предложена шкала для оценки опасности основных радионуклидов в условиях пресноводных
водоемов. На основании данного подхода определено, что потенциально опасными являются 129I,
237Np, 226Ra и 79Se. Проведен анализ разнообразия сообществ фитопланктона пресноводных водоемов,
загрязненных радионуклидами, и систематизированы литературные данные по основным механизмам
иммобилизации радионуклидов биомассой фитопланктона. Оценена роль процесса биоминерализации
ила в долговременной иммобилизации радионуклидов в донных отложениях.
Ключевые слова: донные отложения, радионуклиды, токсичность, подвижность, поверхностные
водоемы.
DOI: 10.31857/S0033831122020022, EDN: ECTLXF
ВВЕДЕНИЕ
дов в Хэнфорде (США) [5], на Сибирском химиче-
ском комбинате [6] и других предприятиях.
Одной из глобальных проблем современности
Поведение техногенных радионуклидов в ги-
является радиоактивное загрязнение водных эко-
дросфере зависит от их физико-химических харак-
систем, произошедшее в результате ядерных испы-
теристик: степени окисления, химической формы
таний [1-6], радиационных аварий (например, на
и состояния в растворе (истинно растворенные, в
Чернобыльской АЭС, ПО «Маяк» в 1957 г., АЭС
виде органических или минеральных комплексов, в
«Фукусима» и др.), а также обращение с радиоак-
форме коллоидных или псевдоколлоидных частиц)
[7]. Важными факторами миграции радионуклидов
тивными отходами (РАО) на предприятиях атом-
в водоемах являются: гидрологический и волновой
ной промышленности. Примерами загрязнения
режим, рельеф дна, глубина [8, 9] и ряд физико-хи-
водоемов при обращении с РАО являются сбросы
мических характеристик (температурный режим,
в естественные водоемы, например, в р. Теча [2],
значения рН, Eh, солесодержание и др.). При бла-
оз. Карачай [3] (ПО «Маяк»), Ирландское море
гоприятных условиях происходит самоочищение
(Селлафилд, Великобритания) [4], а также утечки
водоема: при постепенном перемешивании вод ра-
из поверхностных хранилищ радиоактивных отхо-
дионуклиды связываются взвешенными частицами,
120
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ ВОДОЕМОВ
121
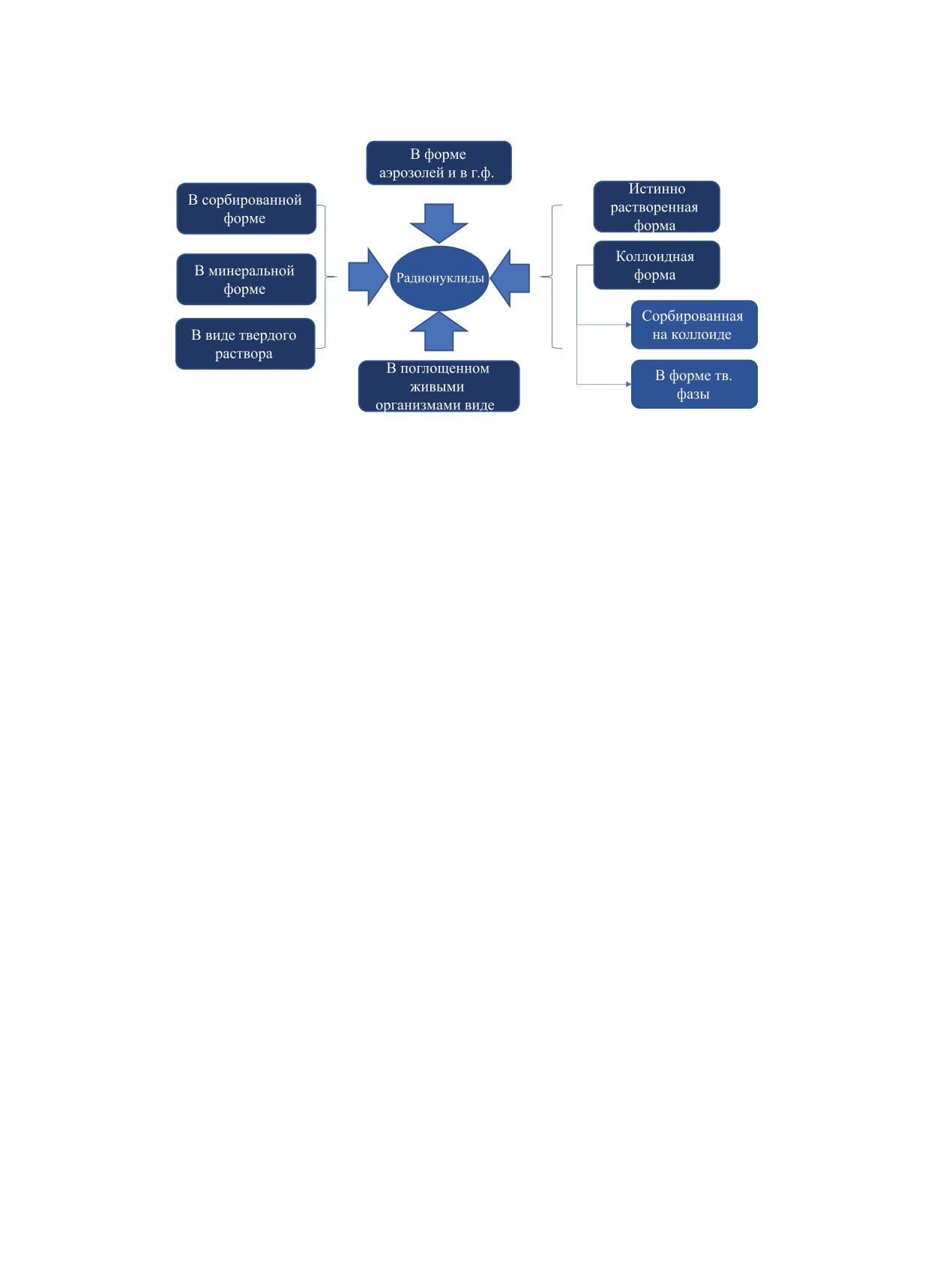
Рис. 1. Схема форм нахождения радионуклидов в водоемах.
осаждаются и фиксируются в донных отложениях.
радионуклиды вне зависимости от сезонных усло-
Биологические факторы, определяемые особенно-
вий. Эффективность биогеохимических процессов
стями таксономического и функционального раз-
самоочищения определяется механизмом иммо-
нообразия микрофлоры, фито- и зооценоза [10],
билизации радионуклидов в донных отложениях
также могут играть важную роль в самоочищении
(биосорбция, биоаккумуляция в клетках или био-
водоема, особенно в летние периоды интенсивного
минерализация). В случае биосорбции радионукли-
развития фитопланктона - так называемого «цвете-
дов на поверхности организмов или аккумуляции
ния» водоема [11]. В этом случае при размножении
внутри клетки [16, 17] после лизиса клетки высока
фотосинтезирующих макро- и микроводорослей, а
вероятность их ремобилизации. Биоминерализация
также цианобактерий в водной толще формируется
включает совокупность процессов, приводящих к
своего рода биосорбент с большой площадью по-
образованию твердых минеральных фаз. Например,
верхности [12-14]. Численность фитопланктона в
при развитии анаэробных микроорганизмов, вос-
пресноводных водоемах в период цветения в ряде
станавливающих сульфат-ионы или трехвалентное
случаев превышает 109 кл/л, а биомасса - 50 г/м3.
железо, формируются малорастворимые осадки
Отмирание и седиментация клеток в донные отло-
пирротина (FenSn+1), троиллита (FeS) и гидрокси-
жения приводит к концентрированию радионукли-
троиллита (mFeS·nFe(OH)2); рост аэробных бакте-
дов в иле. Образование многими микроводорослями
рий может приводить к образованию ферригидрита
и цианобактериями фитохелатинов - ряда макромо-
(mFe2O3·nH2O), гетита (FeOOH) и других осадков
лекул с различными функциональными группами,
[18]. В этом случае может происходить надежная
позволяющими защищать клетку от токсического
фиксация радионуклидов в донных отложениях.
воздействия металлов [15], увеличивает иммобили-
Процессы минералообразования в донных отложе-
зацию многих металлов в донных отложениях.
ниях и их роль в иммобилизации радионуклидов
на данный момент малоизучены. Понимание этого
Поведение радионуклидов в донных отложениях
процесса и поиск подходов для управления им мо-
зависит как от химических свойств самого металла,
гут стать важным этапом для очистки водоемов с
так и от ряда параметров водоема (аэрации, хими-
радионуклидным загрязнением. Таким образом, для
ческого и минерального состава донных отложе-
прогноза самоочищения водоема и степени фикса-
ний). В некоторых случаях наблюдаются сезонное
ции радионуклидов в донных отложениях требу-
концентрирование радионуклидов в иле и их после-
ется биогеохимическое моделирование процесса с
дующая ремобилизация (обычно зимой и ранней
весной при увеличении концентрации кислорода в
учетом комплекса различных параметров.
воде) [7, 8]. Иногда в донных отложениях формиру-
Настоящая работа посвящена обобщению лите-
ется естественный минерально-органический анаэ-
ратурных данных об особенностях развития фито-
робный барьер, позволяющий прочно фиксировать
планктона в загрязненных радионуклидами водо-
РАДИОХИМИЯ том 64 № 2 2022
122
САФОНОВ и др.
Таблица 1. Система расчета баллов опасности радионуклидов в пресноводных водоемах
Период полураспада,
Коэффициент распределения (Kd)
Коллоидообразование, K
Радиотоксичность, УВ, R
T, годы
на донных отложениях (мг/см3), A
Не образуют
1
УВ < 2
3
T1/2 < 2
1
<10
3
Псевдоколлоиды
2
2 < УВ <100
2
2 < T1/2 <50
2
10-1000
2
Истинные коллоиды
3
УВ > 100
1
T
> 50
3
1000
1
1/2
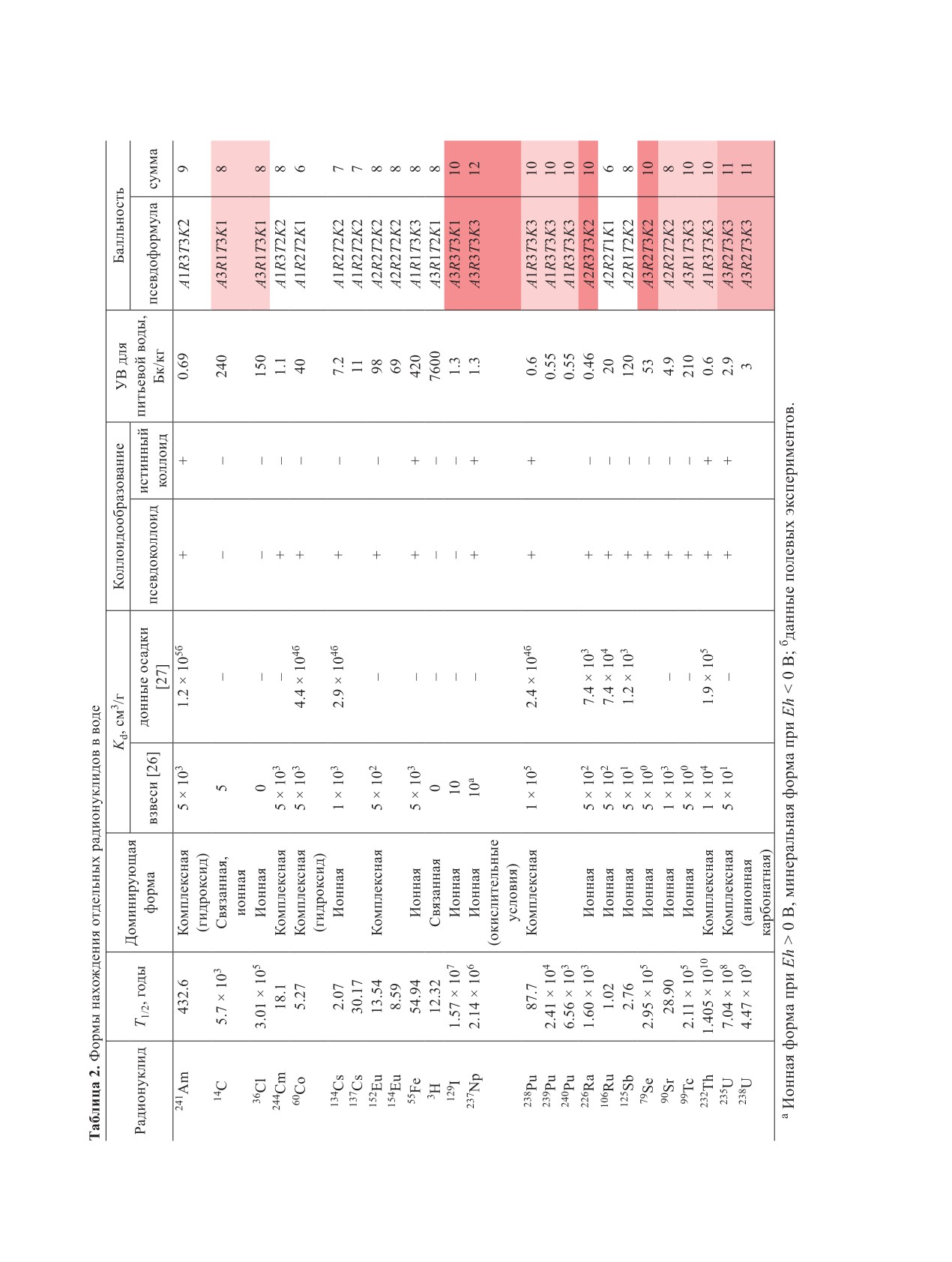
емах и описанию основных механизмов иммоби-
актуальных для пресноводных водоемов. Система
лизации и седиментации радионуклидов. Особое
расчета баллов приведена в табл. 1. Результаты рас-
внимание уделено процессам, способствующим
чета приведены в табл. 2. В качестве результирую-
долговременной иммобилизации радионуклидов в
щего параметра использована псевдоформула вида
донных отложениях.
AаRвTсKd, включающая сумму баллов каждого
Основные аспекты поведения радионукли-
фактора, приведенного в табл. 1 (A - коэффициент
дов в водных объектах. В условиях пресноводных
распределения на донных отложениях, T - время
водоемов мобильность радионуклидов зависит от
полураспада, R - радиотоксичность). Из возможных
химических свойств элемента, физико-химических
12 баллов только 129I, 237Np, 226Ra и 79Se характери-
параметров среды и других факторов. Основные
зуются максимальной опасностью (10 баллов), что
формы нахождения радионуклидов в водоемах при-
обусловлено их высокой биоаккумуляцией, способ-
ведены на рис. 1. Большинство актинидов способ-
ностью образовывать истинные или псевдоколлои-
ны сорбироваться на твердых частицах, биологи-
ды, а также длительным периодом полураспада.
ческих объектах, а также на органическом и мине-
В зависимости от физико-химических условий
ральном веществе донных отложений [7]. Многие
наибольшая подвижность наблюдается у изотопов
радионуклиды, особенно актиниды (например, Pu
Н, Cl, I, Тс, С и Se.
[19]), формируют коллоиды при нейтральных зна-
Уран является наиболее долгоживущим и широ-
чениях pH среды и по этой причине могут стаби-
ко распространенным из актинидов. Загрязнению
лизироваться в водной фазе в дисперсной форме.
U подвержены водоемы, находящиеся вблизи пред-
Большинство радионуклидов может сорбироваться
приятий по добыче урановой руды, ее первичной
на взвешенных илистых, железистых или глинистых
переработке, обогащению, а также в районе заво-
частицах, образуя так называемые псевдоколлоиды
дов по переработке отработанного ядерного топли-
[21], способствующие их активному переносу, сни-
ва (ОЯТ). Значительную роль в загрязнении ураном
жая темпы самоочищения водоема. Некоторые ра-
природных вод играют хвосто- и шламохранили-
дионуклиды, в первую очередь 3Н, 14С и 137Cs [20],
относятся к физиологически активным элементам
ща и хранилища РАО открытого типа [22]. Уран в
и аккумулируются клетками. Для характеристики
природных водах находится либо в виде катиона
радиотоксичности радионуклидов для человека в
уранила (UO22+), либо в виде комплекса с карбона-
нормах радиационной безопасности используется
том. В высококарбонатных пресных водах и океане
термин уровень вмешательства (УВ), аналогично
уранил-ионы лишь частично образуют комплекс с
с предельно допустимыми концентрациями (ПДК)
клетками микроорганизмов, находясь преимуще-
для нерадиоактивных элементов.
ственно в растворенном состоянии в карбонатных
Биологическая значимость радионуклида опре-
комплексах. В пресных водах более ожидаемо вза-
имодействие уранила с клетками и полисахаридами
деляется также его периодом полураспада. Так, ко-
роткоживущие радионуклиды опасны лишь корот-
микроорганизмов [20, 23]. В осадках и придонной
кое время после радиационного загрязнения, дол-
анаэробной зоне в присутствии восстановленной
гоживущие радионуклиды представляют опасность
серы и железа уранил-ионы могут быть восстанов-
тысячи и сотни тысяч лет. На основании ряда факто-
лены до четырехвалентного состояния и иммобили-
ров, включающих также радиотоксичность изотопа
зованы в виде твердых фаз уранинита (UO2) или в
(значения УВ по НРБ-2009), мы разработали бал-
виде фосфатных минералов, или быть сорбированы
льную оценку опасности основных радионуклидов,
на оксигидроксидах переходных металлов.
РАДИОХИМИЯ том 64 № 2 2022
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ ВОДОЕМОВ
123
РАДИОХИМИЯ том 64 № 2 2022
124
САФОНОВ и др.
Таблица 3. Подвижность элементов в зависимости от окислительно- восстановительных и кислотно-основных
условий в водной фазе
Подвижность
Условия
очень
высокая
средняя
низкая
очень низкая
высокая
Окислительно-
Окислительные
Н, Cl, I,
Mo, U, Se, Ca,
Cu, Co, Ni,
Sb, Cs, Tl
Zr, Th, РЗЭ, Pu,
восстановительные
Тс, С, Se
F, Sr, Ra, Co,
Cd
Am
Ni, Ag
Восстановительные
Н, Cl, I,
Ca, F, Sr, Ra
As, Cd, Hg
Si, P, K, Fe,
Zr, Th, РЗЭ, Mo,
B, С, Se
Mn
V, U, Se, Co, Sb,
Cs, U, Pu, РЗЭ,
Am
Кислотность
Кислые
Н, Cl, I,
Mo, V, U, Se,
As, Cd
Si, P, K, Pb,
Ti, Zr, Th, РЗЭ,
С, Se
Re, Ca, Na,
Li, Rb, Ba,
Am
Mg, F, Sr, Ra,
Be, Bi, Sb,
Zn, Cu, Co,
Cs, Fe, Mn
Ni, Hg, Ag,
Au
Нейтральные и
Н, Cl, I,
Ca, Na, Mg, F,
As, Cd
Ba, Be, Bi,
Ti, Sn, Te, Cr, Zr,
щелочные
Mo, U,
Sr, Ra
Sb, Cs
Th, Co, Ni, РЗЭ,
Se, С
Am
Рассчитанные данные об относительной под-
водоемах этот показатель проявляет значительную
вижности элементов в условиях окружающей сре-
вариабельность.
ды приведены в табл. 3.
Диапазон изменений уровня водородного пока-
С уменьшением ионного радиуса и заряда иона
зателя рН, или чувствительность водоема к закисле-
подвижность элементов снижается, что объясняет-
нию, зависит от буферной емкости воды водоема и
ся большим поляризующим действием иона на мо-
в первую очередь определяется карбонатно-бикар-
бонатной буферной системой. Наиболее значитель-
лекулы воды, что приводит к гидролизу, а, следо-
ные изменения рН наблюдаются в слабоминерали-
вательно, и большему комплексообразованию, про-
зованных водоемах, расположенных на скальных
цессам полимеризации, образованию минеральных
породах, верховых болотах, сильно выветренных
фаз (табл. 3) [24]. На подвижность элементов также
геологических структурах осадочного происхожде-
влияет растворимость доминирующей формы ради-
ния [28].
онуклида в окислительных или восстановительных
Особенности развития фитопланктона в во-
условиях. Радионуклиды группы редкоземельных
доемах с радиационным загрязнением. Большой
элементов (РЗЭ), как правило, обладают низкой
интерес для радиоэкологов вызывает изучение био-
растворимостью при нейтральных значениях рН,
геоценозов водоемов, длительное время подвергав-
характерных для природных вод.
шихся радиоактивному загрязнению. Исследование
Значимыми факторами, определяющим подвиж-
днепровских водохранилищ, пострадавших после
ность радионуклида, являются сезонные и суточ-
аварийного выброса на Чернобыльской АЭС, по-
ные изменения значений рН среды. Летом в днев-
казало значительную роль микроводорослей в на-
ные часы, когда фотосинтез достигает максимума,
коплении Sr и Cs. Максимальное включение этих
рН возрастает до 8-9. Зимой, когда преобладают
элементов в биомассу происходило в процессе
процессы разложения органического вещества с
активного размножения фитопланктона в летний
образованием углекислого газа и органических
период [28]. В послеаварийный период обнаруже-
кислот, наблюдается закисление вод [25]. В круп-
ны изменения в структуре популяции Microcystis
ных водоемах на протяжении года рН изменяется
aeruginosa Külz, emend Elenk. - одного из основных
в диапазоне 6.5-8.5 [25]. В небольших по размеру
возбудителей цветения воды [29]. В период прове-
РАДИОХИМИЯ том 64 № 2 2022
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ ВОДОЕМОВ
125
дения исследований в составе фитопланктона дне-
доминирование сине-зеленых водорослей, в пери-
провских водохранилищ преобладали диатомовые
од максимального загрязнения доминировали диа-
(Diatomeae), сине-зеленые (Cyanophyta) и зеленые
томовые водоросли. В этот период продуктивность
водоросли (Chlorophyta).
оз. Кызыл-Таш была около 5 тыс. т/год. К концу
1990-х гг. со снижением техногенной нагрузки био-
Изучение сезонной динамики развития одно-
клеточных водорослей при попадании стоков с
масса зеленых водорослей возросла от 3 до 7 раз,
Белоярской АЭС в Белоярское водохранилище пока-
а биомасса сине-зеленых снизилась в 1.5-2 раза. В
расчетных экспериментах установлено, что макси-
зало, что в весенне-летний сезон происходит пяти-
мальная стадия самоочищения водоема происходит
кратное возрастание их численности, что приводит
к двукратному уменьшению радиоактивности [30].
при формировании донного ила, в массиве которого
В водоеме доминировали 8 видов: Aphanizomenon
накапливаются радионуклиды в форме твердых ми-
flos-aquae, Microcystis aeruginosa, Coelastrum
неральных фаз [12, 35].
microporum, Oocystis submarina, Pediastrum duplex,
Для Теченского каскада водоемов (ТКВ) В-3,
Ceratium hirundinella, Oocystis marssonii и центри-
В-4, В-10 и В-11, согласно данным работы [34], в
ческие диатомовые водоросли рода Stephanodiscus
летний период наблюдалось массовое развитие
[31].
фитопланктона, при этом максимальным видовым
В техногенных водоемах-хранилищах радиоак-
разнообразием обладали зеленые водоросли. Для
тивных отходов ПО «Маяк» [32, 33] зафиксирова-
водоемов Теченского каскада и Шершневского
ны доминирующие виды сине-зеленых водорослей,
вдхр. уровень биомассы фитопланктона достигал
вносящих значительный вклад в осаждение загряз-
максимальных величин - 60-70 г/м3 к концу лета.
нений в донные отложения. При изучении особен-
В начале лета основную часть биомассы фитоплан-
ностей видового состава планктона оз. Карачай
ктона составляли зеленые и диатомовые водоросли,
установлено, что высокие значения радиоактивного
а в конце лета возрастала доля цианобактерий. В
и химического загрязнения приводят к обеднению
водоемах В-11 и В-10 во второй половине лета фор-
сообществ фито- и зоопланктона до монокультур
мировалась монодоминантная структура фитоплан-
[34], что приводит к деградации биоценозов во-
ктона с преобладанием цианобактерий Planktothrix
доема и снижению его способности к самоочище-
agardhii (Gom.) Anagn. et Kom. (60-70% общей био-
нию. В работе [34] указано, что фитопланктон оз.
массы фитопланктона). Доминирование этого вида
Карачай имел крайне низкое видовое разнообра-
свидетельствует о высокой степени эвтрофирова-
зие. Исследователями обнаружено всего четыре
ния водоемов в результате обогащения фосфором
вида водорослей, включающих цианобактерии
и азотом. Для водоемов В-4 и В-3 обычно отмеча-
Geitlerinema amphibium, центрические диатомовые
лось присутствие нескольких видов-кодоминантов:
водоросли Aulacoseira ambigua (Grun.), зеленые во-
представителей родов цианобактерий Microcystis и
доросли Scenedesmus quadricauda (Turp.), а также
Anabaena, а также рода Scenedesmus (зеленые водо-
желто-зеленые водоросли Pleurochloris imitans. В
росли).
виде спор обнаружены Aulacoseira ambigua (Grun.)
В Красноярском крае источником радиоактив-
(диатомовые водоросли) и Scenedesmus quadricauda
ного загрязнения окружающей среды долгое время
(Turp.) (зеленые водоросли). При этом в количе-
являлся Горно-химический комбинат (ГХК), распо-
ственном плане развитие фитопланктона было до-
ложенный на правом берегу р. Енисей. В результа-
вольно высоким (до 1010 кл/л) в зависимости от се-
те многолетней деятельности комбината в пойме р.
зона.
Енисей отмечено загрязнение 60Co, 137Cs, 152Eu, Pu и
При исследовании водоема охладителя В-2
др. [36, 37]. При изучении уровня накопления радио-
(оз. Кызыл-Таш, ПО «Маяк») установлено значи-
нуклидов компонентами пресноводной экосистемы
тельное изменение доминантных групп альгоплан-
было выяснено, что лучшими аккумуляторами ра-
кона в зависимости от степени загрязнения. До на-
дионуклидов являются диатомовые микроводорос-
чала использования водоема численность зеленых
ли, которые включают одноклеточные одиночные
водорослей достигала 140 тыс. кл/мл, с ростом
или колониальные организмы, почти всегда микро-
техногенной нагрузки наблюдалось постепенное
скопической величины или достигающие в диаме-
РАДИОХИМИЯ том 64 № 2 2022
126
САФОНОВ и др.
Таблица 4. Разнообразие механизмов иммобилизации радионуклидов
Организм
Радионуклид
Механизм
Dunaliella salina
131I
Биосорбция, биоаккумуляция
Dunaliella armatus
134-137Cs
Биоаккумуляция
Microcystis sp.
Oscillatoria sp
Synechocystis
Galdieria sulphuraria
Anabaena sр.
Selenastrum capricormitum
134-137Cs
Биосорбция, биоаккумуляция
Haematococcus pluvialis
Closterium moniliferum
90Sr
Биоаккумуляция
Coccomyxa actinabiotis
238U, 137Cs, 110Ag, 60Co,
Биоаккумуляция
54Mn, 65Zn и 14C
Chlorella vulgaris
90Sr и 137Cs
Биокристаллизация (SrCO3)
Chlamydomonas reinhardtii
Cd
Ассимиляция, аккумуляция
Cystoseira indica
U
Биоминерализация
тре 2-3 мм [38-40]. К наиболее распространенным
физико-химических механизмов. Разнообразие ме-
диатомовым водорослям р. Енисей относятся пред-
ханизмов иммобилизации радионуклидов биомас-
ставители семейств Coscinodiscales, Biddulphiales, а
сой приведено в табл. 4.
также диатомеи семейства Pennatophyceae и др.
В работе [42] на примере зеленых водорослей
Отличительным свойством диатомовых водоро-
рассмотрен процесс накопления урана. Определено
слей является высокая скорость размножения при
несколько этапов процесса: быстрая фиксация в
благоприятных условиях и их закрепление на до-
течение первых минут, более медленная фиксация
ступных поверхностях, в том числе и на поверхно-
продолжительностью до нескольких суток экспе-
стях водных растений (рис. 1). При оценке уровня
римента и третья, самая медленная, до несколь-
связывания радионуклидов со структурными ча-
ких недель [43]. Во всех случаях взаимодействие
стями погруженного макрофита Elodea canadensis
радионуклида происходит на поверхности клетки
показано, что большая часть таких радионуклидов,
либо на самой клеточной стенке, состоящей из гли-
как 241Am и 239+240Pu, находится на поверхности во-
копротеинов и полисахаридов, таких как, напри-
дных растений. При этом доля радионуклидов кор-
мер, каррагинан и агар, либо на липополисахарид-
релирует с содержанием диатомовых водорослей,
ных или белковых участках, богатых различными
находящихся на поверхности [41].
функциональными группами. Некоторые водорос-
Таким образом, на развитие фитопланктона в за-
ли накапливают на клеточной стенке кремнезем
грязненных радионуклидами водоемах значитель-
или карбонат кальция. В работе [44] описана роль
ное воздействие оказывает не только радиационный
карбоксил-ионов в связывании катионов металлов
фон, но и уровень химической нагрузки. Попадание
с О-боковыми цепями липополисахарида (ЛПС)
макрокомпонентов отходов, источников азота, серы
поверхности клетки и сделан вывод о том, что ме-
и фосфора приводит к эвтрофикации водоема, одна-
таллы связываются с фосфорильными группами.
ко чрезмерно высокий уровень химической нагруз-
Показано эффективное поглощение U(VI) бурой
ки снижает видовое разнообразие фитопланктона,
морской водорослью Cystoseira indica и форми-
что уменьшает формирование илистых донных от-
рование соединений, подобных уранатам кальция
ложений и может существенно снизить эффектив-
[45]. Важно отметить, что клеточные стенки водо-
ность самоочищения водоема.
рослей могут связывать радионуклиды независимо
Механизмы поглощения радионуклидов ми-
от жизнеспособности водорослей, поскольку струк-
кроводорослями. Поглощение металлов клетками
туры клеточных стенок остаются относительно ста-
происходит благодаря комплексу биологических и
бильными в донных отложениях.
РАДИОХИМИЯ том 64 № 2 2022
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ ВОДОЕМОВ
127
В некоторых случаях взаимодействие радиону-
что некоторые микроводоросли могут выдерживать
клидов с клетками микроорганизмов происходит
дозу до 20 кГр.
не только на их поверхности, но и внутри клеток.
Механизм аккумулирования радионуклида клет-
Аккумуляция радионуклидов в цитоплазме различ-
кой зависит от размера и заряда иона. Вследствие
ными группами водорослей неоднородна и зависит
сходства цезия с K+ клетки микроводорослей могут
как от наличия внешнего минерального скелета, как
активно переносить внутрь клетки одновалентный
у диатомовых водорослей, так и от физиологиче-
катион Cs+ через соответствующие транспортные
ской активности организма. Наилучший результат
каналы [53]. Coобщалось о представителях альго-
аккумуляции радионуклидов отмечен для предста-
флоры, продуцирующих пигмент астаксантин, ко-
вителей отдела зеленые водоросли (Chlorophyta)
торый играл роль фиксатора Cs благодаря своим
[45], что связано с высокой интенсивностью обмена
гидроксильным и карбонильным функциональным
веществ, размером клетки и площадью поверхно-
группам [54]. Некоторые Cs-связывающие домены
сти биомассы.
в цитоплазме или вакуолях могут служить местом
В лабораторных экспериментах определены ко-
хранения радионуклида в клетке [55].
эффициенты накопления ряда радионуклидов для
Стронций, аккумулированный зеленой микро-
планктона в целом и отдельных его представите-
водорослью, был обнаружен в цитоплазме клет-
лей (Scenedesmus quadricauda, Chlorella vulgaris,
ки, в виде минеральных отложений стронцианита
Microcystis sp., Oscillatoria sp.). Коэффициенты на-
(SrCO3), а также в вакуолях [56]. Процесс биокри-
копления варьировались в пределах 25-100 (90Sr),
сталлизации 90Sr, который в результате биоминера-
20-70 (137Cs), 460-3400 (144Се), 70-550 (106Ru) и
лизации становится структурно более плотным в
3300-16000 (234Th) Бк/г сухой биомассы и были со-
клетках фитопланктона, может препятствовать его
измеримы с коэффициентами накопления для харо-
обратному растворению [57].
вых водорослей, высших водных растений и дон-
Механизм накопления радионуклидов диатомея-
ных отложений [46]. Представители фитопланкто-
ми также связан с особым клеточным панцирем, ко-
на пресных вод проявляли лучшую способность к
торый состоит из аморфного кремнезема. Изнутри
накоплению радионуклидов в сравнении с морски-
и снаружи он покрыт тонким органическим слоем,
ми штаммами. Авторы связали это с присутствием
состоящим из пектиновых веществ. После отми-
конкурентных элементов в морской воде, таких как
рания водоросли кремнеземистый остов оболочки
калий, кальций и иод, возможно, снижающих эф-
остается без изменений в иле, за счет чего наблюда-
фективность накопления [47]. Известно предполо-
ется активное накопление радионуклидов [58].
жение о прямой взаимосвязи плотности клеточной
стенки микроводорослей с накоплением радиону-
Перспектива использования фитопланктона
клидов [48]. Например, охрофитовые водоросли
в очистке окружающей среды. Биоремедиация
имеют мощную клеточную стенку, проявляют низ-
- подход к очистке окружающей среды с исполь-
кую способность к удалению радиоизотопов в срав-
зованием физиологических возможностей организ-
нении с представителями других отделов [47, 48].
мов. На сегодняшний день биоремедиация является
Микроводоросли с тонкой клеточной стенкой чаще
перспективной альтернативой химическим и физи-
всего более активно накапливали поллютанты [48].
ческим методам очистки благодаря ее относитель-
Одним из важных факторов аккумуляции ради-
но невысокой стоимости и отсутствию прямого
онуклидов является радиорезистентность организ-
негативного воздействия на окружающую среду.
ма, которая различается не только на уровне видов,
В то время как фитобиоремедиация (в основном
но и на уровне штаммов [49]. Наиболее радиоу-
почв) высшими растениями используется доста-
стойчивыми являются сине-зеленые, зеленые, ох-
точно давно и в ряде случаев весьма эффективно
рофитовые и диатомовые водоросли [49]. Высокая
[59-61], работы по использованию фитопланктона
устойчивость микроводорослей обусловлена их
для очистки водоемов в современной литературе
защитой от окислительного стресса за счет специ-
отсутствуют. Водоросли и микроводоросли фито-
альных молекул, а также высокой эффективностью
планктона представляют значительный интерес для
репарации поврежденной ДНК [50-52]. Известно,
инженеров-экологов из-за их способности связы-
РАДИОХИМИЯ том 64 № 2 2022
128
САФОНОВ и др.
Таблица 5. Окислительно-восстановительные реакции в системе донные отложения-поровая вода-придонный слой
воды
Реакция
Фаза
O2 + 4H+ + 4– → 2H2O
Придонный слой воды
NO– + 6H+ + 5– → 1/2N2 + 3H2O
NO– + 10H+ + 8– → NH+ + 3H2O
MnO2 + 4H+ + 4– → Mn2+ + 2H2O
Донные отложения
Fe(OH)3 +3H+ +– → Fe2+ + 3H2O
Донные отложения
SO2- + 9H+ + 8– → HS- + 4H2O
Поровая вода + донные отложения
CH2O + 4H+ + 4– → CH4 + H2O
4[O2] + 5[NO3-] + 2[Mn(IV)] + [Fe(III)] + 8[SO2-] + 4[окисленный C]
8[NH+] + 2[Mn(II)] + [Fe(II)] + 8[S2-] + 4[восстановленный C]
вать радионуклиды, в том числе и в экстремальных
становительного потенциала будет протекать
условиях - от крайне щелочных значений среды
каскад различных анаэробных биогеохимических
до сильнокислых вод [62-64]. Благодаря быстрому
процессов (табл. 5), приводящих к образованию
развитию (7-14 сут), относительно низкими тре-
различных малорастворимых минеральных фаз:
бованиями к росту и высокой плотности биомассы
пирита-марказита-гидротроиллита (в процессе
использование фитопланктона в очистке водоема
сульфатредукции) и железистых фаз (сидерита,
может быть перспективным. В одной из модельных
ферригидрита и др.). Подобный биогеохимический
работ установлено, что динамика поглощения ради-
барьер в донных отложениях будет эффективно за-
онуклидов фитопланктоном, в первую очередь ми-
держивать радионуклиды, предотвращая их выход в
кроводорослями, достигала постоянного высокого
водную фазу и миграцию в подземные воды. Стоит
уровня через 2-7 сут в период активного накопле-
добавить, что внесение фосфатов в водоемы может
ния биомассы [65].
также положительно сказаться на иммобилизации
актинидов в илистых отложениях.
При биоремедиации водоемов можно использо-
вать два разных подхода. Во всех случаях можно
Добавление глинистых минералов после актив-
увеличить продуктивность образования фитоплан-
ного развития фитопланктона позволит сформиро-
ктона путем внесения источников фосфора, серы и
вать армированный водонепроницаемый сорбци-
азота. В первом случае фитопланктон верхнего слоя
онно-осадительный барьер, предотвращающий как
воды можно собирать мелкоячеистыми сетями раз в
выход радионуклидов со взвешенными частицами в
10-12 дней и затем утилизировать подобно биомас-
воду, так и их попадание в подземные воды (рис. 2).
се растений при фиторемедиации, например, сжи-
Процедуру внесения источников серы, фосфора
ганием после предварительной сушки. Во втором
и азота (например смесь фосфата калия и сульфа-
случае после накопления биомассы в водной толще
та аммония) и последующего внесения глин (через
можно увеличить ее седиментацию в илистые отло-
10-12 сут) можно в зависимости от количества те-
жения путем добавления флокулирующих агентов
плых дней повторять за лето до 4-6 раз.
(анионные полимеры, хлористый кальций, сульфат
Примером подобного подхода может служить
алюминия и др.). В качестве альтернативы можно
наша работа [66] по накоплению Tc осадками озер
использовать минеральное сырье, например, глини-
Тверской области на разной стадии эвтрофирова-
стые смеси (каолинит, бентонит). В этом случае по-
ния. Установлена положительная корреляция между
ступление органического вещества вместе с источ-
стадией эвтрофирования водоема и скоростью уда-
никами серы, фосфора и азота в донные отложения
ления Tc из водной фазы. Определен комплексный
может привести к формированию анаэробной зоны,
биогеохимический механизм переноса технеция,
оптимальной для бактериальных процессов биоми-
ключевую роль в котором играет планктонное фо-
нерализации.
тотрофное сообщество, обеспечивающее быстрое
После этого в зависимости от содержания оста-
потребление и создающее условия для активного
точного кислорода и значений окислительно-вос-
развития в придонном слое анаэробных бактерий
РАДИОХИМИЯ том 64 № 2 2022
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ ВОДОЕМОВ
129
Рис. 2. Принципиальная схема буферного биогеохимического барьера в донных отложениях
цикла серы и железа за счет притока питательных
миграционной активностью и высокой радиоток-
веществ и биогенов. Обнаружено ингибирующее
сичностью.
действие сульфатов и нитратов на биопоглощение
Физиологическое
и
таксономическое
Tc материалом донных отложений. При иммобили-
разнообразие
сообществ
фитопланктона
зации Tc в донных отложениях, помимо анаэроб-
пресноводных водоемов, включающее зеленые
ных условий, важную роль играют минеральные
одноклеточные
водоросли,
цианобактерии,
фазы восстановленных соединений серы и железа,
нитчатые водоросли и других представителей,
формирующих восстановительный геохимический
позволяет
осуществляться
комплексным
барьер [66]. Так, при образовании анаэробного
биогеохимическим
процессам,
приводящим
сульфидно-железистого осадка была обнаружена
к самоочищению водоема в летний период. В
значительная доля прочнофиксированной формы
зависимости от конкретных физико-химических
технеция. Данный подход весьма перспективно
условий и климатических особенностей каждого
применять для управления качеством воды и целе-
вегетационного периода интенсивность данного
вого удаления редокс-чувствительных радионукли-
процесса не постоянна. Схема накопления
дов из водной толщи.
радионуклидов донными отложениями с участием
альгопланктона представлена на рис. 3. На рисунке
представлено также зонирование слоя донных
ЗАКЛЮЧЕНИЕ
отложений по глубине и уровню редокс-состояния.
Отметим, что при естественном процессе
Проведена оценка мобильности основных ра-
самоочищения водоема может происходить выход
дионуклидов в условиях пресноводных водоемов
ряда радионуклидов за счет взмучивания илистых
с учетом растворимости их форм и способности
частиц или в случае небольшой глубины окисления
сорбироваться в донных отложениях. На основа-
илистых осадков. Создание оптимальных
нии ряда факторов, включающих радиотоксичность
концентраций биогенных элементов (P/N) и
изотопа, его период полураспада, способность со-
микроэлементов и увеличение интенсивности
рбироваться на твердом веществе и аккумуляцию
седиментации клеток может заметно сократить
в водных объектах (риск попадания в пищевые це-
продолжительность
самоочищения
водоема
почки), предложена оценка опасности основных ра-
и увеличить эффективность иммобилизации
дионуклидов, актуальных для пресноводных водо-
радионуклидов. При этом радионуклиды в донных
емов. На основании данного подхода максимально
отложениях перейдут в минерализованные
опасными для объектов окружающей среды могут
немобильные формы в окружении восстановленных
быть 129I, 237Np, 226Ra и 79Se, обладающие высокой
форм минералов, образующих анаэробную зону.
РАДИОХИМИЯ том 64 № 2 2022
130
САФОНОВ и др.
Рис. 3. Схема накопления радионуклидов донными отложениями с участием альгопланктона (модифицировано из работы [67]).
Это позволит избежать вертикальной миграции
СПИСОК ЛИТЕРАТУРЫ
радионуклидов в случае выхода в водную фазу и их
попадание в нижележащие водоносные горизонты.
1. Hu Q.H., Weng J.Q., Wang J.S. // J. Environ. Radioact.
Использование подобных подходов является
2010. Vol. 101, N 6. P. 426-437.
перспективным для консервации и окончательной
2.
Трапезников А.В. // Академия наук. 2010. С. 510. //
ремедиации водоемов-хранилищ РАО и прудов
60Co, 90Sr, 137Cs и 239,240 Pu в пресноводных
со значительным уровнем радиоактивного
экосистемах //Екатеринбург: Академия наук. 2010.
загрязнения, например, ТКВ.
С. 510.
3.
Mokrov Y., Glagolenko Y., Napier B. // Health Phys.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
2000. Vol. 79, N 1. P. 15-23.
4.
Kuwabara J., Yamamoto M., Oikawa S., Komura K.,
Настоящая статья не содержит каких-либо ис-
Assinder D.J. // J. Radioanal. Nucl. Chem.
1999.
следований с использованием животных в качестве
Vol. 240, N 2. P. 593-601.
объектов.
5.
Alvarez R. // Sci. Global Secur. 2005. Vol. 13. P. 43-86.
КОНФЛИКТ ИНТЕРЕСОВ
6.
Алексахин Р.М., Булдаков Л.А., Губанов В.А.,
Дрожко Е.Г., Ильин Л.А., Крышев И.И., Линге И.И.,
Авторы заявляют об отсутствии конфликта ин-
Романов Г.Н., Савкин М.Н., Сауров М.М.,
тересов.
Тихомиров Ф.А., Холина Ю.Б. Крупные радиацион-
РАДИОХИМИЯ том 64 № 2 2022
РОЛЬ ФИТОПЛАНКТОНА В САМООЧИЩЕНИИ ВОДОЕМОВ
131
ные аварии: последствия и защитные меры. 2001.
21. Traexler K.A., Utsunomiya S., Kersting A.B.,
752 с.
Ewing R.C. // MRS Online Proc. Library Arch. 2003.
7.
Novikov A.P., Kalmykov S.N., Utsunomiya S., Ewing R.C.,
Vol. 807. P. 206-211.
Horreard F., Merkulov A., Clark S.B., Tkachev V.V.,
Myasoedov B.F. // Science. 2006. Vol. 314, N 5799.
22. Boguslavsky A.E., Gaskova O.L., Naymushina O.S.,
P. 638-641.
Popova N.M., Safonov A.V. // Appl. Geochem. 2020.
Vol. 119. ID 104598.
8.
Казаков С.В., Киселев В.П., Крылов А.Л. // Тр. ИБРАЭ
РАН. Вопр. радиоэкологии. 2009. № 11. С. 241-285.
23. Safonov A.V., Perepelov A.V., Babich T.L., Popova N.M.,
9.
Моисеенко Т.И., Гашев С.Н. // Вестн. Тюменск. гос.
Grouzdev D.S., Filatov A.V., Shashkov A.S., Demina L.I.,
Nazina T.N. // Int. J. Biol. Macromol. 2020. Vol. 165.
ун-та. Сер.: Экология. 2012. № 12. С. 17-27.
P. 2197-2204.
10. German K.E., Firsova E.V., Peretrukhin V.F.,
Khizhnyak T.V., Simonoff M. // Radiochemistry. 2003.
24. Wood B.J., Blundy J.D. // Treatise on Geochemistry.
Vol. 45. P. 250-256.
Elsevier, 2014. 2nd ed. Vol. 3. P. 421-448.
11. Matishov D.G., Matishov G.G.//Transfer and assimilation
25. Комов В.Т. Курс лекций. Вектор-Тис, 2007. 112 с.
of radionuclides in marine ecosystems // Radioecology
26. Corrigall R. // Brit. Inst. Radiol. 2001. Vol 77. N 916.
in Northern European Seas. 2004. P. 267-283.
27. Balonov M., Barnett C.L., Belli M., Beresford N.A.,
12. Меньших Т.Б., Никитина Л.В., Ровный С.И.,
Berkovsky V., Bossew P., Boyer P.B., Brittain J.E.,
Болсуновский А.Я. // Вопр. радиац. безопасности.
Calmon P., Carini F. // Tech. Rep. 2010. N 472.
2005. Т. 39, № 3. С. 71-76.
28. Rameshkumar S., Radhakrishnan K., Aanand S.,
13. Гусева В.П., Чеботина М.Я., Трапезников А.В. //
Rajaram R. // Appl. Water Sci. 2019. Vol. 9. P. 12.
Вопр. радиац. безопасности. 2006. № 4. С. 70-75.
14. Kumar K.S., Dahms H.U., Won E.J., Lee J.S., Shin K.H. //
29. Евтушенко Н.Ю., Кузьменко М.И., Сиренко Л.А. //
Ecotoxicol. Environ. Safety. 2015. Vol. 113. P. 329-352.
Гидроэкологические последствия аварии на
Чернобыльской АЭС.//Киев: Наук. думка,
1992.
15. Shimizu Y. // Curr. Opin. Microbiol. 2003. N 6. P. 236-
C. 267.
243.
30. Ярушина М.И., Гусева В.П., Чеботина М.Я.
//
Экология. 2003. № 1. С. 23-29.
16. Левина С.Г. Закономерности поведения 90Sr и 137Cs
31. Гусева В.П. Планктон и его роль в миграции ради-
в озерных экосистемах Восточно-Уральского радио-
онуклидов в водоеме-охладителе Белоярской АЭС:
активного следа в отдаленные сроки после аварии:
Автореф. дис. … к.биол.н. 2000. С. 16.
Автореф. дис. … д.биол.н. 2007. 48 с.
32. Духовная Н.И., Осипов Д.И., Тряпицына Г.А.,
17. Гудков Д.И., Назаров А.Б., Кулачинский А.В., Зуб Л.Н.,
Пряхин Е.А. // Вопр. радиац. безопасности. 2011.
Каглян А.Е., Машина В.П. // Сахаровские чтения
№ 4. С. 24-36.
2005 года: экологические проблемы XXI века: Матер.
33. Пряхин Е.А., Тряпицына Г.А., Атаманюк Н.И. //
5-й междунар. научной конф., 20-21 мая 2005 г.,
Радиац. биология. Радиоэкология. 2012. Т. 52, № 4.
Минск, Республика Беларусь / Под ред. С.П. Кундаса,
С. 419-427.
А.Е. Океанова, В.Е. Шевчука. Минск, 2005. Ч. 2.
34. Пряхин Е.А., Тряпицына Г.А., Осипов Д.И.,
312 с.
Атаманюк Н.И., Шапошникова И.А., Егорей-
18. Berg J.S., Jézéquel D., Duverger A., Lamy D., Laberty-
ченков Е.А., Стяжкина Е.В., Могильникова Н.И.,
Robert C., Miot J. // PLoS ONE. 2019. Vol. 14, N 2.
Андреев С.С., Шишкина Е.А., Перетыкин А.А.,
P. 21.
Алдибекова А.Е., Тюхай М.В., Трапезников А.В.,
Иванов И.А., Тарасов О.В., Мокров Ю.Г., Аклеев А.В. //
19. Дрожко Е.Г., Стукалов П.М., Алексахин А.И.,
Вопр. радиац. безопасности. 2018. № 4. С. 71-79.
Иванов И.А., Симкина Н.А. // Вопр. радиац. безопас-
35. Смагин А.И. Экология водоемов зоны техногенной
ности. 2006. № 4. С. 22-32.
радиационной аномалии на Южном Урале: Автореф.
20. Zinicovscaia I., Safonov A., Zelenina D., Ershova Y.,
дис. … д.биол.н. 2008. C. 50.
Boldyrev K. // Algal Res. 2020. Vol. 51. ID 102075.
36. Бондарева Л. // Радиохимия. 2012. Т. 54. № 1. С. 91-
96.
РАДИОХИМИЯ том 64 № 2 2022
132
САФОНОВ и др.
37. Ракитский В.Н., Бондарева Л.Г., Федорова Н.Е. //
52. Park E., Choi J. // Biotechnol. Bioprocess Eng. 2018.
Научное обоснование закономерностей и механиз-
Vol. 23. P. 704-709.
мов антропогенного воздействия на биоценоз прес-
новодной экосистемы.//Красноярск: Сибирский фе-
53. Shin R., Adams E. // Impact of Cesium on Plants and the
деральный университет 2020. С. 236.
Environment. 2017. P. 101-124.
38. Zotina T., Koster O., Juttner F. // Freshwater Biol. 2003.
Vol. 48. N 10.
54. Hussein G., Sankawa U., Goto H., Matsumoto K.,
Watanabe H. // J. Natural Prod. 2006. Vol. 69. № 3.
39. Zotina T.A., Bolsunovsky A.Y., Bondareva L.G.
//
P. 443-449.
J. Environ. Radioact. 2009. Vol. 101, N 2. P. 148-152.
40. Zotina T., Dementyev D., Alexandrova Y. // J. Environ.
55. Lee K.Y., Lee S.H., Lee J.E., Lee S.Y. // J. Environ.
Radioact. 2021. Vol. 227. ID 106461.
Manag. 2019. Vol. 233. P. 83-88.
41. Zotina T., Kalacheva G., Bolsunovsky A. // J. Radioanal.
56. Krejci M.R., Finney L., Vogt S., Joester D.
//
Nucl. Chem. 2011. Vol. 290, N 2. P. 447-451.
ChemSusChem. 2011. Vol. 4, N 4. P. 470-473.
42. Aleissa K., Shabana E.S., Almasoud F.I. // J. Radioanal.
57. Lee S.Y., Jung K.H., Lee J.E., Lee K.A., Lee S.H.,
Nucl. Chem. 2004. Vol. 260, N 3. P. 683-687.
Lee J.Y., Lee J.K., Jeong J.T., Lee S.Y. // Bioresource
Technol. 2014. Vol. 172. P. 449-452.
43. Jha V.N., Tripathi R.M., Sethy N.K., Sahoo S.K. // Sci.
Total Environ. 2016. Vol. 539. P. 175-184.
58. Bondareva L. // Fusion Sci. Technol. 2011. Vol. 60. N 4.
P. 1304-1307.
44. Langley S., Beveridge T.J. // Appl. Environ. Microbiol.
1999. Vol. 65, N 2. P. 489-498.
59. Dushenkov S. // Plant Soil. 2003. Vol. 249. P. 167-175.
45. Vrionis H., Anderson R., Ortiz-Bernad I., O’Neill K.,
60. Lasat M.M., Fuhrmann M., Ebbs S.D., Cornish J.E.,
Resch C., Peacock A., Dayvault R., White D., Long P.,
Kochian L.V. // J. Environ. Qual. 1998. Vol. 27. N 1.
Lovley D. // Appl. Environ. Microbiol. 2005. Vol. 71.
P. 165-169.
P. 6308-6318.
61. Yan L., Van Le Q., Sonne C., Yang Y., Yang H, Gu H.,
46. Марчюленене Е.Д. Взаимодействие радионукли-
Ma N.L., Lam S.S., Peng W. // J. Hazard. Mater. 2021.
дов с гидрофитами в пресноводных экосистемах:
Vol. 407.
Автореф. дис. … д.биол.н. 1994. 113 с.
47. Kim I., Yang H.M., Park C.W., Yoon I.H., Seo B.K.,
62. Kalin M., Wheeler W.N., Meinrath G. // J. Environ.
Kim E.K., Ryu B.G. // Sci. Rep. 2019. Vol. 9. ID 10149.
Radioact. 2005. Vol. 78. N 2. P. 151-177.
48. Fukuda S.Y., Iwamoto K., Atsumi M., Yokoyama A.,
63. Iwamoto K., Minoda A. // Algae, Intech Open. 2018.
Nakayama T., Ishida K., Inouye I., Shiraiwa Y. // J. Plant
Res. 2014. Vol. 127, N 1. P. 79-89.
64. Yamamoto T., Goto I., Kawaguchi O., Minagawa K.,
Ariyoshi E., Matsuda O. // Marine Pollut. Bull. 2008.
49. Rivasseau C., Farhi E., Gromova M., Ollivier J.,
Vol. 57. P. 108-115.
Bligny R. // Spectroscopy. 2010. Vol. 24. P. 381-385.
65. Zalewska T., Saniewski M. // Oceanologia. 2011. Vol. 53.
50. Rivasseau C., Farhi E., Compagnon E., Saint Cyr D.G.,
N 2. P. 631-650.
Van Lis R., Falconet D., Kuntz M., Atteia A., Couté A. //
J. Phycol. 2016 Vol. 52. N 5. P. 689-703.
66. German K.E., Safonov A.V., Zelenina D.A.,
Sitanskaya A.V., Boldyrev K.A., Belova E.V. // J. Environ.
51. Rivasseau C., Farhi E., Atteia A., Couté A., Gromova M.,
Radioact. 2021. Vol. 237. ID 106716.
Saint Cyr D.G., Boisson A.M., Féret A.S., Compagnon E.,
Bligny R. // Energy Environ. Sci. 2013. N 6. P. 1230-
67. Meyer J.S., Davidson W., Sundby B., Oris J.T. //
1239.
Bioavailability—Physical, Chemical, and Biological
Interactions. CRC, 1993. P. 155-170.
РАДИОХИМИЯ том 64 № 2 2022