РАДИОХИМИЯ, 2023, том 65, № 1, с. 83-88
УДК 541.11:542.61:544.54
ЭКЗОТЕРМИЧЕСКИЕ ПРОЦЕССЫ
В АЗОТНОКИСЛЫХ РАСТВОРАХ, СОДЕРЖАЩИХ
АЦЕТОГИДРОКСАМОВУЮ КИСЛОТУ
© 2023 г. Е. В. Белова*, Е. Р. Назин, В. В. Калистратова, А. С. Объедков
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
*e-mail: bl174@bk.ru
Поступила в редакцию 26.05.2022, после доработки 29.11.2022, принята к публикации 30.11.2022
Исследована термическая стабильность растворов
5-12 моль/л HNO3, содержащих
5-50 г/л
ацетогидроксамовой кислоты, при атмосферном давлении и давлении выше атмосферного. Установлено,
что в растворах при температурах ниже температуры кипения протекают слабые экзотермические
процессы окисления, сопровождающиеся газовыделением. На основе полученных характеристик
экзотермических процессов анализируется вопрос взрывобезопасности при упаривании азотнокислых
растворов, содержащих ацетогидроксамовую кислоту.
Ключевые слова: ацетогидроксамовая кислота, азотная кислота, термическая стабильность, параметры
экзотермических процессов, взрывобезопасность.
DOI: 10.31857/S0033831123010112, EDN: OHRIKM
ВВЕДЕНИЕ
ции азотной кислоты. Разложение раствора с выде-
лением газов может происходить в срок от 1-2 мин
Ацетогидроксамовая кислота (АГК) использует-
до десятков минут [8, 9]. В первом случае возника-
ся в технологических операциях при переработке
ет избыточное давление, воздействующее на стенки
отработавшего ядерного топлива (ОЯТ) АЭС для
сосуда, во втором случае выделяющиеся газы будут
восстановления и комплексообразования плутония
удаляться из зоны реакции, не создавая избыточно-
и нептуния и уменьшения их перехода в органиче-
го давления. Для оценки взрывобезопасности необ-
скую фазу [1-7]. АГК гидролизуется в азотнокис-
ходима информация о термохимической стабиль-
лом растворе до уксусной кислоты и гидроксилами-
ности смесей восстановителей с окислителями [10]
на со скоростью, зависящей от концентрации кис-
в широком интервале концентраций, в том числе
лоты [8, 9].
скорость газовыделения W, удельный объем выде-
3CH3CONHOH + H2O + H+ →
лившихся газов Vуд, стартовая (критическая) тем-
→ CH3COOH + NH3OH+
(1)
пература теплового взрыва (Tкр) и/или температура
начала экзотермической реакции Тэкз.
Азотнокислые растворы АГК, как и все смеси
В совокупности данные характеристики позво-
органических соединений с азотной кислотой, в
лят установить безопасные параметры проведения
определенных условиях способны к интенсивному
технологических операций. Показатели термиче-
экзотермическому разложению (тепловому взрыву)
и могут быть взрывоопасными. На предприятиях по
ской устойчивости (W, Tкр, Тэкз) определяются толь-
переработке ОЯТ азотнокислые растворы восстано-
ко экспериментально в регламентных условиях и
вителей упаривают в больших объемах. Скорость
при отклонении от них. Цель работы - получение
разложения АГК при температурах упаривания
информации об условиях возникновения и характе-
(90-110°C) зависит от её содержания и концентра-
ристиках потенциально взрывоопасных экзотерми-
83
84
БЕЛОВА и др.
120
100
всех растворах имел место избыток HNO3 по срав-
2
нению со стехиометрией. Опыты проводили при за-
80
100
данной температуре термостата 150°C. Время тер-
60
молиза в экспериментах - 5 ч. Погрешность опре-
80
1
деления давления 5%.
40
60
20
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
40
0
Термическая стабильность при атмосферном
-20
давлении. Эксперименты показали, что при опре-
200
20
40
60
80
100
деленной (критической) температуре (Ткр) начина-
Время, мин
ется экзотермическая реакция, сопровождающаяся
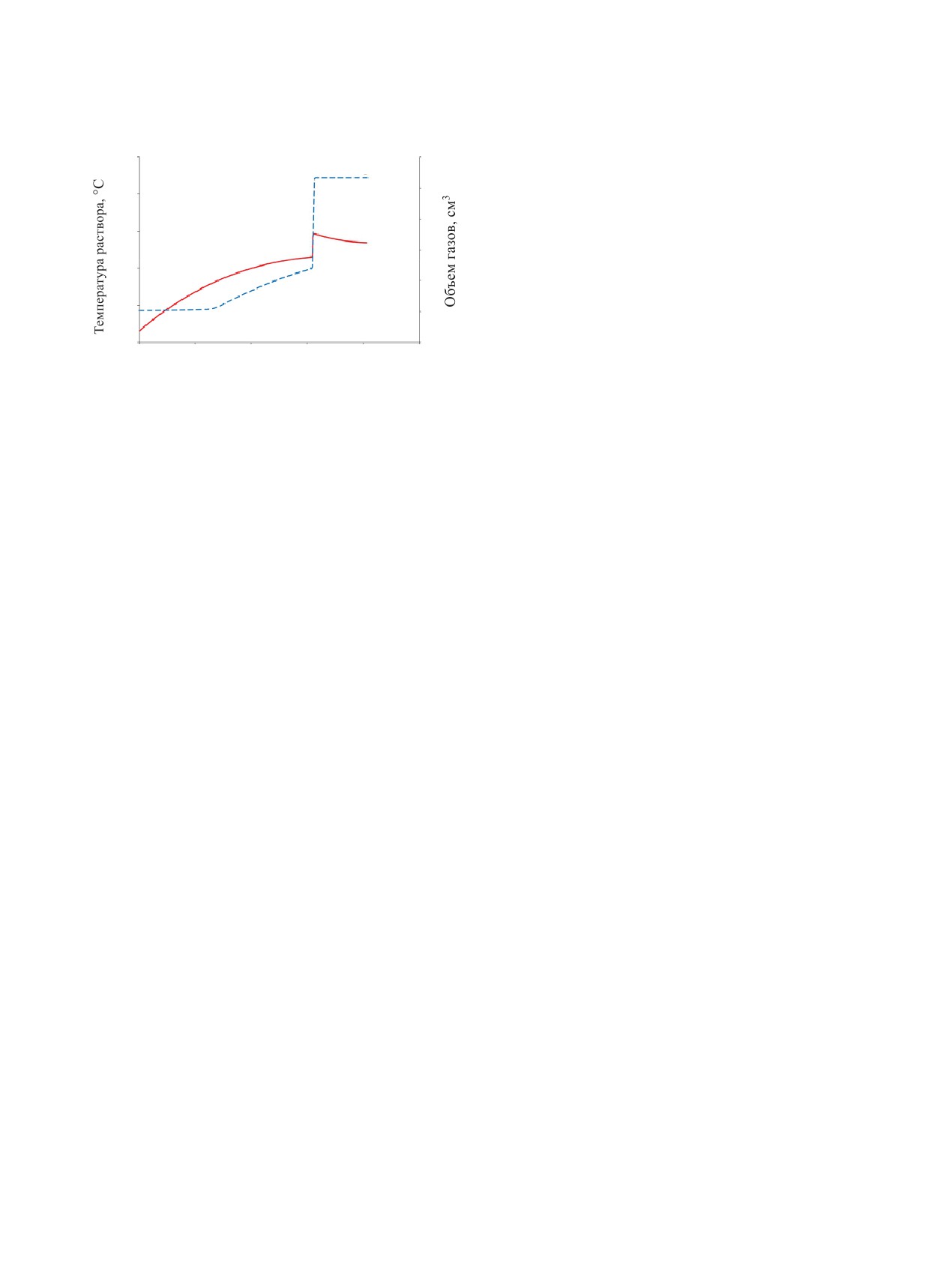
Рис. 1. Динамика изменения температуры раствора (1) и
объема выделяющихся газов (2) при нагревании раство-
скачком температуры раствора и газовыделения.
ра.
Характер процессов при температуре термостата
70°C представлен на рис. 1. В интервале 50-60°C
ческих процессов в азотнокислых растворах, содер-
одновременно с ростом температуры происходит
жащих АГК.
равномерное газовыделение. По достижении 65°C
в течение примерно 10 c температура раствора воз-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
растает и резко увеличивается объем газообразных
продуктов экзотермической реакции. После завер-
Оценку термической стабильности растворов
шения экзотермической реакции выделение газов
при атмосферном давлении проводили волюмоме-
прекращается. Результаты экспериментов сведены
трическим способом в пробирках объемом 20 см3,
в табл. 1.
нагреваемых в воздушном термостате по мето-
Важно отметить, что экзотермическая реакция
дике [11]. Температуру растворов измеряли хро-
между компонентами раствора при атмосферном
мель-копелевой термопарой в защитной оболочке.
давлении возникает при температуре ниже темпе-
Количество выделяющихся газов оценивали по
ратуры кипения раствора. Реакция возникает вне-
массе вытесненной воды с помощью автоматиче-
запно, протекает быстро, но величина саморазо-
ских весов, при этом в реакционном сосуде не соз-
грева ΔТ и увеличение объема выделившихся газов
давалось избыточного давления. Нагрев проводили
невелики, что свидетельствует о невысокой интен-
при температурах 60-110°C в воздушном термо-
сивности экзотермических реакций. Если предпо-
стате, оборудованном теплоизолированными на-
ложить, что все выделяющееся в реакции тепло
гревателями - донным, боковыми и встроенным в
(или его большая часть) идет на нагрев раствора
крышку, которые подключены к цифровому блоку
на величину ΔТ по формуле Q = mсΔТ, то можно
управления термостатом. Время термолиза в экспе-
оценить тепловой эффект экзотермических реак-
риментах - 5 ч. Объем образцов раствора стехио-
ций в растворе. Для исследуемого раствора 50 г/л
метрического состава 50 г/л АГК в 12 моль/л HNO3
АГК в 12 моль/л НNО3 (удельная теплоемкость
составил 10 см3. Определяли температуру, при ко-
Ср = 0.7 кал/(г·град)) в количестве 10 см3 (12 г)
торой возникают экзотермические процессы, ско-
максимальные расчетные величины Q и V состав-
рость газовыделения и объем выделяющихся газов.
ляют соответственно 3276 Дж и 0.507 л газов [12].
Эксперименты при повышенном давлении про-
Максимальное выделение тепла и газов при окисле-
водили в автоклаве объемом 300 см3, нагреваемом
нии АГК азотной кислотой происходит при стехио-
в воздушном термостате, с измерением темпера-
метрическом соотношении компонентов:
туры растворов и давления в автоклаве. Схема ав-
С2Н5NO2 + 1.8НNO3 = 2СО2 + 3.4Н2О +
токлава и описание методики даны в работе [11].
+ 1.4N2 + 117.3 ккал (491.5 кДж),
(2)
Исследовали растворы азотной кислоты с концен-
трацией от 5 до 12 моль/л, содержащие от 5 до
на 1 г АГК выделяется 1.564 ккал тепла (6.55 кДж)
40 г/л АГК, объем образцов составлял 30 см3. Во
и 1.015 л неконденсируемых газов.
РАДИОХИМИЯ том 65 № 1 2023
ЭКЗОТЕРМИЧЕСКИЕ ПРОЦЕССЫ В АЗОТНОКИСЛЫХ Р
АСТВОРАХ
85
Таблица 1. Характеристики экзотермического процесса при различных температурах внешнего нагрева азотнокис-
лого раствора АГК
Величина
Продолжительность
Температура
Индукционный
Ткр, °C
саморазогрева
экзотермического
V, л
термостата, °C
период, мин
(ΔТ),°C
процесса (t), мин
60
58
10
75
2.45
0.079
65
65
14
31
1
0.092
70
65
13
61
< 1
0.057
90
78
11
35
< 1
0.075
95
76
14
35
< 1
0.108
110
78
10
25
< 1
0.080
Таблица 2. Значения тепловых эффектов реакции в зависимости от температуры термостата
Температура
Qэкс, Дж
Qуд.экс, Дж/г
Qэкс/Qмакс, %
Vэкс, л
Vэкс/Vмакс, %
термостата,°C
60
452
32.3
13.8
0.079
15.6
65
574
41.0
17.5
0.092
18.1
70
532
38.0
16.2
0.057
11.2
90
452
32.3
13.8
0.075
14.8
95
574
41.0
17.5
0.108
21.3
110
410
29.3
12.5
0.080
15.8
В табл. 2 приведены результаты этих эксперимен-
Для всех составов смесей экзотермические про-
тов, где Qэкс - величина тепловыделения, рассчитан-
цессы происходят в температурном интервале от 75
ная по экспериментальным данным; Qуд.экс - удель-
до 81°C (Ткр), что ниже температуры интенсивного
ное тепловыделение в расчете на грамм раствора;
разложения азотной кислоты. Интенсивность эк-
Qмакс - величина тепловыделения, рассчитанная для
зотермических реакций снижается с уменьшением
раствора стехиометрического состава; Vэкс - объем
концентрации НNО3 или содержания АГК в рас-
газообразных продуктов, выделившихся при экспе-
творе. Эксперименты показали, что растворы с 5 и
рименте; Vмакс - рассчитанный объем газообразных
8 моль/л НNО3 при концентрации АГК менее 10 г/л
продуктов для раствора стехиометрического соста-
не могут представлять опасность в отношении ин-
ва.
тенсивного газовыделения (рис. 3).
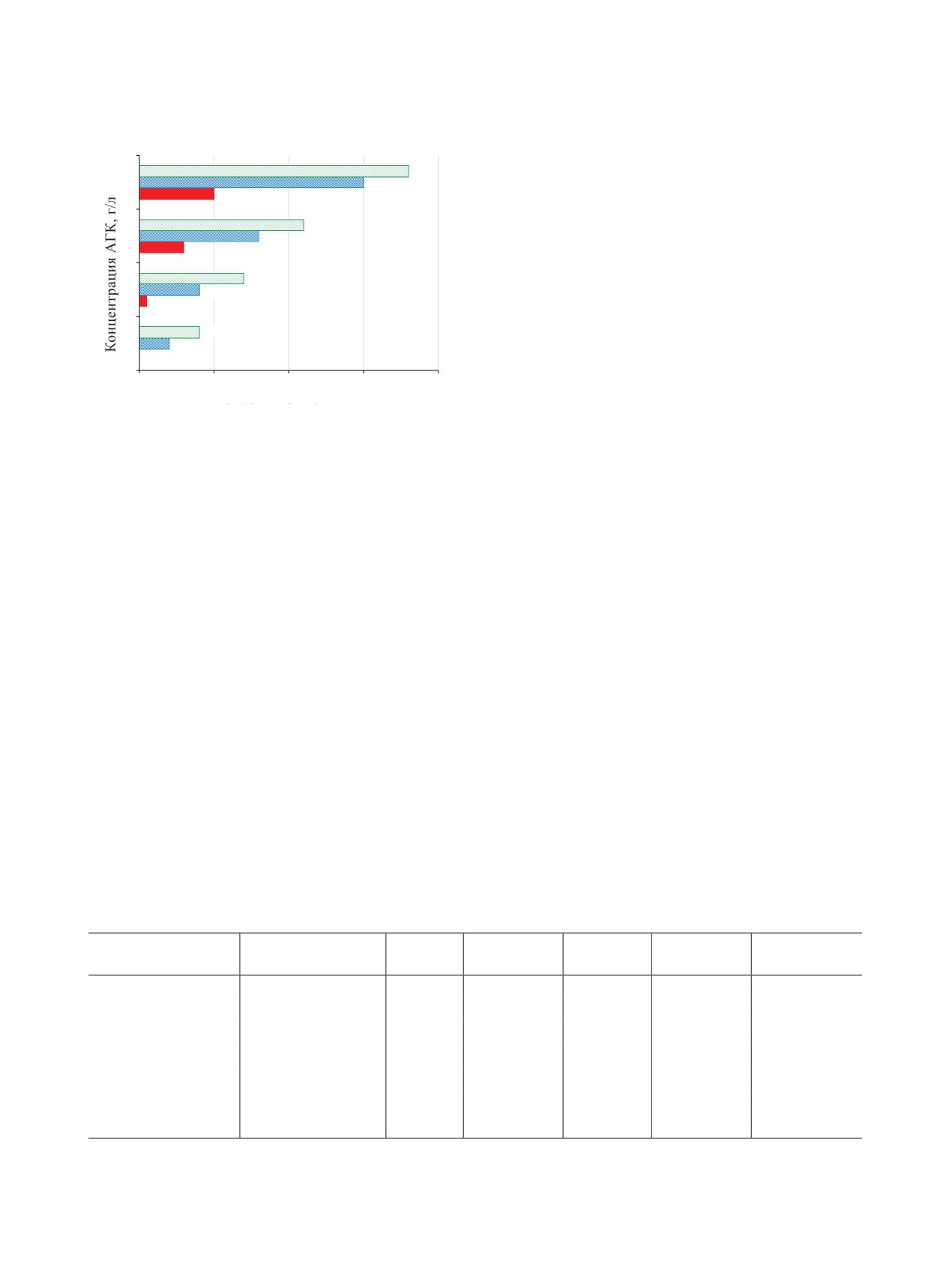
Как видно из экспериментальных данных, для
120
20
нагрева раствора на величину ΔТ требуется от
100
17.5
410 до 574 Дж тепловой энергии, что составляет
1
12.5-17.5% от максимальной расчетной величины.
15
80
Неконденсируемых газообразных продуктов реак-
12.5
60
ции выделяется от 11 до 21% от расчетной величи-
2
10
ны.
40
7.5
Термическая стабильность растворов при
20
5
давлении выше атмосферного. В закрытом сосу-
0
2.5
де также наблюдали экзотермическую реакцию при
2000
2200
2400
2600
2800
температурах ниже 100°C, а именно при 73-80°C.
Время, с
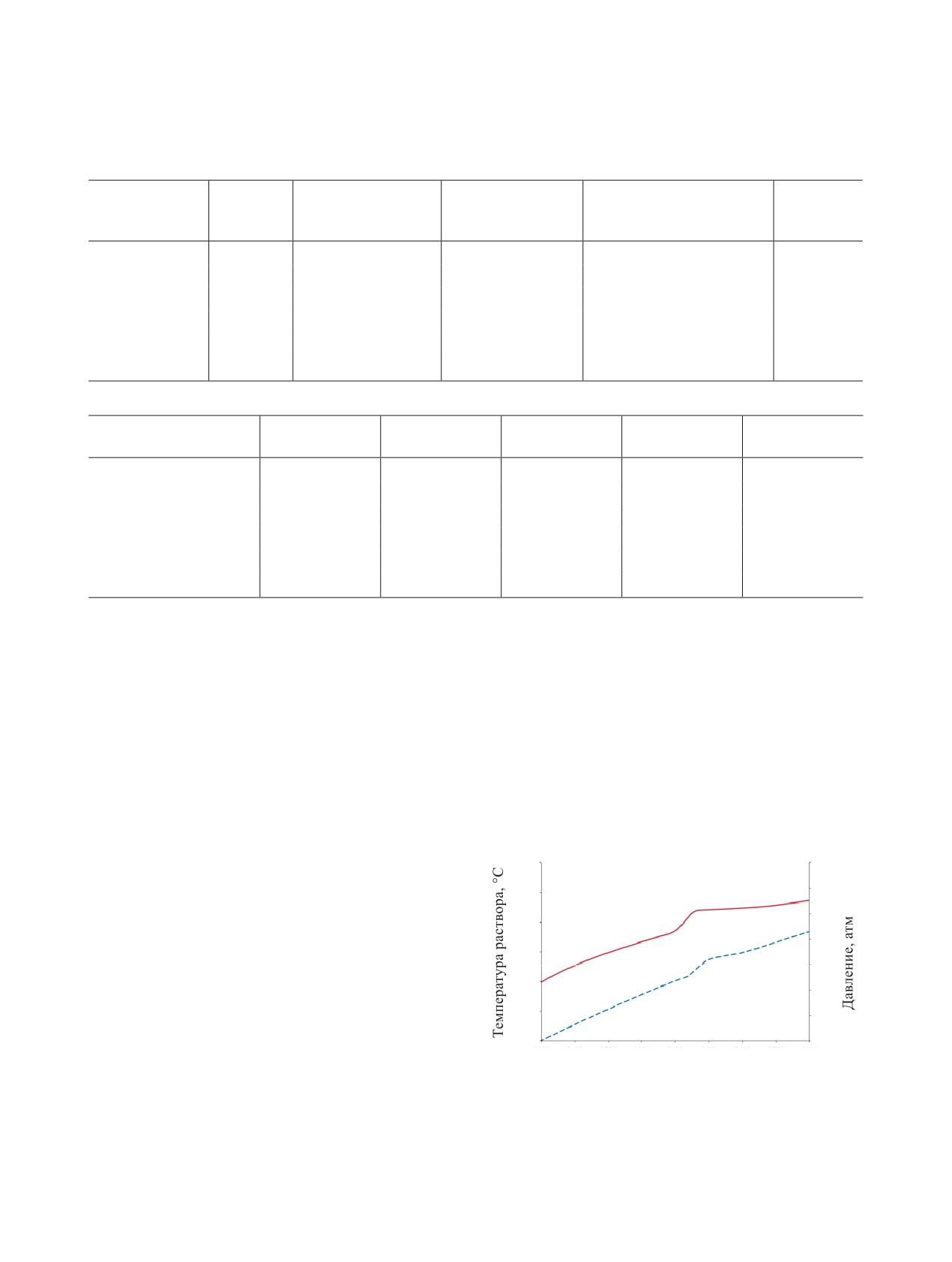
Характер взаимодействия компонентов раство-
Рис. 2. Динамика изменения температуры раствора (1)
ров при нагреве в закрытом сосуде представлен на
и давления в сосуде (2) при нагреве 8 моль/л HNO3,
рис. 2.
содержащей 40 г/л АГК.
РАДИОХИМИЯ том 65 № 1 2023
86
БЕЛОВА и др.
В закрытом сосуде тепловыделение за счет экзо-
3
термических реакций составляет в среднем 26% от
40
2
1
максимального; это больше, чем при атмосферном
давлении. Этот факт объясняется более высоким
3
20
2
содержанием в растворах основного окислителя -
1
диоксида азота, так как в открытом сосуде потери
3
оксидов азота при нагреве азотнокислых растворов
10
2
весьма значительны.
1
Расчетные и экспериментальные величины са-
3
5
моразогрева (ΔТ) и теплового эффекта (Q) снижа-
2
ются с уменьшением концентрации НNО3 и АГК до
0
5
10
15
20
весьма низких значений. Таким образом, при разо-
Температура саморазогрева (ΔТ), °C
греве на 2-3°C экзотермическая реакция практиче-
Рис. 3. Зависимость величины саморазогрева смеси (ΔТ)
ски не представляет опасности создания в аппара-
от концентраций компонентов в условиях закрытого ап-
тах больших избыточных давлений.
парата.
Величины тепловыделения в растворах, имити-
Для малоинтенсивных реакций время от нача-
рующие начальные стадии упаривания, экспери-
ла экзотермических реакций и до их завершения
ментально определяли методом дифференциальной
сканирующей калориметрии (ДСК-500, изготови-
не превышает 3 мин, а в растворах с 8-12 моль/л
тель СамГТУ) [13]. Аликвоту растворов (табл. 4)
HNO3 составляет несколько десятков секунд.
объемом 10 мкл нагревали в стальном герметичном
2
Максимальное повышение давления в автоклаве за
тигле со скоростью 5 К/мин в температурном ин-
счет экзотермической реакции составило 2 атм и
тервале 50-250°C. Во всех исследованных раство-
получено для раствора 12 моль/л HNO3, содержа-
рах имели место экзотермические реакции, вели-
щего 40 г/л АГК, что свидетельствует о небольшом
чины тепловыделения в растворах и температуры
количестве газообразных продуктов. Максимальная
начала экзотермических реакций представлены в
скорость газовыделения для этого раствора соста-
табл. 4 и на рис. 4.
вила 54.5 л/(мин·л). По характеру и параметрам
Как видно из результатов экспериментов, даже
экзотермическая реакция в закрытом сосуде ана-
при невысоких концентрациях азотной кислоты 1.6
и 3.2 моль/л имеет место экзотермическая реакция
логична реакции в открытом сосуде, но протекает
с заметным тепловыделением, сопоставимым с ве-
интенсивнее.
личинами, представленными в табл. 2. При этом
В табл. 3 приведены расчетные и эксперимен-
температура начала экзотермической реакции (Ткр)
тальные данные по тепловыделению при протека-
раствора с 3.2 моль/л НNО3 ниже температуры его
нии экзотермических реакций в закрытом сосуде.
кипения.
Таблица 3. Экспериментальные и расчетные значения тепловых эффектов экзотермической реакции для разных
концентраций НNО3 и АГК
Концентрация
Содержание АГК,
Qэкс, Дж
Qуд.экс, Дж/г
Qрасч, Дж
Qуд.расч, Дж/г
Qэкс/Qрасч, %
НNО3, моль/л
г/л
12
40
2203
53.8
7864
188
28
20
1327
32.2
3934
95.6
33.7
8
40
1827
47.1
7864
202
23.2
20
959
25.1
3934
103
24.4
10
476
12.5
2061
54
23.1
5
237
6.3
1030
27
23.0
5
20
1030
29
3932
110
26.2
РАДИОХИМИЯ том 65 № 1 2023
ЭКЗОТЕРМИЧЕСКИЕ ПРОЦЕССЫ В АЗОТНОКИСЛЫХ Р
АСТВОРАХ
87
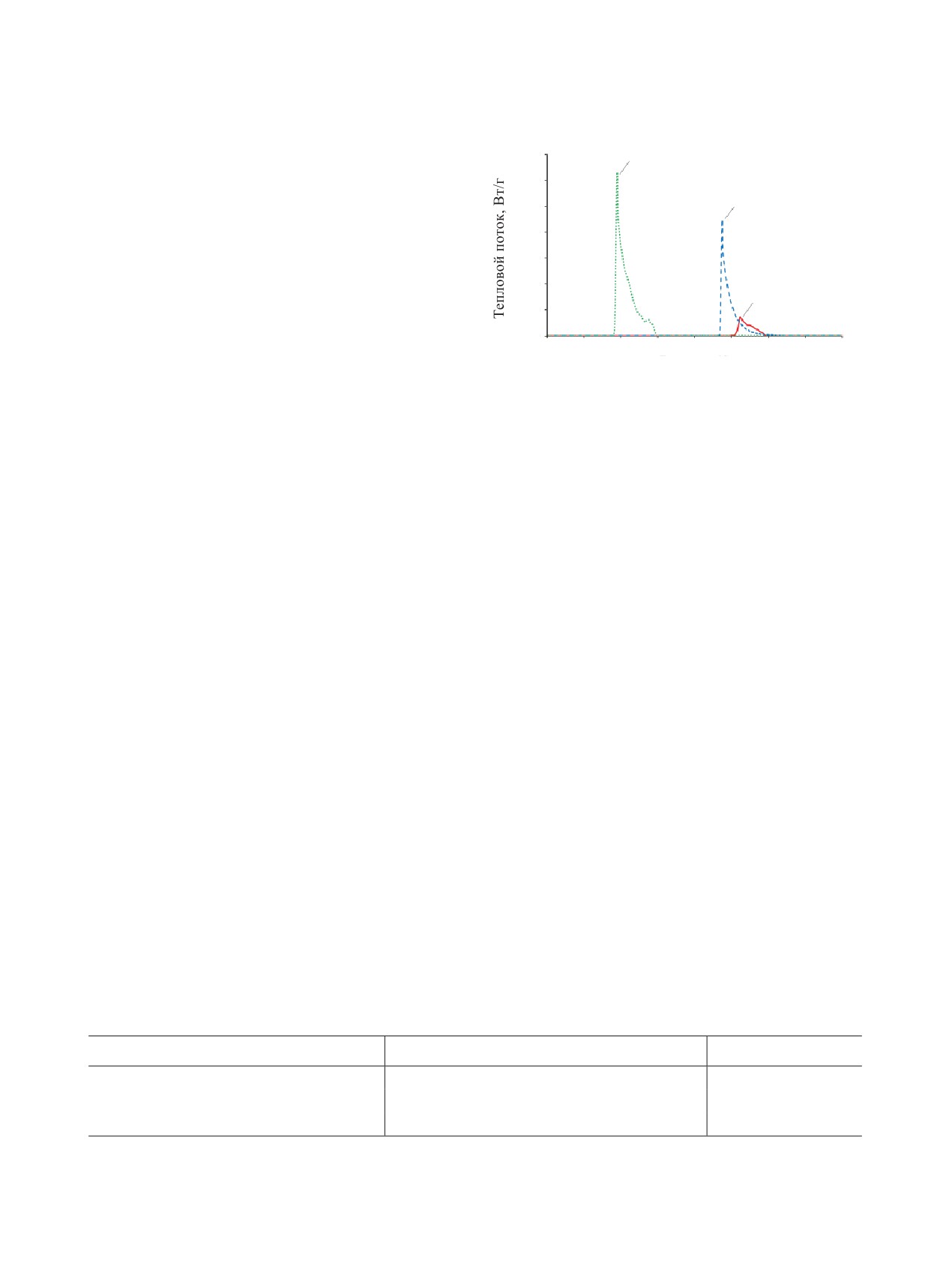
Эксперименты позволили установить, что эк-
0.70
3
зотермические процессы в растворах возникают
0.60
при нагревании их до температур ниже темпера-
0.50
2
тур кипения растворов. Это значит, что они воз-
0.40
можны в открытых аппаратах. В экспериментах
при атмосферном давлении использовали раство-
0.30
ры стехиометрического состава [реакция (2)]. По
0.20
расчету, максимальное выделение тепла при окис-
1
0.10
лении 0.5 г АГК, содержащегося в 10 мл раствора,
должно составлять 3276 Дж с выделением 0.507
0.00
40
60
80
100
120
140
160
180
200
л газов. По экспериментальным данным, количе-
Температура, °C
ство тепла, идущего на нагрев раствора на величи-
Рис. 4. Зависимость теплового потока от температуры
ну ΔТ, составляет 12.5-17.5% (открытый сосуд) и
для растворов АГК при скорости нагрева 5 K/мин. Кон-
23-34% (закрытый сосуд) от расчетной величины.
центрация HNO3, моль/л: 1 - 0.8, 2 - 1.6, 3 - 3.2.
Неконденсируемых газообразных продуктов реак-
ции выделяется от 11 до 21% расчетной величины
ганическими веществами величина саморазогрева
(открытый сосуд). Таким образом, тепло- и газовы-
за счет экзотермической реакции составит около
деление за счет экзотермической реакции окисле-
100°C. Как видно из табл. 2 и 3, расчетные вели-
ния в растворах значительно ниже рассчитанных
чины максимальных тепловых эффектов и само-
для стехиометрического состава.
разогрева существенно ниже этого критерия, поэ-
Причиной этого могут быть различные факторы:
тому экзотермические процессы в исследованных
в растворах не реализуется полное окисление АГК,
азотнокислых растворах АГК не следует считать
или реакция начинается при концентрации NО2 с
тепловыми взрывами. Однако значительные коли-
дефицитом окислителя, или при повышенной тем-
чества газообразных продуктов и высокие скорости
пературе идет гидролиз АГК с образованием уксус-
их выделения на стадии упаривания азотнокислых
ной кислоты, которая экзотермически не реагирует
растворов не исключают возникновение в аппара-
с НNО3 при температуре до 100°C. Механизм взаи-
тах избыточного давления в случае возникновения
модействия АГК с растворами азотной кислоты не
в них экзотермических процессов. Величины избы-
является предметом изучения в данной работе, он
точного давления зависят от концентрации компо-
требует специального исследования с анализом га-
нентов растворов, объема растворов, величин сво-
зовой и конденсированной фаз.
бодного объема аппаратов и должны оцениваться
Полученные в экспериментах и расчетах данные
для каждого конкретного случая.
свидетельствуют о том, что экзотермические про-
цессы окисления в растворах возможны с невысо-
ЗАКЛЮЧЕНИЕ
кими тепловыми эффектами и при слабом газовы-
делении. В работах [14, 15] дана информация о ве-
Исследования показали, что растворы АГК в
ществах и материалах, относящихся к классу само-
азотной кислоте обладают невысокой термической
разлагающихся и представляющих потенциальную
стабильностью, их разложение с тепло- и газовыде-
опасность в отношении возможного развития те-
лением начинается уже при 60-80°C. Смеси АГК с
плового взрыва. Величина этого критерия 300 Дж/г
НNО3 представляют потенциально мощную взрыв-
чатую композицию, однако наличие значительных
для вещества (смеси), т.е. для смесей НNО3 с ор-
Таблица 4. Характеристики экзотермического процесса для растворов
Раствор
Удельное тепловыделение Qуд.экс, Дж/г
Ткр, °C
3 г/л АГК в 0.8 моль/л НNО3
8 ± 2%
142
6 г/л АГК в 1.6 моль/л НNО3
42 ± 2%
133
12 г/л АГК в 3.2 моль/л НNО3
68 ± 2%
76
РАДИОХИМИЯ том 65 № 1 2023
88
БЕЛОВА и др.
количеств воды снижает интенсивность вероятных
СПИСОК ЛИТЕРАТУРЫ
опасных экзотермических процессов.
1.
Chung D.Y., Lee E.H. // Bull. Korean Chem. Soc. 2005.
На основании полученных нами данных можно
Vol. 26, N 11. P. 1692.
заключить, что ниже 50-55°C азотнокислые раство-
ры, содержащие АГК, не представляют опасности в
2.
Chung D.Y., Lee E.H. // J. Ind. Eng. Chem. 2006. Vol. 12,
отношении интенсивных экзотермических процес-
N 6. P. 962.
сов с газовыделением.
3.
Tkac P., Paulenova A., Vandegrift G.F., Krebs J.F. // J.
Применительно к условиям упаривания азотно-
Radioanal. Nucl. Chem. 2009. Vol. 280, N 2. P. 339.
кислых растворов в реальных выпарных аппаратах
4.
Tkac P., Paulenova A. // Sep. Sci. Technol.
2008.
с выносной греющей камерой результаты работы
Vol. 43, N 9-10. P. 2670.
можно интерпретировать следующим образом.
5.
Taylor R.J., Sinkov S.I., Choppin G.R. // Proc. ISEC
После заполнения аппарата раствором с низкими
2008 Int. Solvent Extraction Conf. Tucson, USA, 2008.
концентрациями АГК и НNО3 и при последующем
6.
Li Z., Zhao H., Chen M., Li Q., Zhang L.
//
нагреве возникает циркуляционный поток раство-
Hydrometallurgy. 2018. Vol. 182. P. 1.
ра, в котором возрастает концентрация НNО3 и
7.
Wang J.H., Li C., Li Q., Wu M.H., Zheng W.F., He H. //
диоксида азота. После достижения температуры
Nucl. Sci. Technol. 2018. Vol. 29, N 2. P. 27.
70-80°C АГК полностью или частично реагиру-
8.
Karraker D.G. Radiation Chemistry of Acetohydroxamic
ет с окислителем. При 100-110°C вероятнее всего
Acid in the UREX Process. Savannah River Site, USA,
прореагирует основная часть АГК, причем эффект
WSRC-TR-2002-00283, 2002.
от этого процесса будет незначительным на фоне
интенсивного парового потока. При добавлении в
9.
Cao X.J., Wang J.H., Li Q., Wu M.H., Bao B.R.,
Zheng W.F., He H., Zhang S.D. // At. Energy Sci.
выпарной аппарат свежего азотнокислого раствора
Technol. 2014. Vol. 48, N 11. P. 1933.
с АГК последняя быстро разлагается. Таким обра-
зом, накопление АГК в конечной фазе упаривания
10. РБ-060-10. Положение об оценке пожаровзрывобе-
исключено, и операцию упаривания азотнокислых
зопасности технологических процессов радиохими-
растворов с исходными количествами АГК можно
ческих производств. М.: Ростехнадзор, 2010.
считать взрывобезопасной.
11. Nazin E.R., Zachinyaev G.M., Rodin A.V., Belova E.V.,
Thorzhnitsky G.P., Myasoedov B.F.// Nucl. Technol.
2016. Vol. 194, N 3.P. 369.
БЛАГОДАРНОСТИ
12. Карапетьянц М.X., Карапетьянц М.Л. Основные
Исследование проводили на оборудовании ЦКП
термодинамические константы неорганических и
ФМИ ИФХЭ РАН и УНУ КРХИ ИФХЭ РАН.
органических веществ. М.: Химия, 1968. 472 с.
13. Obedkov A.S., Kalistratova V.V., Skvortsov I.V.,
ФОНДОВАЯ ПОДДЕРЖКА
Belova E.V. // Nucl. Eng. Technol. 2022. Vol. 54, N 9.
P. 3580-3585.
Работа выполнена при финансовой поддерж-
14. Recommendation on the Transport of Dangerous Goods.
ке Министерства науки и высшего образования
Model Regulations. New York: UN, 2015. 19th ed.
Российской Федерации.
Vol. 1.
15. Guidance on the Application of the CLP Criteria.
КОНФЛИКТ ИНТЕРЕСОВ
Guidance to Regulation (EC) no.
1272/2008 on
Classification, Labeling and Packaging (CLP) of
Авторы заявляют об отсутствии конфликта ин-
Substances and Mixtures. Helsinki, Finland: European
тересов.
Chemicals Agency, 2017. Version 5.0.2017.
РАДИОХИМИЯ том 65 № 1 2023