РАДИОХИМИЯ, 2023, том 65, № 5, с. 458-465
УДК 66.092.9
ОПТИМИЗАЦИЯ СИНТЕЗА И ОЧИСТКИ
6-[18F]ФТОРПИПЕРОНАЛЯ - СИНТОНА ДЛЯ
ПОЛУЧЕНИЯ ПЭТ РАДИОТРЕЙСЕРОВ НА ОСНОВЕ
СЛОЖНЫХ МОЛЕКУЛ
© 2023 г. Д. Д. Ваулина, В. В. Орловская, О. С. Федорова,
О. Ф. Кузнецова, Р. Н. Красикова*
Институт мозга человека им. Н.П. Бехтеревой РАН,
197376, Санкт-Петербург, ул. Академика Павлова, д. 12а
*e-mail: raisa@ihb.spb.ru
Поступила в редакцию 31.03.2023, после доработки 06.07.2023, принята к публикации 12.07.2023
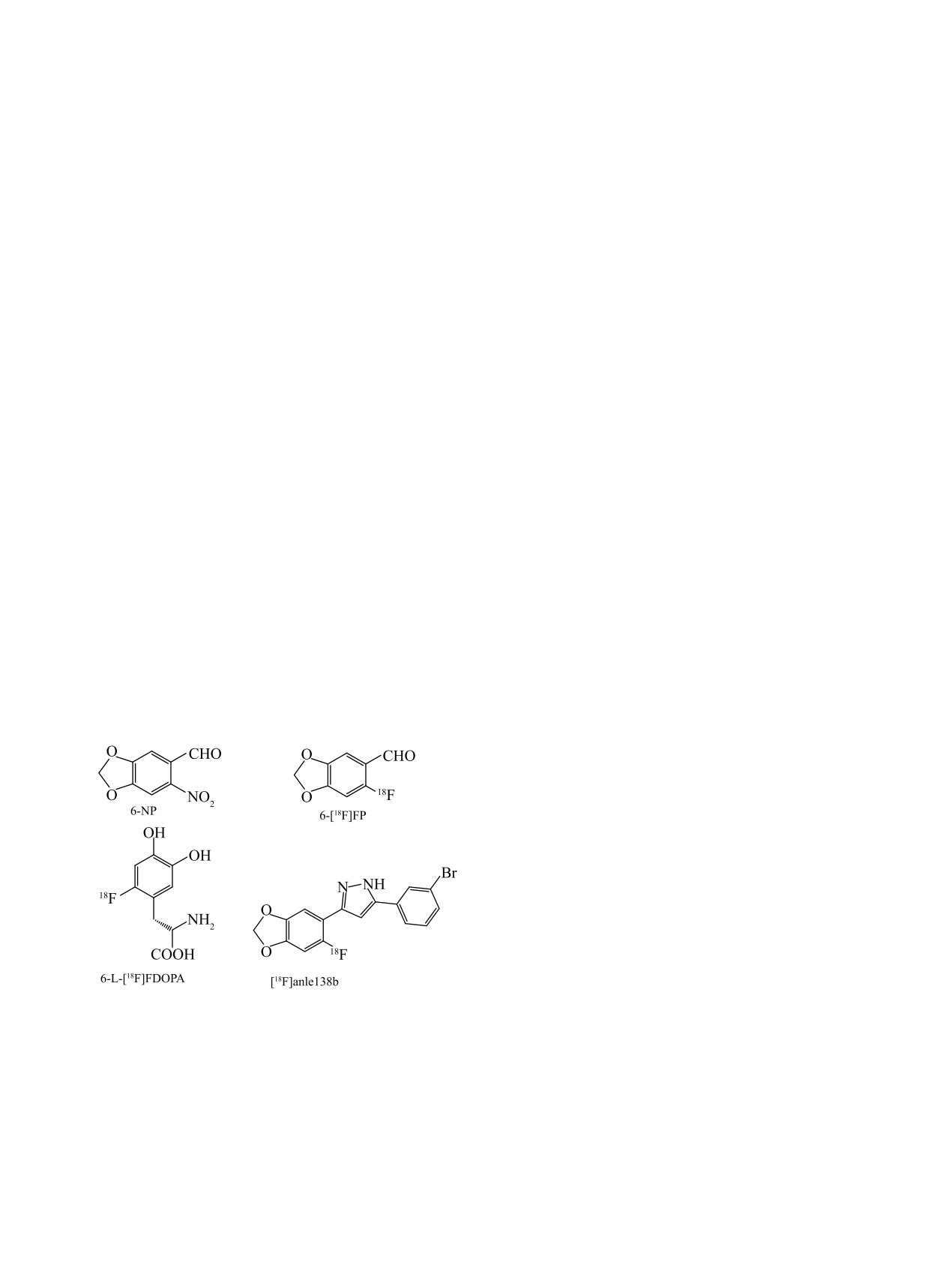
Предложен оптимизированный метод синтеза
6-[18F]фторпипероналя
(6-[18F]FP) реакцией
нуклеофильного замещения нитрогруппы в молекуле предшественника (нитропипероналя
-
6-NP) на [18F]фторид в присутствии тозилата тетрабутиламмония. Благодаря применению этого
слабощелочного межфазного катализатора количество исходного 6-NP в реакции было снижено с 4.0
до 0.2 мг, а в результате последующей реакции с сильным основанием (метилатом калия) уменьшено
до пренебрежимо малых количеств. В свою очередь, это позволило провести разделение близких
по физико-химическим свойствам 6-[18F]FP и 6-NP простым и эффективным методом твердофазной
экстракции на одноразовых картриджах. 6-[18F]FP был получен с радиохимической чистотой 99% и
радиохимическим выходом 10%. Содержание непрореагировавшего 6-NP не превышало 1 мкг/мл, что
сравнимо с результатами трудоемкой очистки методом полупрепаративной ВЭЖХ.
Ключевые слова: позитронная эмиссионная томография, фтор-18, радиотрейсеры,
6-[18F]
фторпиперональ, твердофазная экстракция.
DOI: 10.31857/S0033831123050088, EDN: XTIKTX
ВВЕДЕНИЕ
синтеза и очистки и автоматизированные техноло-
гии. Наиболее предпочтительными являются так
Позитронная эмиссионная томография (ПЭТ) -
называемые «прямые» методы, используемые при
быстро развивающийся метод ядерной медицины,
получении большинства клинически значимых
занимающий прочное место в современной диагно-
РФЛП, где фтор-18 вводят непосредственно в мо-
стике. Среди короткоживущих циклотронных ПЭТ
лекулу предшественника близкой структуры [1, 2].
радионуклидов наиболее востребованным является
Однако условия реакций прямого радиофторирова-
фтор-18 (T1/2 = 109.7 мин). Это обусловлено как его
ния (щелочная среда, высокие температуры, орга-
«идеальными» ядерно-физическими характеристи-
нические растворители) зачастую непригодны для
ками (97% β+, Eβ+ 0.635 МэВ, пробег позитронов
введения метки в сложные биологически активные
в ткани 2.4 мм), так и простым и высокопроизво-
молекулы или аналоги лекарственных средств, со-
дительным методом получения радионуклида в
ставляющие большую группу РФЛП. В этом случае
водной мишени циклотрона в форме [18F]фтори-
используют так называемые «непрямые» методы
да, используемого для введения метки в молекулы
синтеза, где фтор-18 вводят в простые реакцион-
методом нуклеофильного радиофторирования [1].
носпособные соединения с различными функци-
Ввиду малого периода полураспада фтора-18 для
ональными группами (синтоны, простетические
синтеза радиофармацевтических лекарственных
группы), участвующие в последующем построении
препаратов (РФЛП) используют экспресс-методы
необходимой молекулы (build-up synthesis) [3]. Од-
458
ОПТИМИЗАЦИЯ СИНТЕЗА И ОЧИСТКИ 6-[18F]ФТОРПИПЕРОНАЛЯ
459
ной из проблем использования синтонов является
распад). Стадия очистки является обязательной,
необходимость их очистки трудоемким и длитель-
так как в ее отсутствие выход второй стадии син-
ным методом полупрепаративной радиоВЭЖХ, что
теза (конденсация 6-[18F]FP с тозилгидразидом [8])
приводит к потере радиоактивности целевого про-
становится пренебрежимо малым, что, по мнению
дукта, увеличению времени синтеза и сложностям
авторов, обусловлено присутствием в реакционной
в автоматизации.
смеси исходного 6-NP. В недавней работе по син-
тезу [18F]anle138b [10] нами предложены альтер-
Важным синтоном является
3,4-метиленди-
нативные методы получения 6-[18F]FP, наиболее
окси-6-[18F]фторбензальдегид
(6-[18F]фторпипе-
эффективным из которых является радиофториро-
рональ, 6-[18F]FP), используемый при получении
вание иодониевой соли - бромида (6-формилбен-
6-L-[18F]FDOPA - меченного фтором-18 аналога
зо-1,3-диоксол-5-ил)(фенил)иодония.
Недостат-
L-2,4-дигидроксифенилаланина (DOPA), являюще-
ком в использовании иодониевых солей в качестве
гося широко известным ПЭТ радиотрейсером для
предшественников в синтезе РФЛП является слож-
оценки плотности дофаминергических терминалов
ность получения и недоступность из коммерческих
при болезни Паркинсона [4]. Синтез 6-[18F]FP ос-
источников. Поэтому в настоящей работе поставле-
нован на реакции ароматического нуклеофильного
на задача синтеза 6-[18F]FP из коммерчески доступ-
замещения нитрогруппы в молекуле предшествен-
ного 6-NP с заменой предложенного ранее метода
ника,
3,4-метилендиокси-6-нитробензальдегида
трудоемкой полупрепаративной ВЭЖХ очистки [8]
(6-нитропипероналя, 6-NP) на фтор-18 [5, 6]. 6-[18F]
на более простой и пригодный для автоматизации
FP также служит синтоном в процессе получения
метод твердофазной экстракции (ТФЭ) на однора-
меченного фтором-18 производного anle138b ([18F]
зовых картриджах, широко распространенный в
anle138b), перспективного радиотрейсера для ви-
автоматизированном синтезе РФЛП [11]. Проблема
зуализации агрегатов альфа-синуклеина (α-syn) [7,
разделения нитро- и фторпроизводных имеет и об-
8]. Anle138b (3-(1,3-бензодиоксол-5-ил)-5-(3-бром-
щенаучное значение для радиохимии фтора-18, так
фенил-1H-пиразол) [9] - недавно разработанный
как нитрогруппа является одной из наиболее рас-
олигомерный модулятор на основе дифенилпира-
пространенных уходящих групп в реакциях арома-
зола, селективно связывающийся с α-syn и ингиби-
тического радиофторирования.
рующий процессы его агрегирования при болезни
Паркинсона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реактивы. Все перечисленные
ниже коммерчески доступные растворители и реа-
генты - N,N-диметилформамид (ДМФА) (содержа-
ние H2O менее 0.005%, Sigma-Aldrich), диметил-
сульфоксид (ДМСО) (≥99.9%, безводный, Sigma-
Aldrich), ацетонитрил (MeCN) (содержание H2O ме-
нее 0.03%, ООО «Криохим»), этанол (HPLC grade,
Merck), этилацетат (99.8%, PanReac AppliChem),
метанол (х.ч., ЗАО «Вектон»), трифторуксусная
кислота (ТФУ) (peptide grade, Iris Biotech GmbH),
4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8.8.8]
Описанный в работе [8] трехстадийный метод
гексакозан (криптофикс
2.2.2)
(≥98%, Sigma-
синтеза [18F]anle138b включает получение 6-[18F]FP
Aldrich), п-толуолсульфонат тетрабутиламмония
реакцией радиофторирования 6-NP и последующую
(Bu4NOTs) (≥98%, Sigma-Aldrich), безводный кар-
очистку методом полупрепаративной радиоВЭЖХ,
бонат калия (99%, Sigma-Aldrich), метоксид калия
сопровождающуюся потерями радиоактивного
(95%, Merck), 6-нитропиперональ (97%, Sigma-
синтона и низким радиохимическим выходом целе-
Aldrich) - использовали без дополнительной очист-
вого продукта (1% с поправкой на радиоактивный
ки. Для получения фтора-18 использовали воду
РАДИОХИМИЯ том 65 № 5 2023
460
ВАУЛИНА и др.
[18O]H2O, обогащенную кислородом-18
(≥97%,
или [18F]Bu4NF (метод Б) - добавляли раствор 6-NP
ЗАО «Глобальные научные технологии», Сосновый
(0.2-4 мг, 1-20 мкмоль) в 0.6 мл ДМСО или ДМФА,
Бор, Россия); одноразовые анионообменные кар-
реакционную смесь нагревали при 120-140°С в те-
триджи SepPak QMA light, 130 мг (Waters) активи-
чение 10 мин.
ровали последовательной промывкой 10 мл 0.5 М
Разложение предшественника и выделение
K2CO3 и 15 мл Н2О; картриджи для твердофазной
6-[18F]FP. После охлаждения до 70°С к реакцион-
экстракции HLB 3cc (Waters) с обращенно-фазным
ной смеси добавляли 20 мкл раствора KOMe в ме-
сорбентом активировали промывкой 4 мл EtOH и
таноле (10 мг/мл) в 200 мкл растворителя (ДМСО/
10 мл Н2О.
ДМФА). По истечении 1 мин в смесь добавляли
Получение радионуклида фтор-18. Фтор-18
3 мл воды и полученный раствор пропускали через
получали по ядерной реакции 18O(p,n)18F при об-
активированный картридж HLB 3cc; картридж по-
лучении [18O]H2O протонами энергией 16.4 МэВ
следовательно промывали 1 мл 50%-ного этанола и
в водной мишени циклотрона PETtrace 4 (GE
1 мл 60%-ного этанола, после чего 6-[18F]FP элюи-
Healthcare, Швеция). Облученную [18O]H2O, со-
ровали 1 мл 97%-ного этанола.
держащую 1.5 - 3.0 ГБк [18F]фторида, доставляли
Условия анализа методами радиоВЭЖХ и ра-
током гелия на вход модуля синтеза. Радиохимиче-
диоТСХ. Для оценки эффективности радиофтори-
ский синтез 6-[18F]FP осуществляли на сконструи-
рования (radiochemical conversion - RCC, табл. 1)
рованном в ИМЧ РАН полуавтоматическом моду-
и идентификации 6-[18F]FP использовали методы
ле с дистанционным управлением; фторирование
радиоТСХ и радиоВЭЖХ. Тонкослойную хромато-
проводили в реакционном сосуде объёмом 5 мл
графию (ТСХ) проводили на пластинах силикагеля
(Wheaton vial).
типа «Сорбфил» с УФ-индикатором (ЛЕНХРОМ,
Синтез 6-[18F]FP. [18F]фторид выделяли из об-
Санкт-Петербург); в качестве подвижной фазы ис-
лученной [18O]H2O on-line сорбцией на анионоо-
пользовали этилацетат. Распределение радиоак-
бменном картридже SepPak QMA light с последу-
тивности по пластине детектировали с помощью
ющим элюированием растворами, содержащими
радиоТСХ сканера MiniGITA (Raytest, Германия);
межфазный катализатор, и удалением раствори-
Rf [18F]фторида и 6-[18F]FP составил 0.13 и 0.56,
телей в токе азота. Состав элюента (метод А):
соответственно. Для радиоВЭЖХ анализа исполь-
9.0 ±
0.1 мг
(25 мкмоль) криптофикса
2.2.2 и
зовали хроматограф Dionex ISC-5000 (Dionex,
2.0 ± 0.1 мг (12 мкмоль) K2CO3 в 2 мл MeCN/H2O
Sunnyvale, CA, USA), снабженный краном-дозато-
(96/4 по объему), удаление растворителей - 120°С,
ром Rheodyne 7125, УФ-детектором (254 нм) и по-
10 мин. Состав элюента (метод Б): 1 мг Bu4NOTs
следовательно соединенным с ним детектором по
(2.4 мкмоль) в 1 мл МеОН, удаление растворителей
радиоактивности Carrol and Ramsey Associates, CA,
- 90°С, 5 мин. К сухому остатку, содержащему акти-
USA, model 105-S, с разницей во времени регистра-
вированный комплекс - [K/К2.2.2]+[18F]- (метод А)
ции пиков детекторами в 0.1 мин. Условия хромато-
Таблица 1. Результаты синтеза 6-[18F]FP реакцией радиофторирования 6-NP с использованием различных МФК.
Номер
RCC, %
МФК/основание
6-NP, мг/мкмоль
Растворитель
Т, °С/t, мин
системы
(по радиоТСХ)
1
К2.2.2 (25 мкмоль), K2СО3
4/20
ДМСО
120/10
69 ± 10 (n = 6)
(12 мкмоль), MeCN/H2O 96/4
2
К2.2.2 (25 мкмоль,) K2СО3
1/5
ДМСО
120/10
3 (n = 1)
(12 мкмоль), MeCN/H2O 96/4
3
Bu4NOTs 2.4 мкмоль/1 мл
0.2/1
ДМСО
120/10
28 ± 3 (n = 3)
MeOH
4
Bu4NOTs 2.4 мкмоль/1 мл
1/5
ДМСО
120/10
38 ± 6 (n = 3)
MeOH
5
Bu4NOTs 2.4 мкмоль/1 мл
0.2/1
ДМФА
140/10
55 ± 4 (n = 3)
MeOH
РАДИОХИМИЯ том 65 № 5 2023
ОПТИМИЗАЦИЯ СИНТЕЗА И ОЧИСТКИ 6-[18F]ФТОРПИПЕРОНАЛЯ
461
FP и 6-NP) достаточно сложно даже методом полу-
O
CHO
O
18F- ɆɎɄ
CHO
ɪɚɫɬɜɨɪɢɬɟɥɶ
препаративной ВЭЖХ [13], а также сопровождает-
7ɋ ɦɢɧ
ся большими потерями радиоактивности целевого
O
NO2
O
18F
продукта [8]. Для разделения методом ТФЭ с уче-
6-NP
6-[18F]FP
том невысокой сорбционной емкости одноразовых
Схема 1. Синтез 6-[18F]FP реакцией нуклеофильного
ТФЭ картриджей необходимо снижение количества
радиофторирования 6-NP.
исходного 6-NP при сохранении эффективности
графирования: колонка X-Bridge C18 (150 × 4.6 мм),
радиофторирования. Как видно из данных табл. 1
элюент: смесь 0.1% трифторуксусной кислоты и
(система 1), при использовании 4 мг (20 мкмоль)
ацетонитрила в градиентном режиме: 0 мин - 5%
предшественника и варьировании условий реакции
ацетонитрила, 0-8 мин - 5-95% ацетонитрила, ли-
сохранялась высокая эффективность радиофтори-
нейный градиент, скорость потока 2.0 мл/мин. Вре-
рования 6-NP (RCC 69 ± 10%). Однако при умень-
мена удерживания Rt 6-[18F]FP и 6-NP составляли
шении навески 6-NP до 1 мг (5 мкмоль) эта величи-
4.9 ± 0.1 и 4.8 ± 0.1 мин соответственно.
на падала до 3% (система 2, Табл.1), а при фториро-
вании 0.2 мг образования продукта не наблюдалось.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве альтернативы К2.2.2/K2СО3 в послед-
ние годы часто применяют соли тетраалкиламмо-
Для участия в реакциях нуклеофильного фтори-
ния, такие как гидрокарбонат тетраэтиламмония
рования [18F]фторид, образующийся в водной ми-
(Et4NHCO3) [9, 11], обеспечивающие менее щелоч-
шени циклотрона в сильно сольватированной фор-
ные условия радиофторирования и меньшее обра-
ме, переводят в форму активированного комплекса в
зование химических и радиохимических примесей,
присутствии межфазных катализаторов (МФК) [1].
обусловленное разложением предшественника под
В качестве МФК используют краун-эфиры
влиянием оснований. В серии работ нашей ла-
или криптанды в комбинации с различными осно-
боратории была продемонстрирована эффектив-
ваниями, чаще всего аминополиэфир криптофикс
ность использования слабощелочного МФК этой
2.2.2
(4,7,13,16,20,24-гексаокса-1,10-диазабици-
группы - п-толуолсульфоната тетрабутиламмония
кло[8.8.8]гексакозан, К2.2.2) и карбонат калия
(Bu4NOTs) - в реакциях алифатического радиоф-
(К2.2.2/K2CO3), а также соли тетраалкиламмония.
торирования [14-16]. Применение спиртового рас-
Выбор МФК играет определяющую роль в эффек-
твора Bu4NOTs на стадии элюирования [18F]фто-
тивности радиофторирования [1, 12]. Стандартная
рида позволяет исключить традиционную [1] дли-
методика выделения фтора-18, используемая и в
тельную стадию азеотропной осушки, а главное -
данной работе, включает сорбцию радионуклида
уменьшить количество предшественника в 5-10 раз
на анионнообменной смоле, упакованной в коммер-
[16]. Результаты применения этого подхода для син-
чески доступные одноразовые картриджи (Sep-Pak
теза 6-[18F]FP приведены в табл. 1. Для элюирова-
Plus QMA Light, 130 мг) с последующим элюиро-
ния [18F]фторида, сорбированного на анионообмен-
ванием фтора-18 раствором МФК и удалением рас-
ной смоле QMA, использовали раствор Bu4NOTs в
творителя и следов воды азеотропной осушкой. Ра-
метаноле; эффективность элюирования превышала
нее в синтезе 6-[18F]FP [5, 6] в присутствии крипто-
90%. После удаления метанола в токе азота к по-
фикса 2.2.2 (25 мкмоль) мы применяли щелочной
лученному активированному комплексу [18F]Bu4NF
элюент, содержащий 12 мкмоль K2CO3 в смеси
добавляли раствор предшественника и проводили
MeCN/H2O (4% H2O). При использовании 7-8 мг
радиофторирование при 120-140°С (схема 1).
6-NP RCC составляла 53 ± 6% (ДМСО, 180°С,
Как видно из данных табл. 1, в присутствии
5 мин) [5]; полученный 6-[18F]FP использовали в
Bu4NOTs высокие значения RCC достигались при
синтезе 6-L-[18F]FDOPA без промежуточной очист-
использовании 1 мкмоль предшественника (система
ки. Как уже отмечалось [8], применение 6-[18F]FP в
5, табл. 1), однако и в этом случае разделение 6-NP и
синтезе [18F]anle138b требует удаления непрореаги-
6-[18F]FP на одноразовом картридже для ТФЭ осу-
ровавшего предшественника, что в случае близких
ществить очень сложно, поскольку даже в условиях
по физико-химическим свойствам веществ (6-[18F]
градиентной ВЭЖХ (рис. 1, а, б) времена удержива-
РАДИОХИМИЯ том 65 № 5 2023
462
ВАУЛИНА и др.
ɚ
ɛ
Ȗ ɞɟɬɟɤɬɨɪ
ɍɮ ɞɟɬɟɤɬɨɪ Ȝ
ɧɦ
4.8
175
100
4.8
150
6-[18F]FP
6-NP
80
125
100
60
75
40
50
20
25
4.6
4.5
5.9
4.2
5.2
min
min
-20
–10
ȼɪɟɦɹ ɦɢɧ
ȼɪɟɦɹ ɦɢɧ
ɜ
ɝ
4.2
ɉɪɨɞɭɤɬ
ɉɪɨɞɭɤɬ
100
70.0
ɪɚɡɥɨɠɟɧɢɹ
ɪɚɡɥɨɠɟɧɢɹ
60.0
80
6-[18F]FP
4.8
6-[18F]FP
6-NP
50.0
60
40.0
40
20.0
5.8
20
4.6
10.0
4.6
0
0.0
min
-10.0
min
-20
ȼɪɟɦɹ ɦɢɧ
ȼɪɟɦɹ ɦɢɧ
ɞ
ɟ
4.8
150
40.0
[18)@ ɩɪɢɦɟɫɶ
6-[18F]FP
125
ɨɬ ɩɪɨɞɭɤɬɚ
100
ɪɚɡɥɨɠɟɧɢɹ
75
(1.5%)
20.0
50
5.9
7.4
10.0
25
4.6
5.2
4.2
0
min
min
-20
-4
ȼɪɟɦɹ ɦɢɧ
ȼɪɟɦɹ ɦɢɧ
Рис. 1. Данные ВЭЖХ анализа: (а, б) реакционная смесь после радиофторирования; (в, г) реакционная смесь после реакции
с метоксидом калия; (д, е) 6-[18F]FP после ТФЭ очистки. (а, в, д) γ-детектор; (б, г, е) УФ, 254 нм.
ния этих соединений практически не различаются.
этой проблеме является использование метоксидов
В работе [8] по синтезу [18F]anle138b для их разде-
щелочных металлов, селективно реагирующих с
ления методом ТФЭ было предложено перевести
предшественником, образуя продукты значительно
6-нитропиперональ в 6-аминопиперональ реакцией
более полярные, чем фторсодержащий аналог, что
с порошкообразным железом в растворе концентри-
позволяет проводить разделение этих соединений.
рованной HCl в этаноле (100°С, 10 мин). Однако по-
Этот подход был применен в автоматизированном
сле очистки на обращенно-фазном картридже ради-
синтезе [18F]флютаметамола [17] - радиотрейсера
охимический выход 6-[18F]FP оказался пренебрежи-
для визуализации амилоидных агрегатов у пациен-
мо малым, а сам предложенный метод практически
тов с болезнью Альцгеймера [18]. После радиофто-
невозможно автоматизировать. Другим подходом к
рирования нитропредшественника в реакционную
РАДИОХИМИЯ том 65 № 5 2023
ОПТИМИЗАЦИЯ СИНТЕЗА И ОЧИСТКИ 6-[18F]ФТОРПИПЕРОНАЛЯ
463
щелочных условиях (стабилен в области рН 0-14).
Таблица 2. Состав реакционой смеси после реакции с
метоксидом калия (70°С, 1 мин) по данным радиоВЭЖХ
HLB картриджи различной емкости успешно при-
(Рис. 1, в, г).
меняются на стадии очистки РФЛП в автоматизиро-
Мольное
ванных модулях синтез [21, 22]. Однако при пропу-
Растворитель
6-[18F]
соотношение
6-NP, %
для KОМе
FP, %
скании разбавленной водой реакционной смеси на
KOMe/6-NP
HLB картридже сорбировались оба радиоактивных
1/1
ДМСО
0-20
5-15
продукта (сорбировано >99% радиоактивности).
1/1
МеОН
60-65
5-10
Для выделения 6-[18F]FP использовали разрабо-
2/1
МеОН
50-60
пренебрежимо
танный ранее метод фракционного элюирования
малое
[22], включающий последовательную промывку
картриджа 1 мл водного 50%-ного EtOH и 1 мл во-
смесь добавляли метоксид натрия, и образующийся
дного 60%-ного EtOH. При подборе оптимальной
продукт разложения и меченный фтором-18 ради-
концентрации и объема этанола, обеспечивающих
олиганд разделяли методом ТФЭ с использовани-
минимальные потери целевого меченого продукта
ем комбинации одноразовых картриджей. Другим
во фракциях элюата, использовали контроль мето-
примером, но с использованием метоксида калия
дом радиоВЭЖХ. Финальное элюирование HLB
для разложения предшественника, является разде-
картриджа этанолом (1 мл, 97%) позволило полу-
ление на одноразовом картридже нитромазенила и
чить фракцию 6-[18F]FP с пренебрежимо малым
[18F]флюмазенила [19] - радиолиганда для оценки
содержанием 6-NP - ~1 мкг/мл (рис. 1, е), что срав-
плотности центральных бензодиазепиновых ре-
нимо с эффективностью очистки традиционным
цепторов при эпилепсии [20]. Основываясь на этой
методом полупрепаративной ВЭЖХ. Радиохимиче-
работе, мы также использовали метоксид калия
ская чистота полученного 6-[18F]FP превышала 98%
(табл. 2); подбор условий проводили под контро-
(рис. 1, д). Радиохимический выход с поправкой на
лем радиоВЭЖХ (рис. 1). Было показано, что при
радиоактивный распад составил 10% при времени
двукратном мольном избытке KOMe/6-NP (табл. 2,
синтеза 45 мин. Основные потери радиоактивного
нижняя строка) в реакционной смеси практически
продукта обусловлены образованием радиоактив-
не остается нитропредшественника, что видно по
ной примеси на этапе разложения 6-NP метоксидом
исчезновению соответствующего пика на ВЭЖХ
калия (40-50%, рис. 1, в).
и появлению пика деривата с временем удержива-
ния, сильно отличающимся от фторпроизводного
Таким образом, показана возможность эффек-
(рис. 1, б, г). Это позволило перейти к разработке
тивного разделения близких по физико-химиче-
условий очистки 6-[18F]FP методом ТФЭ. К сожале-
ским свойствам нитропредшественника (6-NP) и
нию, в этих условиях (табл. 2, нижняя строка) отме-
продукта его радиофторирования (6-[18F]FP) ме-
чалось и частичное разложение целевого 6-[18F]FP
тодом ТФЭ, что стало возможным в результате
с образованием неидентифицированного меченого
уменьшения количества исходного 6-NP на стадии
продукта (рис. 1, в), что осложняло стадию очистки.
радиофторирования и последующей реакции его
разложения метоксидом калия. Использование от-
В целом, несмотря на огромные преимущества
носительно мягких условий этой реакции и однора-
метода ТФЭ (быстрота, надежность, простота ав-
зовых картриджей на стадии ТФЭ очистки позволя-
томатизации, использование одноразовых картрид-
ет адаптировать этот метод в автоматизированные
жей и др.), подбор условий разделения, обеспечи-
модули синтеза РФЛП, при этом время синтеза мо-
вающих необходимую химическую и радиохими-
жет быть сокращено.
ческую чистоту продукта, является нетривиальной
задачей. Исходя из состава разделяемой смеси,
для очистки 6-[18F]FP наиболее подходящим явля-
ФОНДОВАЯ ПОДДЕРЖКА
ется обращенно-фазный картридж Oasis HLB 3cc
(Waters), не имеющий силанольных групп, вклю-
Работа выполнена в рамках Государственного
чающий как гидрофильный, так и липофильный
задания Министерства образования и науки, тема
фрагменты и пригодный для разделения в кислых и
FMMW-2022-0006.
РАДИОХИМИЯ том 65 № 5 2023
464
ВАУЛИНА и др.
КОНФЛИКТ ИНТЕРЕСОВ
11. Krasikova R. // Curr. Org. Chem. 2013. Vol. 17. P. 2097-
2107.
Авторы заявляют об отсутствии конфликта ин-
12. Krasikova R.N., Orlovskaya V.V. // Appl. Sci.
2022.
тересов.
Vol. 12, N 1. P. 321.
СПИСОК ЛИТЕРАТУРЫ
13. Wenzel B., Günther R., Brust P., Steinbach J. // J.
Chromatogr. A. 2013. Vol. 1311. P. 98-105.
1.
Coenen H.H., Ermert J. // Clin. Transl. Imaging. 2018.
14. Orlovskaya V., Fedorova O., Nadporojskii M.,
Vol. 6. P. 169-193.
Krasikova R. // Appl. Radiat. Isot. 2019. Vol.
152.
2.
Coenen H.H., Elsinga P.H., Iwata R., Kilbourn M.R.,
P. 135-139.
Pillai M.R., Rajan M.G., Wagner H.N. Jr, Zaknun J.J. //
Nucl. Med. Biol. 2010. Vol. 37. P. 727-740.
15. Fedorova O.S., Orlovskaya V.V., Nadporojskii M.,
Krasikova, R.N. // Radiochim. Acta. 2020. Vol. 108.
3.
van der Born D., Pees A., Poot A.J., Orru R.V.A.,
P. 979-988.
Windhorst A.D., Vugts D.J. // Chem. Soc. Rev. 2017.
Vol. 46, N 15. P. 4709-4773.
16. Orlovskaya V., Antuganov D., Fedorova O., Timofeev V.,
4.
Taïeb D., Imperiale A., Pacak K. // Eur. J. Nucl. Med.
Krasikova R. // Appl. Radiat. Isot. 2020. Vol.
163.
Mol. Imaging. 2016. Vol. 43. P. 1187-1189.
Article 109195.
5.
Krasikova R.N., Zaitsev V.V., Ametamey S.M.,
17. Fairway S., Mantzilas D., Horn E., Powell N. // J. Nucl.
Kuznetsova O.F., Fedorova O.S., Mosevich I.K.,
Med. 2010. Vol. 51 (Suppl. 2). P. 140.
Belokon Y.N., Vyskočild Š., Shatik S.V., Nader M.,
18. Matsuda H., Ito K., Ishii K., Shimosegawa E.,
Schubiger P.A. // Nucl. Med. Biol. 2004. Vol. 31. P. 597-
Okazawa H., Mishina M., Mizumura S., Ishii K.,
603.
Okita K., Shigemoto Y., Kato T., Takenaka A., Kaida H.,
6.
Красикова Р.Н., Кузнецова О.Ф., Федорова О.С.,
Hanaoka K., Matsunaga K., Hatazawa J., Ikawa M.,
Мосевич И.К., Малеев В.И., Белоконь Ю.Н., Савелье-
Tsujikawa T., Morooka M., Ishibashi K., Kameyama M.,
ва Т.Ф., Сагиян А.С., Дадаян С.А., Петросян А.А. //
Радиохимия. 2007. Т. 49, № 5. С. 449-454.
Yamao T., Miwa K., Ogawa M., Sato N. // Front. Neurol.
2021. Vol. 11. Article 578753.
7.
Zarrad F., Zlatopolskiy B.D., Urusova E.A.,
Neumaier B. // J. Label. Compd. Radiopharm. 2015.
19. Nasirzadeh M., Vaulina D.D., Gomzina N.A. // IX Int.
Vol. 58. S241.
Conf. of Young Scientists on Chemistry «Mendeleev-
8.
Zarrad F. Ph.D. Dissertation. Köln, Germany: Univ.
2015.» Abstract Book. 2015. P. 270-271.
of Köln,
20. Odano I., Halldin C., Karlsson P., Varrone A.,
(accessed Jan. 12, 2022).
Airaksinen A., Krasikova R.N., Farde L. // Neuroimage.
9.
Wagner J., Ryazanov S., Leonov A., Levin J., Shi S.,
2009. Vol. 45. P. 891-902.
Schmidt F., Prix C., Pan-Montojo F., Bertsch U.,
21. Liu Y., Zhu L., Plössl K., Choi S.R., Qiao H., Sun X.,
Mitteregger-Kretzschmar G. et al. // Acta Neuropathol.
Li S., Zha Z., Kung H.F. // Nucl. Med. Biol. 2010.
2013. Vol. 125. P. 795-813.
Vol. 37. P. 917-925.
10. Orlovskaya V.V., Fedorova O.S., Viktorov N.B.,
Vaulina D.D., Krasikova R.N.
// Molecules.
2023.
22. Vaulina D., Gomzina N., Nasirzadeh M. // Appl. Radiat.
Vol. 28. Article 2732.
Isot. 2018. Vol. 135. P. 110-114.
РАДИОХИМИЯ том 65 № 5 2023
ОПТИМИЗАЦИЯ СИНТЕЗА И ОЧИСТКИ 6-[18F]ФТОРПИПЕРОНАЛЯ
465
Optimization of the Synthesis and Purification
of 6-[18F]Fluoropiperonal, Synton for the Preparation
of Complex Molecules Used as PET Tracers
D. D. Vaulina, V. V. Orlovskaya, O. S. Fedorova, O. F. Kuznetsova, R. N. Krasikova*
Bechtereva Institute of the Human Brain, Russian Academy of Sciences, St. Petersburg, 197376 Russia
*e-mail: raisa@ihb.spb.ru
Received March 31, 2023; revised July 6, 2023; accepted July 12, 2023
An optimized synthesis method for 6-[18F]fluoropiperonal (6-[18F]FP) via nucleophilic substitution of the nitro
group in the precursor molecule (nitropiperonal, 6-NP) with [18F]fluoride in the presence of tetrabutylammonium
tosylate has been proposed. Using this weakly basic phase transfer catalyst, the amount of initial 6-NP in the
reaction was reduced from 4.0 to 0.2 mg with negligible amounts after subsequent treatment of the reaction
mixture with a strong base (potassium methoxide). In turn, this made it possible to separate 6-[18F]FP and
6-NP with similar physicochemical properties by a simple and efficient solid-phase extraction technique on
disposable cartridges. 6-[18F]FP was obtained with radiochemical purity of 99% and a radiochemical yield of
10%. The content of unreacted 6-NP did not exceed 1 μg/mL, which is comparable to the results of laborious
semi-preparative HPLC purification.
Keywords: positron emission tomography, fluorine-18, radiotracers, 6-[18F]fluoropiperonal, solid phase
extraction
РАДИОХИМИЯ том 65 № 5 2023