РАСПЛАВЫ
1 · 2019
УДК 666.1:681.3.06
МОЛЕКУЛЯРНЫЕ МОДЕЛИ НАДСТРУКТУРНЫХ ЕДИНИЦ
ЩЕЛОЧНЫХ БОРАТОВ
© 2019 г. И. А. Бабинаa, *, Б. С. Воронцовb, В. В. Москвинb, И. Н. Греховa
aВоенный учебно научный центр Военно воздушных сил
“Военно воздушная академия им. Н.Е. Жуковского и Ю.А. Гагарина”
454015 Россия, Челябинск 15, городок 11 (филиал, Челябинск)
bКурганский государственный университет, 640000 Россия, Курган, ул. Томина, 40
*e mail: babina_inga@mail.ru
Поступила в редакцию 12.07.2018
Использование полуэмпирических методов показывает возможность построения
надструктурных единиц, за исключением диборатной группы.
Ключевые слова: структурные фрагменты, молекулярные модели, надструктурные
единицы, модельный эксперимент.
DOI: 10.1134/S0235010619010031
Аномальное поведение ряда физико%химических свойств многокомпонентных ще%
лочноборатных оксидов в зависимости от концентрации компонентов было обнару%
жено в большом числе работ и в отечественной литературе получило название “борная
аномалия”. Информация об этом понятии имеется в энциклопедиях, учебниках и
справочниках, например [1, 2]. Эту “аномалию” объясняют переходом части атомов
бора из тройной (треугольной) координации в четверную (тетраэдрическую) с образо%
ванием надструктурных единиц и обратно.
Перечень этих единиц и их названия: триборатная группировка, ди%триборатная
группа, метаборатная группа, метаборатный анион, диборатная группа; пентаборат%
ная, ди%пентаборатная и три%пентаборатная группы были предложены в работе [3] и с
небольшими вариациями используются в публикациях до настоящего времени [4, 5].
В то время как для основных структурных фрагментов оксида бора построены мо%
лекулярные модели и хорошо изучено методами квантовой химии их строение [6, 7], для
надструктурных единиц такой информации нет. Описание их строения дается только на
основе косвенных данных по изучению ИК%спектров, ЯМР исследований и др.
В настоящей работе проведен эксперимент по изучению молекулярных моделей
надструктурных единиц, основанный на квантовохимических расчетах. Использова%
ны полуэмпирические расчетные методы MNDO [8] и PM7 [9], включенные в про%
граммные комплексы MOPAC [10] и Firefly [11].
Основная проблема модельного эксперимента состояла в том, что большая часть
указанных выше базовых единиц и надструктурных группировок не существует в сво%
бодном виде в качестве отдельных молекулярных образований, - они лишь выделяют%
ся в составе боратной сетки и для них сложно построить адекватные молекулярные
модели c относительно небольшим числом атомов.
Подробное описание построения моделей надструктурных единиц ниже дано для
системы B2O3-Na2O с использованием метода MNDO. В них в качестве граничных
входят атомы натрия.
Первая из моделей надструктурных единиц c четырехкоординированым бором со%
ответствует формуле B3Na4O7. Она построена присоединением к бороксольному коль%
цу дополнительного фрагмента -O-Na, так что в модели появляется один четырех%
30
И. А. Бабина, Б. С. Воронцов, В. В. Москвин, И. Н. Грехов
2.37
Na(+0.76)
Na(+0.77)
O(-0.76)
O(-0.09)
Na(+0.76)
1.32
2.49
B(+0.5)
1.41
O(-0.77)
1.43
B(+0.42)
1.49
1.43
1.58
B(+0.5)
O(-0.6)
-0.25
O(-0.6)
2.49
Na(+0.77)
Рис. 1. Распределение заряда и длины связей в модели триборатной группы B3Na4O7.
координированный атом бора (В(+0.42) на рис. 1). Модель после оптимизации со зна%
чениями длин связей и зарядами на атомах показана на рис. 1.
Полученные в расчете данные свидетельствуют о том, что присоединение дополни%
тельного фрагмента -O-Na (иначе увеличение координации бора от трех до четырех)
возмущает только часть модели непосредственно связанную с атомом B(IV). Увеличи%
ваются длины мостиковых связей B(IV)-O-B(III) до 1.58 Å и часть электронной плот%
ности (-0.4 заряда электрона) перетекает от BO4 на мостиковые связи в кольце. Сле%
дует отметить, что использованные полуэмпирические методы дают завышенные по
сравнению с экспериментом [4, 12] значения длин B-O%связей, как для тройной, так
и для четверной координации, но правильно предсказывают увеличение длины этой
связи при переходе от одной координации к другой.
В следующей модели ди%триборатной группы, полученной присоединением еще
одной O-Na%группы к модели, показанной на рис. 1, средний заряд двух четырех%ко%
ординированных атомов бора +0.31, то есть еще значительнее уменьшается по сравне%
нию с зарядом +0.5 трех%координированного атома бора. Аномальным является заряд
+0.07 мостикового атома кислорода, соединяющего два четырех%координированных
атома бора. В кольцевых моделях с трех%координированными атомами бора и в приве%
денной выше надструктурной триборатной группировке B3O7Na4 этот заряд находится
в интервале от -0.5 до -0.6. Заряды всех атомов натрия примерно одинаковы и близки
к +0.75, однако заряды атомов кислорода в связях B-O-Na намного отличаются друг
от друга: наименьший заряд в связях B(IV)-O-Na равен -0.25 наибольший -1. Зна%
чителен и разброс в длинах связей во фрагментах B-O-Na.
Молекулярные модели надструктурных единиц щелочных боратов
31
Na
Na
Na
O
Na
O
Na
Na
Na
Na
O
O
Na
O
B
B
O
O
O
Рис. 2. Шаровая модель надструктурной единицы B3O9.
B2
B1
B3
O
B4
Na
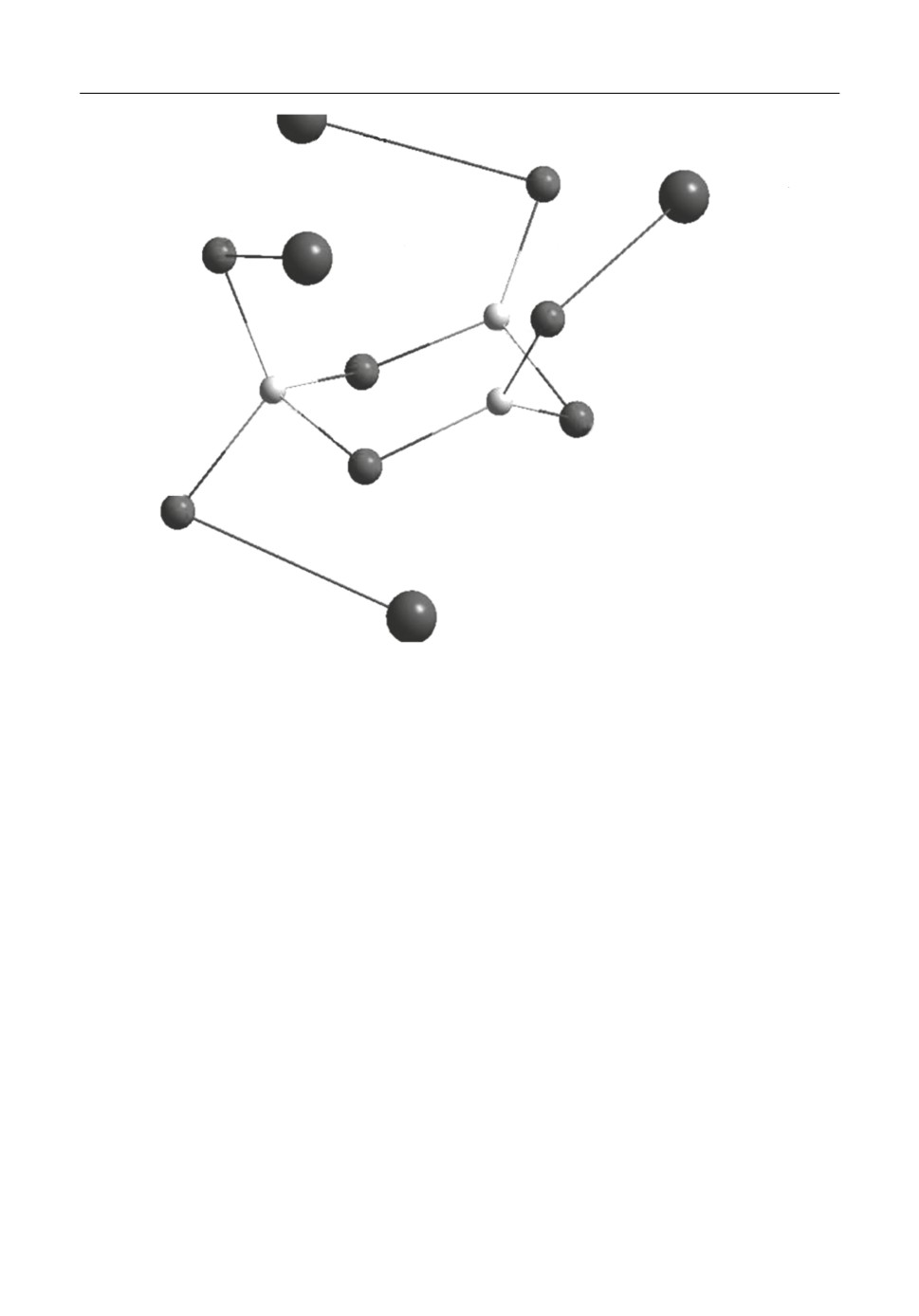
Рис. 3. Диборатная группировка.
На рис. 2 показана в различных ракурсах шаровая модель метаборатной группы, в
которой все три атома бора четырехкоординированы. Видно, что окружение различ%
ных периферийных атомов кислорода качественно различно, что и объясняет значи%
тельное отличие их зарядов. Заряды всех атомов натрия, по%прежнему, примерно оди%
наковы и близки к +0.75. Заряды трех атомов бора одинаковы и равны +0.31, в то же
время заряды связывающих их мостиковых атомов кислорода существенно отличают%
ся: у двух из них заряд -0.2, тогда как у третьего -0.6. Длины B-O%связей в кольце
примерно одинаковы, - их среднее значение 1.52 Å.
Построить диборатную группировку B4O9 с двумя четырех координированными
атомами бора (в пробной геометрии это атомы В1 и В3 соединенные общим атомом
кислорода, подписанным на рис. 3) успехом не увенчались. После оптимизации фак%
тически 4х%координированным из них остается только один атом (атом В3 на рис. 3).
В пентаборатной группировке, показанной на рис. 4, все связи четырех%координи%
рованного атома бора мостиковые (это связи B(IV)-O-B(III)). Средняя длина этих
32
И. А. Бабина, Б. С. Воронцов, В. В. Москвин, И. Н. Грехов
B(IV)
O
B(III)
Na
Рис. 4. Шаростержневая модель пентаборатной группы.
связей 1.48 Å, заряд центрального, общего для этих связей четырех%координированно%
го атома бора +0.201. С учетом погрешности расчета он больше среднего заряд +0.13
трех координированных атомов бора. Заряды мостиковых атомов кислорода пример%
но одинаковы, и в среднем равны -0.27. Заряды всех атомов натрия примерно одинако%
вы, как и во всех предыдущих моделях и близки к +0.63. Заряды концевых атомов кис%
лорода отличаются существенно, в частности имеется аномально низкий заряд -0.125.
В ди%пентаборатной надструктурной единице в результате присоединения O-Na%
группы к B(III) (рис. 4) бороксольные кольца искажаются больше, чем в пентаборатной,
но в целом геометрия похожа. Длины всех мостиковых связей примерно одинаковы, в
среднем равны 1.45 Å, однако длины B(IV)-O%связей несколько больше (1.48 Å), чем
связей B(III)-O (1.42 Å). Заряды мостиковых атомов кислорода примерно одинаковы
(-0.3), также как и заряды атомов натрия (+0.61). Заряд центрального четырех%коор%
динированного атома бора (рис. 4) равен примерно +0.18 и больше, чем среднее для
трех%координированных (+0.13).
В три%пентаборатной группе (B5O12), полученной присоединением дополнительно
к предыдущей ди%пентаборатной модели еще одной концевой группы O-Na к одному
из трех%координированных атомов бора на рис. 4, соотношение зарядов атомов бора с
разной координацией и мостиковых атомов кислорода практически не изменяется.
Такой же остается и разница длин связей.
Следующим этапом было построение более сложных моделей из бороксольных ко%
лец, содержащих трех% и четырех%координированные атомы бора, в состав которых
входят надструктурные единицы. Шаростержневая модель с тремя кольцами показана
на рис. 5.
Фрагмент структуры с четырьмя кольцами приведен на рис. 6.
На основе моделей фрагментов структуры показанных на рис. 5 и 6 можно провести
сопоставительный анализ для атомов бора с различной координацией. По данным
расчета методом MNDO средний заряд трех%координированных атомов бора +0.14,
меньше, чем у четырех%координированных (+0.18). Заряды атомов кислорода в мо%
стиковых связях B(III)-O-B(III) и B(III)-O-B(IV) примерно одинаковы и в среднем
равны -0.28. В то же время заряд атома кислорода в связях B(IV)-O-B(IV) либо отри%
цателен и больше по модулю (0.36), либо положителен и близок к нулю (+0.1). На
рис. 5 такой атом кислорода с аномальным зарядом помечен знаком “+”.
Молекулярные модели надструктурных единиц щелочных боратов
33
B(IV)
O
+
O
B(III)
B(IV)
B(III)
Рис. 5. Модель с тремя бороксольными кольцами.
O
B(III)
B(IV)
B(III)
O
O
B(IV)
B(IV)
B(III)
Na
Рис. 6. Фрагмент структуры с четырьмя бороксольными кольцами.
Длины связей B(III)-O и B(IV)-O равны в среднем 1.42 и 1.48 Å и практически не
зависят от того в составе какого мостика они находятся. Этим же свойством обладают
и порядки этих связей (их значения 0.99 и 0.83, соответственно).
Результаты, полученные в расчетах с параметрами PM7, существенно отличаются
от MNDO расчетов. Так, заряды трех% и четырех координированных атомов бора при%
мерно одинаковы и равны соответственно +0.52 и +0.53. Заряд атомов кислорода в
мостиковых связях B(III)-O-B(III) и B(III)-O-B(IV) несколько отличаются и в сред%
нем равны -0.57 и -0.53, соответственно. Заряд атома кислорода в связях B(IV)-O-
B(IV) как и для MNDO расчетов либо отрицателен и больше по модулю (-0.66), либо
близок к нулю (-0.06...+0.08).
Длины B(III)-O связей равны в среднем 1.44 Å и практически не зависят от того в со%
ставе какого мостика они находятся. Длины же B(IV)-O связей в мостиках B(IV)-O-
B(III) составляют 1.48 Å и значительно меньше, чем 1.55 Å в мостиках B(IV)-O-B(IV).
Наши попытки использовать выше охарактеризованные модели с четырех коорди%
нированными атомами бора для неэмпирических расчетов оказались безуспешными.
Вне зависимости от размера выбранного базиса, добавления поляризационных и диф%
34
И. А. Бабина, Б. С. Воронцов, В. В. Москвин, И. Н. Грехов
фузных функций и способа задания начальной электронной плотности достичь схо%
димости итерационной процедуры для волновых функций не удается.
Таким образом, полуэмпирические методы показывают возможность построения
всех перечисленных в начале работы надструктурных единиц, за исключением дибо%
ратной группы. В этих и более сложных моделях фрагменты с трех%координирован%
ным и четырех%координированным атомами бора существенно отличаются как пере%
распределением электронной плотности, так и геометрическими параметрами. По по%
лученным данным разрушение бороксольной сетки наиболее вероятно за счет
разрыва связей в мостике B(IV)-O-B(IV).
СПИСОК ЛИТЕРАТУРЫ
3. K r o g h % M o e J . Interpretation of the infra%red spectra of boron oxide and alkali borate glasses //
Phis. Chem. of Glasses. 1965. 6. № 2. P. 46-54.
4. Р а й т А . , С и н к л е р Р. , Гр и м л и Д . , Х ю л ь м е Р. и д р . Боратные стекла,
надструктурные группы и теория беспорядочной сетки // Физика и химия стекла. 1996. 22.
№ 4. С. 360-383.
5. О с и п о в а Л . М . , О с и п о в А . А . , Б ы к о в В . Н . Структура высокощелочных
расплавов литиево%боратной системы по данным колебательной спектроскопии // Физика и
химия стекла. 2007. 33. № 5. С. 669-677.
6. U c h i d a N . , M a e k a w a T. , Yo k o k a w a T. An application of MNDO calculation to
borate polyhedral // J. Non%crystalline Solids. 1985. 74. P. 25-36.
7. Vo r o n t s o v B . S . , S o l o d o v n i k o v V. M . , U s a n i n Y. M . MNDO investigation of
electronic parameters in silicate and boroxol molecular groups // Summaries of X National scientific
and technical conference “Glass and fine ceramics”. Bulgaria. Varna. 1990. P. 143-144.
8. D e w a r M . J . S , T h i e l W. Ground states of molecules.38. The MNDO method. Approxi%
mations and parameters // J. Amer. Chem. Soc. 1977. 99. № 15. P. 4899-4907.
9. S t e w a r t J . J . P. Optimization of parameters for semiempirical methods VI: more modifica%
tions to the NDDO approximations and re%optimization of parameters // J. of Molecular Modeling.
2013. 19. № 1. P. 1-32.
10. S t e w a r t J . J . P. MOPAC 2012 // Stewart Computation Chemistry. Colorado Springs, CO,
USA. 2012. http:// Open MOPAC. net.
dex.html.
12. Р о у с о н Г. И . Неорганические стеклообразующие системы, пер. с англ. Под редак%
цией Тананаева И.В. М.: Мир. 1970. 312 с.
Molecular Model With Supra Structural Units Alkaline Borates
I. A. Babina1, B. S. Vorontsov2, V. V Moskvin2, I. N. Grekhov1
1Military Educational and Scientific Center of the Air Force “N.Y. Zhukovsky and Yu.A. Gagarin,”
454015 Russia, Chelyabinsk 15, town 11 (branch, Chelyabinsk)
2Kurgan State University, 640000 Russia, Kurgan, Tomina st., 40
The use of semiempirical methods shows the possibility of building supra%structural
units, with the exception of diborate group.
Keywords: structural fragments, molecular model, with supra%structural units model ex%
periment
REFERENCES
Молекулярные модели надструктурных единиц щелочных боратов
35
3. Krogh%Moe J. Interpretation of the infra%red spectra of boron oxide and alkali borate glasses //
Phis. Chem. of Glasses. 1965. 6. № 2. P. 46-54.
4. Rayt A., Sinkler R., Grimli D., Khyul’me R. Borate glasses, superstructural groups, and the the%
ory of a disordered grid [Boratnyye stekla, nadstrukturnyye gruppy i teoriya besporyadochnoy setki] //
Fizika i khimiya stekla. 1996. 22. № 4. P. 360-383 [In Rus.].
5. Osipova L.M., Osipov A.A., Bykov V.N. The structure of high%alkaline melts of the lithium%bo%
rate system according to vibrational spectroscopy data [Struktura vysokoshchelochnykh rasplavov
litiyevo boratnoy sistemy po dannym kolebatel’noy spektroskopii] // Fizika i khimiya stekla. 2007. 33.
№ 5. P. 669-677 [In Rus.].
6. Uchida N., Maekawa T., Yokokawa T. An application of MNDO calculation to borate polyhe%
dral // J. Non%crystalline Solids. 1985. 74. P. 25-36.
7. Vorontsov B.S., Solodovnikov V.M., Usanin Y.M. MNDO investigation of electronic parameters
in silicate and boroxol molecular groups // Summaries of X National scientific and technical confer%
ence “Glass and fine ceramics”. Bulgaria. Varna. 1990. P. 143-144.
8. Dewar M.J.S, Thiel W. Ground states of molecules.38. The MNDO method. Approximations
and parameters // J. Amer. Chem. Soc. 1977. 99. № 15. P. 4899-4907.
9. Stewart J.J.P. Optimization of parameters for semiempirical methods VI: more modifications to
the NDDO approximations and re%optimization of parameters // J. of Molecular Modeling. 2013. 19.
№ 1. P. 1-32.
10. Stewart J.J.P. MOPAC 2012 // Stewart Computation Chemistry. Colorado Springs, CO, USA.
12. Rouson G.I. Inorganic glass forming systems [Neorganicheskiye stekloobrazuyushchiye sistemy]
trans. from English Edited by Tananaev I.V. M .: Mir. 1970. 312 p. [In Rus.].