РАСПЛАВЫ
1 · 2019
УДК 546.831.4:544.653.3
О РАЗДЕЛЕНИИ УРАНА И ЦИРКОНИЯ:
ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА ЦИРКОНИЯ В РАСПЛАВЕ 3LiCl-2KCl
© 2019 г. Д. С. Мальцевa, *, В. А. Волковичa, Е. В. Рагузинаa, К. Е. Стрепетовa,
А. А. Козловаa, М. Н. Солдатоваa
aУральский федеральный университет имени первого Президента России Б.Н. Ельцина,
620002 Россия, Екатеринбург, ул. Мира 19
*e(mail: d.s.maltcev@urfu.ru
Поступила в редакцию 25.06.2018
Исследовано поведение циркония в эвтектическом расплаве хлоридов лития и
калия на твердом (вольфрам) и жидких (галлий, индий, цинк) катодах в температур!
ном интервале 550-750°С.
Ключевые слова: уран, цирконий, разделение, циклическая вольтамперометрия, хло!
ридные расплавы, потенциал выделения.
DOI: 10.1134/S0235010619010109
ВВЕДЕНИЕ
Переработка отработавшего ядерного топлива (ОЯТ) реакторов на быстрых нейтро!
нах возможна с привлечением пирохимических методов. Солевые электролиты, в
частности хлориды щелочных металлов, являются перспективными рабочими среда!
ми для организации данных методов. Электрохимическое выделение и электрохими!
ческое разделение урана и продуктов деления, в частности циркония, является одной
из основных стадий пирохимической переработки ОЯТ. На данный момент в качестве
рабочей среды для осуществления пирохимических операций при переработке ОЯТ
выбрана эвтектическая смесь хлоридов лития и калия. В литературе имеется ряд работ
посвященных исследованию электрохимического поведения ионов циркония в дан!
ном расплаве. В работах [1-4] исследованы электролитические методы растворения
загрязненных циркониевых сплавов и вопросы селективного извлечения циркония с
целью его использования в ядерной энергетике. Согласно данной методике, загряз!
ненные сплавы циркония растворяются в LiCl-KCl при высокой температуре. Далее
цирконий электродитически очищают от основной массы загрязненного сплава путем
осаждения циркония на катоде при определенном потенциале. Поэтому для улучше!
ния эффективности процесса необходима достоверная информация о потенциалах
окисления и восстановления циркония.
Циклическая вольтамперометрия (ЦВА) является наиболее широко используемым
методом получения количественной и качественной информации об электрохимиче!
ских окислительно!восстановительных механизмах и свойствах [5].
В работах [2, 4, 6-9] метод ЦВА был использован для исследования электрохимиче!
ских свойств циркония в LiCl-KCl. В работе [2] наблюдали три пика окисления и три
пика восстановления циркония при 500°С, в то же время в работе [6] обнаружено
4 пика окисления и 2 пика восстановления при 525°С. Sakamura и др. в работе [7]
идентифицировали два пика окисления и три пика восстановления при 500°С. В рабо!
те [4] наблюдали четыре пика восстановления и три пика окисления циркония, и для
каждого пика была определена окислительно!восстановительная реакция. Согласно
литературным данным цирконий в расплаве LiCl-KCl при 500°С может присутство!
52
Д. С. Мальцев, В. А. Волкович, Е. В. Рагузина, К. Е. Стрепетов и др.
вать в виде двух растворимых форм Zr(IV) и Zr(II), и двух нерастворимых ZrCl и Zr ме!
талл [2, 4, 6, 7]. Однако, отсутствует единое мнение об окислительно!восстановитель!
ном механизме циркония в данном расплаве вследствие его зависимости от концен!
трации циркония в расплаве, материала катода и других условий эксперимента.
Поэтому дальнейшее исследование электрохимического поведения циркония являет!
ся важной задачей для развития и оптимизации пирохимических методов переработки
ОЯТ. Целью настоящей работы явилось изучение катодных процессов с участием цир!
кония в расплаве эвтектической смеси LiCl-KCl на твердом и жидком катоде в темпе!
ратурном интервале 550-750°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты проводили в инертном боксе Glovebox Systemtechnik в атмосфере
высокочистого аргона (99.9999%, O2, H2O < 1 ppm). Индивидуальные соли LiCl и KCl
готовили по методике, описанной ранее [10]. Эвтектическую смесь 3LiCl-2KCl
(58 мол. % LiCl) готовили сплавлением индивидуальных хлоридов в требуемом соот!
ношении при температуре 650°С. Электролит LiCl-KCl-ZrCl4 (3 мас. % Zr) готовили
растворением необходимого количества ZrCl4 в соли!растворителе.
В качестве метода исследования был выбран метод циклической вольтамперомет!
рии (ЦВА), реализуемый с помощью гальваностата Autolab PGSTAT302N. Тип экспе!
риментальной ячейки описан ранее [11]. Рабочий электрод - стержень из вольфрама
d = 4 мм. Электрод сравнения - Ag/AgCl (1 мол. % AgCl в LiCl-KCl). Противоэлек!
трод - стержень из стеклоуглерода (d = 2 мм). Контейнером для расплава служил ти!
гель из оксида бериллия. По окончании эксперимента производили отбор пробы для
последующего определения концентрации и средней степени окисления циркония в
электролите.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В расплаве LiCl-KCl цирконий присутствует в виде двух растворимых форм, Zr(IV)
и Zr(II), и двух нерастворимых форм, ZrCl и металлического Zr. Стабильность, а, сле!
довательно, и комбинация данных форм в расплаве зависит от многих факторов, по!
этому сложно судить об окислительно!восстановительных реакция основываясь только
на данных циклической вольтамперометрии без привлечения других методов электро!
химического анализа. Поэтому для идентификации окислительно!восстановительных
реакций циркония использовали имеющиеся в распоряжении результаты, получен!
ные другими исследователями, в комбинации с результатами, полученными в данной
работе.
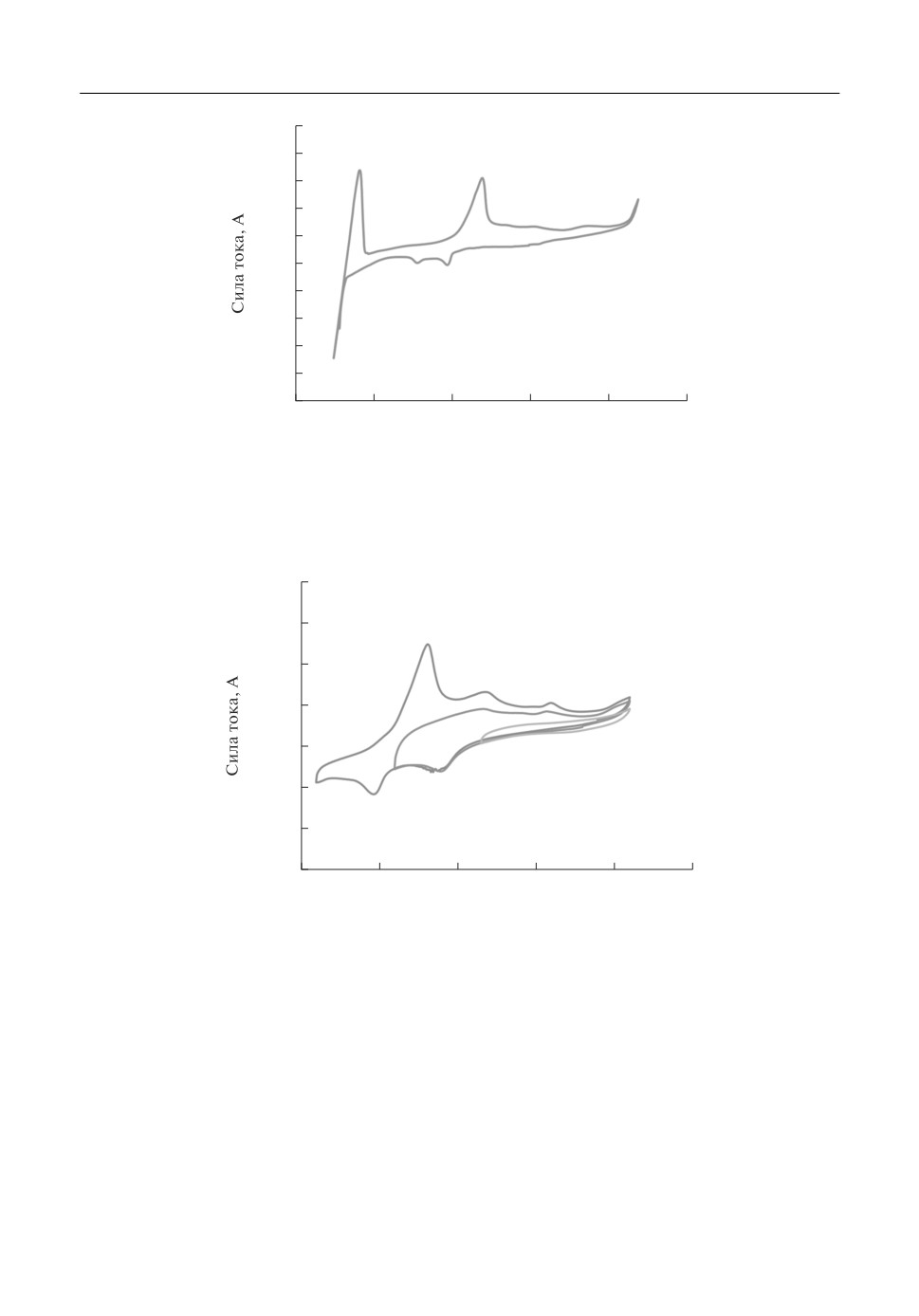
Типичный вид циклических вольтамперограмм в расплаве LiCl-KCl-ZrCl4 при
скорости поляризации рабочего электрода 200 мВ/с, представлен на рис. 1.
На вольтамперограмме присутствуют несколько катодных и анодных волн. Катод!
ный пик Red2 и связанный с ним анодный пик Ox2 соответствуют восстановлению и
окислению щелочного металла соли!растворителя. Пики Red1 и Ox1 связаны с вос!
становлением и окислением ионов циркония. С целью установления взаимосвязи
между катодными и анодными пиками была проведена регистрация вольтамперо!
грамм при различных величинах предельного катодного потенциала поляризации ра!
бочего электрода (РЭ). Полученные результаты представлены на рис. 2. Видно, что
при поляризации РЭ до потенциала -0.4 В (относительно хлорсеребряного электрода
сравнения (ЭС)) на вольтамперограммах отсутствую катодные и анодные волны.
При смещении предельного значения поляризации рабочего электрода до -0.9 В
появляется одна катодная (Red2) и две анодные (Ox2 и Ox3) волны при потенциалах
⎯0.59, -0.33 и +0.07 В, соответственно. Катодный пик Red2 соответствует восстанов!
лению ионов Zr(IV) до Zr(II), анодный пик Ox2 - окислению ионов Zr(II) до Zr(IV),
О разделении урана и циркония
53
0.8
0.6
Ox2
Ox1
0.4
0.2
0
0.2
Red1
0.4
0.6
0.8
Red2
1.0
1.2
-3
-2
-1
0
1
2
Потенциал, B
Рис. 1. Циклическая вольтамперограмма расплава LiCl-KCl-ZrCl4. Т = 550°С, концентрация циркония
0.314 мас. %, РЭ - W, 0.557 см2, ЭС - Ag/AgCl (1 мол. % в NaCl-2CsCl), скорость поляризации РЭ 0.2 В/с.
0.35
0.25
Ox1
0.15
Ox2
Ox3
0.05
0.05
0.15
Red2
Red1
0.25
0.35
-1.5
-1
-0.5
0
0.5
1
Потенциал, B
Рис. 2. Влияние предельной величины катодного потенциала на характер циклических вольтамперограмм
расплава LiCl-KCl-ZrCl4. Т = 550°С, концентрация циркония 0.314 мас. %, РЭ - W, 0.557 см2, ЭС -
Ag/AgCl (1 мол. % в NaCl-2CsCl), скорость поляризации РЭ 0.2 В/с.
что подтверждается другими исследователями [2, 4, 6, 7]. Возникновение анодного
пика Ox3 по всей видимости связано с окислением монослоя дихлорида циркония на
поверхности рабочего электрода [4, 12]. Также Park и др. в работе [4] указывают на воз!
можный вклад в появление данного пика на ЦВА реакции окисления монослоя Zr(II)
до Zr(IV). Для достоверного описания пика Ox3 необходимо проведение дополнитель!
ных электрохимических измерений.
При дальнейшем смещении потенциала поляризации РЭ в катодную область на
вольтамперограммах проявляются катодные пики Red1 и Red3 при потенциалах -1.04
и -1.4 В относительно хлорсеребряного ЭС, соответственно, а также анодный пик
54
Д. С. Мальцев, В. А. Волкович, Е. В. Рагузина, К. Е. Стрепетов и др.
0.03
0.02
3
0.01
2
1
0
0.01
0.02
0.03
-1.5 -1.3
-1.1
–0.9 -0.7 -0.5 -0.3 -0.1
0.1
0.3
0.5
Потенциал, B
Рис. 3. Циклическая вольтамперограмма расплава LiCl-KCl-ZrCl4. Т = 600°С, концентрация циркония
0.814 мас. %, РЭ: 1 - Ga, 2 - Zn, 3 - In. SРЭ = 0.196 см2, ЭС - Ag/AgCl (1 мол. % в 3LiCl-2KCl), скорость по!
ляризации РЭ 0.1 В/с.
Ox1 при потенциале -0.69 В относительно хлорсеребряного ЭС, который, по всей ви!
димости, является суперпозицией окислительных реакций соответствующих реакци!
ям восстановления (Red1 и Red3). В работе Sakamura и др. [7] приводятся результаты
рентгенофазового анализа катодного осадка, полученного после электролиза расплава
LiCl-KCl-ZrCl4 (1.08 мас. % Zr) при 500°С и катодном потенциале в области от -1.04 до
-1.15 В и от -1.35 до -1.42 В, согласно которым в катодном осадке в первом случае
присутствует лишь фаза ZrCl, во втором случае была обнаружена фаза Zr!металл. На
основании этих данных можно заключить, что катодный пик (Red1) соответствует
восстановлению ионов циркония (Zr(II) и Zr(IV)) до ZrCl, а катодный пик Red3 соот!
ветствует восстановлению ZrCl до Zr, и Zr(IV), Zr(II) до Zr. Анодная волна (Ox1) явля!
ется результатом нескольких конкурирующих реакций: окисление металлического
циркония до Zr(II) и Zr(IV) и окисление ZrCl до Zr(II) и Zr(IV) [4, 7].
Аналогичным образом были зарегистрированы циклические вольтамперограммы в
расплаве 3LiCl-2KCl-ZrCl4 с использованием жидких катодов из легкоплавких ме!
таллов: Ga, In, и Zn. Литературных данных об электрохимических свойствах цирко!
ния на жидких катодах обнаружено не было. Пример полученных вольтамперограмм
представлен на рис. 3.
На вольтамперограмме LiCl-KCl-ZrCl4, полученной на жидком галлии (линия 1)
присутствует два катодных пика при потенциалах -0.8 и -1.1 В, соответствующих по!
следовательному восстановлению циркония со степени окисления +4 до +2 и +2 до 0,
и три анодных пика, соответствующих окислению циркония металлического до ZrCl,
Zr(II) и Zr(IV). На циклических вольтамперограммах расплава LiCl-KCl-ZrCl4 с ис!
пользованием в качестве катода металлических цинка или индия, присутствует один
катодный и анодный пики, по всей видимости, характеризующие суммарный процесс
восстановления Zr(IV) до Zr(0) и соответствующего окисления Zr(0) до Zr(IV). Для
более достоверного описания окислительно!восстановительных реакций циркония
на жидко!металлических катодах необходимо проведение дополнительных исследо!
ваний.
Анализ циклических вольтамперограмм показал, что процесс осаждения и раство!
рения металлического циркония на твердом катоде из вольфрама является необрати!
мым. Для определения потенциалов выделения циркония с помощью циклических
О разделении урана и циркония
55
Таблица 1
Потенциалы выделения циркония в расплаве 3LiCl-2KCl-ZrCl4
на твердом и жидких катодах
EZr(IV)/Zr, В
EZr(IV)/Zr, В
Т, °С
Материал катода
СZr, мас. %
(vs Ag/AgCl)
(vs 2Cl-/Cl
2)
550
W
0.314
-1.08
-2.38
650
W
0.991
-0.93
-2.23
750
W
0.621
-0.88
-2.18
600
Ga
0.814
-0.85
-2.15
600
In
0.814
-0.83
-2.13
600
Zn
0.814
-1.03
-2.33
вольтамперограмм были проанализированы катодные пики, соответствующие восста!
новлению ионов циркония до металлического циркония. Полученные результаты
представлены в табл. 1.
Наблюдается ожидаемое смещение потенциала выделения циркония в положи!
тельную область при переходе от твердого катода к жидким за счет эффектов сплаво!
образования.
ЗАКЛЮЧЕНИЕ
В настоящей работе исследовано поведение циркония на твердом и жидких катодах
в эвтектическом расплаве хлоридов лития и калия. Определены значения потенциа!
лов выделения циркония в выбранном расплаве в интервале 550-750°C. Полученные
величины будут использованы при разработке методов селективного извлечения ура!
на в технологии переработки ОЯТ пирохимическим методом.
Работа выполнена при финансовой поддержке Российского Научного Фонда (про!
ект № 17-73-20156).
СПИСОК ЛИТЕРАТУРЫ
1. K i p o u r o s G . J . Electrorefining of Zirconium Metal in Alkali Chloride and Alkali Fluoride
Fused Electrolytes // J. Electrochem. Soc.1985. 132. № 5. P. 1087.
2. L e e C . H . , K a n g K . H . , J e o n M . K . , H e o C . M . , L e e Y. L . Electrorefining of
zirconium from zircaloy!4 cladding hulls in LiCl-KCl molten salts // ECS Transactions. 2012. 50.
№ 11. P. 491-496.
3. L i H . , N e r s i s y a n H . H . , Pa r k K . T. , Pa r k S . B . , K i m J . G . , L e e J . M . ,
L e e J . H . Nuclear!grade zirconium prepared by combining combustion synthesis with molten!salt
electrorefining technique // J. Nucl. Mater. 2011. 413. № 2. P. 107-113.
4. Pa r k J . , C h o i S . , S o h n S . , K i m K . R . , H w a n g I l S . Cyclic Voltammetry on
Zirconium Redox Reactions in LiCl-KCl-ZrCl4 at 500°C for Electrorefining Contaminated Zir!
caloy!4 Cladding // J. Electrochem. Soc. 2013. 161. № 3. H97-H104.
5. B a r d A . J . , Fa u l k n e r L . R . Electrochemicalmethods: fundamentals and applications,
N.Y.: John Wiley & Sons inc., 2000. 833 p.
6. G h o s h S . , Va n d a r k u z h a l i S . , Ve n k a t e s h P. , S e e n i v a s a n G . , S u b r a !
manian T., Prabhakara Reddy B., Nagarajan K. Electrochemical studies on the re!
dox behaviour of zirconium in molten LiCl-KCl eutectic // J. Electroanal. Chem. 2009. 627. № 1-2.
P. 15-27.
56
Д. С. Мальцев, В. А. Волкович, Е. В. Рагузина, К. Е. Стрепетов и др.
7. S a k a m u r a Y. Zirconium Behavior in Molten LiCl-KCl Eutectic, J. Electrochem. Soc.
2004. 151. № 3. P. C187.
8. C h e n Z . , Z h a n g M . H a n W. , Wa n g X . , Ta n g D . Electrodeposition of Zr and
electrochemical formation of Mg-Zr alloys from the eutectic LiCl-KCl, J. Alloys Compd. 2008. 459.
№ 1-2. P. 209-214.
9. Fa b i a n C . P. , L u c a V. , L e T. H . , B o n d A . M . , C h a m e l o t P. , M a s s o t L . ,
C a r a va c a C . , H a n l e y T. L . , L u m p k i n G . R . Cyclic voltammetric experiment - Simula!
tion comparisons of the complex mechanism associated with electrochemical reduction of Zr4+ in
LiCl-KCl eutectic molten salt // J. Electrochem. Soc. 2013. 160. № 2. P. H81-H86.
10. В о л к о в и ч В . А . , Д а н и л о в Д . А . , В а с и н Б . Д . , Х о х р я к о в А . А . Спек!
троскопическое исследование рения в расплавах галогенидов щелочных металлов // Распла!
вы. 2006. № 4. C. 21-28.
11. M a l t s e v D . S . , Vo l k o v i c h V. A . , V l a d y k i n E . N . Electrochemistry of uranium
in fused LiCl-KCl-CsCl eutectic // 44th Journees des Actinides, Ein Gedi, Israel, Be’er Shiva: Nu!
clear Research Center Negev. 2014. P. 140-141.
12. G a o F. , Wa n g C h . , L i u L . , G u o J . , C h a n g S h . , C h a n g L . Electrode pro!
cesses of uranium ions and electrodeposition of uranium in molten LiCl-KCl // J. Radioanal. Nucl.
Chem. 2009. 280. № 1. P. 207-218.
On the Separation of Uranium and Zirconium:
Electrochemical Properties of Zirconium in 3LiCl-2KCl Melt
D. S. Maltsev1, V. A. Volkovich1, E. V. Raguzina1, K. E. Strepetov1,
A. A. Kozlova1, M. N. Soldatova1
1Ural Federal University, 620002 Russia, Yekaterinburg, Mira st., 19
Electrochemical properties of zirconium in lithium and potassium chlorides eutectic
melt was studied employing solid (tungsten) and liquid (gallium, indium, zinc) cathodes in
temperature range 550-750°С.
Keywords: uranium, zirconium, separation, cyclic voltammetry, chloride melts, deposi!
tion potentials
REFERENCES
1. Kipouros G.J. Electrorefining of Zirconium Metal in Alkali Chloride and Alkali Fluoride Fused
Electrolytes // J. Electrochem. Soc.1985. 132. № 5. P. 1087.
2. Lee C.H. Kang K.H., Jeon M.K., Heo C. M., Lee Y.L. Electrorefining of zirconium from zir!
caloy!4 cladding hulls in LiCl-KCl molten salts // ECS Transactions. 2012. 50. № 11. P. 491-496.
3. Li H., Nersisyan H.H., Park K.T., Park S.B., Kim J.G., Lee J.M., Lee J.H. Nuclear!grade zir!
conium prepared by combining combustion synthesis with molten!salt electrorefining technique //
J. Nucl. Mater. 2011. 413. № 2. P. 107-113.
4. Park J., Choi S., Sohn S., Kim K.R., Hwang Il S. Cyclic Voltammetry on Zirconium Redox Re!
actions in LiCl-KCl-ZrCl4 at 500°C for Electrorefining Contaminated Zircaloy!4 Cladding //
J. Electrochem. Soc. 2013. 161. № 3. H97-H104.
5. Bard A.J., Faulkner L.R. Electrochemicalmethods: fundamentals and applications, N.Y.: John
Wiley & Sons inc., 2000. 833 p.
6. Ghosh S., Vandarkuzhali S., Venkatesh P., Seenivasan G., Subramanian T., Prabhakara Reddy B.,
Nagarajan K. Electrochemical studies on the redox behaviour of zirconium in molten LiCl-KCl eu!
tectic // J. Electroanal. Chem. 2009. 627. № 1-2. P. 15-27.
7. Sakamura Y., Zirconium Behavior in Molten LiCl-KCl Eutectic, J. Electrochem. Soc. 2004.
151. № 3. P. C187.
8. Chen Z., Zhang M., Han W., Wang X., Tang D. Electrodeposition of Zr and electrochemical
formation of Mg-Zr alloys from the eutectic LiCl-KCl, J. Alloys Compd. 2008. 459. № 1-2. P. 209-
214.
О разделении урана и циркония
57
9. Fabian C.P., Luca V., Le T.H., Bond A.M., Chamelot P., Massot L., Caravaca C., Hanley T.L.,
Lumpkin G.R. Cyclic voltammetric experiment - Simulation comparisons of the complex mecha!
nism associated with electrochemical reduction of Zr4+ in LiCl-KCl eutectic molten salt // J. Elec!
trochem. Soc. 2013. 160. № 2. P. H81-H86.
10. Volkovich V.A., Danilov D.A., Vasin B.D., Khokhryakov A.A. Spectroscopic study of rhenium
in melts of alkali metal halides [Spektroskopicheskoye issledovaniye reniya v rasplavakh galogenidov
shchelochnykh metallov] // Rasplavy. 2006. № 4. Р. 21-28 [In Rus.].
11. Maltsev D.S., Volkovich V.A., Vladykin E.N. Electrochemistry of uranium in fused LiCl-
KCl-CsCl eutectic // 44th Journees des Actinides, Ein Gedi, Israel, Be’er Shiva: Nuclear Research
Center Negev. 2014. P. 140-141.
12. Gao F., Wang Ch., Liu L., Guo J., Chang Sh., Chang L. Electrode processes of uranium ions
and electrodeposition of uranium in molten LiCl-KCl // J. Radioanal. Nucl. Chem. 2009. 280. № 1.
P. 207-218.