РАСПЛАВЫ
1 · 2019
УДК 546.78'784:(546.32'34'131+546.33'36'131):(544.653+544.174.2)
ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА ВОЛЬФРАМА
В РАСПЛАВАХ ХЛОРИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
© 2019 г. А. А. Рыжовa, А. Б. Ивановa, В. А. Волковичa, *
aУральский федеральный университет имени первого Президента России Б.Н. Ельцина,
620002 Россия, Екатеринбург, ул. Мира, 19
*е;mail: v.a.volkovich@urfu.ru
Поступила в редакцию 17.07.2018
Методами высокотемпературной электрохимии и спектроскопии исследовано
анодное растворение металлического вольфрама в расплавах эвтектических смесей
3LiCl-2KCl (723-1023 K) и NaCl-2CsCl (823-1023 K). Показано, что в расплав пе
реходят ионы W(IV). Определены условные стандартные электродные потенциалы
вольфрама.
Ключевые слова: вольфрам, хлоридный расплав, электродный потенциал.
DOI: 10.1134/S0235010619010171
ВВЕДЕНИЕ
Жидкосолевой ядерный реактор с топливом в виде фторидного или хлоридного
расплава рассматривается в качестве одного из перспективных типов ядерных энерге
тических установок (ЯЭУ). Одним из факторов, сдерживающих внедрение данного
типа ЯЭУ, является подбор материалов, обладающих достаточной коррозионной
стойкостью в контакте с солевыми расплавами. Металлический вольфрам является
одним из возможных конструкционных материалов. Вместо чистого вольфрама могут
быть использованы вольфрамовые покрытия. Расплавы на основе хлоридов щелочных
металлов являются возможными рабочими средами для электролитического осажде
ния вольфрама. Для разработки технологического процесса необходима информация
об электрохимических свойствах вольфрама в хлоридных расплавах, в частности об
электродных потенциалах.
Имеющиеся в литературе сведения об электрохимических свойствах вольфрама в
высокотемпературных галоидных расплавах ограниченны и зачастую противоречивы.
Это связано, в том числе, с экспериментальными трудностями, обусловленными вы
соким сродством хлоридных соединений вольфрама к кислороду; наличие в атмосфе
ре над расплавом следовых количеств кислорода приводит к повышению степени
окисления ионов вольфрама, образованию оксихлоридных соединений [1].
В работе [2] было показано, что в расплаве KCl-KF в равновесии с металлическим
вольфрамом находятся ионы W(V) и W(VI), были получены температурные зависимо
сти условных стандартных электродных потенциалов
E*
и
E*
в интервале
W(VI)/W
W(V)/W
923-1123 K. В результате анализа изотерм электродных потенциалов вольфрама в рас
плаве NaCl-KCl был сделан вывод о присутствии в равновесии с металлом ионов
W(IV) и W(V) [3, 4]. Электродные потенциалы вольфрама также были измерены в рас
плавах NaCl-2CsCl и 6NaCl-9KCl-5CsCl [5]. Однако во всех указанных работах кон
троль содержания кислорода в атмосфере не осуществлялся. Целью настоящей работы
являлось определение электродных потенциалов вольфрама в расплавах на основе
хлоридов щелочных металлов в условиях, позволяющих максимально исключить вли
яние кислорода на результаты измерений.
42
А. А. Рыжов, А. Б. Иванов, В. А. Волкович
Таблица 1
Результаты определения степени окисления ионов вольфрама,
образующихся при анодном растворении металла в расплавах хлоридов щелочных металлов
Средняя степень окисления вольфрама
Т, К
Q, Кл
Убыль массы анода, г
по убыли массы
оксидиметрический анализ
Расплав 3LiCl-2KCl
823
72
0.0358
3.84
4.08
1023
180
0.0851
4.03
4.08
1123
144
0.0694
3.95
3.76
Расплав NaCl-2CsCl
823
360
0.1860
3.69
3.88
923
360
0.1828
3.75
3.73
1023
360
0.1911
3.59
3.96
1123
360
0.1949
3.52
4.25
1123
360
0.2044
3.36
4.23
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты выполняли в расплавах на основе эвтектических смесей 3LiCl-2KCl
и NaCl-2CsCl. Ионы вольфрама в расплав вводили анодным растворением металла
(анодная плотность тока 0.05-0.1 А/см2) непосредственно перед проведением потен
циометрических измерений. В качестве катода при анодном растворении использова
ли свинцовый электрод. Эксперименты проводили в аргоновом перчаточном боксе
GS MEGA (Glovebox Systemtechnik), оборудованном печами, позволяющими выпол
нять электрохимические и спектроскопические измерения в солевых расплавах. Со
держание влаги и кислорода в атмосфере не превышало 10-5 и 10-4%, соответственно.
Электрохимические измерения выполняли с помощью потенциостата/гальваностата
AUTOLAB PGSTAT 302N. В качестве электрода сравнения использовали хлоридсе
ребряный электрод, состоявший из серебряной проволоки, погруженной в расплав
соли растворителя, содержащий 1 мол. % AgCl. По окончании экспериментов опреде
ляли концентрацию вольфрама в рабочем электролите с помощью масс спектромет
рии с индуктивно связанной плазмой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С целью установления степени окисления ионов вольфрама, находящихся в равно
весии с металлом, в первой серии экспериментов было изучено анодное растворение
металлического вольфрама. Число электронов, принимающих участие в анодном про
цессе, рассчитывали по убыли массы анода и количеству пропущенного электриче
ства. Среднюю степень окисления вольфрама определяли по результатам оксидимет
рического анализа проб электролитов. Примеры полученных результатов представле
ны в табл. 1. При использованных в работе плотностях анодного тока, растворение
вольфрама протекает по четырехэлектронной схеме и средняя степень окисления
ионов вольфрама в расплаве также близка к четырем. В качестве дополнительного ме
тода исследования, в процессе анодного растворения металла проводили регистрацию
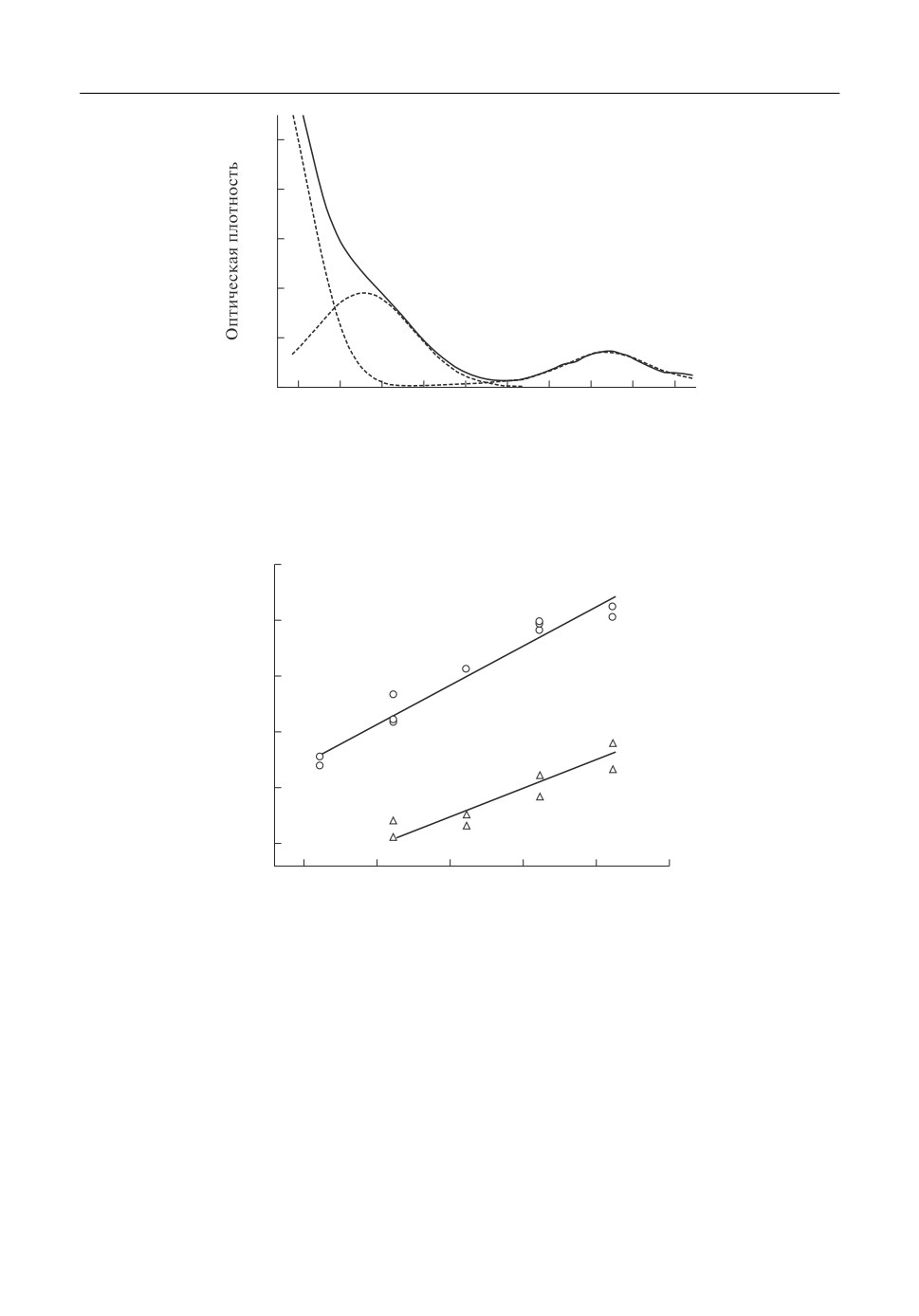
электронных спектров поглощения (ЭСП) расплавов. Пример ЭСП представлен на
рис. 1. Разложение ЭСП на индивидуальные компоненты позволило выявить полосы,
соответствующие электронным переходам, ожидаемым для октаэдрическикоордини
Электрохимические свойства вольфрама в расплавах
43
1.0
0.8
0.6
0.4
0.2
0
28
26
24
22
20
18
16
14
12
10
Длин
а волны, нм
Рис. 1. ЭСП продуктов анодного растворения вольфрама в расплаве NaCl-2CsCl, разложенный на индиви
дуальные компоненты.
E*(IV)/W, B
0.3
1
0.4
0.5
0.6
2
0.7
0.8
700
800
900
1000
1100
1200
T, K
Рис. 2. Температурные зависимости условного стандартного электродного потенциала вольфрама в распла
вах на основе эвтектических смесей 3LiCl-2KCl (1) и NaCl-2CsCl (2).
рованного комплексного иона вольфрама(IV) - два спинразрешенных 3T1g → 3T2g и
3T1g → 3T1g(P) перехода с максимумами около 13000 и 24500 см-1, соответственно. Та
ким образом, результаты спектроскопических измерений подтверждают, что в про
цессе анодного растворения вольфрама в расплав переходят преимущественно ионы
-
W(IV), образующие комплексные ионы
WCl26
По результатам потенциометрических измерений были определены электродные и
рассчитаны условные стандартные электродные потенциалы вольфрама. Полученные
результаты представлены на рис. 2. Температурные зависимости
(пересчи
*
E
W(IV)/W
44
А. А. Рыжов, А. Б. Иванов, В. А. Волкович
танные относительно хлорного электрода сравнения) удовлетворительно описывают
ся следующими уравнениями:
3LiCl-2KCl,
723
-1123
К,
–4
E*=
–1.147
+
7.01⋅10
⋅T
(±0.04
В),
(1)
NaCl-2CsCl,
823-1123 К,
–4
E*=
–1.189
+
4.87⋅10
⋅T(±0.04
В).
(2)
На основании электрохимических измерений было рассчитано изменение свобод
ной энергии Гиббса образования тетрахлорида вольфрама в соответствующих солях
растворителях и получены следующие уравнения температурных зависимостей:
*
ΔG
=
–442.8
+
0.271⋅T,
кДж/моль(3LiCl–2KCl),
(3)
4
WCl
*
ΔG
=
–458.9
+
0.188⋅T,
кДж/моль(NaCl–2CsCl).
(4)
4
WCl
Видно, что устойчивость комплексных ионов вольфрама в исследованных распла
вах повышается с увеличением среднего радиуса катионов соли растворителя, что яв
ляется следствием уменьшения поляризующего воздействия со стороны катионов
второй координационной сферы.
ЗАКЛЮЧЕНИЕ
Анодное растворение металлического вольфрама протекает по четырехэлектрон
ной схеме. В равновесии с металлом в расплаве присутствуют ионы вольфрама(IV).
Определены условные стандартные электродные потенциалы вольфрама и термоди
намические характеристики комплексных ионов вольфрама в расплавах. Устойчи
−
вость ионов
снижается с уменьшением среднего радиуса катионов соли раство
WCl26
рителя.
Работа выполнена при поддержке Министерства образования и науки РФ (проект
4.5062.2017/8.9).
СПИСОК ЛИТЕРАТУРЫ
1. D anilov D .A ., Volkovich V.A ., Vasin B .D ., Polovov I.B ., G riffiths T.R .
Tungsten chemistry in alkali chloride melts // Z. Naturforsch. 2007. 62a. Р. 739-744.
2. В и н о г р а д о в А . М . , В о л к о в и ч А . В . , Ж б а н о в А . М . , К о в а л е в Б . Ф . ,
Ц ы п л е н к о в С . К . Равновесные потенциалы вольфрама в расплаве KCl-KF-WCl6 // Изв.
вузов. Цвет. Металлургия. 1981. № 5. C. 71-74.
3. Ш к о л ь н и к о в С . Н . , М а н н е н к о в М . И . , Я р м о л о в и ч А . К . Равновесные
потенциалы вольфрама в расплаве хлоридов калия и натрия // ЖПХ. 1973. 46. C. 1918-1921.
4. М а н н е н к о в М . И . , Ш к о л ь н и к о в С . Н . Анодное растворение вольфрама в
хлоридных и хлоридно фторидных расплавах // Изв. вузов. Цвет. Металлургия. 1974. № 1.
C. 65-68.
5. I v a n o v A . B . , Vo l k o v i c h V. A . , Po s k r y a k o v D . A . , Va s i n B . D . , G r i f
fiths T.R. Electrode potentials of tungsten in fused alkali chlorides // AIP Conference Proceed
ings. 2016. 1767. Р. 020010 (1-6).
Электрохимические свойства вольфрама в расплавах
45
Electrochemical Properties of Tungsten in Melts of Alkali Chloride Metals
A. A. Ryzhov1, A. B. Ivanov1, V. A. Volkovich1
1Ural Federal University, 620002 Russia, Yekaterinburg, Mira st., 19
Anodic dissolution of tungsten in the melts of 3LiCl-2KCl (723-1023 K) and NaCl-
2CsCl (823-1023 K) eutectic mixtures was studied employing high temperature electro
chemistry and spectroscopy methods. It was shown that W(IV) ions are transferred to the
melt. Formal standard electrode potentials of tungsten were determined.
Keywords: tungsten, chloride melt, electrode potential
REFERENCES
1. Danilov D.A., Volkovich V.A., Vasin B.D., Polovov I.B., Griffiths T.R. Tungsten chemistry in al
kali chloride melts // Z. Naturforsch. 2007. 62a. Р. 739-744.
2. Vinogradov A.M., Volkovich A.V., Zhbanov A.M., Kovalev B.F., Tsyplenkov S.K. Equilibrium
potentials of tungsten in KCl-KF-WCl6 melt [Ravnovesnyye potentsialy vol’frama v rasplave KCl-
KF-WCl6] // Izv. Vuzov. Tsvet. Metallurgiya, 1981. № 5. Р. 71-74. [In Rus.].
3. Shkol'nikov S.N., Mannenkov M.I., Yarmolovich A.K. Equilibrium potentials of tungsten in the
melt of sodium and potassium chlorides [Ravnovesnyye potentsialy vol’frama v rasplave khloridov
kaliya i natriya] // ZHPKH. 1973. 46. Р. 1918-1921. [In Rus.].
4. Mannenkov M.I., Shkol'nikov S.N. Anodic dissolution of tungsten in chloride and chloride flu
oride melts [Anodnoye rastvoreniye vol'frama v khloridnykh i khloridno;ftoridnykh rasplavakh] // Izv.
Vuzov, Tsvet. Metallurgiya. 1974. № 1. Р. 65-68. [In Rus.].
5. Ivanov A.B., Volkovich V.A., Poskryakov D.A., Vasin B.D., Griffiths T.R. Electrode potentials of
tungsten in fused alkali chlorides // AIP Conference Proceedings. 2016. 1767. Р. 020010 (1-6).