РАСПЛАВЫ
3 · 2019
УДК 541.64:542.62:546.23
ДИНАМИКА ИЗМЕНЕНИЯ КЛАСТЕРНОЙ СТРУКТУРЫ РАСПЛАВОВ,
ОБРАЗУЮЩИХ НЕПРЕРЫВНЫЙ РЯД ТВЕРДЫХ РАСТВОРОВ
В ПРОЦЕССЕ РАВНОВЕСНОЙ И НЕРАВНОВЕСНОЙ КРИСТАЛЛИЗАЦИИ
© 2019 г. В. Д. Александровa, *, С. А. Фроловаa, А. П. Зозуляa
aДонбасская национальная академия строительства и архитектуры,
ул. Державина, 2г, Макеевка, Донецкая обл., 86123 Украина
*e$mail: primew65@mail.ru
Поступила в редакцию 11.02.2017
После доработки 01.08.2018
Принята к публикации 17.08.2018
Разработана схема кластерного строения расплава, образующего непрерывный
ряд твердых растворов, в перегретом и переохлажденном состояниях относительно
температур ликвидуса. Проанализирована динамика изменения структуры класте)
ризованной жидкости по мере охлаждения и дальнейшей равновесной и неравно)
весной кристаллизации. Обозначены области сосуществования жидкого раствора с
кластерами, зародышами и твердой фазой. Определены границы кластеризации и
пути их трансформации в зародыши и кристаллы твердых растворов. Рассмотрены
термограммы охлаждения, характеризующие различные виды кристаллизации спла)
вов. На их основе дан анализ путей кристаллизации по диаграмме состояния.
Ключевые слова: расплавы, бинарная система, сплавы, твердые растворы, диаграмма
состояния, растворимость, энтропия, кластеры, кластеризация, зародыши, равно)
весная и неравновесная кристаллизация, термограммы.
DOI: 10.1134/S0235010619030034
1. ВВЕДЕНИЕ
Рентгеноструктурными исследованиями доказана близость структуры расплавов
вблизи температуры плавления к структуре плавящейся твердой фазы [1-5], которая
привела к представлениям о кластерном строении жидкой фазы [6-9]. В литературе
неоднократно делались попытки распространения кластерных моделей на сплавы.
Перспективной в этом отношении можно считать схему кластеризации расплава в до)
кристаллизационном состоянии, предложенную В.И. Архаровым [9]. Однако данная
схема ограничена анализом образования лишь сплавов эвтектического состава при
равновесной кристаллизации и не затрагивает областей метастабильного состояния
ниже температур ликвидуса. В работах [10, 11] нами был предложен расширенный ва)
риант подобной схемы, охватывающий этапы кластеризации, зародышеобразования,
равновесной и неравновесной кристаллизации для сплавов эвтектического типа.
2. ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Целью данной работы является анализ динамики изменения кластеризованной
структуры расплава при равновесной и неравновесной кристаллизации для сплавов, об)
разующих непрерывный ряд твердых растворов с учетом стадии зародышеобразования.
Кластерное строение расплавов при нагревании сохраняется в жидкости до опреде)
+
ленных “критических” температур
Основанием для этого служат многочисленные
T
K
+
экспериментальные исследования по влиянию перегрева
ΔT
относительно темпера)
туры плавления (или ликвидуса)
T
на характер последующей кристаллизации при
L
Динамика изменения кластерной структуры расплавов
235
охлаждении [5, 12, 14]. В этих работах показано, что как для компонентов А и В, так и
для бинарных сплавов в жидком состоянии существуют определенные предельные пе)
+
+
регревы
ΔT
=T
−T
(T+ >T
), характерные тем, что при охлаждении недогретой
K
K L
K
L
+
предварительно до
жидкости происходит квазиравновесная кристаллизация с от)
T
K
сутствием переохлаждений. При этом температуры начала равновесной кристаллиза)
ции приходятся для сплавов на линию ликвидуса, а для чистых компонентов на тем)
+
пературу плавления. После же перегрева расплава выше
и дальнейшего охлажде)
T
K
ния жидкость переходит в метастабильное переохлажденное состояние, а
самопроизвольная кристаллизация расплава наступает после достижения определен)
−
−
ной для каждого сплава температуры Тmin или переохлаждения
ΔT
(ΔT
=T
-T
L
min,
T T
).
min
Рассмотрим диаграмму состояния бинарной смеси компонентов А и В, образующих
непрерывный ряд твердых растворов (рис. 1) и нанесем на нее “критические” темпе)
ратурыT+ для соответствующих сплавов. Эти точки образуют границу раздела между
K
жидким раствором и кластеризованной жидкостью (см. пунктирную линию выше
кривой ликвидуса).
Ниже этой границы в жидкости (ж) могут образовываться кластеры
α)фазы и
α
K
β)фазы. Из этих кластеров при охлаждении, например из точек a* и
ниже ли)
β
K
â*,
нии ликвидуса могут формироваться кристаллы твердых растворовα иβТ.Для их ко)
Т
личественного определения в разных областях диаграммы, необходима некая “репер)
ная” граница, разделяющая α) и β)фазы. В работах [9-11] при разработке схем кри)
сталлизации и определения количественного состава фаз для сплавов эвтектического
типа такими реперными ориентирами являлись эвтектическая точка и т.н. бинодаль для
определения границы расслоения кластеризованной жидкости от некластеризованной.
Подобного расслоения кластеризованной жидкости на “самостоятельные” кластеры
α
K
иKβ для расплавов, из которых образуются твердые растворы, не происходит.
Поэтому в данной работе предлагается в качестве бинодали использовать кривые
растворимости α) и β)фаз в твердом состоянии. Для этого воспользуемся классиче)
ским анализом энтропииS смешения, свободной энергиейG и уравнением раствори)
мости [15].
Как известно, непрерывный ряд твердых растворов образуют вещества, имеющие
близкие физико)химические свойства компонентов А и В. Поэтому число способов
размещений N молекул по N узлам структуры твердого раствора должно быть равным
N! Число способов размещений молекул в каждом из кристаллов А и В будет соответ)
ственно
N
! и
N
! Полное число способов распределения в системе, состоящей из сме)
A
B
си обоих кристаллов, равно
N
!
N
! Энтропия смешения для одного моля вещества:
A
B
N!
S
см
=
S
1
-
S
2
=
Rln
(1)
N !N
A B
!
Пользуясь формулой Стирлинга
ln N! ≈ N ln N - N,
получают:
S
см
=-
R{
N
A
ln
N
A
+
N
B
ln
N
B
-(N
A
+
N
B
)ln(N
A
+
N
B
)}
=
(2)
=-R[
N
A
ln
c
+
N
B
ln
(1
−
c
)],
N
N
где
c
= A
- концентрация компонента А,1-
c
= B
- концентрация компонента В.
N
N
236
В. Д. Александров, С. А. Фролова, А. П. Зозуля
E '
жидкий р
аствор
a*
+
ТK
ж + Kα
ТА
a
b*
ж + αT
b
ж + Kβ
g
c
h
ж + βT
Pmax
SP
g'
αT + Kβ
ТB
S(c)
βT + Kα
n
M
N
αT + βT
E
A
M
′
N ′
B
H
H
αT
=
βT
Рис. 1. Схематическое изображение структурных изменений в жидкой, жидко)твердой и твердой фазах для
сплавов, образующих непрерывный ряд твердых растворов.
На рис. 1 показан график кривой Scм. Эта кривая симметрична относительно орди)
наты с = 0.5. Максимальное значение энтропии смешения при с = 0.5, отнесенное к
одному молю
S
max
=
R ln 2
=
5.77
Дж/моль ⋅ К.
Полная энтропия твердого раствора имеет вид [16]:
T
c
p
dT
S
=
-
R[cln
c
+(1-c)ln(1-c)],
(3)
∫
T
0
где
- удельная теплоемкость сплава.
c
p
Динамика изменения кластерной структуры расплавов
237
Здесь первый член выражает часть энтропии, обусловленной хаотичностью тепло)
вого движения, и связан с нагреванием тела, а второй представляет собой энтропию
смешения.
Энтропия (3) является составной частью свободной энергии Гельмгольца
F(c,
T
),
т.к.
dF = dU -TdS.
Поэтому:
F(c,
T
)=
U c)+
RT cln
c
+(1-c)
ln 1-c)],
(4)
где
U (c)
- внутренняя энергия сплава, зависящая от концентрации с.
Из выражения свободной энергии (4) сплава получают уравнение кривой раствори)
мости [16].
dF
(c,T)
Из условия
=
0
находят уравнение кривой растворимости:
dc
1- 2c + p[lnc - ln(1- c) =0]
(5)
Откуда
U(1-2c)
−
c
RT
=
e
,
(6)
1
-
c
где
p =U RT.
При малых концентрациях из выражения (6) получаем экспоненциальную зависи)
мость концентрации с от температуры:
-U RT
c
≈
e
(7)
Вид зависимости энтропии смешения S от концентрации показан на рис. 1 в виде
куполообразной кривой
Подобный вид имеет и кривая растворимости.
max
AMP
NB
Проведем через точки Е и Е' ось, разделяющую область существования, в основном,
α)фазы (в левой части) от области существования, в основном, β)фазы (в правой ча)
сти от оси
). Концентрация молекул компонента В в α)растворе от точки А до точ)
EE'
ки Е нарастает и достигает насыщения
в точке Е. Аналогично концентрация моле)
αHT
кул А в β)растворе от точки В до точки Е будет увеличиваться и достигать максимума
H
H
β
T
H в точке Е. Очевидно, что в точке Е
α
T
=β
T.
Линии разграничения, включающие ось
кривую растворимости, границу кла)
EE',
стеризованной жидкости позволяют выделить области существования кластеров
α
K
,
твердых растворов α) и β)фаз, и находить концентрации молекул и фаз в различ)
β,
K
ных зонах. Так, площадь фигуры
относится к α)твердому раствору, а пло)
A max
A
T
P AT
щадь фигуры
к β)твердому раствору. Зона под куполом
относит)
B max B
T
P BT
max
AMP
NB
ся к смеси
α
T
+β
T.
Линии
AP
max
и
BP
max
разграничивают области индивидуальных
фазα иβ от смеси этих фаз
α
+β
в твердом состоянии.
Т
Т
T
T
В таком представлении можно применять правило рычага для всех зон для нахож)
дения фазового составаξ в различных частях. Как известно, по конноде, например
gh,
в области между линиями ликвидуса и солидуса традиционно определяют содержание
жидкость + твердая фаза (в данном случае под твердой фазой понимают смесь
) и
αТ
)фаз). В нашем случае, для левой и правой частей диаграммы по правилу рычага
βТ
можно конкретизировать относительное содержание фаз как до оси
так и после
EE',
нее, в частности находить содержание ξ фаз
αТ, αHT, βТ, βT
по отношению к насыщен)
238
В. Д. Александров, С. А. Фролова, А. П. Зозуля
ному состоянию. Например, по отрезку АЕ
ξ
α
=
AM' AE ,
ξ H
= M 'E AE
в левой ча)
T
α
T
сти диаграммы и по отрезку ВЕ
ξ
β
=
BN' BE ,
ξ H = N 'E BE
в правой части диаграм)
T
β
T
мы. Кроме того, по конноде MN под кривой
AMP
max
NB,
например в точке п, можно
определить концентрацию α) и β)твердых растворов
χ
α
=
Mn MN
и
χ
β
= nN MN
в
T
T
смеси
α
T
+β
T.
Содержание насыщенных α) и β) твердых растворов, очевидно, будет пропорцио)
нально длине перпендикуляров
MM'
в точке М,
P
max
E
в точке
P
max
для
αHT,а по длинам
отрезков
NN'
в точке N и отрезку
P
max
E
в точке
P
max
T
дляβH и т.д.
Рассмотрим процессы охлаждения расплава из кластеризованной жидкости
(из точки
), равновесной кристаллизации от точкиa до точки g и дальнейшего охла)
a*
ждения твердой фазы от точки g до точек M и
В данном случае при охлаждении
M'.
расплав и твердая фаза меняют свою структуру в следующей последовательности
ж
+
K
α
→
ж
+α
Т
→ α +
Т
K
β
→ α +β
Т
Т
Аналогичным образом меняется состояние
при охлаждении из правой части системы:
ж
+
K
β
→
ж
+β
Т
→β +
Т
K
α
→ α +β
Т
Т
При этом кристаллизация начинается при температурах ликвидуса, заканчивается
при температурах солидуса и носит равновесный характер.
Проанализируем область диаграммы, характеризующую метастабильное состояние
+
переохлажденных расплавов (рис. 2). Нанесем на нее как точки
так и минималь)
T
K,
ные температуры
на начало самопроизвольной кристаллизации.
T
min
Ниже температур ликвидуса часть кластеров
илиKβ превращается в устойчивые
α
K
зародышиЗ (или
), а переохлажденный расплав можно рассматривать как сосуще)
α
β
З
ствование зародышей и кластеров. Появление зародышей кристаллов в метастабиль)
ной области термодинамически обосновано, т.к. их размеры и работы образования за)
висят от переохлаждений относительно линии ликвидуса [6, 12-14].
При достижении критических концентраций кластеров)зародышей, последние
сближаются и коагулируют между собой, образуя первичный твердый конгломерат
объемом Vx. При этом выделяется теплота коагуляции, способствующая повышению
температуры от
T
и выпадению кристалловα иβТ.Если после начала неравновес)
min
Т
−
ной кристаллизации температуры
T
для всех сплавов поднимаются до линий ликви)
min
дуса, то в этом случае прекращают свое существование метастабильные области между
температурами
T
и ликвидуса T за счет плавления зародышей. Далее после охла)
min
L
ждения от линии ликвидуса до линии солидуса происходит равновесная кристаллиза)
ция без стадии зародышеобразования. Если же в результате неравновесной кристал)
лизации температуры
не поднимаются до температур ликвидуса, то состав рас)
T
min
плава ниже линии ликвидуса трансформируется в смесь ж +
(или ж +
). При
З
З
α
β
дальнейшем охлаждении такого расплава кристаллизация происходит в два этапа (ко)
агуляция зародышей и квазиравновесная докристаллизация).
Все перечисленные этапы равновесной и неравновесной кристаллизации распла)
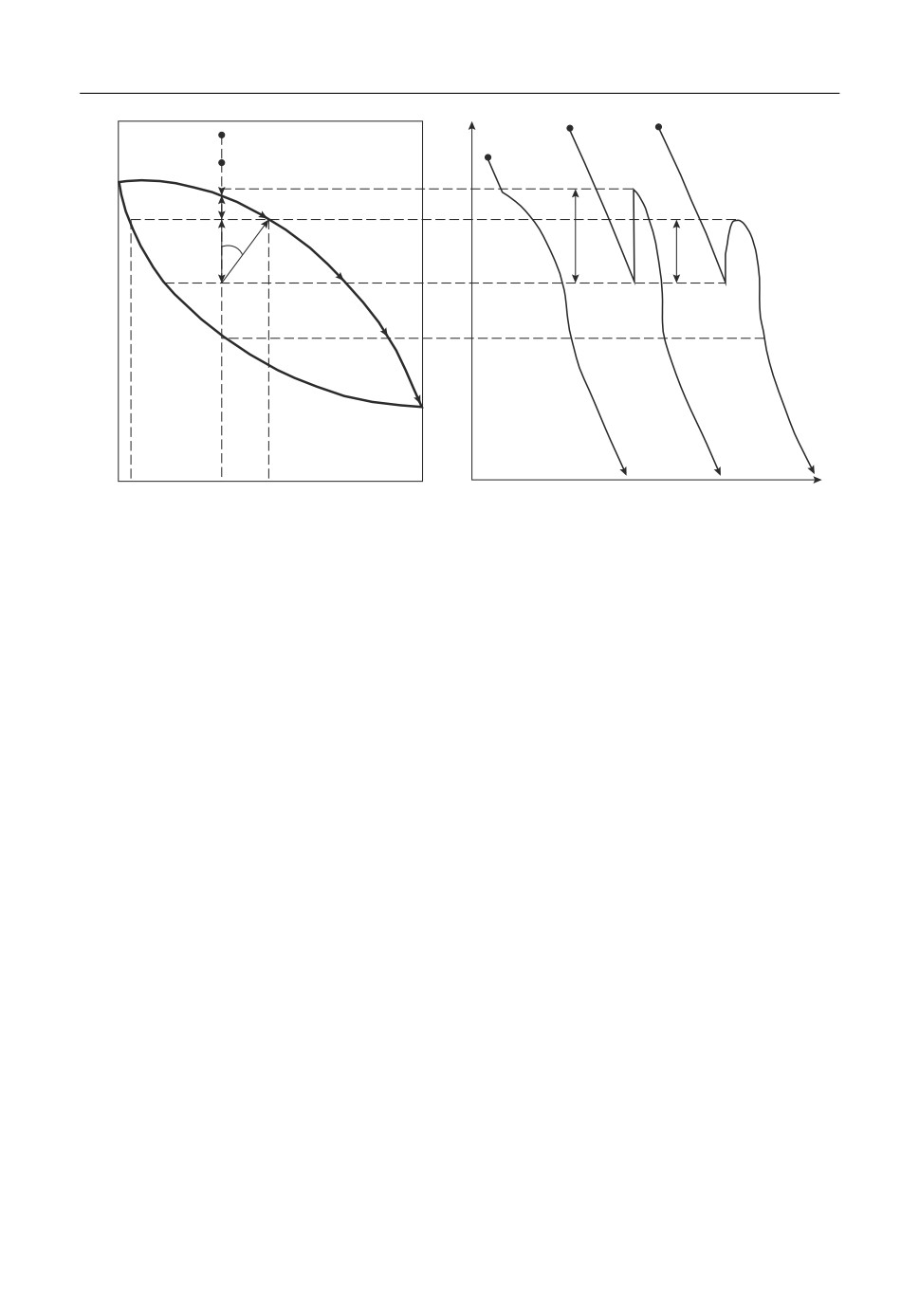
вов иллюстрируют схематические термограммы I-III на рис. 3 на примере охлажде)
ния сплава из точек a* или
в левой части диаграммы. При охлаждении предва)
a'
*
рительно слабо прогретой жидкой фазы из точки a* (термограмма I) и равновесной
кристаллизации первые кристаллы α начинают выпадать в точке а при соответству)
Т
ющей температуре ликвидуса. По мере понижения температуры от точки а до точки
g
образуются последующие кристаллы α . В результате жидкость обедняется молекула)Т
Динамика изменения кластерной структуры расплавов
239
E '
a'
b'
+
+
ΔТА
ТK
ТА
a
ж + Kα
-
ΔТА
ж + Зα
e
Tmin
b
ж + Зβ
g
ж + Kβ
ж + αT
e'
+
ΔТА
ж + βT
αT + Kβ
ТB
g'
βT + Kα
-
ΔТB
αT + βT
E
A
B
Рис. 2. Схема изменения структуры фаз при равновесной и неравновесной кристаллизации сплавов, образу)
ющих непрерывный ряд твердых растворов.
ми компонента А. В этом случае концентрация этих молекул уменьшается, а путь рав)
новесной кристаллизации проходит по направлению
и т.д. до точки
a* → a → d'
T
B
Термограммы II-III (рис. 3) относятся к неравновесной кристаллизации, которая
может происходить после сильного прогрева жидкой фазы, например, из точки A' и
-
дальнейшего охлаждения. Она начинается из точки е из области переохлаждений
ΔT
При этом возможны различные варианты записи термограмм. Так термограмма II ха)
рактеризует вариант взрывной кристаллизации на начальном этапе с подъемом темпе)
−
ратуры на величину
до температуры ликвидуса в точке а. При этом возможно рас)
T
плавление всех зародышей и, следовательно, система возвращается в исходное состо)
яние, а затвердевание будет носить равновесный характер (как и в случае
термограммы I) от точки а до точки g.
240
В. Д. Александров, С. А. Фролова, А. П. Зозуля
T
a'
a'
a'
a*
a*
TA
a
a
a
f
d
d '
d
ϕ
-
ΔT1
–
e
ΔT2
e
e
g
g
g
g
TB
I
II
III
c2
c3
A c1
B
τ (время)
Рис. 3. Пути равновесной и неравновесной кристаллизации сплава по диаграмме состояния и термограм)
мам охлаждения.
В реальных системах при неравновесной кристаллизации на начальной стадии тем)
пература
из метастабильного состояния (точки е) не всегда достигает температуры
T
min
-
ликвидуса (термограмма III), а поднимается до точки d после переохлаждения
В
ΔT2
данном случае в точке d образуется первоначальная
)твердая фаза. Состав жидкой
α
фазы будет соответствовать точке d' с концентрацией c и твердой фазе с концентра)
3
циейc на диаграмме. Положение точкиd' можно характеризовать своеобразным век)
1
тором
под углом ϕ к вертикали. Путь неравновесной кристаллизации в данном
ed'
случае предположительно пройдет через точки
или
a a → e → d'→TB
Угол ϕ очевидно будет зависеть от состава сплавов, характера кри)
a' d →d' →TB.
сталлизации, скорости охлаждения, предыстории расплава и т.д.
3. ВЫВОДЫ
Подводя итог, можно сделать вывод о том, что диаграмма состояния, дополненная
областями сосуществования различных предкристаллизационных структурных единиц
(кластеров и зародышей в расплаве) как выше, так и ниже температуры плавления (лик)
видуса) позволяет последовательно прослеживать этапы кластеризации, зародышеобра)
зования и последующих видов кристаллизации от равновесной к неравновесной.
СПИСОК ЛИТЕРАТУРЫ
1. Уб б е л о д е А . Р. Расплавленное состояние вещества. М.: МГУ, 1986. 264 с.
2. Ф р о с т Б . Р. Т. Строение жидких металлов // В кн. “Успехи физики металлов”. 1958. II.
С. 126-176.
3. С к р ы ш е в с к и й А . Ф . Структурный анализ жидкостей и аморфных сред. М.: Выс)
шая школа, 1980. 328 с.
4. Та т а р и н о в а Л . И . Структура твердых аморфных и жидких веществ. М.: Наука, 1983.
152 с.
Динамика изменения кластерной структуры расплавов
241
5. Д а н и л о в В . И . Строение и кристаллизация жидкостей. Изд)во АН Украинской ССР,
1956. 568 с.
6. C h a l m e r s B . Principles of Solidification. New York. London. Sidney: John Wiley Sons /
Inc., 1968. 288 p.
7. Ф л е м и н г с М . Процессы затвердевания. М.: Мир, 1977. 423 с.
8. А р х а р о в В . И . , Н о в о х а т с к и й И . А . О внутренней адсорбции в расплавах //
Доклады АН СССР. 1969. 185. № 5. 1069 с.
9. А р х а р о в В . И . К вопросу о трактовке механизма фазовых превращений на основе
диаграмм равновесных состояний сплавов // Физика твердого тела. 1979. № 9. С. 73-80.
10. А л ексан дров В .Д ., Ф ролова С .А ., П оки н тели ц а Е .А ., З озуля А .П . ,
А м е р х а н о в а Ш . Л . Динамика изменеия кластерной структуры в процессе равновесной и
неравновесной кристаллизации // Расплавы. 2017. № 6. С. 484-490.
11. А л е к с а н д р о в В . Д . , П о к и н т е л и ц а Е . А . Кластерно)коагуляционная кри)
сталлизация переохлажденных жидкостей. Palmarium Academic Publiching, Deutschland, 2015.
176 c.
12. К и д я р о в Б . И . Кинетика образования кристаллов из жидкой фазы. Новосибирск:
Наука, 1979. 79 с.
13. А л е к с а н д р о в В . Д . , Б а р а н н и к о в А . А . , Ф р о л о в а С . А . Построение диа)
граммы состояния Bi-Sb, Sn-Bi с предкристаллизационными переохлаждениями // Метал)
лы. 2002. № 5. С. 105-111.
14. А л е к с а н д р о в В . Д . Кинетика зародышеобразования и массовой кристаллизации
переохлажденных расплавов и аморфных сред. Донецк: Донбасс, 2011. 591 с.
15. К о т т р е л л А . Х . Строение металлов и сплавов. М.: Металлургиздат, 1961. 288 с.
16. Ж д а н о в Г. С . Физика твердого тела. М.: МГУ, 1962. 502 с.
Dynamics of Cluster Structure Change in Melts that Forms a Continuous Series
of Solid Solutions During Equilibrium and Nonequilibrium Crystallization
V. D. Aleksandrov1, S. A. Frolova1, A. P. Zozulya1
1Donbas National Academy of Civil Engineering and Architecture,
Derzhavin st. 2g, Makeyevka, Donetsk region, 86123 Ukraine
The scheme of a cluster structure of melts that forms a continuous series of solid solu)
tions in the overheated and overcooled states concerning liquidus temperatures is developed.
Structure change dynamics of clusterized liquid during cooling and further equilibrium and
nonequilibrium crystallization is analyzed. Coexistence areas of liquid solution with clusters,
nucleus and a solid phase are designated. Borders of a clustering and a way of their transfor)
mation to nucleus and crystals of solid solutions are defined. The thermograms of cooling
characterizing different types of crystallization of alloys are considered. On their basis the
analysis of ways of crystallization according to state diagram is given.
Keywords: melts, binary system, alloys, solid solutions, state diagram, solubility, entropy,
clusters, clustering, nucleus, equilibrium and nonequilibrium crystallization, thermograms
REFERENSES
1. Ubbelode A.R. Molten state of matter [Rasplavlennoe sostoyanie vethestva]. Moscow: MGU,
1986. 264 p. [In Rus.].
2. Frost B.R.T. The structure of liquid metals [Stroenie zhidkikh metallov] // In book. “Uspekhi
fiziki metallov”. 1958. II. P. 126-176. [In Rus.].
3. Skrihshevskiyj A.F. Structural analysis of liquids and amorphous media [Strukturnihyj analiz
zhidkosteyj i amorfnihkh sred]. Moscow: Vihsshaya shkola, 1980. 328 p. [In Rus.].
4. Tatarinova L.I. The structure of solid amorphous and liquid substances [Struktura tverdihkh
amorfnihkh i zhidkikh vethestv]. Moscow: Nauka, 1983. 152 p. [In Rus.].
5. Danilov V.I. Structure and crystallization of liquids [Stroenie i kristallizaciya zhidkosteyj]. Izd)vo
AN Ukrainskoyj SSR, 1956. 568 p. [In Rus.].
242
В. Д. Александров, С. А. Фролова, А. П. Зозуля
6. Chalmers B. Principles of Solidification. New York. London. Sidney: John Wiley Sons / Inc.,
1968. 288 p.
7. Flemings M. Solidification processes [Processih zatverdevaniya]. Moscow: Mir, 1977. 423 p.
[In Rus.].
8. Arkharov V.I., Novokhatskiyj I.A. On internal adsorption in melts [O vnutrenneyj adsorbcii v ras$
plavakh] // Dokladih AN SSSR. 1969. 185. № 5. 1069 p. [In Rus.].
9. Arkharov V.I. On the interpretation of the mechanism of phase transformations based on the
equilibrium state diagrams of alloys [K voprosu o traktovke mekhanizma fazovihkh prevratheniyj na os$
nove diagramm ravnovesnihkh sostoyaniyj splavov] // Fizika tverdogo tela. 1979. № 9. P. 73-80.
[In Rus.].
10. Aleksandrov V.D., Frolova S.A., Pokintelica E.A., Zozulya A.P., Amerkhanova Sh. K. Dynam)
ics of change of cluster structure in the process of equilibrium and nonequilibrium crystallization [Di$
namica izmeneniya klasternoy strukturi v processe ravnovesvoy i neravnovesvoy crystallizacii] // Ras)
plavy. 2017. № 6. P. 484-490. [In Rus.].
11. Aleksandrov V.D., Pokintelica E.A. Cluster)coagulation crystallization of supercooled liquids
[Klasterno$koagulyacionnaya kristallizaciya pereokhlazhdennihkh zhidkosteyj]. Palmarium Academic
Publiching, Deutschland, 2015. 176 p. [In Rus.].
12. Kidyarov B.I. The kinetics of the formation of crystals from the liquid phase [Kinetika obrazo$
vaniya kristallov iz zhidkoyj fazih]. Novosibirsk: Nauka. 1979. 79 p. [In Rus.].
13. Aleksandrov V.D., Barannikov A.A., Frolova S.A. Construction of the state diagram of Bi-Sb,
Sn)Bi with pre)crystallization supercooling [Postroenie diagrammih sostoyaniya Bi-Sb, Sn-Bi s pred$
kristallizacionnihmi pereokhlazhdeniyami] // Metally. 2002. № 5. P. 105-111. [In Rus.].
14. Aleksandrov V.D. The kinetics of nucleation and mass crystallization of supercooled melts and
amorphous media [Kinetika zarodihsheobrazovaniya i massovoyj kristallizacii pereokhlazhdennihkh ras$
plavov i amorfnihkh sred]. Doneck: Donbass, 2011. 591 p. [In Rus.].
15. Kottrell A.Kh. The structure of metals and alloys [Stroenie metallov i splavov]. Moscow: Metal)
lurgizdat. 1961. 288 p. [In Rus.].
16. Zhdanov G.S. Solid state physics [Fizika tverdogo tela]. Moscow: MGU, 1962. 502 p. [In Rus.].