РАСПЛАВЫ
3 · 2019
УДК 544.344.01
МОДЕЛИРОВАНИЕ ДИАГРАММЫ СОСТОЯНИЯ СИСТЕМЫ BeO-Al2O3
© 2019 г. Д. Н. Камаев*
Курганский государственный университет, ул. Гоголя, 25, Курган, 640669 Россия
*e mail: whoost@mail.ru
Поступила в редакцию 15.01.2016
После доработки 03.08.2018
Принята к публикации 23.08.2018
Выполнено моделирование диаграммы состояния BeO-Al2O3 с использованием
теорий регулярных и субрегулярных ионных растворов и полиномиальной модели
Редлиха-Кистера. Расчеты с применением субрегулярной теории и модели Редли
ха-Кистера удовлетворительно согласуются с имеющимися экспериментальными
данными.
Ключевые слова: диаграмма состояния, термодинамическое моделирование, оксид
бериллия, оксид алюминия.
DOI: 10.1134/S0235010619030071
ВВЕДЕНИЕ
Диаграмма состояния системы BeO-Al2O3 имеет важное прикладное значение при
производстве специальных видов керамических материалов, для получения (выращи
вания) синтетических профилированных монокристаллов александрита, которые
применяются в качестве активных элементов перестраиваемых лазеров инфракрасно
го диапазона, и находят применение в атмосферном зондировании и медицине. Одна
ко какие либо сведения по термодинамике данной системы в литературных источни
ках отсутствуют.
В работе [1] в системе BeO-Al2O3 отмечается наличие двух химических соединений
BeO · Al2O3, отвечающее природному хризобериллу и BeO · 3Al2O3. При этом авторы
исследования не смогли точно установить характер плавления, BeO · 3Al2O3 и приво
дили два варианта диаграммы состояния системы, где указанное соединение плавится
либо конгруэнтно, либо инконгруэнтно. В работе [2] было установлено существова
ние соединения 3BeO · Al2O3, которое плавится инконгруэнтно при температуре
1980°C. Однако результаты проверочного исследования системы [3] окончательно
установили конгруэнтное плавление BeO · 3Al2O3 и отсутствие каких либо других со
единений кроме BeO · Al2O3 и BeO · 3Al2O3. Координаты инвариантных точек в систе
ме по данным исследования [3] представлены в табл. 1.
С учетом важности материалов получаемых на основе данной системы и в связи с
отсутствием каких либо сведений по термодинамике, а также экспериментальными
трудностями, обусловленными высокими температурами, нами было выполнено тер
модинамическое моделирование диаграммы состояния системы BeO-Al2O3.
МОДЕЛИРОВАНИЕ ДИАГРАММЫ СОСТОЯНИЯ
Моделирование выполняли посредством расчета диаграммы состояния системы с
использованием моделей регулярных, субрегулярных ионных растворов, полиноми
альной модели Редлиха-Кистера. Справочные данные энтальпий плавления чистых
компонентов были взяты из источника [4].
266
Д. Н. Камаев
Таблица 1
Инвариантные точки в системе BeO-Al2O3
Состав, мол. %
Температура, °C
№
Фазы
Процесс
экспериментальные
BeO
Al2O3
данные [3]
1
BeO + расплав + BeO · Al2O3
Эвтектика
57.6
42.4
1835
2
BeO · Al2O3 + расплав
Плавление
50
50
1870
3
BeO · Al2O3 + расплав + BeO · 3Al2O3
Эвтектика
40.1
59.9
1850
4
BeO · 3Al2O3 + расплав
Плавление
25.1
74.9
1910
5
BeO · 3Al2O3 + расплав + Al2O3
Эвтектика
20.1
79.9
1890
С позиций теории регулярных ионных растворов выражение химического потенци
ала для компонентов бинарной системы имеет вид:
0
2
µi =µ
i
+
RT
ln
x
i
+
(1-
x
i
)
⋅ Q
12
,
где
- стандартный химический потенциал; xi - мольная доля i ого компонента в
µ0i
расплаве; Q12 - энергетический параметр смешения компонентов.
Для модели субрегулярных ионных растворов химические потенциалы компонен
тов бинарной системы выражаются следующим образом:
0
2
2
2
3
μ
=μ
+ν [
RT ln x
+
3x
x
Q
+
(2
-3x
)x
x
Q
+
(1-3x
)x
Q
]
,
1
1
1
1
1
2
1112
1
1
2
1122
1
2
1222
0
3
2
2
2
μ
=μ
+ν [
RT ln x
+
(1
-3x
)x
Q
+
(2
-3x
)x
x
Q
+
3x
x
Q
]
,
2
2
2
2
2
1
1112
2
2
1
1122
1
2
1222
где νi - число катионов металла в оксиде;
- стандартный химический потенциал;
µ0i
x1 и x2 мольные доли компонентов в расплаве; Q1112, Q1122, Q1222 - энергетические пара
метры взаимодействия (смешения) компонентов. Индекс “1” относится к BeO, ин
декс “2” относится Al2O3.
Полиномиальная модель Редлиха-Кистера описывает зависимость избыточной
энергии Гиббса, и, следовательно, коэффициентов активности компонентов, от соста
ва и температуры. С позиций данной модели выражение для молярной избыточной
энергии Гиббса бинарного раствора имеет вид:
k
2
ΔG
=
x
x
⎡L
+
L
(x
-
x
)
+
L
(
x
-
x
)
+
⎤
=
x
x
L
(x
-
x
) ,j
1
2
0
1
1
2
2
1
2
1
2
∑
j
1
2
⎣
⎦
j
=0
где x1 и x2 - мольные доли компонентов в расплаве; Lj - численные коэффициенты.
При удержании первых трех слагаемых (j = 0, 1, 2) и выполнении необходимых мате
Моделирование диаграммы состояния системы BeO-Al
2
O3
267
матических преобразований выражения для коэффициентов активности компонентов
бинарного раствора принимают вид [5]:
2
2
RT ln
γ
=
(1-
x
)
⎡L
+
L
(4x
-1)
+
L
(12x
-8x
+1)⎤,
1
1
0
1
1
2
1
1
⎣
⎦
2
2
RT ln
γ
=
x
⎡L
+
L
(4x
-3)
+
L
(
12x
−16x
+
5
)
⎤,
2
1
0
1
1
2
1
1
⎣
⎦
где γ1 и γ2 - коэффициенты активности 1 ого и 2 ого компонентов; L0, L1, L2 - число
вые коэффициенты.
В таком случае выражения для химических потенциалов компонентов расплава
можно записать как:
0
2
2
µ = µ
+
RT ln x
+(1-
x
)
⎡L
+
L
(4x
-1)
+
L
(
12x
−8x
+1
)
⎤,
1
1
1
1
0
1
1
2
1
1
⎣
⎦
0
2
2
µ2 = µ
+
RT ln x
+
x
⎡
L
+
L
(4x
-3)
+
L
(
12x
−16x
+
5
)
⎤
2
2
1
0
1
1
2
1
1
⎣
⎦
Плавление соединения BeO · Al2O3 описывается уравнением:
BeO⋅
Al
2
O
3
=
BeO
+
Al
2
O
3
Выражение для константы равновесия данного процесса имеет вид:
K =a
⋅a
2
3
BeO Al
O
Зависимость константы равновесия от температуры определяли выражением
A
ln
K
=-
+
B,
T
где K - константа равновесия, A и B - численные коэффициенты, T - температура, и
с учетом общепринятой формулы
0
µ =µ
+
RT ln a,
выражали с использованием выбранных моделей. Аналогично отражали зависимость
для константы плавления для соединения BeO · 3Al2O3. Более подробная методика мо
делирования излагается в работах [5, 6].
Для расчетов по каждой из моделей записывали уравнения для равновесий в репер
ных точках, в качестве которых были выбраны инвариантные точки равновесий и точ
ка конгруэнтного плавления BeO · Al2O3. После записи всех возможных равновесий
решали полученные системы уравнений и находили энергетические параметры сме
шения компонентов, а также значения коэффициентов A и B для констант плавления
химических соединений. Зная все необходимые параметры, рассчитывали линию
ликвидус, как функцию температуры от состава.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Величина параметра энергетического смешения для теории регулярных растворов
составила следующее значение: Q12 = -71190 Дж/моль.
Значения параметров взаимодействия для субрегулярной теории соответственно
равны Q1112 = -82330 Дж/моль, Q1122 = 72110 Дж/моль, Q1222 = -1699 Дж/моль.
Размеры числовых коэффициентов в модели Редлиха-Кистера составляют L0 = -23920,
L1 = -21540, L2 = -51330.
Значения численных коэффициентов A и B для констант плавления химических со
единений для каждой из моделей представлены в табл. 2.
Рассчитанные координаты инвариантных точек в сравнении с экспериментальны
ми данными показаны в табл. 3.
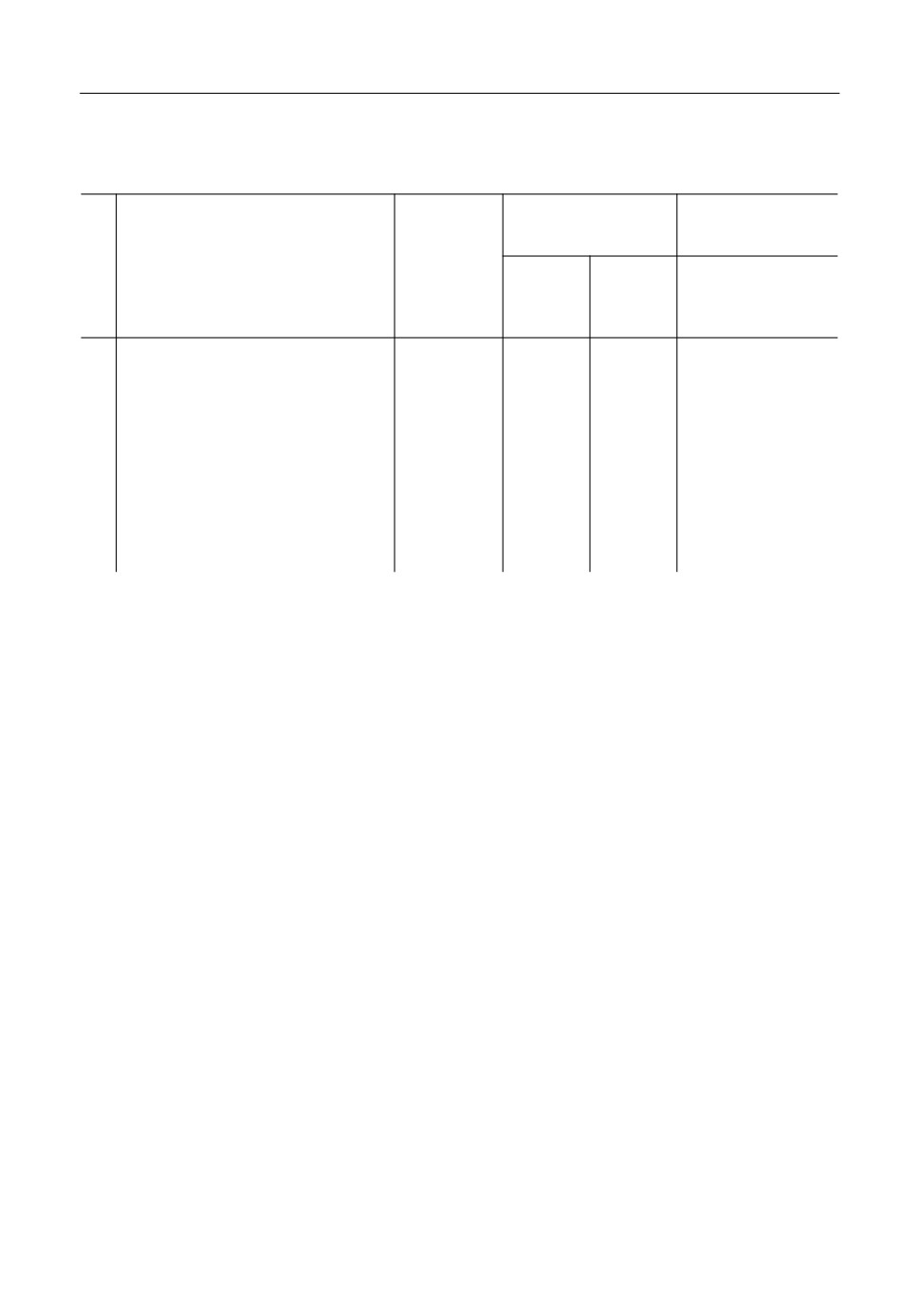
Моделирование по теории регулярных растворов (рис. 1) неудовлетворительно со
гласуется с данными эксперимента. Координаты обеих точек эвтектики не согласуют
268
Д. Н. Камаев
T, °C
2100
2100
2050
2050
2000
2000
1950
1950
1896°C
1900
1893°C
1900
1870°C
BeO · 3Al2O3 +
1855°C
1850°C
+ Al2O
3
1850
1850
BeO + BeO · Al2O
3
BeO · Al2O3 + BeO · 3Al2O3
0
10
20
30
40
50
60
70
80
90
100
BeO
Al2O3 мол. %
Al2O3
Рис. 1. Диаграмма состояния системы BeO-Al2O3: расчет по теории регулярных растворов.
T, °C
2700
2700
2600
2600
2500
2500
2400
2400
2300
2300
2200
2200
2100
2100
1910°C
2000
2000
1870°C
1890°C
1900
1900
1850°C
1835°C
1800
BeO · Al2O3 +
1800
BeO + BeO · Al2O3
B
eO · 3Al2O3 + Al2O3
+ BeO · 3Al2O3
1700
1700
0
10
20
30
40
50
60
70
80
90
100
BeO
Al2O3 мол. %
Al2O3
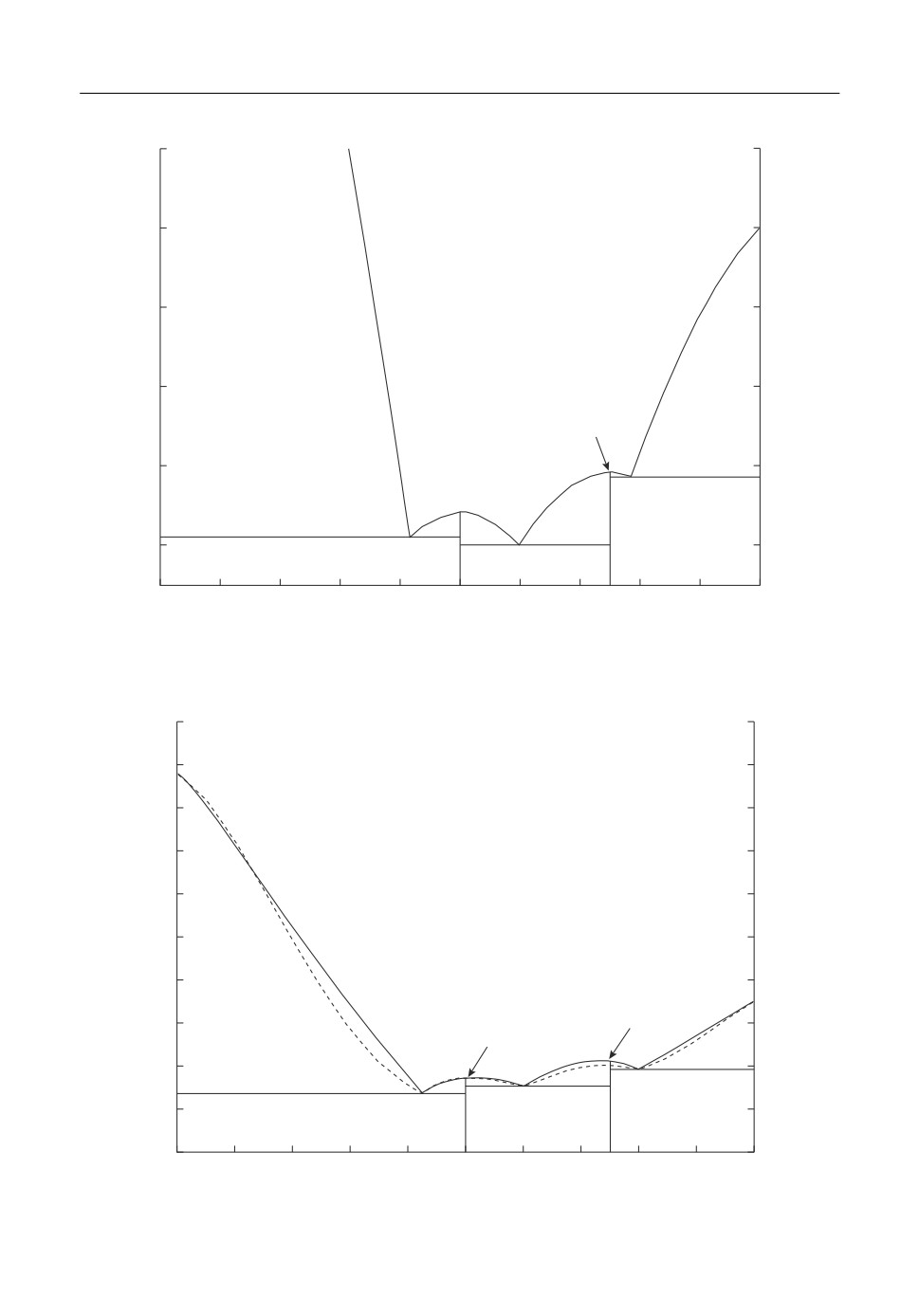
Рис. 2. Диаграмма состояния системы BeO-Al2O3: экспериментальные данные (сплошная линия), расчет по
теории субрегулярных растворов (пунктир).
Моделирование диаграммы состояния системы BeO-Al
2
O3
269
Таблица 2
Значения коэффициентов A и B для константы плавления соединений в системе BeO-Al2O3
Химическое соединение
Расчетная модель
BeO · Al2O3
BeO · 3Al2O3
A
B
A
B
Регулярные растворы
31360
11.251
6777
1.583
Субрегулярные растворы
64010
24.307
-23510
-13.389
Модель Редлиха-Кистера
2987
-0.664
9567
1.043
ся с данными эксперимента, температура плавления BeO · 3Al2O3 ниже эксперимен
тальной.
Расчеты по субрегулярной теории и по модели Редлиха-Кистера можно считать
удовлетворительными, несмотря на то, что линия равновесия чистого оксида берил
T, °C
2100
2100
2050
2050
2000
2000
1950
1950
1910°C
1900
1900
1890°C
1870°C
1850°C
1850
1850
1835°C
BeO · 3Al2O3 + Al2O3
BeO · Al2O3 +
BeO + BeO · Al2O3
+ BeO · 3Al2O3
1800
1800
30
40
50
60
70
80
90
100
BeO
Al2O3 мол. %
Al2O3
Рис. 3. Фрагмент диаграммы состояния системы BeO-Al2O3: экспериментальные данные (сплошная линия),
расчет по теории субрегулярных растворов (пунктир).
270
Д. Н. Камаев
T, °C
2100
2100
2050
2050
2000
2000
1950
1950
1921°C
1900
1900
1890°C
1870°C
1850°C
1850
1850
1835°C
BeO · 3Al2O3 + Al2O3
BeO · Al2O3 +
BeO + BeO · Al2O3
+ BeO · 3Al2O3
1800
1800
30
40
50
60
70
80
90
100
BeO
Al2O3 мол. %
Al2O3
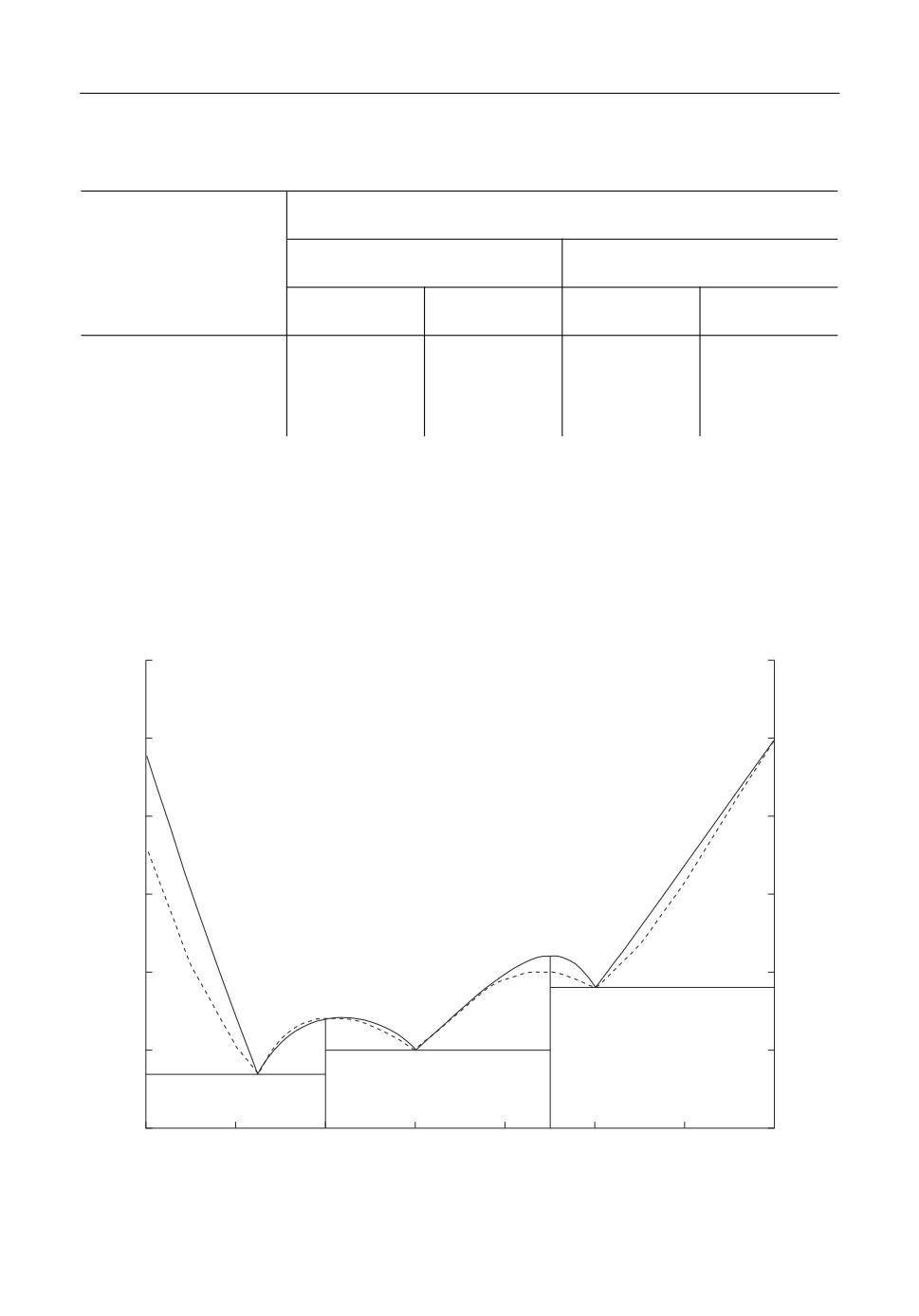
Рис. 4. Фрагмент диаграммы состояния системы BeO-Al2O3: экспериментальные данные (сплошная линия),
расчет по модели Редлиха-Кистера (пунктир).
лия с расплавом несколько расходится с данными эксперимента, а температура плав
ления BeO · 3Al2O3 в первом случае ниже на 10°C, а во втором выше на 11°C. Расчеты
диаграммы по данным моделям представлены на рис. 2, 3 и 4 соответственно.
Таблица 3
Рассчитанные координаты инвариантных точек системы BeO-Al2O3
в сравнении с экспериментальными данными
Регулярные
Субрегулярные
Модель Редлиха-
Эксперимент [3]
растворы
растворы
Кистера
№
Процесс
Al2O3
Al2O3
Al2O3
Al2O3
T, °C
T, °C
T, °C
T, °C
мол %
мол %
мол %
мол %
1
Эвтектика
42.4
1835
41.6
1855
42.4
1835
42.4
1835
2
Плавление BeO · Al2O3
50
1870
50
1870
50
1870
50
1870
3
Эвтектика
59.9
1850
59.9
1850
59.9
1850
59.9
1850
4
Плавление BeO · 3Al2O3
75
1910
75
1896
75
1900
75
1921
5
Эвтектика
79.9
1890
78.5
1893
79.9
1890
79.9
1890
Моделирование диаграммы состояния системы BeO-Al
2
O3
271
ВЫВОДЫ
Выполнено моделирование диаграммы состояния системы BeO-Al2O3 с использо
ванием теорий регулярных, субрегулярных растворов и модели Редлиха-Кистера.
Модель регулярных ионных растворов неудовлетворительно согласуется с имеющими
ся экспериментальными данными, в то время как применение теории субрегулярных
ионных растворов и модели Редлиха-Кистера, соответствуют данным эксперимента.
СПИСОК ЛИТЕРАТУРЫ
1. F o s t e r W. R . , R o y a l H . F. An intermediate compound in the system BeO-Al2O3
(chrysoberyl)-Al2O3 (corundum) // J. Amer. Ceram. Soc.1949. 32. № 1. P. 26-34.
2. Га л а х о в Ф . Я . Диаграммы. Состояние силикатных систем // Изв. АН СССР. ОХН.
1957. № 9. C. 1032.
3. L a n g S . M . , F i l l m o r e C . L . , M a x w e l l L . H . The system beryllia-alumina-tita
nia: phase relations and general physical properties of three component porcelains // J. Res. Nat. Bur.
Stand. 1952. 48. № 4. P. 298-312.
cgi bin/tkv.pl?show=welcome.html (дата обращения 19.10.2015).
5. М и х а й л о в Г. Г. , Л е о н о в и ч Б . И . , Ку з н е ц о в Ю . С . Термодинамика метал
лургических процессов и систем. М.: Изд. Дом МИСиС. 2009. 520 с.
6. К а м а е в Д . Н . Термодинамическое моделирование диаграммы состояния системы
NaCl-BeCl2 // Расплавы. 2010. № 2. С. 44-48.
Modelling of the Phase Equilibriums in the System BeO-Al2O3
D. N. Kamaev
Kurgan state university, Gogol st., 25, Kurgan, 640669 Russia
Modelling of the phase equilibriums in the system BeO-Al2O3 has been carried out with
using regular, subregular theories and Redlich-Kister polynomials. Calculation with using
subregular theory and Redlich-Kister polynomials correspond to the experimental data.
Keywords: phase diagram, thermodynamic modeling, beryllium oxide, aluminum oxide
REFERENCES
1. Foster W.R., Royal H.F. An intermediate compound in the system BeO-Al2O3 (chrysoberyl)-
Al2O3 (corundum) //Journ. Amer. Ceram. Soc.1949. 32. № 1. P. 26-34.
2. Galahov F.Y. Diagrams. State of silicate systems [Diagrammy. Sostoyaniye silikatnykh sistem] //
Izvestia AN USSR. 1957. № 9. Р. 1032. [In Rus.].
3. Lang S.M., Fillmore C.L., Maxwell L.H. The system beryllia-alumina-titania: phase relations
and general physical properties of three component porcelains // Journ. Res. Nat. Bur. Stand. 1952.
48. № 4. P. 298-312.
tkv.pl?show=welcome.html (accessed 19.10.2015).
5. Mikhailov G.G., Leonovich B.I, Kuznetsov Y.S. Thermodynamics in the metallurgical process
es and systems [Termodynamica metallurgicheskih processov i system]. Moscow, MISA Publ. 2009.
520 p. [In Rus.].
6. Kamaev D.N. Thermodynamics modeling of the phase equilibriums in the system NaCl-BeCl2
[Termodinamicheskoe modelirovanie diagrammi sostoyania systemi NaCl-BeCl2] // Melts [Rasplavy].
2010. № 2. P. 44-48. [In Rus.].