РАСПЛАВЫ
3 · 2019
УДК 546.62:546.831.4:546.05
КИНЕТИКА ЭЛЕКТРОВЫДЕЛЕНИЯ ЦИРКОНИЯ И АЛЮМИНИЯ
ИЗ РАСПЛАВОВ KF-AlF3-ZrO2
© 2019 г. А. А. Филатовa, b, *, А. В. Суздальцевa, А. Ю. Николаевa, b, Ю. П. Зайковa, b
aИнститут высокотемпературной электрохимии УрО РАН,
ул. Академическая, 20, Екатеринбург, 620137 Россия
bУральский федеральный университет, ул. Мира, 19, Екатеринбург, 620002 Россия
*e<mail: fill.romantic@yandex.ru
Поступила в редакцию 14.08.2018
После доработки 26.11.2018
Принята к публикации 13.01.2019
Методами вольтамперометрии и стационарной поляризации изучены кинетиче
ские закономерности электровосстановления циркония и алюминия из расплавов
KF-AlF3-Al2O3-ZrO2 при температуре 750°С. Исследовано влияние содержания
оксида ZrO2, материала подложки и скорости развертки потенциала на кинетику ка
тодного процесса в исследуемых расплавах в стационарных и нестационарных усло
виях. Показано, что электровосстановление циркония протекает преимущественно
в условиях диффузионных затруднений и не является обратимым. Оценены предель
ные токи катодного процесса в расплавах KF-AlF3-Al2O3-ZrO2 и коэффициенты
диффузии электроактивных ионов в исследуемых расплавах в зависимости от содер
жания ZrO2 в расплаве. Полученные результаты были использованы для проведения
электролизных испытаний и разработки нового способа получения лигатур Al-Zr из
оксидов в расплавах на основе системы KF-AlF3.
Ключевые слова: алюминий, цирконий, лигатура, расплав, KF-AlF3-Al2O3, электро
восстановление, вольтамперометрия.
DOI: 10.1134/S0235010619030046
1. ВВЕДЕНИЕ
В настоящее время лигатуры Al-Zr получают сплавлением индивидуальных компо
нентов либо алюминотермическим восстановлением солей циркония [1-4]. Оба спо
соба представляются неэффективными с точки зрения энерго и ресурсосбережения,
поскольку в ходе технологического процесса используются дорогостоящие реагенты
(чистый алюминий, цирконий, соли циркония), часть из которых остается в невостре
бованном шлаке, содержащем оксиды. Ввиду того, что спрос на алюминиевые сплавы
и композиты растет, повышается и актуальность разработки новых энергоэффектив
ных способов получения лигатурного полупродукта для получения сплавов. Ранее на
ми была исследована возможность получения сплавов и лигатур Al-Zr при электроли
зе оксидно фторидных расплавов KF-AlF3 и KF-NaF-AlF3 с добавками оксидов
ZrO2 и Al2O3 [5, 6]. Благодаря хорошей растворимости и кинетике растворения данных
оксидов [7-10], а также относительно высокой электропроводности [11] данных рас
плавов, способ может быть реализован в опытно промышленном масштабе. Его ос
новные преимущества - использование наиболее дешевого сырья и возможность не
прерывного ведения процесса за счет постоянной электролитической регенерации
расплава. Однако для определения допустимых параметров электролиза необходимы
данные о закономерностях механизма и кинетики электровосстановления алюминия
и циркония из исследуемых расплавов.
288
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
Ранее электровосстановление циркония в основном изучалось во фторидных и хло
ридных расплавах, а также ионных жидкостях [12-17] с добавками солей циркония
(K2ZrF6, ZrCl4 и ZrF4). Из имеющихся данных стоит выделить, что электровосстанов
ление циркония из расплавов преимущественно лимитируется диффузией. По дан
ным разных авторов оно может протекать в одну либо две стадии на фоне параллель
ного протекания реакций диспропорционирования. Внимание кинетике совместного
электровосстановления алюминия и циркония практически не уделялось за исключе
нием ограниченного количества работ [16-19], в которых исследовано электрооса
ждение тонких пленок Al-Zr с различным составом и морфологией.
В данной работе при помощи стационарных и нестационарных электрохимических
методов изучена кинетика и некоторые особенности механизма совместного электро
восстановления циркония и алюминия из расплавов на основе системы KF-AlF3 с до
бавками ZrO2 и Al2O3.
2. ЭКСПЕРИМЕНТ
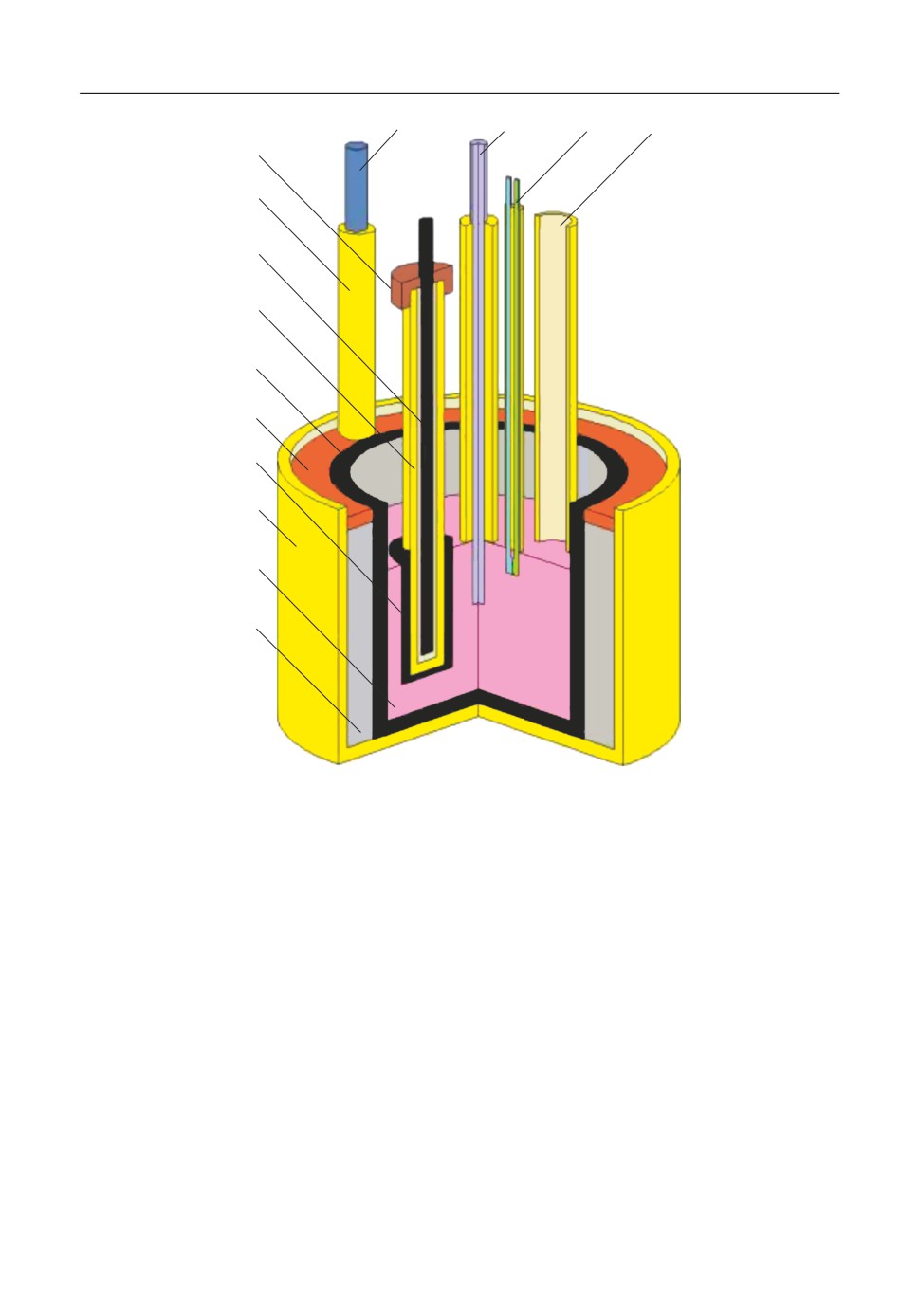
Эксперименты проводили на воздухе в трехэлектродной ячейке (рис. 1). Электролит
и электроды размещали в графитовом тигле 5 в защитном корундовом контейнере 8. За
зор между корундовым контейнером и графитовым тиглем заполняли графитовой
крошкой 10. Там же размещали нихромовый токоподвод 11 к графитовому тиглю 5,
который выполнял функцию противоэлектрода. В графитовый тигель 5 загружали ис
следуемый расплав 9 массой 150-200 г и нагревали до рабочей температуры. После
плавления в расплав добавляли необходимое количество оксида циркония (0.5-
1.5 мас. %) через корундовую трубку 14 и выдерживали смесь в течение 60 мин для
максимального растворения загруженного оксида. Опыты проводили в атмосфере
воздуха в условиях естественной конвекции расплава. По окончании эксперимента
расплав сливали в графитовую изложницу и анализировали его элементный состав.
Температуру в печи сопротивления задавали и поддерживали в пределах ±2°С при по
мощи платина платинародиевой термопары 13 и терморегулятора “Варта ТП 703”.
При измерениях в качестве рабочих электродов 12 использовали полупогруженные
стержни из вольфрама (диаметр - 0.8 мм, погружение - 10 мм) и стеклоуглерода (диа
метр - 2.5 мм, погружение - 20 мм), экранированные корундом. Потенциал рабочего
электрода измеряли относительно потенциала CO/CO2 электрода, в составе углерод
ного потенциалосъемника 3, пористых чехлов из корунда 4 и графита 7 [20].
Измерения проводили методами вольтамперометрии, квадратно волновой вольт
амперометрии с фиксацией кривой отключения потенциала, стационарной поляриза
ции и электролиза при помощи PGSTAT AutoLab 320N и ПО NOVA 1.11 (The MetrOhm,
Netherlands). Для определения и компенсации омической составляющей измеритель
ной цепи в вольтамперных методах использовали процедуру “I Interrupt”. Стационар
ные поляризационные кривые получали путем измерения и фиксации установивше
гося значения потенциала катода в зависимости от подаваемого катодного тока. Элек
тролизные испытания проводили в гальваностатическом и потенциостатическом
режимах с использованием в качестве катода графитовых цилиндров или алюминия
на дне графитового тигля 5. Состав катодных продуктов определяли при помощи
рентгенофазового анализа и сканирующей электронной микроскопии с использова
нием дифрактометра Rigaku D/MAX 2200VL/PC (Rigaku, Япония) и сканирующего
электронного микроскопа JMS 5900LV с микроанализатором INCA Energy 200 и энер
го дисперсионным микроанализатором INCA Wave 250 (JEOL, UK).
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Вольтамперометрия в расплавах KF-AlF3-Al2O3 и KF-AlF3-Al2O3-ZrO2. Для бо
лее точного понимания основных закономерностей совместного электровосстановле
Кинетика электровыделения циркония и алюминия из расплавов
289
11
12
13
14
1
2
3
4
5
6
7
8
9
10
Рис. 1. Схема ячейки для электрохимических измерений. 1 - пробка из вакуумной резины, 2, 14 - корундо
вые трубки, 3 - графитовый потенциалосъемник электрода сравнения CO/CO2, 4 - пористый корундовый
чехол, 5 - графитовый тигель, 6 - защитный слой, 7 - пористый графитовый чехол, 8 - корундовый кон
тейнер, 9 - исследуемый расплав, 10 - графитовая крошка, 11 - токоподвод к противоэлектроду, 12 - рабо
чий электрод, 13 - термопара.
ния циркония и алюминия предварительно были получены вольтамперограммы в рас
плаве KF-AlF3-Al2O3 с соотношением [KF]/[AlF3] = 1.3 мол./мол. без добавки ZrO2.
Добавку Al2O3 (0.5 мас. %) в расплав задавали изначально, поскольку практическая ре
ализация способа предполагается без использования инертной атмосферы.
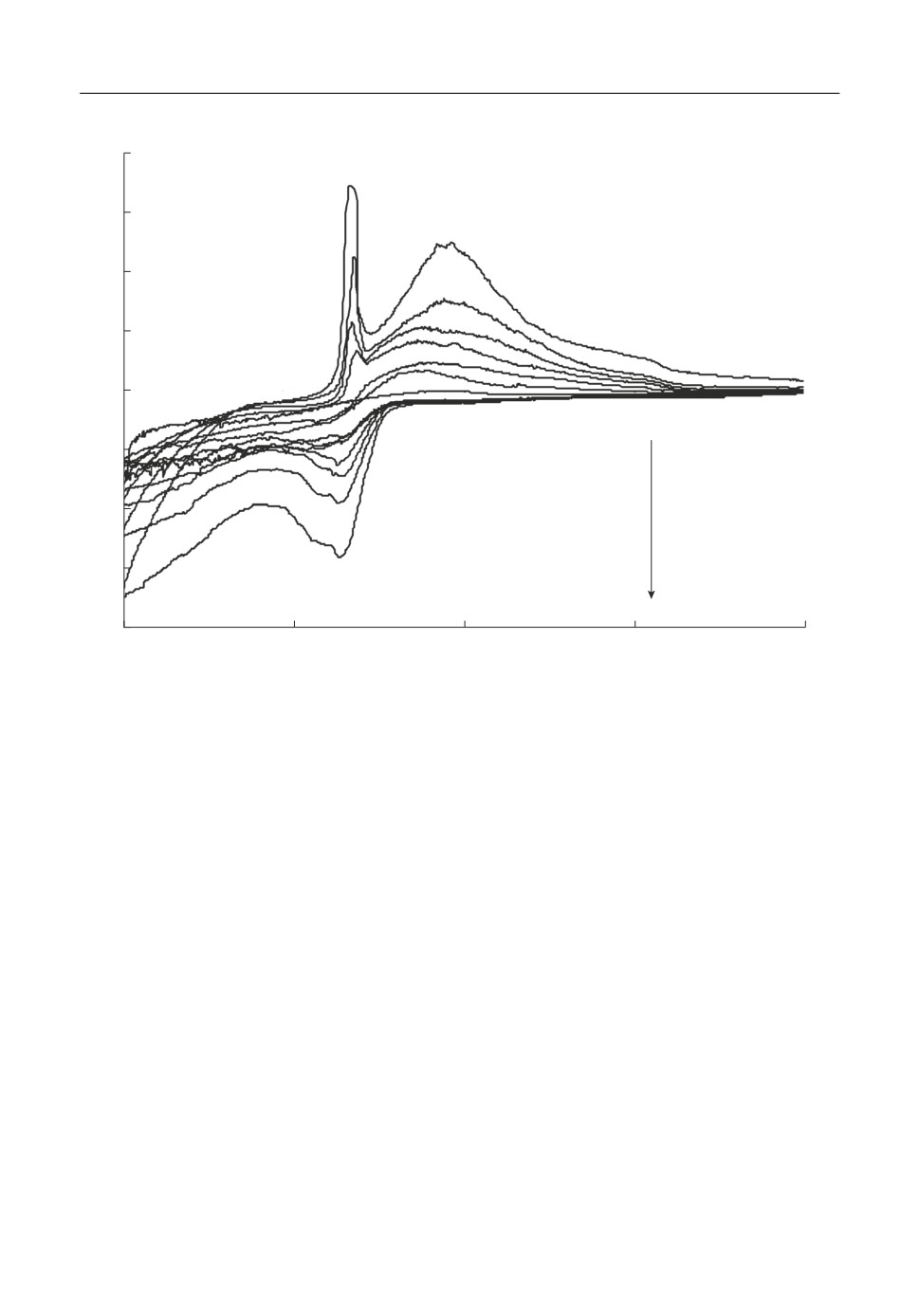
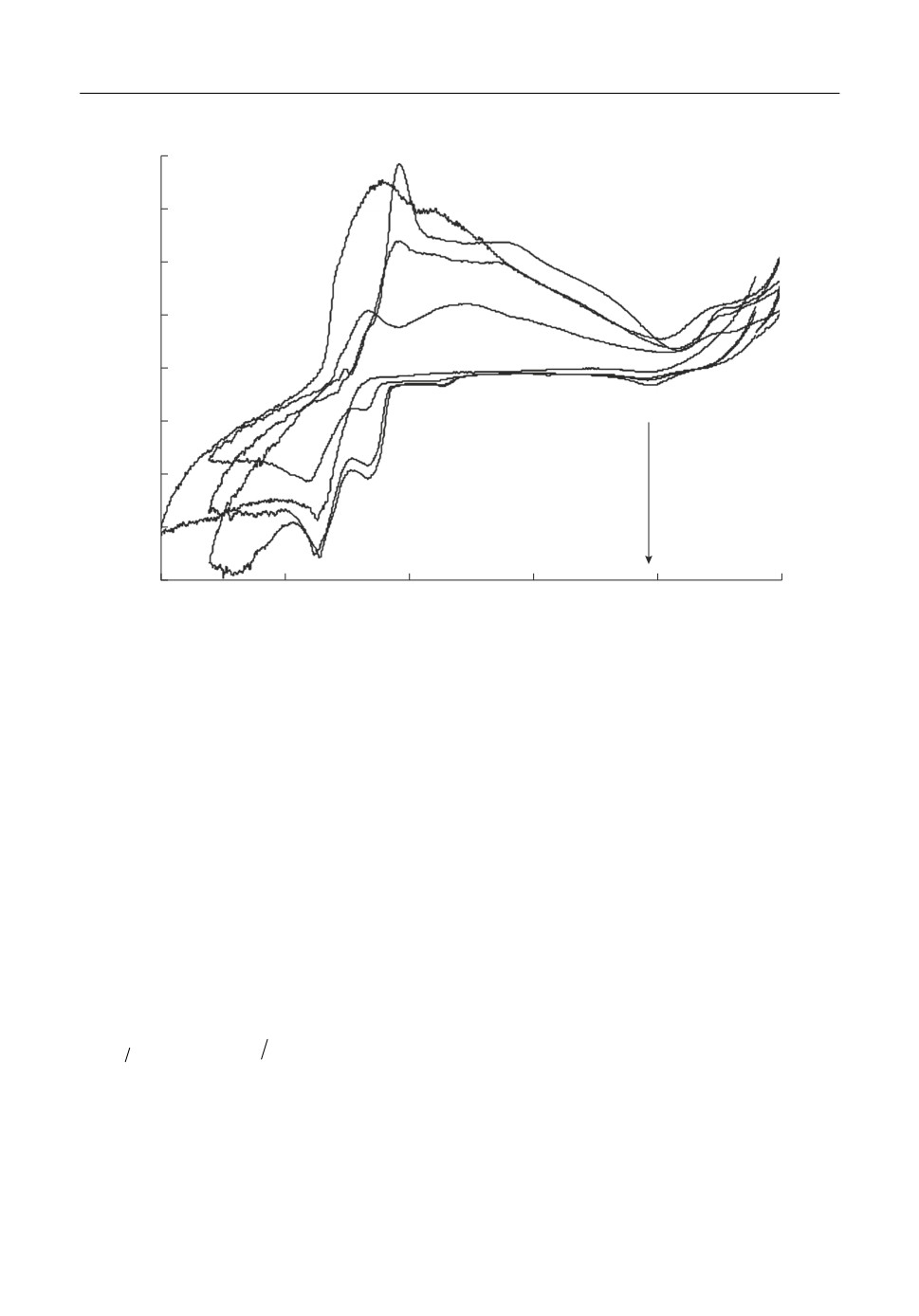
Типичные вольтамперограммы, полученные на стеклоуглероде в расплаве KF-
AlF3-Al2O3 при скоростях развертки потенциала от 0.05 до 2 В/с приведены на рис. 2.
Видно, что электровосстановление алюминия начинается при потенциалах от -1.6 до
-1.7 В относительно потенциала CO/CO2 электрода, а в области потенциалов от -1.8
до -1.9 В формируется пик Al, указывающий на диффузионную природу разряда
ионов алюминия. Дальнейшее смещение потенциала в катодную область приводит к
совместному выделению алюминия и калия (волна K). При развертке потенциала в
анодную сторону виден четкий пик Al' растворения образовавшегося алюминия в об
ласти потенциалов от -1.4 до -1.5 В, а также пик растворения калия K'.
290
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
i, A/см2
8
K'
6
Al'
4
2
0
0.03 В/с
2
0.05 В/с
0.1В/с
4
0.3 В/с
0.5 В/с
Al
6
1 В/с
2 В/с
K
8
-2.5
-2.0
-1.5
-1.0
-0.5
E, B
Рис. 2. Вольтамперограммы на стеклоуглероде в расплаве KF-AlF3-(0.5 мас. %) Al2O3 при температуре
750°С и скоростях развертки потенциала 0.05-2 В/с.
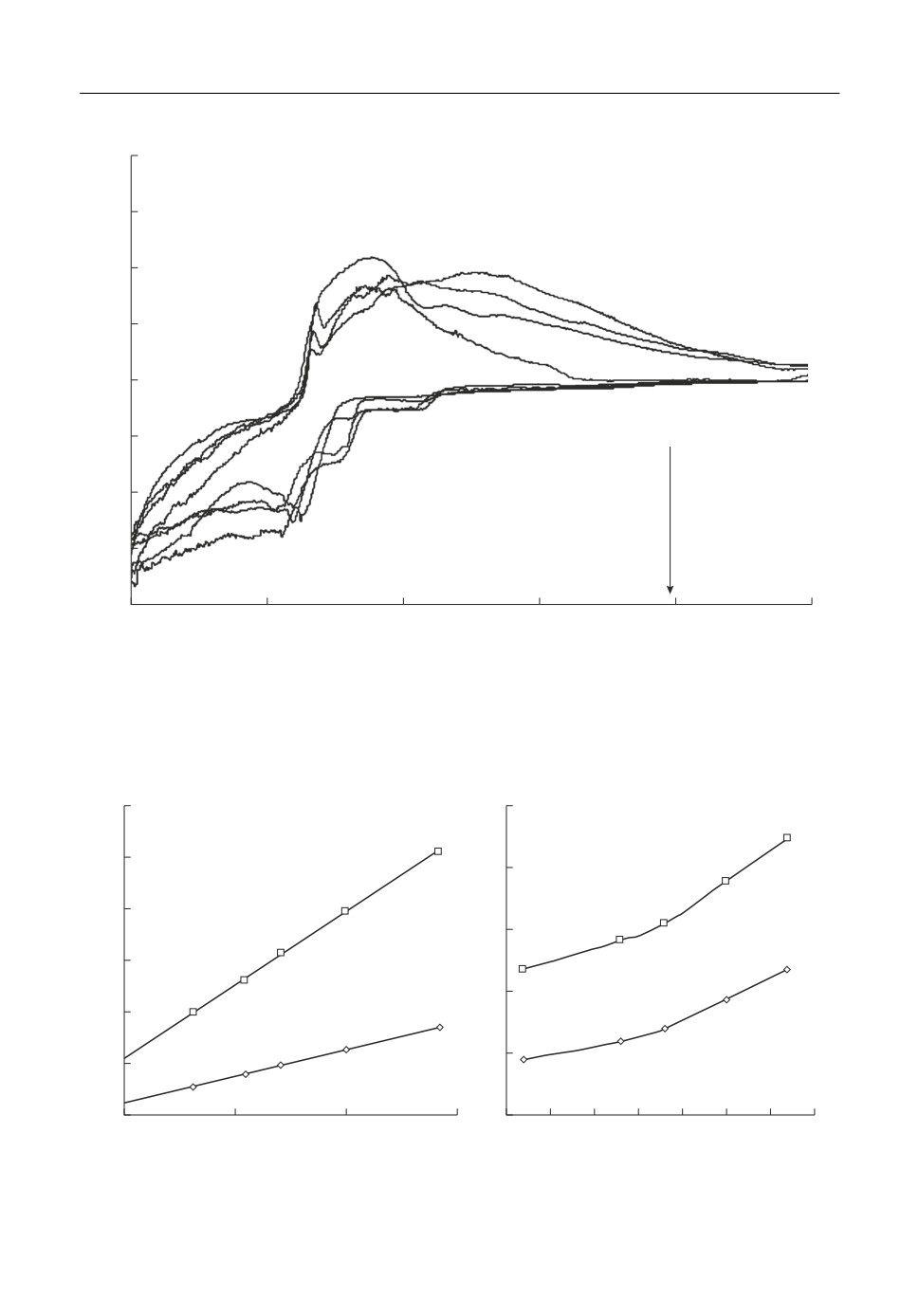
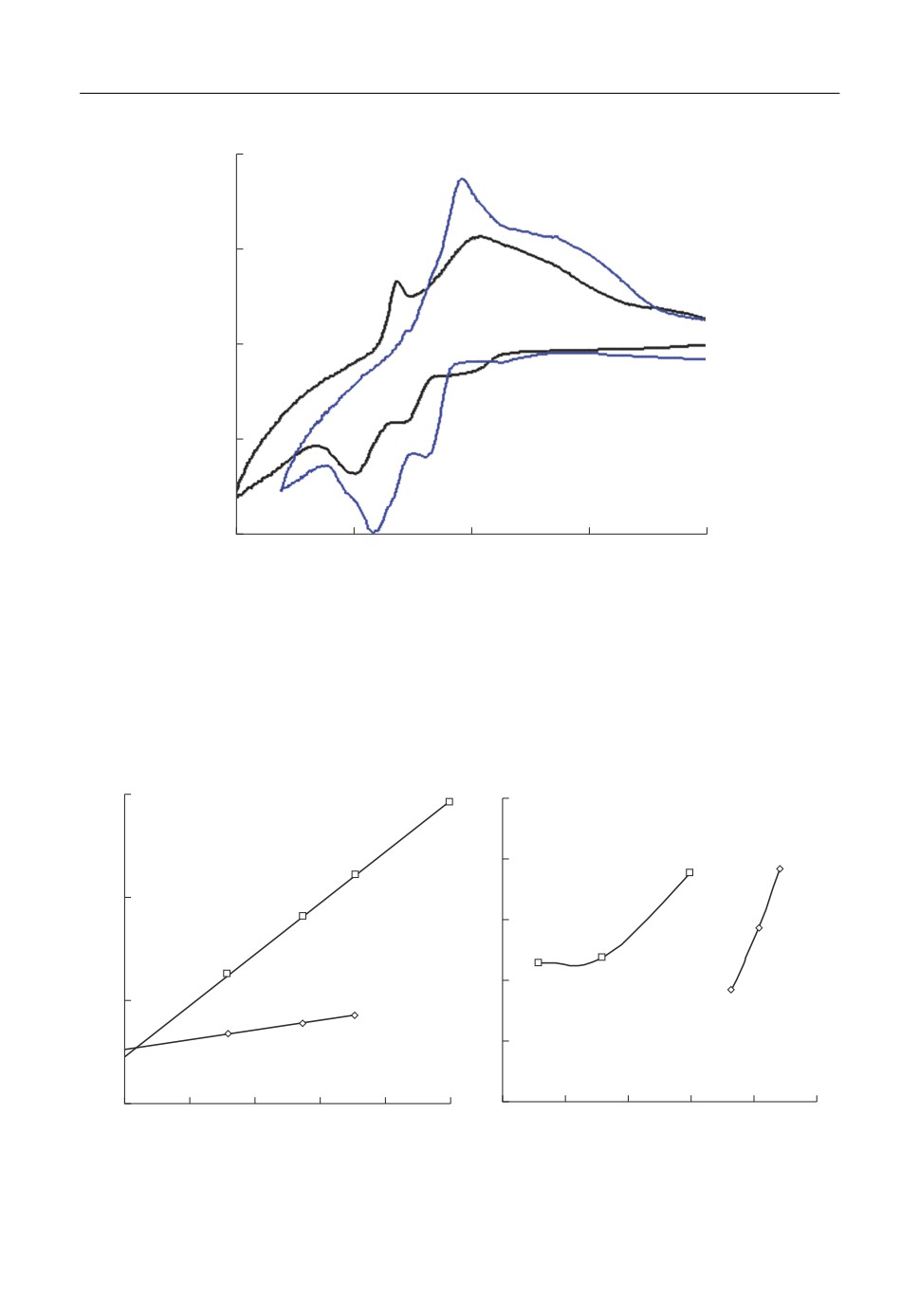
При введении ZrO2 в расплав KF-AlF3-Al2O3 на катодной ветви вольтамперограмм
(рис. 3) появляются площадка ZrI и пик ZrII разряда ионов циркония при потенциа
лах -1.4 и -1.6 В, соответственно. Наличие двух откликов может быть вызвано как
электровосстановлением элементарного циркония в две электрохимические стадии,
так и разрядом цирконий содержащих ионов разного состава [21].
При развертке потенциала в анодную область наблюдается широкая волна раство
рения алюминия и циркония (Al' + Zr'). Электровосстановление циркония при потен
циалах положительнее потенциалов выделения алюминия может быть обусловлено
рядом причин. Во первых, среди образующихся при растворении ZrO2 в расплавах
2-
2−
KF-AlF3 анионов
ZrF
6
и
Al
2
OF
6
первый обладает наименьшей энергией связей [21].
Во вторых, цирконий обладает большим сродством к углероду [22] в сравнении с алю
минием при температуре эксперимента, что может также сказываться на величине де
поляризации. С термодинамической точки зрения суммарные процессы электровос
становления циркония и алюминия из их оксидов равновероятны [22].
Для всех концентраций ZrO2 в исследуемом расплаве плотности токов пиков выде
ления циркония ZrII увеличиваются при увеличении скорости развертки потенциала,
а потенциалы пиков тока смещаются в отрицательную область. Для более выраженно
го пика ZrII получены диагностические зависимости (рис. 4) плотности тока пика (ip)
от квадратного корня развертки потенциала (ν1/2) и потенциала пика (Ep) от натураль
ного логарифма скорости развертки потенциала (ln(ν)). Полученные зависимости
Кинетика электровыделения циркония и алюминия из расплавов
291
i, A/см2
4
3
Al'
Al' + Zr'
2
K'
1
0
мас. % ZrO2
ZrI
1
0
ZrII
2
0.5
1.0
Al
3
1.2
K
4
-2.5
-2.0
-1.5
-1.0
-0.5
0
E, B
Рис. 3. Вольтамперограммы на стеклоуглероде в расплавах KF-AlF3-(0.5 мас. %) Al2O3 с разным содержа
нием ZrO2 при температуре 750°С и скорости развертки потенциала 0.3 В/с.
ip, A/см2
Ep, B
3.0
1.95
2.5
1.90
2
2
2.0
1.85
1.5
1
1.80
1.0
1
1.75
0.5
1.70
0
0.5
1.0
1.5
-2.5 -2.0 -1.5 -1.0 -0.5
0
0.5
1.0
ln(ν)
ν1/2, (В/с)1/2
Рис. 4. Зависимости ip от ν1/2 и Ep от ln(ν) для стеклоуглерода в расплавах KF-AlF3-(0.5 мас. %) Al2O3 с со
держанием ZrO2 (мас. %): 1 - 0.5; 2 - 1.
292
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
i, A/см2
10
Al'
8
6
4
2
0
2
0.03 В/с
0.05 В/с
4
0.1В/с
6
0.3 В/с
0.5 В/с
8
K
1 В/с
Al
2 В/с
10
-2.5
-2.0
-1.5
-1.0
-0.5
E, B
Рис. 5. Вольтамперограммы на вольфраме в расплаве KF-AlF3-(0.5 мас. %) Al2O3 при температуре 750°С и
скоростях развертки потенциала от 0.03 до 2 В/с.
указывают на то, что исследуемый процесс протекает преимущественно в условиях
диффузии и не является обратимым [23, 24].
Кинетика электровосстановления алюминия из расплавов KF-AlF3-Al2O3 была
изучена ранее в работах [25, 26]. Было показано, что для всех исследуемых температур
и концентраций Al2O3 в расплаве преобладающим характером затруднений катодного
процесса является диффузия электроактивных ионов к катоду из вольфрама или стек
лоуглерода. Добавление ZrO2 в расплав приводит к усложнению механизма электро
восстановления алюминия за счет того, что разряд ионов алюминия может происхо
дить как на материале рабочего электрода, так и на выделившемся цирконии.
Аналогичная картина наблюдается на вольтамперограммах, характеризующих кине
тику электровосстановления алюминия и совместного электровосстановления цирко
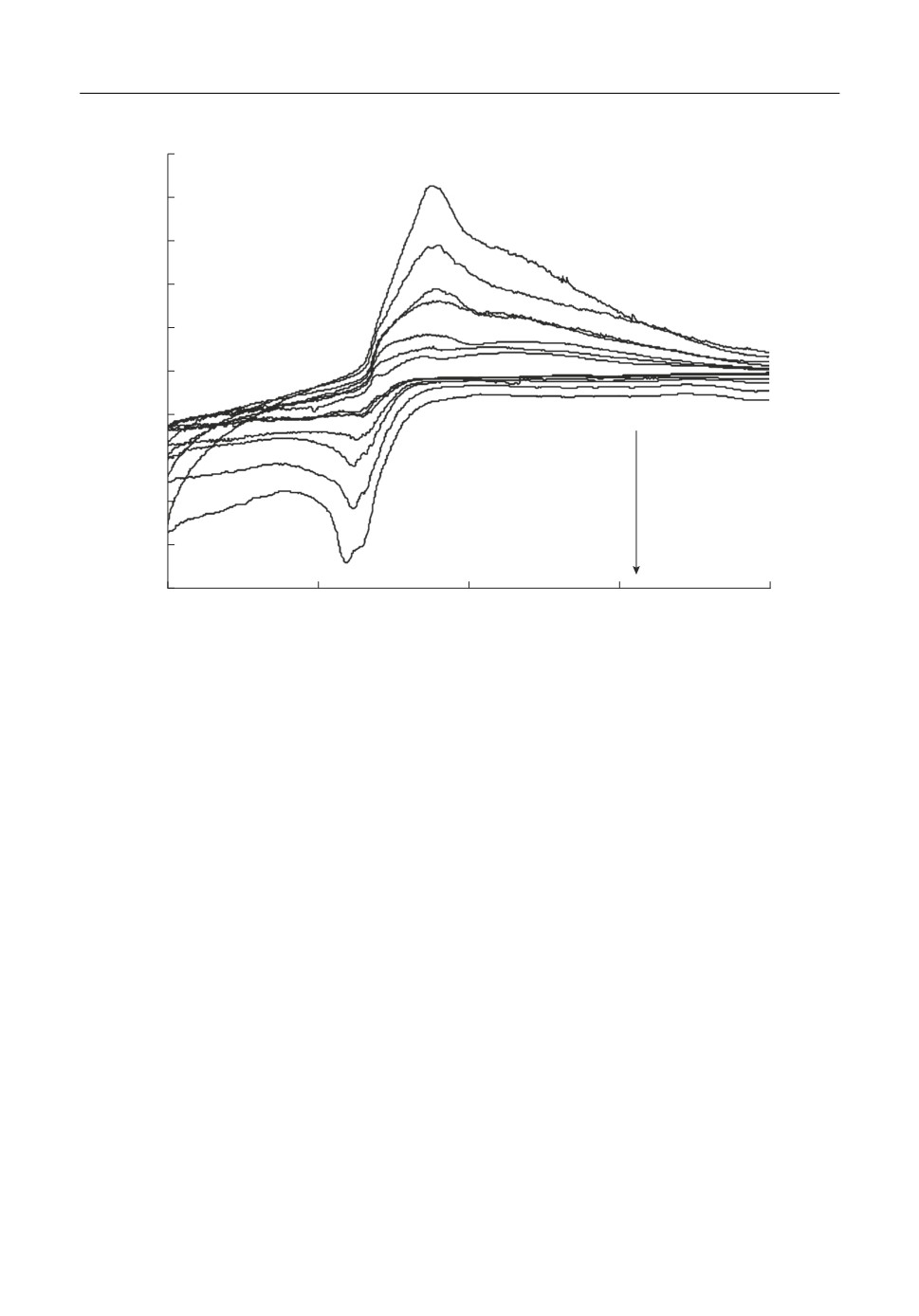
ния с алюминием из исследуемых расплавов на вольфраме. На рис. 5 приведены вольт
амперограммы, полученные на вольфраме в расплаве KF-AlF3-(0.5 мас. %) Al2O3 при
температуре 750°С и скоростях развертки потенциала от 0.03 до 2 В/с. Выделение алю
миния наблюдается отрицательнее -1.5 В относительно потенциала CO/CO2 электро
да, а соответствующий диффузионный пик Al’ формируется при потенциале от -1.8
до -1.9 В. Отсутствие пика растворения калия K' вероятнее всего связано с тем, что
вольфрам не склонен к интеркалляции в отличие от стеклоуглерода [27]. При добавле
нии ZrO2 в исследуемый расплав на вольтамперограммах появляются волна ZrI и диф
фузионный пик ZrII разряда цирконий содержащих ионов при потенциалах -1.3 и
1.6 В, соответственно (рис. 6). В области потенциалов -1.7…-1.8 В имеется четкий
пик Al выделения алюминия.
Кинетика электровыделения циркония и алюминия из расплавов
293
i, A/см2
4
Al'
3
Al' + Zr'
2
1
0
мас. % ZrO2
ZrI
1
0
2
0.5
ZrII
1.0
3
1.2
Al
4
-2.5
-2.0
-1.5
-1.0
-0.5
0
E, B
Рис. 6. Вольтамперограммы на вольфраме в расплавах KF-AlF3-(0.5 мас. %) Al2O3 с разным содержанием
ZrO2 при температуре 750°С и скорости развертки потенциала 0.3 В/с.
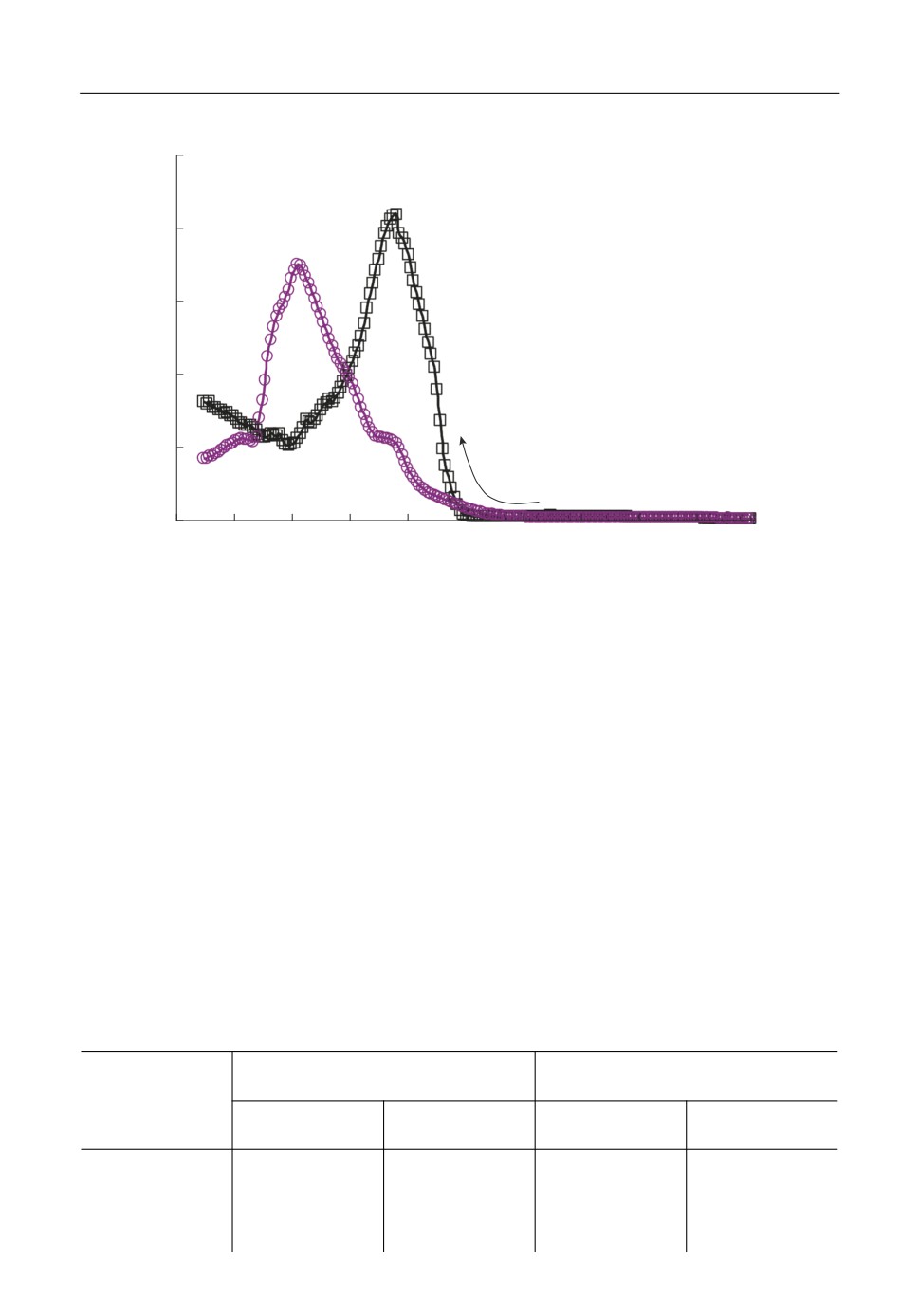
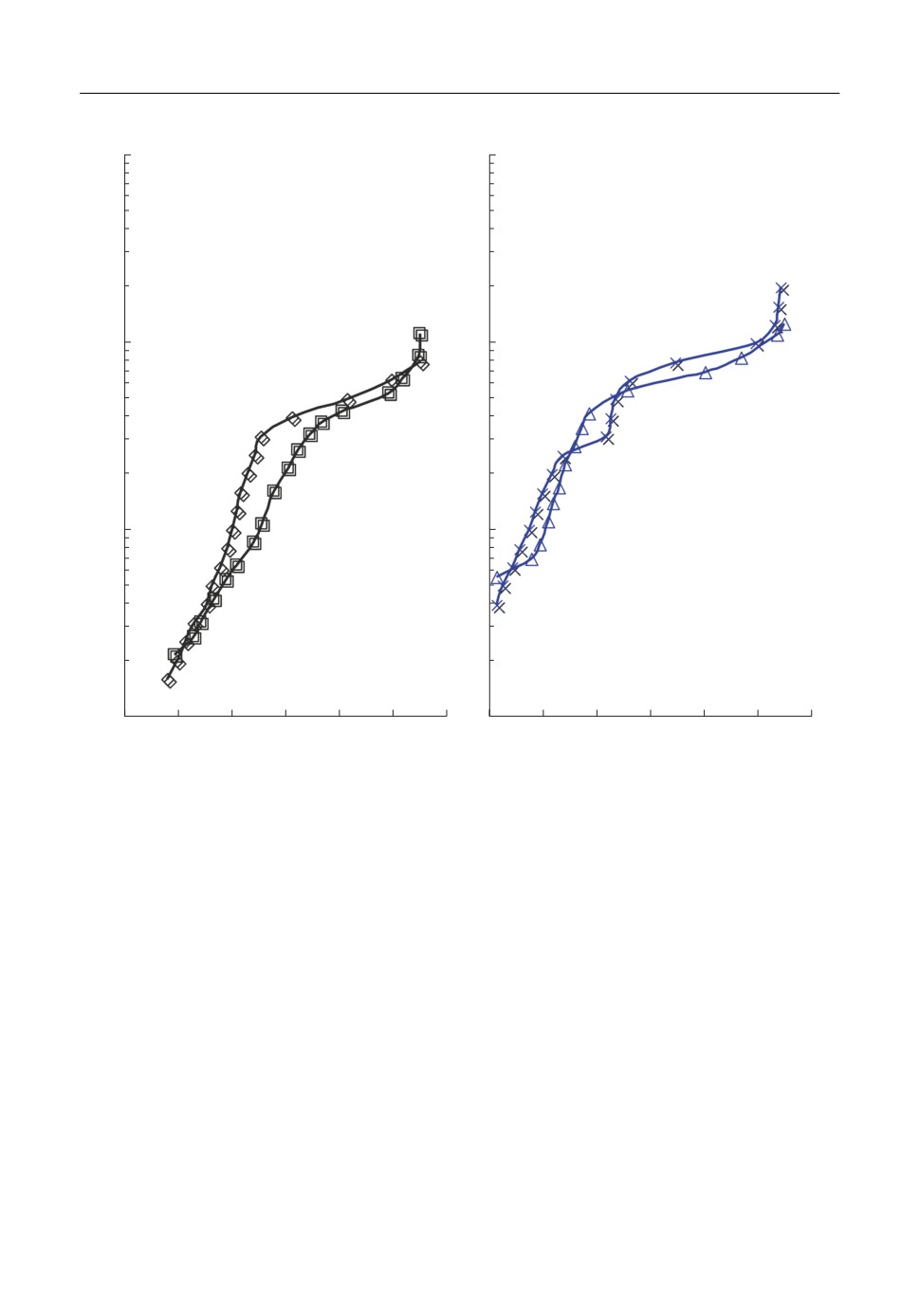
На рис. 7 приведены области вольтамперограмм, характеризующие электровосста
новление циркония и алюминия на стеклоуглероде и вольфраме при прочих равных
условиях. Электровосстановление циркония и алюминия на вольфраме протекает при
более положительных потенциалах, чем на стеклоуглероде. Это может объясняться
деполяризацией по причине образования интерметаллидных соединений вольфрама с
цирконием и алюминием [28]. При повышении скорости развертки потенциала на
блюдается рост плотностей токов пика ZrII и незначительное смещение потенциала
данного пика. Это можно более четко увидеть из диагностических зависимостей, при
веденных на рис. 8.
Из полученных вольтамперных зависимостей были оценены кинетические пара
метры электровосстановления циркония из расплавов на основе системы KF-AlF3-
Al2O3-ZrO2 в зависимости от условий поляризации. Для оценки числа электронов
процесса при четком пике ZrII использовали уравнение [23, 24]:
E
p 2
–E
p
=
2.2 RT zF ,
(1)
где: Еp/2 - потенциал полупика (В); Ep - потенциал пика (В); R - универсальная газо
вая постоянная, R = 8.314 Дж/моль · K; F - число Фарадея, F = 96487 Кл/моль; T -
температура, K; z - число электронов участвующих в текущей стадии электродного
процесса.
Результаты оценки числа электронов приведены в табл. 1. Как видно, число элек
тронов пика ZrII для всех скоростей близко к 4, что подтверждает соответствие пика
электровосстановлению циркония. Там же приведены параметры электровосстанов
ления алюминия, рассчитанные для пика Al.
294
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
i, A/см2
5.0
Al'
Al' + Zr'
2.5
1
2
K'
0
ZrI
2.5
ZrII
Al
K
5.0
-2.5
-2.0
-1.5
-1.0
-0.5
E, B
Рис. 7. Вольтамперограммы на стеклоуглероде (1) и вольфраме (2) в расплаве KF-AlF3-(0.5 мас. %) Al2O3 с
1 мас. % ZrO2 при температуре 750°С и скорости развертки потенциала 1 В/с.
ip, A/см2
Ep, B
3.0
1.72
2
1.70
2
2.0
1.68
1
1.66
1.0
1
1.64
1.62
0
0.2
0.4
0.6
0.8
1.0
-1.5
-1.0
-0.5
0
0.5
1.0
ν1/2, (В/с)1/2
ln(ν)
Рис. 8. Зависимости ip от ν1/2 и Ep от ln(ν) для вольфрама в расплавах KF-AlF3-(0.5 мас. %) Al2O3 с содержа
нием ZrO2 (мас. %): 1 - 0.5; 2 - 1.
Кинетика электровыделения циркония и алюминия из расплавов
295
Таблица 1
Кинетические параметры пиков электровосстановления циркония ZrII и алюминия Al
из расплава KF-AlF3-(0.5 мас. %)Al2O3-(1.0 мас. %)ZrO2 при температуре 750°С
ZrII
Al
ν 1/2,
ν, В/с
ln(ν)
(В/c)1/2
ip, А/см2
EP, В
EP/2, В
z
ip, А/см2
EP, В
EP/2, В
z
Стеклоуглерод
0.05
0.224
-3.00
-0.84
0.137
0.185
4.04
-
-
-
-
0.1
0.316
-2.30
-1.12
0.132
0.181
3.96
2.30
1.96
1.89
2.73
0.2
0.447
-1.61
-1.71
0.130
0.179
3.96
-
-
-
-
0.3
0.548
-1.20
-1.90
0.130
0.178
4.04
2.32
1.96
1.89
2.83
0.5
0.707
-0.69
-2.60
0.105
0.155
3.88
2.51
1.96
1.90
3.45
1
1
0
-
-
-
-
3.41
1.99
1.91
2.83
Вольфрам
0.1
0.32
-2.30
1.27
-1.67
-1.60
2.94
3.50
1.86
-1.80
3.31
0.3
0.55
-1.20
1.82
-1.67
-1.60
3.31
4.08
1.88
-1.81
3.05
0.5
0.71
-0.69
2.22
-1.67
-1.61
3.61
4.96
1.89
-1.82
2.94
1
1
0
2.96
-1.70
-1.62
2.74
9.67
1.91
-1.85
2.84
2
2
1.41
-
-
-
-
3.50
1.94
-1.87
2.74
При добавлении ZrO2 в расплав KF-AlF3-Al2O3 потенциал пика выделения алюми
ния Al сдвигается с -1.88 до -1.95 В, а плотность тока пика выделения алюминия сни
жается. Для процесса, соответствующего данному пику число электронов составило 3.
Из полученных зависимостей для низких скоростей развертки потенциала были
также оценены коэффициенты диффузии цирконий содержащих ионов. Для этого
использовали уравнение Мацуды-Аябе [23, 24]:
12
i
p
=
0.496zFCD
(αzFν
RT)
(2)
и уравнение Берзина-Делахея [23, 24]:
32
−12
-12
32
12
12
i
p
=
0.611F
R
T
z
CD
ν
,
(3)
где ip - плотность тока пика, А/см2; C - концентрация электроактивного вещества,
моль/см3; D - коэффициент диффузии, см2/с; ν - скорость развертки потенциала,
В/с; α - коэффициент переноса заряда, α = 0.5.
В табл. 2 приведены значения коэффициентов диффузии цирконий содержащих
ионов в расплаве KF-AlF3-(0.5 мас. %) Al2O3 при разном содержании ZrO2 и темпера
туре 750°С. Для обеих катодных подложек коэффициенты диффузии возрастают при
повышении содержания ZrO2 в расплаве и составляют от 1.0 · 10-8 до 6.0 · 10-8 м2/с в за
висимости от условий эксперимента. В целом, оцененные значения на порядок пре
вышают значения коэффициентов диффузии цирконий содержащих ионов в других
296
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
i, A/см2
2.5
2.0
2
1
1.5
1.0
0.5
0
-2.0
-1.9
-1.8
–1.7
-1.6
–1.5
-1.4
–1.3
-1.2
-1.1
–1.0
E, B
Рис. 9. Вольтамперограммы на стеклоуглероде в расплавах KF-AlF3-Al2O3-ZrO2 при температуре 750°С и
частоте реверса потенциала 20 Гц: 1 - 0.5 мас. % Al2O3; 2 - 0.5 мас. % Al2O3 + 1.0 мас. % ZrO2.
галогенидных расплавах [12-15] в области температур 600-900°С. Это может быть
связано с электровосстановлением циркония на фоне разряда алюминий содержащих
ионов.
3.2. КвадратноBволновая вольтамперометрия в расплавах KF-AlF3-Al2O3-ZrO2. На
рис. 9 приведены поляризационные зависимости, полученные на стеклоуглероде в
расплавах KF-AlF3-Al2O3 и KF-AlF3-Al2O3-ZrO2 методом квадратно волновой
вольтамперометрии при частоте реверса потенциала 20 Гц (соответствует скорости
развертки потенциала 0.1 В/с) с шагом 2 мВ. Развертку потенциала производили до
значения -1.95 В относительно потенциала CO/CO2 электрода. На поляризационной
зависимости, полученной в расплаве KF-AlF3-Al2O3 видны пики при потенциалах
около -1.65 и -1.80 В, соответствующие электровосстановлению алюминия из разных
Таблица 2
Коэффициенты диффузии (D · 108, м2/с) цирконийBсодержащих ионов
в расплавах KF-AlF3-Al2O3-ZrO2 при температуре 750°С
Стеклоуглерод
Вольфрам
мас. % ZrO2
расчет по (2)
расчет по (3)
расчет по (2)
расчет по (3)
0.5
1.0
0.7
4.2
2.7
1.0
3.1
1.7
5.5
4.4
1.2
6.0
0.7
5.6
3.7
Кинетика электровыделения циркония и алюминия из расплавов
297
E, B
0
0.5
1
1.0
2
1.5
2.0
0
50
100
150
200
250
300
250
400
Время отключения, с
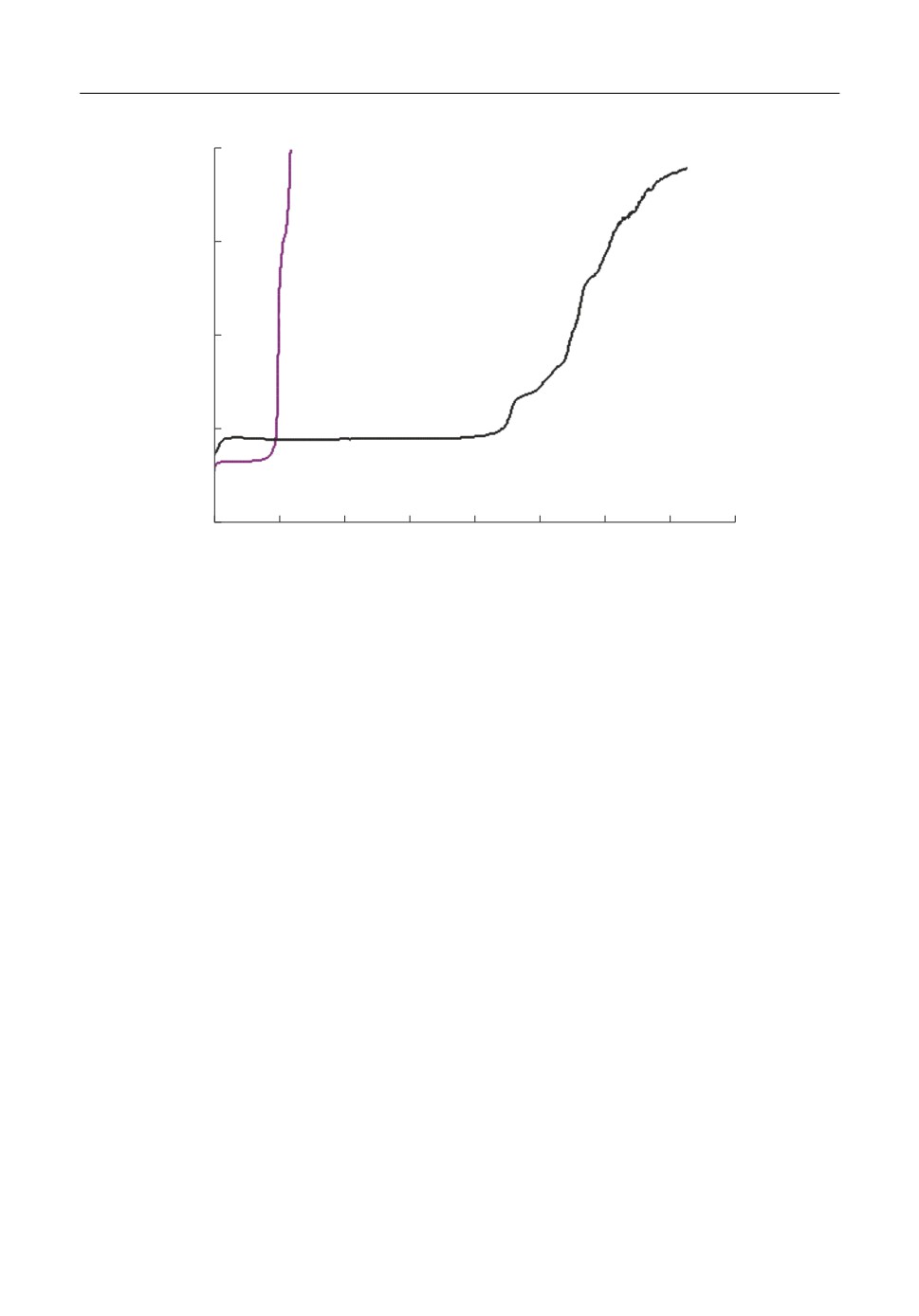
Рис. 10. Кривые спада потенциала стеклоуглерода в расплавах KF-AlF3-Al2O3 (1) и KF-AlF3-Al2O3-ZrO2 (2).
электроактивных ионов [7]. По видимому, пик при -1.80 В соответствует пику Al на
вольтамперограммах (рис. 2). При развертке потенциала отрицательнее -1.85 В сохра
няется катодный ток электровосстановления алюминия.
Добавление 1 мас. % ZrO2 к расплаву приводит к общему смещению катодных токов
электровосстановления циркония и алюминия. При этом формируется пик в области
потенциалов -1.65 В, связанный с совместным разрядом циркония и алюминия.
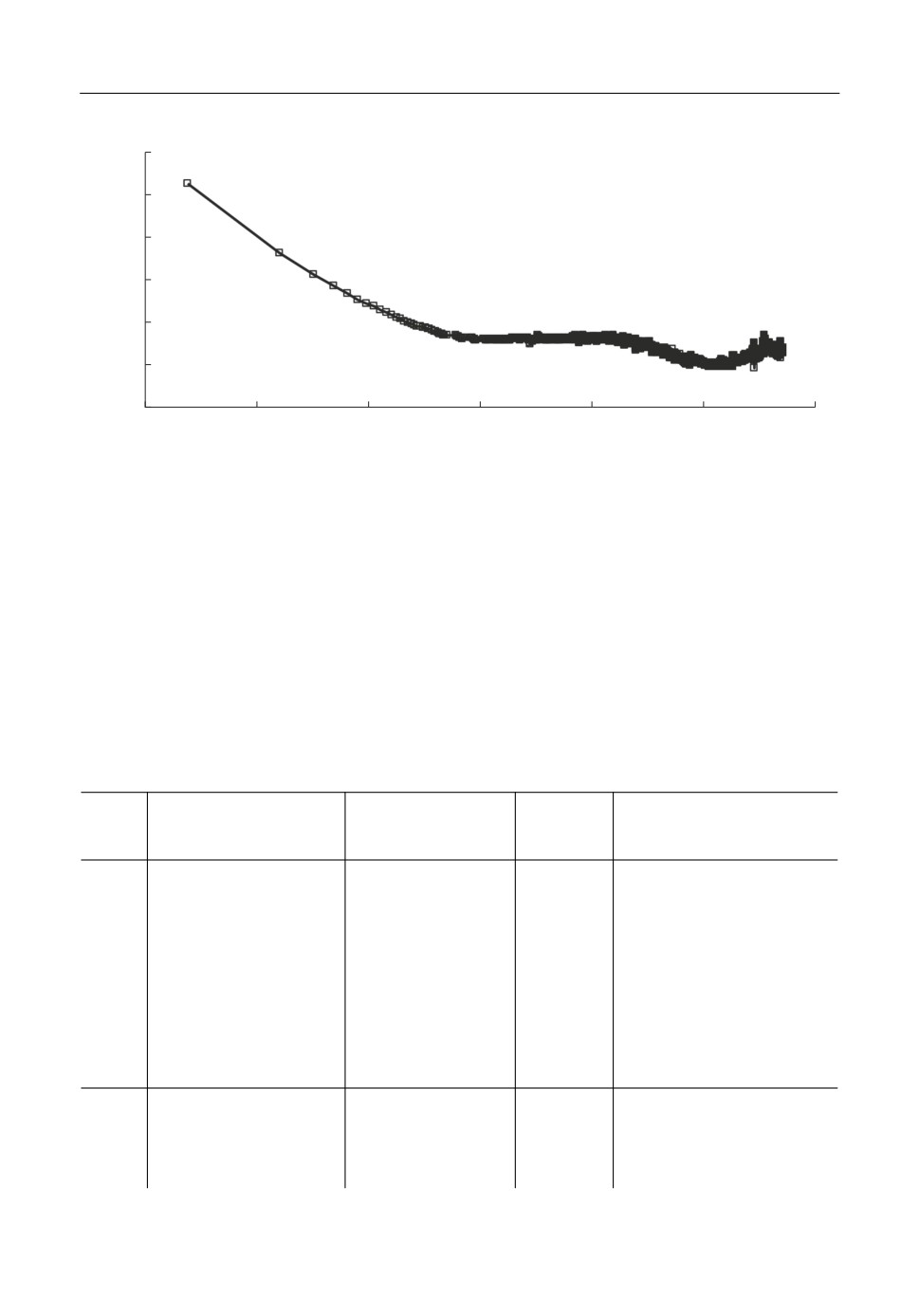
Помимо полученных поляризационных зависимостей были зафиксированы кри
вые спада потенциала стеклоуглерода, которые приведены на рис. 10. Количество
пропущенного электричества при развертке потенциала до -1.95 В составило 0.02 и
0.05 А · с для зависимостей в расплавах KF-AlF3-Al2O3 и KF-AlF3-Al2O3-ZrO2, соот
ветственно. Несмотря на это различие на кривых спада потенциала четко прослежива
ется следующее:
- на кривой спада потенциала после поляризации в расплаве KF-AlF3-Al2O3 име
ется площадка растворения алюминия при потенциале около -1.67 В, после чего по
тенциал стеклоуглерода резко уменьшается в область потенциала 0 В;
- на кривой спада потенциала после поляризации в расплаве KF-AlF3-Al2O3-ZrO2
имеется достаточно протяженная по времени (более 200 с) площадка растворения
компонентов сплава Al-Zr при потенциале около -1.56 В, после которой наблюдается
площадка растворения в области потенциалов около -1.31 В и перегибы, связанные с
растворением алюминия и циркония.
Таким образом, более длительный спад потенциала после поляризации в расплаве
KF-AlF3-Al2O3-ZrO2 связан как с более высокой величиной пропущенного количе
ства электричества, так и с замедленным растворением цирконий содержащих катод
298
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
2
i, A/см
а
б
10
1
0.1
-1.3
-1.5
-1.7
-1.9
-2.1
-2.3
-2.5
-1.3
-1.5
-1.7
-1.9
-2.1
-2.3
-2.5
E, B
E, B
Рис. 11. Стационарные поляризационные кривые на стеклоуглероде (а) и вольфраме (б) в расплавах KF-
AlF3-Al2O3 (1, 3) и KF-AlF3-Al2O3-ZrO2 (2, 4).
ных продуктов. Эти результаты согласуются с результатами, полученными при раз
вертке потенциала в анодную сторону в вольтамперных измерениях (рис. 3 и 6).
3.3. Стационарная поляризация в расплавах KF-AlF3-Al2O3-ZrO2. На рис. 11 приве
дены стационарные поляризационные зависимости, полученные на стеклоуглероде и
вольфраме в расплавах KF-AlF3-(0.5 мас. %)Al2O3 и KF-AlF3-(0.5 мас. %) Al2O3-
(1.0 мас. %) ZrO2. Добавление в расплав KF-AlF3-Al2O3 оксида ZrO2 в количестве
1 мас. % приводит к снижению перенапряжения катодного процесса на стеклоуглеро
де до 0.1…0.2 В в области плотностей тока от 0.07 до 0.50 А/см2 и незначительному из
менению перенапряжения на вольфраме. В целом предельные плотности токов элек
тровосстановления циркония и алюминия при добавлении оксида ZrO2 повышаются
на 0.10-0.15 А/см2 и достигают около 0.4-0.5 А/см2 на стеклоуглероде и 0.65-
0.75 А/см2 на вольфраме. Следовательно, в стационарных условиях электровосстанов
ление циркония также происходит при потенциалах положительнее потенциалов
электровосстановления алюминия.
Кинетика электровыделения циркония и алюминия из расплавов
299
i, A/см2
0.30
0.25
0.20
0.15
0.10
0.05
0
0.0001
0.001
0.01
0.1
1
10
100
Время, мин
Рис. 12. Изменение катодной плотности тока при потенциостатическом электролизе расплава KF-AlF3-
Al2O3-ZrO2 при потенциале катода -1.8 В.
3.4. Электролиз расплавов KF-AlF3-Al2O3-ZrO2. С учетом полученных данных о
кинетике электровосстановления циркония и алюминия была проведена серия элек
тролизных испытаний в расплавах KF-AlF3-Al2O3-ZrO2 в гальваностатическом (Г) и
потенциостатическом (П) режимах. В табл. 3 сведены параметры и результаты данных
испытаний, а на рис. 12 пример изменения катодного тока в ходе потенциостатиче
Таблица 3
Параметры электролиза расплава KF-AlF3-Al2O3-ZrO2 при 750°С
Катодная плотность тока,
Режим
Потенциал катода, В
Время, мин
Продукты в катодном осадке
А/см2
0.5
-1.95…-2.10
40
KAlF4, K3AlF6, Al3Zr
0.5
-1.90…-2.21
90
KAlF4, K3AlF6, Al3Zr
0.25
-1.81…-1.98
125
KAlF4, K3AlF6, K2ZrF6, Al3Zr
Г
0.1
-1.70…-1.75
180
KAlF4, K3AlF6, K2ZrF6, ZrO2
0.25*
-1.86…-2.03
120
Al, Al3Zr
0.5*
-1.91…-2.28
120
Al, Al3Zr
0.5*, **
-1.85…-2.30
360
Al, Al3Zr
0.25…0.06
-1.8
55
KAlF4, K3AlF6, K2ZrF6, ZrO2
П
0.62…0.15
-2.0
250
KAlF4, K3AlF6, K2ZrF6, Al3Zr
0.89…1.06
-2.2
120
KAlF4, K3AlF6
* Катод - алюминий на дне тигля, анод - графитовый цилиндр;
** Подгрузка 1 мас. % ZrO2 в час.
300
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
ского электролиза при потенциале катода -1.8 В. По данным ренгенофазового анали
за после электролизных испытаний при катодных плотностях тока от 0.15 до 0.5 А/см2
осадок на графитовом катоде представлял собой смесь солей с включениями интерме
таллидных соединений Al3Zr. При более низких и более высоких плотностях тока алю
миний и цирконий в катодном осадке обнаружены не были. Это может быть вызвано
окислением катодных продуктов при низких плотностях тока и солевой пассивацией
катода при высоких плотностях тока. При любых исследованных параметрах исполь
зование графитового катода представляется нецелесообразным поскольку отмывка
целевого продукта (Al-Zr) от фторидного расплава очень затруднительна.
В отдельной серии экспериментов в качестве катода использовали жидкий алюми
ний на дне графитового тигля. Использование данного катода позволяет, во первых,
интенсифицировать извлечение циркония из оксида в алюминий за счет протекания
параллельной реакции алюминотермического восстановления [9, 10] и, во вторых,
отделить катодные продукты (Al, Zr и Al3Zr) от компонентов расплава в виде сплавов и
лигатур Al-Zr.
По результатам экспериментальных исследований предложен новый способ полу
чения сплавов и лигатур Al-Zr из оксидов ZrO2 и Al2O3 в расплавах на основе системы
KF-AlF3 [28]. Способ осуществляется без использования инертной атмосферы, из
влечение циркония из оксида составляет от 96.5 до 99.1%, а содержание циркония в
сплавах и лигатурах может регулироваться от 0.2 до 15 мас. %.
Дальнейшая работа будет направлена на исследование физико механических
свойств получаемых сплавов и лигатур, а также на разработку способов получения
многокомпонентных функциональных сплавов на основе системы Al-Zr.
4. ВЫВОДЫ
Методами вольтамперометрии, стационарной поляризации и электролиза исследо
вана кинетика электровосстановления циркония и алюминия на стеклоуглероде и
вольфраме из расплавов KF-AlF3-Al2O3-ZrO2 при температуре 750°С. При нестацио
нарных измерениях показано, что электровосстановление циркония протекает при
более положительных потенциалах в сравнении с потенциалами электровосстановле
ния алюминия. При стационарном режиме это проявляется в снижении катодного пе
ренапряжения и повышении предельной плотности тока исследуемого процесса.
Определено влияние содержания оксида ZrO2, материала подложки и скорости раз
вертки потенциала на кинетику и основные закономерности электровосстановления
циркония и алюминия из расплавов KF-AlF3-Al2O3-ZrO2 в стационарных и нестаци
онарных условиях. Показано, что при исследованных условиях выделение циркония
протекает преимущественно в условиях диффузионных затруднений и не является об
ратимым.
Оценены предельные токи катодного процесса и коэффициенты диффузии цирко
ний содержащих электроактивных ионов в расплавах KF-AlF3-Al2O3-ZrO2 в зависи
мости от содержания ZrO2 в расплаве.
На основании полученных данных выбраны параметры и проведены электролиз
ные испытания, в результате которых был предложен новый способ получения спла
вов и лигатур Al-Zr из оксидов ZrO2 и Al2O3 в расплавах на основе системы KF-AlF3.
Благодарности. Анализы состава и структуры полученных сплавов выполнены с ис
пользованием оборудования и методик в ЦКП “Состав вещества” Института высоко
температурной электрохимии УрО РАН.
Кинетика электровыделения циркония и алюминия из расплавов
301
СПИСОК ЛИТЕРАТУРЫ
1. О г о р о д о в Д . В . , П о п о в Д . А . , Тр а п е з н и к о в А . В . Способы получения ли
гатуры Al-Zr (обзор) // Труды ВИАМ. 2015. № 11. С. 2-11.
2. Я ц е н к о С . П . , О в с я н н и к о в Б . В . , А р д а ш е в М . А . , С а б и р з я н о в А . Н .
Цементационное получение “мастер сплава” из фторидно хлоридных расплавов // Расплавы.
2006. № 5. С. 29-36.
3. R a j a g o p a l a n P. K . , S h a r m a I . G . , K r i s h n a n T. S . , B o s e D . K . Alumino
thermic reduction of K2ZrF6 for preparation of Al-Zr master alloy // Rare Metals. 1999. 18. P. 121-
122.
4. Я ц е н к о С . П . , Х о х л о в а Н . А . , П а с е ч н и к Л . А , С а б и р з я н о в Н . А . По
лучение лигатур на основе алюминия методом высокотемпературных обменных реакций в
расплавах солей. III. Мнококомпонентные модифицирующие лигатуры алюминия со сканди
ем, цирконием и гафнием // Расплавы. 2010. № 2. С. 89-94.
5. F i l a t o v A . A . , P e r s h i n P. S . , S u z d a l t s e v A . V. , N i k o l a e v A . Y u . ,
Z a i k ov Yu . P. Synthesis of Al-Zr master alloys via the electrolysis of KF-NaF-AlF3-ZrO2 melts //
Journal of the Electrochemical Society. 2018. 165. № 2. E28-E34.
6. С у з д а л ь ц е в А . В . , Ф и л а т о в А . А . , Н и к о л а е в А . Ю . , П а н к р а т о в А . А . ,
Молчанова Н.Г., Зайков Ю.П. Извлечение скандия и циркония из их оксидов при
электролизе оксидно фторидных расплавов // Расплавы. 2018. № 1. С. 5-13.
7. R o b e r t E . , O l s e n J . E . , D a n e k V. , Ti x h o n E . , O s t v o l d T. , G i l b e r t B .
Structure and thermodynamics of alkali fluoride aluminum fluoride alumina melts. Vapor pressure,
solubility, and Raman spectroscopic studies // Journal of Physical Chemistry B. 1997. 101. Р. 9447-
9456.
8. А п и с а р о в А . П . , Д е д ю х и н А . Е . , Р е д ь к и н A . А . , Тк а ч е в а O . Ю . ,
З а й к о в Ю . П . Физико химические свойства расплавленных электролитов KF-NaF-AlF3 //
Электрохимия. 2010. 46. С. 672-678.
9. Pe r s h i n P. S . , K a t a e v A . A . , F i l a t ov A . A . , S u z d a l t s e v A . V. , Z a i k ov Yu . P.
Synthesis of Al-Zr alloys via ZrO2 aluminium thermal reduction in KF-AlF3 based melts // Metal
lurgical and Materials Transactions B. 2017. 48. P. 1962-1969.
10. П е р ш и н П . С . , Ф и л а т о в А . А . , С у з д а л ь ц е в А . В . , З а й к о в Ю . П .
Алюмотермическое получение сплавов Al-Zr в расплаве KF-AlF3 // Расплавы. 2016. № 5.
С. 413-421.
11. K u b i n a k o v a E . , D a n i e l i k V. , H i ve s J . Advanced technology for Al-Zr alloy
synthesis: Electrochemical investigation of suitable low melting electrolytes // J. Alloys and Com
pounds. 2018. 738. P. 151-157.
12. Po l y a k o v a L . P. , S t a n g r i t P. T. Cathodic processes at electrolysis of chloride and
chloride fluoride melts of zirconium // Electrochimica Acta. 1982. 27. P. 1641-1645.
13. X u L . , X i a o Y. , X u Q . , S a n d w i j k A . V. , L i J . , Z h a o Z . , S o n g Q . ,
Yang Y. Electrochemical behavior of zirconium in molten LiF-KF-ZrF4 at 600°C // RSC Ad
vances. 2016. 6. P. 84472-84479.
14. C h e n Z . , L i Y. J . , L i S . J . Electrochemical behavior of zirconium in the LiCl-KCl
molten salt at Mo electrode // Journal of Alloys and Compounds. 2011. 509. P. 5958-5961.
15. G i b i l a r o M . , M a s s o t L . , C h a m e l o t P. , C a s s a y r e L . , Ta x i l P. Investiga
tion of Zr(IV) in LiF-CaF2: Stability with oxide ions and electroreduction pathway on inert and reac
tive electrodes // Electrochimica Acta. 2013. 95. P. 185-191.
16. G i l b e r t B . , M a m a n t o v G . , F u n g K . W. Electrochemistry of zirconium(IV) in
chloroaluminate melts // Inorganic Chemistry. 1975. 14. P. 1802-1806.
17. U e d a M . , Te s h i m a T. , M a t s u s h i m a H . , O h t s u k a T. Electroplating of Al-Zr
alloys in AlCl3-NaCl-KCl molten salts to improve corrosion resistance of Al // J. Solid State Electro
chemistry. 2015. 19. P. 3485-3489.
18. K a w a s e M . The electroformation of Zr metal, Zr-Al alloy and carbon films on ceramic //
Journal of Applied Electrochemistry. 2003. 33. P. 785-793.
302
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
19. Ts u d a T. , H u s s e y C . L . , S t a f f o r d G . R . , K o n g s t e i n O . Electrodeposition of
Al-Zr alloys from Lewis acidic aluminum chloride 1 ethyl 3 methylimidazolium chloride melt //
Journal of the Electrochemical Society. 2004. 151. C. 447-C454.
20. С у з д а л ь ц е в А . В . , Х р а м о в А . П . , З а й к о в Ю . П . Углеродный электрод для
электрохимических исследований в криолит глиноземных расплавах при 700-960°С // Элек
трохимия. 2012. 48. С. 1251-1263.
21. В о р о б ь е в А . С . , С у з д а л ь ц е в А . В . , Га л а ш е в А . Е . Энергия связей в рас
плавленных системах M-Al-Zr-O-F (M = Li, Na, K) // Расплавы. 2019. № 2. С. 156-166.
22. Tu r k d o g a n E . T. Physical chemistry of high temperature / Academic Press, NY. 1980.
23. B a r d A . J . , Fa u l k n e r L . R . Electrochemical methods: fundamentals and applications,
2nd ed. John Wiley & Sons, NY. 2001.
24. S c h o l z F. Electroanalytical methods, 2nd ed. Springer Verlag, Berlin. 2010.
25. N i k o l a e v A . Yu . , S u z d a l t s e v A . V. , Po l y a k o v P. V. , Z a i k o v Yu . P. Cath
ode process at the electrolysis of KF-AlF3-Al2O3 melts and suspensions // J. the Electrochemical So
ciety. 2017. 164. № 8. H5315-H5321.
26. Н и к о л а е в А . Ю . , Я с и н с к и й А . С ., С у з д а л ь ц е в А . В . , П о л я к о в П . В . ,
З а й к о в Ю . П . Вольтамперометрия в расплаве и суспензиях KF-AlF3-Al2O3 // Расплавы.
2017. № 3. С. 214-225.
27. Л я к и ш е в Н . П . Диаграммы состояния двойных металлических систем: Справочник
в 3 т. М.: Машиностроение, 1996.
28. С у з д а л ь ц е в А . В . , Ф и л а т о в А . А . , Н и к о л а е в А . Ю . , П е р ш и н П . С . ,
Зайков Ю.П. Способ получения лигатур алюминия с цирконием // Патент RU2658556,
приоритет 24.08.2017. Опубликован: 21.06.2018, бюл. 18.
Kinetic of Zirconium and Aluminium Electrowinning from the KF-AlF3-ZrO2 Melts
A. A. Filatov1, 2, A. V. Suzdaltsev1, A. Yu. Nikolaev1, 2, Yu. P. Zaikov1, 2
1The Institute of High<Temperature Electrochemistry of the UB RAS,
st. Akademicheskaya, 20, Yekaterinburg, 620137 Russia
2Ural Federal University, Mira st., 19, Yekaterinburg, 620002 Russia
Kinetics of zirconium and aluminum electroreduction from the KF-AlF3-Al2O3-ZrO2
melts at a temperature of 750°C have been studied by means of voltammetry methods and
stationary polarization. The effects of the ZrO2 additions, substrate material and polariza
tion rate on the kinetics and the main features of the zirconium and aluminum electroreduc
tion under stationary and nonstationary conditions were studied. It was shown that the zir
conium electroreduction is primary accompanied by diffusion difficulties and it is not re
versible. The limiting currents of the cathode process in the KF-AlF3-Al2O3-ZrO2 melts as
well as diffusion coefficients of zirconium containing electroactive ions were estimated, de
pending on the ZrO2 content in the melts under study. The results obtained were used for
electrolysis tests. A new method for Al-Zr master alloys production from oxides during
electrolysis of the KF-AlF3 based melts was proposed.
Keywords: aluminium, zirconium, master alloy, melt, KF-AlF3-Al2O3, cathode process,
electroreduction, voltammetry
REFERENSES
1. Ogorodov D.V., Popov D.A., Trapeznikov A.V. Ways to obtain ligatures Al-Zr (review) [Sposoby
polucheniya ligatury Al-Zr (obzor)] // Trudy VIAM. 2015. № 11. С. 2-11. [In Rus.].
2. Yatsenko S.P., Ovsyannikov B.V., Ardashev M.A., Sabirzyanov A.N. Cementation production of
a “master alloy” from fluoride chloride melts [Tsementatsionnoye polucheniye “master<splava” iz ftori<
dno<khloridnykh rasplavov] // Rasplavy. 2006. № 5. С. 29-36. [In Rus.].
3. Rajagopalan P.K., Sharma I.G., Krishnan T.S., Bose D.K. Aluminothermic reduction of
K2ZrF6 for preparation of Al-Zr master alloy // Rare Metals. 1999. 18. P. 121-122.
Кинетика электровыделения циркония и алюминия из расплавов
303
4. Yatsenko S.P., Khokhlova N.A., Pasechnik L.A, Sabirzyanov N.A. Production of ligatures based
on aluminum by the method of high temperature exchange reactions in molten salts. Iii. Mnokoko
mponentnye modifying ligatures of aluminum with scandium, zirconium and hafnium [Polucheniye
ligatur na osnove alyuminiya metodom vysokotemperaturnykh obmennykh reaktsiy v rasplavakh soley.
III. Mnokokomponentnyye modifitsiruyushchiye ligatury alyuminiya so skandiyem, tsirkoniyem i
gafniyem] // Rasplavy. 2010. № 2. С. 89-94. [In Rus.].
5. Filatov A.A., Pershin P.S., Suzdaltsev A.V., Nikolaev A.Yu., Zaikov Yu.P. Synthesis of Al-Zr
master alloys via the electrolysis of KF-NaF-AlF3-ZrO2 melts // Journal of the Electrochemical So
ciety. 2018. 165. № 2. E28-E34.
6. Suzdal’tsev A.V., Filatov A.A., Nikolayev A.Yu., Pankratov A.A., Molchanova N.G., Zaykov
Yu.P. Extraction of scandium and zirconium from their oxides during electrolysis of oxide fluoride
melts [Izvlecheniye skandiya i tsirkoniya iz ikh oksidov pri elektrolize oksidno<ftoridnykh rasplavov] //
Rasplavy. 2018. №1. С. 5-13. [In Rus.].
7. Robert E., Olsen J. E., Danek V., Tixhon E., Ostvold T., Gilbert B.. Structure and thermody
namics of alkali fluoride aluminum fluoride alumina melts. Vapor pressure, solubility, and Raman
spectroscopic studies // J. Physical Chemistry B. 1997. 101. Р. 9447-9456.
8. Apisarov A.P., Dedyukhin A.Ye., Red’kin A.A., Tkacheva O.Yu., Zaykov Yu.P. Physico chemi
cal properties of molten electrolytes KF-NaF-AlF3 [Fiziko<khimicheskiye svoystva rasplavlennykh
elektrolitov KF-NaF-AlF3] // Elektrokhimiya. 2010. 46. С. 672-678. [In Rus.].
9. Pershin P.S., Kataev A.A., Filatov A.A., Suzdaltsev A.V., Zaikov Yu.P. Synthesis of Al-Zr alloys
via ZrO2 aluminium thermal reduction in KF-AlF3 based melts // Metallurgical and Materials
Transactions B. 2017. 48. P. 1962-1969.
10. Pershin P.S., Filatov A.A., Suzdal’tsev A.V., Zaykov Yu.P. Aluminothermic production of Al-
Zr alloys in the KF-AlF3 melt [Alyumotermicheskoye polucheniye splavov Al-Zr v rasplave KF-AlF3] //
Rasplavy. 2016. № 5. С. 413-421. [In Rus.].
11. Kubinakova E., Danielik V., Hives J. Advanced technology for Al-Zr alloy synthesis: Electro
chemical investigation of suitable low melting electrolytes // Journal of Alloys and Compounds. 2018.
738. P. 151-157.
12. Polyakova L.P., Stangrit P.T. Cathodic processes at electrolysis of chloride and chloride fluo
ride melts of zirconium // Electrochimica Acta. 1982. 27. P. 1641-1645.
13. Xu L., Xiao Y., Xu Q., Sandwijk A.V., Li J., Zhao Z., Song Q., Yang Y. Electrochemical behav
ior of zirconium in molten LiF-KF-ZrF4 at 600°C // RSC Advances. 2016. 6. P. 84472-84479.
14. Chen Z., Li Y.J., Li S.J. Electrochemical behavior of zirconium in the LiCl-KCl molten salt at
Mo electrode // Journal of Alloys and Compounds. 2011. 509. P. 5958-5961.
15. Gibilaro M., Massot L., Chamelot P., Cassayre L., Taxil P. Investigation of Zr(IV) in LiF-
CaF2: Stability with oxide ions and electroreduction pathway on inert and reactive electrodes // Elec
trochimica Acta. 2013. 95. P. 185-191.
16. Gilbert B., Mamantov G., Fung K.W. Electrochemistry of zirconium(lV) in chloroaluminate
melts // Inorganic Chemistry. 1975. 14. P. 1802-1806.
17. Ueda M., Teshima T., Matsushima H., Ohtsuka T. Electroplating of Al-Zr alloys in AlCl3-
NaCl-KCl molten salts to improve corrosion resistance of Al // Journal of Solid State Electrochemis
try. 2015. 19. P. 3485-3489.
18. Kawase M. The electroformation of Zr metal, Zr-Al alloy and carbon films on ceramic //
Journal of Applied Electrochemistry. 2003. 33. P. 785-793.
19. Tsuda T., Hussey C.L., Stafford G.R., Kongstein O. Electrodeposition of Al-Zr alloys from
Lewis acidic aluminum chloride 1 ethyl 3 methylimidazolium chloride melt // Journal of the Elec
trochemical Society. 2004. 151. C447-C454.
20. Suzdal’tsev A.V., Khramov A.P., Zaykov Yu.P. Carbon electrode for electrochemical studies in
cryolite alumina melts at 700-960°С [Uglerodnyy elektrod dlya elektrokhimicheskikh issledovaniy v
kriolit<glinozemnykh rasplavakh pri 700-960°C] // Elektrokhimiya2012. 48. С. 1251-1263. [In Rus.].
21. Vorobiev, A.S., Suzdaltsev, A.V., Galashev, A.E. Bond Energy in Molten M-Al-Zr-O-F Sys
tems (M = Li, Na, K) [Energiya svyazey v rasplavlennykh sistemakh M-Al-Zr-O-F (M = Li, Na, K)] //
Rasplavy. 2019. № 2. P. 156-166. [In Rus.].
22. Turkdogan E.T. Physical chemistry of high temperature / Academic Press, NY. 1980.
304
А. А. Филатов, А. В. Суздальцев, А. Ю. Николаев, Ю. П. Зайков
23. Bard A.J., Faulkner L.R. Electrochemical methods: fundamentals and applications, 2nd ed.
John Wiley & Sons, NY. 2001.
24. Scholz F. Electroanalytical methods, 2nd ed. Springer Verlag, Berlin. 2010.
25. Nikolaev A.Yu., Suzdaltsev A.V., Polyakov P.V., Zaikov Yu.P. Cathode process at the electroly
sis of KF-AlF3-Al2O3 melts and suspensions // Journal of the Electrochemical Society. 2017. 164.
№ 8. H5315-H5321.
26. Nikolaev A.Yu., Yasinsky A.S., Suzdaltsev A.V., Polyakov P.V., Zaykov Yu.P. Voltamperometry
in the melt and suspensions [Vol’tamperometriya v rasplave i suspenziyakh KF-AlF3-Al2O3] // Ras
plavy. 2017. № 3. С. 214-225. [In Rus.].
27. Lyakishev N.P. State Diagrams of Double Metallic Systems: A Reference Book in 3 tons [Dia
grammy sostoyaniya dvoynykh metallicheskikh sistem: Spravochnik]. Moscow: Mashinostroenie
1996. [In Rus.].
28. Suzdaltsev A.V., Filatov A.A., Nikolaev A.Yu., Pershin PS, Zaikov Yu.P. The method of obtain
ing aluminum ligatures with zirconium // Patent RU2658556, priority 08/24/2017. Published:
06.21.2018 Bulletin 18.