РАСПЛАВЫ
4 · 2019
УДК 620.143
КОРРОЗИОННО ЭЛЕКТРОХИМИЧЕСКОЕ ПОВЕДЕНИЕ НИКЕЛЯ
В РАСПЛАВЕ LiCl-KCl, СОДЕРЖАЩЕМ ТРИХЛОРИД ЛАНТАНА
© 2019 г. Э. А. Карфидовa, b, Е. В. Никитинаa, b, *
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
bУральский Федеральный Университет, Екатеринбург, Россия
*e'mail: neekeetina@mail.ru
Поступила в редакцию 01.08.2018
После доработки 25.08.2019
Принята к публикации 04.10.2019
Изучено влияние температуры в диапазоне от 500 до 800°С на коррозию никеля
(Н1) при проведении испытаний в солевом расплаве эвтектической смеси хлоридов
лития и калия, с добавлением трихлорида лантана от 0.5 до 2 мол. %. Скорость кор(
розии никеля возрастает с увеличением температуры, добавки хлорида лантана сни(
жают скорость коррозии при 500-650°С (ингибирование экранирующего типа за
счет последующей химической реакции). Потенциал коррозии никеля составляет
примерно -0.5 В относительно хлорсеребряного электрода при температуре 500°С и
незначительно уменьшается с ростом температуры, а также не зависит от концентра(
ции хлорида лантана. Для конкретизации механизма коррозионных разрушений
сняты вольтамперные кривые при содержании хлорида лантана 0.5 и 2 мол. % при
скоростях развертки 10 и 20 мВ/с. Использованы рентгенофазовый и микрорентге(
носпектральный методы анализа. Скорость развертки не влияет на протекание не(
обратимого электрохимического процесса окисления, а добавление хлорида лантана
увеличивает плотность тока в анодной области в десятки раз. Сопоставление вели(
чин скорости коррозии, полученных гравиметрическим и химико(аналитическим
методами, позволяет говорить об электрохимическом механизме коррозии.
Ключевые слова: никель, хлоридный расплав, коррозия, трихлорид лантана, темпера(
тура, морфология поверхности.
DOI: 10.1134/S0235010619040078
ВВЕДЕНИЕ
Важные и перспективные технологии ядерной промышленности предъявляют все
более высокие требования к используемым конструкционным материалам в данной
сфере.
В настоящее время никель широко используется в химической промышленности
как в чистом виде, так и в качестве компонента жаропрочных и других специальных
сталей, обладающих определенными химико(физическими свойствами [1-3].
Особый интерес представляет применение никеля при переработке ядерного топ(
лива в связи с его коррозионной стойкостью при высоких температурах, обусловлен(
ной его способностью к пассивации в различных коррозионных средах [4].
Высокотемпературные ядерные энергетические технологии потребляют большое
количество редкоземельных металлов, в том числе и лантан, как добавку в ядерное
топливо [5], влияние которого на конструкционные материалы следует изучить.
В данной работе было исследовано коррозионное поведение металлического нике(
ля в солевой эвтектике LiCl-KCl с добавлением трихлорида лантана в диапазоне тем(
ператур 500-800°С. При помощи метода циклической вольтамперометрии, микроско(
пии, гравиметрического и химического анализа были выявлены зависимости процес(
са, а также механизм коррозии.
Коррозионно(электрохимическое поведение никеля в расплаве LiCl-KCl
361
а
б
в
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
Рис. 1. Морфология поверхности никелевого образца, выдержанного в расплаве KCl-LiCl при: (а) 500,
(б) 650, (в) 800°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты выполнены в высокотемпературной электрохимической ячейке при
температуре 500, 650 и 800°С в эвтектическом солевом расплаве хлоридов лития и ка(
лия (60 мол. % LiCl) с добавлением 0.5 и 2 мол. % LaCl3, в окислительной атмосфере
воздуха.
Никелевые образцы (H1) представляли собой пластины толщиной 0.6 мм, с площа(
дью поверхности 2.2 см2. Образцы предварительно обрабатывали мелкодисперсной
шлифовальной бумагой, обезжиривали и сушили спиртово(ацетоновой смесью. Мас(
су исследуемых образцов измеряли на аналитических весах до и после эксперимента.
Смеси солей готовили сплавлением расчетных количеств солей марки х. ч., предва(
рительно переплавленных на воздухе, а затем подвергнутых трехкратной зонной плав(
ке в токе сухого очищенного аргона. Затем проводили сушку солей при температуре
200°С в атмосфере аргона (чистотой 99.9%), на протяжении 4(х ч, для удаления адсор(
бированной влаги при размоле и смешивании солей. Просушенные смеси солей хра(
нили в герметичном эксикаторе.
В алундовый тигель загружали хлоридную эвтектику, рассчитанное количество три(
хлорида лантана и пластинку никеля. Ячейку с погруженным тиглем нагревали до за(
данной температуры и выдерживали на протяжении 24 ч.
Циклические вольтамперные зависимости были сняты на приборе AutoLab PGSTAT(30,
при различном содержании LaCl3 (от 0.5 до 2.0 мол. %) со скоростью развертки 10 и
20 мВ/с. Применяли высокотемпературную электрохимическую ячейку с серебряны(
ми токоподводами, с никелевой пластинкой в качестве рабочего и вспомогательного
электрода. Использовали хлорсеребряный электрод сравнения.
После эксперимента образцы отмывали от остатка хлоридных солей раствором
0.05 М соляной кислоты. Поверхность образцов исследовали при помощи сканирую(
щего электронного микроскопа “JSM(5900 LV” (Jeol, Япония) и с помощью рентгено(
фазового анализа проводимого на дифрактометре “Rigaku D/MAX(2200VL/PC”, а
также использовали метод гравиметрического измерения, данные которого служили
для расчета скорости коррозии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлена морфология никелевых образцов, выдержанных в течение
24 ч при температуре 500, 650 и 800°С в хлоридном солевом расплаве, соответственно.
Из данных микроскопических исследований видно, что при низких температурах
образцы подвержены локальной коррозии, однако при повышении температуры, кор(
розия приобретает сплошной характер.
362
Э. А. Карфидов, Е. В. Никитина
а
б
в
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
Рис. 2. Морфология поверхности никелевого образца, выдержанного в расплаве KCl-LiCl при 500°С (a) без
добавления LaCl3, (б) + 0.5 мол. % LaCl3, (в) + 2 мол. % LaCl3.
а
б
в
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
Рис. 3. Морфология поверхности никелевого образца, выдержанного в расплаве KCl-LiCl при 650°С (a) без
добавления LaCl3, (б) + 0.5 мол. % LaCl3, (в) + 2 мол. % LaCl3.
На рис. 2-4 представлена морфология никелевых образцов, выдержанных в тече(
ние 24 ч при температуре 500, 650 и 800°С в хлоридном солевом расплаве, с добавкой
0.5 и 2 мол. % трихлорида лантана.
В табл. 1 приведена скорость коррозии для никелевых образцов, полученная при
обработке данных, полученных гравиметрическим методом [6].
По данным, представленным на рис. 1-3 и в табл. 1 можно сделать вывод, что уве(
личение температуры значительно увеличивает скорость коррозии. Введение в рас(
плав LaCl3 приводит к снижению скорости коррозии никеля. Подобное ингибирую(
а
б
в
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
20 кВ ×5000
5 мкм
Рис. 4. Морфология поверхности никелевого образца, выдержанного в расплаве KCl-LiCl при 800°С (a) без
добавления LaCl3, (б) + 0.5 мол. % LaCl3, (в) + 2 мол. % LaCl3.
Коррозионно(электрохимическое поведение никеля в расплаве LiCl-KCl
363
Таблица 1
Скорость коррозии никелевых образцов в расплаве KCl-LiCl
Скорость коррозии, г/(м2 ч) · 104
Температура, °C
KCl-LiCl
KCl-LiCl + 0.5 мас. % LaCl3
KCl-LiCl + 2 мас. % LaCl3
500
16.39 ± 0.03
7.74 ± 0.02
5.81 ± 0.01
650
20.63 ± 0.04
12.28 ± 0.02
10.14 ± 0.02
800
29.12 ± 0.06
27.59 ± 0.06
26.81 ± 0.05
щее действие обусловлено возникновением экранирующего эффекта за счет последу(
ющей химической реакции с образованием оксихлорида лантана:
1/2O2 + 2e = O2-,
Ni - 2e = Ni2+,
Ni + 1/2O2 + LaCl3 = NiCl2 + LaOCl.
Возникновение последнего подтверждается рентгеноспектральной микроскопией с
определением содержания на поверхности эквимольного количества элементов La, Cl
и O (рис. 5). Однако подобное пассирующее действие значительно снижается при уве(
личении температуры и почти не проявляется при температуре 800°С.
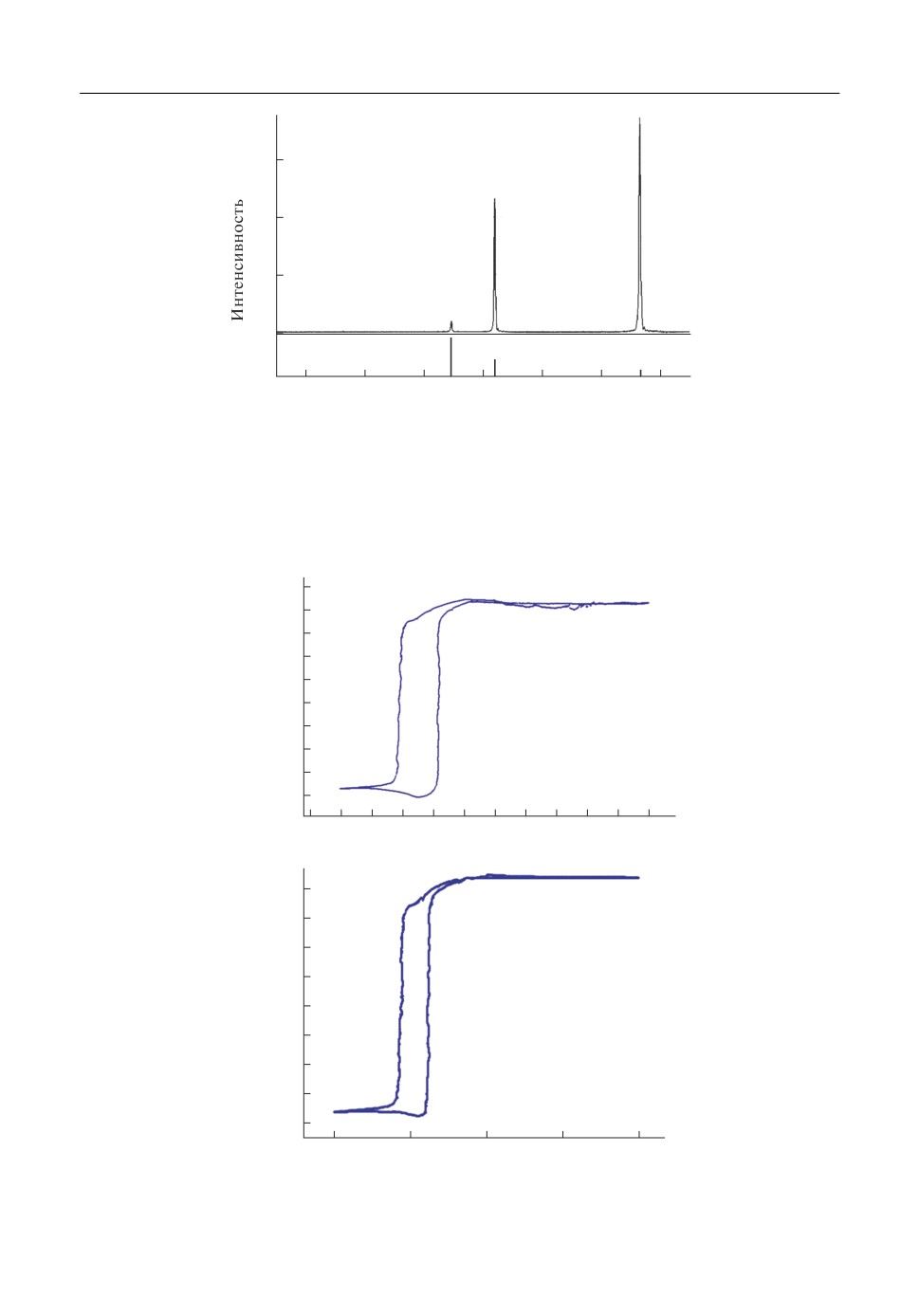
По данным проведенного рентгенофазового анализа подтверждается отсутствие
фазы LaNin на поверхности никелевых образцов (рис. 6), образование которой харак(
терно в инертной атмосфере при аналогичных условиях проведения процесса корро(
зии, как было показано в [7].
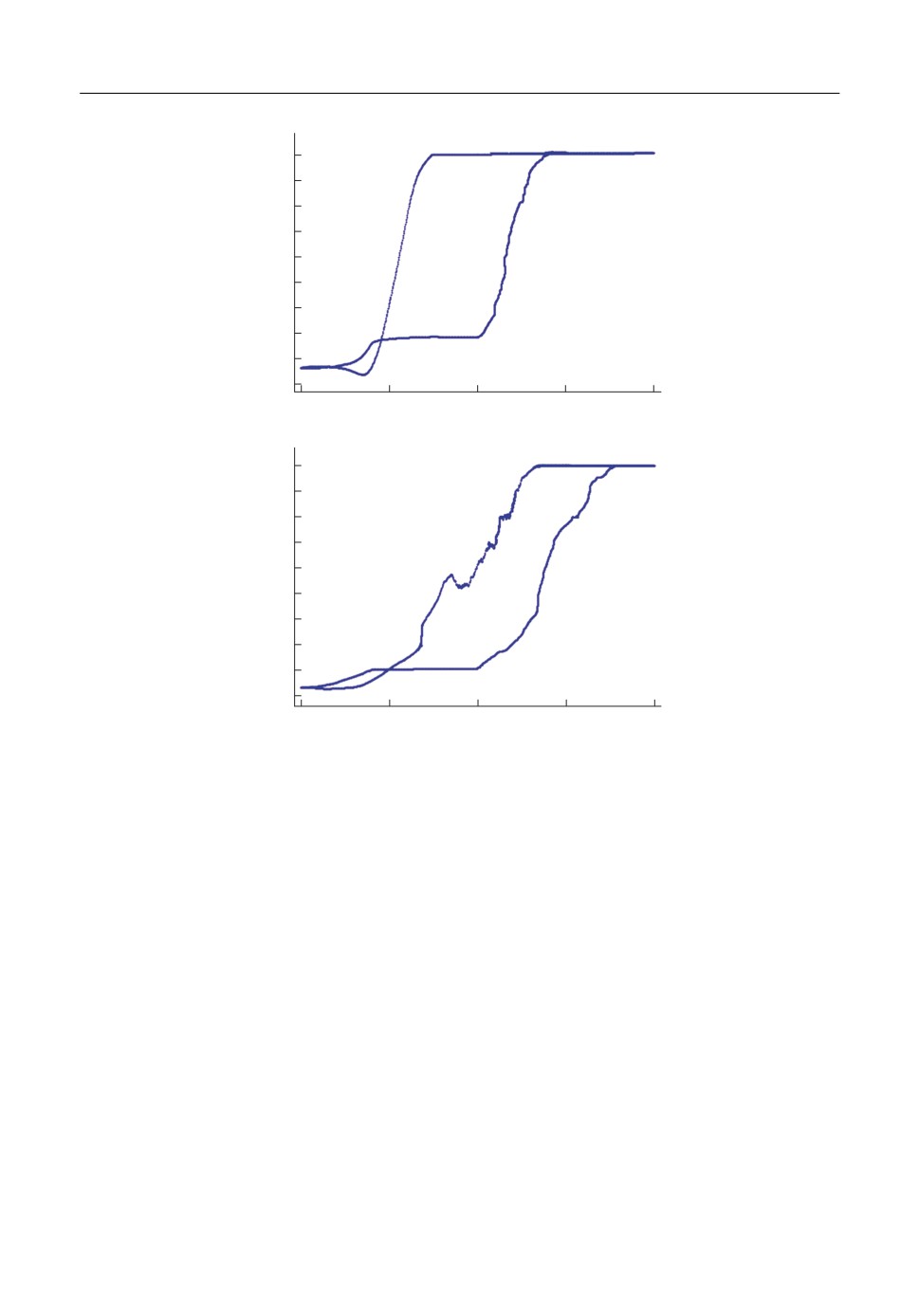
На рис. 7, 8 представлены циклические вольтамперные зависимости при скоростях
развертки 10 и 20 мВ/с.
Из данных циклической вольтамперометрии можно сделать вывод, что скорость
развертки не влияет на протекание необратимого электрохимического процесса окис(
Элемент
Масс. %
Ат. %
O
7.51
27.74
Cl
17.13
30.63
Спектр
Ni
8.41
9.08
La
66.95
30.55
Всего
100
100
100 мкм
Рис. 5. Микроскопия и спектральный анализ поверхности образца никеля, выдержанного в эвтектике LiCl-
KCl при температуре 500°С, с добавлением 0.5 мол. % LaCl3.
364
Э. А. Карфидов, Е. В. Никитина
15
10
5
·103
20
30
40
50
60
70
80
Угол 2Θ, град
Рис. 6. Данные рентгенофазового анализа поверхности образца никеля выдержанного в эвтектике LiCl-KCl
при температуре 500°С, с добавлением 0.5 мол. % LaCl3.
I, А
а
0.010
0.008
0.006
0.004
0.002
0
0.002
0.004
0.006
0.008
-1.0
-0.6
-0.2
0.2
0.6
1.0
I, А
E, В
б
0.008
0.006
0.004
0.002
0
0.002
0.004
0.006
0.008
-1.0
-0.5
0
0.5
1.0
E, В
Рис. 7. Циклическая вольтамперная зависимость для никелевых образцов в расплаве KCl-LiCl со скоростью
развертки (a) 10, (б) 20 мВ/с.
Коррозионно(электрохимическое поведение никеля в расплаве LiCl-KCl
365
а
I, А
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
0.1
-1.0
-0.5
0
0.5
1.0
I, А
E, В
б
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
0.1
-1.0
-0.5
0
0.5
1.0
E, В
Рис. 8. Циклическая вольтамперная зависимость для никелевых образцов в расплаве KCl-LiCl, при скоро(
сти развертки 10 мВ/с. Содержание трихлорида лантана в солевом расплаве: (a) 0.5, (б) 2 мол. %.
ления, а добавление хлорида лантана увеличивает плотность тока в анодной области в
десятки раз. Подобное увеличение токов связано с активным образованием экраниру(
ющего слоя оксихлорида лантана уже при малых перенапряжениях. При большем со(
держании хлорида лантана(III) в расплаве (рис. 8б), возникает пассивация на участке
от -0.05 до -0.15 В, обусловленная снижением диффузионной способности О2 сквозь
образовавшийся экранирующий слой на поверхности никеля.
ЗАКЛЮЧЕНИЕ
Скорость коррозии никеля в хлоридном расплаве возрастает с увеличением темпе(
ратуры. Добавки хлорида лантана значительно снижают скорость коррозии в диапазо(
не температур 500-650°С. При низких температурах коррозия имеет локальный ха(
рактер, при высоких - сплошной.
Сопоставление величин скорости коррозии, полученных гравиметрическим, хими(
ко(аналитическим и расчетным из вольтамперных кривых, позволяет говорить об
электрохимическом механизме коррозии.
366
Э. А. Карфидов, Е. В. Никитина
СПИСОК ЛИТЕРАТУРЫ
1. Гр и л и х е с С . Я . Электролитические и химические покрытия. Ленинград: Химия,
1990.
2. Vo n W. S c h r o t e r, K . ( H . L a u t e n s c h l ä g e r, H . B i b r a c k u n d A . S c h n a b e l .
Veb Fachbuchverlag Leipzig. Chemie. 1989.
3. Р е з н и к И . Д . , Е р м а к о в Г. П . , Ш н е е р с о н Я . М . Никель: Т. 2. Окисленные
никелевые руды. Характеристика руд. Пирометаллургия и гидрометаллургия окисленных ни(
келевых руд. М.: Наука и технологии. 2004.
4. К о ч е р г и н В . П . Защита металлов от коррозии в ионных расплавах и растворах элек(
тролитов. Екатеринбург: Изд(во Урал. ун(та, 1991.
5. Ш а м а н и н И . В . , Га в р и л о в П . М . Высокотемпературные ядерные энергетиче(
ские технологии // Известия ТПУ. 2010. № 4. С. 5-9.
6. А л е к с е е в В . Н . Количественный анализ / Под ред. д(ра хим. наук П.К. Агасяна. М.:
Альянс, 2013.
7. С о р о к а В . В . , К о в а л е н с к и й А . В . , И л ю щ е н к о Н . Г. Сплавообразование
при бестолковом переносе редкоземельных металлов на никелевую подложку в хлоридных
расплавах // Расплавы. 1992. № 6. С. 38-44.
Corrosion Electrochemical Behavior of Nickel in the LiCl-KCl Melt,
Containing Lantan Trichloride
E. A. Karfidov1, 2, E. V. Nikitina1, 2
1Institute of High'Temperature Electrochemistry, Ural Branch of the Russian Academy of Sciences,
Yekaterinburg, Russia
2Ural Federal University, Yekaterinburg, Russia
The effect of temperature in the range from 500 to 800°C on nickel (N1) corrosion was
studied during testing in a salt melt of a eutectic mixture of lithium and potassium chlorides,
with the addition of lanthanum trichloride from 0.5 to 2 mol. %. The corrosion rate of nickel
increases with increasing temperature, the addition of lanthanum chloride reduces the cor(
rosion rate at 500-650°C (inhibition of the shielding type due to the subsequent chemical
reaction). The corrosion potential of nickel is approximately -0.5 V relative to the silver
chloride electrode at a temperature of 500°C and decreases slightly with increasing tempera(
ture, and does not depend on the concentration of lanthanum chloride. To concretize the
mechanism of corrosion damage, the current(voltage curves were taken with the content of
lanthanum chloride 0.5 and 2 mol. % at sweep speeds of 10 and 20 mV/s. X(ray phase and
micro X(ray spectral analysis methods were used. The sweep speed does not affect the course
of the irreversible electrochemical oxidation process, and the addition of lanthanum chlo(
ride increases the current density in the anode region tenfold. Comparison of corrosion rates
obtained by gravimetric and chemical(analytical methods, allows us to speak about the elec(
trochemical mechanism of corrosion.
Keywords: nickel, chloride melt, corrosion, lanthanum trichloride, temperature, surface
morphology
REFERENCES
1. Griliches S.Ya. Elektroliticheskiye i khimicheskiye pokrytiya [Electrolytic and chemical coat(
ings]. Leningrad: Khimiya, 1990.
2. Chemie. Von W. Schroter, K.(H. Lautenschläger, H. Bibrack und A. Schnabel. Veb Fachbuch(
verlag Leipzig. 1989.
3. Reznik I.D., Yermakov G.P., Shneyerson Ya.M. Nikel’: T. 2. Okislennyye nikelevyye rudy. Khar(
akteristika rud. Pirometallurgiya i gidrometallurgiya okislennykh nikelevykh rud [Nickel: in 3 vol(
umes. T. 2. Oxidized nickel ores. Characteristic ores. Pyrometallurgy and hydrometallurgy of oxidized
nickel ores]. M.: Nauka i tekhnologii. 2004.
Коррозионно(электрохимическое поведение никеля в расплаве LiCl-KCl
367
4. Kochergin V.P. Zashchita metallov ot korrozii v ionnykh rasplavakh i rastvorakh elektrolitov
[Protection of metals against corrosion in ionic melts and electrolyte solutions]. Yekaterinburg: Izd(vo
Ural. un(ta. 1991.
5. Shamanin I.V., Gavrilov P.M. Vysokotemperaturnyye yadernyye energeticheskiye tekhnologii
[High(temperature nuclear energy technologies] // Izvestiya TPU. 2010. № 4. P. 5-9.
6. Alekseyev V.N. Kolichestvennyy analiz [Quantitative analysis] / Pod red. d(ra khim. nauk
P.K. Agasyana. M.: Al’yans, 2013.
7. Soroka V.V., Kovalenskiy A.V., Ilyushchenko N.G. Splavoobrazovaniye pri bestolkovom per(
enose redkozemel’nykh metallov na nikelevuyu podlozhku v khloridnykh rasplavakh [Alloy formation
in the confounding transfer of rare(earth metals to the nickel substrate in chloride melts] // Rasplavy.
1992. № 6. P. 38-44.