РАСПЛАВЫ
4 · 2019
УДК 546.664.131
ПЛОТНОСТЬ И МОЛЬНЫЙ ОБЪЕМ РАСПЛАВОВ
БИНАРНЫХ СМЕСЕЙ GdCl3-NaCl И GdCl3-KCl
© 2019 г. К. И. Трифоновa, И. Ф. Заботинa, В. Е. Кротовb, *, А. Ф. Никифоровc
aКовровская государственная технологическая академия имени В.А. Дегтярева, Ковров, Россия
bИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
cУральский федеральный университет, Екатеринбург, Россия
*e)mail: vekro@ihte.uran.ru
Поступила в редакцию 16.07.2018
После доработки 03.11.2018
Принята к публикации 11.12.2018
Определены дилатометрическим методом значения плотности солевых распла$
вов систем GdCl3-NaCl и GdCl3-KCl во всем интервале концентраций и широком
диапазоне температур. Рассчитаны мольные объемы систем и их отклонения от ад$
дитивности. Установлено, что все зависимости от состава электролита являются не$
линейными. Результаты могут быть использованы в технологии производства гадо$
линия и его соединений и для уточнения структуры исследованных расплавленных
солевых смесей.
Ключевые слова: бинарные системы, трихлорид гадолиния, хлориды натрия и калия,
плотность, мольный объем, изотермы.
DOI: 10.1134/S023501061904011X
ВВЕДЕНИЕ
Современные наукоемкие производства все шире применяют редкоземельные ме$
таллы и их соединения с целью использования набора уникальных свойств этих мате$
риалов. Последнее возможно при наличии информации о них и их зависимости от
различных факторов. Поэтому получение новых физико$химических данных о свой$
ствах систем, содержащих соединения редкоземельных элементов, имеет не только
прикладное значение, но и способствует расширению и углублению знаний по фунда$
ментальным вопросам естествознания.
В литературе отсутствуют значения плотности расплавленных солевых смесей
GdCl3 с галогенидами щелочных металлов, в том числе с NaCl и KCl. Их можно было
бы рассчитать из значений мольных объемов для этих систем [1, 2]. Однако вычислить
их не представляется возможным, потому что в публикациях отсутствуют уравнения
их концентрационных зависимостей. В публикациях представлены лишь графически
по одной изотерме зависимости этого параметра от состава смеси [2] и его отклонение
от аддитивных значений [1]. При этом данные авторов различаются между собой.
Целью предлагаемой работы является экспериментальное определение плотности
бинарных расплавленных смесей GdCl3-NaCl и GdCl3-KCl во всем концентрацион$
ном интервале и широком диапазоне температур. При этом будут рассчитаны моль$
ные объемы и их отклонение от аддитивных значений. Ранее нами была измерена
электропроводность этих систем [3].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Плотность расплавленных смесей солей определяли дилатометрическим методом.
Экспериментальная установка и методика измерений представлены в работе [4].
Плотность и мольный объем расплавов бинарных смесей
397
В качестве исходных солей - растворителей были использованы хлориды калия и
натрия квалификации х. ч. Их предварительно сушили под вакуумом в течение 20 ч в
интервале температур 200-600°С, увеличивая температуру на 100 градусов после до$
стижения остаточного давления в системе 10-2 мм. Его контролировали вакуумметром
“МЕРАДАТ-ВИТ”. Затем соли переплавляли, и дополнительно очищали от примесей
методом зонной плавки [5].
Трихлорид гадолиния синтезировали из оксида гадолиния с содержанием основно$
го вещества не менее 99.98% по методике, приведенной в [6]. На первой стадии полу$
чали кристаллогидрат трихлорида гадолиния путем растворения оксида в соляной
кислоте с последующим упариванием полученного раствора досуха. Процесс обезво$
живания проводили в трубчатом реакторе из кварцевого стекла, в котором находились
лодочка из стеклоуглерода с кристаллогидратом хлорида гадолиния и контролирую$
щая процесс термопара. Реактор размещался внутри печи, снабженной терморегуля$
тором. Обезвоживающим агентом служили пары тетрахлорида углерода, поступавшие
в реакционное пространство из испарителя. Скорость подачи хлорирующего агента
регулировали таким образом, чтобы на выходе из реактора в холодильнике конденси$
ровалась примерно 1 капля паров в секунду. В качестве газа$носителя использовался
очищенный аргон. Процесс обезвоживания осуществляли при постепенном ступен$
чатом поднятии температуры. Вначале процесс вели при температуре 100°С в течение
1 ч, затем температуру повышали до 200-250°С, и выдерживали систему при данной
температуре еще 1 час. На последней стадии при температурах 500-550°С обезвожи$
вание проводили в течение 1.5-2 ч. После отключения нагрева и охлаждения печи до
комнатной температуры лодочку с хлоридом гадолиния извлекали из реактора и пере$
носили в сухой бокс, где продукт хранился в ампуле с притертой пробкой.
Последующую подготовку трихлорида гадолиния проводили методом зонной плав$
ки [5]. Чистоту синтезированного GdCl3 контролировали химическим и термическим
анализами. Все операции по приготовлению солевых композиций проводили в сухом
боксе в условиях, исключающих их контакт с внешней атмосферой и влагой.
Достоверность результатов измерений подтверждалась воспроизводимостью и со$
ответствием литературным данным значений плотности хлоридов натрия и калия [7] в
наших опытах. Приведенные в этой публикации величины плотности индивидуаль$
ных хлоридов заимствованы авторами [7] из справочника Национального бюро стан$
дартов США [8], которые рекомендованы в качестве наиболее надежных. Плотность
расплавов трихлорида гадолиния в обозначенном диапазоне температур удовлетвори$
тельно совпадает с результатами других исследователей, и располагается в интервале
значений, приведенных в работах [1, 2, 9-11]. Ошибка использованной методики
определения плотности расплавов оценивается величиной 2%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Плотность, d, расплавленных солевых систем GdCl3-NaCl и GdCl3-KCl измерена
во всем концентрационном интервале при 685-880°С. Ее температурные зависимости
для всех исследованных составов имеют линейный характер. Их аппроксимировали
уравнениями типа d = a - bT. Коэффициенты a и b, определенные методом наимень$
ших квадратов, приведены в табл. 1, 2.
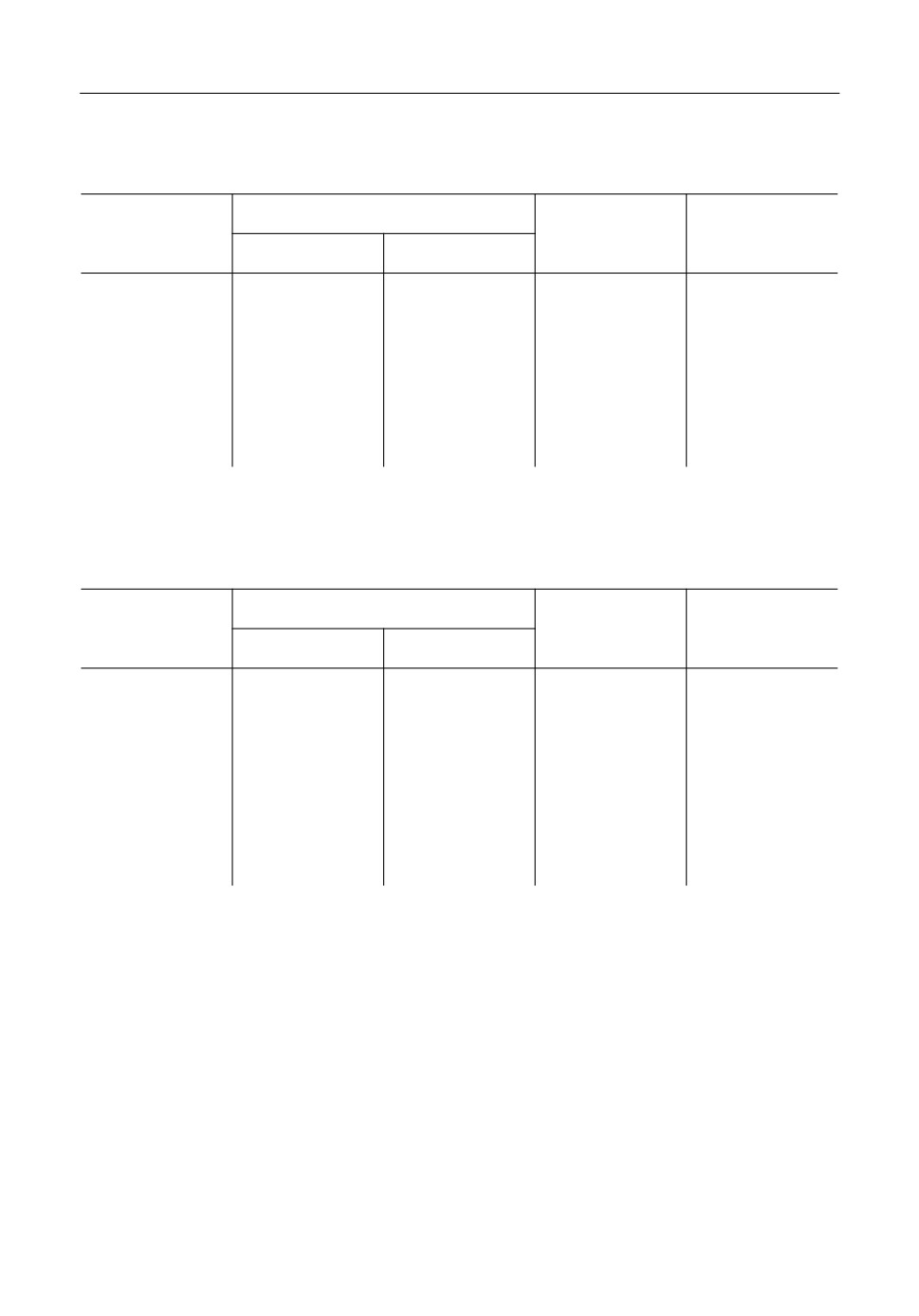
Установлена нелинейная зависимость плотности от состава солевой фазы. Ее значе$
ния отклоняются в сторону более высоких величин по сравнению с аддитивными. В
качестве примера на рис. 1 показаны концентрационные зависимости плотности изу$
ченных смесей для 800°С. Величины плотности близки между собой в случае индиви$
дуальных хлоридов натрия и калия, но расходятся при добавлении трихлорида гадоли$
ния. Наиболее сильно изотермы отстоят друг от друга в интервале концентраций 30-
398
К. И. Трифонов, И. Ф. Заботин, В. Е. Кротов, А. Ф. Никифоров
Таблица 1
Температурная зависимость плотности системы GdCl3-NaCl
d = a - bT (°C), кг/м3 · 103
Стандартное
Температурный
GdCl3, мол. %
отклонение, s
интервал, °С
a
b · 103
0
2.25341
0.833
0.003564
820-895
15
2.56663
0.613
0.001977
780-860
30
3.16005
0.856
0.000495
785-860
45
3.36781
0.728
0.001969
810-860
60
3.65383
0.732
0.003232
800-860
75
4.41814
1.312
0.000912
785-860
85
4.15861
0.944
0.002313
785-865
100
4.24195
0.988
0.002227
695-850
Таблица 2
Температурная зависимость плотности системы GdCl3-KCl
d = a - bT (°C), кг/м3 · 103
Стандартное
Температурный
GdCl3, мол. %
отклонение, s
интервал, °С
a
b · 103
0
1.92410
0.524
0.001182
800-880
10
2.27110
0.570
0.002444
790-860
25
2.84265
0.807
0.001564
830-870
35
3.26092
1.097
0.003704
800-860
43
3.25865
0.910
0.002197
800-875
55
3.64919
1.053
0.003451
795-865
75
3.98662
0.985
0.001148
790-860
85
4.18472
1.030
0.003572
780-850
100
4.24195
0.988
0.002227
695-850
70 мол. % GdCl3. Максимальная разница между значениями плотности жидких фаз
наблюдается в области эквимольных составов, и составляет 0.20 г/см3.
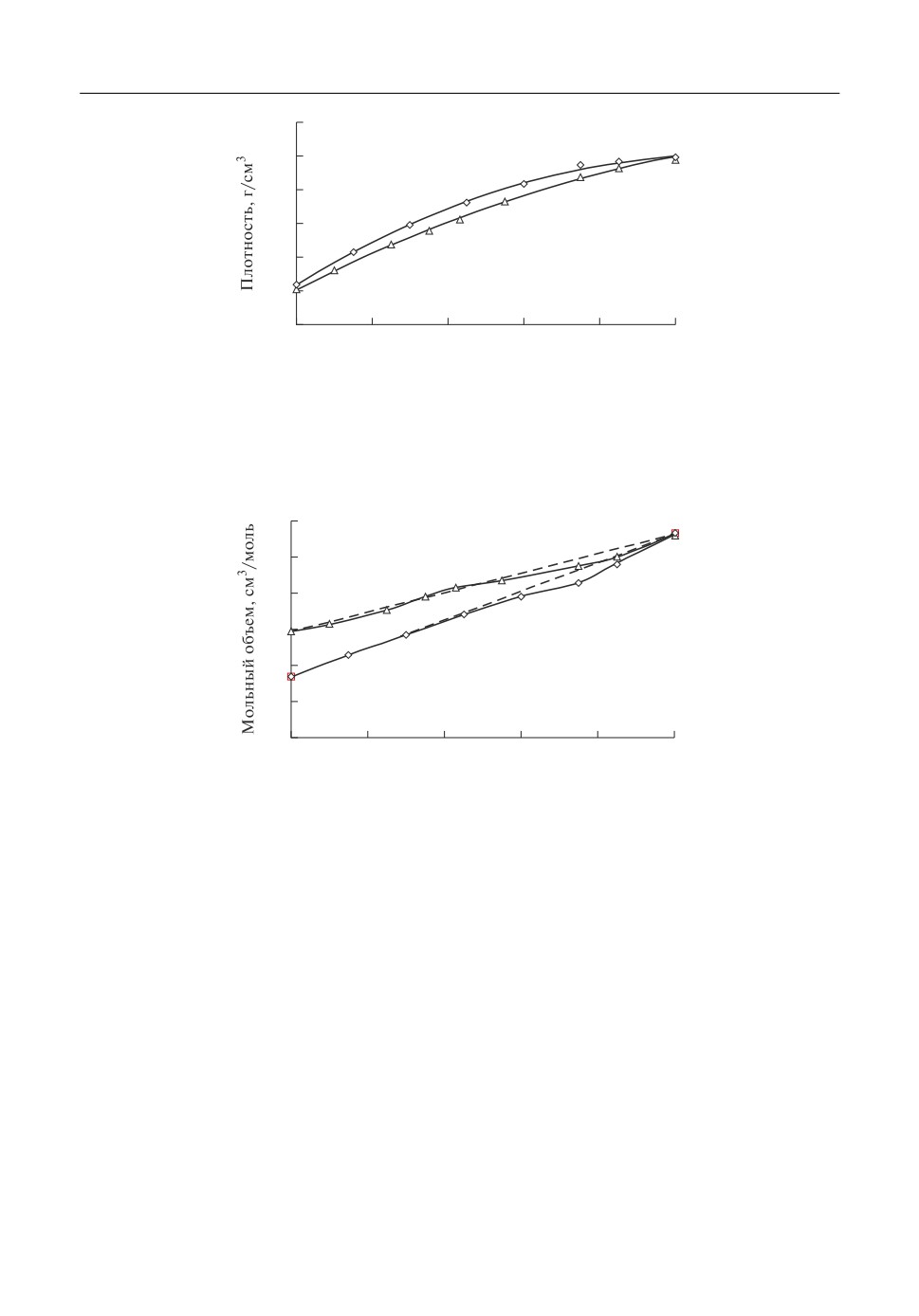
Из экспериментальных значений плотности рассчитаны мольные объемы, Vм, рас$
плавленных солевых смесей GdCl3-NaCl и GdCl3-KCl и их отклонения от аддитив$
ных величин, ΔVм. Концентрационная зависимость Vм представлена на рис. 2 для
800°С.
Мольные объемы возрастают нелинейно с увеличением концентрации GdCl3 в со$
левой фазе. В обеих системах они совпадают практически с аддитивными значениями
при содержании GdCl3 до 50 мол. %. При дальнейшем повышении содержания три$
хлорида гадолиния наблюдаются небольшие отрицательные отклонения мольного
объема от аддитивных величин. Это свидетельствует о том, что расплавленные смеси
хлоридов натрия и калия с трихлоридом гадолиния имеют более плотную структуру,
чем составляющие их компоненты.
Плотность и мольный объем расплавов бинарных смесей
399
4.0
3.5
3.0
NaCl-GdCl3
2.5
KCl-GdCl
3
2.0
1.5
1.0
0
20
40
60
80
100
Концентрация GdCl3, мол. %
Рис. 1. Зависимость плотности расплавленных систем GdCl3-NaCl и GdCl3-KCl от концентрации GdCl3
при 800°С.
80
70
GdCl3-KCl
60
GdCl3-NaCl
50
40
30
20
0
20
40
60
80
100
Концентрация GdCl3, мол. %
Рис. 2. Изотермы мольного объема расплавленных смесей GdCl3-NaCl и GdCl3-KCl при 800°С.
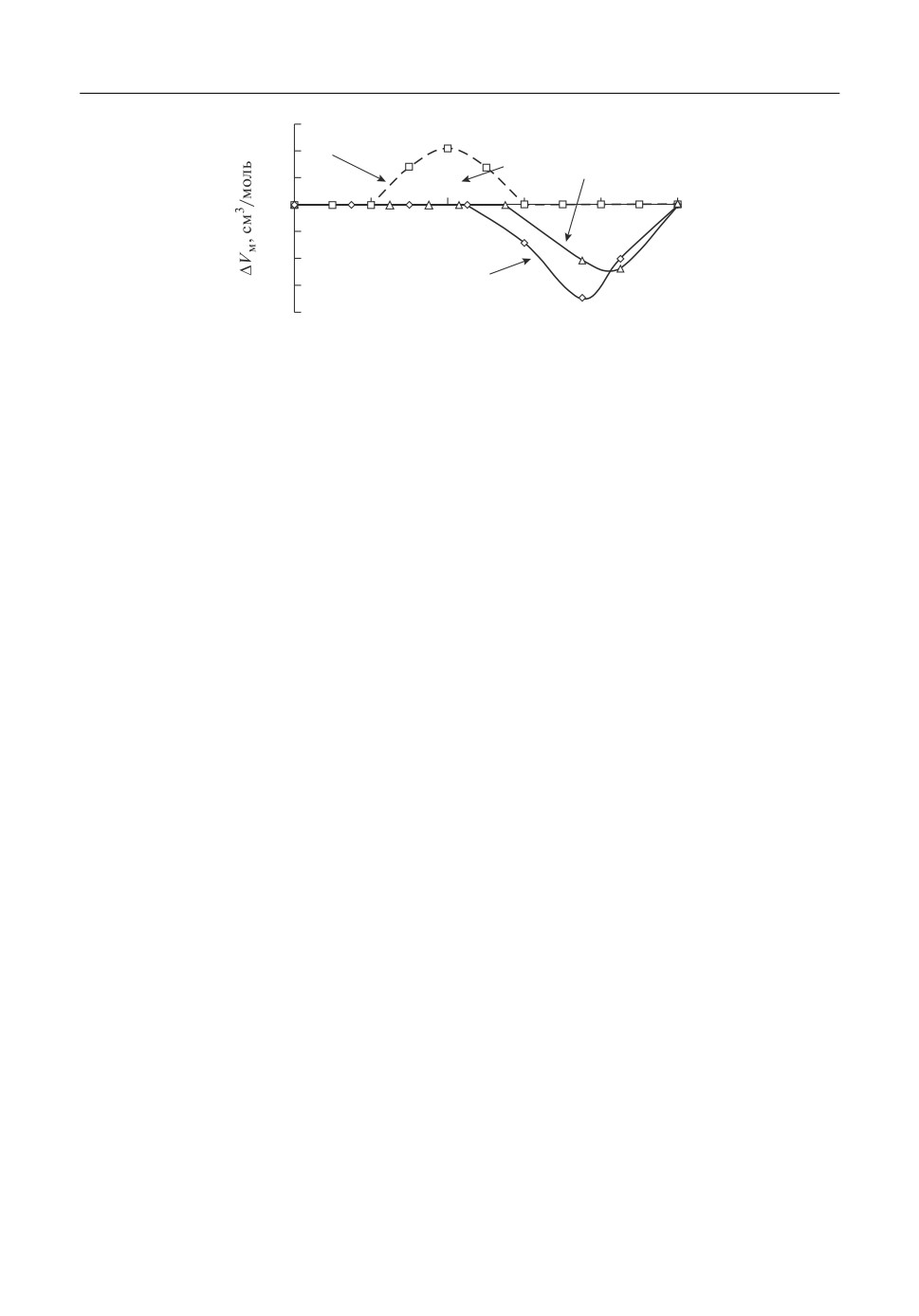
На рис. 3 приведены изотермы концентрационной зависимости отклонения моль$
ного объема от аддитивных значений при 800°С. Для сопоставления их с литератур$
ными данными мы оценили предварительно точность определения значений ΔVм.
Очевидно, что погрешность не может быть меньше ошибки определения величин Vм и
соответственно значений плотности системы, которые подставляют в формулу для
расчета Vм. В условиях наших опытов точность определения ΔVм не может быть мень$
ше 2% относительных, что соответствует погрешности ΔVм равной примерно
1.5 см3/моль. В работах [1] и [2] отсутствуют сведения о точности определения вели$
чин Vм и ΔVм. Мы приняли ее равной ошибке определения плотности индивидуальных
хлоридов натрия и калия, которые всегда используются на первом этапе при калиб$
ровке экспериментальной установки. Согласно [8] точность определения плотности
этих хлоридов близка к 1.5% относительных. В случае систем GdCl3-NaCl и GdCl3-KCl
это соответствует ошибке величины ΔVм равной примерно 1 см3/моль. Поэтому во
всех случаях, мы приняли, равными нулю величины ΔVм, когда их значения были
меньше или равны 1 см3/моль.
400
К. И. Трифонов, И. Ф. Заботин, В. Е. Кротов, А. Ф. Никифоров
3
[1], 876 C
2
GdCl3-KCl
1
0
20
40
60
80
100
-1
-2
GdCl3-NaCl
-3
-4
Концентрация GdCl3, мол. %
Рис. 3. Отклонение мольного объема расплавленных смесей GdCl3-NaCl и GdCl3-KCl от аддитивных зна$
чений при 800°С.
По нашим данным значения ΔVм в обеих системах совпадают практически с адди$
тивными при концентрации GdCl3 до 50 мол. %. При более высоких ее значениях в
обеих системах наблюдаются отрицательные отклонения от аддитивных величин. За$
висимости являются экстремальными с минимумами в районе 80 мол. % GdCl3. Вели$
чина экстремума в системе GdCl3-NaCl составляла 3.5 см3/моль. В системе с KCl она
была меньше примерно в 1.5 раза, и равнялось 2.5 см3/моль.
Ранее [1, 2] были отмечены небольшие положительные отклонения мольных объе$
мов от аддитивных величин в системах GdCl3-NaCl и GdCl3-KCl. Однако большин$
ство значений ΔVм были менее 1 см3/моль, т.е. находились в области ошибки их опре$
деления. За пределами возможной ошибки оказались величины только в системе
KCl-GdCl3 в небольшом интервале составов [1]. Эти данные получены при 876°С, и
приведены на рис. 3. Концентрационная зависимость ΔVм является экстремальной,
как и в наших исследованиях. Однако отклонение ΔVм от аддитивности установлено
при более низком содержании GdCl3. Максимальное положительное отклонение
мольного объема от аддитивности наблюдалось при 40 мол. % GdCl3, и составляло
примерно 2.1 см3/моль. Установлено, что причиной расхождения наших и литератур$
ных данных [1] не может быть иная температура в исследованиях Vogel, которая со$
ставляла 876°С, так как рассчитанная по нашим данным изотерма для этой температу$
ры полностью совпала с изотермой для 800°С, приведенной на рис. 3. Таким образом,
наши результаты отличаются от литературных данных [1, 2], а последние не совпадают
между собой. Не исключено, что установленное различие изотерм концентрационных
зависимостей ΔVм в системах GdCl3-NaCl и GdCl3-KCl может быть связано с разной
степенью очистки исходных хлоридов от примесей.
Отрицательные отклонения мольных объемов от аддитивных значений являются
следствием уменьшения объема солевой фазы при добавлении в нее GdCl3. Появление
в расплаве трихлорида гадолиния, катионы которого являются более сильным ком$
плексообразователем, стимулирует диссоциацию автокомплексных ионов хлорида
щелочного металла [12, 13]. Одновременно с этим ионы хлора будут координировать$
ся преимущественно около катионов Gd3+. После того, как все ионы хлора, присут$
ствующие в солевой смеси, войдут в состав комплексных группировок [GdCl6]3-, в си$
стеме при дальнейшем увеличении концентрации трихлорида будут появляться поли$
ядерные комплексы гадолиния. Они представляют собой отдельные блоки димеров,
тримеров и более сложных образований в виде отдельных пространственных сеток ма$
лого размера в результате объединения комплексных ионов гадолиния [14, 15]. В этих
Плотность и мольный объем расплавов бинарных смесей
401
интервалах составов плотность и мольный объем расплавленной фазы совпадают с ад$
дитивными величинами. При последующем повышении содержания GdCl3 в солевой
фазе происходит объединение отдельных сеток в более крупные, что может приводить
к уменьшению мольного объема по сравнению с аддитивным. Заметное увеличение
размера сеток и соответственное уменьшение мольного объема жидкой фазы начина$
ется, вероятно, при концентрации GdCl3 более 50 мол. %. Его отклонение от аддитив$
ности достигает своего наибольшего значения при образовании единой сетки при
80 мол. % GdCl3. Последующее возрастание доли GdCl3 в составе сетки может способ$
ствовать увеличению объема ее пространственной структуры, и сближению значений
Vм с аддитивными величинами.
ВЫВОДЫ
Представлены впервые значения плотности расплавленных солевых систем GdCl3-
NaCl и KCl-GdCl3 для всего концентрационного интервала и диапазона температур
685-880°С. Экспериментальные данные получены дилатометрическим методом с от$
носительной ошибкой 2%. Установлена нелинейная концентрационная зависимость
значений плотности. Рассчитаны мольные объемы этих систем. Найдены небольшие
отрицательные отклонение их значений от аддитивности в интервале концентраций
60-90 мол. % GdCl3. Зависимости являются экстремальными с минимумами в районе
80 мол. % GdCl3. Их численные значения составляют 3.5 и 2.5 см3/моль в системах
GdCl3-NaCl и GdCl3-KCl соответственно.
СПИСОК ЛИТЕРАТУРЫ
1. Vo g e l G . , S c h n e i d e r A . Chemie der Seltenen Erden in geschmolzenen Alkalihalo$
geniden. X. Shcmelzen von Alkalichloriden mit Neodymchlorid und Gadoliniumchlorid // Z. Anorg.
Allg. Chem. 1972. 388. № 2. P. 97-104.
2. S a s a k i Y. , I g a r a s h i K . , M o c h i n a g a J . Refractive index and molar volume of mol$
ten binary GdCl3-NaCl and GdCl3-KCl systems // Denki Kagaku. 1982. 50. № 3. P. 226-231.
3. Тр и ф о н о в К . И . , З а б о т и н И . Ф . , К а т ы ш е в С . Ф . , Н и к и ф о р о в А . Ф .
Электропроводность расплавов смесей трихлорида гадолиния с хлоридами натрия и калия //
Расплавы. 2017. № 6. С. 512-516.
4. А л е к с а н д р о в И . А . , Б е л о у с о в И . А . , Тр и ф о н о в К . И . Плотность и моль$
ный объем расплавов системы DyCl3-KCl и DyCl3-NaCl // Расплавы. 2007. № 3. С. 44-48.
5. Ш и ш к и н В . Ю . , М и т я е в В . С . Очистка галогенидов щелочных металлов мето$
дом зонной плавки // Изв. АН СССР. Неорганические материалы. 1982. Т. 18. № 11. С. 1917-
1918.
6. Р е в з и н Г. Е . Безводные хлориды редкоземельных элементов и скандия // Труды
ВНИИ химических реактивов и особо чистых химических веществ. 1967. Вып. 16. С. 124-129.
7. Va n A r t s d a l e n E . R . , Ya f f e I . Electrical conductance and density of molten salt sys$
tem: KCl-LiCl, KCl-NaCl and KCl-KI // J. Phys. Chem. 1955. 59. № 2. P. 118-127.
8. Справочник по расплавленным солям. Т. 1. Электропроводность, плотность и вязкость
индивидуальных расплавленных солей / Пер. с англ. под ред. А.Г. Морачевского. Л.: Химия.
1971.
9. Н и с е л ь с о н Л . А . , Л ы з л о в Ю . Н . Плотность безводных трихлоридов редкозе$
мельных элементов в расплавленном состоянии // ДАН. 1975. 220. № 3. С. 608-609.
10. C h o K . , I r i s a w a K . , M o c h i n a g a J . , K u r o d a T. Densities and molar volumes
of molten rare$earth chlorides: PrCl3, NdCl3, GdCl3 and DyCl3 // Electrochim. Acta. 1972. 17. № 10.
P. 1821-1827.
11. I g a r a s h i K . , M o c h i n a g a J . Volumchanges on Melting for Several Rare Chlorides //
Z. Naturforsch. 1987. 42a. P. 777-778.
12. С м и р н о в М . В . , Ш а б а н о в О . М . , Х а й м е н о в А . П . Структура расплавлен$
ных солей // Электрохимия.1966. 2. № 11. С. 1240-1248.
402
К. И. Трифонов, И. Ф. Заботин, В. Е. Кротов, А. Ф. Никифоров
13. С м и р н о в М . В . , С т е п а н о в В . П . , Х о х л о в В . А . Ионная структура и физи$
ко$химические свойства галогенидных расплавов // Расплавы. 1987. № 1. С. 64-73.
14. Pa p a t h e o d o r o u G . N . The structure of molten rare earth chlorides // In: Progress in
Molten Salt Chemistry (2000) V.1. (Proc. EUCHEM 2000 Conf. On Molten Salts in honors of the
60th birthday of prof. N.J.Bjerrum, Karrebaeksminde, Denmark, Aug. 20-25). P.65-70.
15. П о т а п о в А . М . Транспортные свойства расплавленных хлоридов лантанидов и их
бинарных смесей с хлоридами щелочных металлов: дис. д$ра хим. наук. Екатеринбург: ИВТЭ
УрО РАН, 2009.
Density and Moline Volume of Binary Mixture Melts GdCl3-NaCl and GdCl3-KCl
K. I. Trifonov1, I. F. Zabotin1, V. E. Krotov2, A. F. Nikiforov3
1Kovrov State Technological Academy named after V.A. Degtyarev, Kovrov, Russia
2 Institute of High)Temperature Electrochemistry UB RAS, Yekaterinburg, Russia
3Ural Federal University, Yekaterinburg, Russia
The density of salt melts of the GdCl3-NaCl and GdCl3-KCl systems was determined
by the dilatometric method over the entire concentration range and a wide temperature
range. The molar volumes of the systems and their deviations from additivity are calculated.
It is established that all the dependences on the composition of the electrolyte are nonlinear.
The results can be used in the production technology of gadolinium and its compounds and
to clarify the structure of the investigated molten salt mixtures.
Keywords: binary systems, gadolinium trichloride, sodium and potassium chlorides, den$
sity, molar volume, isotherms
REFERENCES
1. Vogel G., Schneider A. Chemie der Seltenen Erden in geschmolzenen Alkalihalogeniden.
X. Shcmelzen von Alkalichloriden mit Neodymchlorid und Gadoliniumchlorid // Z. Anorg. Allg.
Chem. 1972. 388. № 2. P. 97-104.
2. Sasaki Y., Igarashi K., Mochinaga J. Refractive index and molar volume of molten binary
GdCl3-NaCl and GdCl3-KCl systems // Denki Kagaku. 1982. 50. № 3. P. 226-231.
3. Trifonov K.I., Zaborin I.F., Katyshev S.F., Nikiforov A.F. Elektroprovodnost’ rasplavov smesey
trikhlorida gadoliniya s khloridami natriya i kaliya [Electrical conductivity of melts of mixtures of gad$
olinium trichloride with sodium and potassium chlorides] // Rasplavy. 2017. № 6. P. 512-516
(in Russian).
4. Aleksandrov I.A., Belousov I.A., Trifonov K.I. Plotnost’ i mol’nyy ob’’yem rasplavov sistemy
DyCl3-KCl i DyCl3-NaCl [Density and molar volume of melts of the DyCl3-KCl and DyCl3-NaCl
system] // Rasplavy. 2007. № 3. P. 44-48 (in Russian).
5. Shishkin V.Yu., Mityaev V.S. Ochistka galogenidov shchelochnykh metallov metodom zonnoy
plavki [Purification of alkali metal halides by zone melting] // Izv. Academy of Sciences of the USSR.
Inorganic materials. 1982. 18. № 11. P. 1917-1918 (in Russian).
6. Revzin G. E. Bezvodnyye khloridy redkozemel’nykh elementov i skandiya [Anhydrous chlorides
of rare$earth elements and scandium] // Proceedings of the Research Institute of Chemical Reagents
and High$Purity Chemicals. 1967. 16. P. 124 - 129 (in Russian).
7. Van Artsdalen E. R., Yaffe I. Electrical conductance and density of molten salt system: KCl-
LiCl, KCl-NaCl and KCl-KI // J. Phys. Chem. 1955. 59. № 2. P. 118-127.
8. Handbook of molten salts. V. 1. Elektroprovodnost’, plotnost' i vyazkost' individual’nykh ras$
plavlennykh soley [Electrical conductivity, density and viscosity of individual molten salts] / Per. from
English by ed. A.G. Morachevsky. L.: Chemistry. 1971 (in Russian).
9. Niselson L.A., Lyzlov Yu.N. Plotnost’ bezvodnykh trikhloridov redkozemel’nykh elementov v
rasplavlennom sostoyanii [Density of anhydrous trichlorides of rare$earth elements in the molten
state] // DAN. 1975. 220. № 3. P. 608-609 (in Russian).
10. Cho K., Irisawa K., Mochinaga J., Kuroda T. Densities and molar volumes of molten rare$
earth chlorides: PrCl3, NdCl3, GdCl3 and DyCl3 // Electrochim. Acta. 1972. 17. № 10. P. 1821-1827.
Плотность и мольный объем расплавов бинарных смесей
403
11. Igarashi K., Mochinaga J. Volumchanges on Melting for Several Rare Chlorides // Z. Natur$
forsch. 1987. 42a. P. 777-778.
12. Smirnov M.V., Shabanov O.M., Khaymenov A.P. Struktura rasplavlennykh soley [The struc$
ture of molten salts] // Electrohimiya. 1966. 2. № 11. P. 1240-1248 (in Russian).
13. Smirnov M.V., Stepanov V.P., Khokhlov V.A. Ionnaya struktura i fiziko$khimicheskiye svoystva
galogenidnykh rasplavov [The ionic structure and physicochemical properties of halide melts] // Ras$
plavy. 1987. № 1. P. 64-73 (in Russian).
14. Papatheodorou G.N. The structure of molten rare earth chlorides // In: Progress in Molten
Salt Chemistry (2000) V.1. (Proc. EUCHEM 2000 Conf. On Molten Salts in honors of the 60th birth$
day of prof. N.J.Bjerrum, Karrebaeksminde, Denmark, Aug. 20-25). P. 65-70.
15. Potapov A.M. Transportnyye svoystva rasplavlennykh khloridov lantanidov i ikh binarnykh
smesey s khloridami shchelochnykh metallov [Transport properties of molten lanthanide chlorides and
their binary mixtures with alkali metal chlorides]: dis. Dr. chem. sciences. Yekaterinburg: IHTE UB
RAS, 2009 (in Russian).