РАСПЛАВЫ
5 · 2019
УДК 544.651.23
ЭЛЕКТРОВОССТАНОВЛЕНИЕ СМЕСЕЙ
ХЛОРИДА НИКЕЛЯ(II) И ОКСИДА МОЛИБДЕНА(VI)
В ТЕРМОАКТИВИРУЕМОМ ХИМИЧЕСКОМ ИСТОЧНИКЕ ТОКА
© 2019 г. О. В. Волковаa, *, В. В. Захаровa, Э. Г. Вовкотрубa,
С. В. Плаксинa, С. В. Першинаa
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
*e(mail: olga@ihte.uran.ru
Поступила в редакцию 17.09.2018 г.
После доработки 28.09.2018 г.
Принята к публикации 10.10.2018 г.
Исследованы разрядные характеристики элементов термоактивируемого хими&
ческого источника тока, содержащих в качестве положительного электрода смеси
NiCl2-MoO3. Определены состав и морфология продуктов восстановления исследу&
емых катодных материалов. Установлено, что оксид молибдена(VI) стабилизирует и
повышает напряжение разрядных кривых. Процесс восстановления Ni2+ до металла
Ni0 сопровождается снижением степени окисления иона молибдена с образованием
MoO2. Электродный процесс осложнен наличием химических реакций взаимодей&
ствия исходных компонентов катода с продуктами его восстановления и образова&
нием расплавов галогенид лития - оксид молибдена/молибдаты лития. Предложен
механизм восстановления Ni2+ и Mo6+ до металлов через промежуточную стадию об&
разования расплава хлорид никеля(II) - молибдаты лития - галогениды лития.
Ключевые слова: термоактивируемые химические источники тока, катод, хлорид ни&
келя, оксид молибдена.
DOI: 10.1134/S0235010619050116
ВВЕДЕНИЕ
Основное применение первичные термоактивируемые химические источники тока
(ТХИТ) традиционно находят в технике специального назначения [1-5]. Высокая
удельная мощность, работоспособность в широком диапазоне температур окружаю&
щей среды, устойчивость к внешним воздействиям и длительный срок хранения по
праву позволяют позиционировать ТХИТ как перспективный источник электроэнер&
гии в условиях крайнего Севера и чрезвычайных ситуаций. Увеличение длительности
работы ТХИТ при сохранении высоких удельных мощностных характеристик несо&
мненно расширит сферу их использования в гражданских целях.
Одним из способов решения данной задачи является оптимизация теплового ба&
ланса батареи ТХИТ путем приближения ее геометрии к сферическим формам. По&
скольку плотности тока, снимаемые с различных катодных материалов, имеют близ&
кие значения [6-12], то повышение вариативности параметров батареи ТХИТ обеспе&
чивается увеличением напряжения разряда на отдельно взятом электрохимическом
элементе. Повышение напряжения на элементе ТХИТ зависит от выбора электрохи&
мической пары и снижения сопротивления доставки электрических зарядов в зону
электродной реакции. В настоящее время наибольшее распространение получили ли&
тиевые батареи ТХИТ. В качестве анодного материала в этих источниках тока исполь&
зуют литиевые сплавы и композиты, обладающие малой поляризацией и потенциалом
близким к металлическому литию. Так, например, анод из литий&борного композита
[13-16] позволяет снимать ток плотностью до 100 кА ⋅ м-2 при поляризации не превы&
412
О. В. Волкова, В. В. Захаров, Э. Г. Вовкотруб, С. В. Плаксин, С. В. Першина
шающей 25 мВ. Его электрическая емкость в зависимости от содержания бора, варьи&
руется от 1.5 до 2.5 А ⋅ ч ⋅ г-1, а значения э.д.с. относительно хлорного электрода срав&
нения в температурном диапазоне 400-600°С изменяется от 3.676 до 3.549 В. Анало&
гичные характеристики катодных материалов литиевых ТХИТ существенно уступают
литий&борному композиту и следовательно именно свойства положительного элек&
трода будут играть лимитирующую роль при протекании электрохимической реакции.
Таким образом, поиск катодных материалов, способных повысить напряжение разря&
да, является приоритетной целью на данном этапе развития термоактивируемых хи&
мических источников тока.
Галогениды переходных металлов в расплавленных электролитах обладают высоки&
ми значениями плотности токов обмена [17], и в паре с литием дают высокие энерге&
тические показатели электромоторных реакций. Наиболее перспективными в данной
группе материалов являются фториды и хлориды переходных металлов. Однако, при
работе с фторидами возникают трудности, связанные с их высокой коррозионной ак&
тивностью. Поэтому предпочтение отдается хлоридам переходных металлов, коррози&
онная активность которых существенно ниже. Бромиды и иодиды переходных метал&
лов, как правило, термически не устойчивы в области рабочих температур ТХИТ и об&
ладают более низкими удельными энергетическими характеристиками. В свою
очередь, катодные материалы на основе оксида молибдена(VI) обладают малой экви&
валентной массой, не имеют существенных кинетических затруднений при восста&
новлении и образуют различные кислородные соединения с высокой электронной
проводимостью [3]. В данной работе проведено исследование разрядных характери&
стик и продуктов восстановления элементов ТХИТ на основе смесей хлорида нике&
ля(II) и оксида молибдена(VI). Целью работы является поиск катодных материалов,
обеспечивающих повышение напряжения разряда ТХИТ, и определение механизма
восстановления твердофазного катода. Понимание данного процесса существенно
облегчит в дальнейшем выбор катодного материала для батарей ТХИТ с заданными
характеристиками.
МЕТОДИКА ЭКСПЕРИМЕНТА
При изготовлении элементов ТХИТ были использованы реактивы марки “ч. д. а.”.
Исходные навески хлорида никеля(II) и оксида молибдена(VI) гомогенизировали в
агатовой ступке. Полученную смесь, спрессованную в виде таблетки, помещали в ни&
келевую чашку, служившую положительным токоотводом. В качестве отрицательного
электрода использовали литий&борный композит с содержанием бора 24 мас. % [18],
запрессованный в никелевую чашку. Анодный материал брали в избыточном количе&
стве, что гарантировало лимитирующую роль катода в разрядных характеристиках
элемента ТХИТ. В качестве сепаратора применяли низкоплавкую смесь галогенидов
лития 22LiF-31LiCl-47LiBr, мол. %, с температурой плавления 430°С, загущенную
γ&LiAlO2. Все операции по изготовлению элемента ТХИТ проводили в сухом аргоно&
вом боксе.
Рентгенофазовый анализ (РФА) образцов проводили при комнатной температуре
на дифрактометре Rigaku D/MAX&2200VL/PC (Rigaku, Япония) с использованием
Cu Kα излучения в диапазоне брегговских углов 2θ от 10° до 85° с шагом 0.02°.
Для синхронного термического анализа (СТА) использовали термический анализа&
тор STA 449 F1 Jupiter (NETZSCH). Измерения проводили в графитовых тиглях в ин&
тервале температур 35-650°С, скорость нагрева/охлаждения 10°С/мин. Измеритель&
ную ячейку с образцом продували аргоном со скоростью 50 мл/мин. Полученные дан&
ные были обработаны с помощью программного обеспечения NETZSCH Proteus.
Разряд электрохимических ячеек проводили в гальваностатическом режиме с помо&
щью электрохимической рабочей станции Zahner IM6.
Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI)
413
U, В
2.5
3
1
2.0
2
1.5
1.0
5
4
3
1
0.5
0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
1.8
2.0
CK/CNiCl2
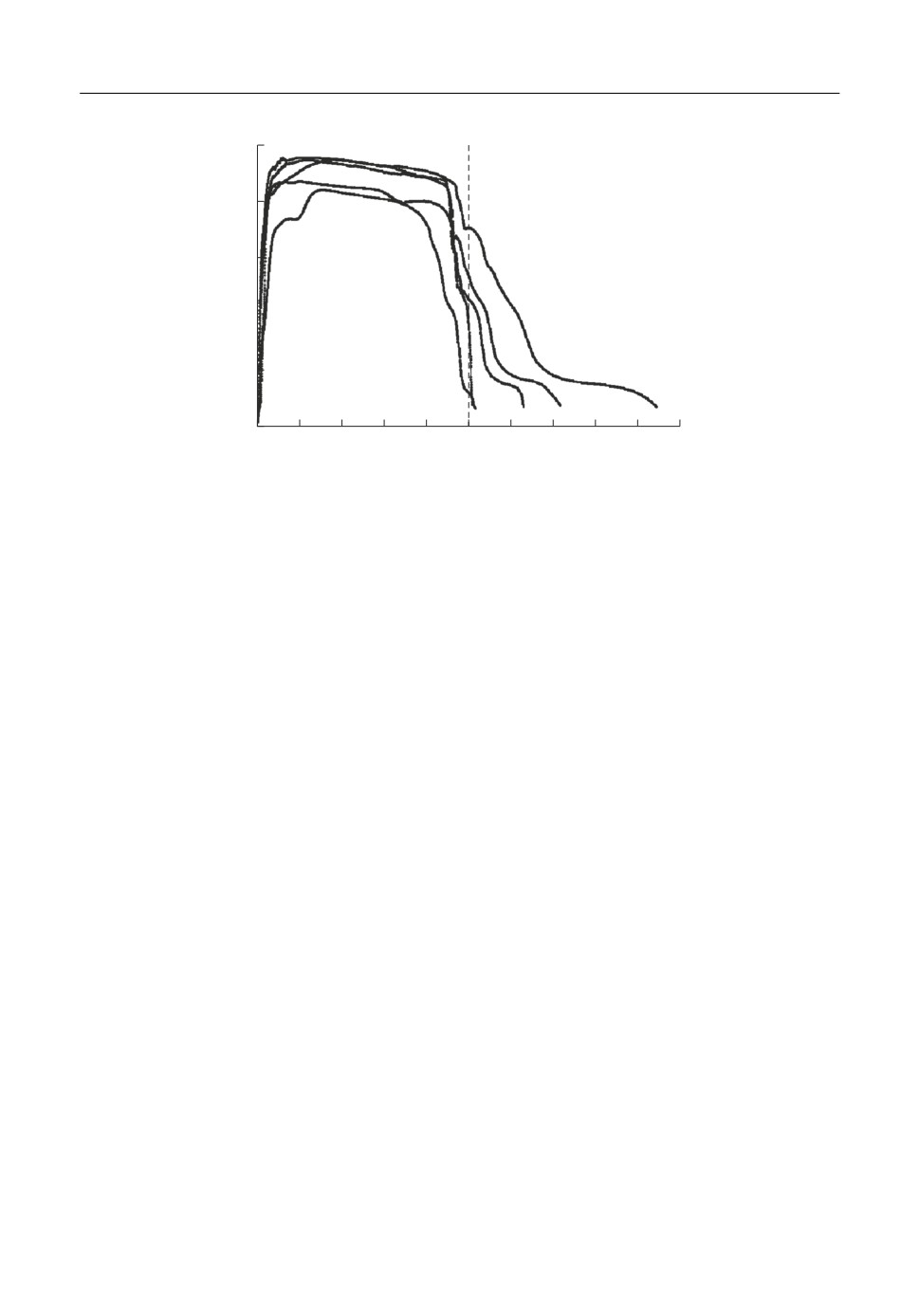
Рис. 1. Разрядные кривые элементов ТХИТ: 1 - Li-B/NiCl2; 2 - Li-B/NiCl2-MoO3 (5 мас. %); 3 -
Li⎯B/NiCl2-MoO3 (10 мас. %); 4 - Li-B/NiCl2-MoO3 (20 мас. %); 5 - Li-B/NiCl2-MoO3 (30 мас. %). Плот&
ность тока разряда 0.5 A ⋅ см-2; Тразряда = 550°С.
Спектры комбинационного рассеяния (КР) снимали на рамановском микроскопе&
спектрометре U1000 (Renishaw, Англия), оборудованным микроскопом Leica DML,
нотч&фильтром и ССД камерой. Микроскоп позволяет регистрировать спектры КР для
объектов размером менее 1 мкм и обладает абсолютной чувствительностью до 10-12 г. В
качестве возбуждающего источника света использовали лазер с длиной волны 532 нм.
Морфологию продуктов восстановления катода исследовали с помощью растрово&
го электронного микроскопа (РЭМ) с безазотным энергодисперсионным детектором
X&Act ADD + JSM&5900LV (Jeol, Япония), пространственное разрешение 3 нм (2.5 нм
с катодом LaB6).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В рамках данной работы были исследованы разрядные характеристики элементов
ТХИТ с катодными смесями NiCl2-MoO3 (содержание оксида молибдена(VI) до
30 мас. %) в диапазоне плотностей тока от 0.1 до 1 А/см2 в расчете на поверхность ис&
ходного катода. Для всех катодов, масса NiCl2 в исходной смеси составляла 1 г, масса
MoO3 варьировалась в соответствии с требуемым соотношением компонентов. Разря&
ды элементов ТХИТ проводили при 550°С, так как это минимальная температура поз&
воляющая реализовать весь рассматриваемый диапазон плотностей тока с максималь&
ным отбором электрической емкости катода.
На рис. 1 представлены разрядные кривые элементов ТХИТ с различными состава&
ми катодных смесей. Для сравнения на рисунке также приведена разрядная кривая
элемента ТХИТ с хлоридом никеля. Из полученных данных следует, что добавка окси&
да молибдена более 5 мас. % позволяет существенно повысить величину напряжения
разряда элементов ТХИТ на основе хлорида никеля. Этот эффект наблюдается во всем
диапазоне исследуемых плотностей тока (рис. 2). Помимо этого, при плотностях тока
414
О. В. Волкова, В. В. Захаров, Э. Г. Вовкотруб, С. В. Плаксин, С. В. Першина
U, В
4
2.5
3
2
2.0
1
1.5
1.0
4
0.5
0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
CK/CNiCl2
Рис. 2. Разрядные кривые элементов ТХИТ (Тразряда = 550°С). Плотность тока разряда 1 А ⋅ см-2: 1 -
Li⎯B/NiCl2; 2 - Li-B/NiCl2-MoO3 (20 мас. %); плотность тока разряда 0.25 A ⋅ см-2: 3 - Li-B/NiCl2; 4 -
Li-B/NiCl2-MoO3 (20 мас. %).
ниже 0.5 А/см2, введение добавки оксида молибдена(VI) способствует стабилизации
разрядной кривой (рис. 2, кривые 3, 4).
Характерной чертой разрядных кривых в исследуемом токовом диапазоне является
наличие плато. Его длительность соответствует электрической емкости хлорида нике&
ля, входящего в состав катодной смеси (
= 24.78 А · мин). Варьирование величи&
CNiCl
2
ны добавки оксида молибдена(VI) в катодной смеси от 10 до 30 мас. % не вносит суще&
ственных изменений в характер данного участка разрядной кривой. Поэтому мы отно&
сим его к процессу восстановления NiCl2, который в присутствии MoO3 протекает с
меньшими затруднениями, чем в чистом хлориде никеля(II). Последующий участок
на разрядных кривых имеет ступенчатый характер. Мы полагаем, что его вид опреде&
ляется особенностями восстановления молибденовой составляющей катодной смеси
при различных плотностях тока.
РЭМ исследования продуктов катодной реакции показали, что в них формируется
металлическая матрица, покрытая солевой фракцией. В качестве примера, на рис. 3а
представлен снимок катода после восстановления при протекании тока плотностью
0.5 А/см2. Энергодисперсионный анализ солевой составляющей показал, что в иссле&
дуемых образцах помимо кислорода и хлора в небольшом количестве присутствуют Br
и F. Наличие этих элементов в разряженном катоде обусловлено диффузией соответ&
ствующих галогенидов лития из сепаратора в процессе разряда элемента ТХИТ. Рост
матрицы происходит в течение всего разряда и направлен от границы с сепаратором
вглубь катода. Формирование матрицы зависит от плотности тока разряда. При высо&
ких плотностях тока, образуются прочные структуры с более развитой поверхностью и
мелкими порами. Для более четкой прорисовки особенностей морфологии матрицы
исследуемых объектов, часть микрофотографий снята на образцах, отмытых в дистил&
лированной воде (рис. 3б). Следует отметить, что поверхность матрицы со стороны
Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI)
415
a
б
10 мкм
200 мкм
Рис. 3. РЭМ продуктов катодной реакции элементов ТХИТ: а - не отмытые; б - отмытые в дистиллирован&
ной воде. Плотность тока разряда 1 A ⋅ см-2; Тразряда = 550°С.
никелевой чашки имеет волокнистую структуру, более богатую по содержанию молиб&
дена, чем остальная часть матрицы. Мы предполагаем, что подобная анизотропия со&
става матрицы является следствием образования летучих молибденсодержащих соеди&
нений (например, оксихлорида молибдена). По мере роста матрицы, образующиеся га&
зообразные фракции вытесняются преимущественно в объем не восстановленной части
твердофазного катода и в дальнейшем восстанавливаются до металлического молибдена.
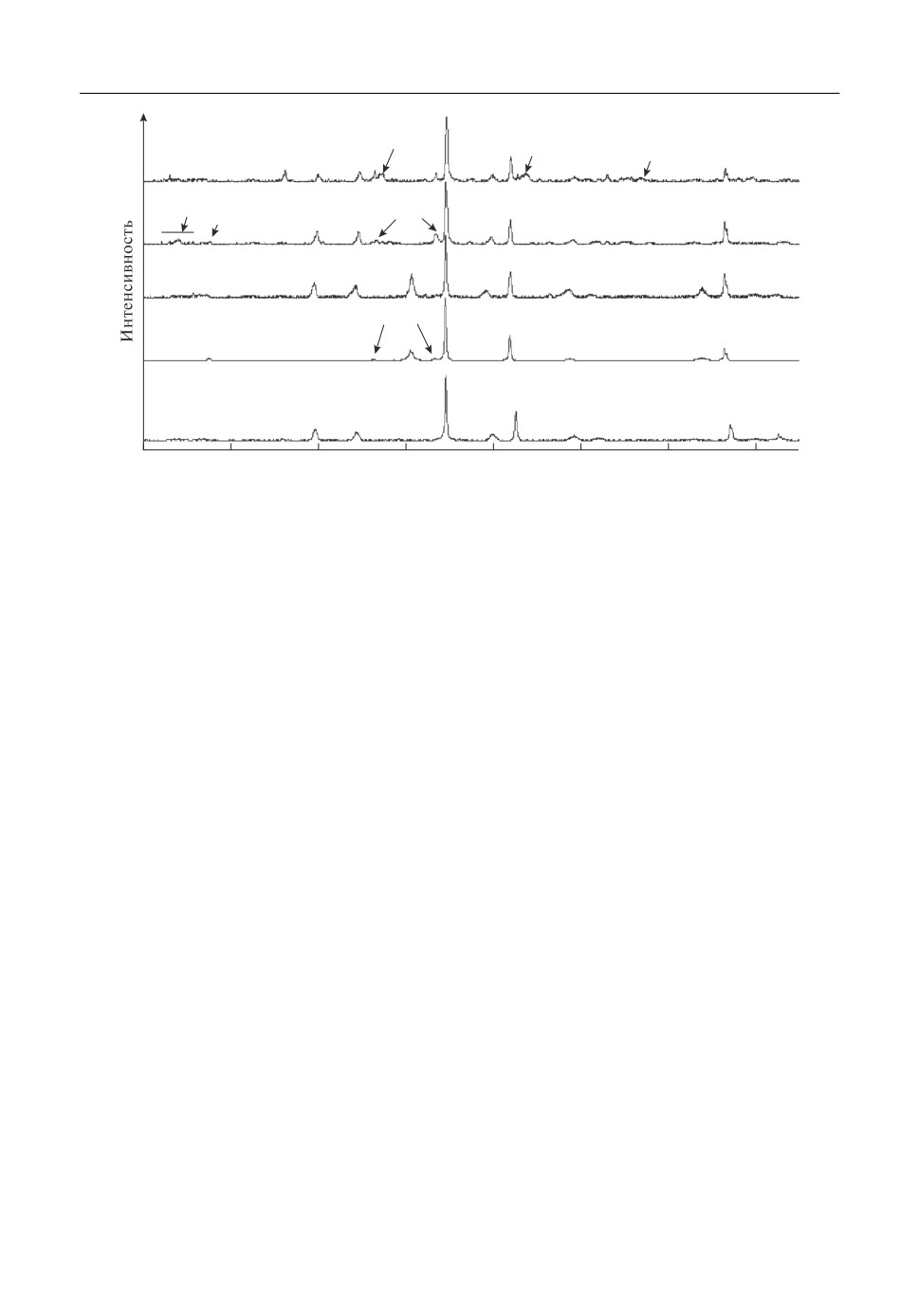
На рис. 4 представлены данные РФА разряженных катодных смесей при макси&
мальном отборе емкости (дифрактограмма 3) и частичном отборе емкости (дифракто&
граммы 4 и 5). Для сравнения, на рисунке также представлена дифрактограмма про&
дуктов восстановления NiCl2 (кривая 1). На всех дифрактограммах присутствует набор
линий, относящийся к LiCl и металлическому Ni. Линии, принадлежащие молибдену,
появляются лишь на дифрактограммах катодных смесей с отбором электрической ем&
кости более 1.05
Это подтверждает наше предположение о том, что начальное
CNiCl
2
плато на разрядных кривых соответствует восстановлению NiCl2 до металлического
никеля. Линии исходных компонентов катода (NiCl2, MoO3) на дифрактограммах ка&
тодных смесей отсутствуют, в не зависимости от величины отобранной емкости. В то&
же время при частичном разряде элементов ТХИТ с катодом из NiCl2, наблюдается
наличие слоя исходного компонента со стороны катодной чашки. Это позволяет
предположить, что в процессе восстановления катодной смеси NiCl2-MoO3, на поло&
жительном электроде элемента ТХИТ, помимо электрохимических реакций, протека&
ет ряд химических превращений, в которых задействованы как исходные компоненты
катода, так и продукты его восстановления. В результате, процесс восстановления
Ni2+ до Ni0 происходит из образовавшихся никельсодержащих фаз, отличных от ис&
ходного компонента смеси (NiCl2). Например из ограниченного ряда твердых раство&
ров, которые существуют в системе LiCl-NiCl2 в области богатой хлоридом лития, из
соединения Li6NiCl8, образующегося в твердой фазе и устойчивого до 575°С [19-21],
либо из молибдатов никеля. В отличие от катодов из хлорида никеля(II), на дифракто&
416
О. В. Волкова, В. В. Захаров, Э. Г. Вовкотруб, С. В. Плаксин, С. В. Першина
MoO2
MoO2
MoO2
MoO2
5
MoOCl4
Li2MoO3
Li2MoO3
4
3
Li2MoO3
Mo
Mo
Mo
Li2MoO3
2
Ni
Ni
LiCl LiCl
Ni
LiCl
LiCl
LiCl
LiCl
LiCl
1
10
20
30
40
50
60
70
80
2
Рис. 4. Дифрактограммы продуктов разряда катодных материалов элементов ТХИТ: 1 - Li-B/NiCl2; 2 -
Li⎯B/NiCl2-MoO3 (20 мас. %), катод отмыт в дистиллированной воде; 3 - Li-B/NiCl2-MoO3 (20 мас. %);
4 - Li-B/NiCl2-MoO3 (20 мас. %), 1.05
5 - Li-B/NiCl2-MoO3 (20 мас. %), 0.75
NiCl2;
C
NiCl2.
C
граммах разряженных смесей NiCl2-MoO3 появляется ряд дополнительных линии.
Вследствие малой интенсивности этих линий, их однозначная идентификация в со&
ставе многофазного образца не представляется возможной. Однако мы предполагаем,
что они относятся к соединениям на основе молибдатов лития и оксихлоридов молиб&
дена. После удаления из образцов растворимых осадков (дифрактограмма 2), линии,
отнесенные нами к оксихлоридам молибдена, исчезают. Помимо этих фаз, на дифрак&
тограмме образца с отбором электрической емкости 0.75
присутствуют линии
CNiCl
,
2
относящиеся к MoO2.
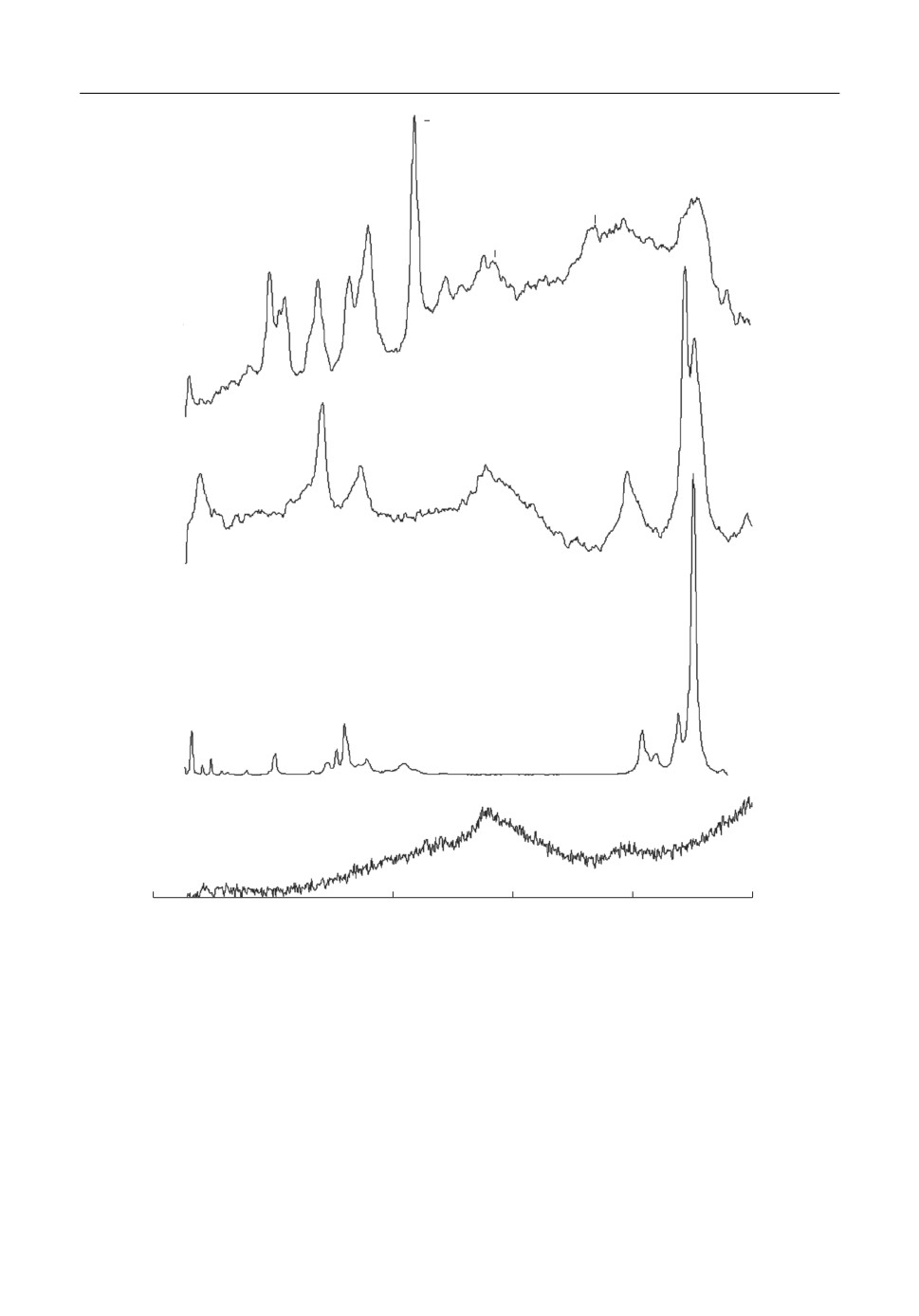
Для дополнительной идентификации фаз, образующихся в процессе восстановле&
ния катода, нами были сняты спектры КР образцов с максимальным и частичным от&
бором электрической емкости (рис. 5, спектры 2 и 1, соответственно). Вследствие вы&
сокой гигроскопичности образцов, были использованы защитные покровные стекла
(спектр 4). Для анализа исследуемых образцов, также были сняты спектры КР исход&
ных компонентов катода (NiCl2, MoO3) и Li2MoO4 (последний также представлен на
рис. 5, спектр 3). Сравнение полученных данных подтвердило отсутствие в образцах 1
и 2 компонентов исходного катода. В высокочастотной области спектра КР (950-
750 см-1) исследуемых образцов наблюдаются интенсивные линии, соответствующие
частотам валентных колебаний тетраэдра MoO4 в молибдате лития. В низкочастотной
области спектра КР образца с максимальным отбором электрической емкости наблю&
даются две интенсивные линии 344 и 282 см-1. Их частоты близки к частоте колебания
Mo=O октаэдрической группировки MoO6 и колебаний мостиковых связей Mo-O-Mo
кластеров Mo3O13 в Li2MoO3 [22-24]. Спектр КР образца с отбором электрической
емкости 0.75
содержит ряд дополнительных линий характерных для спектра
CNiCl2
MoO2 [25].
Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI)
417
440
740
362
567
197
330
490
278
223
1
282
2
344
3
4
0
200
400
600
800
1000
, см-1
Рис. 5. Спектры комбинационного рассеяния света продуктов восстановления катодной смеси NiCl2-MoO3
(20 мас. %) при отборе электрической емкости 0.75
(1) и 1.25
(2). Для сравнения представлены
C
CNiCl
2
NiCl2
спектры реактива Li2MoO4 и покровного стекла levenhuk G100.
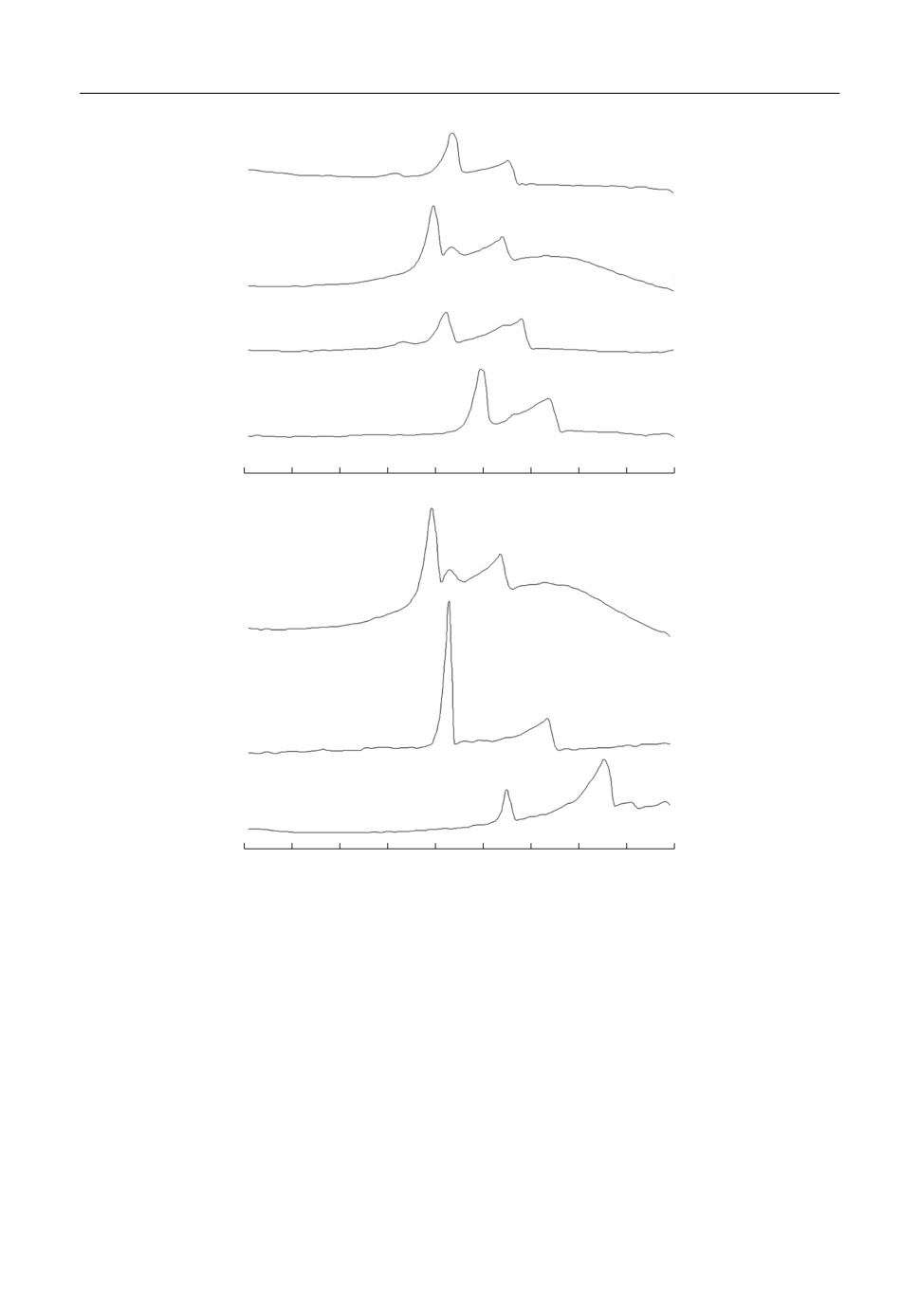
Результаты СТА продуктов восстановления различных составов катодных смесей
представлены на рис. 6а. В образцах содержащих менее 30 мас. % MoO3, с ростом кон&
центрации оксидной добавки на ДСК кривых наблюдается смещение пиков в область
более низких температур. Также на положение пиков влияет степень восстановления
катода. При отборе емкости 0.75
CNiCl
,
высокотемпературный пик близок к темпера&
2
туре плавления LiCl (рис. 6б, кривая 3). Поэтому мы относим его к плавлению эвтек&
418
О. В. Волкова, В. В. Захаров, Э. Г. Вовкотруб, С. В. Плаксин, С. В. Першина
а
↑ exo
4
3
2
1
200
250
300
350
400
450
500
550
600
650
б
↑ exo
1
2
3
200
250
300
350
400
450
500
550
600
650
Температура, °C
Рис. 6. ДСК кривые охлаждения разряженных катодных материалов элементов ТХИТ (плотность тока раз&
ряда 0.5 A ⋅ см-2). (а): 1 - Li-B/NiCl2; 2 - Li-B/NiCl2-MoO3 (10 мас. %), 3 - Li-B/NiCl2-MoO3 (20 мас. %),
4 - Li-B/NiCl2-MoO3 (30 мас. %); (б): 1 - Li-B/NiCl2-MoO3 (20 мас. %), 2 - Li-B/NiCl2-MoO3 (20 мас. %),
1.05
, 3 - Li-B/NiCl2-MoO3 (20 мас. %), 0.75
NiCl2
C
NiCl2.
C
тики в системе LiCl-MoO3. Дальнейший отбор емкости также ведет к смещению пика
в область более низких температур (рис. 6б, кривая 1 и 2). В процессе восстановления
Ni2+, осаждение LiCl происходит на поверхность металлической матрицы. Рост мат&
рицы сопровождается увеличением ее дисперсности. В свою очередь это ведет к повы&
шению количества поверхностных структурных дефектов LiCl и к снижению его тем&
пературы плавления. Низкотемпературный пик соответствует совместному плавле&
Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI)
419
нию смеси молибдатов лития с галогенидами лития и имеет аналогичную зависимость
от концентрации MoO3 в исходной катодной смеси и глубины разряда катода.
ЗАКЛЮЧЕНИЕ
Исследование разрядных характеристик элементов ТХИТ, содержащих в качестве
положительного электрода смеси NiCl2-MoO3 показало, что оксид молибдена(VI)
стабилизирует и повышает напряжение разрядных кривых. Процесс восстановления
Ni2+ до металла Ni0 сопровождается снижением степени окисления иона молибдена с
образованием MoO2. Электродный процесс также осложнен наличием химических ре&
акций взаимодействия исходных компонентов катода с продуктами его восстановле&
ния. В виду того, что образующаяся солевая фракция распределена по мелкодисперс&
ной металлической матрице, температура плавления ее компонентов вблизи поверх&
ности металла снижается ниже рабочей температуры элемента ТХИТ, образуя
расплавы галогенид лития-оксид молибдена/молибдаты лития. Температура образо&
вания расплава зависит от состава исходной катодной смеси и степени дисперсности,
образующейся в процессе восстановления катода, металлической матрицы. Наличие
жидкой фазы в восстановленной части катода обеспечивает доставку ионов лития к
зоне электрохимической реакции. Процессу восстановления NiCl2 предшествует его
растворение в расплавах. Растворимость NiCl2 в чистом хлориде лития невелика (ме&
нее 7 мол. % при 600°С [21]). Поэтому при частичном разряде элемента ТХИТ с NiCl2
(0.75
), в катоде наблюдается слой не восстановленного хлорида никеля(II).
CNiCl
2
Присутствие в составе исходного катода оксида молибдена(VI) обеспечивает рост
концентрации NiCl2 в расплаве солевой составляющей в зоне катодной реакции, что
снижает поляризационные затруднения и повышает напряжение разряда элемента
ТХИТ.
Исследования выполнены с использованием оборудования ЦКП “Состав веще&
ства” ИВТЭ УрО РАН.
СПИСОК ЛИТЕРАТУРЫ
1. G u i d o t t i R . A . , M a s s e t P. // J. of Power Sources. 2006. 161. № 2. P. 1443-1449.
2. К о р о в и н Н . В . , С к у н д и н А . М . Химические источники тока: Справочник. 3
Изд.: МЭИ, 2003.
3. Ку к о з Ф . И . , Тр у ш Ф . Ф . , К о н д р а т е н к о в В . И . Тепловые химические ис&
точники тока. Изд. Ростовского университета. 1989.
4. G u i d o t t i R . , R e i n h a r d t F. W. , D a i J . , R e i s n e r D . E . // J. of Power Sources.
2006. 160. № 2. P. 1456-1464.
5. N e l s o n P. A . // J. of Power Sources. 1990. 29. P. 565-577.
6. M a s s e t P. J . , G u i d o t t i R . A . // J. of Power Sources. 2008. 177. № 2. P. 595-609.
7. M a s s e t P. J . , G u i d o t t i R . A . // J. of Power Sources. 2008. 178. № 1. P. 456-466.
8. B u t l e r P. , Wa g n e r C . , G u i d o t t i R . , F r a n c i s I . // J. of Power Sources. 2004.
136. P. 240-245.
9. A u M . // J. of Power Sources. 2003. 115. № 2. P. 360-366.
420
О. В. Волкова, В. В. Захаров, Э. Г. Вовкотруб, С. В. Плаксин, С. В. Першина
10. M a s s e t P. J . Thermal stability of FeS2 cathode material in “thermal” batteries: effect of dis&
solved oxides in molten salt electrolytes // Z. Naturforsch. 2008. 63a. P. 596-602.
11. Vo l k o v a O . V. , Z a k h a r o v V. V. , R e z n i t s k i k h O . G . // Russian Metallurgy.
2017. № 8. P. 655-659.
12. Vo l k o v a O . V. , Z a k h a r o v V. V. // Russian Metallurgy. 2018. № 2. P. 201-204.
13. D a l l e k S . , E r n s t D . W. , L a r r u c k B . F. Thermal Analysis of Lithium-Boron Al&
loys // J. Electrochem. Soc. 1979. 126. № 5. P. 866-870.
14. D e v r i e s L . E . , J a c k s o n L . D . , J a m e s S . D . Structure and anodic discharge beha&
viar of lithium&boron alloys in the LiCl-KCl eutectic melt (II) // J. Electrochem. Soc. 1979. 126. № 6
P. 993-996.
15. M c M a n i g G . E . , M i l e s M . H . , F l e t c h e r A . N . The lithium&boron alloy anode
in molten nitrate electrolytes // J. Electrochem. Soc. 1984. 131. № 2. P. 286-289.
16. M i l e s M . H . , M c M a n i g G . E . , F l e t c h e r A . N . Effect of temperature and elec&
trolyte composition on the lithium&boron alloy anode in nitrate melts: passivating films on solid and
liquid lithium // J. Electrochim. Acta. 1985. 30. P. 889-897.
17. Б а р а б о ш к и н А . Н . Электрокристаллизация металлов из расплавленных солей. М.:
Наука. 1976.
18. З а х а р о в В . В . и д р . Способ изготовления литий&борного композита и реактор.
Патент РФ № 2395603, 2010.
19. Го л у б е в а М . С . , М е д в е д е в Б . С . Тройная взаимная система из хлоридов и
сульфатов лития и никеля // Журн. неорган. химии. 1962. 7. № 2. С. 2600.
20. С а ф о н о в В . В . , Тр у ш Ф . Ф . , Н а х ш и н М . Ю . , Гр ы з л о в а Е . С . // Журн.
неорган. химии. 1983. 7. № 5. С. 1344.
21. С а ф о н о в В . В . , М и р е е в В . А . , Б р ы к с и н а & Л я м и н а М . М . , Б а я н д и н
Д . В . , П р о к р п е ц В . Е . // Журн. неорган. химии. 1990. 35. № 2. С. 517.
22. J e z l o r o w s k l H . , K n o z i n g e r H . // J. Phys. Chem. 1979. 83. № 9. P. 1166-1173.
23. H u H . , Wa c h s I . E . , B a r e S . R . // J. Phys. Chem. 1995. 99. P. 10897-10910.
24. M a J . , G a o Y. , Wa n g Z . , C h e n L . Structural and electrochemical stability of Li&
rich layer structured Li2MoO3 in air // J. of Power Sources. 2014. 258. P. 314-320.
25. S p e v a c k P. A . , M c I n t y r e N . S . // J. Phys. Chem. 1992. 96. P. 9029-9035.
Electroreduction of Nickel(II) Chloride and Molybdenum(VI) Oxide Mixtures
in a Heat Activated Battery
O. V. Volkova1, V. V. Zakharov1, E. G. Vovkotrub1, S. V. Plaksin1, S. V. Pershina1
1Institute of High(Temperature Electrochemistry of the Ural Branch of Russian Academy
of Sciences, Yekaterinburg, Russia
Discharge characteristics of the heat activated battery with NiCl2-MoO3 mixtures as a
cathode material has been investigated. Composition and morphology of reduction products
of the cathode materials have been determined. The addition of molybdenum(VI) oxide to
nickel(II) chloride leads to stabilization of the discharge curves and increase of the cell volt&
age. The formation of MoO2 was accompanied by the reduction process of Ni2+ to Ni0. The
electrode process was complicated by interaction of the cathode material with the reduction
products and the formation of the melt of molybdenum oxide / lithium molybdates with
lithium halogenides. A mechanism of the reduction of Ni2+ and Mo6+ to metallic nickel and
Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI)
421
molibdenum has been proposed, which includes an intermediate step of a melt formation of
NiCl2 and lithium molybdates with lithium halogenides.
Keywords: thermally activated chemical current sources, cathode, nickel chloride, mo&
lybdenum oxide
REFERENCES
1. Guidotti R.A., Masset P. // J. Power Sources. 2006. 161. № 2. P. 1443-1449.
2. Korovin N.V., Skundin A.M. Khimicheskiye istochniki toka: Spravochnik. [Chemical current
sources] 3 Izd.: MEI. 2003. (In Russian).
3. Kukoz F.I., Trush F.F., Kondratenkov V.I. Teplovyye khimicheskiye istochniki toka [Thermal
chemical current sources]. Izd. Rostovskogo universiteta. 1989. (In Russian).
4. Guidotti R., Reinhardt F.W., Dai J., Reisner D.E. // J. of Power Sources. 2006. 160. № 2.
P. 1456-1464.
5. Nelson P.A. // J. of Power Sources. 1990. 29. P. 565-577.
6. Masset P.J., Guidotti R.A. // J. Power Sources. 2008. 177. № 2. P. 595-609.
7. Masset P.J., Guidotti R.A. // J. Power Sources. 2008. 178. № 1. P. 456-466.
8. Butler P., Wagner C., Guidotti R., Francis I. // J. of Power Sources. 2004. 136. P. 240-245.
9. Au M. // J. Power Sources. 2003. 115. № 2. P. 360-366.
10. Masset P.J. Thermal stability of FeS2 cathode material in “thermal” batteries: effect of dis&
solved oxides in molten salt electrolytes // Z. Naturforsch. 2008. 63a. P. 596-602.
11. Volkova O.V., Zakharov V.V., Reznitskikh O.G. // Russian Metallurgy. 2017. № 8. P. 655-659.
12. Volkova O.V., Zakharov V.V. // Russian Metallurgy. 2018. № 2. P. 201-204.
13. Dallek S., Ernst D.W., Larruck B.F. Thermal Analysis of Lithium-Boron Alloys // J. Electro&
chem. Soc. 1979. 126. № 5. P. 866-870.
14. Devries L.E., Jackson L.D., James S.D. Structure and anodic discharge behaviar of lithium&
boron alloys in the LiCl-KCl eutectic melt (II) // J. Electrochem. Soc. 1979. 126. № 6 P. 993-996.
15. McManig G.E., Miles M.H., Fletcher A.N. The lithium-boron alloy anode in molten nitrate
electrolytes // J. Electrochem. Soc. 1984. 131. № 2. P. 286-289.
16. Miles M.H., McManig G.E., Fletcher A.N. Effect of temperature and electrolyte composition
on the lithium&boron alloy anode in nitrate melts: passivating films on solid and liquid lithium //
J. Electrochim. Acta. 1985. 30. P. 889-897.
17. Baraboshkin A.N. Elektrokristallizatsiya metallov iz rasplavlennykh soley [Electrocrystalliza&
tion of metals from molten salts]. M.: Nauka. 1976. (In Russian).
18. Zakharov V.V. i dr. Sposob izgotovleniya litiy&bornogo kompozita i reactor [A method of man&
ufacturing a lithium&boron composite and a reactor]. The patent of the RF. № 2395603, 2010.
(In Russian).
19. Golubeva M.S., Medvedev B.S. Troynaya vzaimnaya sistema iz khloridov i sul’fatov litiya i ni&
kelya [Triple mutual system of lithium and nickel chlorides and sulfates] // Zhurn. neorgan. khimii.
1962. 7. № 2. P. 2600. (In Russian).
422
О. В. Волкова, В. В. Захаров, Э. Г. Вовкотруб, С. В. Плаксин, С. В. Першина
20. Safonov V.V., Trush F.F., Nakhshin M.YU., Gryzlova Ye.S. // Zhurn. neorgan. khimii. 1983. 7.
№ 5. P. 1344. (In Russian).
21. Safonov V.V., Mireyev V.A., Bryksina&Lyamina M.M., Bayandin D.V., Prokrpets V.Ye. //
Zhurn. neorgan. khimii. 1990. 35. № 2. P. 517. (In Russian).
22. Jezlorowskl H., Knozinger H. // J. Phys. Chem. 1979. 83. № 9. P. 1166-1173.
23. Hu H., Wachs I.E., Bare S.R. // J. Phys. Chem. 1995. 99. P. 10897-10910.
24. Ma J., Gao Y., Wang Z., Chen L. Structural and electrochemical stability of Li&rich layer struc&
tured Li2MoO3 in air // J. of Power Sources. 2014. 258. P. 314-320.
25. Spevack P.A., McIntyre N.S. // J. Phys. Chem. 1992. 96. P. 9029-9035.