РАСПЛАВЫ
5 · 2019
УДК 541.48 14:541.1:546.65
ЭЛЕКТРОВОССТАНОВЛЕНИЕ ХЛОРИДА ГОЛЬМИЯ
В ЭКВИМОЛЬНОМ РАСПЛАВЕ NaCl-KCl
© 2019 г. О. В. Черноваa, *, С. В. Жуковинa, Д. А. Кондратьевa
aВятский государственный университет, Киров, Россия
*e mail: olgavc_kirov@mail.ru
Поступила в редакцию 12.11.2018 г.
После доработки 30.11.2018 г.
Принята к публикации 17.12.2018 г.
Редкоземельные металлы и их сплавы находят применение в различных областях
техники. Это обусловлено их уникальными физическими и химическими свойствами.
Для получения покрытий с редкоземельными металлами, необходимы сведения о ки'
нетике электродных процессов с их участием в солевых расплавленных средах. Эти во'
просы для редкоземельных металлов недостаточно изучены. В данной работе опреде'
лены кинетические параметры катодного восстановления ионов гольмия в эквимоль'
ном расплаве NaCl-KCl (коэффициенты переноса, гетерогенные константы скорости
переноса заряда) методами хронопотенциометрии и хроновольтамрперометрии в диа'
пазоне температур 1073-1173 К и концентраций хлорида гольмия 1-10 мас. %. Опре'
делены зависимости кинетических параметров от температуры и концентрации хло'
рида редкоземельного металла. Предложен механизм восстановления комплексного
-
−
−
-
иона в указанном расплаве:
HoCl36
=
HoCl4
+ 2Cl-,
HoCl4
+ e
→
HoCl24
Ключевые слова: расплавы хлоридов, трихлорид гольмия, кинетические параметры,
хронопотенциометрия, хроновольтамперометрия.
DOI: 10.1134/S0235010619050049
ВВЕДЕНИЕ
Интерес к использованию редкоземельных металлов (РЗМ) в качестве легирующих
добавок к другим металлам и сплавам обусловлен приданию последним уникальных
свойств - жаростойкость, жаропрочность, коррозионная стойкость, каталитическая и
сорбционная активность [1-4]. Все это относится и к сплавам на основе гольмия. До'
бавки гольмия к железу, алюминию позволяют получить материалы с особыми маг'
нитными свойствами, которые используются в технике [5]. Удобным и перспектив'
ным способом получения перечисленных свойств металлических изделий является
обработка поверхности их в расплавах солей с РЗМ. Процессы получения покрытий
имеют электрохимическую природу, поэтому для управления этими процессами необ'
ходимо знать кинетику и механизм катодного восстановления ионов РЗМ.
Анализ литературных источников показал, что, несмотря на значительный интерес
к электрохимическому поведению редкоземельных металлов в расплавленных хлори'
дах, нет единой точки зрения на механизм катодного восстановления. В работах [6, 7]
высказано предположение, что редкоземельные металлы в ионных расплавах суще'
ствуют в трехвалентном состоянии. В исследованиях [8, 9] показано устойчивое двух'
валентное состояние РЗМ, доля двухвалентных ионов с увеличением температуры
возрастает. Согласно [10, 11], редкоземельные элементы в хлоридных расплавах обра'
3−
2−
зуют комплексные группировки
LnCl
и
LnCl
В литературных источниках недо'
6
4 .
424
О. В. Чернова, С. В. Жуковин, Д. А. Кондратьев
статочно информации о кинетических параметрах катодного восстановления гольмия
в эквимольном расплаве NaCl-KCl.
Учитывая перспективу использования сплавов на основе гольмия, необходимых со'
временной технике, весьма важно всесторонне изучить процессы катодного восста'
новления ионов гольмия в расплавленных солевых электролитах. Цель данной работы
состояла в исследовании процессов катодного восстановления ионов гольмия и полу'
чение количественных характеристик их разряда в эквимольном расплаве NaCl-KCl.
Данные, полученные в работе, могут быть использованы для совершенствования тех'
нологии получения сплавов с РЗМ.
МЕТОДИКА ЭКСПЕРИМЕНТА
Эксперимент проводили с использованием рекомендаций, приведенных в работах
[12, 13]. В работе использовали соли квалификации “х. ч.” Для получения эквимоль'
ной смеси NaCl-KCl предварительно высушенные хлориды калия и натрия смешива'
ли в заданном соотношении и переплавляли в кварцевой ячейке. Затем продували осу'
шенным хлороводородом в течение 2-3 ч. Хлорид гольмия очищали путем продувки па'
рами тетрахлорида углерода по известной методике [14]. Для оценки остатков влаги в
хлоридах гольмия использовали прибор Shimandzu DTG'60. Влагосодержание состав'
ляло около 0.4 мас. % от исходной массы при выдержке на воздухе до одной минуты.
ЭКСПЕРИМЕНТ
Электровосстановление хлорида гольмия изучалось методами хронопотенциомет'
рии (ХП) с диапазоном значений плотности тока 0.01-1.20 А/см2 и хроновольтампе'
рометрии (ХВА) со скоростью развертки потенциала от 0.2 до 20 В/с [15]. ХП и ХВА
зависимости получали с помощью потенциостата'гальваностата Р'150I. Эксперимент
проводили в атмосфере очищенного аргона в температурном интервале 1073-1173 К и
диапазоне концентраций хлорида гольмия 1-10 мас. %. Для исключения попадания
влаги навеску хлорида гольмия взвешивали в закрытой пробирке. Хлорид гольмия
вводили в расплав после заполнения аргоном и нагрева ячейки до температуры опыта.
В трехэлектродной ячейке рабочим электродом служил молибден, вспомогательным и
одновременно контейнером - стеклоуглеродный тигель. Измерения проводили отно'
сительно свинцового электрода сравнения, который состоял из молибденового токо'
подвода, погруженного в смесь состава Pb/NaCl-KCl (эквимоль) + 2.56 PbCl2 мол. %
[12]. Для исключения контакта кислородсодержащих соединений с расплавом, алун'
довый чехол свинцового электрода предварительно покрывали нитридом титана.
Конструкционные материалы обработали в расплаве эквимоля для удаления воздуха.
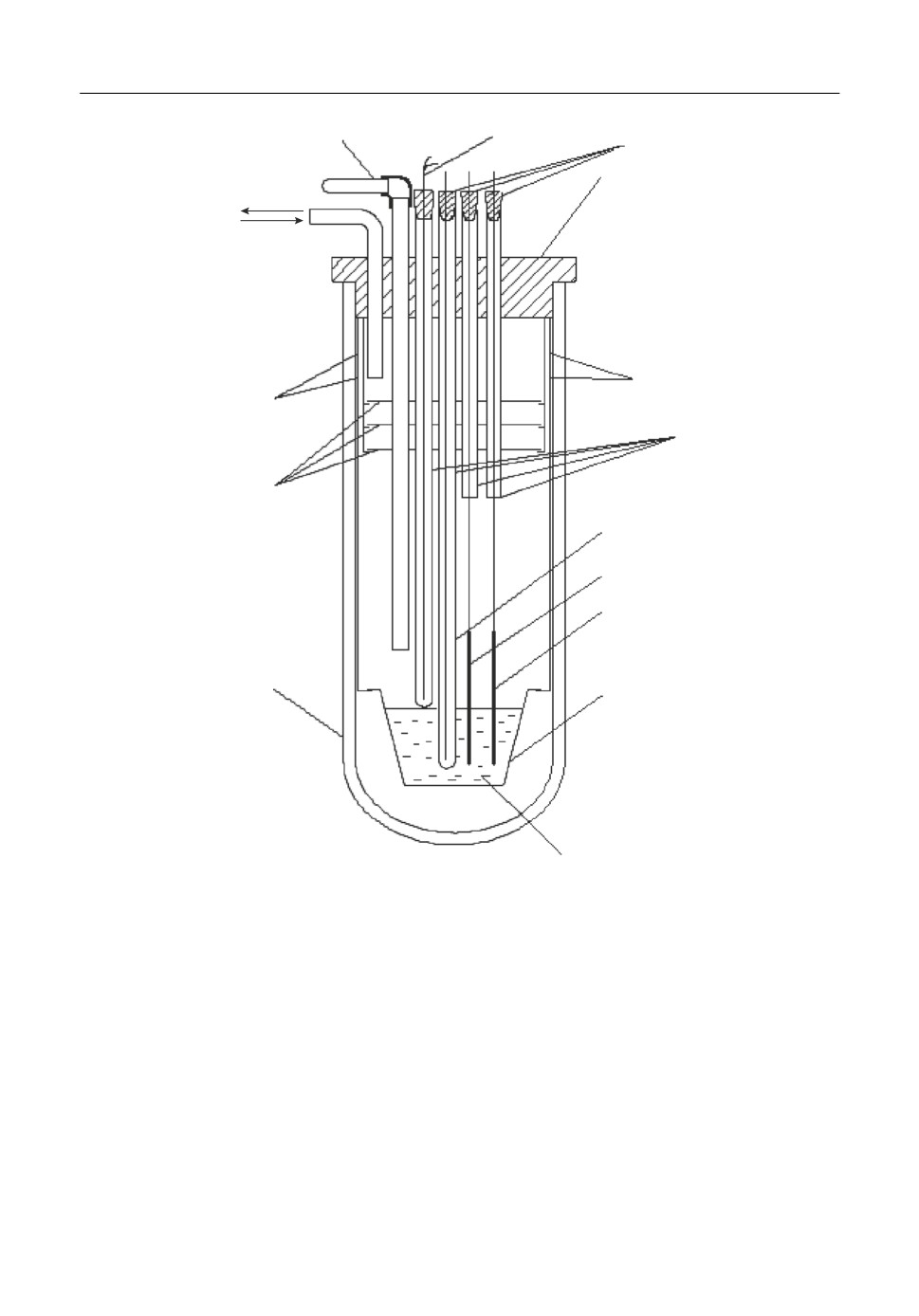
Собранную герметичную ячейку (рис. 1) из оптического кварца, в которой был за'
креплен тигель из стеклоуглерода (СУ'2000) помещали в печь СШОЛ с автоматиче'
ским регулированием температуры.
После опыта проводился химический анализ застывших солевых плавов на содер'
жание хлорида гольмия. Навеску отработанного расплава растворяли в дистиллиро'
ванной воде, полученный раствор титровали комплексонометрическим методом с ис'
пользованием индикатора арсеназо I. Разница между содержанием HoCl3 перед опы'
том и в застывшем солевом плаве составляла не более 1%, что значительно меньше
прочих погрешностей.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кислородсодержащие примеси влияют на результаты эксперимента, поэтому пред'
варительно снимались фоновые кривые. В эквимольном расплаве NaCl-KCl отсут'
ствовали пики (ХВА) и площадки с переходным временем (ХП), что говорит об отсут'
Электровосстановление хлорида гольмия в эквимольном расплаве NaCl-KCl
425
4
13
5
6
Вакуум
Аргон
3
3
7
2
8
9
10
1
11
12
Рис. 1. Экспериментальная ячейка. 1 - пробирка из оптического кварца; 2 - экраны молибденовые; 3 -
держатели молибденовые; 4 - термопара (хромель'алюмель); 5 - токоподводы молибденовые; 6 - пробка
из вакуумной резины; 7 - кварцевые трубки; 8 - электрод сравнения; 9 - рабочий электрод; 10 - вспомога'
тельный электрод; 11 - тигель; 12 - расплав; 13 - устройство для загрузки HoCl3.
ствии примесей в расплаве. При добавлении хлорида гольмия в эквимольный расплав
на ХП кривой появляется площадка, а на ХВА - пик. Типичные ХП и ХВА кривые
представлены на рис. 2.
Для определения кинетических параметров необходимо знать природу замедлен'
ной стадии, чтобы обоснованно подойти к выбору расчетных формул. Оценка обрати'
мости проводилась по известным критериям [15].
В методе ХВА зависимость скорости развертки потенциала от тока пика - прямо
пропорциональная, следовательно, процесс не является квазиобратимым. Критерием
426
О. В. Чернова, С. В. Жуковин, Д. А. Кондратьев
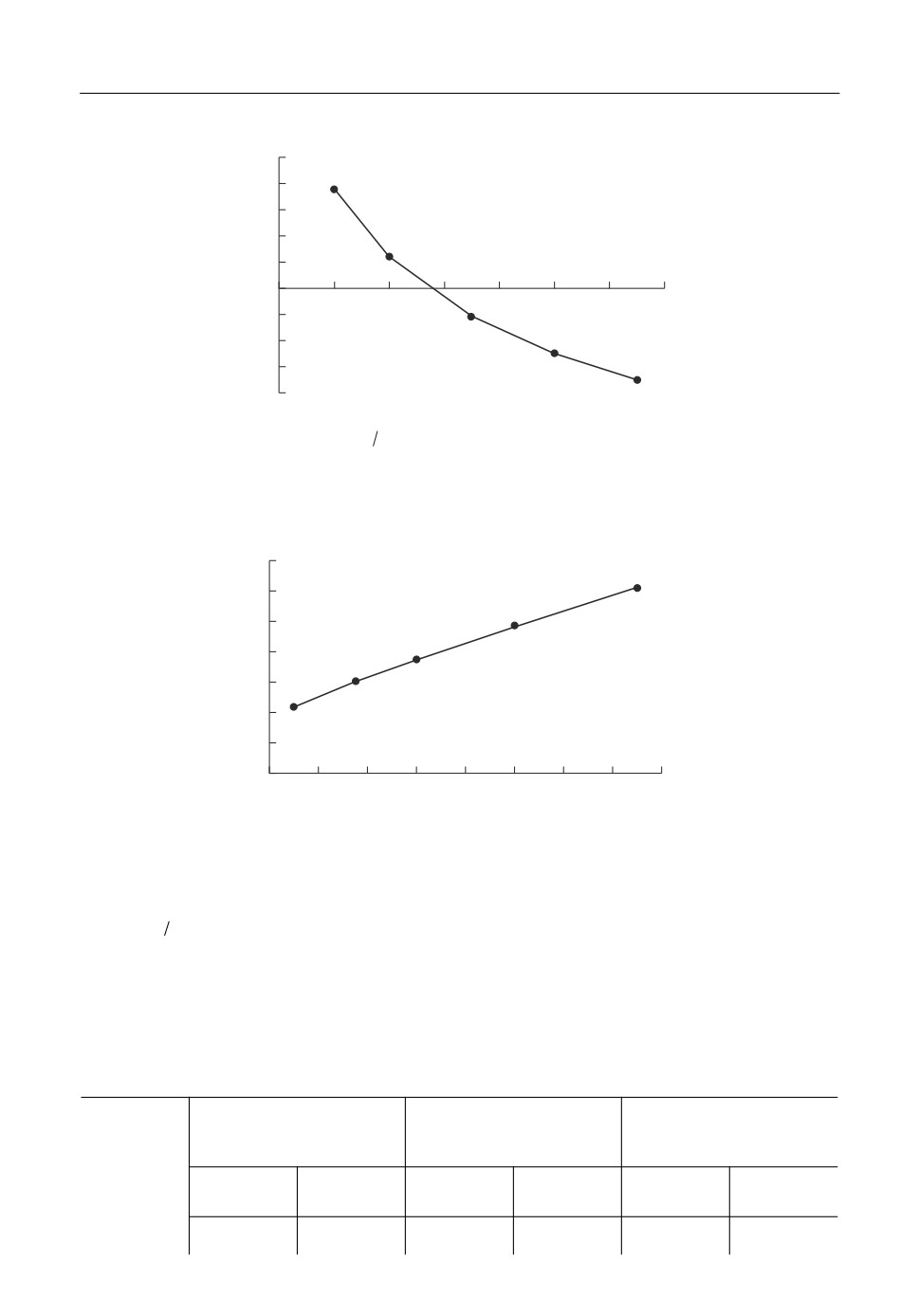
i, A/см2
а
0.40
6
5
0.35
4
3
0.30
2
0.25
1
0.20
0.15
0.10
0.05
0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
1.8
2.0
– E, В
E, В
1.4
б
1
2
3
4
5
6
1.2
1.0
0.8
0.6
0.4
0.2
0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
, с
Рис. 2. Типичные хроновольтамперометрические (скорость развертки 1 В/с (1-3) и 5 В/с (4-6)) и хронопо'
тенциометрические (плотность тока 1 А/см2) кривые. а - хроновольтамперометрические кривые: 1 - фоно'
вая кривая расплава NaCl-KCl; кривые расплава NaCl-KCl-HoCl3 с различной концентрацией HoCl3: 2 -
С = 1 мас. %, T = 1073 K; 3 - С = 10 мас. %, Т = 1173 К; 4 - С = 1 мас. %, Т = 1073 К; 5 - С = 5 мас. %, Т = 1123 К;
6 - С = 10 мас. %, Т = 1173 К; б - хронопотенциометрические кривые: 1 - фоновая кривая NaCl-KCl;
NaCl-KCl-HoCl3 с концентрацией HoCl3 (7 мас. %) с температурой: 2 - 1073; 3 - 1098; 4 - 1123; 5 - 1148;
6 - 1173 К.
обратимости является сравнение разности потенциала пика и полупика на ХВА'кри'
вой с величиной, рассчитанным по уравнению (1) для обратимого процесса:
RT
E
p 2
-
E
p
=
2.20
,
(1)
zF
где Eр - потенциал пика, В; Eр/2 - потенциал полупика, В; z - число электронов; R -
универсальная газовая постоянная; F - постоянная Фарадея.
В табл. 1 дано сравнение расчетных и экспериментальных величин Ep/2 - Ep при
скорости развертки υ = 5 В/с. Аналогичные значения получены для других условий
эксперимента.
Значительное различие экспериментальных и расчетных значений позволяет утвер'
ждать о необратимости процесса. На необратимость процесса указывает разность катод'
ного и анодного пиков в циклическом методе ХВА: Eк - Eа = 0.263 В при C = 5 мас. %,
T = 1123 K. В ХП методе наблюдается нелинейная зависимость (рис. 3) в координатах
Электровосстановление хлорида гольмия в эквимольном расплаве NaCl-KCl
427
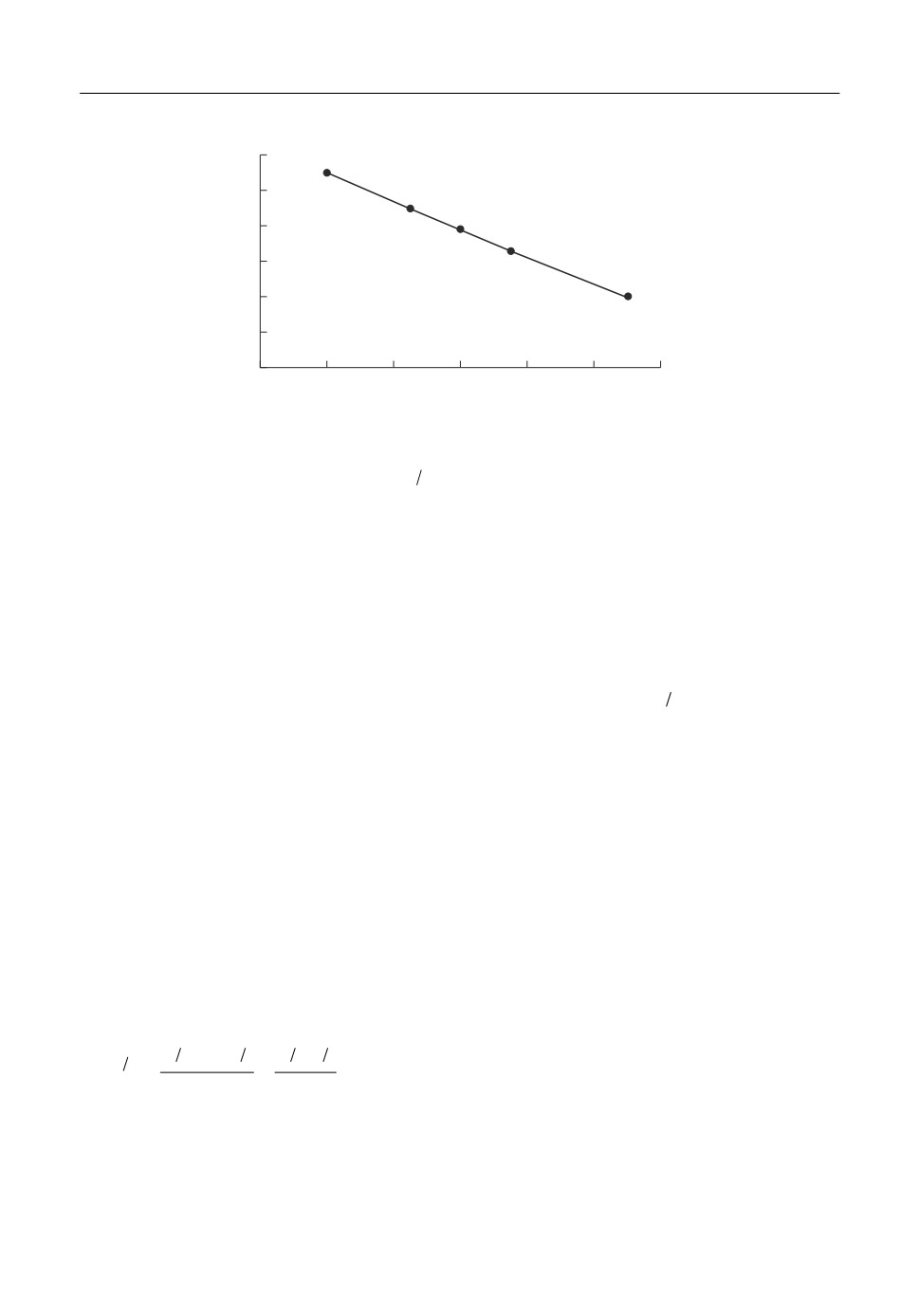
ln(τ01/2 - τ1/2)/τ1/2
1.0
0.8
0.6
0.4
0.2
0
0.7
0.72
0.74
0.76
0.78
0.80
0.82
0.84
0.2
- E, В
0.4
0.6
0.8
12
Рис. 3. Зависимость ln(τ
- τ1/2)/τ1/2 от ΔЕ, при С = 3 мас. %, Т = 1173 К.
0
ln(1 - ( /τ0)1/2)
1.4
1.2
1.0
0.8
0.6
0.4
0.2
0
0.7
0.72
0.74
0.76
0.78
0.80
0.82
0.84
0.86
- E, В
Рис. 4. Зависимость ln(1 - (τ/τ0)1/2) от ΔЕ при С = 3 мас. %, Т = 1173 К.
ΔE - ln(
- τ1/2)/τ1/2, и линейная зависимость (рис. 4) в координатах ΔE - ln(1 - (τ/τ0)1/2)
τ12
0
(τ0 - переходное время, τ - текущее время), что также указывает на необратимость
процесса.
Таблица 1
Экспериментальные и расчетные значения Ep/2 - Ep, В
С = 1 мас. %
С = 5 мас. %
С = 10 мас. %
Т = 1073 К
Т = 1123 К
Т = 1173 К
3−
HoCl
6
теор.
эксп.
теор.
эксп.
теор.
эксп.
0.20
0.46
0.21
0.46
0.22
0.47
428
О. В. Чернова, С. В. Жуковин, Д. А. Кондратьев
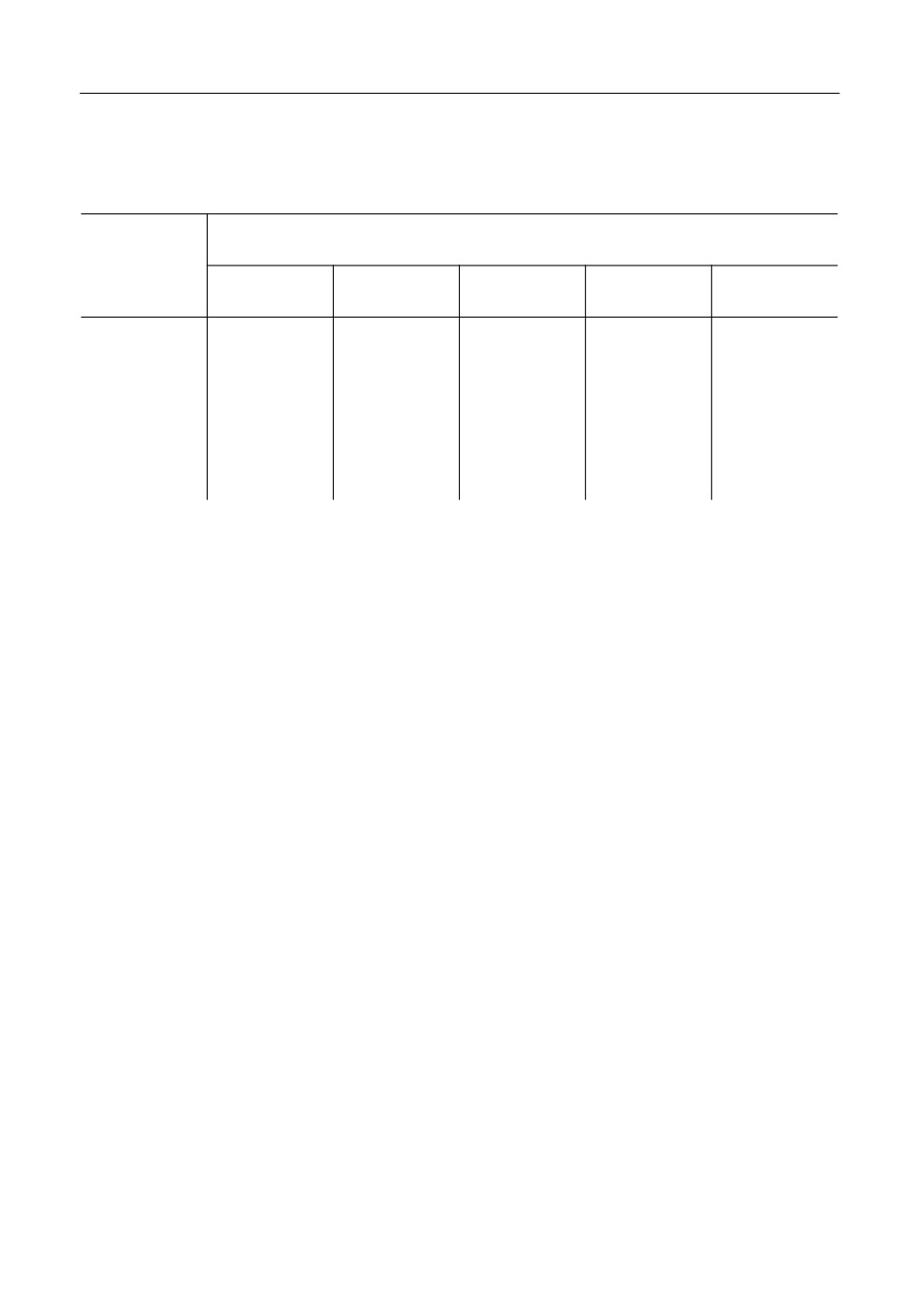
iτ01/2, A · c1/2/см2
6
5
4
3
2
1
0
0.02
0.04
0.06
0.08
0.10
0.12
i, A/см2
Рис. 5. Зависимостьiτ 2 от i при С = 3 мас. %, Т = 1123 К.10
По результатам ХП и ХВА измерений можно сделать вывод: процесс перезаряда
ионов гольмия в эквимольном расплаве NaCl-KCl необратим во всем изученном диа'
пазоне температур 1073-1173 К и концентраций хлорида гольмия 1-10 мас. %, скоро'
стей развертки потенциала от 0.2 до 20 В/с (ХВА), плотностей тока 0.01-1.20 А/см2 и
переходного времени 0.01-1.5 с (ХП). Полученный вывод о необратимости перезаря'
да хлорида гольмия в хлоридном расплаве согласуется с работой [16].
Для хлорида неодима в ХП методе наблюдается уменьшение
с ростом плотно'
i
τ120
сти тока i (рис. 5), что в соответствии с работой [17] указывает на осложнение элек'
тродного процесса кинетическим током - предшествующей химической реакцией.
Так как РЗМ в хлоридных расплавах существуют преимущественно в виде комплек'
сов, и кинетический ток, согласно [18], обычно связан с реакцией диссоциации ком'
плексов, то предшествующей стадией электродного процесса, по нашему мнению, яв'
3-
ляется процесс диссоциации комплексного иона
HoCl
6
по уравнению (2):
3-
-
-
HoCl
6
=
HoCl
4
+
2Cl
(2)
С использованием расчетных значений коэффициентов диффузии работы [19] бы'
ла определена константа скорости химической реакции по уравнению (3) для случая с
предшествующей химической реакцией метода ХП.
12
12
12
12
12
π
zFCD
π
D
iτ
o
=
-
i,
(3)
2
2k
где k - константа скорости химической реакции, D - коэффициент диффузии.
Значения константы скорости химической реакции в зависимости от концентра'
ции и температуры представлены в табл. 2.
Поскольку значения k
1, следует, что химическая реакция протекает медленно и
это значительно осложняет процесс восстановления гольмия из хлоридного расплава.
Электровосстановление хлорида гольмия в эквимольном расплаве NaCl-KCl
429
Таблица 2
Значения k · 103
Концентрация HoCl3, мас. %
Т, К
1
3
5
7
10
1073
3.65
3.50
2.46
1.02
0.94
1098
3.71
3.72
2.53
1.12
1.02
1123
3.74
3.75
2.58
2.31
1.76
1148
3.92
3.82
2.84
2.34
1.95
1173
4.01
4.01
3.03
2.56
2.05
Таблица 3
Значения αz
Концентрация HoCl3, мас. %
Т, К
1
3
5
7
10
1073
0.58
0.54
0.50
0.48
0.44
1098
0.63
0.60
0.56
0.54
0.49
1123
0.64
0.61
0.59
0.55
0.55
1148
0.65
0.62
0.59
0.58
0.57
1173
0.68
0.63
0.62
0.62
0.60
0
Значения αz и
(гетерогенная константа скорости переноса заряда) рассчитаны
k
fh
по уравнению (4) [14], представлены в табл. 3 и 4.
0
RT
RT
k
fh
RT
E
P
=-1.14
+
ln
-
ln
αzV,
(4)
12
αzF
αzF
D
2αzF
где α - коэффициент переноса.
Полученные значения αz < 1, свидетельствуют, что электровосстановление HoCl6
стадийно. Первой стадией является присоединение одного электрона по схеме:
−
2-
HoCl
+ e
→
HoCl
Одноэлектронный процесс восстановления РЗМ показан в рабо'
4
4 .
тах [9, 12, 21]. В данной работе на ХП кривых обнаружена одна площадка с переход'
ным временем, а на ХВА кривых - лишь один ток пика. Возможно, вторая стадия
430
О. В. Чернова, С. В. Жуковин, Д. А. Кондратьев
Таблица 4
0
Значения
k
fh
· 103, см/c
Концентрация HoCl3, мас. %
Т, К
1
3
5
7
10
1073
0.71
0.23
0.15
0.11
0.11
1098
0.79
0.24
0.17
0.13
0.12
1123
0.84
0.24
0.20
0.14
0.12
1148
0.87
0.27
0.23
0.19
0.13
1173
0.94
0.29
0.25
0.19
0.16
2-
электровосстановления
до гольмия протекает совместно с выделение натрия и
HoCl
4
калия. Известно, что РЗМ в хлоридных расплавах существуют в виде комплексных
3−
2−
группировок с координационными числами 6 и 4 [12], существование
LnCl
и
LnCl
6
4
подтверждено в исследованиях [20, 21]. На основании результатов, полученных в дан'
ной работе об осложнении процесса восстановления гольмия химической реакцией,
3-
предполагаем, что предшествующей реакцией является диссоциация
до
6
HoCl
-
4.
HoCl
Полученные экспериментальные значения по константам скорости химической и
электрохимической реакции, коэффициентам переноса согласуются со значениями,
приведенными в литературе [22-24] для расплавов солей.
ЗАКЛЮЧЕНИЕ
Согласно литературным источникам и анализу ХП'кривых, процесс восстановле'
ния хлоридных комплексов может быть осложнен предшествующей химической реак'
цией - диссоциацией комплекса. Определены значения кинетических параметров пе'
резаряда ионов гольмия из эквимольного расплава NaCl-KCl.
По результатам проведенных исследований электровосстановления трихлорида
гольмия в эквимольном расплаве NaCl-KCl на молибденовом электроде в изученном
интервале температур и концентраций описывается схемой:
3−
-
-
−
2−
HoCl
6
=
HoCl
4
+
2Cl
,
HoCl
4
+
e
→
HoCl
4
СПИСОК ЛИТЕРАТУРЫ
1. К о р о в и н С . С . Редкие и рассеянные элементы. Химия и технология. Кн. 2. М.: МИСИС,
1996.
2. П е т р о в И . М . , Н а у м о в А . В . Современное состояние мирового рынка редкозе'
мельных металлов и российские перспективы на этом рынке // Цветная металлургия. 2012.
№ 2. С. 61-71.
3. Ку з н е ц о в С . А . Электрохимия редкоземельных, редких металлов в солевых распла'
вах и синтез новых соединений и материалов функционального назначения на их основе //
Электровосстановление хлорида гольмия в эквимольном расплаве NaCl-KCl
431
Тезисы докладов ХIV Всероссийской конференции по физической химии и электрохимии
ионных расплавов и твердых электролитов. Т. 1. Екатеринбург: ИВТЭ УрО РАН, 2007. С. 110.
4. А ж а ж а В . М . , Б о р ц Б . В . , В а н ж а А . В . , Р ы б а л ь ч е н к о Н . Д . ,
Шевякова Э.П. Возможности применения редкоземельных элементов при создании
конструкционных материалов для атомной промышленности Украины // Вопросы атомной
науки и техники. Сер. Вакуум, чистые материалы, сверхпроводники. 2008. № 1. С. 195-201.
5. Н и к и н и н С . А . Магнитные свойства редкоземельных металлов и их сплавов. М.:
МГУ, 1989.
6. Ку ш х о в Х . Б . , Ч у к с и н С . И . , Ж а н и к а е в а З . А . Электровосстановление
ионов неодима и празеодима в эквимольном KCl-NaCl и эвтектическом KCl-NaCl-CsCl рас'
плавах на вольфрамовом электроде // Расплавы. 2013. № 3. С. 87-96.
7. C a strillejo Y., B erm ejo M .R ., A rocas P.D ., M artinez A .M ., B arrado E .
Electro'chemical behavior of praseodymium(III) in molten chlorides // J. Electroanalytical Chemis'
try. 2005. 575. № 1. P. 61-74.
8. Н о в о с е л о в а А . В . , С м о л е н с к и й В . В . Электрохимические и термодинамиче'
ские свойства лантанидов (Nd, Sm, Eu, Tm, Yb) в расплавленных хлоридах щелочных метал'
лов // Радиохимия. 2013. 55. № 3. С. 193-204.
9. U e h a r a A . , F u k a s a w a K . , N a g a i T. , F u j i i T. , Ya m a n a H . Separation of
Nd metal by using disproportionation reaction of Nd(II) in molten chloride // J. of Nuclear Materials.
2011. 414. № 2. P. 336-339.
10. С м и р н о в М . В . , Ч е б о т и н В . Н . Активность ионов в расплавленных солях //
Труды института электрохимии УФАН СССР. 1970. № 16. С. 3-16.
11 А с т а х о в а И . С . , Го р ю ш к и н В . Ф . Периодичность в изменении кристаллогра'
фических свойств дихлоридов лантаноидов // Журн. неорганической химии. 1992. 37. № 4.
С. 707-714.
12. С м и р н о в М . В . Электродные потенциалы в расплавленных хлоридах. М.: Наука,
1973.
13. П о л я к о в Е . Г. , С т а н г р и т П . Т. Методические особенности электрохимическо'
го исследования галогенидных расплавов, содержащих редкие элементы // Расплавы. 1993.
№ 2. С. 17-27.
14. Р е в з и н Г. Е . Безводные хлориды редкоземельных элементов и скандия // Методы
получения химических реактивов и препаратов: сборник. М.: ИРЕА, 1967. № 16. С. 124-129.
15. Га л ю с З . Теоретические основы электрохимического анализа. М.: Мир, 1974.
16. Ш к о л ь н и к о в С . Н . , То л ы п и н Е . С . , З а т я ц к и й Б . Э . Исследование меха'
низма разряда ионов лантана и иттрия на твердом катоде в расплавленных хлоридах // При'
кладная химия. 1982. № 2. С. 319-322.
17. З а х а р о в М . С . , Б а к а н о в В . И . , П н е в В . В . Хронопотенциометрия. М.:
Мир, 1978.
18. В о л к о в С . В . , Гр и щ е н к о В . Ф . , Д е л и м а р с к и й Ю . К . Координационная
химия солевых расплавов. Киев: Наукова думка, 1977.
19. Х р а н и л о в Ю . П . , С а м о д е л к и н а О . В . , Жу к о в и н С . В . Определение ко'
эффициентов диффузии на основе редкоземельных металлов в эквимольном расплаве NaCl-KCl
хроновольтамперометрическим и хронопотенциометрическим методами. Деп. в ВИНИТИ
№ 475'В2004. 24.03.04. 52 с.
20. Б а я н о в А . П . , В н у ч к о в а Л . А . , С е р е б р е н н и к о в В . В . Состояние NdCl3 в
равновесии с металлом в эквимольной смеси хлоридов калия и лития // Известия вузов. Цвет'
ная металлургия. 1972. № 4. С. 77-84.
21. Б а я н о в А . П . , В н у ч к о в а Л . А . , Д е г т я р ь В . А . , С е р е б р е н н и к о в
В.В. Взаимодействие металлического празеодима с его трихлоридом в расплаве эквимоляр'
ной смеси хлоридов калия и лития // Известия вузов. Цветная металлургия. 1972. № 3. С. 115-
119.
22. Д е л и м а р с к и й Ю . К . Электрохимия ионных расплавов. М.: Металлургия, 1978.
23. Д е л и м а р с к и й Ю . К . Химия ионных расплавов. Киев: Наукова думка, 1980.
24. Б а р а б о ш к и н А . Н . Электрокристаллизация металлов из расплавленных солей. М.:
Наука, 1976.
432
О. В. Чернова, С. В. Жуковин, Д. А. Кондратьев
Electroreduction of Holmium Chloride in the Equimolar NaCl-KCl Melt
O. V. Chernova1, S. V. Zhykovin1, D. A. Kondratyev1
1Vyatka State University, Kirov, Russia
Rare'earth metals and their alloys are used in various fields of technology. This is due to
their many unique physical and chemical properties. To obtain coatings with rare'earth met'
als, information is needed on the kinetics of electrode processes with their participation in
molten salt media. These problems for rare'earth metals have not been sufficiently studied.
In this work we have determined the kinetic parameters (transport coefficients, heteroge'
neous constants of the charge transfer rate) of cathode reduction of holmium ion in the
equimolar NaCl-KCl melt by chronopotentiometry and chronovoltamperometry in tem'
perature range of 1073-1173 and containing 1-10 mas % HoCl3. The dependences of the
kinetic parameters on temperature and the rare'earth metal chloride concentration are pre'
sented. A mechanism is proposed for the reduction of the complex in the equimolar NaCl-
3-
−
−
2-
KCl melt:HoCl
=
HoCl
+ 2Cl-,
HoCl
+ e
→
HoCl
6
4
4
4 .
Keywords: chlorides of rare'earth metals, holmium trichloride, kinetic parameters, chro'
nopotentiometry and chronovoltamperometry
REFERENCES
1. Korovin S.S. Redkie i rasseyannye elementy. Khimiya i tekhnologiya. Kn. 2 [Rare and trace ele'
ments. Chemistry and technology. Vol. 2]. Moscow. MISIS Publ., 1996. (in Russian).
2. Petrov I.M., Naumov A.V. Sovremennoe sostoyanie Mirovogo rinka redkozemel’nih metallov I
Rosiikie perspektivi na etom rinke [Current state of the World market of rare'earth metals and Russian
prospects on this market] // Tsvetnaya metallurgiya. 2012. № 2. Р. 61-71. (in Russian).
3. Kuznetsov S.A. Elektrohimiya redkozemel’nih, redkih metallov v solevih rasplavah i sintez
novih soedinenii i materialov funktsional’nogo naznacheniya na ih osnove [Electrochemistry of rare'
earth and rare metals in molten salts and synthesis of new species and materials on their basis for func'
tional use] // XIV Conf. on Physical Chemistry and Electrochemistry of Ion Melts and Solid Electro'
lytes, Yekaterinburg, IHTE UBO RAS. 2007. P. 110 (in Russian).
4. Azhazha V.M., Borts B.V., Vanzha A.V., Rybal’chenko N.D., Shevyakova E.P. [Possibility of the
use of rear'earth elements for development of structural materials for nuclear industry of Ukraine] //
Voprosy atomnoy nauki i tekhniki. 2008. № 1. Р. 195-201. (in Russian).
5. Nikinin S.A. [Magnetic properties of rare earth metals and their alloys]. Moscow. MGU, 1989.
(in Russian).
6. Kushkhov Kh.B., Chuksin S.I., Zhanikaeva Z.A. [Electroreduction of neodymium and
praseodymium ions in equimolar KCl-NaCl and eutectic KCl-NaCl-CsCl melt on the tungsten
electrode] // Rasplavy. 2013. № 3. Р. 87-96. (in Russian).
7. Castrillejo Y., Bermejo M.R., Arocas P.D, Martinez A.M., Barrado E. Electrochemical behavior
of praseodymium(III) in molten chlorides // J. of Electroanalytical Chemistry. 2005. 575. № 1. Р. 61-74.
8. Novoselova A.V., Smolenskii V.V. [Electrochemical and thermodynamic properties of lan'
thanides (Nd, Sm, Eu, Tm, Yb) in alkali metal chloride melts] // Radiochemistry. 2013. 55. № 3.
Р. 243-256. (in Russian).
9. Uehara A., Fukasawa K., Nagai T., Fujii T., Yamana H. Separation of Nd metal by using dispro'
portionation reaction of Nd (II) in molten chloride // J. of Nuclear Materials. 2011. 414. № 2.
Р. 336-339.
10. Smirnov M.V., Chebotin V.N. [Ion activity in molten salts] // Trudy instituta elektrokhimii
UFAN SSSR. 1970. № 16. P. 3-16. (in Russian).
11. Astakhova I.S., Goryushkin V.F. [Periodicity in change of crystallographic properties of lan'
thanide bichlorides] // Zh. neorganicheskoy khimii. 1992. 37. № 4. P. 707-714. (in Russian).
12. Smirnov M.V. Elektrodnye potentsialy v rasplavlennykh khloridakh [Electrolytic potential in
molted chlorides]. Moscow. Nauka Publ., 1973.
13. Polyakov E.G., Stangrit P.T. [Methodical specifics of electrochemical research on halogenide
melts with rare elements] // Rasplavy. 1993. № 2. Р. 17-27. (in Russian).
Электровосстановление хлорида гольмия в эквимольном расплаве NaCl-KCl
433
14. Revzin G.E. [Anhydrous chlorides of rare'earth elements and scandium] // Methods for the
production of chemical reagents and preparations: a collection. M.: IREA. 1967. 16. P. 124-129.
(in Russian).
15. Galyus Z. Teoreticheskie osnovy elektrokhimicheskogo analiza [Theoretical fundamentals of
electrochemical analysis]. Moscow, Mir Publ., 1974. (in Russian).
16. Shkolnikov S.N., Tolypin E.S., Zatyatsky B.E. Study of the mechanism of discharge of lantha'
num and yttrium ions on a solid cathode in molten chlorides] // Prikladnaya khimiya. 1982. № 2.
P. 319-322. (in Russian).
17. Zakharov M.S., Bakanov V.I., Pnev V.V. Khronopotentsiometriya [Chronopotentiometry].
Moscow, Mir Publ., 1978. (in Russian).
18. Volkov S.V., Grishchenko V.F., Delimarskiy Yu.K. Koordinatsionnaya khimiya solevykh ras'
plavov [Coordination chemistry of molten salts]. Kiev, Naukova dumka Publ., 1977. (in Russian).
19. Khranilov Yu.P., Samodelkina O.V., Zhukovin S.V. [Evaluation of diffusion coefficient based
on rare'earth metals in equimolar melt of NaCl-KCl using chronovoltammetric and chronopotentio'
metric methods] // Dep. v VINITI. 2004. № 475'V2004. 52 p. (in Russian).
20. Bayanov A.P., Vnuchkova L.A., Serebrennikov V.V. [NdCl3 equilibrium state with metal in
equimolar blender of potassium and lithium chlorides] // Izvestiya vuzov. Tsvetnaya metallurgiya.
1972. № 4. Р. 77-84. (in Russian).
21. Bayanov A.P., Vnuchkova L.A., Degtyar’ V.A., Serebrennikov V.V. [Interaction of metal
praseodymium with its trichloride in melted equimolar blender of potassium and lithium chlorides] //
Izvestiya vuzov. Tsvetnaya metallurgiya. 1972. № 3. P. 115-119. (in Russian).
22. Delimarskiy Yu.K. Elektrokhimiya ionnykh rasplavov [Electrochemistry of ion melts]. Mos'
cow, Metallurgiya Publ., 1978. (in Russian).
23. Delimarskiy Yu.K. Khimiya ionnykh rasplavov [Chemistry of ion melts]. Kiev, Naukova dumka
Publ., 1980. (in Russian).
24. Baraboshkin A.N. Elektrokristallizatsiya metallov iz ras from molten salts]. Moscow, Nauka
Publ., 1976. (in Russian).