РАСПЛАВЫ
5 · 2019
УДК 621.744.079
ВЗАИМОДЕЙСТВИЕ ПРОТИВОПРИГАРНОГО КОРУНДОВОГО ПОКРЫТИЯ
С ЖЕЛЕЗОУГЛЕРОДИСТЫМИ РАСПЛАВАМИ В УСЛОВИЯХ ЛИТЬЯ
ПО ГАЗИФИЦИРУЕМЫМ МОДЕЛЯМ
© 2019 г. П. Г. Овчаренкоa, *, Е. В. Кузьминыхa, В. И. Ладьяновa
aУдмуртский Федеральный исследовательский центр УрО РАН, Ижевск, Россия
*e(mail: ovcpg@yandex.ru
Поступила в редакцию 04.10.2018 г.
После доработки 17.01.2019 г.
Принята к публикации 26.01.2019 г.
В работе представлены результаты термодинамических расчетов взаимодействия
железоуглеродистых расплавов с противопригарным покрытием на основе корунда
при температурах сталеплавильных процессов (1600-1700°С) с учетом особенностей
технологии литья по газифицируемым моделям (ЛГМ). В качестве объектов иссле
дования выбраны расплавы сталей Ст10, У8 и серого чугуна СЧ15 с содержанием
кислорода и алюминия [O] = 0.001, [Al] = 0.02% соответственно. При оценке взаи
модействия корунда с железоуглеродистыми расплавами рассматривали процессы
растворения покрытия в металле, его восстановление компонентами расплава (угле
род, кремний) и взаимодействие с растворенным кислородом. В результате расчётов
определена граничная концентрация алюминия [Al] в расплаве, выше которой воз
можно растворение и восстановление корунда. Показано, что при высокой окислен
ности расплава ([O] > 0.05% при 1600°С) возможен переход кислорода в виде FeO из
металла в противопригарный слой с образованием герцинита и жидких шлаков си
стемы FeO-Al2O3. В процессе изготовления отливок методом ЛГМ модели из пено
полистирола (литейные формы) подвергаются деструкции от тепловой энергии рас
плава, вследствие чего образуется парогазовая фаза, отводящаяся через поры проти
вопригарного покрытия в опорный материал. Для оценки влияния данной
составляющей на противопригарное покрытие рассмотрены реакции взаимодей
ствия корунда с компонентами парогазовой среды.
Ключевые слова: противопригарное покрытие, корунд, железоуглеродистые распла
вы, термодинамические расчеты, литье по газифицируемым моделям.
DOI: 10.1134/S0235010619050074
ВВЕДЕНИЕ
В металлургической промышленности, и в частности, литейном производстве, про
тивопригарные покрытия (ПП) нашли широкое применение в качестве защитных об
лицовок, препятствующих воздействию жидкого сплава на литейные формы и узлы
плавильных и разливочных агрегатов, контактирующих с расплавом.
Состав ПП представляет собой смесь порошкообразного огнеупорного наполните
ля (обычно на основе оксидов кремния, алюминия, магния, циркония) с клеевым свя
зующим (растворы жидкого стекла, поливинилового спирта и др.) [1]. Данные покры
тия непосредственно контактируют с расплавом при формообразовании отливок, ис
пытывая на себе термическое воздействие. Высокая температура процесса может
привести непосредственно к химическому взаимодействию с расплавом. Выбор огне
упорной составляющей ПП в зависимости от состава и температуры расплава позво
ляет предотвратить процессы их взаимодействия, что в свою очередь обеспечивает по
470
П. Г. Овчаренко, Е. В. Кузьминых, В. И. Ладьянов
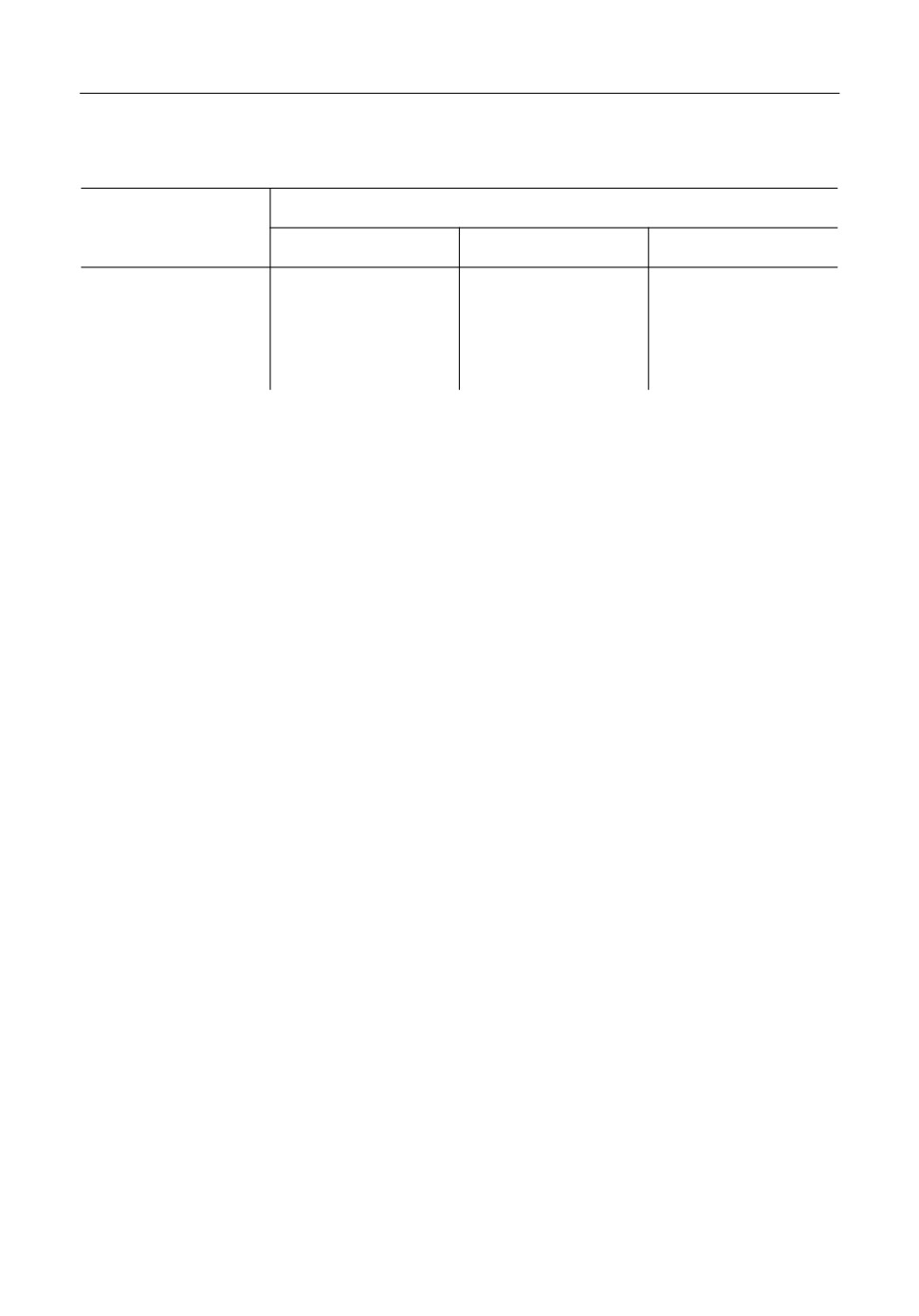
Таблица 1
Коэффициенты активности fi компонентов железоуглеродистых расплавов
Марка железоуглеродистого сплава
fi
сталь Ст10
сталь У8
чугун СЧ15
fО
0.688
0.333
0.020
fAl
1.01
1.16
1.73
fC
1.08
1.37
4.42
fSi
1.13
1.51
5.67
fMn
0.984
0.879
0.617
лучение качественных отливок, не содержащих поверхностных дефектов (пригар,
прижоги и др.).
Литье по газифицируемым моделям (ЛГМ), как технология формообразования от
ливок, заключается в применении разовых моделей из пенополистирола в качестве
литейных форм [2]. При ЛГМ модели подвергаются термодеструкции под действием
тепловой энергии заливаемого расплава, в результате чего образуются газообразные,
жидкие и твердые продукты: низшие углеводороды, оксид углерода (СО), азот, водо
род, сажистый углерод [3]. В литейной форме летучие продукты удаляются из зоны
взаимодействия модели и расплава, а процесс термодеструкции пенополистирола
протекает в небольшом зазоре между ними. Высокая температура процесса может
привести к участию продуктов термодеструкции модели в физико химических взаи
модействиях при формировании отливок.
В данной работе представлены результаты термодинамических расчетов процесса
взаимодействия ПП на основе корунда с железоуглеродистыми расплавами, имеющи
ми различное содержание углерода, с учетом активности взаимодействующих компо
нентов и особенностей технологии ЛГМ, с целью установления основных параметров,
определяющих защитные свойства корундсодержащих облицовок литейных форм.
МЕТОДИКА ПРОВЕДЕНИЯ РАСЧЕТОВ
В качестве объектов исследования рассматривали расплавы стали Ст10 (0.1% С,
0.4% Mn, 0.3% Si), стали У8 (0.8% С, 0.4% Mn, 0.3% Si) и серого чугуна СЧ15 (3.0% С,
0.4% Mn, 2.0% Si). Содержание кислорода и алюминия в расплаве принимали равны
ми [O] = 0.001%, [Al] = 0.02%, что соответствует хорошо раскисленному металлу. Рас
четы проводили для температур 1600 и 1700°С, в ряде случаев учитывали давление га
зовой фазы. Константы равновесия реакций взаимодействия ПП с металлическим
расплавом определяли методом комбинирования простых химических реакций. Ко
эффициенты активности данных элементов fi в металлическом расплаве вычисляли с
использованием массовых параметров взаимодействия 1 го и 2 го порядков [4]. Ре
зультаты вычислений fi приведены в табл. 1.
Согласно [2] состав (мас. %) парогазовой фазы образующейся при заливке моделей,
плотностью 25 кг/м3, железоуглеродистым расплавом с температурой 1550°С содер
жит: СО ~ 5%, CnHm ~ 13%, H2 ~ 3%, N2 ~ 7%, C ~ 72%. Термодинамическую вероят
ность взаимодействия корунда с парогазовой фазой оценивали по изменению стан
дартной свободной энергии ΔG° при 1600 и 1700°С для соответствующих реакций.
Стандартную свободную энергию равновесий, в которых участвуют четыре и более ве
ществ, вычисляли методом комбинирования стандартных реакций образования.
Взаимодействие противопригарного корундового покрытия
471
ВЗАИМОДЕЙСТВИЕ КОРУНДА С ЖЕЛЕЗОУГЛЕРОДИСТЫМ РАСПЛАВОМ
Взаимодействие покрытия с железоуглеродистым расплавом можно свести к двум
процессам - растворению Al2O3 в расплаве и к восстановлению его компонентами
расплава.
1. Растворение корунда в металлическом расплаве
Растворение корунда в расплаве протекает по схеме
Al
2
O
3(тв)
=
2
[
Al]+
3
[
O
]
(1)
Если бы исходный расплав представлял собой абсолютно чистое железо, то после
приведения его в контакт с корундом за счет растворения Al2O3 произошло бы увели
чение концентрации [Al] и [O] до установления равновесия, c отношением молярных
концентраций обоих компонентов в равновесном расплаве [Al]/[O] = 2/3. Если в та
кой расплав добавить алюминий и/или кислород, то реакция пойдет в обратном на
правлении - выделение оксида алюминия из расплава.
Константа равновесия реакции (1) равна [5]:
2
2
3
3
[
Al]
f
Al
[O]
f
O
63790
lg K
Al
O
=
lg
=-
+
20.586.
(2)
2
3
a
Al
O
T
2
3
Здесь [Al] и [O] - концентрации алюминия и кислорода в металлическом расплаве,
мас. %, fAl и fO - их коэффициенты активности,
a
Al
O
- активность корунда. Принимая
2
3
для оксидных фаз стандартное состояние “чистый твердый оксид”, имеем
a
Al
O
= 1.
2
3
Из уравнения (2) константы равновесия реакции (1) можно получить граничную
концентрацию алюминия в металле, ниже которой становится термодинамически
возможным растворение Al2O3 в расплаве металла:
1
⎛
K
⎞
2
−1
Al2O
3
[Al
]
=
f
Al
⎜
⎟
⎜
3
3
⎟
⎝
f
O
[O
]
⎠
Значение константы равновесия реакции (1) при 1600°С составляет 3.38 · 10-14, а
при 1700°С 1.80 · 10-12. Используя значение f (табл. 1) и задаваясь [O] = 0.001%, най
i
дем предельные концентрации алюминия (табл. 2). Из приведенных в табл. 2 данных
следует, что растворению ПП в расплаве способствует увеличение содержания углеро
да и повышение температуры, причем, при 1700°С пороговые значения концентрации
алюминия [Al] заметно превышают исходную концентрацию алюминия во всех исход
ных расплавах (0.02%), то есть появляются термодинамические условия для растворе
ния в них противопригарного покрытия. Для температуры 1600°С растворение корун
да может иметь место только в случае взаимодействия с расплавами с высоким содер
жанием углерода (У8 и СЧ15).
2. Восстановление корунда углеродом расплава
В предыдущем анализе учитывалось лишь косвенное, через активности влияние уг
лерода на растворение оксида алюминия в железоуглеродистом расплаве. Но углерод
может выступать и в качестве непосредственного восстановителя оксида алюминия по
реакции:
2
3
CO fAl[
]
(
)
Al
p
Al
2
O
3(тв)
+
3
[C]
=
2
[
Al
]+
3CO
(газ)
,
K
C,Al
=
,
(3)
3
(
f
C
[C])
472
П. Г. Овчаренко, Е. В. Кузьминых, В. И. Ладьянов
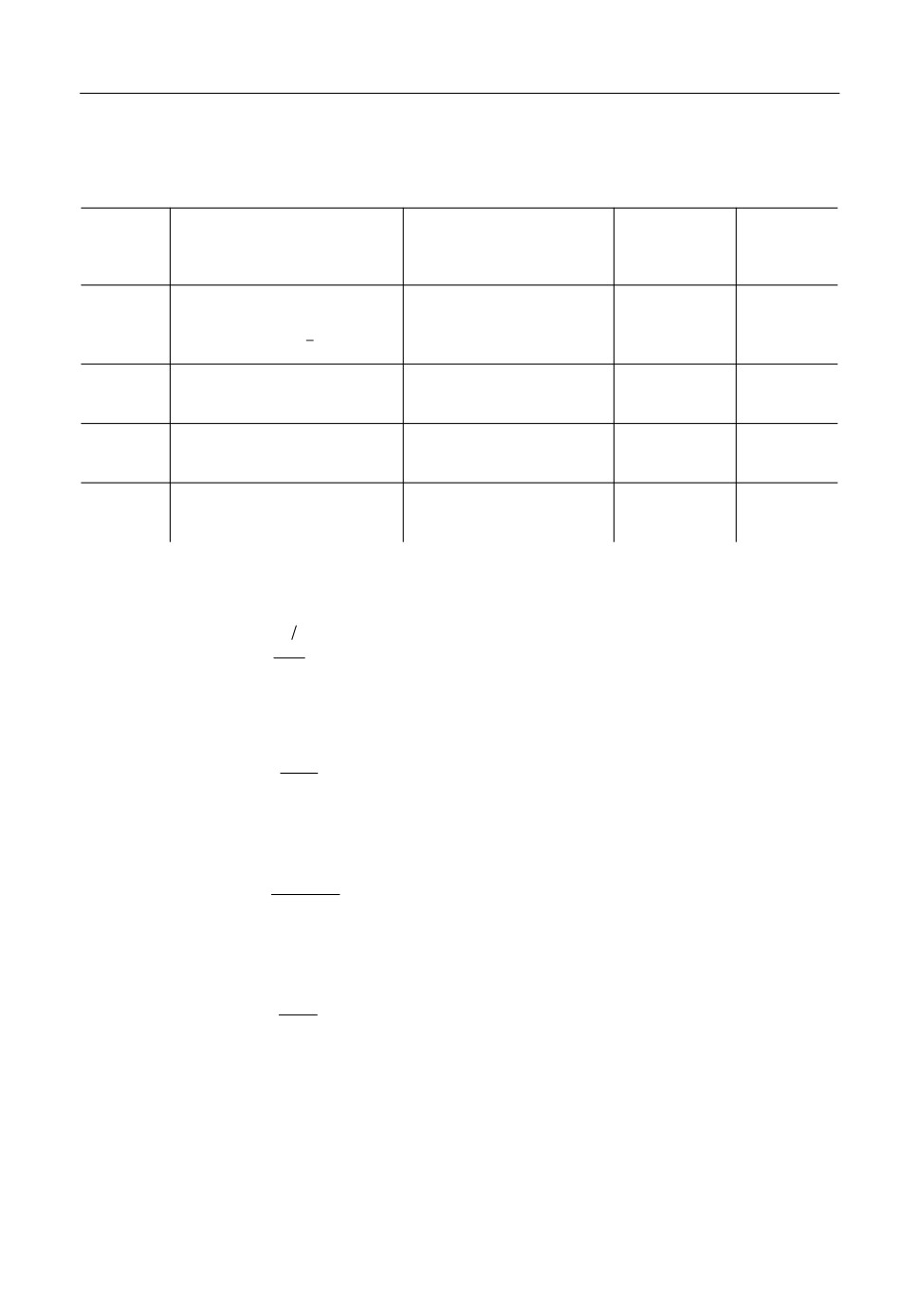
Таблица 2
Граничная концентрация алюминия [Al] в расплаве,
выше которой возможно растворение и восстановление корунда
Граничная концентрация алюминия [Al] в расплаве
Реакция
сталь 10
сталь У8
чугун СЧ15
0.010
0.026
1.09
(1)
0.074
0.191
8.50
−4
−3
2.06
⋅
10
5.71⋅10
0.12
(3) (
p
CO
= 0.05 МПа)
-3
−2
0.76
1.36
⋅
10
3.77
⋅10
−5
−3
7.18
⋅
10
1.96
⋅10
0.04
(3) (
p
CO
= 0.1 Мпа)
-4
−2
4.82
⋅
10
1.29
⋅10
0.30
−4
−4
−3
1.78
⋅
10
1.94
⋅10
1.35⋅10
(4)
-4
−4
−3
3.07
⋅
10
3.32
⋅10
2.31⋅10
−4
−4
−3
1.86
⋅
10
2.01
⋅10
1.51⋅10
(5)
-4
−4
−3
3.12
⋅
10
3.38
⋅10
2.53⋅10
−6
−6
−6
4.52
⋅
10
3.32
⋅10
1.31⋅10
(6)
-6
−6
−6
7.97
⋅
10
5.86
⋅10
2.31⋅10
В числителе приведены данные, рассчитанные для температуры 1600°С, в знаменателе - для 1700°С.
где
- парциальное давление оксида углерода СО в газовой атмосфере в зоне взаи
pCO
модействия.
Выражение для константы равновесия реакции (3) получим комбинированием
констант реакции окисления углерода
1043
[C]+[O
]=
CO
(газ)
, lg K
C,Al
=
+
2.140
[5]
T
и алюминия (1), в результате чего имеем:
60661
lg K
C,Al
=
3lg K
C
-
lg K
Al
=-
+
27.006.
T
При 1600°С - KAl,C = 4.16 · 10-6, а при 1700°С - KAl,C = 1.82 · 10-4.
Используя полученные данные, вычислим концентрацию алюминия [Al], способ
ную остановить реакцию (3) восстановления оксида алюминия углеродом:
3
−1
p
CO
[Al
]
=
f
Al
f
C
[
C
]
K
C,Al
Расчеты выполняли для
= 0.1 МПа и
= 0.05 МПа, соответствующего пони
pCO
pCO
женному общему давлению в литейной форме (табл. 2). Вероятность развития реак
ции восстановления оксида алюминия возрастает с увеличением содержания [C] в
расплаве, температуры и понижении давления оксида углерода
При 1700°С и по
pCO
Взаимодействие противопригарного корундового покрытия
473
ниженном давлении СО возможно протекание реакции (3), в силу того, что концентра
ция алюминия, находящегося в расплаве (0.02%) ниже, чем минимальная [Al], способ
ная остановить процесс восстановления. В случае расплава чугуна имеют место условия
для развития восстановления при всех исследованных температурах и давлениях.
Сравнивая равновесные концентрации [Al] (табл. 2), создаваемые реакциями (1) и
(3), можно видеть, что в исследованном интервале температур и давлений с термоди
намической точки зрения вероятность разрушения ПП за счет растворения Al2O3 вы
ше, чем за счет восстановления этого соединения углеродом расплава.
3. Восстановление корунда кремнием железоуглеродистого расплава
В состав рассматриваемых железоуглеродистых сплавов входит кремний, обладаю
щий сравнительно высоким сродством к кислороду. Реакция восстановления:
4
2
4
( f
[Al])
3
Al O
+[Si]
=
[Al]
+SiO
,
K
= Al
(4)
2
3
(
тв
)
2
(
тв
)
Al,Si
3
3
f
Si
[Si]
Константу равновесия реакции (4) вычислим комбинированием реакций растворе
ния оксида кремния
31100
SiO
2(тв)
=[Si]+
2[O], lg K
SiO
=-
+12.0
[5]
2
T
и алюминия (1):
2
11567
lg
K
Al,Si
=
lg
K
Al
O
-
lg
K
SiO
= -
+1.653.
2
3
2
3
T
Вычисленная при помощи приведенных выше данных граничная концентрация
алюминия (табл. 2)
3
⎛
f
[Si]⎞
4
-1
Si
[Al]
=
f
Al
⎜
⎟
,
⎝
K
Al,Si
⎠
свидетельствует об отсутствии восстановления корунда ПП кремнием железоуглеро
дистого расплава.
Условия для восстановления оксида алюминия кремнием могут стать более благо
приятными, если выделяющийся в результате реакции окисления кремний связывает
ся с избытком оксида алюминия в химическое соединение - муллит 3Al2O3 · 2SiO2:
2
4
Al
2
O
3(тв)
+[
Si]=
[
Al]+
SiO
2(тв)
,
2SiO
2(тв)
+
3
Al
2
O
3(тв)
=
3Al
2
O
3
⋅ 2SiO
2(тв)
3
3
Комбинируя последние уравнения получим:
3
13
8
(
f
[
Al
])
8
Al
2
O
3(тв)
+
2[
Si]
=
[Al]
+
3Al
2
O
3
⋅ 2SiO
2(тв)
,
K
Al,МУЛ
= Al
(5)
2
3
3
( f
[
Si
])
Si
Константу равновесия реакции (5) найдем, комбинируя реакцию растворения ко
рунда (1) и растворения муллита в железе:
255700
3Al
2
O
3
⋅
2
SiO
2(тв)
=
6
[Al
]+
2[Si
]+
13[O], lg K
МУЛ
=-
+
86.10, [5]
T
474
П. Г. Овчаренко, Е. В. Кузьминых, В. И. Ладьянов
в результате получим
13
21633
lg
K
=
lg
K
-
lg
K
= -
+
2.647.
Al,МУЛ
Al
2
O
3
МУЛ
3
T
Вычисление равновесной концентрации алюминия [Al] в расплаве, содержащей
кремний (табл. 2), проводили по формуле
3
−1
2
[Al]
= fAl
(
K
Al,МУЛ Si
( f
[Si])
)
8.
Сравнивая эти данные с предыдущим, видим, что, действительно, восстановление
оксида алюминия облегчается, однако равновесные концентрации [Al] по реакции (5)
настолько малы, что содержащийся в заливаемом расплаве алюминий (0.02%) спосо
бен предотвратить восстановление.
4. Восстановление корунда марганцем, растворенным в расплаве
Взаимодействие корунда с марганцем протекает по реакции
2
([Al]f
Al
)
Al
2
O
3(тв)
+
3[
Mn]
=
3MnO
(тв)
+
2[Al],
K
Al,Mn
=
(6)
3
f
(
)
Mn
Mn
[
]
Константу равновесия реакции (6) находим комбинированием реакций растворе
ния оксида марганца
15200
MnO
(тв)
=
[Mn] +
[O], lg K
MnO
=-
+
6.78
[5]
T
и алюминия (1):
18190
lg K
Al,Mn
=-
+
0.246.
T
Вычисленная граничная концентрация алюминия (табл. 2)
−1
3
[Al]
= fAl
K
Al,Mn
([Mn
]f
Mn
)
,
показывает на отсутствие взаимодействия корунда с марганцем, растворенным в рас
плаве.
5. Взаимодействие корунда с кислородом, растворенным в расплаве
Раствор кислорода в железе формально можно представить как раствор оксида же
леза FeO в железе. Если расплав Fe-[FeO] привести в соприкосновение с неметалли
ческой фазой, например, оксидом алюминия, то в силу закона распределения часть
[FeO] перейдет в эту фазу, образуя с ней раствор или химическое соединение. Этому
процессу соответствует реакция [FeO] = (FeO) с константой распределения:
a
(FeO)
K
(FeO)
=
a
[
FeO]
(круглыми скобками обозначен компонент, растворенный в неметаллической фазе).
В системе FeO-Al2O3 [6] существуют три однофазные области - узкая область α
Al2O3 (корунда) с незначительным (до 4% при 1600°С) содержанием FeO, железисто
алюминиевая шпинель FeO · Al2O3 (герцинит), содержащая около 59% FeO и область
богатых (>75% (FeO) при 1600°С) жидких шлаков. Эти же фазы могут находиться в
Взаимодействие противопригарного корундового покрытия
475
равновесии с расплавом стали, содержащим кислород и алюминий. Анализ равнове
сий в системе Fe-Al-O проще всего провести с помощью диаграммы раскисления же
леза алюминием [7]. Из диаграммы следует, что при 1600°С и содержании [O] = 5 · 10-2%
происходит преобразование фазы Al2O3 в герцинит FeO · Al2O3. Этой концентрации
кислорода в металле соответствует [Al] = 2.4 · 10-5%. При дальнейшем увеличении со
держания кислорода ([O] > 0.16%, [Al] < 2.4 · 10-6%) вместо FeO · Al2O3 образуются
жидкие шлаки FeO-Al2O3 переменного состава. В такой же последовательности про
исходит смена равновесных с расплавом Fe-О-Al фаз и при 1700°С, но окисленность
металла оказывается еще выше (0.19%). Таким образом, преобразование оксида алю
миния в богатые FeO фазы требует очень большой окисленности металла и возможно
только при значительном поступлении в металл кислорода извне. При такой окислен
ности из металла должны практически полностью выгореть не только алюминий, но и
кремний и, в значительной мере, углерод и марганец. Согласно данным [8] при
=
pCO
= 0.1 МПа произведение [C] · [O] равно 2 · 10-3 при 1600°С и 2.18 · 10-3 при 1700°С. От
сюда следует, что если [О] = 0.05%, то равновесное с ним содержание углерода при
1600°С будет равно 0.04%, а при переходе к жидким шлакам содержание [C] должно
составить 0.013%. Более детально процессы взаимодействия в системе Al2O3-Fe2O3-
FeO рассмотрены в работе [9].
Переход FeO в противопригарный слой имеет значительные практические послед
ствия. Металл, контактирующий с оксидной фазой, богатой FeO, имеет низкие значе
ния межфазного натяжения на границе с этой фазой и высокую адгезию к ней: при
увеличении (FeO) от 0.1 до 95%, межфазное натяжение уменьшается с 1260 до
180 мДж/м2 [6]. Это может привести к прочному прилипанию противопригарного по
крытия к поверхности отливки. Более того, повышение окисленности металла вызы
вает сильное увеличение смачиваемости им оксидной фазы. Чистое железо практиче
ски не смачивает оксид алюминия (угол смачивания составляет 141° [10]), но при уве
личении содержания кислорода в металле смачиваемость резко возрастает - при
[O] > 0.07% угол смачивания уменьшается до значений меньше 90° [10], что дает воз
можность самопроизвольного впитывания металлического расплава в поры противо
пригарного слоя даже без помощи гидростатического давления столба металла [10].
Этот процесс может вызывать появление дефекта поверхности отливок (пригара) -
появление прочного оксидного слоя, пропитанного металлом и железистым шлаком
[11]. Вероятность образования пригара возрастает с увеличением окисленности ме
талла и температуры, что, в частности, связано с расширением области существования
жидких шлаков, а также уменьшения вязкости жидких фаз, ускорения диффузии ком
понентов и общей интенсификации процессов взаимодействия.
ВЗАИМОДЕЙСТВИЕ КОРУНДА С ПРОДУКТАМИ ДЕСТРУКЦИИ
ЛИТЕЙНЫХ ФОРМ (МОДЕЛЕЙ ИЗ ПЕНОПОЛИСТИРОЛА)
1. Взаимодействие корунда с газовой фазой
В табл. 3 представлены реакции взаимодействия корунда с основными компонента
ми газовой среды (азотом, водородом и метаном), образующейся при заливке моделей
металлическими расплавами. Во всех рассмотренных реакциях изменение стандарт
ной свободной энергии является положительной величиной, что указывает на невоз
можность их протекания в стандартных условиях, когда парциальные давления всех
газообразных компонентов равны 1.013 · 105 Па (1 атм). В реальных условиях парци
альные давления заметно отличаются от стандартных [2], что может несколько изме
нить значение ΔG°. В этом случае выражения для ΔGT примут вид:
476
П. Г. Овчаренко, Е. В. Кузьминых, В. И. Ладьянов
Таблица 3
Изменение стандартной свободной энергии реакций взаимодействия
в системе противопригарное покрытие - продукты деструкции модели
Температурная зависимость
ΔG°
,
ΔG°
,
№ реакции
Реакция взаимодействия
1873
K
1973
K
ΔGT,Дж/моль
кДж/моль
кДж/моль
Al
2
O
3
(
тв
)
+
N
2(газ)
=
(7)
1033344
−
102.33T
841.68
831.45
3
=
2
AlN
(
тв
)
+
O2(
газ)
2
Al
2
O
3
(
тв
)
+
3H2
(
газ
)
=
(8)
949564
−
162.79T
644.65
628.38
=
2Al
(
ж
)
+3H
2
O
(
газ
)
Al
2
O
3
(
тв
)
+
CH4
(
газ
)
=
(9)
1167904
−
410.21T
399.58
358.56
=
2Al
(
ж
)
+
CO
(
газ
)
+
2H
2
O
(
газ
)
2Al
2
O
3
(
тв
)
+
3CH4
(газ
)
=
(10)
1911803
−
557.17T
868.22
812.51
=
Al
4
C
3
(
тв
)
+
6
H
2
O
(
газ
)
для реакции (7)
32
p
O
2
ΔG
=ΔG
°
+
RT
ln
,
(7)
T
T
pN2
для реакции (8)
p
H2O
ΔG
=ΔG
°
+
3
RT
ln
,
T
T
(8)
p
H
2
для реакции (9)
2
p
H2O CO
p
ΔG
=ΔG
°
+
RT
ln
,
(9)
T
T
pCH4
для реакции (10)
2
p
H2O
ΔG
=ΔG
°
+3
RT
ln
,
(10)
T
T
CH
p
4
где
- давление компонента i в газовой смеси.
p
i
Для вычислений по этим формулам необходимы данные о парциальных давлениях
кислорода и паров воды в парогазовой смеси, которые в литературе [2, 3] отсутствуют,
что делает невозможным уточнение ΔGT. Но учитывая, что сродство алюминия к кис
лороду значительно выше, чем к углероду и азоту, можно предположить, что взаимо
действие противопригарного покрытия на основе корунда с продуктами термоде
струкции пенополистирола в условиях изготовления отливок из сталей ЛГМ проте
кать не будет.
Взаимодействие противопригарного корундового покрытия
477
2. Взаимодействие корунда с твердым углеродом
Восстановление оксида алюминия противопригарного покрытия чистым углеро
дом до чистого алюминия протекает по реакции:
Al
2
O
3
(
тв
)
+3C
(
тв
)
=
2Al
(ж)
+3CO
(газ)
(11)
Комбинируя реакцию образования оксида углерода СО с реакцией образования ко
рунда получим для процесса (11):
°
Δ
= 1327000 - 576
, Дж моль.
G
T
T
В результате реакции (11) образуется газообразный продукт СО, то возможность ее
протекания будет зависеть от давления данного компонента в зоне реакции.
Поскольку:
ΔG
°
=-RT ln
K
= -3RT
ln
p
,
T
C,Al
CO
то
23085
lg p
CO
=-
+10.20.
T
Оценка граничной величины парциального давления оксида углерода СО, ниже ко
торой возможно протекание реакции восстановления оксида алюминия углеродом
показала, что условия для восстановления оксида алюминия углеродом улучшаются с
увеличением температуры, однако даже при 1700°С необходимое парциальное давле
ние СО настолько мало, что протекание реакции (11) в реальных условиях заливки не
-4
-3
возможно: при 1600°С
p
CO
=
4.95⋅10
МПа, при 1700°С
p
CO
=
2.09⋅10
МПа.
Рассмотрим возможность взаимодействия углерода с оксидом алюминия, когда вы
деляющийся алюминий соединяется с избытком углерода с образованием карбида
алюминия Al4C3:
2Al
2
O
3
(
тв
)
+
9C
(
тв
)
=
Al
4
C
3
(
тв
)
+
6CO
(
газ
)
(12)
Комбинированием реакции образования карбида алюминия и процесса (11) для реак
ции (12) получим:
ΔG
°
=
2396000
-1055
T
,
Дж моль.
T,
C
Переходя к выражению для
pCO
получим:
20841
lg p
CO
=-
+
9.177.
T
-
3
При 1700°С
p
CO
=
4.11
⋅
10
В реальных условиях заливки давление газовой фазы го
раздо больше 0.004 МПа и развитие реакции восстановления невозможно и в этом
случае.
ВЫВОДЫ
1. Растворению ПП на основе корунда в железоуглеродистом расплаве способству
ют увеличение содержания в нем углерода и температура. При принятых в расчетах
предпосылках термодинамические условия растворения оксида алюминия при 1600°С
имеет высокоуглеродистая сталь У8 и серый чугун СЧ15, а при 1700°С и низкоуглеро
дистая сталь Ст10. Остановить этот процесс можно увеличением концентрации алю
миния в расплаве выше вычисленных значений.
478
П. Г. Овчаренко, Е. В. Кузьминых, В. И. Ладьянов
2. Восстановление корунда углеродом стальных расплавов возможно только при
высоком содержании углерода (>0.8%), высокой температуре (1700°С) и пониженном
давлении газовой атмосферы. Восстановление корунда расплавом чугуна возможно
уже при 1600°С и нормальном давлении.
3. В разрушении ПП на основе корунда при температурах 1600-1700°С и давлении
0.1-0.01 МПа можно ожидать превалирование реакции растворения Al2O3 в расплаве
над восстановлением его углеродом расплава.
4. Восстановление корунда кремнием и марганцем расплава в области исследован
ных параметров плавки термодинамически невозможно.
5. При высокой окисленности расплава (содержание кислорода выше 0.05% при
1600°С) возможен переход кислорода из металла в виде FeO в противопригарный слой
с образованием герцинита и жидких шлаков системы FeO-Al2O3.
6. Взаимодействие противопригарного покрытия на основе корунда с продуктами
термодеструкции пенополистирола при заливке моделей железоуглеродистыми рас
плавами, согласно
соответствующих реакций, термодинамически невозможно.
°
ΔGT
7. Для борьбы с прилипанием ПП к поверхности отливок с образованием пригара
заливать формы следует хорошо раскисленным металлом, регулируя его окисленность
присадками раскислителей и не допускать его перегрева.
СПИСОК ЛИТЕРАТУРЫ
1. Е ф и м о в В . А . , А н и с о в и ч Г. А . , Б а б и ч В . Н . Специальные способы литья:
Справочник. М.: Машиностроение. 1991.
2. Ш у л я к В . С . Литье по газифицируемым моделям. СПб.: НПО Профессионал, 2007.
3. Состояние и перспективы применения литья по газифицируемым моделям / Строительное,
дорожное и коммунальное машиностроение. Обзорная информация. М.: ЦНИИТЭстроймаш,
1984.
4. Гр и г о р я н В . А . , С т о м а х и н А . Я . , П а н о м а р е н к о А . Г. Физико химиче
ские расчеты электросталеплавильных процессов: Учебное пособие для вузов. М.: Металлур
гия, 1989.
5. Ку л и к о в И . С . Раскисление металлов. М.: Металлургия. 1975.
6. Атлас шлаков: Справ. изд. Пер. с нем. М.: Металлургия, 1985.
7. М и х а й л о в Г. Г. , П о в о л о ц к и й Д . Я . Термодинамика раскисления стали. М.:
Металлургия, 1993.
8. Э л л и о т Д . Ф . , Гл е й з е р М . , Р а м а к р и ш н а В . Термохимия сталеплавильных
процессов: Справочник. М.: Металлургия, 1969.
9. D r e v a l L . , Z i e n e r i t T. , Fa b r i c h n ay a O . Calculated phase diagrams and thermo
dynamic properties of the Al2О3-Fe2O3-FeO system // J. Alloys and Compounds. 2016. 657. P. 192-
214.
10. П о п е л ь С . И . Поверхностные явления в расплавах. М.: Металлургия, 1994.
11. Ку н и н Л . Л . Поверхностные явления в металлах. М.: Металлургиздат, 1955.
Interaction of Corundum NonJStick Coating with IronJCarbon Melts
in the Conditions of Lost Form Casting
P. G. Ovcharenko1, E. V. Kuzminykh1, V. I. Ladyanov1
1Udmurt Federal Research Center of the Ural Branch of the RAS, Izhevsk, Russia
The thermodynamic calculations results of interaction of iron carbon melts with non
stick coating based on corundum at temperatures of steelmaking processes (1600-1700°C)
are presented. The melts of construction steel (steel 10), tool steel (U8) and grey cast iron
(SCh 15) with oxygen and aluminum content [O] = 0.001%, [Al] = 0.02% respectively have
been selected as objects of research. The processes of non stick coating dissolution in metal,
his deoxidation by melt components (carbon, silicon) and interaction with dissolved oxygen
Взаимодействие противопригарного корундового покрытия
479
were considered in assessing the interaction of corundum with iron carbon melts. As a re
sults of calculations boundary aluminum concentration [Al] in melt is determined. The dis
solution and deoxidation of corundum is possible above this aluminum concentration in
melt. Oxygen transfer in the form of FeO from metal in non stick coating with formation of
hercynite and liquid slags of the system FeO-Al2O3 is shown to be possible at high oxidation
of the melt ([O] > 0.05% at 1600°C). In the process of manufacturing castings by lost form
casting the models made of expanded polystyrene (casting molds) are destructed from melt
heat energy with separation gas vapor mixture (phase). The gas vapor mixture (phase) is led
in supporting material through the pores of non stick coating. To estimate the effect of this
component on non stick coating the reactions of corundum interaction with the compo
nents of the gas vapor medium are considered.
Keywords: non stick coating; corundum; iron carbon melts; thermodynamic calcula
tions, lost foam casting
REFERENCES
1. Efimov V.A., Anisovich G.A., Babich V.N. et al. Special Casting Methods. Ed. by V.A. Efimov.
Moscow, Mashinostroenie Publ., 1991. (in Russian).
2. Shulyak V.S. Lit’e po gazificiruemym modelyam [Lost foam casting]. St. Petersburg: NPO Pro
fessional Publ., 2008. (in Russian).
3. Sostoyanie i perspektivy primeneniya lit’ya po gazificiruemym modelyam / Stroitel’noe, dor
ozhnoe i kommunal’noe mashinostroenie. Obzornaya informaciya [State and prospects of casting on
consumable pattern application / Building, Highway, and Municipal Machine Engineering: Review
Information]. Moscow, TSNIITEstroimash Publ., 1984. (in Russian).
4. Grigoryan V.A., Stomahin A.Ya., Ponamorenko A.G., Belyanchikov L.N., Utochkin Yu.I., Ko
tel’nikov G.I., Ostrovskoj O.I. Fiziko himicheskie raschyoty electrostaleplavil’nyh processov [Physi
co chemical calculation of electric furnace steelmaking process]. Moscow: Metallurgiya Publ., 1989.
(in Russian).
5. Kulikov I.S. Raskislenie metallov [The killing of metals]. Moscow, Metallurgiya Publ., 1975.
(in Russian).
6. Russ. ed.: Atlas shlakov [Atlas of slags]. Moscow, Metallurgiya Publ., 1985. (in Russian).
7. Mihajlov G.G., Povolockij D.Ya. Termodinamika raskisleniya stali [Thermodynamics of steel
deoxidation]. Moscow, Metallurgiya Publ., 1993. (in Russian).
8. Elliott J.F., Gleiser M., Ramakrishna V. Thermochemistry for Steelmaking, Reading, Mass.,
Addison Wesley Publ. Co. 1969. (in Russian).
9. L. Dreval, T. Zienerit, O. Fabrichnaya. Calculated phase diagrams and thermodynamic proper
ties of the Al2О3-Fe2O3-FeO system // J. Alloys and Compounds. 2016. 657. P. 192-214.
10. Popel’ S.I. Poverhnostnye yavleniya v rasplavah [Surface phenomena in melts]. Moscow, Met
allurgiya Publ., 1994. (in Russian).
11. Kunin L.L. Poverhnostnye yavleniya v metallah [Surface phenomena in metals]. Moscow,
Metallurgizdat Publ., 1955. (in Russian).