РАСПЛАВЫ
5 · 2019
УДК 541.123.2.034.6 143
КОЭФФИЦИЕНТ АКТИВНОСТИ ЦЕЗИЯ В РАСПЛАВАХ Cs-CsF
© 2019 г.
a, В. М. Ивенкоa, *, Л. А. Циовкинаa
В. В. Чебыкин
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
*e mail: V. Ivenko@ihte.uran.ru
Поступила в редакцию 23.01.2019 г.
После доработки 13.02.2019 г.
Принята к публикации 06.03.2019 г.
Из тензиметрических данных (17 составов от 0.35 до 89.6 мол. % Cs) исследования
расплавов Cs-CsF рассчитаны коэффициенты активности цезия и получены ап%
проксимирующие уравнения для коэффициентов активности цезия в конкретных
опытах, а также общее уравнение, описывающее все экспериментальные точки. Об%
суждены условия проведения эксперимента и их влияние на погрешность получен%
ных экспериментальных данных.
Ключевые слова: расплавы, растворы, коэффициенты активности, цезий, фторид
цезия.
DOI: 10.1134/S0235010619050025
Определение термодинамических характеристик расплавов содержащих фториды и
легкоокисляемые, имеющие большие давления паров щелочные металлы, наталкива%
ется на ряд трудностей как в подборе конструкционных материалов, контактирующих
с данными средами, так и с методами исследования. Электрохимические методы при%
годны лишь для разбавленных растворов щелочных металлов, так как с повышением
концентрации щелочного металла в расплаве появляется электронная проводимость.
Нами использовался статический тензиметрический метод, описанной в работе [1].
Первичные экспериментальные данные по давлению насыщенных паров расплавов
Cs-CsF приведены в депонированной работе [2]. В ней кроме измеренного давления
и температуры, приведены количества загруженных компонентов, объемы газового
пространства над исследуемой смесью и разделительного элемента (сильфона). Тем%
пература сильфона также контролировалась и входила в последующие расчеты. Схема
расчета достаточно подробно описана в предыдущих работах [3, 4]. Здесь остановимся
лишь на основных моментах расчета и условиях экспериментов.
Материал установки, контактирующий с цезием и фторидом цезия, - сталь
12Х18Н9Т. В работе [2] рассмотрены коррозионные процессы стали и фторида цезия и
показано, что в изученном концентрационном интервале добавка цезия за счет корро%
зии меньше погрешности измерений. В работе описано приготовление исходных ком%
понентов и методы их загрузки в прибор. Фторид цезия марки х. ч. сушился под ваку%
умом с последующей очисткой зонной плавкой по методике описанной в работе [5], а
цезий особой чистоты (основная примесь калий, менее 0.01 мас. %) запаянный в ам%
пулы, вскрывался и перегонялся в прибор при давлении остаточных газов около 1 Па.
Конструкция прибора позволяла после эксперимента изменять концентрацию цезия,
либо отгонкой его части, не вскрывая прибор, либо заполняя прибор очищенным ар%
гоном, добавлением нового известного количества цезия в ампулах с последующей от%
качкой, герметизацией прибора аргонно%дуговой сваркой и добавлением в прибор це%
зий перегонкой. Все это позволяет снизить неконтролируемые контакты цезия и его
соли с окружающей средой.
Коэффициент активности цезия в расплавах Cs-CsF
503
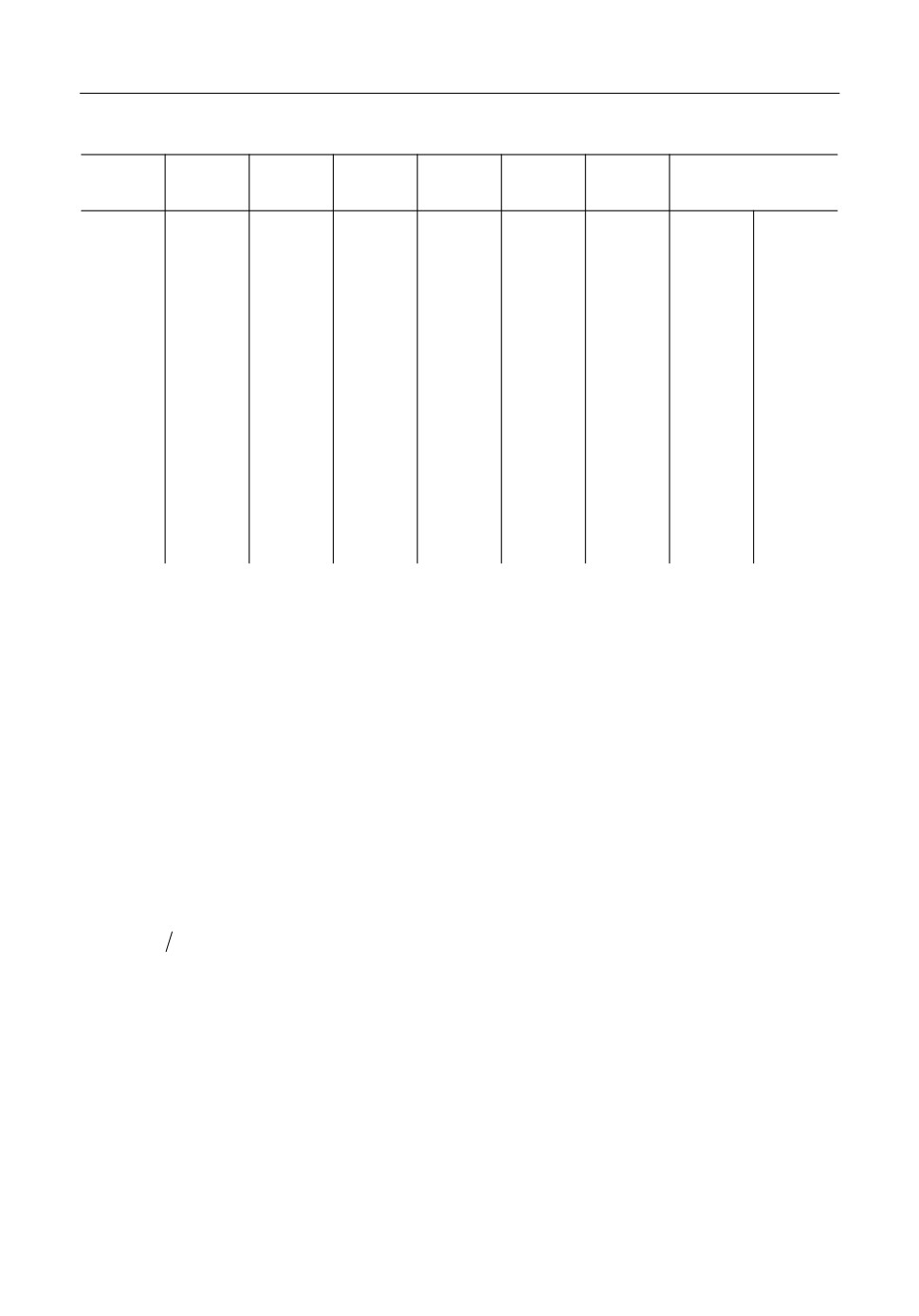
Таблица 1
n, кол%во
Опыт
NCs · 100
А
В
С
Δ
ΔT, K
точек
1
0.343
-2.30790
4847.46
-4.75820
0.0418
14
988
1277
2
0.55
-2.52920
5000.00
-6.39220
0.0345
12
993
1272
3
0.995
-2.47030
4801.50
-3.15620
0.0133
13
975
1278
4
1.34
-2.56564
4801.58
-3.06298
0.0222
14
978
1262
5
2.21
-2.39206
4446.24
-1.78599
0.0124
13
779
1248
6
3.40
-2.24876
4125.83
-1.68020
0.0359
11
979
1275
7
5.20
-1.72940
3425.50
0.55866
0.0095
9
975
1245
8
6.23
-1.93395
3468.40
-0.81930
0.0156
8
974
1282
9
8.37
-1.43644
2791.87
-0.70610
0.0055
11
968
1264
10
11.7
-1.15220
2247.05
-0.93420
0.0076
10
970
1228
11
19.2
-0.86523
1571.85
0.64290
0.0063
10
977
1228
12
21.5
-0.75941
1376.04
0.75913
0.0054
12
855
1232
13
28.8
-0.54147
934.040
-0.58810
0.0052
11
958
1251
14
59.1
-0.25132
325.620
0.45956
0.0067
11
928
1195
15
66.2
-0.24056
244.691
0.93939
0.0018
28
876
1216
16
80.0
-0.13860
146.700
1.14833
0.0122
34
815
1166
17
89.5
-0.19072
188.140
1.22096
0.0042
19
793
1155
Данный метод измерения позволяет достаточно точно определять общее давление в
приборе при определенной температуре расплава. Для определения термодинамиче%
ских характеристик цезия необходимо знание при конкретной температуре парциаль%
ного давления цезия и его концентрации в расплаве. Наличие газового пространства,
доступного парам исследуемой смеси, при сильной разницы давления паров индивиду%
альных цезия и фторида цезия приводит к большему содержанию в паровой фазе легко%
летучего цезия и некоторому изменению его концентрации в расплаве. Схема расчета
позволяет рассчитать концентрацию цезия при каждой измеряемой температуре с уче%
том его испарения. Общее давление складывалось из парциальных давлений цезия и
мономера и димера фторида цезия. Предполагалось отсутствие соединений в паре на
основе цезия и его солевого компонента. Все необходимые данные по давлению цезия и
его фторида рассчитывались с использованием справочника [6]. Из парциального дав%
ления пара цезия по этому же справочнику рассчитывалась фугитивность цезия при
каждой температуре и фугитивность цезия над индивидуальным цезием при данной
температуре. Коэффициент активности цезия в расплаве находили из выражения:
y
Cs
=
f (f
о
N
Cs
),
где yCs - коэффициент активности цезия, f - фугитивность цезия при его парциальном
давлении, fо - фугитивность цезия над индивидуальным цезием при данной темпера%
туре, NCs - мольная доля цезия. Как уже упоминалось, концентрация цезия в опыте не%
сколько отличалась от загруженной и принималась равной рассчитанной для температу%
ры 1000 К. Температура 1000 К соответствует, примерно, середине температурного ин%
тервала исследований. Вид аппроксимирующего уравнения для yCs:
B
⎛
T
0
T
0
⎞
lnγ
Cs
=
A
+
+
C
⎜1-
+
ln
⎟
±Δ
T
⎝
T
T
⎠
Коэффициенты уравнения, общая погрешность на доверительном уровне 0.95 с ис%
пользованием при расчете коэффициента Стьюдента, число экспериментальных то%
чек и интервал температуры исследования в однофазной области приведены в табл. 1.
Т0 равно 1000 К.
504
В. В. Чебыкин, В. М. Ивенко, Л. А. Циовкина
ln yCs
%
3.0
NCs = 0.34
NCs = 0.55
2.5
NCs = 1.0
NCs = 1.34
2.0
NCs = 2.2
NCs =3.4
NCs= 5.2
1.5
NCs = 6.2
= 8.4
NCs
1.0
NCs = 11.7
NCs = 19.2
0.5
NCs = 21.5
NCs = 28.8
0
NCs = 59.1
NCs = 66.2
Линейный
0.5
0.00075
0.00080
0.00085
0.00090
0.00095
0.00100
0.00105
1/T
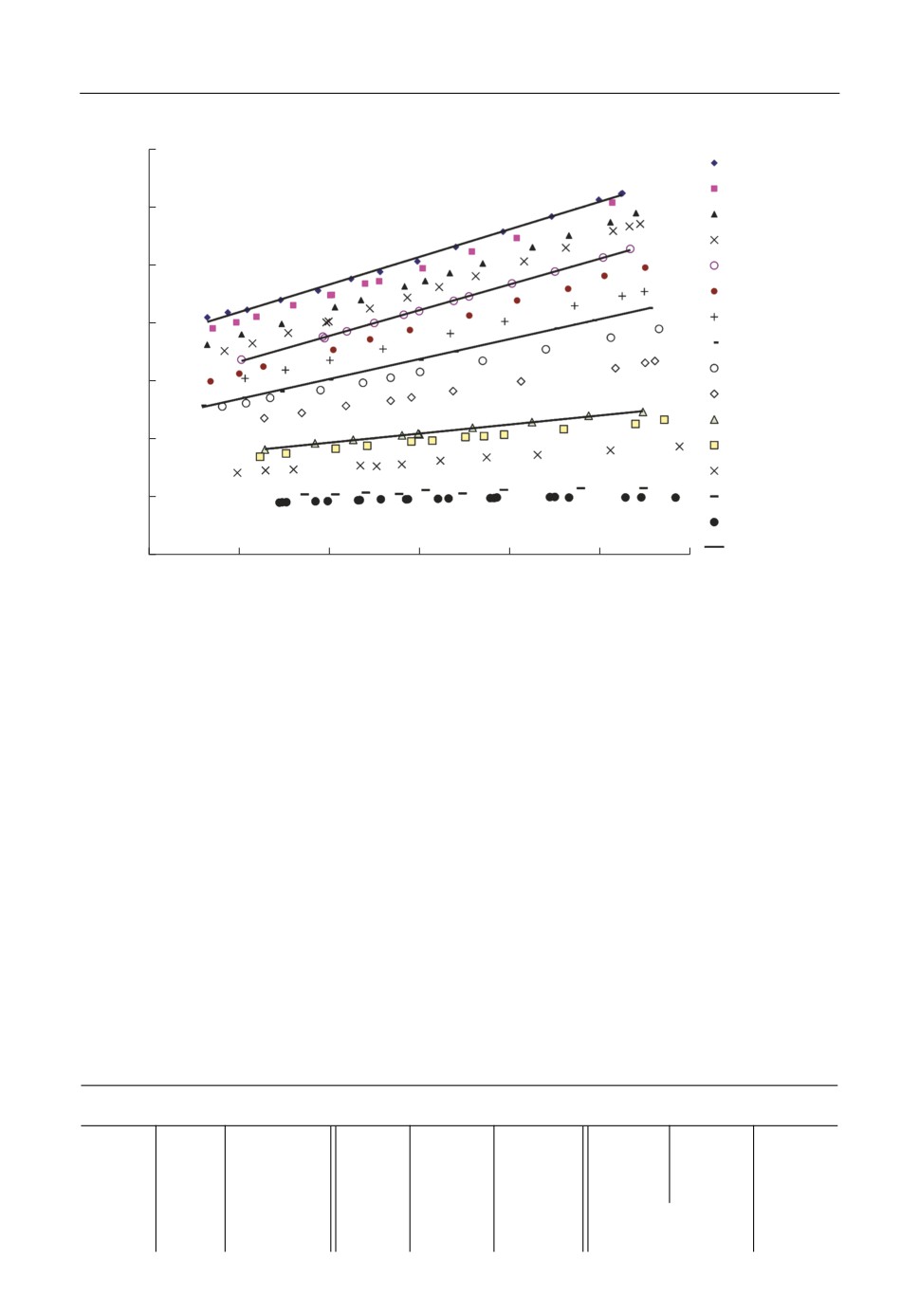
Рис. 1. Зависимость коэффициента активности цезия от температуры для расплавов Cs-CsF.
На рис. 1 показана температурная зависимость для экспериментальных данных
lnyCs от 1/Т. Видно, что lnyCs в этих координатах линейно убывает с ростом температу%
ры и коэффициент активности цезия с увеличением концентрации щелочного метал%
ла уменьшается и после 50 мол. % цезия практически равен 1.
Все экспериментальные данные можно достаточно точно описать общим уравне%
нием с 13 параметрами.
n
1
n
2
i
n
3
⎡
⎤
2
i
N
Cs
i
⎛
T
0
T
0
⎞
ln
γ
Cs
=
(1−
N
Cs
)
⎢
∑
a
i
N
Cs
+
∑
b
i
+
∑
c
i
N
Cs
⎜1-
+
ln
⎟⎥
±Δ
⎣
T
⎝
T
T
⎠⎦
i=
0
i=
0
i=
0
Коэффициенты общего уравнения, общая погрешность на доверительном уровне
0.95 с использованием при расчете коэффициента Стьюдента, и число эксперимен%
тальных точек приведено в табл. 2.
На рис. 2 показана концентрационная зависимость коэффициента активности це%
зия для температуры 1100 К при конкретных опытах и рассчитанных по общему урав%
Таблица 2
Параметры уравнения
1
a0
-2.47499
6
b0
5056.08
11
c0
-5.11047
2
a1
2.38721
7
b1
-22019.1
12
c1
36.6955
3
a2
52.0998
8
b2
47631.9
13
c2
-149.398
4
a3
-200.842
9
b3
-22450.8
Δ =
0.0130
5
a4
214.283
10
b4
-56300.4
число точек
242
Коэффициент активности цезия в расплавах Cs-CsF
505
yCs
9
8
7
Эксп.
6
Общ. ур.
5
4
3
2
1
0
10
20
30
40
50
60
70
80
90
100
NCs, мол. %
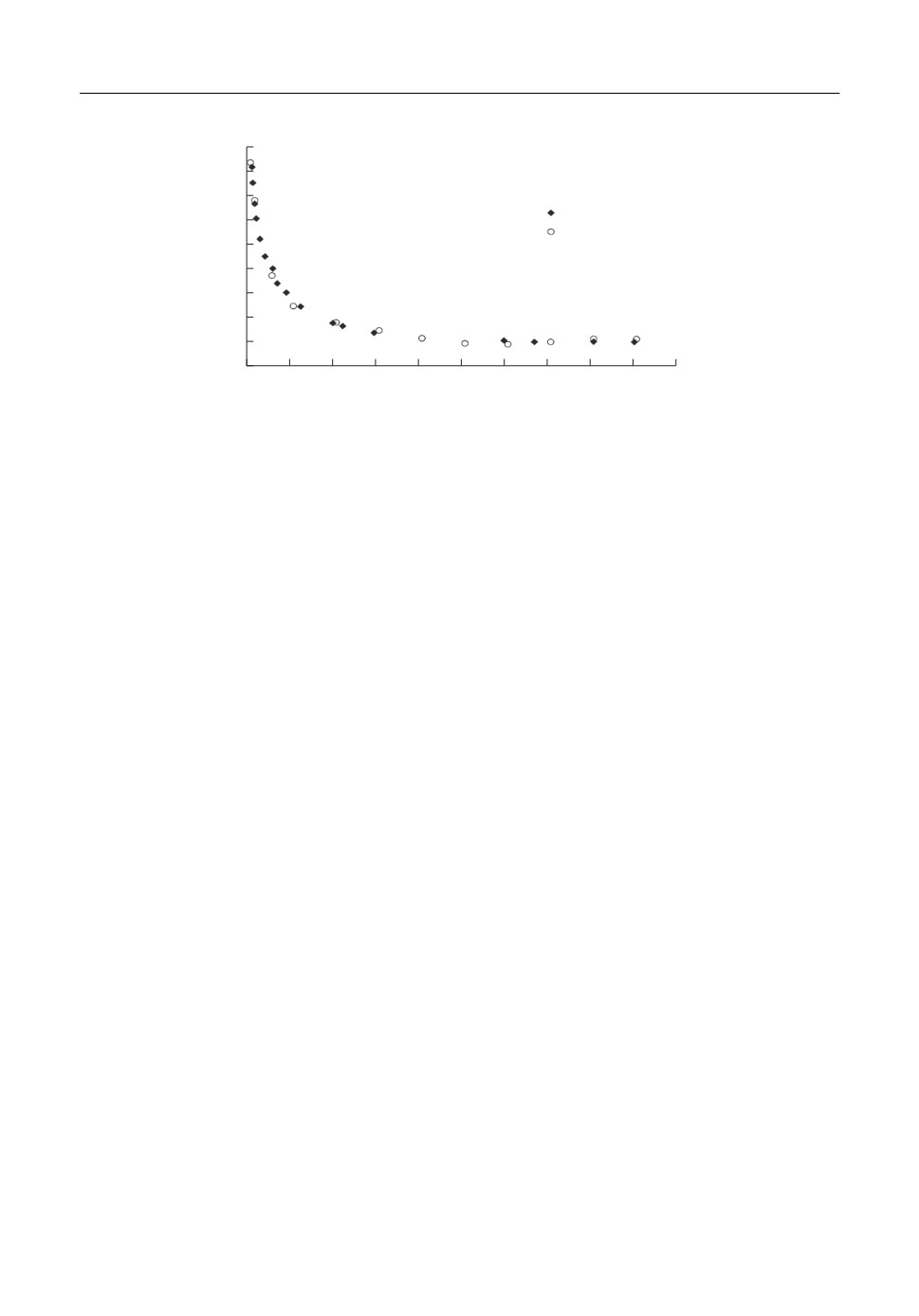
Рис. 2. Изменение коэффициента активности цезия от состава при температуре 1100 К для расплавов Cs-CsF.
нению. Видно, что коэффициент активности цезия максимален при небольших кон%
центрациях щелочного металла и резко убывает с ростом его концентрации. После
40-50 мол. % цезия его коэффициент активности практически равен 1.
Величины коэффициента активности цезия меньше чем у других щелочных металлов,
в частности у калия и натрия [7, 8], однако вид зависимости от концентрации и темпе%
ратуры схож. Известно также, что цезиевые металло%солевые смеси не имеют выра%
женного купола расслоения [9] однако коэффициенты активности цезия больше 1,
что может указывать на тенденцию к расслоению.
СПИСОК ЛИТЕРАТУРЫ
1. С м и р н о в М . В . , Ч е б ы к и н В . В . , Ц и о в к и н а Л . А . , К р а с н о в Ю . Н .
Прибор для измерения давления агрессивных высокотемпературных сред статическим мето%
дом // Журн. физ. химии. 1977. 51. № 7. С. 1848-1850.
2. Ч е б ы к и н В . В . , И в е н к о В . М . , Ц и о в к и н а Л . А . , С м и р н о в М . В . Экс%
периментальное исследование давления насыщенных паров растворов цезия в его расплав%
ленных галогенидах. I. Система Cs-CsF. Свердловск. 1987. Деп. в ВИНИТИ 12.01.1987.
№ 799%В87.
3. И в е н к о В . М . , Ч е б ы к и н В . В . , Ц и о в к и н а Л . А . Давление насыщенных
паров концентрированных растворов калия в хлориде, бромиде и иодиде калия // Распла%
вы. 1995. № 3. С. 44-46.
4. И в е н к о В . М . , Ц и о в к и н а Л . А . Коэффициент активности калия в его концен%
трированных растворах в расплавленных хлориде, бромиде и иодиде калия // Расплавы. 1998.
№ 5. С. 48-52.
5. Ш и ш к и н В . Ю . , М и т я е в В . С . Очистка галогенидов щелочных металлов мето%
дом зонной плавки // Изв. АН СССР. Неорган. Материалы. 1982. 18. № 11. С. 1917-1918.
6. Гл у ш к о В . П . Термодинамические свойства индивидуальных веществ: Справ, изд%е.
М.: Наука, 1978, 1982.
7. S m i r n o v M . V. , I ve n k o V. M . Saturation vapor pressure and thermodynamic properties
of potassium solutions in molten binary mixtures of its halides // Electrochimica Acta. 1990. 35. № 2.
P. 529-538.
8. S m i r n o v M . V. , C h e b y k i n V. V. , Ts i o v k i n a L . A . The thermodynamic properties
of sodium and potassium dissolved in their molten chlorides, bromides, and iodides // Electrochimica
Acta. 1981. 26. № 9. P. 1275-1288.
9. B r e d i g M . A . Mixtures of metals with molten salts. In Molten salts chemistry. New York ets.:
Interscience Publ. 1964. P. 367-425.
506
В. В. Чебыкин, В. М. Ивенко, Л. А. Циовкина
The Activity Coefficient of Cesium in the Melts of the Cs-CsF
V. V. Chebykin1, V. M. Ivenko1, L. A. Tsiovkina1
1Institute of High Temperature Electrochemistry, Ural Branch of the Russian Academy of Sciences,
Yekaterinburg, Russia
From tensimetric data (17 compositions from 0.35 to 89.6 mol % Cs) studies of Cs-CsF
melts approximating equations for the coefficients of cesium activity in specific experi%
ments, as well as a General equation describing all experimental points are obtained. The
conditions of the experiment and their influence on the error of the experimental data are
discussed.
Keywords: melts, solutions, activity coefficients, cesium, cesium fluoride
REFERENCES
1. Smirnov M.V., Chebykin V.V., Tsiovkina L.A., Krasnov YU.N. Pribor dlya izmereniya davleniya
agressivnykh vysokotemperaturnykh sred staticheskim metodom [A device for measuring the pressure
of aggressive high%temperature media by the static method] // Zhurnal fiz. Khimii. 1977. 51. № 7.
С. 1848-1850. (in Russian).
2. Chebykin V.V., Ivenko V.M., Tsiovkina L.A., Smirnov M.V. Eksperimental'noye issledovaniye
davleniya nasyshchennykh parov rastvorov tseziya v yego rasplavlennykh galogenidakh. I. Sistema Cs-
CsF [Experimental investigation of the pressure of saturated vapors of cesium solutions in its molten
halides. I. System Cs-CsF]. Sverdlovsk. 1987. Dep. v VINITI 12.01.1987. № 799%В87. (in Russian).
3. Ivenko V.M., Chebykin V.V., Tsiovkina L.A. Davleniye nasyshchennykh parov kontsentrirovan%
nykh rastvorov kaliya v khloride, bromide i iodide kaliya [Saturated vapor pressure of concentrated so%
lutions of potassium in chloride, bromide, and potassium iodide] // Rasplavy. 1995. № 3. С. 44-46.
(in Russian).
4. Ivenko V.M., Tsiovkina L.A. Koeffitsiyent aktivnosti kaliya v yego kontsentrirovannykh rastvora%
kh v rasplavlennykh khloride, bromide i iodide kaliya [The activity coefficient of potassium in its con%
centrated solutions in molten chloride, bromide and potassium iodide] // Rasplavy. 1998. № 5.
С. 48-52. (in Russian).
5. Shishkin V.Yu., Mityayev V.S. Ochistka galogenidov shchelochnykh metallov metodom zonnoy
plavki [Purification of alkali metal halides by zone melting] // Izv. AN SSSR. Neorgan. Materialy.
1982. 18. № 11. С. 1917-1918. (in Russian).
6. Glushko V.P. Termodinamicheskiye svoystva individual'nykh veshchestv: Sprav, izd%ye [Ther%
modynamic properties of individual substances: Reference book] M.: Nauka, 1978, 1982. (in Rus%
sian).
7. Smirnov M.V., Ivenko V.M. Saturation vapor pressure and thermodynamic properties of potassi%
um solutions in molten binary mixtures of its halides // Electrochimica Acta. 1990. 35. № 2. P. 529-
538.
8. Smirnov M.V., Chebykin V.V., Tsiovkina L.A. The thermodynamic properties of sodium and po%
tassium dissolved in their molten chlorides, bromides, and iodides // Electrochimica Acta. 1981. 26.
№ 9. P. 1275-1288.
9. Bredig M.A. Mixtures of metals with molten salts. In Molten salts chemistry. New York ets.: In%
terscience Publ. 1964. P. 367-425.