РАСПЛАВЫ
6 · 2019
УДК 544.3.01
МОДЕЛЬ ПОЛЯРИЗАЦИОННЫХ ВЗАИМОДЕЙСТВИЙ ИОНОВ
В РАСПЛАВАХ ГАЛОГЕНИДОВ ЦЕЗИЯ НА ОСНОВЕ
ТЕРМОДИНАМИЧЕСКОЙ ТЕОРИИ ВОЗМУЩЕНИЙ
© 2019 г. А. Г. Давыдовa, *, Е. В. Смолярчукb, Н. К. Ткачевa
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
bУральский федеральный университет им. Б.Н. Ельцина, Екатеринбург, Россия
*e-mail: A.Davydov@ihte.uran.ru
Поступила в редакцию 13.03.2019 г.
После доработки 25.03.2019 г.
Принята к публикации 16.04.2019 г.
Представлен метод учета поляризационных взаимодействий между ионами в
жидкосолевых расплавах посредством термодинамической теории возмущений на
базе модели многосортной смеси заряженных твердых сфер различающихся диамет%
ров. Основанием для использования такой модели сравнения являются наблюдения
за парциальными структурными факторами в жидких солях выше температуры
плавления. Учет поляризационных взаимодействий может быть реализован в рамках
термодинамической теории возмущений. В работе получены явные выражения для
дополнительного поляризационного терма в энергию солей. На этой основе рас%
смотрено влияние поляризационного вклада на термодинамические свойства и ха%
рактеристики плавления расплавов галогенидов цезия. Показано, что учет поляри%
зационных взаимодействий между ионами соли приводит к снижению температур
плавления и теплосодержания расплавов по сравнению с моделью заряженных твер%
дых сфер. Погрешность в определении температур плавления указанных солей без
подгонки параметров парного потенциала не превышает 3%. Учет поляризационно%
го вклада в свободную энергию приводит к более точному описанию энтальпий и
энтропий плавления.
Ключевые слова: поляризуемость, заряженные твердые сферы, термодинамическая
теория возмущений, среднесферическое приближение, галогениды щелочных ме%
таллов, температура плавления, энтальпия плавления, теплосодержание, фазовые
равновесия.
DOI: 10.1134/S0235010619060021
ВВЕДЕНИЕ
Интерес к галогенидным солям цезия в настоящее время обусловлен их широким
применением в различных сферах производства и химических наук [1-2]. К примеру,
хлорид цезия может применяться в качестве электролита в топливных элементах.
Фторид цезия является одним из лучших катализаторов для получения фторорганиче%
ских соединений и, также как хлорид цезия, материалом для электропроводящих сте%
кол. Бромид и иодид цезия обладают хорошей оптической прозрачностью в дальней
инфракрасной области спектра, что делает их незаменимыми материалами при изго%
товлении призм для ИК%спектрометрии. Помимо упомянутых областей применения
существует также множество более узких направлений использования галогенидных
солей цезия [3]. Кроме того, расплавы галогенидов цезия также являются компонен%
тами ядерного топлива в жидкосолевых реакторах [2-4].
Очевидно, что в вопросах, связанных с материаловедением и технологиями процес%
сов, первоочередными являются сведения о термодинамической стабильности соеди%
нений и границах существования фаз [5, 6]. Поэтому в последнее время все большее
514
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
внимание направлено на теоретические подходы к описанию и предсказанию термо%
динамических характеристик и фазовых равновесий в расплавленных солевых систе%
мах [7, 8].
Наиболее распространенным в этой области теоретических исследований является
метод термодинамического моделирования (CALPHAD, PANDAT и др.), который ос%
нован на использовании баз данных по термодинамическим свойствам и фазовым
равновесиям однокомпонентных и бинарных систем для построения моделей фазо%
вых равновесий в системах более сложного типа [9-12]. Суть этого метода сводится к
вычислению свободной энергии фаз из термодинамических данных по чистым ком%
понентам в системах низшего порядка (n%компонентных) и дальнейшей экстраполя%
ции на системы более высокого порядка (n + 1%компонентные). Большинство таких
методов основано на подходе, предложенном Ван Лааром еще в начале прошлого века
[13], т.е. на использовании моделей идеального и регулярного растворов. Однако при%
менение данного подхода в описании жидких фаз не имеет микроскопического обос%
нования. Например, остается открытым вопрос об ограничении радиуса взаимодей%
ствия второй координационной сферой, как это осуществлялось в работах Пельтона
[14, 15], что делает подход менее привлекательным с фундаментальной точки зрения.
Вообще возрастание числа подгоночных параметров является наиболее уязвимым ме%
стом методов типа CALPHAD.
Отметим также, что в последнее время с ростом вычислительных возможностей
стали все более плодотворно развиваться другие подходы к описанию межфазных гра%
ниц, связанные с методами ab initio и молекулярной динамики [16-20]. Однако и со%
временная статистическая теория, и указанный прогресс в области компьютерных
технологий до сих пор не были применены к статистико%термодинамическим расче%
там фазовых равновесий твердое-жидкое в солевых системах.
В рамках статистической теории данную задачу удобнее решать с помощью термо%
динамической теории возмущений (TPT) [21], учитывая более сложные (например,
поляризационные) взаимодействия на базе простых моделей (заряженных твердых
сфер и др.), имеющих аналитические решения. Наиболее успешно термодинамическая
теория возмущений была применена для описания структурных и термодинамических
характеристик чистых металлических систем и их бинарных сплавов. Более того, к на%
стоящему времени применение TPT%метода к металлическим расплавам достаточно хо%
рошо опробовано с использованием различных подходов термодинамической теории
возмущений. Например, в работах [22-24] были рассчитаны структурные факторы и
термодинамические свойства жидких металлов в рамках приближения случайных фаз
(“random phase approximation” - RPA) и оптимизированного RPA. В работе [25] для
расчета структурных факторов металлических расплавов был применен метод Уикса-
Чандлера-Андерсена (WCA). Также методом WCA были рассчитаны структурные
факторы бинарных сплавов K-Cs разного состава [26]. Другим успешным методом
TPT%подхода является вариационный метод, который заключается в варьировании
параметров парного потенциала для достижения минимума свободной энергии воз%
мущенной системы. Данный подход также нашел свое применение при описании тер%
модинамических и структурных характеристик жидких щелочных металлов [27-29].
Стоит отметить, что при построении таких моделей важной особенностью является
удачный выбор системы сравнения и учет наиболее значительных дополнительных
вкладов в энергию расплава. Для вычисления свойств жидких металлов в качестве си%
стем сравнения наиболее часто используют такие модели как твердые сферы, прямо%
угольная яма, мягкие сферы, заряженные твердые сферы в однородном нейтрализую%
щем фоне и др. Однако для солевых расплавов термодинамическая теория возмуще%
ний на основе модели заряженных твердых сфер вообще не была разработана. Цели
настоящей работы: во%первых, развить термодинамическую теорию возмущений для
солевых расплавов, позволяющую учитывать вклад поляризационных взаимодей%
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
515
ствий между ионами и, во%вторых, проанализировать влияние поляризационных эф%
фектов на термодинамические свойства и характеристики плавления галогенидных
расплавов цезия.
МОДЕЛЬ
Рассмотрим систему, состоящую из N = N1 + N2 свободных частиц, которая содер%
жит N1 катионов Cs+ с зарядом z1 = +1 и N2 анионов X- с зарядом z2 = -1 (где X- = F-,
Cl-, Br- и I-). Определим также мольные доли компонентов в такой смеси как xi =
Ni/N, и диаметры катиона и аниона как d1 и d2, соответственно. Основной вклад в сво%
бодную энергию рассматриваемой системы описывается в рамках модели многосорт%
ной смеси заряженных твердых сфер (“charged hard spheres” - CHS). Среднесфериче%
кое приближение (“mean spherical approximation” - MSA) для этого случая записыва%
ется следующим образом [30, 31]:
hs
⎧C R),
R
≤
d
ij
ij
⎪
C
(R)
2
(1)
ij
=⎨
z
z
e
i
j
⎪-
,
dij < R,
⎩
εRkBT
где kB - постоянная Больцмана, T - температура, zi - электровалентность частицы
i%го сорта, e - элементарный заряд, ε - диэлектрическая постоянная среды, Cij(R) -
прямая корреляционная функция, и dij = (di + dj)/2. Среднесферическая модель может
быть решена аналитически в общем виде [32] и поэтому активно используется в рабо%
тах по статистической теории растворов электролитов.
Однако, в отличие от других систем (например, металлических расплавов), в случае
описания энергии жидкосолевых электролитов необходимо также учитывать эффекты
взаимной поляризации ионов. Такой вид межчастичного взаимодействия имеет более
сложный характер, поскольку заряд данного иона индуцирует дипольные моменты на
соседних ионах, которые будут не только взаимодействовать друг с другом, но и в
свою очередь индуцировать дипольные моменты на других ионах. Однако энергия по%
ляризации для расплавленной соли в целом может быть рассчитана путем введения
диэлектрической проницаемости [33]. Отметим, что в рамках данной работы рассмат%
ривается только наиболее существенный тип поляризационных эффектов в солевых
расплавах, связанный с ион%дипольными взаимодействиями ионов. Поэтому, здесь и
далее по тексту под поляризационным вкладом в энергию расплава подразумевается
именно его ион%дипольная часть. При этом пренебрегается еще более слабыми ди%
поль%дипольными и диполь%квадрупольными типами межионных взаимодействий.
Затруднение таких расчетов заключается в отсутствии точных решений для слож%
ных моделей взаимодействия, например, при учете эффектов поляризации. Поэтому в
рамках статистической теории данную задачу удобнее решать с помощью термодина%
мической теории возмущений (“thermodynamic perturbation theory” - TPT) [34]. При
таком подходе более сложные взаимодействия стараются учесть на основе более про%
стых моделей (твердых сфер, заряженных твердых сфер и др.), имеющих аналитиче%
ские решения. Другими словами, TPT%подход может позволить рассмотреть более
слабые поляризационные взаимодействия ионов как возмущающую добавку к систе%
ме заряженных твердых сфер, которая в основном и определяет структуру расплава
[35]. В соответствие с этим свободную энергию можно представить в следующем виде:
∞
Pol
CHS
2
F
=
F
+2πρ
x
x
ϕ
(R)g
(R)R
dR,
(2)
liq
CHS
∑
i
j
∫
ij
ij
i, j
0
516
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
где Fliq - полная свободная энергия солевого расплава, FCHS - свободная энергия си%
CHS
стемы сравнения заряженных твердых сфер,
- парная функция распределения
(
)
ij
g
R
Pol
системы сравнения,
- возмущающая добавка в парный потенциал системы
ϕ
(
)
ij
R
сравнения за счет поляризационных взаимодействий, ρ = N/V - численная плотность.
Дальнейшее вычисление температур и термодинамических характеристик плавле%
ния в данной работе основано на стандартном правиле равенства химических потен%
l
циалов жидкости
µ
и твердого тела
µ
в точке фазового рав%
liq
=FViq,N Nl
sol
новесия [36]. В следующем разделе проводится более подробное рассмотрение вкла%
дов в свободные энергии жидкого и твердого состояний.
ТЕОРЕТИЧЕСКИЕ РАСЧЕТЫ
Запишем свободную энергию Гиббса жидкого расплава в виде суммы нескольких
вкладов в следующем виде:
G
liq
=
F
id
+
F
hs
+
F
msa
+U
pol
+
PV
=
F
0
+U
pol
+
PV
,
(3)
где Fid - вклад идеальной газовой смеси, Fhs - вклад твердосферных отталкиваний,
Fmsa - электростатический вклад в свободную энергию, рассматриваемый в работе в
рамках среднесферического приближения, Upol - возмущающая добавка в потенци%
альную энергию системы сравнения за счет поляризационных взаимодействий, P -
внешнее давление, V - объем системы. Перейдем теперь к рассмотрению отдельных
вкладов в свободную энергию жидкого расплава.
Идеальный вклад в свободную энергию имеет стандартный вид:
3
⎡
⎡
⎤⎤
x
i
x
j
2
⎛
2πm
m
k
T
⎞
⎢
⎢1
i
j
B
⎥⎥
F
id
=
Nk
B
T
∑
x
i
ln
x
i
-1-
ln
⎜
⎟
,
(4)
⎢
⎢
2
⎟
⎥⎥
h
⎢
i
⎢ρ⎜
⎠
⎥⎥
⎣
⎣
⎦⎦
где mi - молекулярная масса частицы i%го сорта, h - постоянная Планка.
Вклад твердосферных взаимодействий в свободную энергию учитывается в работе в
рамках интерполяционной схемы Мансури-Карнагана-Старлинга-Леланда (MCSL)
[37], основанной на решении Лебовитца системы уравнений Перкуса-Йевика для за%
дачи о многосортной смеси твердых сфер отличающихся диаметров:
⎡
3y
2
+
2y
3
3
-
3y
1
-
3
y
2
-
y
3
3
⎤
F
hs
=
Nk
B
T
+
-
(1
−
y
1
+
y
2
+
y
3
)
+
(y
3
−1)ln
Δ
,
(5)
⎢
2
⎥
⎣
Δ
2Δ
2
⎦
π
n
где
Δ=
1
-ξ3,
ξ
n
= ρ
A
n
,
A
n
=∑
x
di i
,
а коэффициенты yn для бинарной смеси опреде%
i
6
ляются как:
2
2
3
8x
x
d
λ
4
x
x
dd
λ
A
A
i
j ij
ij
i
j i
j
ij
2
2
y
1
=
,
y
2
=
,
y
3
=
,
(6)
2
2
A
A
A
3
3
3
где
d
ij
=(
d
i
+
d
j
) 2,
λ
ij
=(d
j
-
d
i
) 2.
Электростатический вклад найден в работе Блюма в рамках среднесферического
приближения для многосортной смеси заряженных твердых сфер произвольных диа%
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
517
метров и электровалентностей [32]. Выражение для свободной энергии в приближе%
нии MSA представим в виде:
2
2
2
3
⎛
x
z
Γ πP
⎞
Nk
TΓ
Ne
i i
n
Ω
B
F
msa
= -
⎜
∑
+
⎟
+
(7)
⎜
⎟
ε
1
+Γd
2Δ ρ
3πρ
⎝
i
i
⎠
Здесь
2
πd
i
2
z
i
-
P
n
2
2
e
2Δ
4
Γ
= 4πρθ
∑
x
i
X
i
,
θ=
,
X
i
=
,
(8)
εkBT
1+Γ
d
i
i
3
ρ
x
zdi i i
πρ
x
di i
P
n
=
∑
,
Ω=
1+
∑
(9)
Ω
1+Γd
i
2Δ
1
+Γd
i
i
i
Перейдем к описанию ион%дипольного вклада в свободную энергию расплава. От%
метим, что с точки зрения уменьшения вычислительных затрат удобнее оперировать
структурными факторами в обратном пространстве Фурье%образов, чтобы снизить по%
требность в вычислительных ресурсах. Поэтому далее все действия, связанные с учетом
поляризационного вклада в энергию жидкого расплава, будут производиться в обрат%
ном Фурье%пространстве. Тогда свободную энергию жидкой соли можно записать как:
∞
1
1
0
2
ρ
1
F
liq
=
F
0
+
∑
x
i
x
j
ϕ
ij
(k)
(
ij
S k)−δ
ij
)
k
d
k
+
∑
x
i
x
j
ϕ
ij
(0),
(10)
2
∫
4
π
2
i, j
0
i, j
где
- структурные факторы системы сравнения в обратном Фурье%пространстве,
0(
)
ij
S
k
- возмущающая добавка в парный потенциал в Фурье%пространстве, F0 относит%
ϕ1 (k)ij
ся к свободной энергия системы сравнения, а два других слагаемых описывают поля%
ризационную добавку к свободной энергии системы.
Соответственно, выражение для вклада поляризационных взаимодействий в пар%
ный потенциал можно записать в следующем виде:
⎛sin
kd
coskd
⎞
1
ij
ij
ϕ
(k)
=πkE
⎜
+
-
Si(kd
)
⎟,
(11)
ij
ij
ij
⎜
2
2
kd
⎟
⎝
k d
ij
ij
⎠
d
ij
sin
kR
где
Si(kd
)
dR
- интегральный синус.
=∫0
ij
R
Параметр Eij описывает интенсивность ион%дипольного воздействия ионов и опре%
деляется следующим выражением [33]:
3
2
3
3
2
3
(
ε-1
)
b
i
−
(
ε+2)α
i
(z
j
e)
b
i
(
ε-1)
b
j
−(ε+
2
)α
j
(z
i
e)
b
j
E
ij
=
+
,
(12)
3
3
(2
ε+1
)
b
−
2
(
ε-
1)α
ε
(
2
ε+1)
b
−2(ε-
1)
α
ε
i
i
j
j
где αi - поляризуемость иона i%го сорта, bi - радиус Борновской полости, который
естественно приравнять ионному радиусу (ri = di/2). В более простом случае при допу%
щении, что ε = 1, выражение (12) преобразуется к следующему виду, зависящему толь%
ко от поляризуемостей катиона и аниона:
2
E
=-
⎡α
(
z
e)
+α
(
z
e
)
2⎤.
(13)
ij
i
j
j
i
⎣
⎦
518
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
Sij(k)
a
2
S12
S11
S22
1
0
1
0
1
2
3
4
5
k, Å-1
ij(k)
б
3
12
11
1
22
0
1
3
5
0
1
2
3
4
5
k, Å-1
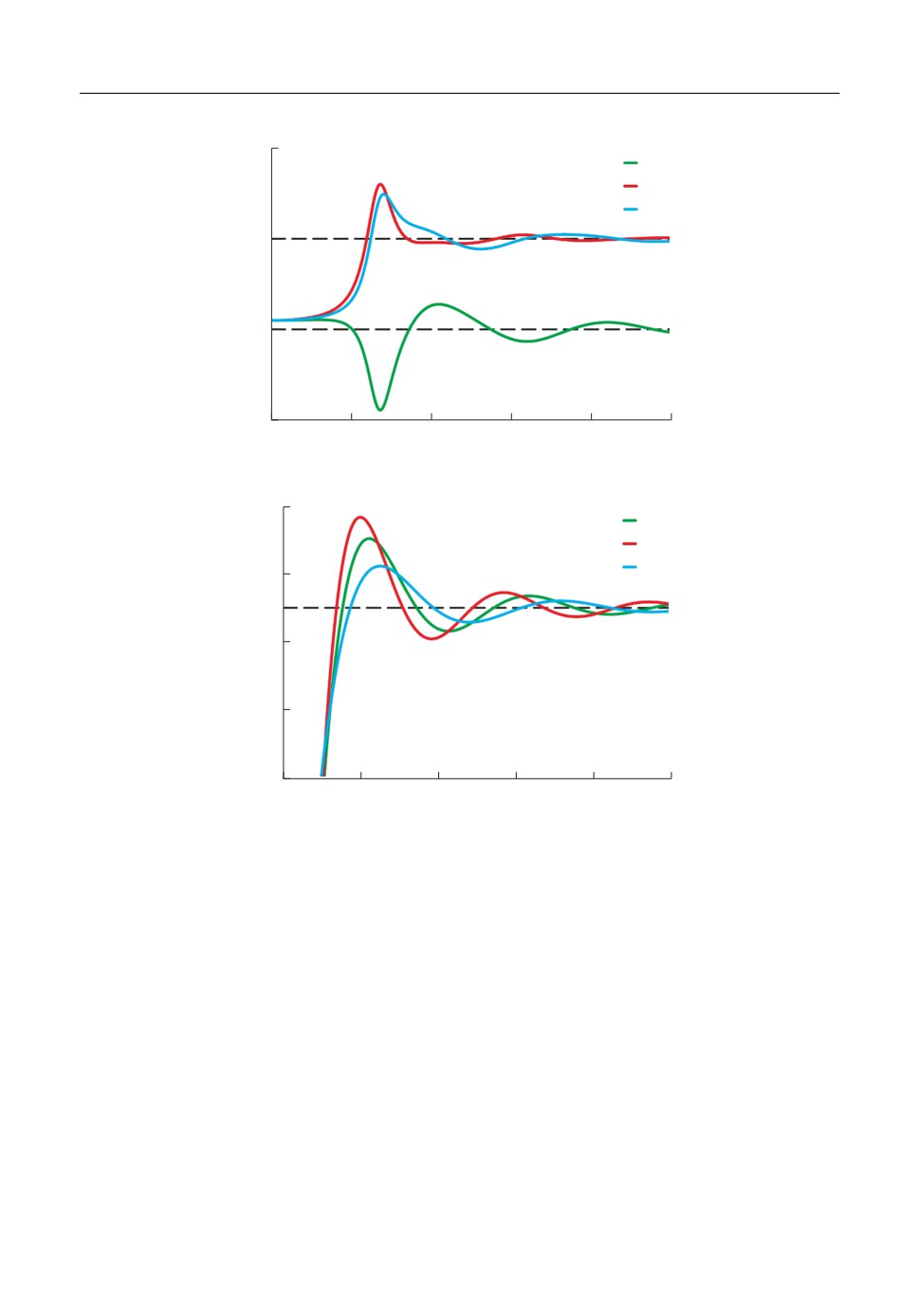
Рис. 1. Зависимости: а) структурных факторов системы сравнения и б) поляризационного вклада в парный
потенциал взаимодействия от волнового числа k для расплава CsF при температуре 1000 K.
Соотношения для структурных факторов выражаются через прямые корреляцион%
ные функции, которые имеют достаточно громоздкий вид, поэтому помещены в при%
ложение (см. приложение А). Характерный вид структурных факторов системы срав%
нения для расплава CsF вблизи температуры плавления показан на рис. 1а. Кроме то%
го, на рис. 1б приведены зависимости поляризационного вклада в парный потенциал
взаимодействия для системы CsF при той же температуре.
Перейдем к описанию свободной энергии твердой фазы. В данной работе свобод%
ная энергия кристалла была рассчитана с использованием трех основных вкладов:
энергии Маделунга ионного кристалла, энергии отталкивания электронных оболочек
и колебательного вклада. Тогда свободную энергию Гиббса для ионного кристалла
можно представить как:
G
=U
+F
+ PV,
(14)
sol
pot
vib
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
519
где Upot - вклад в потенциальную энергию кристалла в соответствие с уравнением
Борна-Майера, которое включает в себя энергию Маделунга кристалла и энергию от%
талкивания электронных оболочек. Выражение для этого вклада в энергию кристалла
выглядит следующим образом:
2
NAz
i
z
j
e
⎛
ρe⎞
U
=
1-
(15)
pot
⎜
⎟
R
0
⎝
R
0
⎠
Здесь A - постоянная Маделунга, ρe - параметр отталкивания Борна, R0 - равновес%
ное межионное расстояние в кристалле.
Колебательный вклад в свободную энергию Fvib можно выбрать по модели Дебая.
Характеристические температуры Дебая хорошо известны в случае кристаллов галоге%
нидов щелочных металлов [38]. Отметим, что даже вблизи температуры плавления это
слагаемое (пропорциональное температуре) мало по сравнению с энергией Маделун%
га. Выражение для последнего вклада в свободную энергию при этом можно привести
к виду:
θ
d
⎡
⎛
-
⎞
⎤
T
9θ
d
⎛θ
d
⎞
F
vib
=
Nk
B
T
⎢
3ln⎜1-
e
⎟+
-
D⎜
⎟⎥,
(16)
⎜
⎟
8
T
⎝T
⎠
⎣
⎝
⎠
⎦
⎛θ
d
⎞
где θd - характеристическая температура Дебая, а
D⎜
⎟
- функция Дебая.
⎝T
⎠
Перейдем теперь к обсуждению полученных результатов моделирования для систем
CsX, где X- = F-, Cl-, Br- и I-. Отметим, что дальнейшее вычисление термодинамиче%
ских характеристик производится по стандартным термодинамическим соотношени%
ям, которые нетрудно найти в классических руководствах по химической термодина%
мике (см., например, [36]).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Основное внимание данной работы сосредоточено на разработке модели для учета
поляризационных взаимодействий ионов в расплавах на основе заряженных твердых
сфер, а также проверке работоспособности модели при описании термодинамических
свойств жидкого состояния и характеристик плавления солевых расплавов. Для этих
целей нет существенной необходимости в выводе выражения уравнения состояния
или варьировании ионных радиусов. Поэтому все необходимые величины (например,
ионные радиусы и поляризуемости, плотности расплавов и др.) взяты из справочной
литературы и монографий [38-40]. Кроме того, в целях экономии места в работе не
приводятся стандартные формулы для расчета тепловых эффектов, которые также не%
трудно найти в справочниках по термохимии (см., например, [41]).
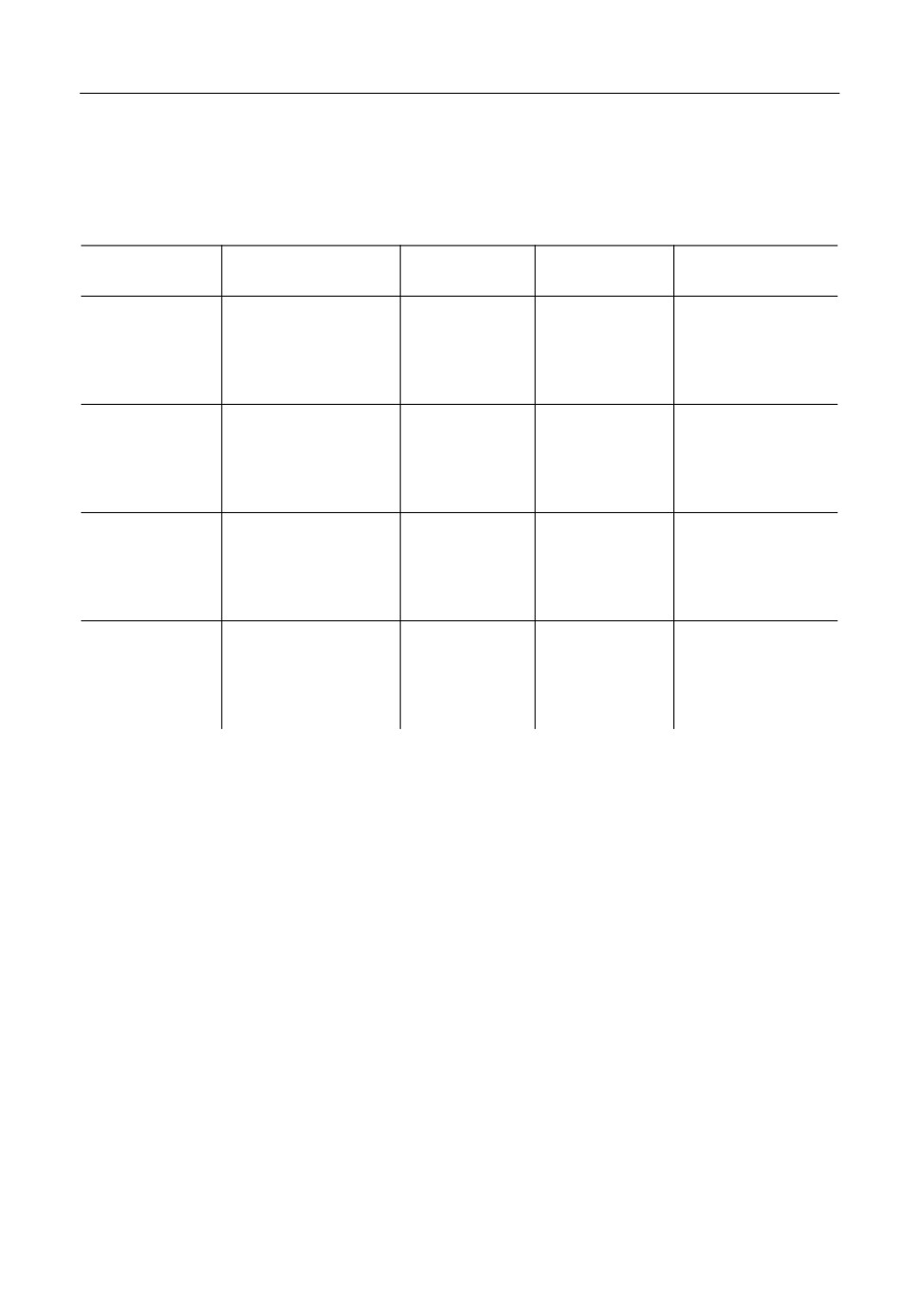
В табл. 1 представлены результаты моделирования характеристик плавления для га%
логенидов цезия при учете поляризационных эффектов. Для сопоставления также
приведены результаты расчетов в рамках среднесферического приближения без учета
поляризационных взаимодействий между ионами и экспериментальные данные из
литературы.
Приведенные в табл. 1 данные показывают, что разработанная модель учета поля%
ризационных эффектов способна достаточно точно описывать характеристики плав%
ления представленных солей. Погрешность в описании температур плавления не пре%
вышает 3%. При этом стоит отметить, что полученное значение сопоставимо с по%
грешностью между самими экспериментальными данными. Значения энтальпий и
энтропий плавления также достаточно близки к экспериментально измеренным (по%
грешность составляет меньше 4% для всех расплавов, кроме соли CsF). Немного боль%
520
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
Таблица 1
Результаты расчетов температур плавления Tm и соответствующих им энтальпий ΔHm
и энтропий ΔSm плавления солей CsX (X- = F-, Cl-, Br- и I-) для модели заряженных твердых сфер
различающихся диаметров в рамках среднесферического приближения (CHS)
и при учете поляризационных взаимодействий (CHS + Pol) в сопоставлении с литературными данными
CHS
CHS + Pol
Experimental data
Tm, K
1637
989.5
955 [38], 976 [40]
CsF (ε = 1.889)
ΔHm, кДж · моль-1
61.292
19.224
21.7 [40]
ΔSm, Дж · моль-1 · K-1
37.44
19.429
22.23 [40]
Tm, K
1754
935.5
919 [38, 40]
CsCl (ε = 1.892)
ΔHm, кДж · моль-1
64.789
19.688
20.4 [40]
ΔSm, Дж · моль-1 · K-1
36.94
21.05
22.2 [40]
Tm, K
1694
922
909 [38, 40]
CsBr (ε = 1.907)
ΔHm, кДж · моль-1
67.362
23.048
23.6 [40]
ΔSm, Дж · моль-1 · K-1
39.78
24.99
25.96 [40]
Tm, K
1673
908
894, 899 [38], 905 [40]
CsI (ε = 1.939)
ΔHm, кДж · моль-1
70.316
25.393
25.7 [40]
ΔSm, Дж · моль-1 · K-1
42.04
27.97
28.4 [40]
шее отклонение рассчитанных характеристик от экспериментальных данных для фто%
рида цезия, вероятно, связано с малым значением поляризуемости фторид%аниона
(αF = 1.04 Å3) и, следовательно, с меньшим вкладом поляризационной добавки в по%
тенциальную энергию расплава. Полученные значения диэлектрической постоянной,
в целом, близки к приведенным в литературе оценками (ε ≈ 2 [33]). Заметим также, что
значения характеристик плавления, полученные при тех же условиях в рамках MSA
без учета эффектов поляризации, значительно выше экспериментальных данных.
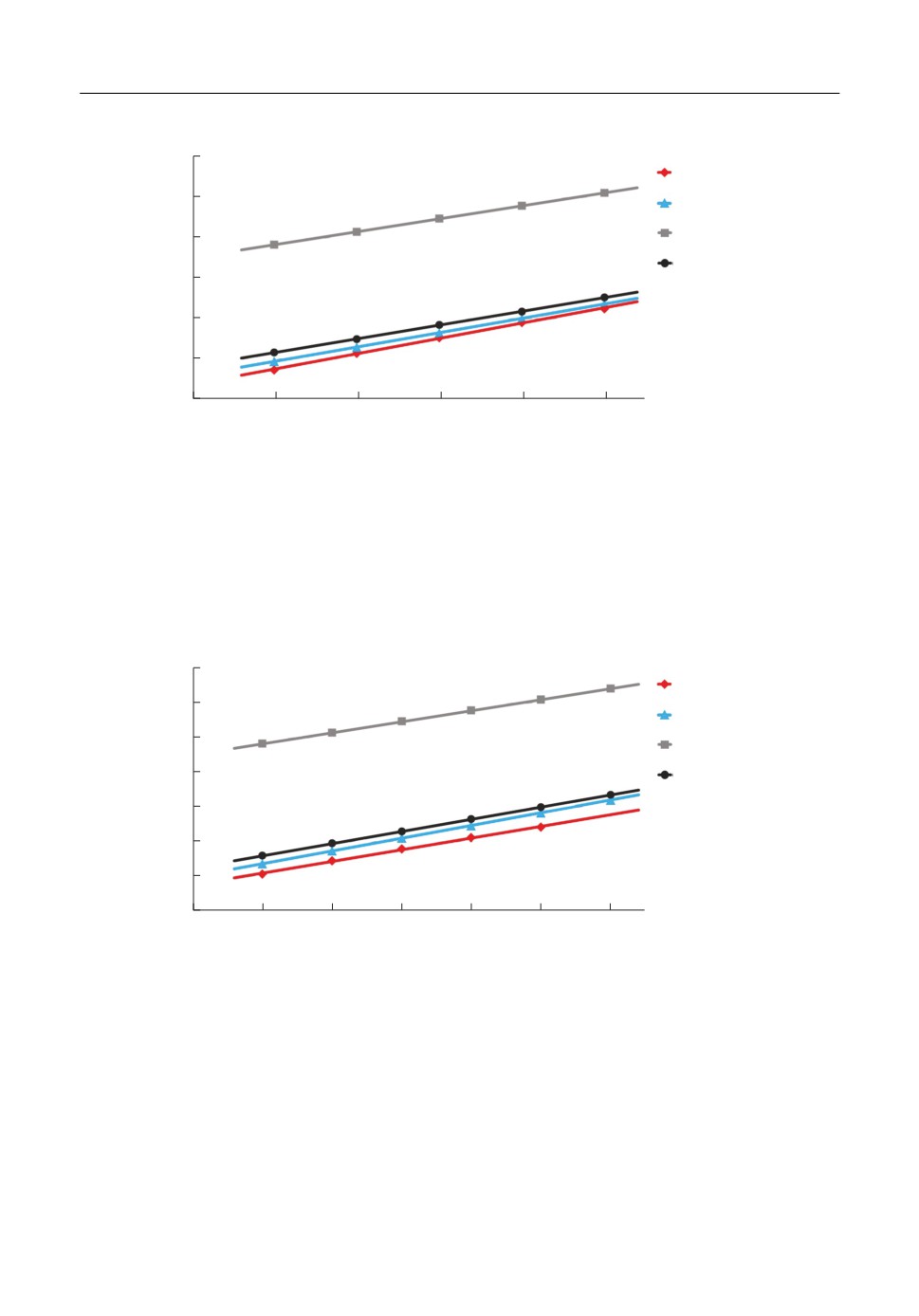
На рис. 2 представлены зависимости теплосодержания расплавленного фторида це%
зия от температуры. Черным цветом обозначены результаты моделирования при учете
поляризационных взаимодействий между ионами, серым цветом - расчеты в рамках
среднесферической модели в сопоставление с экспериментальными данными (цвет%
ные линии).
Из рис. 2 видно, что модель с включением поляризационных эффектов достаточно
хорошо описывает температурную зависимость теплосодержания расплава CsF, в то
время как среднесферическое приближение при тех же условиях завышает результаты
примерно в полтора раза. При этом диэлектрическая постоянная среды закономерно
убывает с ростом температуры и в данном интервале хорошо аппроксимируется ли%
нейной зависимостью ε = 2.0038-0.0002T.
На рис. 3 представлены температурные зависимости теплосодержания для расплава
CsCl. Черным цветом обозначены результаты расчетов при учете поляризационных
эффектов, серым цветом - в рамках модели MSA. Также для сопоставления приведе%
ны экспериментальные зависимости (цветные линии).
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
521
H0 - H0
, кДж/моль
T
298
120
Эксп. 1
110
Эксп. 2
100
CHS
CHS + Pol
90
80
70
60
950
1000
1050
1100
1150
1200
T, K
Рис. 2. Зависимости теплосодержания расплава от температуры для соли CsF в модели заряженных твердых
сфер различающихся диаметров в рамках среднесферического приближения (CHS) и при учете поляриза%
ционных взаимодействий (CHS + Pol) в сопоставлении с экспериментальными данными (Эксп. 1 - [42];
Эксп. 2 - [43]).
H0 - H0
, кДж/моль
T
298
120
Эксп. 1
110
Эксп. 2
100
CHS
90
CHS + Pol
80
70
60
50
900
950
1000
1050
1100
1150
1200
T, K
Рис. 3. Зависимости теплосодержания расплава от температуры для соли CsCl в модели заряженных твердых
сфер различающихся диаметров в рамках среднесферического приближения (CHS) и при учете поляриза%
ционных взаимодействий (CHS + Pol) в сопоставлении с экспериментальными данными (Эксп. 1 - [44];
Эксп. 2 - [45]).
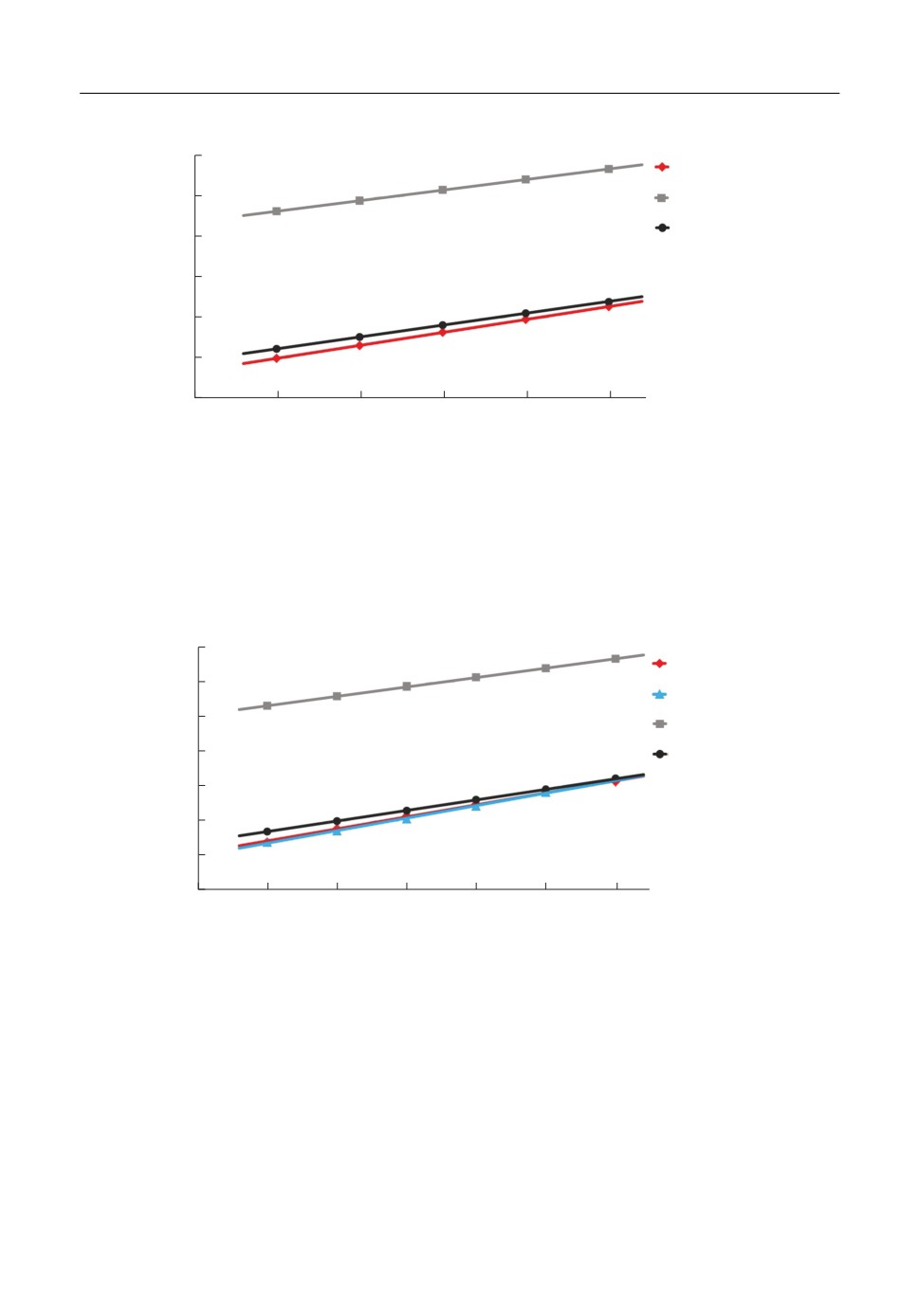
На рис. 3 показано, что при учете эффектов поляризации модель также удовлетво%
рительно описывает зависимость теплосодержания расплава CsCl. Диэлектрическая
постоянная закономерно понижается с увеличением температуры и укладывается в
линейную зависимость ε = 1.9758-0.0002T в указанном интервале температур. На
рис. 4 представлены зависимости теплосодержания жидкого расплава от температуры
для соли CsBr с использованием тех же цветовых обозначений (см. рис. 2).
522
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
H0 - H0
, кДж/моль
T
298
110
Эксп.
100
CHS
CHS + Pol
90
80
70
60
50
900
950
1000
1050
1100
1150
T, K
Рис. 4. Зависимости теплосодержания расплава от температуры для соли CsBr в модели заряженных твердых
сфер различающихся диаметров в рамках среднесферического приближения (CHS) и при учете поляриза%
ционных взаимодействий (CHS + Pol) в сопоставлении с экспериментальными данными (Эксп. - [46]).
H0 - H0
, кДж/моль
T
298
120
Эксп. 1
110
Эксп. 2
100
CHS
90
CHS + Pol
80
70
60
50
900
950
1000
1050
1100
1150
1200
T, K
Рис. 5. Зависимости теплосодержания расплава от температуры для соли CsI в модели заряженных твердых
сфер различающихся диаметров в рамках среднесферического приближения (CHS) и при учете поляриза%
ционных взаимодействий (CHS + Pol) в сопоставлении с экспериментальными данными (Эксп. 1 - [44];
Эксп. 2 - [47]).
Рассчитанные значения теплосодержания для расплавленного бромида цезия на
рис. 4 также достаточно точно повторяют поведение экспериментальной зависимости.
Уравнение, описывающее понижение диэлектрической постоянной с ростом темпе%
ратуры в указанном интервале, имеет вид: ε = 1.9915-0.0003T. Рисунок 5 иллюстриру%
ет температурные зависимости теплосодержания расплава CsI с использованием тех
же цветовых обозначений (см. рис. 2).
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
523
S, Дж/моль · K
220
CsI (CHS)
CsI (CHS + Pol)
210
CsBr (CHS)
CsBr (CHS + Pol)
200
CsCl (CHS)
CsCl (CHS + Pol)
190
CsF (CHS)
CsF (CHS + Pol)
180
170
160
150
900
950
1000
1050
1100
1150
1200
T, K
Рис. 6. Зависимости энтропии расплава от температуры для солей CsX в модели заряженных твердых сфер
различающихся диаметров в рамках среднесферического приближения (CsF -
, CsCl -
, CsBr -
, CsI -
)
и при учете поляризационных взаимодействий (CsF -
, CsCl -
, CsBr -
, CsI -
).
Результаты моделирования на рис. 5 повторяют описанные выше закономерности
для других солей CsX при сопоставлении расчетных и экспериментальных данных, а
зависимость диэлектрической постоянной от температуры описывается уравнением
ε = 2.0178-0.0003T.
В целом, сопоставление расчетных и экспериментальных данных для расплавов
CsX показывает хорошее согласие модели с литературными данными и по термодина%
мическим свойствам, и по характеристикам плавления при довольно реалистичных
значениях диэлектрической постоянной, что указывает на способность разработан%
ной модели описывать термодинамические характеристики солевых расплавов.
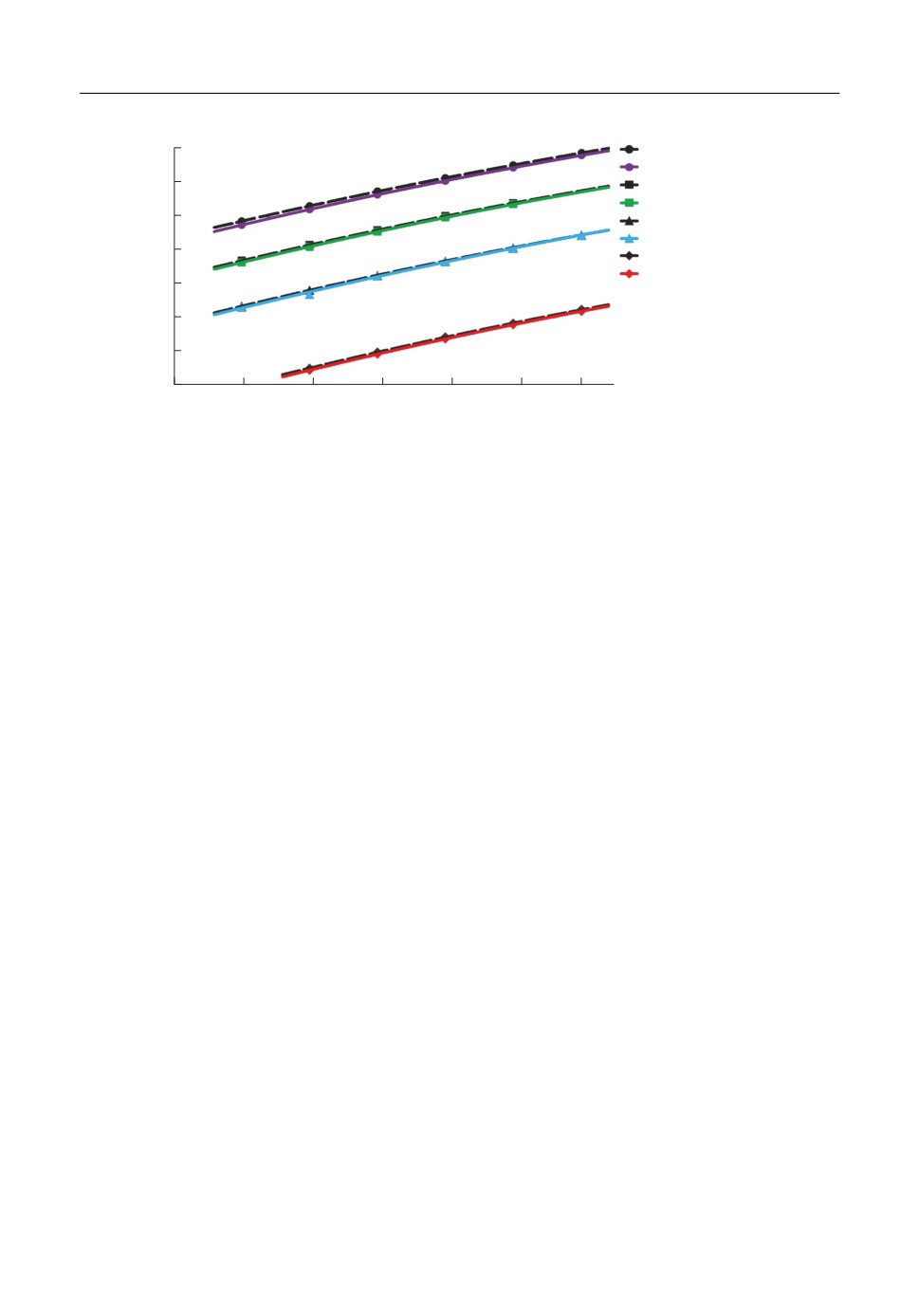
Наконец, на рис. 6 приведены зависимости энтропии расплавов CsX от температу%
ры, где сплошными цветными линиями обозначены результаты расчетов в рамках мо%
дели, учитывающей поляризационные взаимодействия ионов, в то время как черные
пунктирные кривые описывают результаты, полученные в рамках среднесферической
модели для многосортной смеси заряженных твердых сфер.
Из рис. 6 видно, что, во%первых, энтропия расплава растет с увеличением радиуса
аниона, что вполне закономерно, поскольку увеличение различий в радиусах частиц
бинарной смеси способствует ее дополнительному упорядочению [48]. Притом энтро%
пия закономерно увеличивается с ростом температуры. Следует также заметить, что
вклад поляризационных взаимодействий, как видно из сопоставления, вносит не%
большую добавку в упорядочение системы, т.е. приводит к слабому понижению эн%
тропии. Это понижение энтропии, как видно из рисунка, становится немного более
заметным с понижением температуры при приближении к температурам плавления.
ВЫВОДЫ
1. Предложена термодинамическая теория возмущений для учета эффектов поля%
ризации ионов в расплавах солей на базе модели заряженных твердых сфер.
2. На основе разработанной модели рассмотрено влияние ион%дипольной добавки
на термодинамические свойства жидкого состояния и характеристики плавления со%
левых расплавов CsX (где X- = F-, Cl-, Br- и I-).
524
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
3. Показано, что учет ион%дипольных взаимодействий между ионами соли приво%
дит к снижению температур плавления и теплосодержания расплавов CsX по сравне%
нию с моделью сравнения заряженных твердых сфер. Кроме того, поляризационный
вклад в свободную энергию приводит к более точному описанию энтальпий и энтро%
пий плавления за счет дополнительного понижения энергии расплавов.
4. Установлено, что при описании характеристик плавления солей CsCl, CsBr и CsI
погрешность расчетов не превышает 4%. Для соли CsF модель предсказывает более за%
метное отклонение рассчитанных характеристик от экспериментальных данных
(меньше 10%), что может быть связано с уменьшением поляризационного вклада в
энергию расплава вследствие малого радиуса и небольшой поляризуемости фторид%
аниона.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного
проекта № 18%33%01234.
ПРИЛОЖЕНИЕ А
Связь между структурными факторами системы и прямыми корреляционными
функциями в обратном Фурье%пространстве определяется следующими соотношени%
ями [49]:
-1
-1
ii
S k)
=
(
1−x ρ
j
jj
c k)
)
D
,
ij
S k)
=
x
i
x
j
ρ
ij
c k)D
,
(A1)
где
D
=(1-xiρc k
)(1-xjρc k
)-
x
x c2(k).
(A2)
ii
jj
i
j
ij
Соответственно, Фурье%образы прямых корреляционных функций cij(k) в рамках
среднесферического приближения [50] можно привести к следующему виду:
3
hs
c
4
hs
c
⎡
k
α
+φ
kλ
cos
(
kλ
)
−
sin
(
kλ
))
+
k
δ
+δ
χ +
⎤
(
i
)(
ij
ij
ij
(
)
0
⎢
⎥
4
π⎢
3
hs
c
2
hs
c
c k)
=
+
k
α
+α
χ1-ψ
+
k
β
+β
χ2 -2ψ1-2χ
+
⎥,
(A3)
ij
(
ij
ij
)(
0
)
(
ij
ij
)(
0
)
6
k
⎢
⎥
⎢
hs
c
4
⎥
+
(
γ
+γ
ij
)(
χ4 -4ψ3 -12χ2 +24ψ1 +24χ
0
) −k θz
i
z
j
cos
(
kd
ij
)
⎣
⎦
⎡
⎤
⎢
3
hs
c
2
⎥
k
(
α
i
+α
ii
)(
kd
i
cos
(kd
i
)
−
sin
(
kd
i
))
−k4θz
i
⋅ cos
(kd
i
) +
⎢
⎥
4
π⎢
2
hs
c
2
2
⎥
ii
c k)
=
+
k
(
β
i
+β
ii
)
(
k
d
i
cos
(kd
i
)
−
2kd
i
sin(
kd
i
) −
2cos
(kd
i
)
+
2
)
+
(A4)
6
⎢
⎥
k
⎢
4
4
3
3
2
2
⎥
⎛
k
d
cos(kd
)
−
4
k
d
sin(
kd
)
−12
k
d
cos
(
kd
) +⎞
⎢
hs
c
i
i
i
i
i
i
⎥
+
(
γ
+γ
ii
)
⎜
⎟
⎢
+
24kd
sin
(kd
) +
24cos(kd
)
−
24
⎥
⎣
⎝
i
i
i
⎠⎦
Ниже представлены все необходимые обозначения:
n n
n n
χ
=
k
d
cos(kd
)-knλij cos(kλij), ψ
=
k
d
sin(
kd
)-knλij sin(kλ
),
(A5)
n
ij
ij
n
ij
ij
ij
hs
−
1
2
1
3
hs
1
2
α
i
=Δ
+
ad
i
+
bd
i
+
cd
i
,
β
i
=-
(
a
+
2bd
i
+
cd
i
)
,
3
2
(A6)
hs
1
2
2
δ
=- λ
ij
(
a
+
2
bd
ij
+
cd
ij
)
,
2
3
hs
0
1
2
0
3
ξ +6ξξ -2ξ ξ +ξ ξ2 -6ξξ ξ +9ξ
0
3
1
2
3
2
hs
hs
hs
γ
=
,
α
ij
=(α
i
+α
j
)
2,
4
2Δ
(A7)
hs
hs
hs
β
ij
=
(
β
i
+β
j
)
2,
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
525
с
⎡
2
2
1
3
2
3
2
⎤
α
ij
=θ
(
X
i
−
X
j
)(
N
i
−
N
j
)
+
(
X
i
+
X
j
)
Γ+
2d
ij
NNi
j
-
(
d
i
M
i
+
d
j
M
j
)
,
(A8)
⎣
3
⎦
с
⎡
1
2
2
2
2
⎤
с
θ
2
2
β
= -θ
XM
+
X M
+
NN
-
d
M
+
d
M
,
γ
=-
⎡M
+
M
⎤,
(A9)
ij
i
i
j
j
i
j
(
i
i
j
j
)
ij
⎣
i
j
⎦
⎣
2
⎦
6
c
⎡
1
1
2
⎤
δ = θλ
(X
+
X
)(d
M
−d
M
)
+λ
(d M
+d
M
)
−NiN
,
(A10)
ij
i
j
i
i
j
j
ij
(
i
i
j
j
j
)
⎣
2
4
⎦
c
⎡
1
3
2
⎤
X
i
−
z
i
N
i
+ΓX
i
φ =-2θ
z
i
N
j
−
XidiM
i
+
d
i
M
i
,
N
i
=
,
M
i
=
(A11)
⎣
3
⎦
d
d
i
i
СПИСОК ЛИТЕРАТУРЫ
1. G r e e n wo o d N . N . , E a r n s h a w A . Chemistry of the Elements. Butterworth%Heine%
mann, 1997.
2. П е т р я н о в % С о к о л о в И . В . Популярная библиотека химических элементов. М.:
Наука, 1977.
3. L a n t e l m e F. , G r o u l t H . Molten Salts Chemistry: From Lab to Applications. Elsevier
Inc., 2013.
4. C a p e l l i E . , B e n e š O . , K o n i n g s R . J . M . // J. Nuclear Materials. 2018. 501.
P. 238-252.
5. J a n z G . J . Molten Salts Handbook. Academic Press Inc., 1967.
6. M a m a n t o v G . , M a r a s s i R . Molten Salt Chemistry: An Introduction and Selected Ap%
plications. D. Reidel Publishing Company, 1987.
7. G a u n e % E s c a r d M . , H a a r b e r g G . M . Molten Salts Chemistry and Technology. John
Wiley & Sons, 2014.
8. G a u n e % E s c a r d M . Molten Salts: From Fundamentals to Applications. Springer Science
& Business Media, 2002.
9. C h a n g Y. A . , C h e n S . , Z h a n g F. , Ya n X . , X i e F. , S c h m i d % F e t z e r R . ,
O a t e s W. A . // Progress in Materials Science. 2004. 49. P. 313-345.
10. G o n g W. // Thermochimica Acta. 2013. 562. P. 105-108.
11. G o n g W. , W u Y. , Z h a n g R . , G a u n e % E s c a r d M . // Calphad. 2012. 36. P. 44-51.
12. K a p a l a J . , B o c h y n s k a M . , B r o c z k o w s k a K . , R u t k o w s k a I . // J. Alloys
and Compounds. 2008. 451. P. 679-681.
13. Va n L a a r J . J . Melting%point and freezing%point curves in binary systems, when the solid
phase is a mixture (amorphous solid solution or mixed crystals) of both components. First part //
Zeitschrift fuer Physikalische Chemie, Stoechiometrie und Verwandtschaftslehre. 1908. 63. P. 216-
253.
14. Z h u Z . , Pe l t o n A . D . // J. Alloys and Compounds. 2015. 641. P. 261-271.
15. K a n g Y. % B . , Pe l t o n A . D . // J. Chemical Thermodynamics. 2013. 60. P. 19-24.
16. Ta b a c c h i G . , M u n d y C . J . , H u t t e r J . , Pa r r i n e l l o M . // J. Chemical Phys%
ics. 2002. 117. P. 1416-1433.
526
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
17. R o d r i g u e s P. C . R . , F e r n a n d e s F. M . S . // J. Chemical Physics. 2007. 126.
P. 02450301-02450310.
18. Pe n t i n I . V. , S c h ö n J . C . , J a n s e n M . // J. of Chemical Physics. 2007. 126.
P. 12450801-12450815.
19. B e n e š O . , Z e l l e r P h . , S a l a n n e M . , K o n i n g s R . J . M . // J. of Chemical
Physics. 2009. 130. P. 13471601 -13471613.
20. A r a g o n e s J . L . , S a n z E . , Va l e r i a n i C . , Ve g a C . // J. Chemical Physics. 2012.
137. P. 10450701-10450710.
21. Zw a n z i g R . W. // J. Chemical Physics. 1954. 22. P. 1420-1426.
22. A k i n l a d e O . // Physica Status Solidi (b). 1990. 161. P. 75-83.
23. K h a n n a K . N . , M c L a u g h l i n I . L . // J. Physics: Condensed Matter. 1989. 1.
P. 4155-4160.
24. H a f n e r J . , K a h l G . // J. Physics F: Metal Physics. 1984. 14. P. 2259-2278.
25. K u m a r a v a d i ve l R . , E v a n s R . // J. Physics C: Solid State Physics. 1976. 9. P. 3877-
3903.
26. K a h l G . , H a f n e r J . // J. Physics F: Metal Physics. 1985. 15. P. 1627-1638.
27. D u b i n i n N . , Yu r y e v A . , Va t o l i n N . // J. Non%Equilibrium Thermodynamics.
2010. 35. P. 289-300.
28. H a u s l e i t n e r C . , H a f n e r J . // J. Physics F: Metal Physics. 1988. 18. P. 1013-1023.
29. U m a r I . H . , M e y e r A . , Wa t a b e M . , Yo u n g W. H . // J. Physics F: Metal Phys%
ics. 1974. 4. P. 1691-1706.
30. L e b o w i t z J . L . , Pe r c u s J . K . // Physical Review. 1966. 144. P. 251-258.
31. B l u m L . // Theoretical Chemistry: Advances and Perspectives. 1980. 5. P. 1-66.
32. B l u m L . , R o s e n f e l d Y. // J. Statistical Physics. 1991. 63. P. 1177-1190.
33. S t i l l i n g e r F. H . Equilibrium theory of pure fused salts. Molten salt chemistry, 1964.
34. S o l a n a J . R . Perturbation Theories for the Thermodynamic Properties of Fluids and Solids.
CRC Press: Taylor & Francis Group, 2013.
35. Z i m a n J . M . Models of Disorder: The Theoretical Physics of Homogeneously Disordered
Systems. Cambridge University Press, 1979.
36. P r i g o g i n e I . , D e f ay R . Chemical thermodynamics. Longmans Green and Co, 1954.
37. M a n s o o r i G . A . , C a r n a h a n N . F. , S t a r l i n g K . E . , L e l a n d T. W. //
J. Chemical Physics. 1971. 54. P. 1523-1525.
38. S i r d e s h m u k h D . B . , S i r d e s h m u k h L . , S u b h a d r a K . G . Alkali halides: A
handbook of physical properties. Springer%Verlag Berlin Heidelberg, 2001.
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
527
39. М и н ч е н к о В . И . , С т е п а н о в В . П . Ионные расплавы: упругие и калорические
свойства. Екатеринбург: УрО РАН, 2008.
40. H ay n e s W. M . CRC Handbook of Chemistry and Physics: 97th Edition. CRC Press: Taylor
& Francis Group, 2017.
41. Гу р в и ч Л . В . и д р . Термодинамические свойства индивидуальных веществ. Спра%
вочное издание. М.: Наука, 1978, Т. 1. Кн. 1.
42. M a c l e o d A . C . // J. Chemical Society, Faraday Transactions 1: Physical Chemistry in
Condensed Phases. 1973. 69. P. 2026-2035.
43. B e n e š O . , K o n i n g s R . J . M . , S e d m i d u b s k ý D . , B e i l m a n n M . , Va l u
O.S., Capelli E., Salanne M., Nichenko S. // J. Chemical Thermodynamics. 2013.
57. P. 92-100.
44. K ay l o r C . E . , Wa l d e n G . E . , S m i t h D . F. // J. Physical Chemistry. 1960. 64.
P. 276-278.
45. M a r c h i d a n D . I . , Pa n d e l e L . Thermal properties of KCl, CsCl, and binary mixture
KCl + CsCl. High temperature heat content // Revue Roumaine de Chimie. 1975. 20. P. 299-304.
46. B i b a s I . , L e o n a r d i J . Mesure de l’enthalpie, de la chaleur de fusion et de la chaleur
massique du bromure de cesium // C.R. Acad. Sc. Paris. 1968. 266. P. 1319-1322.
47. R o k i F. % Z . , O h n e t M . % N . , F i l l e t S . , C h a t i l l o n C . , N u t a I . // J. Chem%
ical Thermodynamics. 2014. 70. P. 46-72.
48. Davydov A.G., Tkachev N.K. // J. Molecular Liquids. 2017. 242. P. 879-883.
49. A s h c r o f t N . W. , L a n g r e t h D . C . // Physical Review. 1967. 159. P. 500-510.
50. H i r o i k e K . // Molecular Physics, 1977. 33. P. 1195-1198.
Model of Polarization Interactions between Ions in Melts of Cesium Halides
Based on Thermodynamic Perturbation Theory
A. G. Davydov1, E. V. Smolyarchuk2, N. K. Tkachev1
1Institute of High Temperature Electrochemistry of the Ural Branch of RAS, Yekaterinburg, Russia
2Ural Federal University named B.N. Yeltsin, Yekaterinburg, Russia
A method to take into account polarization interactions between ions in molten salts by
means of thermodynamic perturbation theory based on the model of a mixture of charged
hard spheres with different diameters is presented. The basis for using such reference model
is the observation for partial structural factors in liquid salts above the melting point. The in%
clusion of polarization interactions can be implemented in the framework of thermodynam%
ic perturbation theory. Explicit expressions for the additional polarization term to the energy
of salts are obtained in this work. On this basis, the influence of polarization contribution on
the thermodynamic properties and melting characteristics of cesium%halide melts is consid%
ered. We have showed that the inclusion of polarization interactions between salt ions leads
to decrease in the melting temperature and heat content of the melts as compared with the
reference system of charged hard spheres. The errors in determining the melting tempera%
tures of these salts without fitting the parameters of pair potential don’t exceed three per%
cent. Accounting for the polarization contribution to free energy provides a more accurate
description of the enthalpies and entropies of melting.
528
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
Keywords: polarizability, charged hard spheres, thermodynamic perturbation theory,
mean spherical approximation, alkali metal halides, melting temperature, enthalpy of melt%
ing, heat content, phase equilibria
The reported study was funded by RFBR according to the research project № 18%33%01234.
REFERENCES
1. Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth%Heinemann, 1997.
2. Petryanov%Sokolov I.V. Populyarnaya biblioteka khimicheskikh elementov [Popular library of
chemical elements]. M.: Nauka, 1977. (in Russian)
3. Lantelme F., Groult H. Molten Salts Chemistry: From Lab to Applications. Elsevier Inc., 2013.
4. Capelli E., Beneš O., Konings R.J.M. // J. Nuclear Materials. 2018. 501. P. 238-252.
5. Janz G.J. Molten Salts Handbook. Academic Press Inc., 1967.
6. Mamantov G., Marassi R. Molten Salt Chemistry: An Introduction and Selected Applications.
D. Reidel Publishing Company, 1987.
7. Gaune%Escard M., Haarberg G.M. Molten Salts Chemistry and Technology. John Wiley &
Sons, 2014.
8. Gaune%Escard M. Molten Salts: From Fundamentals to Applications. Springer Science & Busi%
ness Media, 2002.
9. Chang Y.A., Chen S., Zhang F., Yan X., Xie F., Schmid%Fetzer R., Oates W.A. // Progress in
Materials Science. 2004. 49. P. 313-345.
10. Gong W. // Thermochimica Acta. 2013. 562. P. 105-108.
11. Gong W., Wu Y., Zhang R., Gaune%Escard M. // Calphad. 2012. 36. P. 44-51.
12. Kapala J., Bochynska M., Broczkowska K., Rutkowska I. // J. Alloys and Compounds. 2008.
451. P. 679-681.
13. Van Laar J.J. Melting%point and freezing%point curves in binary systems, when the solid phase
is a mixture (amorphous solid solution or mixed crystals) of both components. First part // Zeitschrift
fuer Physikalische Chemie, Stoechiometrie und Verwandtschaftslehre. 1908. 63. P. 216-253.
14. Zhu Z., Pelton A.D. // J. Alloys and Compounds. 2015. 641. P. 261-271.
15. Kang Y.%B., Pelton A.D. // J. Chemical Thermodynamics. 2013. 60. P. 19-24.
16. Tabacchi G., Mundy C.J., Hutter J., Parrinello M. // J. Chemical Physics. 2002. 117. P. 1416-
1433.
17. Rodrigues P.C.R., Fernandes F.M.S. // J. Chemical Physics. 2007. 126. P. 02450301-
02450310.
18. Pentin I.V., Schön J.C., Jansen M. // J. Chemical Physics. 2007. 126. P. 12450801-12450815.
19. Beneš O., Zeller Ph., Salanne M., Konings R.J.M. // J. Chemical Physics. 2009. 130.
P. 13471601-13471613.
20. Aragones J.L., Sanz E., Valeriani C., Vega C. // J. Chemical Physics. 2012. 137. P. 10450701-
10450710.
Модель поляризационных взаимодействий ионов в расплавах галогенидов цезия
529
21. Zwanzig R.W. // J. Chemical Physics. 1954. 22. P. 1420-1426.
22. Akinlade O. // Physica Status Solidi (b). 1990. 161. P. 75-83.
23. Khanna K.N., McLaughlin I.L. // J. Physics: Condensed Matter. 1989. 1. P. 4155-4160.
24. Hafner J., Kahl G. // J. Physics F: Metal Physics. 1984. 14. P. 2259-2278.
25. Kumaravadivel R., Evans R. // J. Physics C: Solid State Physics. 1976. 9. P. 3877-3903.
26. Kahl G., Hafner J. // J. Physics F: Metal Physics. 1985. 15. P. 1627-1638.
27. Dubinin N., Yuryev A., Vatolin N. // J. Non%Equilibrium Thermodynamics. 2010. 35. P. 289-
300.
28. Hausleitner C., Hafner J. // J. Physics F: Metal Physics. 1988. 18. P. 1013-1023.
29. Umar I.H., Meyer A., Watabe M., Young W.H. // J. Physics F: Metal Physics. 1974. 4.
P. 1691-1706.
30. Lebowitz J.L., Percus J.K. // Physical Review. 1966. 144. P. 251-258.
31. Blum L. // Theoretical Chemistry: Advances and Perspectives. 1980. 5. P. 1-66.
32. Blum L., Rosenfeld Y. // J. Statistical Physics. 1991. 63. P. 1177-1190.
33. Stillinger F.H. Equilibrium theory of pure fused salts. Molten salt chemistry, 1964.
34. Solana J.R. Perturbation Theories for the Thermodynamic Properties of Fluids and Solids.
CRC Press: Taylor & Francis Group, 2013.
35. Ziman J.M. Models of Disorder: The Theoretical Physics of Homogeneously Disordered Sys%
tems. Cambridge University Press, 1979.
36. Prigogine I., Defay R. Chemical thermodynamics. Longmans Green and Co, 1954.
37. Mansoori G.A., Carnahan N.F., Starling K.E., Leland T.W. // J. Chemical Physics. 1971. 54.
P. 1523-1525.
38. Sirdeshmukh D.B., Sirdeshmukh L., Subhadra K.G. Alkali halides: A handbook of physical
properties. Springer%Verlag Berlin Heidelberg, 2001.
39. Минченко В.И., Степанов В.П. Ионные расплавы: упругие и калорические свойства.
Екатеринбург: УрО РАН, 2008.
40. Haynes W.M. CRC Handbook of Chemistry and Physics: 97th Edition. CRC Press: Taylor &
Francis Group, 2017.
41. Gurvich L.V. Termodinamicheskiye svoystva individual’nykh veshchestv. Spravochnoye
izdaniye [Thermodynamic properties of individual substances. Reference edition]. M.: Nauka, 1978.
V. 1. Book 1. (in Russian).
42. Macleod A.C. // J. Chemical Society, Faraday Transactions 1: Physical Chemistry in Con%
densed Phases. 1973. 69. P. 2026-2035.
43. Beneš O., Konings R.J.M., Sedmidubský D., Beilmann M., Valu O.S., Capelli E., Salanne M.,
Nichenko S. // J. Chemical Thermodynamics. 2013. 57. P. 92-100.
530
А. Г. Давыдов, Е. В. Смолярчук, Н. К. Ткачев
44. Kaylor C.E., Walden G.E., Smith D.F. // J. Physical Chemistry. 1960. 64. P. 276-278.
45. Marchidan D.I., Pandele L. Thermal properties of KCl, CsCl, and binary mixture KCl + CsCl.
High temperature heat content // Revue Roumaine de Chimie. 1975. 20. P. 299-304.
46. Bibas I., Leonardi J. Mesure de l’enthalpie, de la chaleur de fusion et de la chaleur massique du
bromure de cesium // C.R. Acad. Sc. Paris. 1968. 266. P. 1319-1322.
47. Roki F.%Z., Ohnet M.%N., Fillet S., Chatillon C., Nuta I. // J. Chemical Thermodynamics.
2014. 70. P. 46-72.
48. Davydov A.G., Tkachev N.K. // J. Molecular Liquids. 2017. 242. P. 879-883.
49. Ashcroft N.W., Langreth D.C. // Physical Review. 1967. 159. P. 500-510.
50. Hiroike K. // Molecular Physics, 1977. 33. P. 1195-1198.