РАСПЛАВЫ
6 · 2019
УДК 620.143
ХАРАКТЕР СЕЛЕКТИВНОГО АНОДНОГО РАСТВОРЕНИЯ.
ВЛИЯНИЕ СОСТАВА СПЛАВА
© 2019 г. Э. А. Карфидовa, b, Е. В. Никитинаa, b, *, Н. А. Казаковцеваa, Л. М. Бабушкинаb
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
bУральский Федеральный Университет им. Б.Н. Ельцина, Екатеринбург, Россия
*e5mail: neekeetina@mail.ru
Поступила в редакцию 12.02.2019 г.
После доработки 25.05.2019 г.
Принята к публикации 08.06.2019 г.
Изучено коррозионно электрохимическое поведение сплавов на основе меди
(Л63, мельхиор, монель и Cu-Al) в высокотемпературных солевых электролитах раз
личного состава в гальваностатическом режиме. Наиболее перспективным сплавом
на основе меди для получения нанопористых и мезопористых материалов в солевых
расплавах является латунь Л63; наименьшим средним размером пор обладали образ
цы из латуни Л63 в экспериментах с хлоридным расплавом; в гальваностатическом
режиме размер пор составил - 1.1 мкм (при заданных условиях - 200 А/м2, 500°С);
результаты циклической вольтамперометрии можно применить для прогнозирова
ния характера электрохимической деструкции и анализа стадий сопряженных анод
ных процессов. Было установлено влияние природы второго компонента сплава на
характер электрохимической деструкции и формирование развитого поверхностно
го слоя исследуемых сплавов.
Ключевые слова: сплавы меди, электрохимическая деструкция, хлоридный расплав,
коррозия, температура, морфология поверхности.
DOI: 10.1134/S0235010619060057
ВВЕДЕНИЕ
Итогом селективного растворения сплава является образование поверхностного слоя
с модифицированным составом. В процессе анодного растворения изменяются как ре
льеф поверхности твердого электрода, так и соотношение компонентов сплава, проис
ходит электрохимическая деструкция исходного материала или “электрокоррозия”.
Исследования закономерностей селективного растворения важны как для корро
зиологии и для исследования кинетики электрохимических процессов в целом[1-3],
так и для электрохимического материаловедения и получения структурированных ма
териалов, поскольку необходим учет реальной неоднородности твердых металличе
ских поверхностей.
При анодном растворении сплава меди с более электроотрицательным компонен
том, таким, как цинк или алюминий, в расплавленных солевых электролитах в хло
ридных расплавах, сплав растворяется в активном состоянии при относительно невы
соком перенапряжении анодной реакции растворения металла. В условиях анодного
растворения двухфазного сплава чаще всего наблюдается структурно избирательное
растворение.
Анодное растворение может проводиться как в гальваностатическом, так и в потен
циостатическом режиме. Достоинство гальваностатического метода с технологиче
ской точки зрения в том, что всегда можно по величине пропущенного количества
электричества оценить выходы по току для парциальных реакций перехода в расплав
(растворения) компонентов сплава.
532
Э. А. Карфидов, Е. В. Никитина, Н. А. Казаковцева, Л.М. Бабушкина
Таблица 1
Состав исходных сплавов
Содержание элемента, мас. %
сплав
Сu
Zn
Al
Ni
O
примеси
50Cu-50Al
47.29
47.39
3.13
2.19
Л63
61.77
36.41
1.72
0.10
Мельхиор
65.82
28.31
2.69
3.18
Монель
32.71
63.88
2.50
0.91
Все известные схемы селективного растворения в низкотемпературных электроли
тах [4-13] используют механизм диффузии в сплаве. Теория Пикеринга-Вагнера [14]
основывается на механизме объемной диффузии в твердом растворе замещения ме
таллов. Вакансии, образующиеся при ионизации атомов цинка, заполняются атомами
меди. Математическая модель низкотемпературного селективного растворения по ме
ханизму объемной диффузии, которая учитывает уменьшение массы анода и предпо
лагает знание величин парциальных коэффициентов диффузии компонентов сплава
при температуре процесса, изложена в [15]. Высокотемпературное селективное рас
творение в основном исследуется на эмпирическом уровне, и в настоящее время еще
не создан его приемлемый механизм. Как будут меняться коэффициенты диффузии
при увеличении температуры более чем на порядок, хотя материал по прежнему будет
находиться в том же агрегатном состоянии - вопрос остается открытым. Кроме того,
существенное значение для состава поверхностного слоя при температуре эксплуата
ции солевых расплавов могут иметь такие процессы, как образование твердых продук
тов солевой пассивации или газообразных продуктов возгона.
Исследовано влияние состава исследуемого сплава (количество электроотрица
тельного компонента в сплаве, а также его природа) на структуру поверхности конеч
ного анодного продукта.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения экспериментов были выбраны следующие сплавы - медно алюми
ниевый сплав 50Cu-50Al (мас. %); промышленные сплавы: латунь Л63 (63Cu-37Zn,
мас. %), мельхиор М65 (65Cu-35Zn, мас. %), монель М35(35Cu-65Zn, мас. %). Сплав
Cu-Al был получен на кафедре литейного производства и упрочняющих технологий
Уральского Федерального Университета им. Б.Н. Ельцина. Была проведена аттестация
всех изучаемых образцов методом рентгеноспектральной микроскопии (рис. 1).
В табл. 1 приведены данные на основе рентгенофазовой микроскопии. По этим
данным можно судить о том, что исходные образцы соответствуют исходным заявлен
ным составам сплавов.
Исходные образцы не имеют развитой поверхностной структуры. В дальнейшем
они использовались в качестве рабочих электродов при анодном селективном раство
рении в расплавах хлоридов щелочных металлов различного состава.
Эксперименты выполнены в высокотемпературной электрохимической ячейке при
температуре 500°С, в атмосфере очищенного аргона. В качестве высокотемпературно
го электролита использовали смеси хлоридов в их эвтектическом состоянии в соответ
ствии с фазовой диаграммой. Хлоридным расплавом, имеющим температуру плавле
ния 280°С, служила тройная эвтектика солей 54.4CsCl-15.3KCl-45.3LiCl мас. %.
Характер селективного анодного растворения
533
а
б
×100 100 мкм
×1000
10 мкм
в
г
×1000
10 мкм
×1000
10 мкм
Рис. 1. Микрофотография поверхности исходных образцов: а) сплав 50Сu-50Al (мас. %); б) латунь Л63;
в) мельхиор; г) монель.
Смеси солей готовили сплавлением расчетных количеств солей марки ”х. ч”, пред
варительно переплавленных на воздухе, а затем подвергнутых трехкратной зонной
плавке в токе сухого очищенного аргона. Затем проводили сушку солей при темпера
туре 200°С в атмосфере аргона (чистотой 99.9%), на протяжении 4 х ч, для удаления
адсорбированной влаги при размоле и смешивании солей. Хранили соли в герметич
ном вакуумном эксикаторе во избежание поглощения влаги ввиду сильной гигроско
пичности солей лития.
Образцы сплавов предварительно обрабатывали мелкодисперсной шлифовальной
бумагой, обезжиривали и сушили спиртово ацетоновой смесью. Массу исследуемых
образцов измеряли на аналитических весах до и после эксперимента.
Циклические вольтамперные зависимости были сняты на приборе AutoLab PGSTAT 30
со скоростью развертки 10 и 15 мВ/с.
После эксперимента образцы отмывали от остатка хлоридных солей раствором
0.05 М соляной кислоты. Поверхность образцов исследовали при помощи сканирую
щего электронного микроскопа “JSM 5900 LV” (Jeol, Япония) и с помощью рентгено
фазового анализа проводимого на дифрактометре “Rigaku D/MAX 2200VL/PC”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Циклическая вольтамперометрия. Перед снятием циклической вольтамперной за
висимости фиксировали значение потенциала разомкнутой цепи (после погружения
электродов в расплав и выдержки 30 мин для установления равновесия в системе. Изме
рения проводились относительно хлорид серебряного электрода сравнения (табл. 2).
534
Э. А. Карфидов, Е. В. Никитина, Н. А. Казаковцева, Л.М. Бабушкина
I, мА
20
f
15
d
10
e
5
b c
a
0
5
10
15
20
-1
0
1
E, В
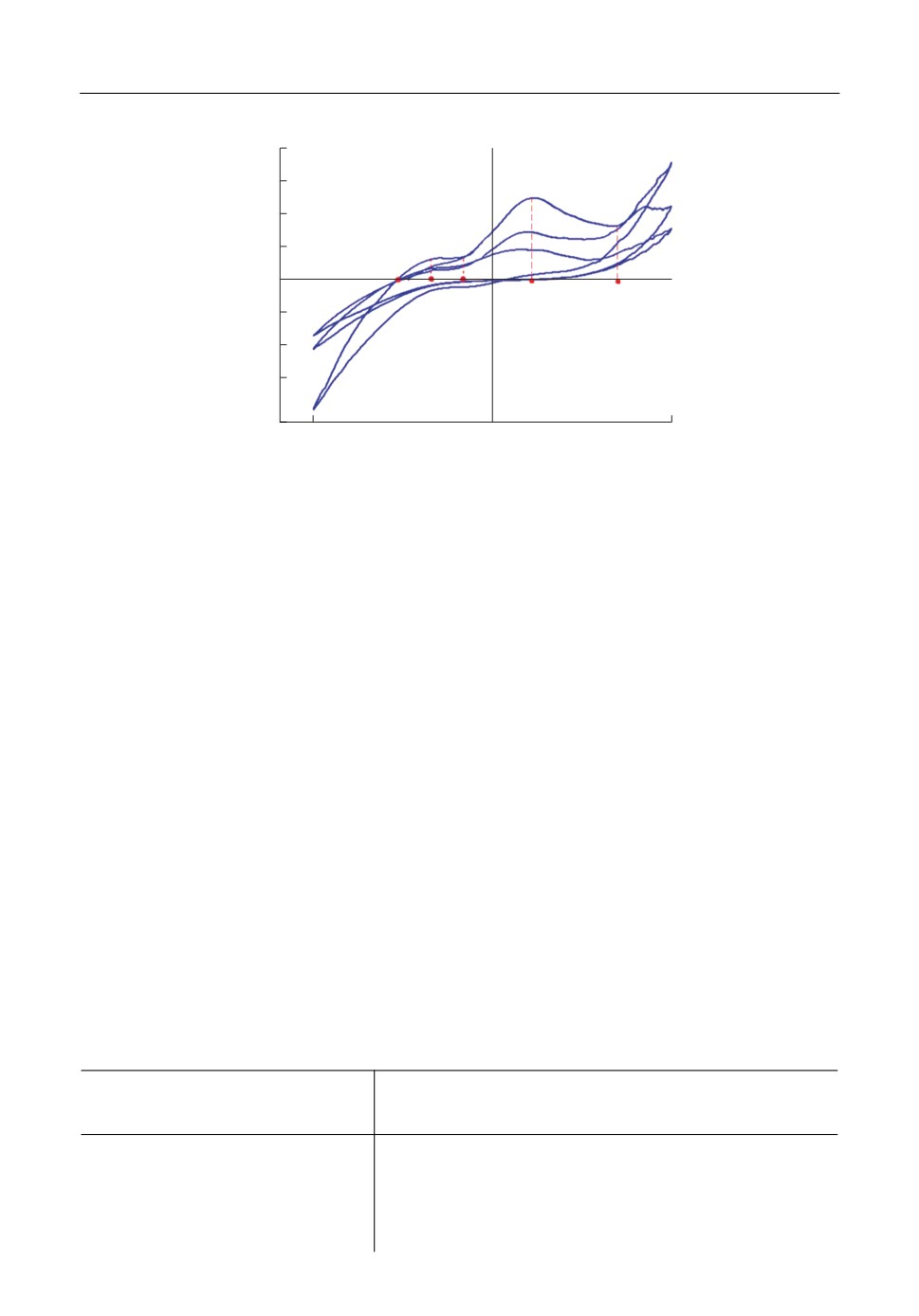
Рис. 2. Циклическая вольтамперная зависимость для образцов из латуни Л63 в хлоридном расплаве при
500°С со скоростью развертки 15 мВ/с, три цикла.
Наиболее электроотрицательный потенциал имеет медно алюминиевый сплав, что
является предпосылкой к наиболее активному протеканию анодного растворения
электроотрицательного компонента (Al) из сплава.
Для определения характера процессов, протекающих при анодной поляризации,
были сняты циклические вольтамперные зависимости для медно цинкового, медно
алюминиевого и медно никелевого сплавов в хлоридном расплаве при 500°С. Следует
отметить, что наиболее информативным является первый цикл, а также то, что ско
рость развертки не влияет на характер вольтамперной зависимости из за необратимо
сти процесса анодного растворения (рис. 2).
Кроме того, пассивности при малых перенапряжениях в выбранных солевых элек
тролитах не наблюдается.
По данным циклических вольтамперных кривых определяются стадии анодного
процесса в зависимости от перенапряжения. Например, для образца латуни Л63
(рис. 2) можно выделить следующие процессы, которым соответствуют участки на
графике:
1) селективное вытравливание электроотрицательного компонента сплава (a-b);
2) перестройка поверхности (b-c);
3) выделение цинка из очагов коррозии (с-d);
Таблица 2
Потенциалы разомкнутой цепи (потенциалы коррозии) для исследуемых сплавов
Потенциал разомкнутой цепи, В
Сплав
Относительно хлорсеребряного электрода сравнения
50Cu-50Al
-1.43
Л63
-0.58
Мельхиор
-0.91
Монель
-0.83
Характер селективного анодного растворения
535
0.008
0.006
0.004
0.002
0
0.002
0.004
0.006
0.008
-1.8
-1.6
-1.4
-1.2
-1.0
-0.8
-0.6
Приложенный потенциал, В
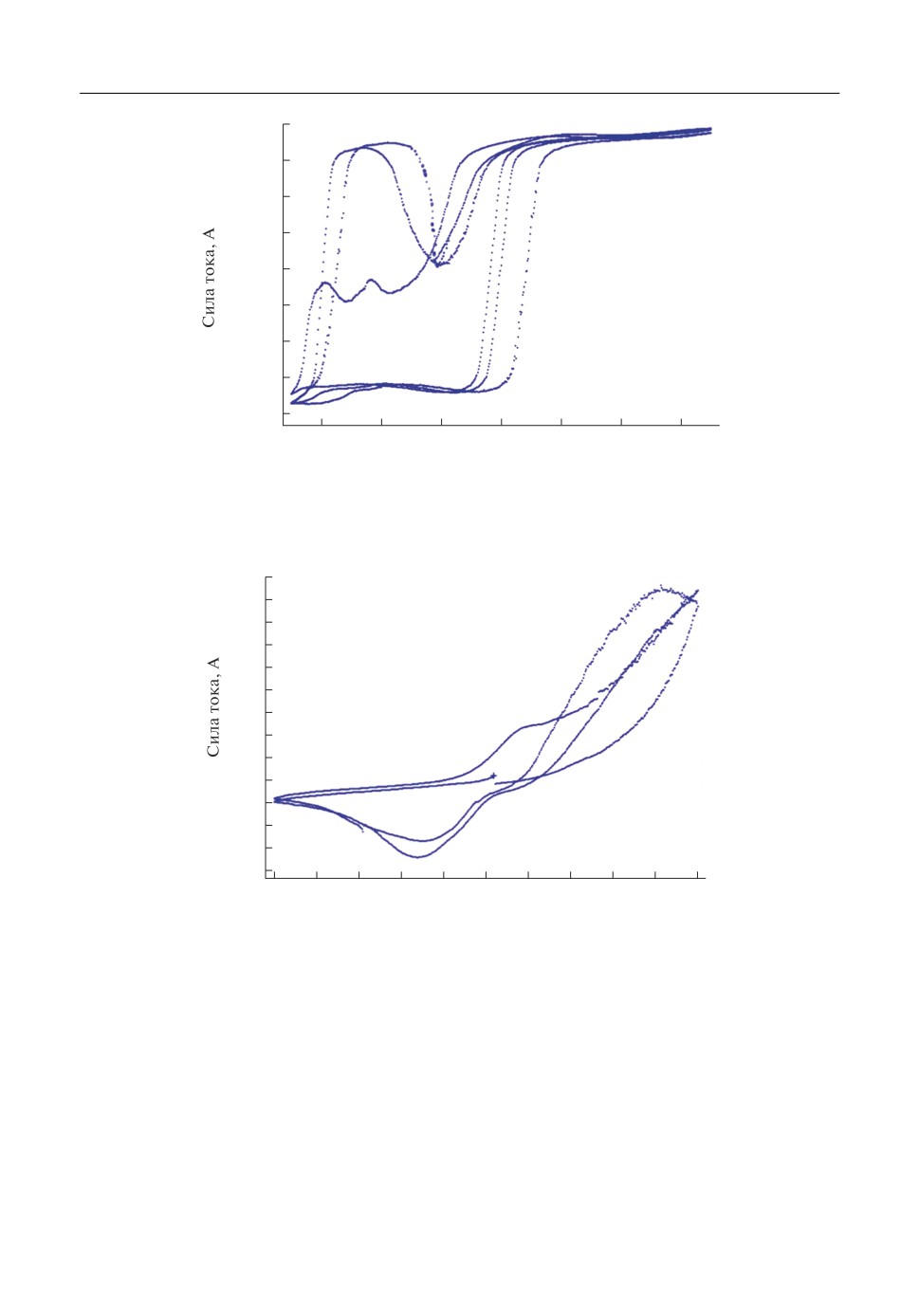
Рис. 3. Циклическая вольтамперная зависимость для образца из сплава Cu-Al в хлоридном расплаве при
500°С со скоростью развертки 10 мВ/с.
0.45
0.40
0.35
0.30
0.25
0.20
0.15
0.10
0.05
0
0.05
0.10
0.15
0.20
-1.5 -1.4 -1.3 -1.2 -1.1 -1.0 -0.9 -0.8 -0.7 -0.6 -0.5
Приложенный потенциал, В
Рис. 4. Циклическая вольтамперная зависимость для образца из сплава M65 в хлоридном расплаве при
500°С со скоростью развертки 10 мВ/с.
4) пассивация (d-е);
5) совместное выделение металлов (e-f).
Подобное протекания процессов при растворении подтверждается данными полу
ченными в потенциостатическом режиме анодного растворения при различных фик
сированных потенциалах в области a-b (+0.1 В); b-c (+0.2 В) с-d (+0.5 В); Медно
алюминиевый сплав проявляет отчетливую склонность к пассивации в хлоридном
расплаве уже при малых перенапряжениях, как показано на рис. 3.
На рис. 4, 5 приведены циклические вольтамперные зависимости для сплавов мо
нель (М35) и мельхиор (М65) в хлоридном расплаве.
536
Э. А. Карфидов, Е. В. Никитина, Н. А. Казаковцева, Л.М. Бабушкина
I, мА
200
150
100
50
0
50
-1.0
-0.5
0
0.5
E, В
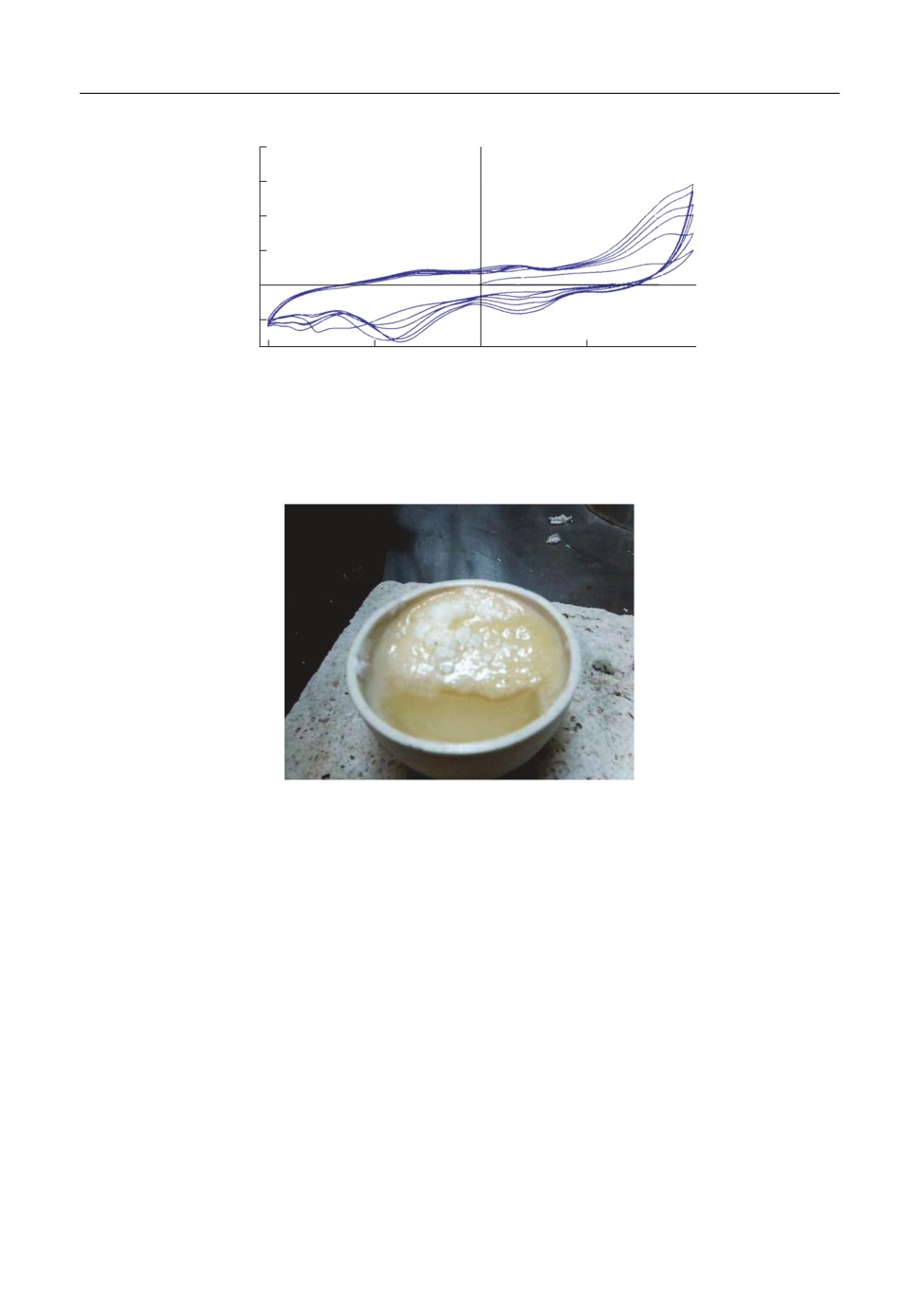
Рис. 5. Циклическая вольтамперная зависимость для образца из сплава M35 в хлоридном расплаве при
500°С со скоростью развертки 10 мВ/с (6 циклов).
Рис. 6. Расплав, извлеченный из ячейки после циклической вольтамперометрии медно алюминиевого
сплава.
Наиболее интересные результаты демонстрировал именно медно алюминиевый
сплав, при селективном растворении которого в хлоридах уже при небольшом перена
пряжении начинает вспениваться расплав на границе сплав-расплав (рис. 6).
Подобное поведение можно объяснить тем, что выделяющийся электроотрицатель
ный компонент (Al) в результате анодного растворения переходит в ионное состояние
Al3+ и образует соединение с ионами расплава - AlCl3. Хлорид алюминия имеет темпе
ратуру кипения 183°С. Переход AlCl3 (возможно в виде димера Al2Cl6) в газовую фазу
приводит к вспениванию на границе раздела фаз, тем самым затрудняя доступ элек
тролита к поверхности, что в свою очередь вызывает пассивность анода.
Латунь Л63 в хлоридном расплаве является наиболее перспективным материалом для
изучения анодного селективного растворения в связи с отсутствием пассивации при малых
напряжениях. Для этого материала характерна высокая скорость растворения и возмож
ность поддерживать тот или иной желаемый процесс, обуславливающий формирование
требуемой морфологии поверхности приложением заданного перенапряжения. Несмотря
Характер селективного анодного растворения
537
а
б
×1000
10 мкм
×1000 10 мкм
в
г
×1000
10 мкм
×1000
10 мкм
Рис. 7. Микрофотография поверхности образцов медных сплавов после анодного селективного растворения
в расплаве CsCl-KCl-LiCl: а) Л63; б) Сu-Al; в) монель М35; г) мельхиор М65.
на меньшую разность потенциалов, геометрическая плотность тока (показатель интенсив
ности анодного растворения) значительно выше на латуни, чем на других сплавах.
На рис. 7 изображена поверхность образцов различных медных сплавов после се
лективного растворения, проводимого при геометрической плотности тока 200 А/м2 и
температуре 500°С в расплаве хлоридов щелочных металлов.
Результаты микрорентгеноспектрального анализа показывают, что на формирование
морфологии поверхности значительное влияние оказывает природа и количество вто
рого компонента сплава, а также выбор состава высокотемпературного электролита.
Для медно цинкового сплава Л63 в хлоридных расплавах с увеличением содержа
ния электроотрицательного компонента (цинк), степень развития поверхности
уменьшается.
Для медно никелевых сплавов М65 и М35 характерно формирование развитого
слоя никеля и обеднение по меди в хлоридном расплаве. Объясняется это тем, что не
смотря на то, что в низкотемпературных растворах никель электроотрицательнее ме
ди, в хлоридном расплаве потенциал для окисления металлической меди до ближай
шей степени окисления примерно на 0.1 В отрицательнее, чем для никеля [16], и дан
ная разность потенциалов увеличивается с повышением температуры процесса.
Выделение ионов Cu+ является отличительной способностью расплавов, что в свою
очередь позволяет получать развитую поверхность никеля, обедненную по меди, что
является невозможным для традиционных низкотемпературных электролитов анод
ного селективного растворения на водной основе. Феномен солевой пассивации в
хлоридных расплавах требует тщательного дополнительного изучения.
538
Э. А. Карфидов, Е. В. Никитина, Н. А. Казаковцева, Л.М. Бабушкина
В данном случае увеличение содержания никеля в сплаве так же, как и в случае с ла
тунями, приводит к формированию более развитой поверхности в хлоридном расплаве.
Медно алюминиевый сплав по своим термодинамическим свойствам мог бы
явиться самым перспективным объектом для анодного растворения с формированием
высокопористой поверхности. Однако, как описано выше, в хлоридном расплаве дан
ный образец пассивируется уже при малых перенапряжениях, и в гальваностатиче
ском режиме, где приложенные плотности тока значительно выше, морфология по
верхности почти не изменяется в течение процесса селективного растворения.
ЗАКЛЮЧЕНИЕ
1. Было изучено поведение сплавов на основе меди (Л63, мельхиор, монель и
Cu⎯Al) в высокотемпературных солевых электролитах различного состава в гальвано
статическом режиме.
2. Наиболее перспективным сплавом на основе меди для получения нанопористых
и мезопористых материалов в солевых расплавах является латунь Л63.
3. Наименьшим средним размером пор обладали образцы из латуни Л63 в экспери
ментах с хлоридным расплавом в гальваностатическом режиме. Размер пор составил -
1.1 мкм (при заданных условиях - 200 А/м2, 500°С).
Работа выполнена при финансовой поддержке Российского Фонда фундаменталь
ных исследований № 17 03 00715 А.
СПИСОК ЛИТЕРАТУРЫ
1. К о л о т ы р к и н Я . М . Питтинговая коррозия металлов // Защита металлов. 1975. 11.
№ 6. С. 675-686.
2. К о л о т ы р к и н Я . М . Механизм анодного растворения гомогенных и гетерогенных
металлических материалов // Защита металлов. 1983. 19. № 5. С. 675-685.
3. К о л о т ы р к и н Я . М . О механизме взаимного влияния компонентов металлических
сплавов на кинетику их анодного растворения в растворах электролитов // Электрохи
мия.1992. 28. № 6. С. 939-943.
4. Tr o n g O n D . , D e s p l a n t i e r G i s c a r d D . , D a n u m a h C . , K a l i a g u i n e S .
Perspectives in catalytic applications of mesostructured materials // Applied Catalysis A: General.
2003. 253. P. 545-602.
5. B r y c e C . Ta p p a n , S t e p h e n A . S t e i n e r I I I , E r i k P. L u t h e r. Nanoporous
metal foams // Angew. Chem. Int. Ed. 2010. 49. P. 4544-4565.
6. J i n t a o Z h a n g , C h a n g M i n g L i . Nanoporous metal: fabrication strategies and ad
vanced electrochemical applications in catalysis, sensing and energy system // Chem. Soc. Rev. 2012.
41. P. 7016-7031.
7. Z h a n g Q . , Z h a n g Z . On the electrochemical dealloying of Al based alloys in a NaCl
aqueous solution // J. Phis. Chem. Chem. Phis. 2010. 12. P. 1453-1472.
8. M . H a k a m a d a , M . M a b u c h i . Preparation of nanoporous Ni and Ni-Cu by dealloying
of rolled Ni-Mn and Ni-Cu-Mn alloys // J. Alloys and Compounds. 2009. 485. № 1-2. P. 583-585.
9. Wa n g Y. , X u J . , W u B o . Electrochemical dealloying of Al2(Au, X) (X = Pt, Pd, PtPd,
Ni, Co and NiCo) alloys in NaCl aqueous solution // J. Phis. Chem. Chem. Phis. 2013. 15. P. 5499-
5509.
10. Х о б о т о в а Э . Б . , Е г о р о в а Л . М . Закономерности электрохимического раство
рения сплава Л 62 в хлоридных растворах // Электронная обработка материалов. 2014. 50.
№ 1. P. 39-44.
11. З у н г Ч . Ф . , Ту т у к и н а Н . М . , М а р ш а к о в И . К . Склонность латуней к обес
цинкованию в хлоридных средах // Конденсированные среды и межфазные границы. 2009.
11. № 4. C. 349-353.
12. Б а н н ы х О . А . , Б у д б е р г П . Б . , А л и с о в а С . П . и д р . Диаграммы состоя
ния двойных и многокомпонентных систем на основе железа. Металлургия, 1986.
Характер селективного анодного растворения
539
13. D u P. , L i J . , Z h a o Y. , D a i Y. , Ya n g Z h . , Ti a n Y. Corrosion characteristics
of Al alloy/galvanized steel couple in NaCl solution // Int. J. Electrochem. Sci. 2018. 13. Р. 11164-
11179.
14. P i c k e r i n g H . W. , Wa g n e r C . J . Electrolytic dissolution of binary alloys containing a
noble // J. Electrochem. Soc. 1967. 114. № 7. P. 698-706.
15. А н д р е е в Ю . Я . Описание диффузии в бинарном сплаве при его массообмене с
внешней средой // Доклады АН СССР. 1984. 278. № 5. С.1153-1155.
16. С м и р н о в М . В . Электродные потенциалы в расплавленных хлоридах. М.: Наука,
1973.
Character of Selective Anodic Solution. Influence of Alloy Composition
E. A. Karfidov1, 2, E. V. Nikitina1, 2, N. A. Kazakovtseva1, L. M. Babushkina2
1Institute of High Temperature Electrochemistry of the Ural Branch of RAS, Yekaterinburg, Russia
2Ural Federal University named B.N. Yeltsin, Yekaterinburg, Russia
The corrosion electrochemical behavior of copper based alloys (L63, Cu-Ni-Zn alloy,
monel and Cu-Al) in high temperature salt electrolytes of various compositions in the gal
vanostatic mode was studied. The most promising copper based alloy for producing nanop
orous and mesoporous materials in salt melts is brass L63; the smallest average pore size had
samples of brass L63 in experiments with chloride melt; in the galvanostatic mode, the pore
size was 500 nm (under specified conditions 200 A/m2, 350°C); The results of cyclic voltam
metry can be used to predict the nature of electrochemical destruction and analysis of the
stages of conjugate anode processes. It was found that the nature of the second component of
the alloy affects the nature of electrochemical destruction and the formation of a developed
surface layer of the studied alloys.
Keywords: copper alloys, electrochemical destruction, chloride melt, corrosion, temper
ature, surface morphology
REFERENCES
1. Kolotyrkin Ya. M. Pittingovaya korroziya metallov [Pitting corrosion of metals // Protection of
metals] // Zashchita metallov. 1975. 11. № 6. P. 675-686. (in Russian).
2. Kolotyrkin Ya.M. Mekhanizm anodnogo rastvoreniya gomogennykh i geterogennykh metalli
cheskikh materialov [The mechanism of anodic dissolution of homogeneous and heterogeneous me
tallic materials] // Zashchita metallov. 1983. 19. № 5. P. 675-685. (in Russian).
3. Kolotyrkin Ya.M. O mekhanizme vzaimnogo vliyaniya komponentov metallicheskikh splavov na
kinetiku ikh anodnogo rastvoreniya v rastvorakh elektrolitov [On the mechanism of the mutual influ
ence of the components of metal alloys on the kinetics of their anodic dissolution in electrolyte solu
tions] // Elektrokhimiya. 1992. 28. № 6. P. 939-943. (in Russian).
4. Trong On D., Desplantier Giscard D., Danumah C., Kaliaguine S. Perspectives in catalytic ap
plications of mesostructured materials // Applied Catalysis A: General. 2003. 253. P. 545-602.
5. Bryce C. Tappan, Stephen A. Steiner III, Erik P. Luther. Nanoporous metal foams // Angew.
Chem. Int. Ed. 2010. 49. P. 4544-4565.
6. Jintao Zhang, Chang Ming Li. Nanoporous metal: fabrication strategies and advanced electro
chemical applications in catalysis, sensing and energy system // Chem. Soc. Rev. 2012. 41. P. 7016-
7031.
7. Zhang Q., Zhang Z. On the electrochemical dealloying of Al based alloys in a NaCl aqueous so
lution // J. Phis. Chem. Chem. Phis. 2010. 12. P. 1453-1472.
8. Hakamada M., Mabuchi M. Preparation of nanoporous Ni and Ni-Cu by dealloying of rolled
Ni-Mn and Ni-Cu-Mn alloys // J. Alloys and Compounds. 2009. 485. № 1-2. P. 583-585.
9. Wang Y., Xu J., Wu Bo. Electrochemical dealloying of Al2(Au, X) (X = Pt, Pd, PtPd, Ni, Co and
NiCo) alloys in NaCl aqueous solution. // J. Phis. Chem. Chem. Phis. 2013. 15. P. 5499-5509.
540
Э. А. Карфидов, Е. В. Никитина, Н. А. Казаковцева, Л.М. Бабушкина
10. Khobotova E.B., Yegorova L.M. Zakonomernosti elektrokhimicheskogo rastvoreniya splava
L 62 v khloridnykh rastvorakh [Patterns of electrochemical dissolution of the L 62 alloy in chloride
solutions] // Elektronnaya obrabotka materialov. 2014. 50. № 1. P. 39-44. (in Russian).
11. Zung Ch.F., Tutukina N.M., Marshakov I.K. Sklonnost’ latuney k obestsinkovaniyu v khlorid
nykh sredakh [The tendency of brass to dezincification in chloride environments] // Kondensirovan
nyye sredy i mezhfaznyye granitsy. 2009. 11. № 4. P. 349-353. (in Russian).
12. Bannykh O.A., Budberg P.B., Alisova S.P. et al. Diagrammy sostoyaniya dvoynykh i mnogoko
mponentnykh sistem na osnove zheleza [State diagrams of binary and multicomponent systems based
on iron]. Metallurgiya, 1986. (in Russian).
13. Du P., Li J., Zhao Y., Dai Y., Yang Zh., Tian Y. Corrosion characteristics of Al alloy/galva
nized steel couple in NaCl solution // Int. J. Electrochem. Sci. 2018. 13. Р. 11164-11179.
14. Pickering H.W., Wagner C.J. Electrolytic dissolution of binary alloys containing a noble //
J. Electrochem. Soc. 1967. 114. № 7. P. 698-706.
15. Andreyev Yu.Ya. Opisaniye diffuzii v binarnom splave pri yego massoobmene s vneshney sredoy
[Description of diffusion in a binary alloy during its mass transfer with the external environment] //
Doklady AN SSSR. 1984. 278. № 5. P. 1153-1155. (in Russian).
16. Smirnov M.V. Elektrodnye potentsialy v rasplavlennykh khloridakh [Electrode potentials in
molten chlorides]. M.: Nauka, 1973. (in Russian).