РАСПЛАВЫ
6 · 2019
УДК 544.623:544.6.018.42 143
ИЗУЧЕНИЕ ПЛАВЛЕНИЯ СМЕСЕЙ НАТРИЕВОГО КРИОЛИТА
С ФТОРИДАМИ АЛЮМИНИЯ, КАЛЬЦИЯ И ОКСИДОМ АЛЮМИНИЯ
© 2019 г. А. В. Руденкоa, *, А. А. Редькинa, С. В. Першинаa, Е. А. Ильинаa,
А. А. Катаевa, Ю. П. Зайковa, b
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
bУральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Екатеринбург, Россия
*e mail: a.rudenko@ihte.uran.ru
Поступила в редакцию 25.04.2019 г.
После доработки 08.05.2019 г.
Принята к публикации 21.05.2019 г.
Проведено изучение процессов плавления смесей натриевого криолита с фтори
дами алюминия, кальция и оксидом алюминия. Исследования проводились методом
дифференциальной сканирующей калориметрии (ДСК). Все изученные системы в
твердом состоянии имеют фазовые переходы, температурный диапазон которых за
висит от состава смеси. Обнаружено, что эндотермические пики плавления на кри
вых ДСК очень широкие, особенно в смесях, содержащих фторид кальция. Опреде
ленные температуры плавления эвтектических составов совпадают с литературными
данными, которые были получены другими методами.
Ключевые слова: криолит, плавление, эвтектика.
DOI: 10.1134/S0235010619060112
ВВЕДЕНИЕ
Расплавленные криолиты применяются в качестве электролита при промышлен
ном производстве алюминия благодаря высокой растворимости глинозема и высокой
электропроводности [1]. Однако их трудно использовать из за их относительно высо
кой коррозионной активности. Одним из способов решения этой проблемы является
создание защитного слоя из замороженных солей на стенках электролизера, но этот
слой или выступ нестабилен из за высоких тепловых потоков в ванне. Для контроля
толщины бокового выступа очень важно знать теплофизические свойства как жидко
го, так и замороженного электролита, а также характеристики процессов заморажива
ния и плавления [2].
Основным компонентом алюминиевой ванны является криолит, при этом все вво
димые в криолит компоненты понижают температуру ликвидуса. Ранее обнаружено,
что влияние добавок на температуру ликвидуса является неравномерным [3-6]. Так,
добавки фторида алюминия меняют температуру ликвидуса незначительно, однако
при криолитовых отношениях меньше 2.0 добавка фторида алюминия резко снижает
точку плавления. По этой причине температуры плавления, полученные разными ав
торами, значительно отличаются. Имеется мало данных, где изучались сложные сме
си, содержащие в качестве добавок одновременно фториды алюминия и кальция, а
также оксид алюминия. Целью данной работы являлось изучение процесса нагрева
ния и плавления смесей натриевого криолита с разными добавками.
542
А. В. Руденко, А. А. Редькин, С. В. Першина, Е. А. Ильина и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных компонентов для приготовления образцов использовали: NaF
(99.5%, ЗАО “ВЕКТОН), AlF3 (95.0%, ЗАО "ВЕКТОН”), Al2O3 (99.5%, ТСО АО “РУСАЛ
Ачинск”), CaF2 (99.5%, ЗАО “ВЕКТОН”). Фторид алюминия был очищен от кисло
родсодержащих примесей фторидом аммония в стеклоуглеродном тигле. Часть NH4F
(10% AlF3) помещали на дно тигля, а другую часть смешивали с фторидом алюминия в
следующем соотношении: 12 г NH4F на 100 г AlF3. Смесь нагревали до 450-500°C и
выдерживали при этой температуре около 6 ч. Реакцию взаимодействия оксида алю
миния с фторидом аммония можно записать в виде:
6NH4F + Al2O3 = 2AlF3 + 6NH3 + 3H2O.
Анализ содержания кислорода после очистки проводился с использованием эле
ментного анализатора LECO (США). Массовая доля кислорода составляла менее
0.1%. Чистота других реагентов была выше 99.5% по содержанию основного компо
нента, поэтому их дополнительная очистка не проводилась.
Для приготовления криолитов с фторидом кальция и оксидом алюминия фторид
алюминия смешивали с другими компонентами эвтектической смеси, помещали в
платиновый тигель и нагревали до 1050°C. Чтобы избежать окисления, в смесь было
добавлено небольшое количество NH4F. Фторид аммония разлагался при 240°C и не
влиял на состав итоговой смеси. Закалка расплава осуществлялась путем его отливки в
графитовую форму.
Исследования термических свойств натриевых криолитов проводили с использова
нием синхронного термического анализатора STA 449C Jupiter® (NETZSCH, Герма
ния), позволяющего синхронно фиксировать изменение массы образца и кривой
дифференциально сканирующей калориметрии (ДСК). Экспериментальная установ
ка обеспечивает высокую точность измерения заданных параметров и откалибрована
с использованием чистых солей, поставляемых NETZSCH. Монокристаллический сап
фир был использован для калибровки чувствительности. Измерения проводились в сле
дующих условиях: температурный интервал - 35-1100°C; скорость нагрева - 10°C мин-1;
атмосфера - чистый аргон (ос. ч.); тигли с крышкой - Pt-Rh. Полученные данные бы
ли обработаны с помощью программного обеспечения NETZSCH Proteus.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В рамках исследования были получены и рассмотрены натриевые криолиты с фтори
дами алюминия (AlF3) и кальция (CaF2), а также глиноземом (Al2O3); их составы приве
дены в табл. 1. Фазовые диаграммы этих систем широко изучены в работах [3-8].
На рис. 1 представлены кривые ДСК и термогравиметрии (ТГ) для криолитов си
стемы Na3AlF6-Al2O3 с различным содержанием добавки оксида алюминия. Потеря
массы наблюдалась только после точки плавления, и ее значение составляло от 0.6 до
2.0%. При температурах 558 и 559°C наблюдается эндотермический пик, который от
носится к фазовому превращению α/β криолит. Его температура хорошо согласуется
с литературными данными [3-8]. При более высокой температуре наблюдается вто
рой эндотермический пик, относящийся к плавлению исследуемых образцов. Мы ру
ководствовались температурами начала пиков, которые характеризуют начало про
цесса, (рис. 1а), и определяются как точки пересечения касательных основной (базо
вой) линии ДСК и плеч пика.
Затем было изучено термическое поведение натриевого криолита с добавкой фто
рида кальция и глинозема. Потеря массы наблюдалась также только после плавления
образца, и ее значение составляло от 0.7 до 3.0%. Кривые, содержащие фторид каль
Изучение плавления смесей натриевого криолита
543
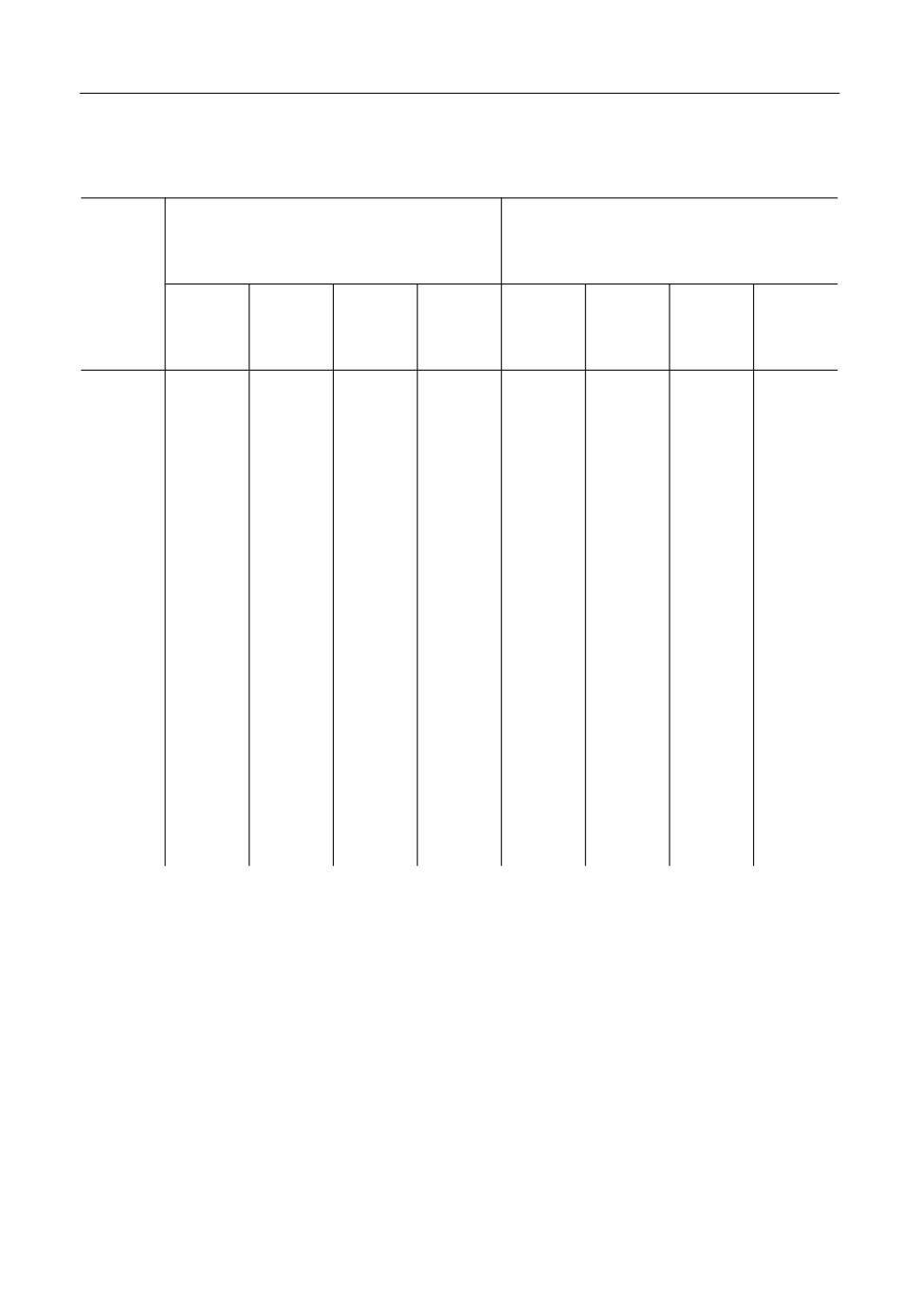
Таблица 1
Состав полученных образцов
Состав, мас. %
Состав, мол. %
№
NaF
AlF3
CaF2
Al2O3
NaF
AlF3
CaF2
Al2O3
1
58.2
38.8
0.0
3.0
73.8
24.6
0.0
1.6
2
56.4
37.6
0.0
11.7
70.5
23.5
0.0
6.0
3
50.5
33.6
10.0
5.9
67.2
22.4
7.2
3.2
4
46.2
30.8
19.9
3.1
62.8
21.0
14.6
1.7
5
43.1
53.9
0.0
3.0
60.5
37.8
0.0
1.8
6
38.5
61.5
0.0
0.0
55.6
44.4
0.0
0.0
7
43.5
32.2
21.8
2.5
60.1
22.3
16.2
1.4
ция, имеют эндотермические пики в интервале 787-807°C. Федотьев и Ильинский [8]
обнаружили две температурные остановки на кривых охлаждения в этой области для
составов, содержащих фторид кальция. Фазовый переход в этой области также был за
фиксирован Хольмом [7]. В исследуемых образцах α/β переход криолита отсутствует.
Этот переход хорошо представлен в квазибинарных смесях, таких как Na3AlF6-
Al2O3, Na3AlF6-AlF3 и Na3AlF6-CaF2. Для многокомпонентных смесей характерны
другие пики на кривых ДСК. Крейг [6] исследовал восемь составов эвтектических
смесей Na3AlF6-AlF3-CaF2-Al2O3, богатых по фториду кальция. Было установлено,
что эндотермические пики ДСК для этих смесей появляются только при 675°C. Полу
ченные в настоящей работе пики плавления достаточно широкие, однако такие же
пики наблюдались и другими учеными [7, 9]. Особенно широкие пики характерны для
составов, содержащих фторид кальция. Точки плавления исследуемых смесей хорошо
согласуются с результатами, представленными в литературе [3].
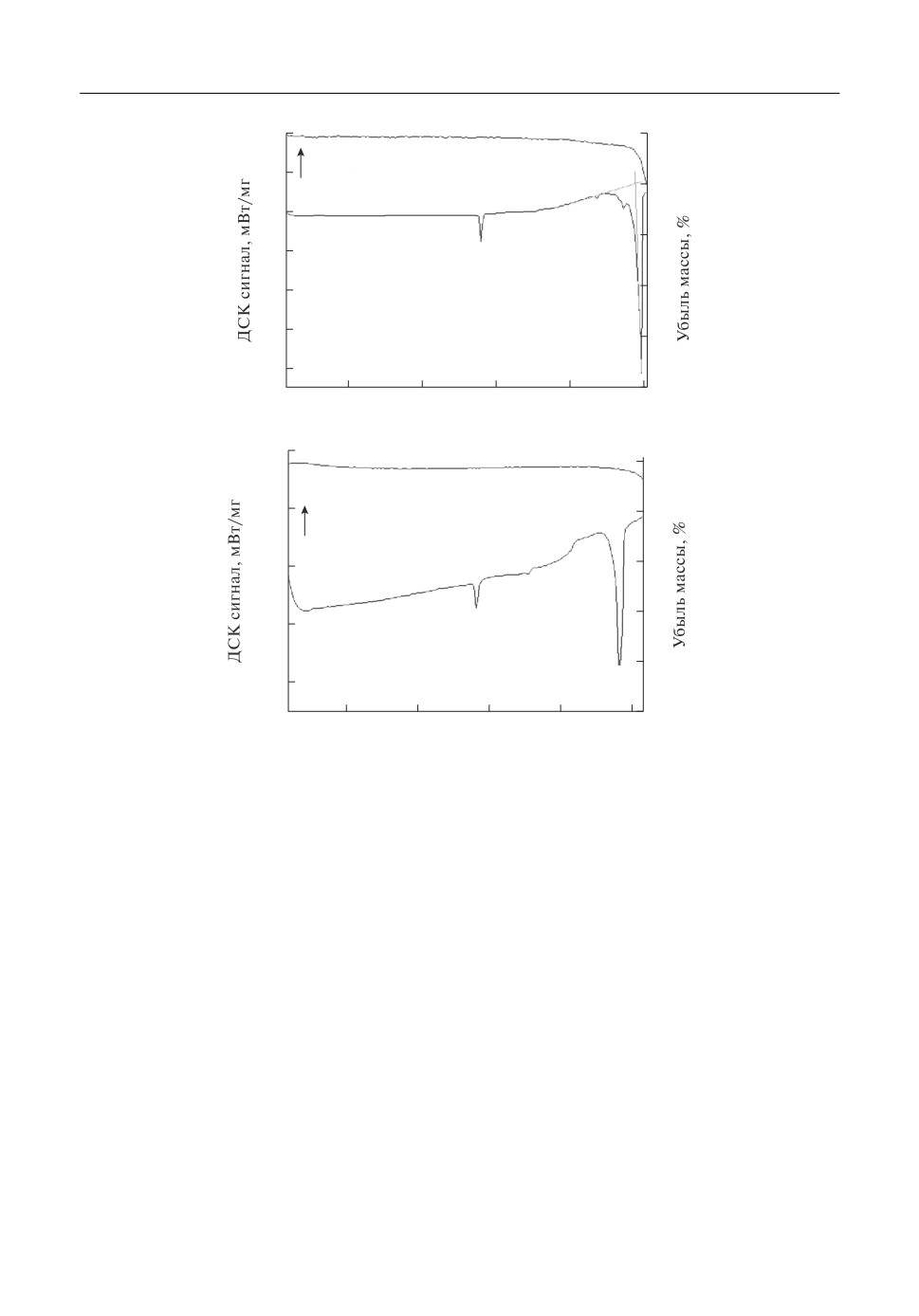
ДСК кривые натриевого криолита с добавлением фторида алюминия представлены
на рис. 3. На рис. 3б наблюдается небольшой эндотермический пик при 554°C, кото
544
А. В. Руденко, А. А. Редькин, С. В. Першина, Е. А. Ильина и др.
а
2
100
Экзо
1
T = 981 C
98
T = 559 C
0
96
1
2
94
3
92
4
90
200
400
600
800
1000
T, C
0.4
б
100
0.2
98
T = 929 C
Экзо
96
T = 558 C
0
94
0.2
92
0.4
90
200
400
600
800
1000
T, C
Рис. 1. ДСК и ТГ кривые криолитов системы Na3AlF6-1.6 мол. % Al2O3 (а) и Na3AlF6-6.0 мол. % Al2O3 (б).
рый, как было указано ранее, относится к α/β фазовому переходу в криолите. В интер
вале температур 685-717°C наблюдается эндотермический пик, относящийся к плав
лению образца. Для образцов на рис. 3а и 3в этот пик раздвоенный. Кривые ДСК, по
лученные для составов с низким мольным отношением NaF к AlF3 значительно
отличаются от остальных. Здесь отсутствуют пики, соответствующие α/β переходу
криолита, что соответствует фазовой диаграмме NaF-AlF3 [4]. Пики плавления здесь
более узкие и их площадь гораздо меньше, что указывает на меньшую величину тепло
ты плавления. На рис. 4 представлена ДСК кривая для криолита сложного состава
NaF-AlF6-CaF2 -Al2O3. Наблюдается эндотермический пик при 565°C (α/β фазовый
переход) и раздвоенный пик плавления образца. Стоить отметить, что эндотермиче
ских пиков в районе 780-800°C, присутствующих на ДСК кривых для системы с фто
ридом кальция (рис. 2), не наблюдается.
Полученные в ходе исследования кривые ДСК характерны для диаграммы NaF-AlF3,
форма которой аналогична диаграммам тригалогенидов редкоземельных металлов с
галогенидами щелочных металлов, которые хорошо изучены методами ДСК [10].
Изучение плавления смесей натриевого криолита
545
а
100
0
T = 785 C
98
1
96
94
2
T = 946 C
92
3
90
200
400
600
800
T, C
2
б
100
1
95
T = 806 C
0
90
1
T = 938
C
2
85
200
400
600
800
1000
T, C
Рис. 2. ДСК и ТГ кривые
криолитов Na3AlF6-7.2 мол. % CaF2-3.2 мол. % Al2O3 (а) и Na3AlF6-
14.6 мол. % CaF2-1.7 мол. % Al2O3 (б).
В процессе измерения регистрировалась также убыль массы. На всех графиках вид
но, что существенная убыль массы образца наблюдается только тогда, когда весь обра
зец находится в расплавленном состоянии. В эвтектических смесях это происходит на
вершине пика плавления (рис. 1б, 2 и 4).
ВЫВОДЫ
1. При выполнении работы были получены натриевые криолиты с различными до
бавками - фторидами кальция и алюминия, и оксида алюминия.
2. Методом ДСК исследованы термические свойства криолитов различного состава.
3. Установлены температуры фазовых переходов (α/β), которые согласуются с лите
ратурными данными, а также получены новые данные по температурам плавления
криолитов системы Na3AlF6-AlF3-CaF2-Al2O3, как по данным ДСК, так и по данным
термогравиметрии.
Работа выполнена при поддержке РФФИ (грант № 18 03 00785 А).
546
А. В. Руденко, А. А. Редькин, С. В. Першина, Е. А. Ильина и др.
а
100
1
0
1
95
2
3
90
4
T = 680 C
5
T = 726 C
6
85
200
400
600
800
T, C
1
б
100
0
T = 684 C
98
1
96
2
94
3
92
4
5
90
100
200
300
400
500
600
700
T, C
Рис. 3. ДСК и ТГ кривые криолитов 60.5 мол. % NaF-37.8 мол. % AlF6-1.8 мол. % Al2O (а), 55.6 мол. % NaF-
44.4 мол. % AlF6 (б).
0.6
100
0.3
98
T = 926 C
0
96
T = 560 C
0.3
94
0.6
92
0.9
90
300
400
500
600
700
800
900
T, C
Рис. 4. ДСК и ТГ кривые криолита системы 60.1 мол. % NaF-22.3 мол. % AlF6-16.2 мол. % CaF2-
1.4 мол. % Al2O3.
Изучение плавления смесей натриевого криолита
547
СПИСОК ЛИТЕРАТУРЫ
1. T h o n s t a d J , F e l l n e r P, H a a r b e r g G M , H í ve s J , Kv a n d e H , S t e r t e n
A . Aluminium Electrolysis. Fundamentals of the Hall Héroult Process, 3rd Edition. Aluminium Ver
lag, Dusseldorf, 2001.
2. A l l a r d F, D e s i l e t s M , B l a i s A . // Thermochimica Acta. 2019. 671. Р. 89-102.
3. F e n e r t y A , H o l l i n g s h e a d E . Liquidus curves for aluminum cell electrolyte: III. Sys
tems Cryolite Alumina with Aluminum Fluoride and Calcium Fluoride // J Electrochem Soc. 1960.
107. Р. 993-997.
4. F o s t e r P. A . Phase Diagram of a Portion of the System Na3A1F6-AlF3-Al2O3 // J. The
American Ceramic Soc. 1975. 58. Р. 288-291.
5. F o s t e r P. A . Phase Equilibria in the System Na3AlF6-AlF3 // J. The American Ceramic Soc.
1970. 53. Р. 598-600.
6. C r a i g D , B r o w n J . Phase equilibria in the system CaF2-AlF3-Na3AlF6 and part of the
system CaF2-AlF3-Na3AlF6-Al2O3 // J. Am Ceramic Soc. 1980. 63. Р. 254-261.
7. H o l m J . The phase diagram of the system Na3AlF6-CaF2 and the constitution of the melt in
the system // Acta Chem Scand. 1968. 22. Р. 1004-1012.
8. F e d o t i e f f P. P. , I l j i n s k y W. P. Uber die Smellzbarkeit des ternaren Systems: Natrium
fluorid, Calciumfluorid, Aluminium Fluorid // Z. fur Anorg. und Allgem. Chemie. 1923. 129. Р. 93-
107.
9. Ti s s o t P. DTA determination of liquidus temperatures and Al2O3 and AlF3 content in cry
olitic melts. Thermochimica Acta 1994. 234. Р. 245-254.
10. R y c e r z L . // J. Thermal Analysis and Calorimetry. 2013. 113. Р. 231-238.
Study of Melting of Sodium Cryolite Mixtures
with Aluminum, Calcium Fluoride and Aluminum Oxide
A. V. Rudenko1, A. A. Red’kin1, S. V. Pershina1, E. A. Ilyina1,
A. A. Kataev1, Yu. P. Zaykov1, 2
1Institute of High Temperature Electrochemistry of the Ural Branch of RAS, Yekaterinburg, Russia
2Ural Federal University named B.N. Yeltsin, Yekaterinburg, Russia
The study of the melting processes of mixtures of sodium cryolite with aluminum fluo
rides, calcium and alumina was carried out. The studies were carried out by differential scan
ning calorimetry (DSC). All studied systems in the solid state have phase transitions, the
temperature range of which depends on the composition of the mixture. It was found that
the endothermic melting peaks on the DSC curves are very wide, especially in mixtures con
taining calcium fluoride. Certain melting points of eutectic compositions coincide with the
literature data that were obtained by other methods.
Keywords: cryolite, melting, eutectic
REFERENCES
1. Thonstad J, Fellner P, Haarberg GM, Híves J, Kvande H, Sterten A. Aluminium Electrolysis.
Fundamentals of the Hall Héroult Process, 3rd Edition. Aluminium Verlag, Dusseldorf, 2001.
2. Allard F, Desilets M, Blais A. // Thermochimica Acta. 2019. 671. Р. 89-102.
3. Fenerty A, Hollingshead E. Liquidus curves for aluminum cell electrolyte: III. Systems Cryo
lite Alumina with Aluminum Fluoride and Calcium Fluoride // J Electrochem Soc. 1960. 107.
Р. 993-997.
4. Foster P.A. Phase Diagram of a Portion of the System Na3A1F6-AlF3-Al2O3 // J. The Ameri
can Ceramic Soc. 1975. 58. Р. 288-291.
548
А. В. Руденко, А. А. Редькин, С. В. Першина, Е. А. Ильина и др.
5. Foster P.A. Phase Equilibria in the System Na3AlF6-AlF3 // J. The American Ceramic Soc.
1970. 53. Р. 598-600.
6. Craig D, Brown J. Phase equilibria in the system CaF2-AlF3-Na3AlF6 and part of the system
CaF2-AlF3-Na3AlF6-Al2O3 // J. Am Ceramic Soc. 1980. 63. Р. 254-261.
7. Holm J. The phase diagram of the system Na3AlF6-CaF2 and the constitution of the melt in the
system // Acta Chem Scand. 1968. 22. Р. 1004-1012.
8. Fedotieff P.P., Iljinsky W.P. Uber die Smellzbarkeit des ternaren Systems: Natriumfluorid, Cal
ciumfluorid, Aluminium Fluorid // Z. fur Anorg. und Allgem. Chemie. 1923. 129. Р. 93-107.
9. Tissot P. DTA determination of liquidus temperatures and Al2O3 and AlF3 content in cryolitic
melts. Thermochimica Acta 1994. 234. Р. 245-254.
10. Rycerz L. // J. Thermal Analysis and Calorimetry. 2013. 113. Р. 231-238.