РАСПЛАВЫ
6 · 2019
УДК 544.636/.638:544.723
ЕМКОСТЬ ЗОЛОТОГО ЭЛЕКТРОДА
В РАСПЛАВЛЕННЫХ СМЕСЯХ НИТРАТА И ХЛОРИДА КАЛИЯ
© 2019 г. Е. В. Кирилловаa, *, В. П. Степановa, b
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
bУральский федеральный университет им. Б.Н. Ельцина, Екатеринбург, Россия
*e)mail: e.kirillova@ihte.uran.ru
Поступила в редакцию 23.04.2019 г.
После доработки 16.05.2019 г.
Принята к публикации 02.06.2019 г.
В работе исследованы закономерности изменения емкости электрода от потен*
циала при разном содержании KCl в расплаве KNO3 и разной частоте переменного
сигнала. Показано, что в этих системах при определенном критическом потенциале
добавка KCl приводит к появлению дополнительного минимума на анодной ветви
емкостной кривой, и предложено объяснение этого эффекта.
Ключевые слова: золото, нитраты щелочных металлов, хлориды щелочных металлов,
потенциал минимума емкости, адсорбция.
DOI: 10.1134/S0235010619060070
ВВЕДЕНИЕ
Начиная с работ Гуи, исследователи уделяют большое внимание проблеме двойного
электрического слоя (ДЭС) для установления характера зависимости емкости ДЭС от
потенциала электрода, влияния на нее природы электрода и состава электролита. С
научной точки зрения эти сведения должны стать базой для развития представлений о
распределении зарядов и характере взаимодействия частиц в зоне контакта фаз. К на*
стоящему времени в научной литературе имеется большое число работ, посвященных
исследованию емкости ДЭС на ряде проводников первого рода в расплавленных со*
лях разной природы. Неоднозначные результаты получены для систем электрод*ион*
ная жидкость, в качестве которых выступают низкоплавкие соли органических кислот
и оснований [1-5]. Так, Ислам и др. [2, 3] наблюдали емкостные кривые выпуклой
формы на электродах из Pt и Au, в то время как U*образные кривые были найдены для
Hg и стеклоуглеродных электродов в одних и тех же электролитах. Бальделли [4], ко*
торый также исследовал Pt электрод в расплаве тетрафторбората имидазолия с помо*
щью электрохимической импедансной спектроскопии, сообщил о параболической
форме кривой емкость*потенциал с минимумом. Локкет c соавторами [5] исследовали
емкость стеклоуглерода в нескольких ионных жидкостях, содержащих анион хлора,
брома или иода. Их измерения показали, что кривые емкость*потенциал имеют два
максимума.
Большой массив данных имеется и для систем металл-расплав неорганической со*
ли [6-17]. Большинство этих исследований выполнено в эквимольной смеси NaCl-
KCl или в эвтектике LiCl-KCl с целью определения потенциалов нулевого заряда ме*
таллов в предположении аналогии точки минимума емкости потенциалу максимума
электрокапиллярной кривой. В указанных расплавах, как правило, зависимость емко*
сти, С, от потенциала, Е, выражается кривой, близкой к параболической форме, что
находится в соответствии с классической теорией Гуи-Штерна. Такие кривые получе*
550
Е. В. Кириллова, В. П. Степанов
ны для Мо, Ni, Be, Co, Fe, Cu, Cr, Zr, Ta, Ti и Mn [9, 11]. С-Е кривые с двумя миниму*
мами найдены для Pt и Au электродов в хлоридных расплавах [7, 12, 15-17], причем в
катодной области поляризаций они подчиняются теории Гуи*Штерна. Аномальное
поведение емкости в анодной области потенциалов объясняется особенностями ад*
сорбции анионов на заряженной поверхности.
Несмотря на большой объем исследований в индивидуальных нитратных распла*
вах, информации о свойствах границы раздела, полученной электрохимическими ме*
тодами, мало, и она, в основном, посвящена вольтамперометрическим измерениям
[18-23]. Имеющиеся к настоящему времени результаты по изучению свойств ДЭС на
твердых электродах в галогенидных расплавах получены только для систем, имеющих
один анион, который и составляет ближайший к металлу слой солевой обкладки двой*
ного слоя. Исследование зависимости этих свойств от концентрации галогенид*иона
может существенно дополнить информацию, полученную ранее в расплавах чистых
галогенидов. Поэтому в данной работе поставлена цель изучить влияние адсорбции
хлорид*иона на свойства поверхности при разном содержании его в нитратном рас*
плаве методом измерения емкости золотого электрода.
ЭКСПЕРИМЕНТ
Для приготовления рабочих электролитов использовались соли марок “х. ч” и “ч. д. а”.
Нитрат калия сушили под вакуумом при 383 К в течение 20 ч, хлорид калия подверга*
ли шестикратной зонной плавке в инертной атмосфере. Смесь навесок солей повтор*
но сушили под вакуумом в течение 4 ч, затем переплавляли в атмосфере аргона.
Измерения вели по трехэлектродной схеме. В качестве рабочего электрода исполь*
зовалась золотая проволока (Au 99.99) диаметром 1 мм, погруженная в расплав на глу*
бину 0.5 см. Электрод сравнения представлял собой платиновую проволоку, погру*
женную в исследуемый расплав, и исполнял функцию квазикислородного электрода
[23]. Поляризующий электрод - платиновая пластина. Пробирка и чехлы для термо*
пары изготовлены из кварцевого стекла. Все электроды и конструкционные материа*
лы перед добавлением электролита промывали водой и ацетоном, затем прокаливали
на воздухе.
Исходя из фазовой диаграммы смеси KNO3-KCl [24, 25] и данных по термической
устойчивости KNO3 [26], для эксперимента была выбрана температура 643 K, находя*
щаяся выше линии перитектического равновесия (629 [24] или 635 К [25]). Точка эв*
тектики, согласно [24], соответствует 6 мол. % KCl и 592 К; или, согласно [25] -
10 мол. % KCl и 581 К. Смеси KNO3 с 1, 5 и 10 мол. % KCl, исследованные в данной ра*
боте, находятся вблизи эвтектического состава.
Все измерения проводили в атмосфере очищенного аргона. Перед каждым экспе*
риментом ячейку с расплавом выдерживали при температуре 643 К не менее 2 ч для
установления равновесия, затем в течение еще 2 ч поляризовали до -0.1 В относитель*
но стационарного потенциала. После этого систему подвергали электрохимической
очистке с помощью последовательного циклирования потенциала. Полученная цик*
лическая вольтамперная кривая (ЦВА) служила для оценки интервала поляризаций, в
котором отсутствуют окислительно*восстановительные реакции и который соответ*
ствует двойнослойной области потенциалов. Время пребывания системы при крайних
анодных и катодных потенциалах было сведено к минимуму.
Измерения емкости проводили на скорости развертки потенциала 10 мВ/с при ам*
плитуде переменного сигнала 10 мВ в диапазоне частот 1-3 · 104 Гц. Исследования
проводились на потенциостате*гальваностате PARSTAT 2273.
Емкость золотого электрода в расплавленных смесях нитрата и хлорида калия
551
а
б
5
5
3
3
1
1
–1.2
-0.8
-0.41
0
0.4
0.8
-1.2
-0.8
-0.41
0
0.4
0.8
E, В
E, В
3
3
5
5
в
г
5
5
3
3
1
1
–1.2
-0.8
-0.41
0
0.4
0.8
-1.2
-0.8
-0.41
0
0.4
0.8
E, В
E, В
3
3
5
5
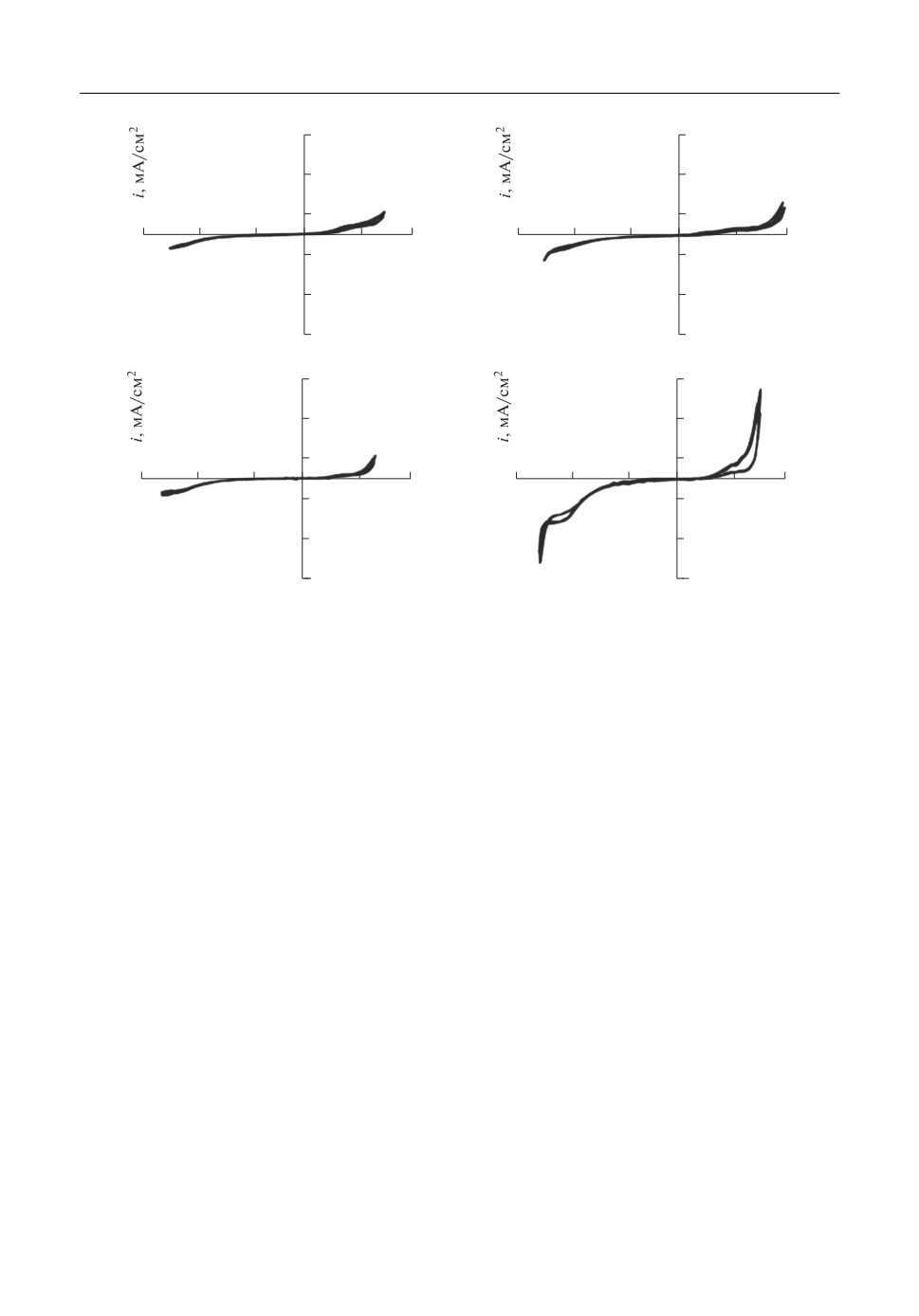
Рис. 1. ЦВА Au*электрода в расплаве KNO3 c добавкой 0 (а), 1 (б), 5 (в) и 10 (г) мол. % KCl.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Поляризационные кривые для золотого электрода в исследуемых расплавах приве*
дены на рис. 1. Они показывают, что в интервале - -0.4…+0.4 В нет явно выраженных
фарадеевских процессов, и весь ток идет на заряжение двойного электрического слоя.
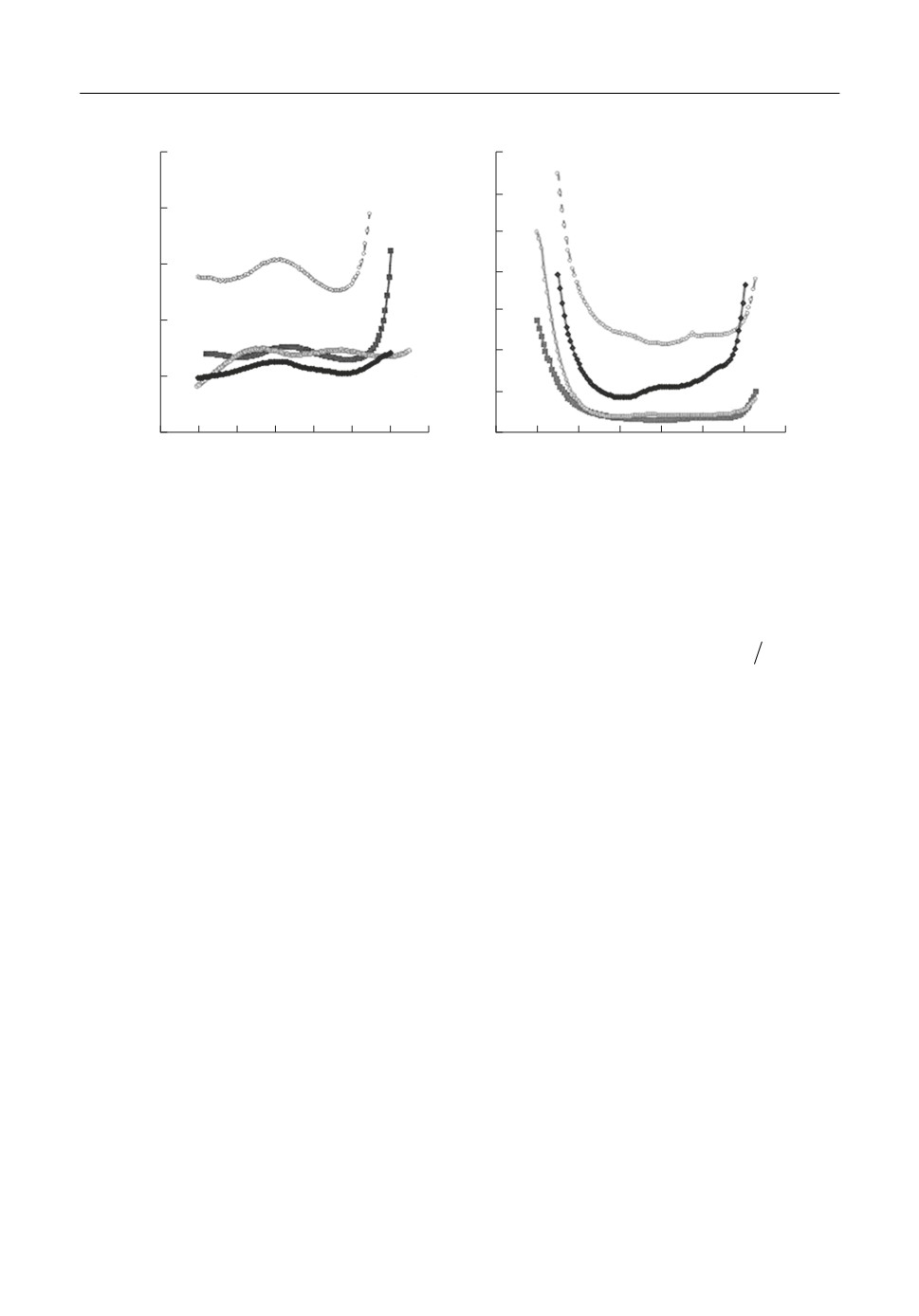
Для этого интервала потенциалов зависимость емкости двойного электрического
слоя, С, от приложенного потенциала, Е, для каждого расплава имеет сложный вид
(рис. 2). При сдвиге потенциала от крайней катодной границы в сторону положитель*
ных значений емкость уменьшается, достигает некоторого минимального значения и
затем увеличивается. Этот участок кривой хорошо соотносится с теорией Гуи-Штер*
на, которая предполагает, что электрод представляет собой заряженную стенку, а взаи*
модействие между заряженными частицами описывается кулоновскими силами. Тео*
рия предусматривает, что потенциал минимума емкости (ПМЕ) по своему смыслу со*
ответствует потенциалу нулевого заряда (ПНЗ). Однако классический ход емкостной
кривой нарушается при дальнейшем удалении потенциала от ПМЕ: положительнее
некоторого значения потенциала емкость резко уменьшается. Учитывая электрохими*
ческую индифферентность нитратных анионов в исследованном интервале потенциа*
лов [21, 22], можно предположить, что указанная аномалия связана с поведением га*
логенидного аниона на электроде. Подобные особенности для золотого электрода в
расплаве индивидуального хлорида калия обнаружены ранее на анодных ветвях зави*
симостей от потенциала емкости двойного слоя [17], дифференциального поверхност*
ного натяжения [27], угла смачивания [28].
Известно, что емкость двойного электрического слоя определяется потенциалом и
зарядом электрода, ε: С = dε/dЕ. При удалении от ПМЕ в положительном направле*
нии плотность заряда электрода должна непрерывно увеличиваться. Если оставаться в
рамках только кулоновского взаимодействия заряженных частиц, невозможно понять
причину спада емкости. Разрешить противоречия теории Гуи-Штерна и эксперимен*
552
Е. В. Кириллова, В. П. Степанов
C, мФ/см2
0.25
а
1.4
б
4
1.2
4
0.20
2
1.0
1
3
0.15
0.8
0.6
0.10
3
0.4
2
0.05
1
0.02
0
0
-0.6 -0.4 -0.2
0
0.2
0.4
0.6
0.8
-1.0 -0.8 -0.6 -0.4 -0.2
0
0.2
0.4
E, В
Рис. 2. Емкость Au в расплаве KNO3 c добавкой 0 (1), 1 (2), 5 (3) и 10 (4) мол. % KCl при f = 30 кГц (а) и 3 Гц (б).
та помогает отход от отождествления электрода с заряженной стенкой. В реальности,
носителями заряда на поверхности электрода являются электроны и ионы металла.
Положительнее ПМЕ плотность заряда на золотом электроде определяется положи*
тельным гиббсовым избытком катионов
FΓ
+
,
тогда емкость С =
dFΓ
+
dE.
По*
Au
Au
скольку при удалении потенциала электрода от ПМЕ dE > 0, снижение емкости на
анодной ветви С-Е кривой может быть объяснено уменьшением плотности заряда
электрода. Это возможно, если отказаться от электростатического характера взаимо*
действия между анионами солевой фазы и поверхностью электрода и принять, что ка*
тионы золота и анионы соли взаимно поляризуют друг друга, в результате чего на по*
верхности электрода формируется упорядоченный слой ионов, который экранирует
заряд электрода и приводит к появлению максимума на С-Е кривой в анодной обла*
сти потенциалов [29]. Ближайшими соседями ионов золота в солевой фазе будут анио*
–
ны
NO
3
и Cl-, причем с учетом знаков заряда ионов
FΓ
+
=
FΓ
-
+
FΓ
-
Известно,
Au
NO
3
Cl
что выше 300 K не наблюдается химическая связь золота с кислородом, хотя кислород
может адсорбироваться на микропримесях кремния и углерода на поверхности золота
[30-33]. Поэтому появление максимума на С-Е кривых может быть связана с взаим*
ной поляризацией ионов золота и хлора, в результате чего часть ионов хлора
из
A
-
Cl
солевой фазы пойдет на экранирование заряда электрода
-
что приводит
+
F
ΓAu
FA
-
,
Cl
к появлению отрицательной составляющей емкости. Принимая во внимание химиче*
скую природу золота [34], можно допустить, что на поверхности электрода происхо*
дит фазовый переход от хаотичного распределения ионов к упорядоченному слою из
комплексных группировок
Существование подобных ассоциатов доказано ис*
–.
AuCl
2
следованиями рамановских спектров заряженной границы золото*водный раствор
хлорида калия [35]. В дальнейшей работе хотелось бы доказать этот факт in situ.
Гиббсов избыток анионов хлора, как известно, зависит от его концентрации в объе*
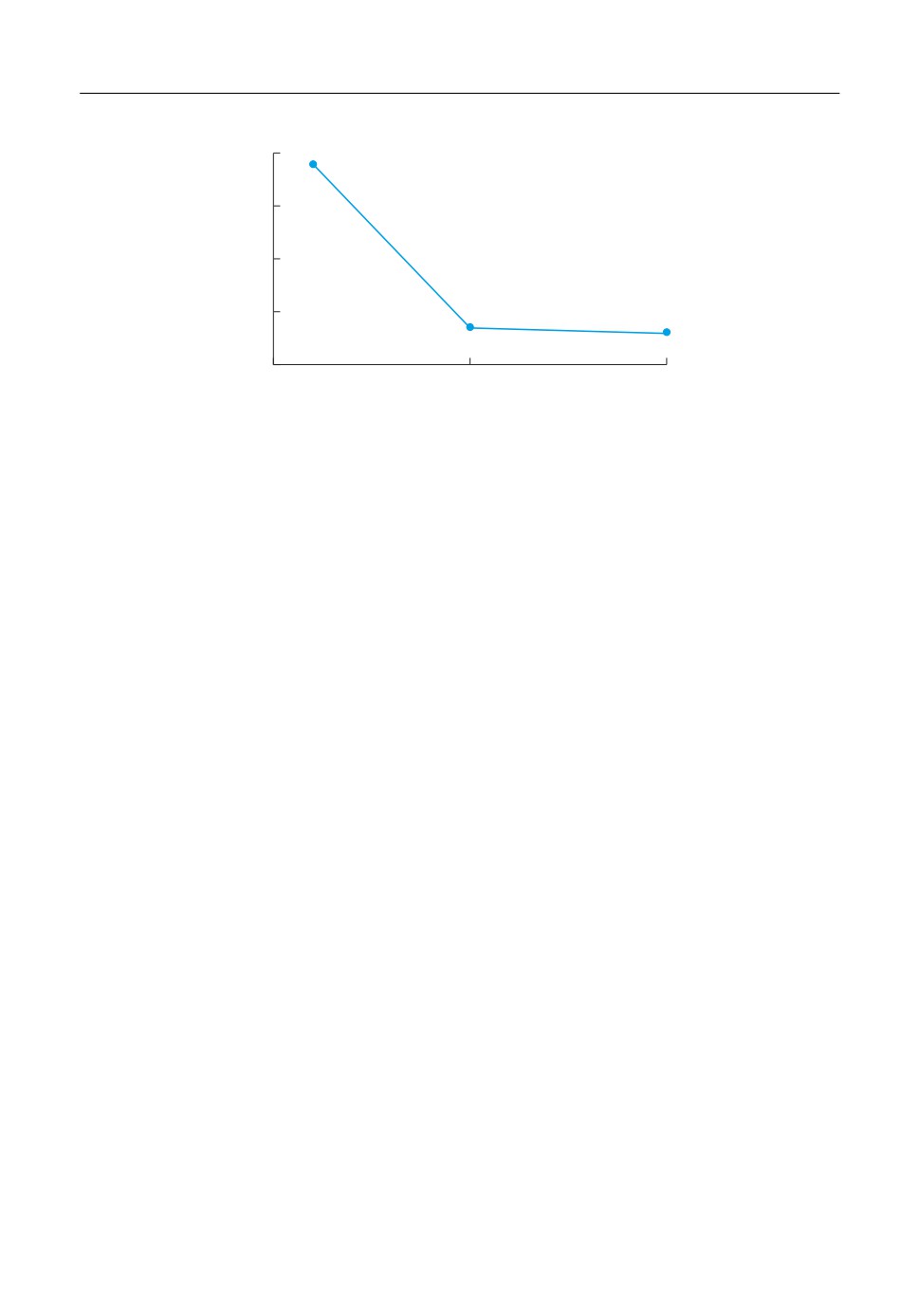
ме жидкой фазы. Можно ожидать, что критический потенциал, Ек, положительнее ко*
торого наступает фазовый переход, также должен зависеть от концентрации хлорида в
объеме электролита. На рис. 3, как Ек меняется с концентрацией KCl. Как видно, кри*
Емкость золотого электрода в расплавленных смесях нитрата и хлорида калия
553
Emax, В
0.4
0.3
0.2
0.1
0
5
10
KCl, мол. %
Рис. 3. Потенциал анодного максимума емкости Au*электрода в расплаве KNO3 с различным содержанием
KCl при f = 30 кГц.
тический потенциал практически одинаков для расплавов, содержащих 5 и 10 мол. %
KCl, но резко смещается в положительную сторону по мере разбавления смеси. Это
свидетельствует о том, что заполнение поверхности анионами соли затрудняется по
мере уменьшения концентрации активного компонента. В этой связи представляет
интерес расширить исследования на еще более разбавленные растворы с целью уста*
новления характера концентрационной зависимости Ек.
ЗАКЛЮЧЕНИЕ
Впервые исследованы емкостные свойства границы золотого электрода в расплаве
нитрата калия, содержащего 1, 5 и 10 мол. % хлорида калия в зависимости от скачка
потенциала. В окрестностях катодного минимума зависимости емкости электрода от
потенциала поведение системы подчиняется теории Гуи-Штерна. Положительнее не*
которого критического значения потенциала электрода в анодной области поляриза*
ций обнаружен спад емкости. В качестве объяснения этому эффекту предложено счи*
тать взаимную поляризацию катионов на поверхности металла и анионов галогена со*
левой фазы с образованием анионных ассоциатов на электроде. Обнаружена
зависимость величины критического потенциала от концентрации анионов хлора.
Работа выполнена при поддержке программы фундаментальных исследований УрО
РАН, проект № 18*5*3*12.
СПИСОК ЛИТЕРАТУРЫ
1. L o c k e t t V. , S e d e v R . , R a l s t o n J . , R o d o p o u l o s T. , H o r n e M . // J. Phys.
Chem. 2008. 112. № 19. P. 7486-7495.
2. A l a m M . T. , I s l a m M . M . , O k a j i m a T. , O h s a k a T. // Electrochem. Commun.
2007. 9. P. 2370-2374.
3. I s l a m M . M . , A l a m M . T. , O h s a k a T. Electrical double*layer structure in ionic liq*
uids: a corroboration of the theoretical model by experimental results // J. Phys. Chem. C. 2008. 112.
P. 16568-16574.
4. B a l d e l l i S . Probing electric fields at the ionic liquid-electrode interface using sum frequen*
cy generation spectroscopy and electrochemistry // J. Phys. Chem. B. 2005. 109. P. 13049-13051.
554
Е. В. Кириллова, В. П. Степанов
5. L o c k e t t V. , H o r n e M . , S e d e v R . , R o d o p o u l o s T. , R a l s t o n J . Differen*
tial capacitance of the double layer at the electrode/ionic liquids interface // Phys. Chem. Chem.
Phys. 2010. 12. P. 12499-12512.
6. Б у к у н Н . Г. , Ук ш е Е . А . Зависимость емкости двойного слоя в расплавленных со*
лях от температуры // Журн. прикладной химии. 1963. 36. № 3. С. 1965-1969.
7. G r a ve s A . D . , I n m a n D . Adsorption and the differential capacitance of the electrical
double*layer at platinum/halide metal interfaces. Nature. 1965. 208. P. 481-482.
8. Б у к у н Н . Г. , Ук ш е Е . А . , Тк а ч е в а Н . С . Двойной электрический слой и фара*
деевский импеданс серебра в расплавах галогенидов // Электрохимия. 1968. 4. № 12. С. 1409-
1413.
9. Д е л и м а р с к и й Ю . К . , К и х н о В . С . Нулевые точки металлов в расплавленных
солях // Электрохимия. 1969. 5. № 2. С. 145-149.
10. Ук ш е Е . А . , Б у к у н Н . Г. , Тк а ч е в а Н . С . Исследование двойного электриче*
ского слоя на платине в расплавленных солях // Электрохимия. 1969. 5. № 12. С. 1421-1426.
11. Б у к у н Н . Г. , Тк а ч е в а Н . С . , Ук ш е Е . А . Емкость двойного слоя на молибде*
не в расплавленных солях // Электрохимия. 1970. 6. № 8. С. 1215-1218.
12. Б у к у н Н . Г. , А л е к с е е в а Р. А . Емкость двойного слоя золота в хлоридном рас*
плаве // Электрохимия. 1975. 11. № 11. С. 1738-1741.
13. L a i t i n e n H . A . , R o e D . K . Double layer capacity of platinum and bismuth electrodes
in molten lithium chloride-potassium chloride // Collect. Czechoslovak Chem. Commun. 1960. 25.
№ 12. Р. 3065-3070.
14. H i l l s G . J . , J o n s o n K . E . Impedance phenomena in molten salts // J. Electrochem.
Soc. 1961. 108. № 11. Р. 1013-1018.
15. С т е п а н о в В . П . , Д о к а ш е н к о С . И . , К и р и л л о в а Е . В . Частотная зависи*
мость потенциалов минимума емкости электродов из металлов подгруппы меди в расплавах
галогенидов щелочных металлов // Электрохимия. 2012. 48. № 10. C. 1073-1078.
16. К и р и л л о в а Е . В . , С т е п а н о в В . П . Емкость двойного электрического слоя на
металлах подгруппы меди в расплавах галогенидов щелочных металлов // Расплавы. 2015.
№ 5. С. 39-50.
17. К и р и л л о в а Е . В . , Д о к а ш е н к о С . И . , С т е п а н о в В . П . Емкость и импе*
данс границы раздела поликристаллического золота с расплавами хлоридов щелочных метал*
лов // Расплавы. 2008. № 4. C. 74-79.
18. H i l l s G . J . , Po w e r P. D . Electrical double layers in fused alkali metal nitrates // Trans.
Faraday Soc. 1968. 64. P. 1629-1637.
19. H i l l s G . J . , Po w e r P. D . Electrode impedances in fused alkali nitrates // Trans. Faraday
Soc. 1969. 65. P. 3042-3052.
20. Б у к у н Н . Г. , Л е о н о в а Л . С . Емкость поляризованного серебряного электрода в
расплаве NaNO3-KNO3. В кн.: Физическая химия и электрохимия расплавленных и твердых
электролитов. Свердловск: УНЦ АН СССР. 1973. Ч. 2. С. 102-103.
21. Тк а л е н к о Д . А . , Ку д р я С . А . , Д е л и м а р с к и й Ю . К . , А н т р о п о в Л . И .
Химическое и электрохимическое поведение галогенидов в нитратных расплавах // Электро*
химия. 1978. 14. № 6. С. 844-850.
22. Ш и л и н а Г. В . , Д е л и м а р с к и й Ю . К . Полярографическое исследование хлори*
дов щелочных металлов на фоне расплавленной эвтектики LiNO3-NaNO3-KNO3 // Укр. хим.
журн. 1965. 30. С. 1045-1051.
23. Д е л и м а р с к и й Ю . К . , К о л о т и й А . А . , Гр и щ е н к о В . Ф . Электродная
функция платины в расплавленных солях // Укр. хим. журн. 1961. 27. С. 760-766.
24. S a n g s t e r J . M . , Pe l t o n A . D . Critical coupled evaluation of phase diagrams and ther*
modynamic properties of binary and ternary alkali salt systems. Special Report to the Phase Equilibria
Program, Part B: Evaluations for 54 common*ion binary systems involving (Li, Na, K) and (F, Cl,
OH, NO3, CO3, SO4) // American Ceramic Society, Westerville, Ohio. 1987. P. 4-231.
25. FACTSAGE Thermochemical software and databases. [Электронный ресурс].
26. S t e r n K . H . High temperature properties and thermal decomposition of inorganic salts with
oxyanions. CRCPressLLC., 2001.
Емкость золотого электрода в расплавленных смесях нитрата и хлорида калия
555
27. П а с т у х о в Ю . Г. , С т е п а н о в В . П . Изучение поверхности золотого электрода в
расплавленных галогенидах калия методом эстанса // Докл. АН СССР. 1989. 307. № 3. С. 648-
652.
28. K i r i l l o v a E . V. , S t e p a n o v V. P. Electrowetting of gold electrode by molten alkali
chlorides. Book of Abstracts of the 16th IUPAC High Temperature Materials Chemistry Conference
(HTMC*XVI), July 2-6, 2018, Yekaterinburg. 2018. P. 145.
29. Ta z i S . , S a l a n n e M . , S i m o n C h . , Tu r q P. , Po u n d s M . , M a d d e n P. A .
Potential*induced ordering transition of the adsorbed layer at the ionic liquid / electrified metal inter*
face // J. Phys. Chem. B. 2010. 114. P. 8453-8459.
30. Ts a i H . , H u E . , Pe r n g K , C h e n M . , W u J . * C h . , C h a n g J . * S . Instability
of gold oxide Au2O3 // Surface Sci. 2003. 537. P. L447-450.
31. B a z h u t i n N . B . , B o r e s k o v G . K . , S a vc h e n k o V. I . Adsorption of molecular
and atomic oxygen on gold // React. Kinet. Catal. Lett. 1979. 10. № 4. P. 337-340.
32. P i r e a u x J . J . , C h t a i b M . , D e l r u e J . P. , T h i r y P. A . , L i e h r M . ,
C a u d a n o R . // Surf. Sci. 1984. 141. P. 211-220.
33. S c h r a d e r M . E . Chemisorption of oxygen to gold: AES study of catalytic effect of calcium //
Surf. Sci. 1978. 78. P. L227.
34. P u d d e p h a t t R . J . The Chemistry of Gold. Elsevier Scientific, Amsterdam. 1978.
35. С и т н и к о в Л . В . , З а к и р ь я н о в а И . Д . , К и р и л л о в а Е . В . Исследование
взаимодействия аниона хлора с поверхностью золотого электрода методом спектроскопии
ГКР в условиях электрической поляризации // Расплавы. 2016. № 5. С. 455-463.
Capacity of Gold Electrode in Melted Mixtures of Nitrate and Potassium Chloride
Ye. V. Kirillova1, V. P. Stepanov1, 2
1Institute of High Temperature Electrochemistry of the Ural Branch of RAS, Yekaterinburg, Russia
2Ural Federal University named B.N.Yeltsin, Yekaterinburg, Russia
Capacitance-potential dependences for gold electrode in molten KNO3-KCl mixtures
were obtained at various concentrations of KCl and ac frequencies. It was shown that chlo*
ride addition to nitrate melts causes capacitance drop at a certain anodic potential. This po*
tential is almost the same for 5 and 10 mol % KCl, and it shifts to a more positive value for
1 mol % KCl. An explanation of this effect is suggested. According to it, the anodic maxi*
mum of capacitance is observed at the critical potential of the phase transition from chaotic
distribution of Cl- anions to formation of
complexes on the electrode surface.
2
AuCl-
Keywords: gold, alkali metal nitrates, alkali metal chlorides, potential of minimum ca*
pacitance, adsorption
REFERENCES
1. Lockett V., Sedev R., Ralston J., Rodopoulos T., Horne M. // J. Phys. Chem. 2008. 112. № 19.
P. 7486-7495.
2. Alam M.T., Islam M.M., Okajima T., Ohsaka T. // Electrochem. Commun. 2007. 9. P. 2370-
2374.
3. Islam M.M., Alam M.T., Ohsaka T. Electrical double*layer structure in ionic liquids: a corrobo*
ration of the theoretical model by experimental results // J. Phys. Chem. C. 2008. 112. P. 16568-
16574.
4. Baldelli S. Probing electric fields at the ionic liquid-electrode interface using sum frequency
generation spectroscopy and electrochemistry // J. Phys. Chem. B. 2005. 109. P. 13049-13051.
5. Lockett V., Horne M., Sedev R., Rodopoulos T., Ralston J. Differential capacitance of the dou*
ble layer at the electrode/ionic liquids interface // Phys. Chem. Chem. Phys. 2010. 12. P. 12499-
12512.
556
Е. В. Кириллова, В. П. Степанов
6. Bukun N.G., Ukshe Ye.A. Zavisimost’ yemkosti dvoynogo sloya v rasplavlennykh solyakh ot
temperatury [Dependence of the double layer capacity in molten salts on temperature] // Zh. priklad*
noy khimii. 1963. 36. № 3. Р. 1965-1969. (in Russian).
7. Graves A.D., Inman D. Adsorption and the differential capacitance of the electrical double*lay*
er at platinum/halide metal interfaces. Nature. 1965. 208. P. 481-482.
8. Bukun N.G., Ukshe Ye.A., Tkacheva N.S. Dvoynoy elektricheskiy sloy i faradeyevskiy im*
pedans serebra v rasplavakh galogenidov [The double electric layer and the Faraday impedance of sil*
ver in molten halides] // Elektrokhimiya. 1968. 4. № 12. P. 1409-1413. (in Russian).
9. Delimarskiy YU.K., Kikhno V.S. Nulevyye tochki metallov v rasplavlennykh solyakh [Zero
points of metals in molten salts] // Elektrokhimiya. 1969. 5. № 2. P. 145-149. (in Russian).
10. Ukshe Ye.A., Bukun N.G., Tkacheva N.S. Issledovaniye dvoynogo elektricheskogo sloya na
platine v rasplavlennykh solyakh [Investigation of a double electric layer on platinum in molten salts] //
Elektrokhimiya. 1969. 5. № 12. P. 1421-1426. (in Russian).
11. Bukun N.G., Tkacheva N.S., Ukshe Ye.A. Yemkost’ dvoynogo sloya na molibdene v rasplav*
lennykh solyakh [The capacity of the double layer on molybdenum in molten salts] // Elektrokhimiya.
1970. 6. № 8. P. 1215-1218. (in Russian).
12. Bukun N.G., Alekseyeva R.A. Yemkost’ dvoynogo sloya zolota v khloridnom rasplave [The ca*
pacity of a double layer of gold in a chloride melt] // Elektrokhimiya. 1975. 11. № 11. P. 1738-1741.
(in Russian).
13. Laitinen H.A., Roe D.K. Double layer capacity of platinum and bismuth electrodes in molten
lithium chloride-potassium chloride // Collect. Czechoslovak Chem. Commun. 1960. 25. № 12.
Р. 3065-3070.
14. Hills G.J., Jonson K.E. Impedance phenomena in molten salts // J. Electrochem. Soc. 1961.
108. № 11. Р.1013-1018.
15. Stepanov V.P., Dokashenko S.I., Kirillova Ye.V. Chastotnaya zavisimost' potentsialov minimu*
ma yemkosti elektrodov iz metallov podgruppy medi v rasplavakh galogenidov shchelochnykh metall*
ov [he frequency dependence of the potentials of the minimum capacitance of electrodes from metals
of the copper subgroup in melts of alkali metal halides] // Elektrokhimiya. 2012. 48. № 10. P. 1073-
1078. (in Russian).
16. Kirillova Ye.V., Stepanov V.P. Yemkost’ dvoynogo elektricheskogo sloya na metallakh podgrup*
py medi v rasplavakh galogenidov shchelochnykh metallov [The capacity of the double electric layer
on metals of the copper subgroup in melts of alkali metal halides] // Rasplavy. 2015. № 5. P. 39-50.
(in Russian).
17. Kirillova Ye.V., Dokashenko S.I., Stepanov V.P. Yemkost’ i impedans granitsy razdela polikris*
tallicheskogo zolota s rasplavami khloridov shchelochnykh metallov [Capacity and impedance of the
interface between polycrystalline gold and melts of alkali metal chlorides] // Rasplavy. 2008. № 4.
P. 74-79. (in Russian).
18. Hills G.J., Power P.D. Electrical double layers in fused alkali metal nitrates // Trans. Faraday
Soc. 1968. 64. P. 1629-1637.
19. Hills G.J., Power P.D. Electrode impedances in fused alkali nitrates // Trans. Faraday Soc.
1969. 65. P. 3042-3052.
20. Bukun N.G., Leonova L. S. Yemkost’ polyarizovannogo serebryanogo elektroda v rasplave
NaNO3-KNO3. V kn.: Fizicheskaya khimiya i elektrokhimiya rasplavlennykh i tverdykh elektrolitov
[Capacitance of a polarized silver electrode in a NaNO3-KNO3 melt. In: Physical chemistry and elec*
trochemistry of molten and solid electrolytes] Sverdlovsk: UNTS AN SSSR. 1973. V. 2. P. 102-103.
(in Russian).
21. Tkalenko D.A., Kudrya S.A., Delimarskiy YU.K., Antropov L. I. Khimicheskoye i elek*
trokhimicheskoye povedeniye galogenidov v nitratnykh rasplavakh [Chemical and electrochemical be*
havior of halides in nitrate melts] // Elektrokhimiya. 1978. 14. № 6. P. 844-850. (in Russian).
22. Shilina G.V., Delimarskiy YU.K. Polyarograficheskoye issledovaniye khloridov shchelochnykh
metallov na fone rasplavlennoy evtektiki LiNO3-NaNO3-KNO3 [Polarographic study of alkali metal
chlorides against the background of molten eutectic LiNO3-NaNO3-KNO3] // Ukr. khim. j. 1965.
30. P. 1045-1051. (in Russian).
23. Delimarskiy YU.K., Kolotiy A.A., Grishchenko V.F. Elektrodnaya funktsiya platiny v rasplav*
lennykh solyakh [The electrode function of platinum in molten salts] // Ukr. khim. j. 1961. 27. P. 760-
766. (in Russian).
Емкость золотого электрода в расплавленных смесях нитрата и хлорида калия
557
24. Sangster J.M., Pelton A.D. Critical coupled evaluation of phase diagrams and thermodynamic
properties of binary and ternary alkali salt systems. Special Report to the Phase Equilibria Program,
Part B: Evaluations for 54 common*ion binary systems involving (Li, Na, K) and (F, Cl, OH, NO3,
CO3, SO4) // American Ceramic Society,Westerville, Ohio. 1987. P. 4-231.
25. FACTSAGE Thermochemical software and databases. [Electronic resource].
26. Stern K.H. High temperature properties and thermal decomposition of inorganic salts with
oxyanions. CRCPressLLC., 2001.
27. Pastukhov YU.G., Stepanov V.P. Izucheniye poverkhnosti zolotogo elektroda v rasplavlennykh
galogenidakh kaliya metodom estansa [tudying the surface of a gold electrode in molten potassium ha*
lides by the estance method] // Dokl. AN SSSR. 1989. 307. № 3. P. 648-652. (in Russian).
28. Kirillova E.V., Stepanov V.P. Electrowetting of gold electrode by molten alkali chlorides. Book
of Abstracts of the 16th IUPAC High Temperature Materials Chemistry Conference (HTMC*XVI),
July 2-6, 2018, Yekaterinburg. 2018. P. 145.
29. Tazi S., Salanne M., Simon Ch., Turq P., Pounds M., Madden P.A. Potential*induced ordering
transition of the adsorbed layer at the ionic liquid / electrified metal interface // J. Phys. Chem. B.
2010. 114. P. 8453-8459.
30. Tsai H., Hu E., Perng K, Chen M., Wu J.*Ch., Chang J.*S. Instability of gold oxide Au2O3 //
Surface Sci. 2003. 537. P. L447-450.
31. Bazhutin N.B., Boreskov G.K., Savchenko V.I. Adsorption of molecular and atomic oxygen on
gold // React. Kinet. Catal. Lett. 1979. 10. № 4. P. 337-340.
32. Pireaux J.J., Chtaib M., Delrue J.P., Thiry P.A., Liehr M., Caudano R. // Surf. Sci. 1984. 141.
33. Schrader M.E. Chemisorption of oxygen to gold: AES study of catalytic effect of calcium //
Surf. Sci. 1978. 78. P. L227.
34. Puddephatt R.J. The Chemistry of Gold. Elsevier Scientific, Amsterdam. 1978.
35. Sitnikov L.V., Zakir’yanova I.D., Kirillova Ye.V. Issledovaniye vzaimodeystviya aniona khlora s
poverkhnost’yu zolotogo elektroda metodom spektroskopii GKR v usloviyakh elektricheskoy pol*
yarizatsii [Investigation of the interaction of chlorine anion with the surface of a gold electrode by the
method of GCR spectroscopy under conditions of electric polarization ] // Rasplavy. 2016. № 5.
P. 455-463. (in Russian).