РАСПЛАВЫ
6 · 2019
УДК 620.193.43
СИНТЕЗ НАНОКРИСТАЛЛИЧЕСКОГО ПОРОШКА α Al2O3
В ГАЛОГЕНИДНЫХ РАСПЛАВАХ ПРИ ТЕМПЕРАТУРАХ 700-800°С
© 2019 г. Л. А. Елшинаa, *, В. А. Елшинаa
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
*e$mail: yolshina@ihte.uran.ru
Поступила в редакцию 17.05.2019 г.
После доработки 18.06.2019 г.
Принята к публикации 26.06.2019 г.
Исследовано химическое взаимодействие расплавленного алюминия с глюкозой
в среде расплавленных галогенидов щелочных металлов при температурах 700-
800°С. Показано, что в ходе взаимодействия в объеме солевого расплава образуется
порошок α Al2O3, который состоит из нанокристаллов размерностью 20-100 нм.
Образование нанокристаллического α Al2O3 подтверждено методами сканирующей
электронной микроскопии и спектроскопии комбинационного рассеяния света.
Ключевые слова: алюминий, галогенидный расплав, синтез, нанопорошок, α Al2O3.
DOI: 10.1134/S0235010619060033
ВВЕДЕНИЕ
Получение нанопрошков оксидов металлов является одной из важнейших практи
ческих задач из за многочисленных возможных применений их в электрических
устройствах, солнечных батареях и других областях “зеленых” технологий [1, 2]. В на
стоящее время разработаны два основных подхода к получению нанопорошков: дис
пергационный [3-5] и конденсационный [6-8]. Диспергационные методы основаны
на измельчении макроскопических частиц до наноразмеров. Конденсационные спо
собы связаны с образованием наночастиц при фазовых переходах. К диспергацион
ным методам относят механическое диспергирование (механохимический синтез), а
также пиролиз водных растворов солей. В химических конденсационных методах об
разование наночастиц в этих методах осуществляется через ряд переходных состояний
при образовании промежуточных ансамблей, приводящих к возникновению зароды
ша новой фазы, спонтанному его росту и появлению физической границы раздела
фаз. При этом важно обеспечить высокую скорость образования зародышей новой
фазы и малую скорость их роста. К этим методам можно отнести самый широко ис
пользуемый золь гель метод, метод сублимации, гидротермический синтез, а также
синтез в расплавленных солях (MSS синтез) [9, 10]. Эти методы обладают чрезвычай
но широкими возможностями, а его недостатками являются широкое распределение
по размерам образующихся наночастиц и необходимость использования очень раз
бавленных по основному компоненту растворов, т.к. только в этом случае удается по
лучать нанопорошки из за нехватки в зоне реакции основного компонента реакции, а
также необходимость в последующем отжиге продуктов взаимодействия.
Нашими исследованиями в предыдущие годы [11-15] было показано, что электро
химический синтез в расплавленных кислородсодержащих солях позволяет осуществ
568
Л. А. Елшина, В. А. Елшина
лять синтез нанопорошков оксидов металлов с узким распределением по размерам ча
стиц и тонких оксидных покрытий с высокими защитными свойствами. Таким обра
зом были синтезированы нанопорошки оксидов алюминия
[12], тантала
[13],
циркония [14] и свинца [15]. Наличие в расплавах нитрит ионов, образующихся при
термическом разложении нитрата натрия при температурах выше 700 К. относили к
нежелательному фактору, который приводит к возможному ухудшению адгезии ок
сидного покрытия к металлической основе. Однако синтез порошков оксидов метал
лов в хлоридно нитритном расплаве в таком случае становится чрезвычайно привле
кательным процессом.
В настоящем исследовании предлагается новый метод синтеза нанопорошков ок
сида алюминия, получаемых при химическом взаимодействии расплавленного алю
миния с твердым органическим прекурсором в среде расплавленных галогенидов ще
лочных металлов в воздушной атмосфере.
ЭКСПЕРИМЕНТ
Синтез образцов проводился при химическом взаимодействии жидкого алюминия
с органическим прекурсором в среде расплавленных галогенидов щелочных металлов.
Навеска алюминия помещается в корундовый тигель, в который добавляют смесь га
логенидов щелочных металлов на основе хлоридов, например хлорида калия. В каче
стве затравки процесс помещают навеску кислородсодержащей органической добав
ки, например, глюкозы. Тигель помещают в открытую печь вертикального нагрева,
выдерживают 1-2 ч в зависимости от массы прекурсора, выливают в холодный тигель,
остужают, после чего остывший королек металла и солевой расплав, содержащий об
разованные оксид алюминия и углеродные наноматериалы, растворяют в дистиллиро
ванной воде. Королек металла удаляют, углеродные хлопья - очень легкие, они под
нимаются к верху стакана с водой, и их легко можно снять и отфильтровать. Остав
шийся раствор после растворения соли содержит большое количество порошка белого
цвета. Порошок отделяли центрифугированием, сушили, после чего проводили отжиг
при температуре 500°С на воздухе. Полученный порошок анализировали при помощи
сканирующего электронного микроскопа Auriga CrossBeam Workstation (Carl Zeiss
NTS, Germany), со энергодисперсионным спектрометром Inca Energy 350 X MAX,
(Oxford instruments, UK), спектроскопии комбинационного рассеяния света при по
мощи “Renishaw 1000” с зеленым лазером с длиной волны 514 нм, при помощи рент
генофазового метода на Rigaku DMAX 2200PC.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие алюминия с глюкозой под слоем расплавленных галогенидов ще
лочных металлов протекает очень интенсивно с выделением газообразного водорода,
которое сопровождается легкими хлопками. Основными продуктами взаимодействия
является углерод, который формирует нанотонкие пленки внутри алюминиевой мат
рицы, углеродные пленки, образуемые в объеме солевой фазы, а также оксид алюми
ния по реакции (1):
4Al
+
C
H
O
=
6C
+
2Al
O
+
6H (g).
(1)
6
12
6
2
3
2
Энергия Гиббса, рассчитанная при 750°С (ΔG750°C = -2320.5 кДж/моль) - очень от
рицательная величина. Окончание процесса обычно было связано с прекращением
образования пузырьков водорода.
После растворения реакционной солевой смеси, белый порошок не осаждался в ви
де осадка, проходил через все фильтры из за крайне малого размера частиц. Поэтому
Синтез нанокристаллического порошка α Al
2
O3
569
10
8
6
4
2
· 103
83-2256 > Bayerite - Al(OH)3
20
30
40
50
60
70
80
2θ
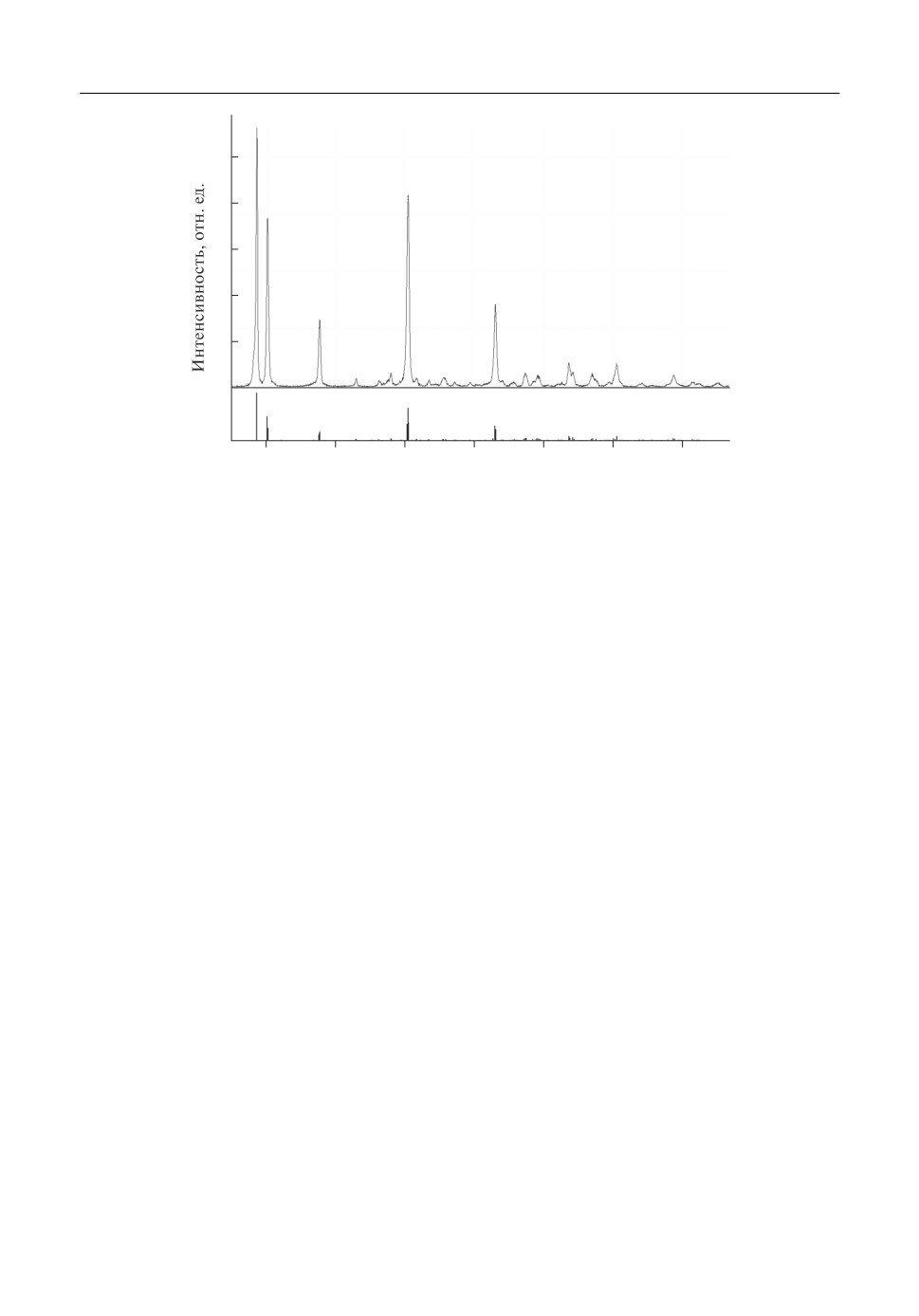
Рис. 1. Рентгенограмма порошка байерита, синтезированного при температуре 750°С по реакции (1).
раствор с содержащимся там в виде взвеси порошком центрифугировали со скорость
6000 об./мин в течение 6 ч, выделенный белый порошок сушили, была снята рентге
нограмма этого (рис. 1). Синтезированный порошок оказался однофазным и состоял
из байерита Al(OH)3. По всей вероятности, гидратирование порошка оксида алюми
ния в водном растворе произошло из за длительности времени, в течение которого
чрезвычайно мелкодисперсный порошок находился в воде.
Следующим технологическим этапом была сушка порошка байерита на воздухе в
открытой печи при температуре 500°С в течение 1 ч.
Аттестацию порошка после отжига провели при помощи спектроскопии комбина
ционного рассеяния света (КРС), как крайне чувствительного метода определения
структуры вещества, позволяющего точно разделять фазы оксида и гидроксида алю
миния.
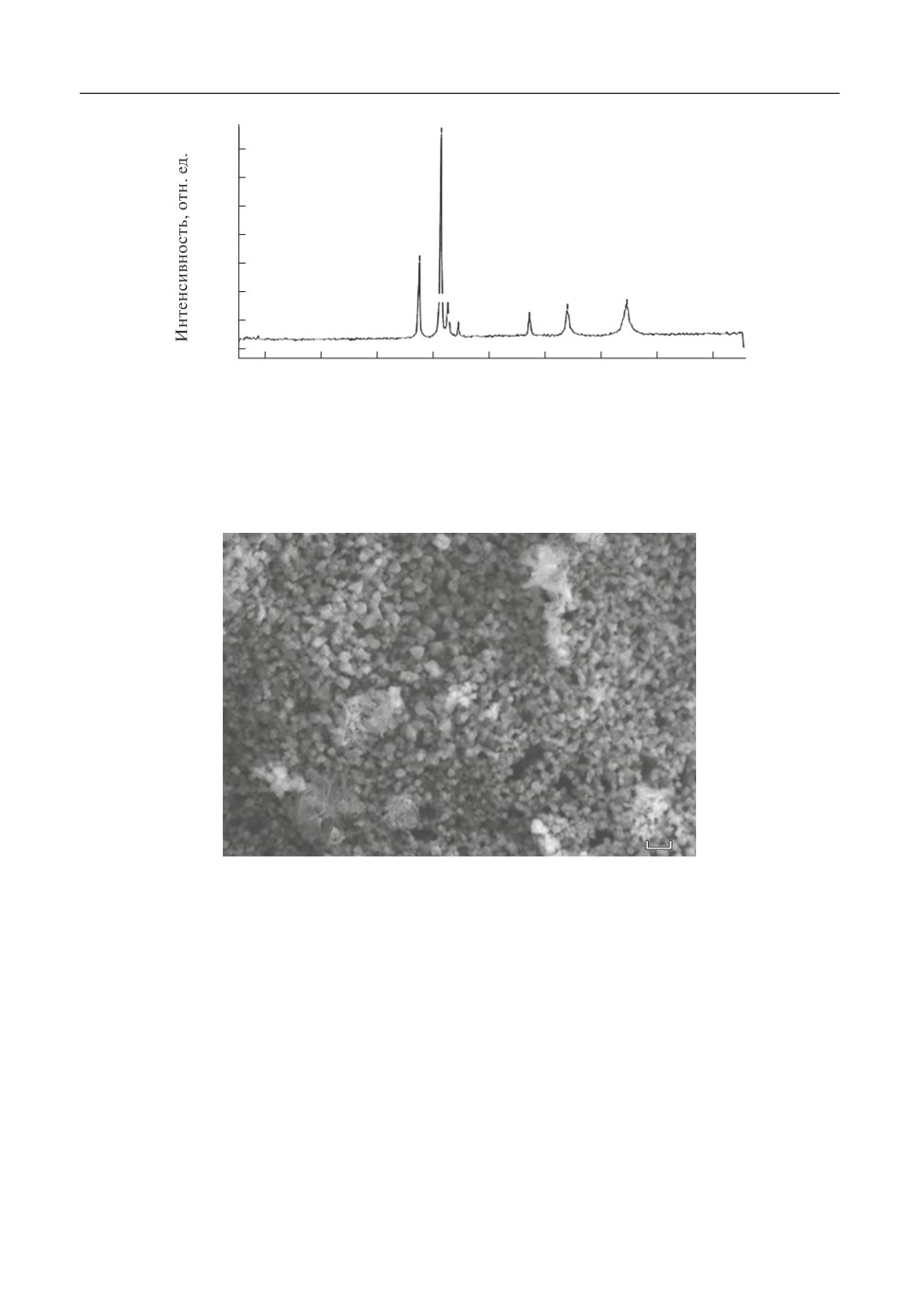
Спектр КРС порошка после отжига представлен на рис. 2. Спектр порошка пред
ставляет семь комбинационных активных фононных мод, 2A1g + 5Eg (416.9 и 643.8;
378, 429.9, 448.9, 749.5, 576 см-1). Этот спектр является характеристическим для оксида
алюминия в модификации корунда α Al2O3 [16]. Однако следует отметить, что все ли
нии спектра прекрасно выражены, но несколько сдвинуты (на 2-3 см-1) в сторону
меньших длин волн, что можно связать с наноразмерностью частиц получаемого по
рошка α Al2O3. Известно, что α Al2O3 образуется при отжиге β Al2O3 при температу
рах 1600-1700°С. Таким образом, синтез оксида алюминия в модификации корунда
происходит при температурах на 900° ниже, чем при существующих на сегодняшний
день методах.
Порошок α Al2O3 был исследован при помощи сканирующей электронной микро
скопии (рис. 3). Показано, что образующийся порошок корунда состоит из наноча
стиц в форме правильных призм с размерностью от 20 до 100 нм. Таким образом, мож
но считать доказанным, что при синтезе в расплавленной соли и последующем отжиге
570
Л. А. Елшина, В. А. Елшина
416.971
7000
6000
5000
4000
378.627
3000
2000
749.503
643.834
429.928
576.028
1000
448.197
0
100
200
300
400
500
600
700
800
900
Волновое число, см-1
Рис. 2. Спектр КРС порошка после отжига.
200 нм
Рис. 3. Микрофотография нанокристаллического порошка α Al2O3.
на воздухе образуется нанокристаллический порошок оксида алюминия в модифика
ции корунда.
ВЫВОДЫ
Впервые методом химического взаимодействия расплавленного алюминия с глю
козой в среде расплавленных галогенидов щелочных металлов при температуре 750°С
с последующим отжигом при температуре 500°С был синтезирован кристаллический
порошок α Al2O3 с размером частиц от 20 до 100 нм. Синтез нанопорошка α Al2O3
проходит при температуре, которая на 900° ниже, чем в существующих технологиях.
Он очень прост аппаратурно, легко воспроизводим, и может стать основой новых на
нотехнологий.
Синтез нанокристаллического порошка α Al
2
O3
571
В работе использовано оборудование Центра коллективного пользования “Состав
вещества” ИВТЭ УрО РАН и “Современные нанотехнологии” УрФУ им. Б.Н. Ельци
на. Работа выполнена в соответствии с бюджетным планом Института по теме АААА
А19 119020190042 7.
СПИСОК ЛИТЕРАТУРЫ
1. I . Z u m e t a , R . E s p i n o s a , J . A . Ayllón et al. Comparative study of nanocrystalline
TiO2 photoelectrodes based on characteristics of nanopowder used // Solar Energy Materials & Solar
Cells. 2003. 76. Р. 15-24.
2. A . Yu a n , X . Wa n g , Y. Wa n g , J . H u . Textural and capacitive characteristics of
MnO2 nanocrystals derived from a novel solid reaction route// Electrochimica Acta. 2009. 54.
Р. 1021-1026.
3. Гу с е в А . И . , Р е м п е л ь А . А . Нанокристаллические материалы. М., Физматлит.
2001.
4. P. N . K u s n e t s o v, L . I . K u s n e t s o v a , A . M . Z h y z h a e v e t a l . Ultrafast synthe
sis of metastable tetragonal zirconia by means of mechanochemical activation // Applied Catalysis A.
2002. 227. Р. 299-307.
5. C . X u , X . Z h a o , S h . L i u , G . Wa n g . Large scale synthesis of rutile SnO2 nanorods //
Solid state communications. 2003. 125. Р. 301-304.
6. J . H u , J . Z h a n g , C h . C a o . Thermolytic formation and microstructure of IrO2 + Ta2O5
mixed oxide anodes from chloride precursors // Thermochimica Acta. 2003. 403. Р. 257-266.
7. H . K o m o n a m i , J . K a t o , S h . M u r a k a m i e t a l . Synthesis of titanium(IV) oxide
of ultra high photocatalytic activity: high temperature hydrolysis of titanium alkoxides with water lib
erated homogeneously from solvent alcohols // J. Molecular Catalysis A: Chemical. 1999. 144.
Р. 165-171.
8. d e Fa r i a s R . F. , A r n o l d U . , M a r t i n e z L . e t a l . Synthesis, characterization and
catalytic properties of sol gel derived mixed oxides // J. Physics and Chemistry of Solids. 2003. 64.
Р. 2385-2389.
9. M a r o t e P. , M a t e i C . , S i g a l a C . , D e l o u m e J . P. Influence of spectator ions on
the reactivity of divalent metal salts in molten alkali metal nitrates. Morphology of the resulting metal
oxide // Materials Research Bulletin. 2005. 40. Р. 1-11.
10. H a r l é V. , Vr i n a t M . , S c h a r f f J . P. , D u r a n d B . , D e l o u m e J . P. Catalysis
assisted characterizations of nanosized TiO2-Al2O3 mixtures obtained in molten alkali metal nitrates.
Effect of metal precursor // Applied Catalysis A: General. 2000. 196. № 2. Р. 261-269.
11. Yo l s h i n a L . A . Mechanism of formation of oxide nanopowders by anodic oxidation of
metals in molten salts - nanomaterials: properties, preparation and processes, ISBN: 978 1 60876
627 7, NOVA Publishers, New York, USA. 2011. Р. 255-293.
12. Yo l s h i n a L . A . , K u d y a k o v V. Ya . , M a l k o v V. B . , M o l c h a n o v a N . G .
Corrosion and electrochemical behavior of aluminium treated with high temperature pulsed plasma
in CsCl-NaCl-NaNO3 melt // Corrosion Science. 2011. 53. Р. 2015-2026.
13. E l s h i n a L . A . , K u d y a k o v V. Ya . , M a l k o v V. B . , E l s h i n A . N . High Tem
perature Electrochemical Synthesis of Oxide Thin Films and Nanopowders of Some Metal Oxides //
Glass Physics and Chemistry. 2008. 34. № 5. Р. 617-622.
14. E l s h i n a L . A . , K u d y a k o v V. Ya . , M a l k o v V. B . , M o l c h a n o v a N . G . ,
A n t o n ov B . D . The mechanism of formation of thin oxide coatings and nanopowders at the anod
ic oxidation of zirconium in molten salts // Protection of Metals. 2008. 44. № 3. Р. 257-262.
15. Yo l s h i n a L . A . , M a l k o v V. B . , Yo l s h i n A . N . The influence of formation condi
tions on the electrochemical behavior of lead oxide in sulfuric acid solutions // J. Power Sources.
2009. 191. P. 36-41.
16. L i P. G . , L e i M . , Ta n g W. H . Raman and photoluminescence properties of α Al2O3
microcones with hierarchical and repetitive superstructure // Materials Letters. 2010. 64. Р. 161-163.
572
Л. А. Елшина, В. А. Елшина
Synthesis of Nanocrystalline Powder α Al2O3 in Molten Halides
at Temperature Range 700-800°С
L. A. Yolshina1, V. A. Yolshina1
1Institute of High$Temperature electrochemistry UB RAS, Yekaterinburg, Russia
The chemical interaction of molten aluminum with glucose in the media of molten alkali
halides at temperatures 700-800°С studied. It shown that the powder of α Al2O3 which
consists of nanocrystals with the sizes from 20 to 100 nm forms at interaction in the melt
bulk. The formation of nanocrystalline α Al2O3 confirmed by scanning electron microscopy
and Raman spectroscopy.
Keywords: aluminum, halide melt, synthesis, nanopowder, α Al2O3
REFERENCES
1. I. Zumeta, R. Espinosa, J.A. Ayllón et al. Comparative study of nanocrystalline TiO2 photoelec
trodes based on characteristics of nanopowder used // Solar Energy Materials & Solar Cells. 2003. 76.
Р. 15-24.
2. A. Yuan, X. Wang, Y. Wang, J. Hu. Textural and capacitive characteristics of MnO2 nanocrystals
derived from a novel solid reaction route // Electrochimica Acta. 2009. 54. Р. 1021-1026.
3. Gusev A.I., Rempel’ A.A. Nanokristallicheskiye materialy [Nanocrystalline materials]. M., Fiz
matlit. 2001. (in Russian).
4. Kusnetsov P.N., Kusnetsova L.I., Zhyzhaev A.M. et al. Ultrafast synthesis of metastable tetrag
onal zirconia by means of mechanochemical activation // Applied Catalysis A. 2002. 227. Р. 299-307.
5. Xu C., Zhao X., Liu Sh., Wang G. Large scale synthesis of rutile SnO2 nanorods // Solid state
communications. 2003. 125. Р. 301-304.
6. Hu J., Zhang J., Cao Ch. Thermolytic formation and microstructure of IrO2 + Ta2O5 mixed ox
ide anodes from chloride precursors // Thermochimica Acta. 2003. 403. Р. 257-266.
7. Komonami H., Kato J., Murakami Sh. et al. Synthesis of titanium(IV) oxide of ultra high pho
tocatalytic activity: high temperature hydrolysis of titanium alkoxides with water liberated homoge
neously from solvent alcohols // J. Molecular Catalysis A: Chemical. 1999. 144. Р. 165-171.
8. de Farias R.F., Arnold U., Martinez L. et al. Synthesis, characterization and catalytic properties
of sol gel derived mixed oxides // J. Physics and Chemistry of Solids. 2003. 64. Р. 2385-2389.
9. Marote P., Matei C., Sigala C., Deloume J.P. Influence of spectator ions on the reactivity of di
valent metal salts in molten alkali metal nitrates. Morphology of the resulting metal oxide // Materials
Research Bulletin. 2005. 40. Р. 1-11.
10. Harlé V., Vrinat M., Scharff J.P., Durand B., Deloume J.P. Catalysis assisted characterizations
of nanosized TiO2-Al2O3 mixtures obtained in molten alkali metal nitrates. Effect of metal precursor //
Applied Catalysis A: General. 2000. 196. № 2. Р. 261-269.
11. Yolshina L.A. Mechanism of formation of oxide nanopowders by anodic oxidation of metals in
molten salts - nanomaterials: properties, preparation and processes, ISBN: 978 1 60876 627 7, NOVA
Publishers, New York, USA. 2011. Р. 255-293.
12. Yolshina L.A., Kudyakov V.Ya., Malkov V.B., Molchanova N.G. Corrosion and electrochemi
cal behavior of aluminium treated with high temperature pulsed plasma in CsCl-NaCl-NaNO3 melt //
Corrosion Science. 2011. 53. Р. 2015-2026.
13. Elshina L.A., Kudyakov V.Ya., Malkov V.B., Elshin A.N. High Temperature Electrochemical
Synthesis of Oxide Thin Films and Nanopowders of Some Metal Oxides // Glass Physics and Chemis
try. 2008. 34. № 5. Р. 617-622
Синтез нанокристаллического порошка α Al
2
O3
573
14. Elshina L.A., Kudyakov V.Ya., Malkov V.B., Molchanova N.G., Antonov B. D. The mecha
nism of formation of thin oxide coatings and nanopowders at the anodic oxidation of zirconium in
molten salts // Protection of Metals. 2008. 44. № 3. Р. 257-262.
15. Yolshina L.A., Malkov V.B., Yolshin A.N. The influence of formation conditions on the elec
trochemical behavior of lead oxide in sulfuric acid solutions // J. Power Sources. 2009. 191. P. 36-41.
16. Li P.G., Lei M., Tang W.H. Raman and photoluminescence properties of α Al2O3 microcones
with hierarchical and repetitive superstructure // Materials Letters. 2010. 64. Р. 161-163.