Российская сельскохозяйственная наука, 2022, № 2
УДК 579.64:632.3
DOI: 10.31857/S2500262722020090, EDN: GAKQOB
ПРИМЕНЕНИЕ МОЛЕКУЛЯРНЫХ МЕТОДОВ В ДИАГНОСТИКЕ ВОЗБУДИТЕЛЯ БАКТЕРИАЛЬНОЙ
ПЯТНИСТОСТИ ЛИСТЬЕВ ЦВЕТНОЙ КАПУСТЫ Pseudomonas syringae pv. maculicola
(McCulloch) Young et al
С.И. Приходько, А.Б. Яремко, К.П. Корнев, кандидат биологических наук
Всероссийский центр карантина растений,
140150, Московская обл., Раменский район, р.п. Быково, ул. Пограничная, 32
Email: svetlana.prik@yandex.ru
Исследования проводили с целью оценки применимости и апробации ПЦР-теста в соответствие с Inoue & Takikawa
(2021) в диагностике Pseudomonas syringae pv. maculicola (McCulloch) Young et al. Тест был оптимизирован для использо-
вания в формате «реального времени». Для этого в реакционную смесь добавляли краситель SYBR Green I с длиной волны
испускания флуоресценции 520 нм. Оценка применимости теста в режиме «реального времени» показала достаточную
аналитическую чувствительность, которая составляла 103…104 КОЕ/мл, что соответствует низкой и средней степени
зараженности. Определение аналитической специфичности показало ложноположительный результат с P. syringae pv.
tomato. Имеются также данные in silico по 100 %-ному совпадению с P. syringae pv. avii, pv. persicae, pv. spinaciae. Получен-
ные данные указывают на возможность использования теста для прямой диагностики фитопатогена из растительного
экстракта. Апробацию методики проводили на образцах рапса из Тульской, Липецкой областей и Забайкальского края.
Генетический материал Psm был обнаружен в одном образце рапса из Тульской области.
APPLICATION OF MOLECULAR METHODS IN THE DIAGNOSIS OF THE PATHOGEN OF THE
BACTERIAL LEAF SPOT OF CABBAGE Pseudomonas
syringae pv. maculicola (McCulloch) Young et al
Prikhodko S. I., Yaremko A.B., Kornev K.P.
All-Russian Plant Quarantine Center (VNIIKR),
140150, Moskovskaya obl., Ramenskii raion, r.p. Bykovo, ul. Pogranichnaya, 32
E-mail: svetlana.prik@yandex.ru
Abstract. The studies were performed to evaluate the applicability and validation of the PCR test according to Inoue & Takikawa
(2021) in the diagnosis of Pseudomonas syringae pv. maculicola (McCulloch) Young et al. (Psm). The test was optimized for real-time
application. For this purpose, the intercalating dye SYBR Green I with a fluorescence emission wavelength of 520 nm was added
to the reaction mixture. Method performance criteria were determined according to EPPO standard PM 7/098 (4). The evaluation
of the applicability of the test in real-time mode showed sufficient analytical sensitivity, which was 103-104 CFU/ml. Determination
of analytical specificity showed false positive results with P. syringae pv. tomato. There is also in silico data on 100% match with P.
syringae pv. avii, pv. persicae, pv. spinaciae. These pathovars affect other crop species; there is also no information on their distribution
in Russia; therefore, they were not considered in these studies. Determination of selectivity showed the effect of the matrix on the
sensitivity of the test. Thus, the detection threshold decreased from 103 to 104 CFU/ml when studying extracts of vegetative parts of
rapeseed as compared to seeds. The repeatability and reproducibility of the test was 100% when the concentration of the target object
in the matrix was 104 CFU/ml. The obtained values of the test efficiency criteria indicate the possibility of using PCR according to
Inoue & Takikawa (2021) for direct diagnosis of the phytopathogen from the plant extract of seeds and vegetative parts of Psm host
plants. The method was tested on rapeseed samples from Tula, Lipetsk region, and the Zabaykalsky Krai. Psm genetic material was
found in one rape sample from the Tula region.
Ключевые слова: полимеразная цепная реакция (ПЦР),
Key words: PCR, Pseudomonas syringae pv. maculicola,
Pseudomonas syringae pv. maculicola, бактериоз, крестоцвет-
bacteriosis, cruciferous crops, monitoring, validation.
ные культуры, обследование, валидация.
Pseudomonas syringae - повсеместно распространен-
обозначается как патовар maculicola. Pseudomonas
ный патоген. Первоначально этот вид был выделен из
syringae pv. maculicola, описанный в 1911 г., поражает
растений с симптомами бактериоза. Изучение особен-
крестоцветные культуры, в том числе рапс [5].
ностей распространения, механизмов заражения и фило-
Рапс представляет собой одну из важнейших сельско-
гении псевдомонад привело к тому, что на сегодняшний
хозяйственных культур, используемых в масложировой
день идентифицировано несколько десятков патоваров
промышленности, а также для производства дополни-
вида P. syringae, поражающих почти все экономически
тельного кормового белка [6]. Посевные площади рапса
важные виды сельскохозяйственных культур [1].
в Российской Федерации в 2020 г., по данным Росстата,
Несмотря на то, что вид изначально идентифициро-
составили 1488,2 тыс. га из них яровой рапс (кольза)
ван как патоген, было установлено, что многие изоляты,
занимал 1180,9 тыс. га, озимый - 307,3 тыс. га. Наи-
которые филогенетически принадлежат к этому виду, не
большая часть посевов этой культуры расположена в
патогенны и существуют на растениях как комменсалы.
Сибирском ФО (567,9 тыс. га на 2020 г). Выращивание
Это в значительной степени затрудняет диагностику воз-
рапса на экспорт сегодня крайне выгодно в связи со
будителя из-за близкого генетического родства патова-
значительны увеличением спроса на мировом рынке.
ров и их высокого фенотипического сходства [2, 3, 4].
Из рапса производят масло, а шрот используют на корм
Возбудитель бактериальной пятнистости цветной ка-
сельскохозяйственным животным. Кроме того, рост
пусты относится к виду-полифагу Pseudomonas syringae
спроса на рапс связан с расширением производства
47
Российская сельскохозяйственная наука, 2022, № 2
биодизеля [7]. Согласно данным Министерства сель-
(PBS) так, чтобы лабораторная проба была полностью
ского хозяйства Российской Федерации, для увеличения
покрыта (примерно 20…30 мл). Далее ее мацерировали
производства рапса на экспорт с 2021 г. введены меры
на орбитальном шейкере в режиме 200 об/мин в течение
государственной поддержки для предприятий и инди-
1 ч. Мацерат фильтровали через бумажный обеззолен-
видуальных предпринимателей, выращивающих эту
ный фильтр в центрифужную пробирку. При подготовке
культуру, а также для предприятий, осуществляющих
проб семян навеску массой 10 г помещали в пакеты или
его дальнейшую переработку.
контейнеры для биологических материалов и заливали
По сведениям, предоставляемым Федеральной тамо-
20 мл буфера PBS. Далее семена выдерживали в течение
женной службой РФ, экспорт семян рапса по коду ТН
16…18 ч при 4…8 °C, затем проводили мацерацию при
ВЭД 1205 в 2020 г. составил 714,7 тыс. т наибольшая
200 об/мин в течение 30…60 мин. Мацерат фильтровали
его часть приходилась на Китай (347,5 тыс. т), Беларусь
в центрифужную пробирку через бумажный фильтр.
(185,7 тыс. т), Казахстан (45,2 тыс. т), Монголию (38,5
Фильтрат концентрировали в центрифуге в режиме
тыс. т), Германию (12,1 тыс. т) и другие страны (85,7
10000 об/мин в течение 10 мин при температуре 4…10
тыс. т).
°C. Супернатант сливали в резервуар с дезинфици-
Сельскохозяйственная продукция, производимая
рующим раствором, а осадок ресуспендировали в 1 мл
на экспорт должна соответствовать фитосанитарным
буфера PBS и переносили в чистые микропробирки
требованиям страны-торгового партнера. Так, на сайте
объемом 1,5…2,0 мл.
Россельхознадзора опубликованы фитосанитарные
ДНК чистых культур бактерий получали путем на-
требования КНР, согласно которым российская сторона
гревания водной суспензии при 96 °C в течение 10 мин.
должна проводить мониторинг вредных организмов
Тотальную ДНК из искусственно инокулированных рас-
карантинного значения для КНР в местах производства
тительных и семенных экстрактов выделяли при помощи
экспортных культур, в том числе рапса, руководствуясь
комплектов реагентов «Проба-ГС» (ООО «Агродиагно-
соответствующими стандартами МККЗР. В части бак-
стика») и «ФитоСорб-Автомат-48» (ЗАО «Синтол») на
териологии в этой стране регламентировано отсутствие
автоматической станции выделения нуклеиновых кислот
Pseudomonas syringae pv. maculicola [8].
Tecan Freedom EVO (Tecan, Швейцария) в соответствии
На сегодняшний день не существует единой между-
с инструкциями производителей.
народной методики выявления и идентификации воз-
В ходе исследований, которые выполняли согласно
будителя бактериальной пятнистости цветной капусты,
методике Inoue & Takikawa [11], были проведены ис-
которую можно было бы применять при проведении
пытания следующих олигонуклеотидов:
мониторинга в местах производства экспортного рапса
прямой праймер - hrpK_fw1
на территории Российской Федерации. Кроме того, со-
GTCTGGGCGGACAGATGAT;
гласно стандарту ИСО/IEC 17025-2019 аккредитованная
обратный праймер - MAC_rv1
лаборатория должна использовать только те методы,
CGCCTTCTGGTGTGCTTTAC.
которые прошли валидацию (признаны надежными и до-
Амплификацию проводили в оптимизированном
стоверными). В сфере диагностики вредных организмов
режиме с использованием интеркалирующего красителя
растений тест должен быть подходящим для проведения
SYBR Green I, производства фирмы ООО «Евроген»
рутинной диагностики. В зарубежной практике для вы-
(табл. 1). Возможно также использование других ком-
явления и идентификации возбудителя бактериальной
мерческих смесей с этим красителем.
пятнистости цветной капусты принят комплексный
Табл. 1. Состав реакционной смеси
подход, предусматривающий сочетание культурально-
и условия амплификации
морфологических, биохимических и молекулярно-
генетических методов исследований [9, 10, 11].
Состав реакционной смеси
В 2021 г. японские ученые Inoue Y. и Takikawa Y.
компонент
объем, мкл
рабочая
разработали ПЦР тест с использованием специфичной
концентрация
последовательности заменяемых эффекторных локусов,
Ультрачистая вода
16,0
-
фланкирующих кластер hrp генов. Прямые праймеры,
5х qPCRmix-HS SYBR
5,0
1х
общие для обеих бактерий (hrpK_fw1 и hrpK_fw2),
Прямой праймер hrpK_fw1
1,0
10 пкм/мкл
были подобраны к последовательности гена hrpK, рас-
Обратный праймер MAC_rv1
1,0
10 пкм/мкл
положенного на конце кластера hrp. Psm-специфичные
праймеры (MAC_rv1 и MAC_rv2) ориентированы на
ДНК
2,0
-
последовательность гена hopPtoB1 Psm [11].
Объем реакции
25,0
-
Цель наших исследований - оценка применимо-
Условия амплификации
сти и апробация ПЦР-теста в соответствие с Inoue &
температура, оС
время
число циклов
Takikawa (2021) при диагностике Pseudomonas syringae
95
10 мин
1
pv. maculicola.
95
30 с
35
Методика. Объект исследований - возбудитель бак-
60
25 с
териальной пятнистости цветной капусты Pseudomonas
72
30 с
syringae pv. maculicola (McCulloch) Young et al. (далее
Psm). Типовой штамм бактерии получен из Между-
народного центра микробиологических ресурсов -
Согласно стандарту ЕОКЗР РМ 7/98 (4) определяли
Французской коллекции бактерий, ассоциированных
следующие критерии эффективности: аналитическая
с растениями (Cirm-CFBP). Исследования проводили в
чувствительность, аналитическая специфичность, по-
2021 г. на базе ФГБУ «Всероссийский центр карантина
вторяемость, воспроизводимость и селективность.
растений» (ВНИИКР).
Для определения аналитической чувствительности
При подготовке проб вегетативных органов от рас-
готовили 5 серий (повторностей) экстрактов из веге-
тений рапса отделяли фрагменты размером 1×1 см и
тативных частей и семян рапса и проводили их ино-
помещали в контейнер для сбора биологического ма-
куляцию целевым организмом в концентрациях 108…
териала. Затем заливали буфером фосфатно-солевым
102 КОЕ/мл. Затем определяли средние значения по-
48
Российская сельскохозяйственная наука, 2022, № 2
более восприимчивы к Psm и относятся к экономически
значимым сельскохозяйственным культурам. Селектив-
ность определяли путем исследования искусственно за-
раженных экстрактов в 3-кратной повторности на уровне
пороговой концентраций фитопатогена 103 КОЕ/мл.
Для контроля за ингибированием использовали вну-
тренний положительный контроль (ВПК) производства
ООО «Синтол».
Апробацию оптимизированного ПЦР-теста прово-
дили на образцах рапса, полученных в рамках научно-
исследовательского сбора материала и в ходе монито-
ринга, выполняемого в рамках государственного задания
по контролю за распространением на территории РФ
вредных организмов, имеющих карантинное значение
для КНР.
В рамках исследовательского сбора материала на
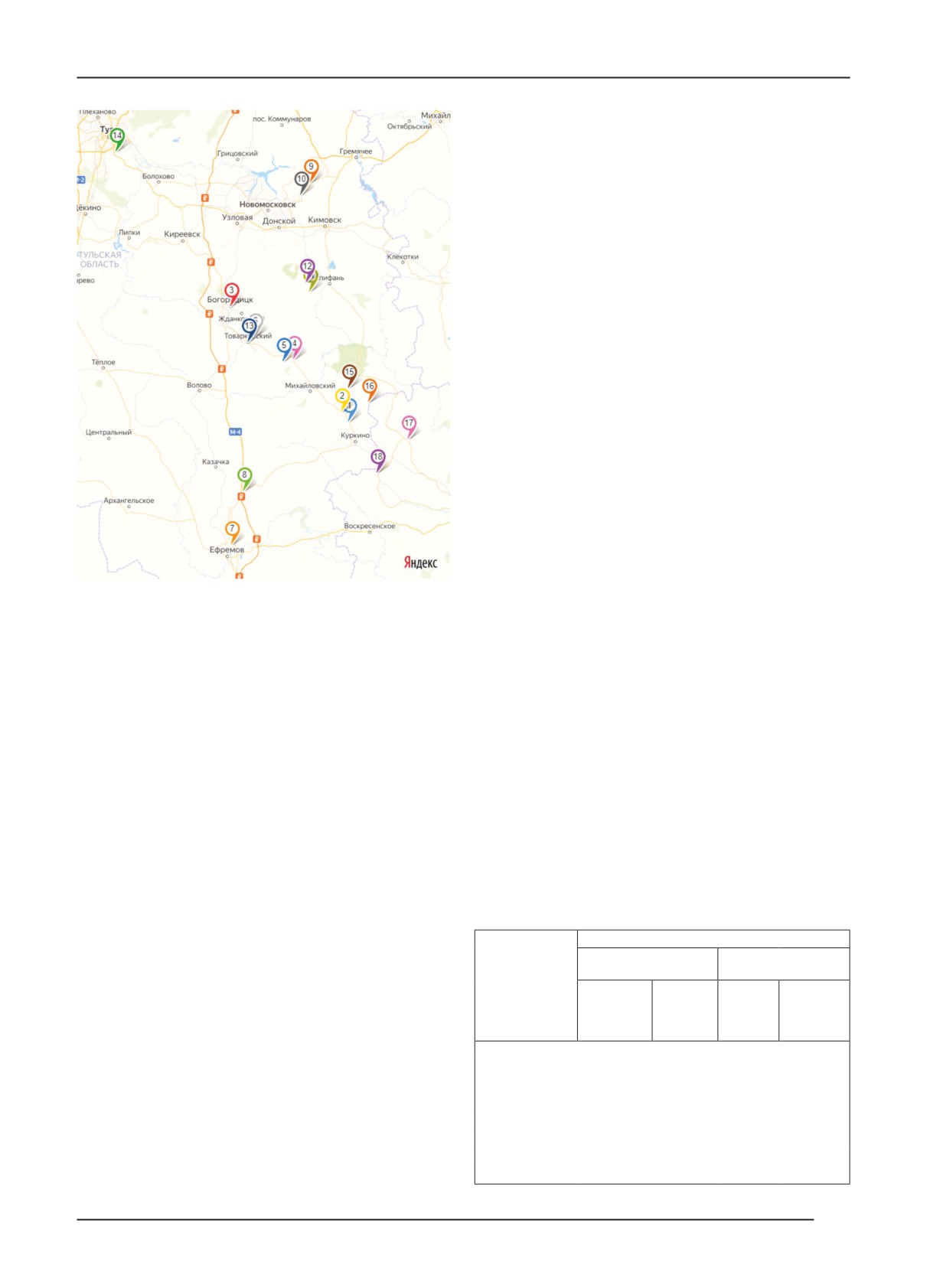
территории Тульской и Липецкой областей (рис. 1) было
отобрано и проанализировано 55 образцов рапса.
В ходе мониторинга предприятий АПК в Забайкаль-
ском крае проанализировано 100 образцов вегетативных
частей рапса. Обследования проводили в июле-августе
2021 г. При отборе образцов особое внимание уделяли
симптомам бактериальных инфекций.
Результаты и обсуждение. Определение аналити-
ческой чувствительности ПЦР с праймерами hrpK_fw1/
MAC_rv1 и интеркалирующим красителем SYBR Green I
в зависимости от использованного метода выделения ДНК
из двух матриц (семена и вегетативные части) показало,
что при тестировании искусственно инокулированных
экстрактов из вегетативных частей она составляет 104
КОЕ/мл независимо от метода выделения ДНК (табл.2).
Рис. 1. Районы отбора образцов растений рапса
При тестировании искусственно инокулированных
при проведении научных обследований.
экстрактов из семян с использованием ДНК комплекта
роговых циклов (Ctср.). С целью сравнения результатов
реагентов «Проба-ГС» аналитическая чувствительность
определения чувствительности, была также проведена
ПЦР была равна 103 КОЕ/мл, «Фито-Сорб-Автомат-48» -
ПЦР с праймерами hrpK_fw1/MAC_rv1 в классическом
104 КОЕ/мл. При такой аналитической чувствительности
варианте с последующей постановкой гельэлектрофо-
ПЦР с праймерами hrpK_fw1/MAC_rv1 и интеркалирую-
реза в 1,5 %-ном трисборатном агарозном геле, окра-
щим красителем SYBR Green I может быть использован
шенном бромистым этидием. Состав ПЦР-смеси был
для анализа бессимптомного растительного и семенного
аналогичным, только вместо 5х qPCRmix-HS SYBR
материала. В то же время тест обладает селективностью.
использовали 5x ScreenMix-HS (ООО «Евроген»).
Его чувствительность при использовании экстракта из
Аналитическую специфичность определяли путем
семян рапса была на порядок выше, чем в варианте с
тестирования 34 близкородственных штаммов бактерий
экстрактом из его вегетативных частей.
рода Pseudomonas из бактериологической коллекции
Следует отметить, что аналитическая чувствитель-
ФГБУ «ВНИИКР». Дополнительно обратный, специфич-
ность теста зависит как от метода выделения ДНК, так
ный для Psm праймер MAC_rv1, был проверен in silico
и от матрицы. Вещества, оказывающие ингибирующее
через базу Национального центра биотехнологической
воздействие на компоненты ПЦР-смеси, влияют на
информации NCBI с помощью инструмента Basic Local
Alignment Search Tool (BLAST).
Табл. 2. Определение чувствительности ПЦР с праймерами
Повторяемость теста ПЦР определяли путем иссле-
hrpK_fw1/MAC_rv1 и интеркалирующим красителем SYBR
дования серии 10-кратных разведений искусственно за-
Green I в растительных экстрактах, Сtср.
раженных экстрактов в 6-кратной повторности на уровне
пороговых концентраций фитопатогена, установленных
Метод выделения
в ходе определения чувствительности, одним человеком
«ФитоСорб-автомат-
«Проба-ГС»
и на одном приборе, в одинаковых условиях и за корот-
48»
Концентрация
кий период времени.
экстракт
Psm, КОЕ/мл
экстракт из
Для определения воспроизводимости готовили ис-
экстракт из
из веге-
экстракт
вегетатив-
кусственно инокулированные экстракты с низким и
семян
тативных
из семян
ных частей
средним уровнем зараженности в 6 кратной повторности
частей
по методике, аналогичной определению аналитической
108
16,4
16,5
18,6
18,5
чувствительности. При этом тестирование серий про-
107
19,9
19,6
22,1
21,7
водили 2 оператора на различном оборудовании (ДТ-
106
23,5
23,4
25,8
25,2
прайм, «ДНК-Технология»; CFX96 Touch, «BioRad») и
105
27,4
26,9
29,7
28,3
в разное время.
104
30,8
30,3
31,9
32,3
Для оценки селективности тестов использовали
103
33,7
-
-
-
экстракты из семян таких крестоцветных культур, как
К-выделения
-
-
рапс, китайская капуста, цветная капуста, брокколи,
К-чистая зона
-
-
брюссельская капуста, редька масличная, которые наи-
49
Российская сельскохозяйственная наука, 2022, № 2
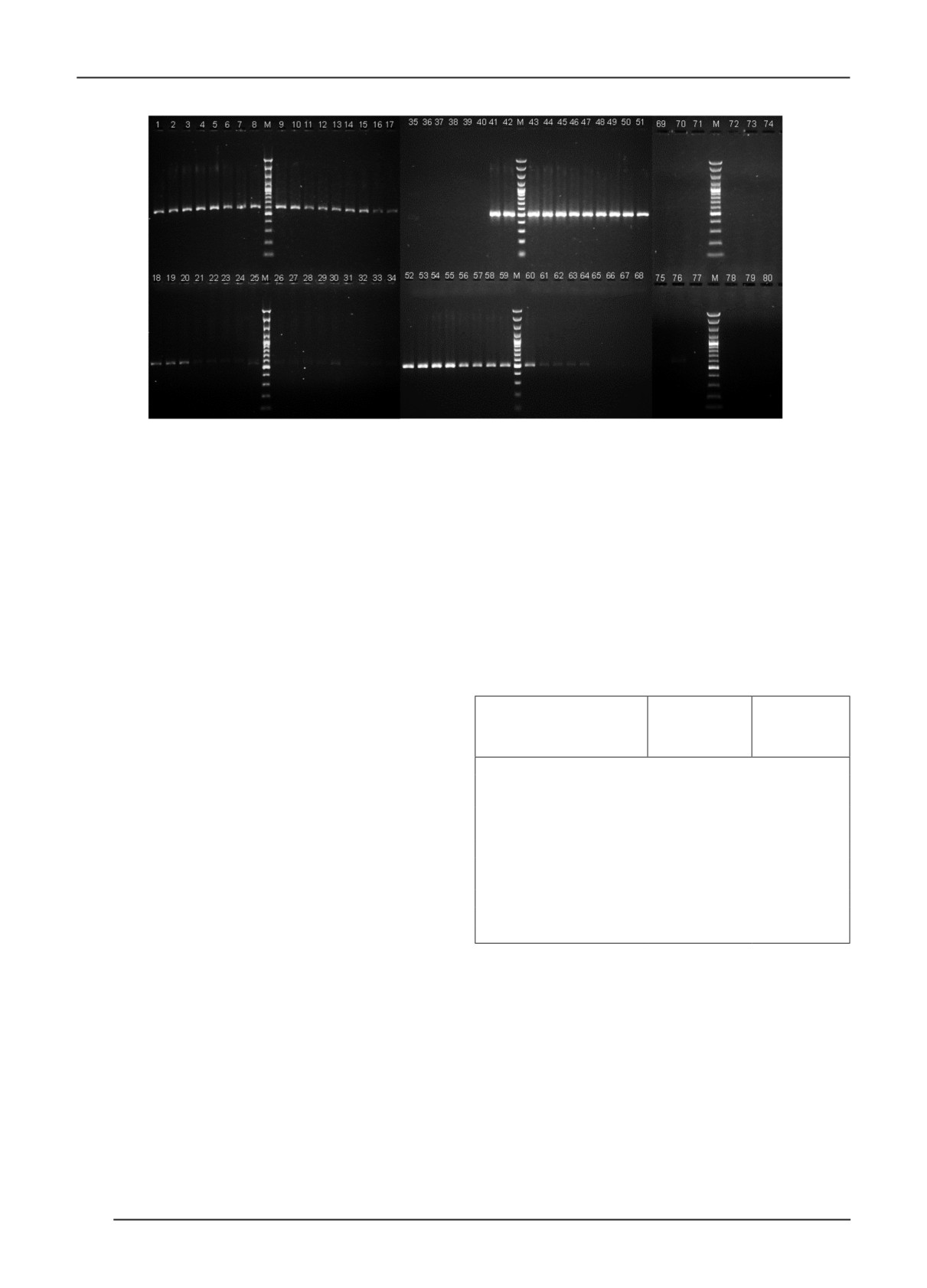
Рис. 2. Определение чувствительности ПЦР с праймерами hrpK_fw1/MAC_rv1 с детекцией результатов методом
гельэлектрофореза: дорожки №1-35 - концентрация целевого объекта в экстракте вегетативных частей рапса
108…102 КОЕ/мл в 5-кратной повторности; дорожки № 36-39 - отрицательные контроли; дорожки № 40-74 -
концентрация целевого объекта в экстракте из семян рапса 108…102 КОЕ/мл в 5-кратной повторности; дорожки
№75-80 - отрицательные контроли, М - маркер молекулярного веса.
эффективность амплификации ДНК-мишени, взаимо-
Определение влияния экстрактов, полученных из
действуя с матрицей ДНК, вмешиваясь в активность
семян различных видов крестоцветных растений, на ре-
ДНК-полимеразы или снижая эффективность фермен-
зультат лабораторного тестирования (табл. 3) показало,
тативных кофакторов (Mg2+). Процедуры экстракции
что при низкой концентрации (103 КОЕ/мл) целевого
ДНК должны исключить или значительно уменьшить
объекта оно практически отсутствует. Тестирование
количество веществ, ингибирующих ПЦР. Однако
экстрактов позволило выявить фитопатоген на уровне
конечное количество ингибиторов в образце сильно
аналитической чувствительности.
зависит от природы образца и процедуры экстракции.
Табл. 3. Определение селективности ПЦР
Растительный материал может содержать такие вторич-
с праймерами hrpK_fw1/MAC_rv1 и интеркалирующим
ные метаболиты, как полифенолы, масла и полисахари-
красителем SYBR Green I, Сtср.
ды, которые могут образовывать комплексы с нитями
ДНК. Кроме того, ингибиторы могут быть добавлены
Результат вну-
Результат опре-
во время процедуры выделения ДНК: соли KCl и NaCl,
треннего по-
Матрица
деления целевого
ионные детергенты, этанол, изопропанол и фенол и др.
ложительного
объекта (Psm)
[12]. Таким образом, использование набора для выде-
контроля
ления ДНК «Проба-ГС» позволяет в большей степени
Яровой рапс сорт Лунеди
33,5
34,5
удалять ингибиторы и повысить чувствительность теста
Китайская капуста сорт Кра-
32,4
35,8
на порядок.
са Востока
Согласно результатам ПЦР в соответствии с Inoue &
Цветная капуста сорт Сноу-
32,5
36,5
Takikawa (2021) в классическом варианте с детекцией
болл 123
результатов методом электрофореза специфичные хо-
Брокколи сорт Фортуна
32,2
32,4
рошо визуализированные фрагменты с молекулярным
Брюссельская капуста сорт
32,6
33,6
весом 591 п.о. отмечены во всех образцах растительного
Геркулес
экстракта с концентрациями целевого объекта 108…
Редька масличная
32,7
34,5
105 КОЕ/мл (дорожки с №1 по 20). Слаборазличимые
К-выделения
-
33,8
фрагменты отмечены в образцах растительного экс-
К-чистая зона
-
33,6
тракта, инокулированного Psm в концентрации 104…
102 КОЕ/мл (дорожки № 21…35). Причем в образцах с
самой низкой величиной этого показателя ПЦР-продукт
При определении аналитической специфичности вы-
практически не различим (рис. 2). Таким образом,
явлена неспецифическая реакция с P. syringae pv. tomato
чувствительность ПЦР-теста без использования ин-
(рис. 3), которая определяется более пологой кривой (Б),
теркалирующего красителя составила 104 КОЕ/мл, что
в отличии от положительного контроля (А).
в экстрактах из семян рапса на порядок ниже, чем при
В результате проверки праймеров in silico через базу
проведении анализа в режиме «реального времени».
NCBI было установлено 100 %-ное совпадение нуклео-
Следует отметить, что использование интеркали-
тидной последовательности праймера с имеющимися в
рующих красителей дает возможность проводить ПЦР
базе последовательностями бактерий P. syringae pv.
«в реальном времени» довольно несложным и относи-
tomato и P. syringae pv. spinaciaе. Диапазоны хозяев
тельно дешевым способом [13]. Предлагаемая модифи-
P. s. pv. tomato и P. s. pv. maculicola перекрываются,
кация позволяет выполнять такой тест в лабораториях,
ранее также предлагалось объединить эти два патовара
не оборудованных зоной электрофореза, и получать
[14]. Результаты французских исследователей показали
результаты в значительно более короткие сроки, нежели
наличие двух популяций P. s. pv. tomato, образованных
при дополнительной постановке гельэлектрофореза.
разными генетическими линиями. Одна из них не пато-
50
Российская сельскохозяйственная наука, 2022, № 2
При проведении апробации метода ПЦР с праймера-
ми hrpK_fw1/MAC_rv1 и интеркалирующим красителем
SYBR Green I в Тульской и Липецкой области отмечен
положительный результат (Ct=27,8) в одном образце.
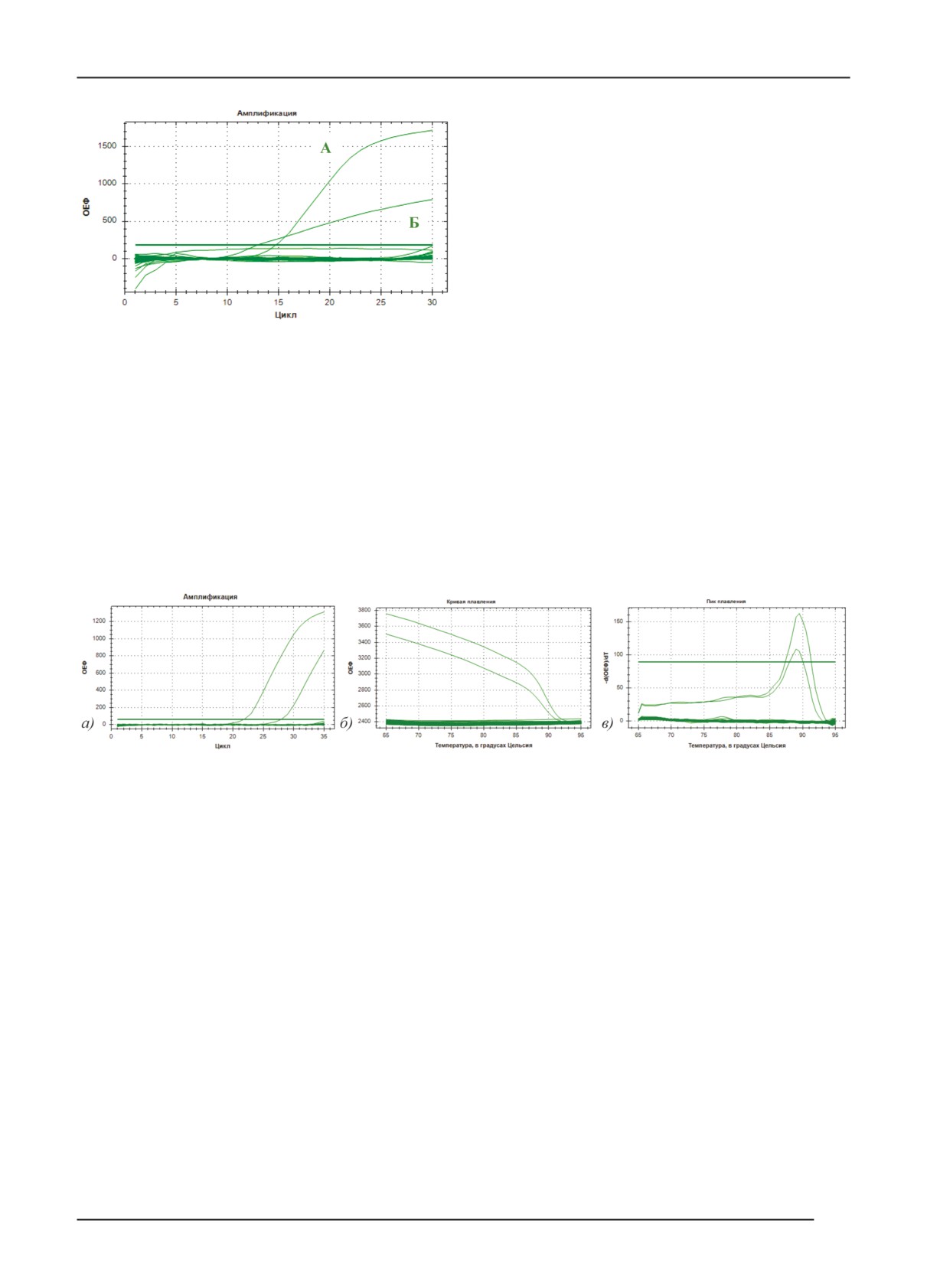
Анализ графиков кривых амплификации ПЦР-РВ, полу-
ченных в ходе исследования образцов рапса, собранных
в Тульской и Липецкой областях (рис. 4) свидетель-
ствует, что накопление флуоресценции и температуры
плавления происходило аналогично положительному
контролю. Более низкий пик плавления может быть
связан с меньшей концентрацией мишени.
В образцах из Забайкалья положительных реакций
не выявлено.
Таким образом, на базе ФГБУ «ВНИИКР» валидиро-
ван метод ПЦР с праймерами, подобранными к участку
Рис. 3. Определение специфичности ПЦР с праймерами
гена системы патогенности hrp (по Inoue Y.&Takikawa
hrpK_fw1/MAC_rv1 и интеркалирующим красителем
Y., 2021), и интеркалирующим красителем SYBR Green
SYBR Green I: А - положительный контроль,
I, который позволяет проводить исследования в фор-
Б - P. syringae pv. tomato.
мате «реального времени». Определенные критерии
генна для Brassicaceae, а вторая патогенна как для то-
эффективности показали возможность использования
матов, так и для растений семейства Brassicaceae, что
теста в качестве отборочного для выявления ДНК воз-
характерно и для P. s. pv. maculicola [3].
будителя бактериальной пятнистости цветной капусты
Согласно данным разработчика теста, при оценке
в растительном экстракте без предварительного высева
специфичности были проанализированы 76 штаммов фи-
на питательную среду, что снижает время лаборатор-
топатогенных бактерий. При этом инклюзивность оцени-
ных исследований. Порог чувствительности теста при
вали на 13 штаммах Psm и 30 штаммах других патоваров
выделении ДНК набором реагентов «Проба-ГС» (ООО
Pseudomonas syringae. Остальные 33 штамма использо-
«Агродиагностика») из экстракта вегетативных частей
вали для оценки эксклюзивности. В ходе тестирования
рапса - концентрация бактерии 104 КОЕ/мл (100 %), из
были выявлены кросс-реакции с P. syringae pv. tomato и
экстракта семян рапса - 103 КОЕ/мл (100 %). Влияния
P. syringae pv. spinaciae. Кроме того, авторы уточняют,
матрицы, полученной из семян других крестоцветных
Рис. 4. Результаты тестирования образцов рапса из Тульской и Липецкой областей: А) график накопления
флуоресценции во время амплификации; Б) график кривых плавления ПЦР-продуктов; В) график пиков плавления.
что праймеры hrpK_fw1/MAC_rv1 не позволяют отличить
культур, на результаты исследования образцов с низкой
патовары tomato и spinaciae от Psm. Прямой праймер
концентрацией целевого объекта не выявлено. Воспроиз-
hrpK_fw1 подобран к последовательности hrpK Pca. При
водимость и повторяемость при концентрации целевого
подборе обратного специфичного для Psm праймера вы-
объекта в матрице 104 КОЕ/мл составила 100 %, 103 КОЕ/
явлена гомология участка гена hrpK за пределами области
мл - 83 % и 73 % соответственно. Тем не менее, при про-
hopPto B1 патовара spinaciaе с патоварами avii и persicae,
ведении лабораторной диагностики следует учитывать
возбудителями болезней косточковых плодовых культур.
отсутствие дополнительных молекулярно-генетических
В связи с этим возможна также амплификация специфич-
тестов и наличие кросс-реакций с патоваром tomato.
ных фрагментов с ДНК патоваров avii и persicae [11].
Апробация методики в ходе научных обследова-
Поскольку сведения о распространении патоваров avii,
ний посевов рапса в Тульской и Липецкой областях,
persicae, spinaciae на территории Российской Федерации
а также результаты мониторинга предприятий АПК в
и о возможности обнаружения их на растениях-хозяевах
Забайкальском крае свидетельствуют о том, что она
объекта исследований отсутствуют, эти патовары при
позволяет выявлять генетический материал возбудителя
определении специфичности не учитывали.
бактериальной пятнистости цветной капусты. При этом
При определении повторяемости ПЦР с праймерами
неспецефических реакций, требующих дополнительных
hrpK_fw1/MAC_rv1 и интеркалирующим красителем
исследований, не обнаружено.
SYBR Green I было установлено, что при концентрации
целевого объекта 104 КОЕ/мл она составляет 100 %,
Литература
при концентрации 103 КОЕ/мл - 73 %. Результаты те-
1. Xin X. F., Kvitko B., He S. Y. Pseudomonas syringae:
стов, выполненных разными операторами на разном
what it takes to be a pathogen // Nature Reviews
оборудовании и в разные сроки, оказались полностью
Microbiology. 2018. Vol. 16. No. 5. P. 316-328.
идентичными, их воспроизводимость при концентрации
2. Genetic Diversity in Pseudomonas syringae pv.
целевого объекта в матрице 104 КОЕ/мл составила 100 %,
maculicola Strains / C. Alvarez-Mejia, G. Hernández-
при концентрации 103 КОЕ/мл - 83 %.
Guzmán, V. López-Ramírez, et al. //Journal of Pure
51
Российская сельскохозяйственная наука, 2022, № 2
and Applied Microbiology. 2018. No. 3 (12). P.
бактериальной пятнистости цветной капусты
1233-1238.
Pseudomonas syringae pv. maculicola (McCulloch)
3.
Gironde S., Manceau C. Housekeeping gene sequencing
Young et al // Фитосанитария. Карантин растений.
and multilocus variable-number tandem-repeat analysis
2020. №. 3. С. 24-32.
to identify subpopulations within Pseudomonas syringae
9. Ilicic R., Balaz J., Stojsin V., Bagi F., Pivic R.,
pv. maculicola and Pseudomonas syringae pv. tomato
Stanojkovic-Sebic A., Josic D. Molecular characterization
that correlate with host specificity //Applied and
of Pseudomonas syringae pvs. from different host plants
environmental microbiology. 2012. Vol. 78. No. 9. P.
by repetitive sequence-based PCR and multiplex-
3266-3279.
PCR// Zemdirbyste-Agriculture. 2016. No. 2 (103). P.
4.
Fujikawa T., Takikawa Y., Inoue Y. Complete and
199-206.
Draft Genome Sequences of the Cruciferous Pathogens
10. Takikawa Y., Takahashi F. Bacterial leaf spot and blight
Pseudomonas cannabina pv. alisalensis and Pseudomonas
of crucifer plants (Brassicaceae) caused by Pseudomonas
syringae pv. maculicola //Microbiology Resource
syringae pv. maculicola and P. cannabina pv. alisalensis
// J. Gen. Plant Pathol. 2014. No. 80. P. 466-474.
ncbi.nlm.nih.gov/pmc/articles/PMC8086205/ (дата об-
11.Inoue Y., Takikawa Y. Primers for specific detection
ращения: 18.10.2021). doi: 10.1128/MRA.00149-21.
and identification of Pseudomonas syringae pv.
5.
Detection of plant-pathogenic bacteria in seed / M.
maculicola and P. cannabina pv. alisalensis //Applied
Fatmi, R.R. Walcott, N.W. Sсhaad, et al. // St. Paul,
Microbiology and Biotechnology. 2021. No. 4 (105).
Minnesota: APS-Press, 2017. 360 р.
P. 1575-1584.
6.
Малахов А. В., Хорунжин М. Г. Экономические
12. Verification of analytical methods for GMO testing
предпосылки производства рапса в России и Алтай-
when implementing interlaboratory validated methods
ском крае //Аграрная наука-сельскому хозяйству»:
/ L. Hougs, F. Gatto, O. Goerlich, et al. //Testing and
сборник материалов XIII Международной научно-
Analysis of GMO-containing Foods and Feed // Boca
практической конференции. Барнаул: Алтайский
Raton: CRC Press, 2019. P. 245-266.
государственный аграрный университет, 2018. №.
13. Способы детекции результатов полимеразной
2. С. 165-167.
цепной реакции в режиме реального времени / С.
7.
Олейникова Е. Н., Янова М.А., Пыжикова Н.И. и др.
М. Бикбулатова, Д. А. Чемерис, Ю. М. Никоноров и
Яровой рапс - перспективная культура для развития
др. // Вестник Башкирского университета. 2012. Т.
агропромышленного комплекса Красноярского края //
17(1). С. 59-67.
Вестник Красноярского государственного аграрного
14. Takikawa Y. Synonymy of Pseudomonas syringae pv.
университета. 2019. №. 1 (142). С. 74-80.
maculicola and Pseudomonas syringae pv. tomato //
8.
Приходько С. И., Яремко А. Б., Корнев К. П. Ха-
Plant Pathogenic Bacteria; Proc. 8th Int. Conf. Plant
рактеристика и распространение возбудителя
Path. Bact. Versailles: INRA, 1994. P. 199-204.
Поступила в редакцию 30.11.2021
После доработки 29.12.2021
Принята к публикации 28.01.2022
52