Российская сельскохозяйственная наука, 2023, № 2
УДК 632.4.01/.08
DOI: 10.31857/S2500262723020114, EDN: AQEBFC
ХАРАКТЕРИСТИКА ПОПУЛЯЦИЙ Pyrenophora tritici-repentis, Parastagonospora nodorum
И Parastagonospora pseudonodorum НА ТЕРРИТОРИИ ТАМБОВСКОЙ ОБЛАСТИ
ПО НАЛИЧИЮ ГЕНОВ-ЭФФЕКТОРОВ*
Н.М. Коваленко1, кандидат биологических наук, Ю.В. Зеленева1, доктор биологических наук,
В.П. Судникова2, кандидат сельскохозяйственных наук
1Всероссийский научно-исследовательский институт защиты растений,
196608, Санкт-Петербург, Пушкин, ш. Подбельского, 3
E-mail: info@vizr.spb.ru
2Среднерусский филиал Федерального научного центра им. И. В. Мичурина,
392553, Тамбовская обл., Тамбовский р-н., пос. Новая Жизнь, ул. Молодежная, 1
E-mail: tmbsnifs@mail.ru
Исследования проводили с целью характеристики популяций Pyrenophora tritici-repentis, Parastagonospora nodorum и
Parastagonospora pseudonodorum на территории Тамбовской области на наличие генов-эффекторов Tox1, Tox3, ToxA и
ToxВ с использованием связанных с ними молекулярных маркеров. Инфекционные образцы отобраны в 2022 г. с листьев
яровой и озимой пшеницы, выращенной на участке, расположенном в северо-восточной части Центрально-Черноземного
региона. Предшественник - чистый пар. Виды P. nodorum и P. pseudonodorum отмечены на сортах яровой пшеницы в
конце вегетации растений. Гриб P. tritici-repentis поразил сорта как озимой, так и яровой пшеницы. C использованием
молекулярных маркеров, проведена идентификация генов, кодирующих NEs у 68 изолятов гриба P. tritici-repentis с 19 сортов
озимой пшеницы, 100 изолятов вида P. nodorum с 10 сортов яровой пшеницы и 70 изолятов P. pseudonodorum с 7 сортов
яровой пшеницы. Среди изученных изолятов P. nodorum отмечены как единичные гены Tox1, Tox3 и ToxА, так и сочета-
ния по два гена в одном генотипе. В генотипе изолятов P. pseudonodorum не отмечено присутствие гена ToxА. Выявлены
изоляты грибов, генотипы которых несут Tox1 и/или Tox3. Ген ToxB в изученной популяции P. tritici-repentis не выявлен,
тогда как ToxА был широко представлен. Встречаемость в популяции P. nodorum генов ToxА составила 30 %, Tox1 - 20
%, Tox3 - 30 %; в популяции P. pseudonodorum отмечали Tox1 - 57,1 % и Tox3 - 30 %; в популяции P. tritici-repentis был
представлен ToxА - 76,5 %. Штаммы P. tritici-repentis, P. nodorum и P. pseudonodorum, охарактеризованные по наличию
генов-эффекторов, будут использованы при создании искусственных инфекционных фонов для выявления источников и
доноров устойчивости к листовым пятнистостям.
CHARACTERIZATION OF Pyrenophora tritici-repentis, Parastagonospora nodorum AND Parastagonospora
pseudonodorum POPULATIONS BASED ON THE PRESENCE OF EFFECTOR GENES
IN THE TAMBOV OBLAST TERRITORY
N.M. Kovalenko1, Yu.V. Zeleneva1, V.P. Sudnikova2
1All-Russian Institute of Plant Protection,
196608, Sankt-Peterburg, Pushkin, sh. Podbel'skogo, 3
E-mail: info@vizr.spb.ru
2Central Russian branch of Michurin Federal Scientific Center,
392553, Tambovskaya obl., Tambovskii r-n, pos. Novaya Zhizn', ul. Molodezhnaya, 1
E-mail: tmbsnifs@mail.ru
The aim of the research is to characterise the populations of Pyrenophora tritici-repentis, Parastagonospora nodorum and
Parastagonospora pseudonodorum in the territory of the Tambov region based on the presence/absence of the Tox1, Tox3, ToxA and
ToxB effector genes using their associated molecular markers. Infectious samples were obtained in 2022 from the leaves of spring and
winter wheat. The infectious site is located in the northeastern part of the Central Black Soil region. The predecessor is represented
by the pure steam. The species of P. nodorum and P. pseudonodorum were observed on spring wheat cultivars in the end of their
vegetation period. The fungus of P. tritici-repentis affected the cultivars of both winter and spring wheat. Using molecular markers,
the genes encoding NEs were identified in 68 P. tritici-repentis isolates obtained from 19 winter wheat cultivars, 100 P. nodorum
isolates, taken from 10 spring wheat cultivars, and 70 P. pseudonodorum isolates, provided by 7 spring wheat cultivars. Among the P.
nodorum isolates studied, there were both single genes Tox1, Tox3, and ToxA, as well as combinations of two genes in one genotype.
The presence of the ToxA gene was not found in the genotype of P. pseudonodorum isolates. Fungal isolates with genotypes carrying
Tox1 and/or Tox3 have been identified. The ToxB gene was not found in the examined population of P. tritici-repentis, while ToxA was
widely represented. The occurrence of genes in the P. nodorum population was as follows: ToxA, 30%; Tox1, 20%; Tox3, 30%; in the
population of P. pseudonodorum it was: Tox1 - 57.1%, Tox3 - 30 %; in the population of P. tritici-repentis the ratio was represented
by the following figures: ToxA - 76.5%. P. tritici-repentis, P. nodorum, and P. pseudonodorum strains, characterized by the presence
of effector genes, will be used to create artificial infectious backgrounds to identify sources and donors of leaf spot resistance.
Ключевые слова: вирулентность, гены-эффекторы, пирено-
Key words: virulence, effector genes, pyrenophorosis, PCR-
фороз, ПЦР-диагностика, пшеница, пятнистости, септориоз,
diagnostics, wheat, spots, septoriasis, phytopathogenic fungi.
фитопатогенные грибы.
Результаты ежегодного мониторинга болезней
регионах России, все большее распространение получают
пшеницы свидетельствуют, что в последние годы
септориозные и пиренофорозные пятнистости [1].
на территории Тамбовской области, как и во многих
Виды Parastagonospora nodorum (Berk.) Quaedvl.,
* работа выполнена при поддержке Российского научного фонда, проект № 19-76-30005.
52
Российская сельскохозяйственная наука, 2023, № 2
Табл. 1. Происхождение изолятов
Verkley & Crous и Parastagonospora pseudonodorum
P. tritici-repentis, P. nodorum и P. pseudonodorum
(синоним P. avenae f. sp. triticea) [2] вызывают септориоз
листа и колоса пшеницы. По нашим наблюдениям, они
Сорт (озимая
Число
Сорт (яровая
Число
Регистрацион-
образуют некротические пятна с пикнидами на листьях,
пшеница)
изолятов
пшеница)
изолятов
ный номер
побегах и колосе, как правило, начиная с фазы колошения
Pyrenophora
Parastagonospora
(51 по шкале Цадокс) [3]. P. nodorum и P. pseudonodorum
tritici-repentis
nodorum
считают одними из наиболее вредоносных фитопатогенов
Безенчукская
во всех зернопроизводящих странах [4]. P. nodorum имеет
2
Валентина
10
175-22-P.n.
380
широкий круг хозяев. Кроме пшеницы, он поражает рожь,
Бирюза
4
Воевода
10
185-22-P.n.
тритикале, ячмень, дикие злаки. Вид P. pseudonodorum
поражает только пшеницу.
Звонница
6
Курская 2038
10
137-22-P.n.
Гриб Pyrenophora tritici-repentis (Died.) Drechsler
Изюминка
4
Л 400
10
156-22-P.n.
вызывает желтую пятнистость пшеницы. Это одна из
Инна
4
Л 503
10
157-22-P.n.
наиболее вредоносных болезней культуры, которая
Косовица
4
Пирамида
10
149-22-P.n.
встречается во всех районах возделывания пшеницы по
Саратовская
Лагуна
4
10
145-22-P.n.
всему миру [5, 6, 7]. Первичные симптомы заболевания
29
отмечают весной на озимой пшенице в виде мелких
Латыневка
2
Союз 1
10
148-22-P.n.
желто-коричневых пятен, которые увеличиваются,
Липецкая
Тулайковская
принимая линзообразную форму [8]. Помимо пшеницы,
4
10
150-22-P.n.
звезда
100
гриб может поражать множество других злаков, таких
Льговская
как рожь, ячмень и пырей ползучий [9, 10].
2
Фаворит
10
161-22-P.n.
167
Грибы P. tritici-repentis, P. nodorum и P. pseudonodorum
Льговская 4
4
Итого
100
-
известны своей способностью синтезировать
Мироновская
Parastagonospora
некротрофные эффекторы (necrotrophic effectors - NEs),
4
100
pseudonodorum
в том числе специфичные к хозяину токсины (host selec-
Мироновская
Краснокутка
tive toxins - HSTs), которые функционируют как факторы
6
10
136-22-P.p.
808
10
патогенности [11]. У вида P. tritici-repentis описаны три
Московская
некротрофных эффектора - Ptr ToxA, Ptr ToxB и Ptr
2
Кинельская 6
10
134-22-P.p.
39
Tox C. При этом ученые отмечают, что NEs существует
Московская
Тулайковская
больше [12, 13, 14]. Ptr ToxA и Ptr ToxB - белки, Ptr ToxC -
2
10
150-22-P.p.
40
100
низкомолекулярное соединение небелковой природы [13].
Престиж
4
Фаворит
10
161-22-P.p.
Ptr ToxA вызывает некроз, Ptr ToxB и Ptr ToxC - хлороз
[11, 12]. Ptr ToxA кодирует одна единственная копия гена
Проза
2
Экада 109
10
163-22-P.p.
ToxA, тогда как Ptr ToxB - многокопийный ген ToxB [15].
Синтетик
4
Воевода
10
185-22-P.p.
Ptr также имеет гомолог Ptr ToxB, кодируемый геном toxb,
Спартак
4
Гранни
10
186-22-P.p.
который не вызывает никаких симптомов у пшеницы,
Итого
68
Итого
70
-
несмотря на 81 % сходства с Ptr ToxB [16, 17].
У вида P. nodorum идентифицировано восемь
Среднерусского филиала Федерального научного центра
генов, кодирующих NEs, комплементарных девяти
им. И. В. Мичурина).
генам чувствительности пшеницы (Snn) - SnToxA/Tsn1,
Инфекционный участок расположен в северо--
SnTox1/Snn1, SnTox2/Snn2, SnTox3/Snn3-B1/Snn3-D1,
восточной части Центрально-Черноземного региона.
SnTox4/Snn4, SnTox5/Snn5, SnTox6/Snn6 и SnTox7/Snn7
Почва опытного участка, на котором собирали инфек-
[18]. Изначально предполагали, что SnTox2, SnTox6 и Sn-
ционный материал, характеризовалась следующими
Tox7 - три разных NEs, нацеленных на три отдельных
показателями: содержание в пахотном слое (0…30 см)
гена чувствительности хозяина. Richards с коллегами [19]
подвижного фосфора - 22,0 мг/100 г почвы, подвиж-
показали, что на самом деле они кодируют один и тот же
ного калия - 10,9 мг/100 г почвы (по Чирикову, ГОСТ
ген, который обозначили как Tox267. Этот ген нацелен
26204-91), реакция почвенного раствора (рНсол.) - 5,5 ед.
на три отдельных гена чувствительности хозяина - Snn2,
(ГОСТ 26483-85), гидролитическая кислотность - 3,9 мг-
Snn6 и Snn7. На сегодняшний день клонированы четыре
экв./100 г почвы (по Каппену, ГОСТ 26212-91), сумма
некротрофных эффекторных гена P. nodorum - ToxA, Tox1,
поглощенных оснований - 57,2 ммоль/100 г почвы (ГОСТ
Tox3 и Tox267. Показано, что они также характерны и для
26483-85).
вида P. pseudonodorum [20].
Учетная площадь делянки 10 м2, повторность че-
Знание разнообразия Ptr может помочь улучшить
тырехкратная. Посев проводили сеялкой СФК, норма
идентификацию патогенов и возможность борьбы
высева 5 млн всхожих семян на 1 га. Агротехника выра-
с ними, а также создавать новые сорта пшеницы, которые
щивания культуры общепринятая в Тамбовской области.
будут обладать устойчивостью к местной популяции
Предшественник - чистый пар.
возбудителей болезней [21].
Погодные условия 2022 г. были неблагоприятными
Цель исследований - охарактеризовать популяции
для возделывания сельскохозяйственных растений
Pyrenophora tritici-repentis, Parastagonospora nodorum
и развития на них фитопатогенов микозной этиологии
и Parastagonospora pseudonodorum на территории
(табл. 2). В начале вегетационного периода за май выпа-
Тамбовской области на наличие у них генов-эффекторов
ло 34,4 мм осадков, и при умеренных температурах воз-
Tox1, Tox3, ToxA и ToxВ с использованием связанных
духа гидротермический коэффициент (ГТК) находился
с ними молекулярных маркеров.
на достаточно высоком уровне - 1,41. В июне количество
Методика. Материалом для исследования служили
осадков (23,4 мм) и ГТК (0,40) были низкими. В июле
моноконидиальные изоляты P. tritici-repentis, P. nodorum
выпало 98,2 мм осадков, что значительно выше нормы,
и P. pseudonodorum (табл. 1), выделенные в 2022 г.
а гидротермический коэффициент составил 1,54. Это
из пораженных листьев пшеницы, собранных на
способствовало росту и развитию сельскохозяйственных
территории Тамбовской области (инфекционный участок
растений. В августе осадков выпало мало - 22,0 мм,
53
Российская сельскохозяйственная наука, 2023, № 2
Табл. 2. Метеорологические условия 2022 г. (Тамбовская метеостанция)
Месяц
Фактор погоды
Декада
апрель
май
июнь
июль
август
Среднесуточная температура воздуха
I
6,2
8,7
17,9
21,4
22,5
по декадам, °С
II
10,9
11,2
19,5
20,2
22,0
III
11,0
12,2
20,6
20,1
25,5
Средняя температура за месяц, °С
-
9,3
10,7
19,4
20,5
22,6
Сумма осадков по декадам, мм
I
32,6
5,0
11,3
1,3
0,0
II
10,3
18,9
7,1
49,8
22,0
III
8,0
10,5
5,0
47,1
0,0
Сумма осадков за месяц, мм
-
50,9
34,4
23,4
98,2
22,0
Гидротермический коэффициент (ГТК) за месяц
-
-
1,41
0,40
1,54
0,31
произошло повышенные температуры воздуха - мак-
методике Gao et al. [24] с использованием ПЦР с парами
симальную температуру воздуха больше или равную
праймеров SnTox1-cF/SnTox1-cR и SnTox3-cF/SnTox3-cR
30 °С отмечали 17 дней. Величина гидротермического
соответственно (табл. 3). Условия ПЦР: 94 °C в течение
коэффициента за этот - 0,31 свидетельствует о засушли-
4 мин., затем 30 циклов - 94 °C в течение 30 с, 60 °C -
вых условиях. Урожайность изучаемых культур в 2022
30 с, 72 °C - 3 мин.; последний этап элонгации - 72 °C
г. оказалась ниже уровня 2020 г., но выше 2021 г.[1].
в течение 10 мин.
Погодные факторы оказали влияние и на развитие
ToxA у изолятов трёх видов детектировали с методом
возбудителей болезней. Так, характерные некротические
ПЦР с использованием праймеров для связывания ORF
пятна с пикнидами P. nodorum и P. pseudonodorum были
ToxA TA51F и TA52R [25]. Условия ПЦР: 94 °C в течение
зарегистрированы только на сортах яровой пшеницы
3 мин., затем 30 циклов - 94 °C в течение 30 с, 58 °C -
в конце вегетации растений, что позволило в условиях
30 с, 72 °C - 30 с; последний этап удлинения - 72 °C
лаборатории выделить гриб в чистую культуру [22]. Ре-
в течение 7 мин.
зультаты лабораторной диагностики видов грибов были
Идентификацию гена ToxB проводили с помощью
подтверждены методом секвенирования с использова-
ПЦР с двумя парами геноспецифических праймеров:
нием оборудования ЦКП «Геномные технологии, про-
TB10/TB12 [16, 26] и TB57/TB6 [15, 16]. Условия
теомика и клеточная биология» ФГБНУ ВНИИСХМ».
ПЦР (TB10/TB12): 95 °C в течение 2 мин., затем 35
Гриб P. tritici-repentis отмечали на сортах озимой
циклов - 95 °C в течение 15 с, 57 °C - 15 с, 72 °C - 1 мин.;
и яровой пшеницы. При этом озимая пшеница в условиях
последний этап - 72 °C в течение 10 мин. Условия ПЦР
года поражалась сильнее яровой, поэтому в анализ
(TB57/ TB6): 94 ºC в течение 3 мин.; затем 30 циклов -
были включены изоляты с сортов этой разновидности.
94 ºC в течение 30 с, 58 ºC - 30 с, 72 ºC - 30 с; последний
Выделение и размножение культуры гриба P. tritici--
этап - 72 ºC в течение 7 мин.
repentis выполняли по методике Л. А. Михайловой
В качестве положительного контроля для редко
с соавторами [8].
встречаемого у изолятов гриба гена ToxB использовали
Изоляты выращивали в чашках Петри на питательной
изоляты греческого происхождения из коллекции
среде в течение 7…10 дней в термостате при 21…22 °C.
лаборатории иммунитета растений к болезням
Геномную ДНК грибов выделяли из чистой культуры
Всероссийского научно-исследовательского института
моноконидиальных изолятов стандартным методом
защиты растений, которые стабильно дают четкие
СТАВ/хлороформ [23]. Амплификацию геномной ДНК
продукты амплификации с праймерами на ген ToxB [27].
проводили в 25 мкл реакционной смеси (67 мМ Трис-HCl
Результаты и обсуждение. В результате молеку-
рН 8,8; 3мМ MgCl2; по 200 мкМ каждого dNTP; 10 рМ/мл
лярного скрининга у изучаемого материала (238
праймера; 25 (от 2 до 50) нг геномной ДНК и 0,5 ед. Taq-
ДНК-проб, полученных от 100 моноконидиальных
полимеразы). Амплифицированные фрагменты разделяли
изолятов вида P. nodorum, 70 - P. pseudonodorum, 68 -
методом электрофореза в 2%-ном агарозном геле,
P. tritici-repentis) были выявлены как единичные гены,
в 1×ТВЕ буфере (pH 8,2), гель окрашивали бромистым
кодирующие NEs, так и их сочетания в одном генотипе.
этидием. Для оценки размера фрагментов использовали
Ген Tox1 выявлен среди изолятов с 6 сортов
ДНК маркер Step 100 plus (Биолабмикс).
яровой пшеницы. Его наличие отмечено у изолятов
Скрининг изолятов P. nodorum и P. pseudonodorum
P. nodorum с сортообразцов Курская 2038 (номер
на присутствие генов Tox1 и Tox3 проводили по
изолята 137-22-P.n.) и Тулайковская 100 (150-22-P.n.),
Табл. 3. Список праймеров, использованных для выявления маркеров генов Tox1, Tox3, ToxA, ToxB
Размер
Название
Ссылка на литературный
Последовательность 5ʹ-3ʹ
диагностического
праймера
источник
фрагмента, п.н.
SnTox1-c
F: ATGAAGCTTACTATGGTCTTGT
500
R: TGTGGCAGCTAACTAGCACA
[24]
SnTox3-c
F: CTCGAACCACGTGGACCCGGA
600
R:CTCCCCTCGTGGGATTGCCCCATATG
TA51/52
F: GCGTTCTATCCTCGTACTTC
[25]
573
R: GCATTCTCCAATTTTCACG
TB10/TB12
F: TATGCGACCCTAACCTAGCC
[16, 26]
646
R: GCCAGATAAAAAACCCCTATACC
TB57/TB6
F: GAGACTGCTATGCTACTTGCTG
[15, 16]
243
R: ACGTCCTCCACTTTGCACACTCTC
54
Российская сельскохозяйственная наука, 2023, № 2
а также моноконидиальных изолятов P. pseudonodorum,
выделенных с инфекционного материала сортов яровой
пшеницы Краснокутка 10 (136-22-P.p.), Кинельская 6
(134-22-P.p.), Тулайковская 100 (150-22-P.p.) и Экада
109 (163-22-P.p.) (рис. 1).
Наличие гена Tox3 отмечено среди изолятов вида
Рис. 3. Продукты амплификации с праймерами
Рис. 1. Продукты амплификации с праймерами SnTox1-
TA51 F/TA52 R, специфичными для гена ToxА
cF/SnTox1-cR, специфичными для гена Tox 1, номера
в изолятах тамбовской популяции P. tritici-repentis, пробы
изолятов: 1) 137-22-P.n.; 2) 150-22-P.n.; 3) 136-22-P.p.;
соответствуют изолятам, полученным со следующих
4) 134-22-P.p.; 5) 150-22-P.p.; 6) 163-22-P.p; М - ДНК
сортов озимой мягкой пшеницы: 1) Безенчукская 380,
маркер Step100 plus; К+ изолят 32-21-P.n.; К- изолят
2) Бирюза, 3) Изюминка, 4) Лагуна, 5) Льговская 4,
29-21-P.n. Размер диагностического фрагмента 500 п.н.
6) Мироновская 808, 7) Москавская 39, 8) Спартак,
9) Звонница, 10) Косовица, 11) Липецкая Звезда,
P. nodorum, полученных из растительных образцов
12) Мироновская 100, 13) Латыневка, 14) Льговская 167,
сортов Курская 2038 (137-22-P.n.), Союз 1 (148-22-P.n.)
15) Престиж, 16) Проза 2, 17) Синтетик,
и Воевода (185-22-P.n.), а также P. Pseudonodorum с
18) Инна; М - ДНК маркер Step100 plus;
сортов Экада 109 (163-22-P.p.) и Воевода (185-22-P.p.)
К+ изолят 29-21-P.n.; К- изолят 26-21-P.n. Размер
(рис. 2).
диагностического фрагмента: 573 п.н.
Ген ToxA присутствует в геноме P. nodorum, P.
pseudonodorum, а также P. tritici-repentis. Вследствие
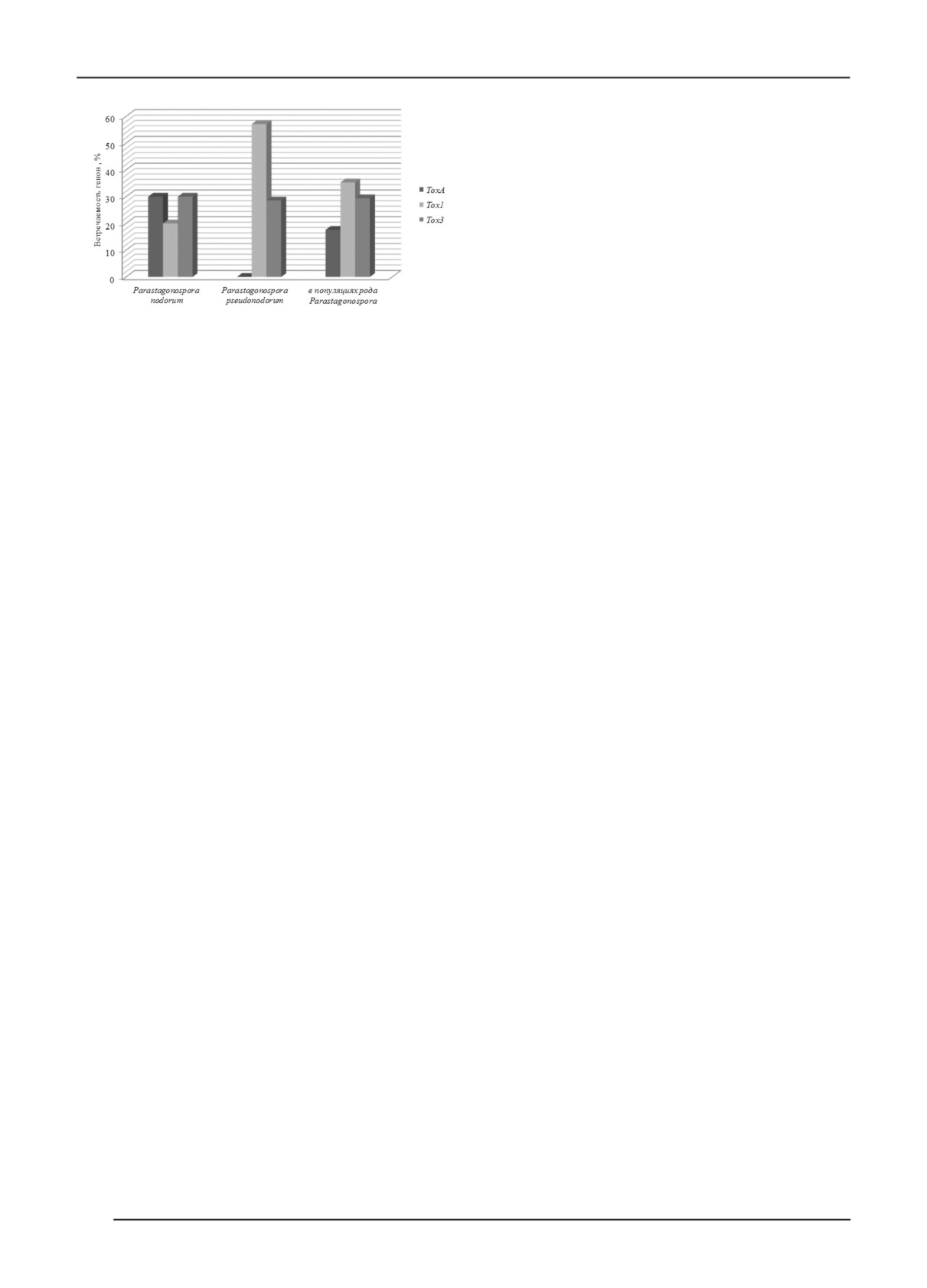
Таким образом, в 2022 г. среди изученных изо-
разницы в количестве полиморфизмов по ToxA среди лятов встречаемость гена ToxА, кодирующего NEs,
изолятов P. nodorum и P. tritici-repentis (13 и 3 гаплотипа в Тамбовской популяции вида P. nodorum составила
соответственно), было сделано предположено, что P.
30 %, Tox1 - 20 %, Tox3 - 30 %; гена Tox1 в популяции
nodorum служит донором гена ToxA для P. tritici-
P. Pseudonodorum - 57,1 %, Tox3 - 30 %; гена ToxА
repentis [25]. В нашем исследовании он был выявлен
в популяции P. tritici-repentis - 76,5 % (рис. 5).
среди изолятов P. nodorum с трех сортов яровой
пшеницы: Союз 1 (148-22-P.n.), Пирамида (149-22-
P.n.) и Воевода (185-22-P.n.) (см. рис. 2, 3). В генотипе
изолятов P. pseudonodorum в 2022 г. ген ToxA не
выявлен, в 2021 г. он был выявлен в генотипе изолятов
вида P. pseudonodorum из листьев сорта яровой мягкой
пшеницы Воронежская 20 (101-21-P.av.t.) [3].
В результате молекулярного скрининга ген ToxА
выявлен среди изолятов вида P. tritici-repentis,
полученных из листьев 18 сортов озимой мягкой
пшеницы, находящихся в испытании (рис. 3). Два
изолята гриба с сорта Московская 40 не несли в своем
генотипе ген ToxА (рис. 4).
Рис. 4. Встречаемость гена ToxА в изолятах тамбовской
популяции P. tritici-repentis, в % (всего проанализировано
68 моноконидиальных изолятов).
Ген ToxB не обнаружен в изученной популяции
P. tritici-repentis. При этом при использовании пар
праймеров TB10/TB12 и TB57/TB6 получены четкие
Рис. 2. Продукты амплификации ПЦР с праймерами
продукты амплификации соответствующих размеров
SnTox3-cF/SnTox3-cR, специфичными для гена Tox3,
номера изолятов: 1) 137-22-P.n.; 2) 148-22-P.n.;
у положительных контролей греческого происхождения.
3) 185-22-P.n.; 4) 163-22-P.p.; 5) 185-22-P.p.; М -ДНК
Такие результаты согласуются с публикациями ряда
маркер Step100 plus; К+ изолят 32-21-P.n.;
авторов, которые сообщают об отсутствии гена ToxB
К- изолят 2-21-P.n.-1. Размер диагностического
и широкой представленности гена ToxА в генотипах
фрагмента - 600 п. н. Продукты амплификации
изолятов P. tritici-repentis из российских популяций.
с праймерами TA51 F/TA52 R, специфичными для гена
Так, ген ToxB не был обнаружен в коллекцию изолятов
ToxА, номера изолятов: 6) 148-22-P.n.; 7) 149-22-P.n.;
P. tritici-repentis из южных, северных и западносибир-
8) 185-22-P.n. К+ изолят 29-21-P.n.; К- изолят 26-21-P.n.
ских регионов РФ, Финляндии и Казахстана, сформи-
Размер диагностического фрагмента - 573 п. н.
рованной в 2017-2018 гг. [27, 28, 29]. Отсутствие или
55
Российская сельскохозяйственная наука, 2023, № 2
(дата обращения: 03.03.2023). doi: 10.1007/978-3-
662-44053-7_1.
6. Impact of crop rotation and soil tillage on the severity
of winter wheat leaf blotches / B. Bankina, G. Bimsteine,
I. Arhipova et al. // Rural Sustain Res. 2021. Vol. 45. No.
340. P. 21-27. doi: org/10.2478/plua-2021-0004.
7. Ким Ю. С., Волкова Г. В. Желтая пятнистость
листьев пшеницы: распространение, вредоносность,
расовый состав (обзор) // Вестник Ульяновской
государственной сельскохозяйственной академии.
2020. № 2 (50). С. 105-116. doi: 10.18286/1816-4501-
2020-2-105-116.
8. Михайлова Л. А., Мироненко Н. В., Коваленко Н. М.
Желтая пятнистость пшеницы. Методические
Рис. 5. Встречаемость генов ToxА, Tox1 Tox3 в генотипах
указания по изучению возбудителя желтой
изолятов тамбовских популяций Parastagonospora spp, %.
пятнистости Pyrenophora tritici-repentis
и устойчивости сортов., СПб: ВИЗР, 2012. 64 с.
редкая встречаемость изолятов, продуцирующих этот
9. Vistas of tan spot research / E. D. de Wolf, R. J. Effertz,
токсин, была отмечена и в других странах [30, 31].
S. Ali, et al. // Can J Plant Pathol. 1998. Vol. 20. No. 4.
Представленность гена ToxA у изученных образцов по-
P. 349-370. doi: 10.1080/07060669809500404.
пуляций P. tritici-repentis варьирует. Так, в российской
10. Ali S., Francl L. J. Population race structure of
северокавказской и казахстанской юго-восточной попу-
Pyrenophora tritici-repentis. Prevalent on wheat
ляциях частота изолятов с геном ToxA составляла 100 %,
and noncereal grasses in the great plains // Plant
а в других варьировала от 5,5 % (западносибирская
Dis. 2003. Vol. 87. No. 4. P. 418-422. doi: 10.1094/
омская популяция) до 66 % (финская популяция) [28].
pdis.2003.87.4.418.
Выводы. В результате идентификации генов,
11. Ciuffetti L. M., Tuori R. P., Gaventa J. M. A single gene
кодирующих NEs, у грибов P. tritici-repentis, P.
encodes a selective toxin causal to the development
nodorum и P. pseudonodorum, проведенной в 2022 г.
of tan spot of wheat // Plant Cell. 1997. Vol. 9. Np. 2.
на территории Тамбовской области ЦЧР, установлено,
P. 135-144. doi: 10.1105/tpc.9.2.135.
что генотипы изолятов гриба P. nodorum, находившихся
12. Strelkov S. E., Lamari L., Ballance G. M. Characterization
в изучении, содержат гены ToxА (частота встречаемости
of a host-specific protein toxin (Ptr ToxB) from
30 %), Tox1 (20 %) и Tox3 (30 %), P. pseudonodorum -
Pyrenophora tritici-repentis // Mol Plant-Microbe
Tox1 (57,1 %) и Tox3 (30 %); генотипы изолятов гриба
Interact. 1999. Vol. 12. No. 8. P. 728-732. doi: 10.1094/
P. tritici-repentis характеризуются наличием гена ToxА
MPMI.1999.12.8.728.
(76,5 %) и отсутствием - Tox В.
13. Identification of a chlorosis-inducing toxin from
Результаты проведенных исследований будут полезны
Pyrenophora tritici-repentis and the chromosomal
при составлении селекционных программ и проведении
location of an insensitivity locus in wheat / R. J. Effertz,
защитных мероприятий сельскохозяйственных растений.
S. W. Meinhardt, J. Anderson, et al. // Phytopathology.
2002. Vol. 92. No. 5. P. 527-533. doi: 10.1094/
Литература.
PHYTO.2002.92.5.527.
1. Обзор фитосанитарного состояния посевов
14. Phenotypical and genotypical characterization
сельскохозяйственных культур в Тамбовской области
of Pyrenophora tritici-repentis races in Brazil /
в 2021 году и прогноз развития вредных организмов
V. V. Bertagnolli, J. R. Ferreira, Z. Liu, et al. // Eur
в 2022 году / сост. Н. П. Сдвижков, О. И. Илларионова,
J Plant Pathol. 2019. Vol. 154. No. 4. P. 995-1007.
М. В. Савенкова и др. Тамбов: ООО «Издательский
doi: 10.1016/j.fgb.2017.10.004.
дом «Тамбов», 2022. 134 с.
15. Characterization of the ToxB gene from Pyrenophora
2. Genome-scale phylogenies reveal relationships among
tritici-repentis / J. P. Martinez, S. A. Ottum, S. Ali, et
Parastagonospora species infecting domesticated and
al. // Mol Plant-Microbe Interact. 2001. Vol. 14. No. 5.
wild grasses / D. Croll, P. W. Crous, D. Pereira et al.
P. 675-677. doi: 10.1094/MPMI.2001.14.5.675.
// Persoonia. 2021. Vol. 46. P. 116-128. doi: 10.3767/
16. Martinez J. P., Oesch N. W., Ciuffetti L. M. Characterizati
persoonia.2021.46.04.
on of the multiple-copy host-selective toxin gene, ToxB, in
3. Видовой состав возбудителей септориозов пшеницы
pathogenic and nonpathogenic isolates of Pyrenophora
в европейской части России и идентификация
tritici-repentis // Mol. Plant-Microbe Interact. 2004.
генов-эффекторов SnToxA, SnTox1 и SnTox3 /
Vol. 17. P. 467-474. doi: 10.1094/MPMI.2004.17.5.467.
Ю. В. Зеленева, И. Б. Аблова, В. П. Судникова и др.
17. Kim Y. M., Strelkov S. Heterologous expression and
// Микология и фитопатология. 2022. Т. 56. № 6.
activity of Ptr ToxB from virulent and avirulent
С. 441-447. doi: 10.31857/S0026364822060113.
isolates of Pyrenophora tritici-repentis // Can J
4. Novel sources of resistance to Septoria nodorum blotch
Plant Pathol. 2007. Vol. 29. No. 3. P. 232-242.
in the Vavilov wheat collection identified by genome-wide
doi: 10.1080/07060660709507465.
association studies / H.T.T. Phan, K. Rybak, S. Bertazzoni
18. Duba A., Goriewa-Ðuba K., Wachowska U. A review
et al. // Theor Appl Genet. 2018. Vol. 131, P. 1223-1238.
of the interactions between wheat and wheat
doi: 10.1007/s00122-018-3073-y.
pathogens: Zymoseptoria tritici, Fusarium spp. and
5. Pyrenophora tritici-repentis: a plant pathogenic fungus
Parastagonospora nodorum // Int. J. Mol. Sci. 2018. Vol.
with global impact. In: Genomics of plant-associated
fungi: monocot pathogens / Ciuffetti L. M., Manning V. A.,
0067/19/4/1138. (дата обращения: 03.03.2023).
Pandelova I. et al. / Dean RA, Lichens-Park A, Kole C
doi: 10.3390/ijms19041138.
19. A triple threat: the Parastagonospora nodorum
springer.com/chapter/10.1007/978-3-662-44053-7_1
SnTox267 effector exploits three distinct host genetic
56
Российская сельскохозяйственная наука, 2023, № 2
factors to cause disease in wheat / Richards J. K.,
25. Andrie R. M., Pandelova I., Ciuffetti L. M. A combination
Kariyawasam G. K., Seneviratne S., et al. // New Phytol.
of phenotypic and genotypic characterization strengthens
2022. Vol. 233. No. 1. P. 427-442. doi: 10.1111/
Pyrenophora tritici-repentis race identification
nph.17601.
// Phytopathology. 2007. Vol. 97. P. 694-701.
20. Friesen T. L., Faris J. D. Characterization of Effector--
doi: 10.1094/PHYTO-97-6-0694.
Target Interactions in Necrotrophic Pathosystems
26. Ubiquity of ToxA and absence of ToxB in Australian
Reveals Trends and Variation in Host Manipulation
populations of Pyrenophora tritici-repentis / E. A. Antoni,
// Annu Rev Phytopathol. 2021. Vol. 59. P. 77-98.
K. Rybak, M. P. Tucker et al. // Australasian Plant
doi: 10.1146/annurev-phyto-120320-012807.
Pathology. 2010. P. 39. P. 63-68. doi: 10.1071/AP09056.
21. Diversity in morphotypes and necrotrophic effectors
27. Мироненко Н. В., Орина А. С., Коваленко Н. М.
(Nes) of Pyrenophora tritici-repentis strains in Latvia and
Генетический полиморфизм ядер штаммов
Belarus / J. Kaņeps, I. Moroсko-Biсevska, B. Bankina, et
Pyrenophora tritici-repentis по генам-эффекторам
al. // Cereal research communications. 2022. Vol. 50.
ToxA и ToxB // Генетика. 2021. Т. 57. № 5. С. 528-535.
P. 1037-1043. doi: 10.1007/s42976-022-00255-4.
doi: 10.31857/S0016675821040093.
22. Коломиец Т. М., Пахолкова Е. В. Дубовая Л. П. Отбор
28. Частота гена ToxА в популяциях Pyrenophora tritici--
исходного материала для создания сортов пшеницы
repentis на Северном Кавказе и северо-западе России
с длительной устойчивостью к септориозу. М.:
/ Н. В. Мироненко, О. А. Баранова, Н. М. Коваленко
Печатный город, 2017. 56 с.
и др. // Микология и фитопатология. 2015. Т. 49.
23. Doyle J. J., Doyle J. L. Isolation of plant DNA from fresh
№ 5. С. 325-329.
tissue // Focus. 1990. Vol. 12. P. 13-15.
29. Мироненко Н. В., Коваленко Н. М., Баранова О. А.
24. Identification and characterization of the SnTox6-Snn6
Характеристика географически отдаленных
interaction in the Parastagonospora nodorum - wheat
популяций Pyrenophora tritici-repentis по
pathosystem / Y. Gao, J. D. Faris, Z. Liu, et al. // Mol.
вирулентности и генам токсинообразования ToxA
Plant Microbe Interact. 2015. Vol. 28. P. 615-625.
и ToxB // Вестник защиты растений. 2019. № 1 (99).
doi: 10.1094/MPMI-12-14-0396-R.
Поступила в редакцию 23.01.2023
После доработки 16.02.2023
Принята к публикации 09.03.2023
57